
Основные понятия и определения.
Внутренняя энергия системы. Внутренняя энергия идеального газа
 Существуют два вида механической энергии:
кинетическая и потенциальная. Сумма кинетической и потенциальной энергии тела
называется его полной механической энергией, которая зависит от скорости
движения тела и от его положения относительно того тела, с которым оно
взаимодействует. Если тело обладает энергией, то оно может совершить
работу. При совершении работы энергия тела изменяется. Значение работы равно изменению
энергии.
Существуют два вида механической энергии:
кинетическая и потенциальная. Сумма кинетической и потенциальной энергии тела
называется его полной механической энергией, которая зависит от скорости
движения тела и от его положения относительно того тела, с которым оно
взаимодействует. Если тело обладает энергией, то оно может совершить
работу. При совершении работы энергия тела изменяется. Значение работы равно изменению
энергии.
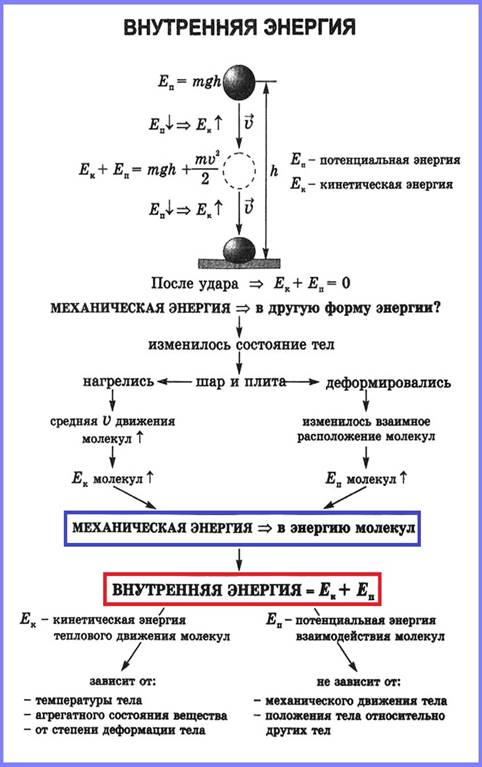 Если в закрытую пробкой толстостенную
банку, дно которой покрыто водой, накачивать, то через какое-то время пробка из
банки вылетит и в банке образуется туман. Пробка вылетела из банки, потому что
находившийся там воздух действовал на неё с определённой силой. Воздух при
вылете пробки совершил работу. Известно, что работу тело может совершить, если
оно обладает энергией. Следовательно, воздух в банке обладает энергией.
Если в закрытую пробкой толстостенную
банку, дно которой покрыто водой, накачивать, то через какое-то время пробка из
банки вылетит и в банке образуется туман. Пробка вылетела из банки, потому что
находившийся там воздух действовал на неё с определённой силой. Воздух при
вылете пробки совершил работу. Известно, что работу тело может совершить, если
оно обладает энергией. Следовательно, воздух в банке обладает энергией.
При совершении воздухом работы понизилась его температура, изменилось его состояние. При этом механическая энергия воздуха не изменилась: не изменились ни его скорость, ни его положение относительно Земли. Следовательно, работа была совершена не за счёт механической, а за счёт другой энергии. Эта энергия — внутренняя энергия воздуха, находящегося в банке.
Внутренняя энергия тела – это сумма кинетической энергии движения его молекул и потенциальной энергии их взаимодействия. Кинетической энергией (Ек) молекулы обладают, так как они находятся в движении, а потенциальной энергией (Еп), поскольку они взаимодействуют.
Внутреннюю энергию обозначают буквой U. Единицей внутренней энергии является 1 джоуль (1 Дж). U = Eк + En.
Способы изменения внутренней энергии
Чем больше скорости движения молекул, тем выше температура тела, следовательно, внутренняя энергия зависит от температуры тела. Чтобы перевести вещество из твёрдого состояния в жидкое состояние, например, превратить лёд в воду, нужно подвести к нему энергию. Следовательно, вода будет обладать большей внутренней энергией, чем лёд той же массы, и, следовательно, внутренняя энергия зависит от агрегатного состояния тела.
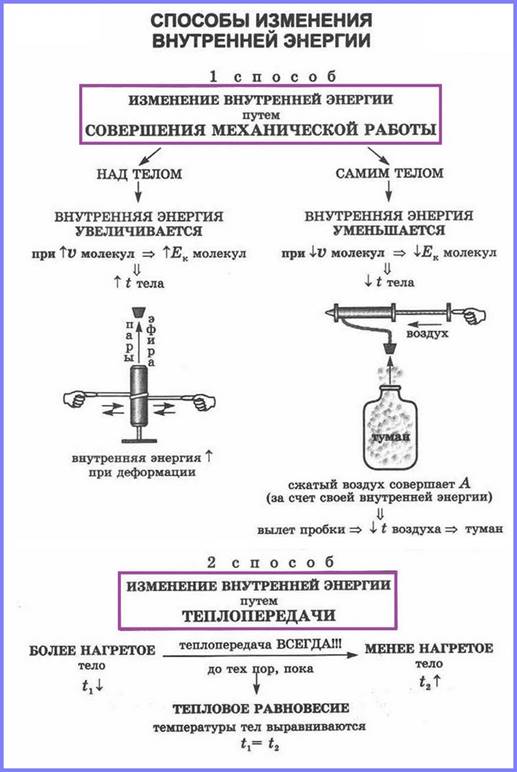
Внутреннюю энергию можно изменить при совершении работы. Если по куску свинца несколько раз ударить молотком, то даже на ощупь можно определить, что кусок свинца нагреется. Следовательно, его внутренняя энергия, так же как и внутренняя энергия молотка, увеличилась. Это произошло потому, что была совершена работа над куском свинца.
Если тело само совершает работу, то его внутренняя энергия уменьшается, а если над ним совершают работу, то его внутренняя энергия увеличивается.
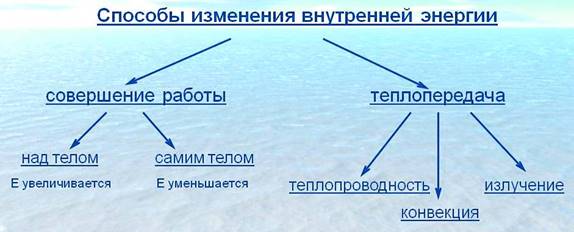
Если в стакан с холодной водой налить горячую воду, то температура горячей воды понизится, а холодной воды — повысится. В рассмотренном примере механическая работа не совершается, внутренняя энергия тел изменяется путём теплопередачи, о чем и свидетельствует понижение её температуры.
Молекулы горячей воды обладают большей кинетической энергией, чем молекулы холодной воды. Эту энергию молекулы горячей воды передают молекулам холодной воды при столкновениях, и кинетическая энергия молекул холодной воды увеличивается. Кинетическая энергия молекул горячей воды при этом уменьшается.
Теплопередача – это способ изменения внутренней энергии тела при передаче энергии от одной части тела к другой или от одного тела к другому без совершения работы.
Внутренняя энергия любого вещества — это энергия теплового движения его молекул и энергия их взаимодействия между собой. Модель идеального газа предполагает отсутствие взаимодействия между его молекулами, поэтому внутренней энергией идеального газа принято считать только энергию теплового движения молекул. Внутренняя энергия газа представляет собой сумму кинетических энергий его молекул и определяется формулой: U=N⟨Ek⟩,
где N — число молекул (атомов), N = νN A; ν — количество вещества; N A — постоянная (число) Авогадро, N A = 6,02 ⋅ 1023 моль–1; ⟨Ek⟩ — средняя кинетическая энергия одной молекулы, ⟨Ek⟩=i2kT; i — число степеней свободы; k — постоянная Больцмана, k = 1,38 ⋅ 10−23 Дж/К; T — абсолютная температура.
Число степеней свободы зависит от количества атомов в молекуле газа и имеет следующие значения:
· для одноатомного — i = 3;
· для двухатомного — i = 5;
· для трех- и многоатомного — i = 6.
В Международной системе единиц внутренняя энергия вещества (газа) измеряется в джоулях (1 Дж).
Внутренняя энергия идеального газа определяется формулой: U=i2νRT,
где i — число степеней свободы; ν — количество вещества (газа); R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К); T — абсолютная (термодинамическая) температура вещества.
Внутренняя энергия для одно-, двух-, трех- и многоатомных газов определяется следующими формулами:
· для одноатомного — U=32νRT;
· для двухатомного — U=52νRT;
· для трех- и многоатомного — U = 3νRT.
Изменение внутренней энергии газа определяется разностью: ΔU = U 2 − U 1,
где U 1 — внутренняя энергия начального состояния газа; U 2 — внутренняя энергия конечного состояния газа.
Изменение внутренней энергии газа связано с изменением кинетической энергии движения его молекул. Изменение кинетической энергии движения молекул вещества, в свою очередь, связано с изменением температуры. Следовательно, изменение внутренней энергии газа определяется изменением его температуры.
Изменение внутренней энергии идеального газа рассчитывается по формуле: ΔU=i2νR(T2−T1)=i2νRΔT,
где i — число степеней свободы; ν — количество вещества; R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); T 2 — абсолютная температура конечного состояния газа; T 1 — абсолютная температура начального состояния идеального газа; ∆T = T 2 − T 1.
Изменение внутренней энергии для одно-, двух-, трех- и многоатомных газов определяется следующими формулами:
· для одноатомного — ΔU=32νRΔT;
· для двухатомного — ΔU=52νRΔT;
· для трех- и многоатомного — ∆U = 3νR∆T.
Изменение внутренней энергии газа ΔU при различных процессах также различно и показано в таблице (для одно-, двух-, трех- и многоатомных газов):
|
Процесс |
Одноатомный газ, i = 3 |
Двухатомный газ, i = 5 |
Трех- и многоатомный газ, i = 6 |
|
Изотермический T = const |
0 |
0 |
0 |
|
Изохорный V = const |
32νRΔT |
52νRΔT |
3νR∆T |
|
Изобарный P = const |
32νRΔT |
52νRΔT |
3νR∆T |
|
Циклический |
0 |
0 |
0 |
Внутренняя энергия газа не изменяется (U = const):
· при изотермическом процессе, так как ΔT = 0;
· при циклическом процессе, так как в конце процесса газ возвращается в состояние с исходными параметрами; циклическим (круговым, замкнутым) процессом, или циклом, называется процесс, при котором газ, пройдя ряд состояний, возвращается в исходное.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.