
А.А. Остапенко
М.В.Воронина
Э.В.Хандога
ОСНОВЫ
клинической
лабораторной диагностики
г.Запорожье, 2020
УДК
ББК
Т
Авторы
А.А. Остапенко, М.В.Воронина
Рецензенты:
.
А.Г.ЛУНЕВА, доктор медицинских наук, профессор, зав. кафедры клинической лабораторной диагностики НМАПО им. П.Л. Шупика.
Основы клинической лабораторной диагностики: учебное пособие / А.А.Остапенко. М.В.Воронина, Э.В.Хандога – Запоріжжя, 2020. – 185 с.
Учебно-методическое пособие разработано на кафедре лабораторной диагностики, общей патологи и клинической анатомии ГЗ «ЗМАПО МЗ Украины»
В учебном пособии рассмотрены основные принципы организации и проведения клинических лабораторных исследований. Описаны этапы технологического процесса выполнения лабораторных анализов и способы повышения надежности диагностической информации. Значительное внимание уделено вопросам оценки и интерпретации результатов исследований. Представлены современные методы количественного анализа в клинико-диагностической лаборатории.
Пособие написано в соответствии с учебной программой по специальности «Клиническая лабораторная диагностика» для курсантов факультетов высших медицинских учебных заведений последипломного образования. Может быть полезным также для преподавателей, магистрантов, аспирантов, научных сотрудников, использующих в своей работе лабораторные исследования.
УДК
ББК
Т
ISBN
ISBN
©
О Г Л А В Л Е Н И Е
|
Предисловие ……………………………………………………………………………. |
5 |
|
||||
|
Часть 1 |
Организационные основы клинической ЛАБОРАТОРНОЙ диагностики |
|
||||
|
|
1.1. |
Цели и задачи клинической лабораторной диагностики как вида медицинской деятельности ………………………………………………. |
7 |
|||
|
|
1.2. |
Статус клинико-диагностической лаборатории ………………………… |
8 |
|||
|
|
1.3. |
Штаты и структура клинико-диагностической лаборатории ………….. |
11 |
|||
|
|
1.4. |
Организация рабочих мест и оснащение клинико-диагностической лаборатории ……………………………………………………………….. |
13 |
|||
|
|
1.5. |
Правила безопасной работы в лаборатории ……………………………. |
15 |
|||
|
|
1.5.1. |
Санитарно-противоэпидемический режим в клинико-диагностической лаборатории ……………………………………….. |
16 |
|||
|
|
1.5.2. |
Средства индивидуальной защиты …………………………………… |
19 |
|||
|
|
1.5.3. |
Правила обеззараживания использованного биологического материала ………………………………………………………………. |
20 |
|||
|
|
1.5.4. |
Способы и средства дезинфекции и стерилизации изделий медицинского назначения в КДЛ ……………………………………. |
21 |
|||
|
|
1.5.5. |
Противопожарная безопасность в КДЛ …………………………….. |
24 |
|||
|
|
1.5.6. |
Правила безопасной работы с едкими веществами (кислоты, щелочи) ………………………………………………………………… |
26 |
|||
|
|
1.5.7. |
Первая помощь пострадавшим в лаборатории ……………………… |
27 |
|||
|
Часть 2 |
Техническое обеспечение КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ Исследований |
|
||||
|
|
2.1. |
Лабораторная посуда и инструментарий ………………………………… |
28 |
|||
|
|
2.2. |
Средства пробоподготовки в лаборатории. Дозирующие устройства. .. |
32 |
|||
|
|
2.3. |
Центрифугирование ………………………………………………………. |
34 |
|||
|
|
2.4. |
Перемешивающие и термостатирующие устройства ………………….. |
36 |
|||
|
|
2.5. |
Весоизмерительная техника ……………………………………………… |
38 |
|||
|
|
2.6. |
Лабораторные реагенты ………………………………………………….. |
39 |
|||
|
|
2.7. |
Правила приготовления растворов ……………………………………… |
44 |
|||
|
|
2.7.1. |
Определение рН растворов …………………………………………... |
49 |
|||
|
|
2.7.2. |
Фильтрование …………………………………………………………. |
50 |
|||
|
|
2.7.3. |
Определение плотности растворов ………………………………….. |
52 |
|||
|
|
2.7.4. |
Измерение температуры растворов …………………………………. |
53 |
|||
|
|
2.8. |
Оборудование клинико-диагностической лаборатории ………………. |
55 |
|||
|
Часть 3 |
Принципы налаживания КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ исследованиЙ |
|
||||
|
|
3.1. |
Основные этапы процесса производства лабораторных анализов ……. |
56 |
|||
|
|
3.2. |
Запрос на анализ ………………………………………………………….. |
57 |
|||
|
|
3.3. |
Взятие материала …………………………………………………………. |
59 |
|||
|
|
3.4. |
Правила транспортировки и хранения биологического материала …… |
61 |
|||
|
|
3.5. |
Порядок приема и регистрации проб для исследования ………………. |
62 |
|||
|
|
3.6. |
Выбор метода и режима исследования …………………………………. |
63 |
|||
|
|
3.7. |
Обеспечение качества лабораторных исследований …………………... |
66 |
|||
|
|
3.7.1. |
Система управления качеством лабораторных исследований ……. |
71 |
|||
|
|
3.8. |
Представление результатов лабораторных исследований …………….. |
79 |
|||
|
|
3.9. |
Принципы оценки результатов лабораторных исследований ………… |
81 |
|||
|
|
3.9.1. |
Допустимая погрешность результатов лабораторных исследований в клинике ……………………………………………………………… |
82 |
|||
|
|
3.9.2. |
Референтные интервалы лабораторных показателей ………………. |
85 |
|||
|
Часть 4 |
КОЛИЧЕСТВЕННЫЕ МЕТОДЫ АНАЛИЗА В КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ |
|
||||
|
|
4.1. |
Оптические методы анализа …………………………………………….. |
90 |
|||
|
|
4.1.1. |
Основные условия измерений при работе с фотометрической аппаратурой …………………………………………………………… |
98 |
|||
|
|
4.1.2. |
Способы измерений, расчета и представления результатов фотометрии ……………………………………………………………. |
100 |
|||
|
|
4.2. |
Иммунохимические методы анализа в клинической лаборатории ……. |
102 |
|||
|
|
4.2.1. |
Способы детекции результатов иммунохимической реакции …….. |
107 |
|||
|
|
4.2.2. |
Краткий обзор некоторых иммунохимических тестов …………….. |
108 |
|||
|
|
4.2.3. |
Радиоиммунологический анализ …………………………………….. |
112 |
|||
|
|
4.2.4. |
Иммуноферментный анализ ……………………………………………. |
114 |
|||
|
|
4.2.5. |
Иммуноблотинг …………………………………………………………. |
116 |
|||
|
|
4.3. |
Методы фракционирования биологических жидкостей ………………. |
117 |
|||
|
|
4.3.1. |
Хроматография ……………………………………………………….. |
117 |
|||
|
|
4.3.2. |
Электрофорез …………………………………………………………. |
125 |
|||
|
|
4.4. |
Методы микроскопии в клинико-диагностической лаборатории …….. |
131 |
|||
|
|
4.4.1. |
Методы световой микроскопии ……………………………………... |
132 |
|||
|
|
4.4.2. |
Современные приборы для микроскопии ………………………….. |
138 |
|||
|
|
4.4..3. |
Уход за микроскопом ………………………………………………… |
143 |
|||
|
|
4.5. |
Сухая химия ………………………………………………………………. |
143 |
|||
|
|
4.6. |
Молекулярно-биологические методы исследований ………………….. |
145 |
|||
|
|
4.6.1. |
Применение ПЦР в клинической практике ………………………… |
152 |
|||
|
|
4.6.2. |
ПЦР в реальном времени ……………………………………………. |
153 |
|||
|
Приложения |
|
|
||||
|
Приложение I …………………………………………………………………………… |
156 |
|
||||
|
Приложение II ………………………………………………………………………….. |
160 |
|
||||
|
Приложение III ………………. ………………………………………………………… |
178 |
|
||||
|
Рекомендуемая литература …………………………………………………………….. |
184 |
|
||||
П Р Е Д И С Л О В И Е
Клиническая лабораторная диагностика представляет собой медицинскую диагностическую специальность, которая занимается исследованием in vitro биологических материалов человеческого организма с целью верификации и мониторинга патологических состояний в клинической практике, а в более широком смысле – с целью получения объективных данных о состоянии здоровья и нездоровья отдельно взятого пациента, выделенной группы или населения региона в целом.
В современной медицине лабораторная диагностика является неотъемлемой частью клинического обследования больного, поэтому знание основ этой дисциплины является необходимым для врачей различных специальностей. Это определяет важность и целесообразность введения клинической лабораторной диагностики в систему высшего медицинскогопоследипломного образования Украины.
Представляемое пособие предназначено в первую очередь для курсаетов факультетов последипломного образования высших учебных заведений, которые приступают к изучению клинической лабораторной диагностики. Пособие призвано дать цельное представление об организации выполнения лабораторных анализов и создать необходимый фундамент знаний для последующего освоения различных разделов лабораторной медицины.
Пособие состоит из 4-х частей. В первой части излагается роль и место клинико-диагностической лаборатории в структуре учреждений здравоохранения, принципы взаимодействия с другими клиническими подразделениями, организационные основы деятельности КДЛ, а также принципы организации технологического процесса. Материал основан на инструктивных документах и приказах МЗ Украины, регламентирующих работу лаборатории.
Вторая часть посвящена основам техники лабораторных работ, без знаний которых студент не может стать специалистом по клинической лабораторной диагностике: даются маркировка и правила хранения реактивов, приготовление растворов, описываются средства пробоподготовки и правила работы с ними, приводится перечень основного оборудования.
В третьей части пособия рассматриваются принципы налаживания технологического процесса выполнения лабораторных исследований на всех его этапах (преаналитическом, аналитическом и постаналитическом). Подробно рассматриваются факторы, способные повлиять на надежность лабораторной информации и подходы к обеспечению контроля качества лабораторных исследований.
В заключительной части пособия приведены современные технологии анализа в клинико-диагностической лаборатории. При изложении материала большое внимание уделено теоретическим вопросам, лежащим в основе того или иного метода исследования, области его применения в клинической практике, потенциальным источникам ошибок, точности метода, а также его преимуществам и недостаткам.
Пособие дополнено приложениями, содержащими справочные материалы, которые могут пригодиться специалистам по лабораторной медицине в их будущей деятельности.
Все критические замечания и пожелания в адрес книги будут восприняты авторами с благодарностью.
|
Часть 1 |
Организационные основы клинической ЛАБОРАТОРНОЙ диагностики |
1.1. Цели и задачи клинической лабораторной диагностики как вида медицинской деятельности
Многообразие патологических форм заболеваний, индивидуальность их проявления у различных людей делают процесс диагностики достаточно трудным. Поэтому клиническая медицина широко использует объективные методы исследования организма пациента, среди которых важнейшую роль играет лабораторная диагностика, предоставляющая около 80% объема объективной диагностической информации.
Клиническая лабораторная диагностика имеет целью обеспечение научно-обоснованной, максимально быстрой и минимально затратной лабораторной поддержки верификации патологических состояний в клинической практике.
Основными задачами лабораторной диагностики как вида медицинской деятельности являются:
1. Формирование единого технологического процесса производства лабораторных анализов.
2. Непосредственное выполнение различных видов лабораторных исследований.
3. Разработка критериев качества для отдельных этапов единого технологического процесса выполнения анализов.
4. Участие в разработке и внедрении новых эффективных методов исследования.
5. Своевременная замена лабораторных тестов на новые, имеющие более высокие клинические критерии: специфичность, чувствительность, устойчивость к интерференциям и одновременно являющиеся экономически целесообразными.
6. Составление диагностических программ, определение спектра и частоты выполнения лабораторных исследований при различных патологических состояниях. Выбор количественных лабораторных критериев оценки эффективности лечебных мероприятий на основании передовых достижений медицинской науки.
Клинико-диагностическая лаборатория (КДЛ) работает в постоянном взаимодействии с клиническими подразделениями учреждений здравоохранения. Без такого взаимодействия невозможно использование лечащим врачом объективной информации о состоянии пациента, предоставляемой лабораторией.
В целом ответственность за принятие решений о том, какие лабораторные исследования должны быть выполнены, а также за интерпретацию полученных результатов ложится на лечащего врача. Однако роль клинической лаборатории не сводится просто к выполнению заказа лечащего врача. В настоящее время в связи с резким расширением номенклатуры лабораторных исследований лечащий врач часто испытывает затруднение в выборе наиболее подходящего параметра, а также в оценке их клинической значимости. Но его задача может быть существенно облегчена адекватной помощью клинико-диагностической лаборатории.
Поэтому в современной клинической медицине наиболее рациональной признается следующая модель взаимодействия врача-клинициста и КДЛ: лечащий врач ставит диагностическую задачу, определяя круг необходимых анализов, и организует сбор проб соответствующих биоматериалов пациента. При этом лабораторные исследования назначаются только по показаниям: посиндромная диагностика состояния пациента, диагностика заболевания, скрининг скрытой патологии, контроль динамики патологического процесса, мониторинг эффективности лечения, прогноз. Лаборатория предоставляет информацию о способе подготовки пациента, взятии биологического материала, нормальных значениях и допустимой погрешности для проводимых анализов, производит выполнение анализов и представляет результат лечащему врачу. Интерпретация результатов лабораторных исследований осуществляется лечащим врачом совместно с врачом лабораторной диагностики.
1.2. Статус клинико-диагностической лаборатории
Статус клинико-диагностической лаборатории в учреждениях здравоохранения регламентируется Положением о клинико-диагностической лаборатории, которое утверждается руководителем учреждения.
Документ включает в себя следующие разделы:
1. Общие положения. В этом разделе дается определение клинико-диагностической лаборатории как структурного подразделения учреждения, имеющего права отделения. Непосредственное руководство деятельностью лаборатории и контроль за работой всех подчиненных осуществляет заведующий КДЛ, который подчиняется заместителю руководителя учреждения здравоохранения по медицинской части. Заведующий КДЛ несет ответственность за соблюдение персоналом лаборатории правил внутреннего распорядка, техники безопасности, санитарно-противоэпидемического режима, противопожарной безопасности. На должность заведующего КДЛ назначается врач лабораторной диагностики, имеющий высшее медицинское образование. Для крупных лабораторий могут быть предусмотрены дополнительные требования, например, квалификационная категория не ниже первой, стаж работы не менее пяти лет, наличие научной степени и др.
2. Основные задачи. В данном разделе указываются цели и задачи КДЛ как одного из отделений учреждения здравоохранения в обеспечении лечебно-диагностического процесса.
3. Права и обязанности. В разделе определяется право КДЛ проводить диагностические исследования для населения, подтверждая результаты проведенных исследований справками-заключениями; проводить испытания реагентов и клинико-диагностического оборудования, используемых для обеспечения работы КДЛ; определять полноту программ исследований, давать предложения о внесении в них изменений. В разделе подтверждается право персонала КДЛ вносить предложения по совершенствованию работы КДЛ, иметь в лаборатории безопасные условия труда и средства индивидуальной защиты.
4. Взаимоотношения. Связи. В данном разделе регламентированы взаимодействие КДЛ с Министерством здравоохранения Украины, территориальными органами здравоохранения, главным специалистом по клинической лабораторной диагностике Министерства здравоохранения Украины, главными специалистами регионов и руководителями КДЛ города и области, учреждениями здравоохранения и отдельными гражданами.
5. Функции. В данном разделе названы виды лабораторных исследований, которые выполняются КДЛ данного учреждения в соответствии с основной задачей. Определен порядок формирования заказов на реактивы, диагностические наборы и реагенты, клинико-диагностическое оборудование; меры по обеспечению контроля качества и повышению достоверности исследований, проводимых в КДЛ. Указаны пути осуществления взаимодействия с Всеукраинской Асоциацией Клинической Химии и Лабораторной Медицины и другими органами, отвечающими за обеспечение стандартизации при проведении лабораторных исследований.
6. Ответственность. Клинико-диагностическая лаборатория в лице заведующего КДЛ несет ответственность за выполнение функций и обязанностей, установленных настоящим Положением и, прежде всего, за полноту и объективность проводимых исследований, достоверность их результатов и выводов, за соблюдение установленных сроков проведения исследований, а также за обеспечение конфиденциальности информации. Определена дисциплинарная ответственность сотрудников лаборатории за неисполнение или ненадлежащее исполнение должностных обязанностей, возложенных на них настоящим Положением, должностными инструкциями и другими нормативными документами, а также материальную ответственность – за нанесение ущерба своими действиями и решениями.
Для быстрейшего внедрения в повседневную практику новых современных диагностических методов целесообразно создание централизованных лабораторий. Первыми в Украине были централизованы биохимические методы исследования, что сделало их доступными для широкого круга учреждений здравоохранения и одновременно позволило использовать с максимальной эффективностью современное дорогостоящее диагностическое оборудование. В настоящее время актуальность создания централизованных биохимических лабораторий потеряла свою актуальность в связи с развитием материальной базы клинико-диагностических лабораторий всех уровней. На повестке дня стоит вопрос о централизации аллергологических и молекулярно-биологических исследований, что обеспечит рациональное использование лабораторной техники, реактивов и высокопрофессиональных специалистов.
Каждая клинико-диагностическая лаборатория занимает определенное место в общей структуре лабораторной службы Украины. На республиканском уровне работу службы курирует отдел Министерства здравоохранения, Всеукраинская Асоциация Клинической Химии и Лабораторной Медицины и непосредственно главный (внештатный) специалист по клинической лабораторной диагностике, который, в свою очередь, руководит кафедрой клинической лабораторной диагностике. Основной задачей Асоциации является определение стратегических направлений деятельности службы, в том числе разработка предложений по перспективному оснащению КДЛ и контролю за рациональным использованием оборудования, проведение рабочих совещаний и конференций по актуальным проблемам клинической лабораторной диагностики, планирование подготовки и усовершенствования персонала КДЛ в области использования современных технологий. Под руководством главного специалиста Асоциаця проводит работу по внешнему (межлабораторному) контролю качества. На уровне области (региона) методическое руководство службой лабораторной диагностики осуществляет главный (внештатный) специалист по клинической лабораторной диагностике области (как правило, заведующий КДЛ областной больницы), который назначается Управлением здравоохранения областного исполнительного комитета.
1.3. Штаты и структура клинико-диагностической лаборатории
Штаты медицинского персонала клинико-диагностической лаборатории устанавливаются в соответствии с выполняемым объемом работ на основе расчетных норм, оговоренных в нормативных документах Министерства здравоохранения Украины.
Примерные штаты КДЛ:
· заведующий КДЛ
· врач лабораторной диагностики
· старший фельдшер-лаборант
· фельдшер-лаборант
· лаборант
· медрегистратор*
· сестра-хозяйка*
· инженер по обслуживанию и ремонту аппаратуры*
· программист*
· младшая медсестра
Примечание: * - должности вводятся в крупных лабораториях.
Функциональные обязанности каждого сотрудника лаборатории – врача лабораторной диагностики, фельдшера-лаборанта (лаборанта), младшей медсестры – регламентируются должностными инструкциями и рабочей инструкцией (для санитарки).
Должностные инструкции разрабатываются на основе нормативных документов, которыми специалист руководствуется в своей работе, в том числе Устава учреждения, Положения о КДЛ, нормативных актов вышестоящих органов по вопросам здравоохранения. Они определяют требования к специалисту, спектр выполняемых им в лаборатории функций, права и ответственность.
При этом на врача возлагается выполнение наиболее сложных исследований, что позволяет ему уделить значительное внимание организации работы по контролю качества лабораторных исследований, внедрению новых передовых методик, обучению персонала. Это предполагает, что врач лабораторной диагностики должен владеть всем перечнем исследований, выполняющихся на его участке.
В то же время, согласно этому постановлению, выполнение (самостоятельно или под руководством врачей) простых рутинных исследований возлагается на средний медицинский персонал (фельдшеров-лаборантов и лаборантов)
Повышение профессиональной подготовки специалистов – врачей лабораторной диагностики и фельдшеров-лаборантов – осуществляется путем запланированного усовершенствования в учреждениях последипломного образования, организации и проведения специальной учебы, аттестации на квалификационные категории.
Структура клинико-диагностической лаборатории отражает виды лабораторной деятельности, которые реализуются в данной лаборатории. В многопрофильной лаборатории могут быть сформированы группы гематологических, общеклинических, биохимических, микробиологических и других исследований. В клинико-диагностических лабораториях учреждений здравоохранения, имеющих реаниматологические отделения, организуются участки срочных исследований (экспресс-лаборатории), которые позволяют проводить диагностику неотложных состояний.
Номенклатура лабораторных исследований должна соответствовать специфике работы стационарных и поликлинических отделений. Перечень лабораторных методов регулярно пересматривается и обновляется в соответствии с целями и задачами лабораторной службы, совершенствуются аналитические возможности, повышается ценность лабораторной информации в плане принятия обоснованных диагностических и лечебных клинических решений.
Крупные клинико-диагностические лаборатории могут являться базовыми для кафедр клинической лабораторной диагностики медико-диагностических факультетов медицинских университетов и академий последипломного образования по вопросам проведения занятий со студентами, интернами и курсантами по отдельным разделам лабораторной диагностики, по подготовке дипломных работ, обучению в интернатуре, клинической ординатуре и магистратуре.
1.4. Организация рабочих мест и оснащение клинико-диагностической лаборатории
Под лабораторию должно быть отведено просторное светлое помещение, обязательно обеспеченное водопроводом, канализацией и электричеством. Отопление предпочтительнее центральное. Помещения лаборатории желательно размещать в таких зданиях, которые имеют прочный фундамент, предохраняющий строение от вибрации, так как это может сильно отразиться на работе точных приборов и аналитических весов. Если помещение лаборатории расположено в цокольных этажах, то рабочие места необходимо обеспечить хорошим освещением, желательно лампами дневного света. Освещенность рабочих мест должна быть не ниже 60 люкс.
Площадь лабораторных помещений должна обеспечивать среднюю санитарную норму на каждого работающего, в среднем 12-14 м2. Недопустимо скопление в лаборатории большого числа работающих.
В помещениях лаборатории должно быть предусмотрено наличие ряда помещений: кабинет приема и регистрации биоматериалов, помещение для пробоподготовки, приготовления и хранения реактивов, моечная, функциональные помещения для выполнения отдельных аналитических процедур, где установлено необходимое оборудование. В небольших лабораториях возможно совмещение ряда кабинетов, например помещения для приема и регистрации биоматериалов и помещения для проведения пробоподготовки. Однако во всех этих случаях должны быть соблюдены правила техники безопасности, противопожарной безопасности и санитарно-противоэпидемического режима.
В настоящее время потеряло актуальность наличие специальных помещений для приготовления реактивов, так как практически повсеместно исследования выполняются с использованием готовых диагностических наборов, в том числе отечественного производства. В то же время применение современных высокопроизводительных анализаторов требует соблюдения определенного температурного режима. Поэтому в производственных помещениях КДЛ необходимо устанавливать кондиционеры.
Количество функциональных помещений для выполнения различных аналитических процедур зависит от мощности лаборатории, то есть количества и спектра выполняемых ежедневно исследований. В крупных лабораториях, как правило, в раздельных помещениях предусматриваются исследования гемостаза, анализ белковых и липидных фракций методом электрофореза (помещение должно быть обязательно оборудовано местной вытяжной вентиляцией), иммуноферментные, радиоиммунные, иммунофлуоресцентные анализы.
Некоторые современные виды исследований требуют выделения специальных дополнительных помещений. Так, при налаживании технологии полимеразной цепной реакции (ПЦР), в связи с высокой чувствительностью метода, серьезной проблемой является возможность контаминации материала. Поэтому для организации ПЦР-лаборатории необходимо три (минимум два) несмежных помещения общей площадью не менее 25 – 30 м2, в которых проводятся различные стадии анализа. Причем в этих помещениях запрещено проводить все другие виды работ с биологическим материалом, за исключением предусмотренных ПЦР-методом.
В лаборатории необходимо установить аппарат для дистилляции воды, который лучше расположить в моечной или в отдельном помещении.
Для каждого работника следует оборудовать удобное рабочее место. На рабочем месте для приема и регистрации биологического материала необходимо предусмотреть раздельное размещение биоматериалов (кровь, моча, кал и т.д.). Здесь же должен располагаться запас посуды для сбора образцов биоматериалов. Для этого помещение для приема проб оборудуется шкафами. Следует помнить, что некоторая часть биологического материла должна оставляться в запасе в холодильнике до конца рабочего дня на случай необходимости повторного исследования.
Для выполнения исследований ручными методами используются химические столы, которые должны быть достаточно большими, приблизительно от 1,5 до 3 м2 полезной поверхности на каждого работающего. Это необходимо для того, чтобы удобно было расставить исследуемый материал, реактивы и посуду. Целесообразно размещать все необходимое для работы таким образом, чтобы любой нужный предмет было удобно достать рукой, не вставая с места. В то же время рабочее место нельзя загружать излишней посудой и оборудованием. На рабочих столах должно быть только самое необходимое. Обычно для выполнения определенной методики подготавливают свое рабочее место, на котором собраны нужные реактивы и посуда. Удобно на столе, вдоль всей его длины, установить горизонтальные полочки для рабочих реактивов и штативов с пипетками. Около каждого химического стола надо иметь специальные склянки для слива отработанного материала и емкости для использованной посуды. Лабораторные столы рекомендуется покрывать кафельной белой плиткой или светлым кислотоупорным пластиком. Стулья лучше подходят типа вертушки с моющимся покрытием.
Автоматизированные рабочие места могут иметь особенности в зависимости от конструкции прибора и его размещения (место для работы в положении сидя или для работы в положении стоя).
Важное значение имеет правильное освещение. Рабочие столы в лаборатории следует размещать так, чтобы свет падал сбоку, желательно с левой стороны. Если помещение небольшое, а рабочих столов много, то лучше всего приспособить скрытые лампы дневного света, расположенные впереди работающего. Для работы в вечернее и ночное время необходимо создать достаточное освещение, лучше лампами дневного света.
Потолки и стены в клинико-диагностической лаборатории должны быть облицованы кафелем или окрашены масляной краской, чтобы их можно было мыть. Полы можно покрывать линолеумом либо плиткой. Все помещение лаборатории должно быть приспособлено к частому мытью и возможности проведения дезинфекции.
Электрическое энергоснабжение должно обеспечивать питание всей измерительной и вспомогательной аппаратуры лаборатории. Необходимо предусмотреть достаточное количество электрических розеток различных типов, электросиловых автоматов, аккумуляторов типа УПС и обязательно систему заземления электрооборудования.
Лаборатория должна быть оборудована приточно-вытяжной вентиляцией с мощностью не менее 3-кратного обмена воздуха в помещении за смену. Для поддержания оптимальной температуры воздуха в рабочем помещении в жаркое время года необходимо предусмотреть в лаборатории установку кондиционеров.
Оснащение лабораторий формируется в зависимости от уровня учреждения здравоохранения (участковая больница, районный, городской, областной, республиканский уровень), коечного фонда стационаров, количества посещений в смену для амбулаторно-поликлинических учреждений.
1.5. Правила безопасной работы в лаборатории
В связи с тем, что в лабораториях широко используются различные электрические приборы, а также приходится работать с биологическим материалом и различными химическими веществами, предъявляются определенные требования к организации работы клинико-диагностической лаборатории, которые называют «правила техники безопасности». Техника безопасности – раздел охраны труда, определяющий использование безопасных приемов и методов работы, правильную организацию рабочего места, внедрение в практику средств защиты от опасных производственных факторов. Допущенная в работе небрежность может не только исказить результаты выполненных анализов, но и явиться причиной возникновения несчастных случаев (появления ожогов, отравлений, заражений и др.). Поэтому овладение элементами техники лабораторных работ представляет собой задачу первостепенной важности.
Необходимые требования для организации безопасной работы в лаборатории оговорены инструктивными материалами.
В доступном месте для персонала лаборатории вывешиваются типовые правила по технике безопасности, пожарной безопасности и соблюдению санитарно-эпидемического режима работы. Там же, обычно, комплектуется аптечка для оказания первой медицинской помощи с учетом профиля работы лаборатории.
Каждый сотрудник лаборатории должен пройти инструктаж по технике безопасности, который осуществляется поэтапно:
1. При поступлении на работу проводится вводный инструктаж инженером по охране труда данного учреждения здравоохранения и только после этого производится оформление вновь поступающего работника и направление его к месту работы.
2. На рабочем месте в клинико-диагностической лаборатории каждый вновь принятый на работу проходит первичный инструктаж, который проводится ответственным за технику безопасности в лаборатории.
3. Повторный инструктаж по технике безопасности осуществляется не реже 1 раза в 6 месяцев.
4. Проверка знаний персонала по вопросам безопасности труда осуществляется не реже 1 раза в 12 месяцев по программе, утвержденной главным врачом учреждения здравоохранения.
1.5.1. Санитарно-противоэпидемический режим в клинико-диагностической лаборатории
1. Санитарно-противоэпидемический режим в КДЛ – это комплекс санитарно–гигиенических и противоэпидемических мероприятий, препятствующих инфицированию медперсонала КДЛ и обследуемых больных. Сотрудники КДЛ подвергаются риску заражения ВИЧ, вирусным гепатитом, кишечными инфекциями и другими инфекционными заболеваниями, основным источником распространения которых является инфицированный биологический материал (кровь, мокрота, ликвор, сперма, кал и другие секреты и экскреты). Ответственность за организацию и соблюдение противоэпидемического режима при работе с потенциально опасным материалом возлагается на руководителя КДЛ. Контроль за выполнением санитарно-противоэпидемического режима в КДЛ учреждений здравоохранения осуществляют заведующий КДЛ, старший фельдшер-лаборант и специалисты центров гигиены и эпидемиологии. Требования по соблюдению санитарно-противоэпидемического режима в учреждениях здравоохранения оговорены нормативными актами. (Наказ МОЗ України № 26 від 24.01.2008 г. “Про затвердження державних са-нітарних норм і правил “Організація роботи лабораторій при дослідженні матеріалу що містить біологічні патогенні агенти І – IV груп патогенності молекулярно-генетичними методами ”, Наказ від 05.11.2013 № 955 «Про затвердження нормативно-правових актів щодо захисту від зараження ВІЛ-інфекцією при виконанні професійних обов’язків» и др.).
Медицинскому персоналу КДЛ следует избегать контакта кожи и слизистых с кровью и другими биологическими жидкостями, для чего необходимо:
1. Работать в халатах, шапочках, сменной обуви, а при угрозе забрызгивания кровью или другими биожидкостями – в масках, очках, клеенчатом фартуке.
2. Работать с исследуемым материалом в резиновых перчатках, избегать уколов и порезов, все повреждения кожи должны быть закрыты лейкопластырем или напальчниками.
3. Проводить разборку, мойку, прополаскивание лабораторного инструментария и посуды после предварительной дезинфекции.
4. В случае загрязнения кожных покровов кровью или другими биожидкостями следует немедленно обработать их в течение 2 мин. тампоном, смоченным 70 % спиртом, вымыть с мылом под проточной водой и вытереть индивидуальным полотенцем.
5. При загрязнении перчаток кровью их протирают тампоном, смоченным 3% раствором хлорамина или 6% раствором перекиси водорода.
6. При попадании крови на слизистые оболочки, их немедленно промывают водой, 1% раствором борной кислоты, слизистую носа обрабатывают 1 % раствором протаргола, рот и горло прополаскивают 70% спиртом или 1% раствором борной кислоты или 0,06% раствором марганцевокислого калия.
7. Запрещается пипетирование крови ртом. Следует использовать автоматические пипетки, а при их отсутствии – резиновые груши.
8. Запрещается принимать пищу, пить, курить и пользоваться косметикой на рабочем месте.
9. Поверхность рабочих столов в конце каждого рабочего дня, а в случае загрязнения биологическим материалом, немедленно подвергаются дезинфекции.
Мероприятия при ранениях, контактах с кровью, другими биологическими материалами пациентов
Любое повреждение кожи, слизистых, загрязнение их биологическими материалами пациентов должно квалифицироваться как возможный контакт с материалом, содержащим ВИЧ или другой агент инфекционного заболевания.
Если контакт с кровью или другими жидкостями произошел с нарушением целостности кожных покровов (укол, порез), пострадавший должен:
· снять перчатки рабочей поверхностью внутрь;
· выдавить кровь из раны;
· поврежденное место обработать одним из дезинфектантов (70% спирт, 5% настойка йода при порезах, 3% раствор перекиси водорода при уколах и др.);
· руки вымыть под проточной водой с мылом, а затем протереть спиртом 70%;
· на рану наложить пластырь, надеть напальчники;
· при необходимости продолжить работу, надеть новые перчатки.
В случае загрязнения кровью или другой биологической жидкостью без повреждения кожи:
· обработать кожу одним из дезинфектантов (70% спиртом, 3% перекисью водорода, 3% раствором хлорамина и др.);
· обработанное место вымыть водой с мылом и повторно обработать спиртом.
При попадании биоматериала на слизистые оболочки:
· полость рта прополоскать 70% спиртом;
· в полость носа закапать 20-30% раствором альбуцида;
· глаза промыть водой, закапать 20-30% раствор альбуцида.
При попадании биоматериала на халат, одежду, обувь:
· обеззараживаются перчатки перед снятием одежды;
· при незначительных загрязнениях биологической жидкостью одежда снимается и помещается в пластиковый пакет и направляется в прачечную без предварительной обработки, дезинфекции;
· при значительном загрязнении одежда замачивается в одном из дезинфектантов (кроме 6% перекиси водорода и нейтрального гидрохлорида кальция, который разрушает ткани);
· личная одежда, загрязненная биологической жидкостью, подвергается стирке в горячей воде 70°С с моющим средством;
· кожа рук и других участков тела под местом загрязненной одежды протирается 70% спиртом, затем промывается с мылом и повторно протирается спиртом;
· загрязненная обувь двукратно протирается ветошью, смоченной в растворе одного из дезинфицирующих средств.
Аптечка для экстренной медицинской помощи
Для оказания экстренной медицинской помощи при аварийной ситуации, сопровождающейся нарушением целостности кожных покровов, попаданием биологического материала на слизистые на рабочем месте, необходимо иметь аптечку со следующим набором предметов и медикаментов:
- напальчники (или перчатки),
- лейкопластырь,
- ножницы,
- спирт этиловый 70%,
- альбуцид 20-30%,
- настойка йода 5%,
- перекись водорода 3%.
1.5.2. Средства индивидуальной защиты
Средствами индивидуальной защиты при работе в лабораториях являются халаты, косынки или шапочки, прорезиненный или полиэтиленовый фартук, резиновые перчатки, защитные очки.
Прорезиненный или полиэтиленовый фартук, резиновые перчатки, защитные очки (должны плотно прилегать к лицу) необходимы при работе с биологическим материалом и едкими веществами.
Халат является формой одежды медицинского персонала, стирается по мере загрязнения, но не реже 2 раз в неделю. В случае загрязнения биологическим материалом обязательно предварительное замачивание в дезинфицирующем растворе в соответствии со стандартом «Дезинфекция и стерилизация в медицинской практике: основные нормы и правила» (60 мин в 0,5% растворе хлорамина).
Перчатки необходимо одевать во время каждой процедуры работы с пациентами или с биологическим материалом. При работе с пациентами и при проведении аналитических манипуляций используются одноразовые диагностическо-смотровые нестерильные перчатки. Для обработки и мойки инструментов используют технические перчатки. Использованные перчатки погружаются в дезинфицирующий раствор на 60 минут.
Маска и очки необходимы при возможности разбрызгивания биологического материла. Маска должна меняться через каждые 4 часа работы. Очки после каждого использования протирают дезинфицирующим раствором, промывают проточной водой, высушивают.
1.5.3. Правила обеззараживания использованного биологического материала
Биологический материал от пациентов подлежит обеззараживанию. Для этого используют специальные средства, разрешенные к применению в Украине, большинство из которых содержит хлор либо гипохлорид кальция.
Обеззараживание мокроты, оформленных фекалий, смешанных с мочой или водой в соотношении 1:5, жидких фекалий, рвотных масс, остатков пищи. Наиболее часто используют следующие средства:
· Хлормикс, Хлордез
· Двутретьосновная соль гипохлорита кальция (ДТС ГК): Время обеззараживания – 60 мин, нормы расхода –200 г/л, засыпать и размешать
· Двуосновная соль гипохлорита кальция (ДСГК): Время обеззараживания – 60 мин, нормы расхода – 200 г/л, засыпать и размешать
· Гипохлорид кальция технический (ГКТ): Время обеззараживания – 120 мин, нормы расхода – 200 г/л марки А, 250 г/л марки В, засыпать и размешать
· Нейтральный гипохлорид кальция (НГК): Время обеззараживания – 120 мин, нормы расхода – 150 г/л. Время обеззараживания – 30 мин, нормы расхода 200 г/л, засыпать и размешать
Обеззараживание мочи, жидкости после ополаскивания зева:
· Автоклавирование при 1,5 атм в течение 60 минут
· Гипохлорид кальция технический (ГКТ): Время обеззараживания – 15 мин, нормы расхода – 10 г/л, засыпать и размешать
· Нейтральный гипохлорид кальция (НГК): Время обеззараживания – 15 мин, нормы расхода – 5 г/л, засыпать и размешать
При использовании других дезинфицирующих средств не указанных в данном списке, обеззараживание проводить согласно инструкции фирмы-производителя.
Обеззараживание отработанной крови и ее компонентов
Осуществляется в соответствии со Наказом Міністерства охорони здоров’я України від 11.08.2014 № 552 «Про затвердження Державних санітар-них норм та правил «Дезінфекція, передстерелізаційне очищення та стерилізація медичних виробів в закладах охорони здоров’я», що вступає в силу із 01.09.2016 року и «Стандартами дезинфекции и стерилизации при работе с кровью». Используют следующие средства: хлормикс, хлордез, люмакс, ультрадез и др. Их выпускают в виде порошка или гранул, которым засыпают использованный биологический материал, который через определенный промежуток времени (обычно 60 минут) утилизируют.
Обеззараживание культур микроорганизмов
Отработанные чашки Петри и пробирки с посевами патогенных культур, матрацы с зараженными перевиваемыми тканевыми культурами собирают в посуду с крышками и автоклавируют при 1200, 1,5 атм, в течение 60 минут или кипятят в мыльной воде или 2% содовом растворе в течение 30 минут с момента закипания. В виде исключения допускается обеззараживание погружением в дезинфицирующие растворы на 10-12 часов (5% лизол или 3% хлорамин). В последнем случае посуда после обеззараживания тщательно промывается.
1.5.4. Способы и средства дезинфекции и стерилизации изделий медицинского назначения в КДЛ
Дезинфекция изделий медицинского назначения производится с целью профилактики внутрибольничных инфекций у пациентов и персонала учреждений здравоохранения. Основные требования по организации и осуществлению контроля за соблюдением режимов дезинфекции и стерилизации определены Приказом Міністерства охорони здоров’я України від 11.08.2014 № 552 «Про затвердження Державних санітар-них норм та правил «Дезінфекція, передстерелізаційне очищення та стерилізація медичних виробів в закладах охорони здоров’я», що вступає в силу із 01.09.2016 року.
В соответствии с этим приказом дезинфекцию изделий проводят с целью уничтожения патогенных и условно-патогенных микроорганизмов: вирусов (в том числе возбудителей парентеральных вирусных гепатитов, ВИЧ-инфекции), вегетативных бактерий (включая микобактерии туберкулеза), грибов. Дезинфекции подлежат все изделия после применения их у пациентов.
Дезинфекцию изделий осуществляют физическим или химическим методами. Выбор метода зависит от особенностей изделия и его назначения.
Физический метод дезинфекции наиболее надежен, экологически чист и безопасен для персонала. В тех случаях, когда позволяют условия (оборудование, номенклатура изделий и т. д.), при проведении дезинфекции изделий следует отдавать предпочтение данному методу.
Дезинфекцию с использованием физического метода выполняют:
· способом кипячения в дистиллированной воде или в воде с добавлением натрия двууглекислого (сода пищевая);
· паровым методом в паровом стерилизаторе (автоклаве);
· воздушным методом в воздушном стерилизаторе (сухожаровом шкафу).
Дезинфекции способом кипячения подвергают изделия из стекла, металлов, термостойких полимерных материалов. Перед кипячением изделия очищают от органических загрязнений (кровь, слизь и др.), промывая водопроводной водой и соблюдая при этом меры безопасности при работе с биологическим жидкостями. Отсчет времени дезинфекционной выдержки начинают с момента закипания воды.
Паровым методом дезинфицируют изделия из стекла, металлов, латекса, термостойких полимерных материалов. Предварительная очистка изделий не требуется. Их складывают в стерилизационные коробки и помещают в паровой стерилизатор. Дезинфекция осуществляется воздействием водяного насыщенного пара под избыточным давлением.
Воздушным методом дезинфицируют изделия из стекла, металлов, силиконовой резины, не загрязненные органическими веществами (ввиду их пригорания к поверхности изделий).
Химический метод дезинфекции является более распространенным и общепринятым методом обеззараживания изделий медицинского назначения в учреждениях здравоохранения. Для дезинфекции изделия погружают в раствор сразу после применения, не допуская их подсушивания. При видимом загрязнении изделий биологическими субстратами их предварительно промывают водопроводной водой или раствором дезсредства в специально выделенной емкости с соблюдением мер безопасности.
После дезинфекции изделия промывают водопроводной водой, высушивают и применяют по назначению, а при наличии показаний подвергают стерилизации с предварительной предстерилизационной очисткой.
Предстерилизационную очистку изделий медицинского назначения осуществляют после их дезинфекции и последующего отмывания остатков дезинфицирующих средств под проточной водой. Новые инструменты, не применявшиеся для работы с пациентами, должны также пройти предстерилизационную очистку с целью удаления промышленной смазки и механических загрязнений.
Для предстерилизационной очистки используют физические и химические средства, разрешенные к применению в Украине.
Растворы, содержащие перекись водорода и моющие средства (Лотос, Лотос-автомат, Астра, Прогресс), готовят в условиях учреждений здравоохранения, применяя перекись водорода медицинскую или техническую (марки А и Б). Для снижения коррозионного действия моющих растворов с перекисью водорода и моющим средством «Лотос» и «Лотос-автомат», целесообразно периодически использовать ингибитор коррозии – 0,14% раствор олеата натрия. Инструменты с видимыми пятнами коррозии, а также с наличием оксидной пленки можно подвергать химической очистке не более 2 раз в квартал.
После проведения предстерилизационной очистки изделия высушивают в сушильных шкафах до полного исчезновения влаги.
Стерилизацию изделий медицинского назначения проводят с целью умерщвления на них всех патогенных и непатогенных микроорганизмов, в том числе их споровых форм. Стерилизация проводится после дезинфекции и предстерилизационной очистки, является завершающим этапом обработки изделий медицинского назначения.
Стерилизацию осуществляют физическими и химическими методами. Выбор метода стерилизации зависит от особенностей стерилизуемых изделий.
Физические методы стерилизации:
Паровой метод – осуществляют в паровых стерилизаторах (автоклавах). Стерилизующим средством является водяной насыщенный пар под избыточным давлением 0,05 МПа, температурой 110–135°С. Паровым методом стерилизуют детали приборов и аппаратов из коррозионно стойких металлов, стекла, шприцы с пометкой 200°С, изделия из резины, латекса, отдельных видов пластмасс.
Воздушный метод – осуществляется в воздушных стерилизаторах, стерилизующим средством является сухой горячий воздух температурой 160°С и 180°С. Метод используется для стерилизации изделий из стекла, металла, силиконовой резины.
Химические методы стерилизации используют, когда особенности материалов, из которых изготовлены изделия, не позволяют использовать физические методы стерилизации (например, изготовлены из термолабильных материалов). Стерилизация изделий растворами химических средств является вспомогательным методом, поскольку не позволяет простерилизовать их в упаковке, а по окончании стерилизации необходимо промыть изделия стерильной жидкостью (питьевая вода, 0,9% раствор натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению (контаминации) простерилизованных изделий микроорганизмами. Для стерилизации изделий химическими методами используют средства, разрешенные к применению для данной цели Министерством здравоохранения Украины по режимам согласно инструктивно-методическим документам.
Для газового метода стерилизации используют смесь ОБ (смесь окиси этилена и бромистого метила в весовом соотношении 1:2,5 соответственно), окись этилена, пары раствора формальдегида в этиловом спирте.
Стерилизацию смесью ОБ и окисью этилена проводят при комнатной температуре (не менее 18°С), а парами раствора формальдегида в этиловом спирте – при температуре 80°С. Стерилизацию газовым методом осуществляют в стационарных газовых стерилизаторах, разрешенных к применению, а также в портативных аппаратах (микроанаэростаты объемом 2,0 дм3 и 2,7 дм3).
1.5.5. Противопожарная безопасность в КДЛ
Противопожарная безопасность в клинико-диагностической лаборатории включает мероприятия по предупреждению возникновения пожара, а также, в случае возгорания, комплекс мер, направленных на его ликвидацию.
Для предупреждения пожарноопасной ситуации необходимо:
1. Не производить работы с горючими веществами вблизи открытого огня (газовая горелка, открытый электрический нагреватель и пр.).
2. Отработанные горючие жидкости собирать в специальную герметично закрывающуюся тару и передавать для регенерации или уничтожения. Спуск их в канализацию воспрещается. Использованные кислоты и щелочи следует собирать порознь в специально предназначенную посуду.
3. Следить за исправностью электропроводки, контролировать заземление приборов.
4. Баллоны со сжатым газом не размещать в местах, освещаемых прямыми солнечными лучами, вблизи нагревательных или отопительных приборов, не позволять им соприкасаться с электрическими проводами. Расстояние от радиаторов и других отопительных приборов до баллонов должно быть не менее 1 м. Баллоны должны быть тщательно закреплены в вертикальном положении.
5. Наладить учет сильнодействующих, взрывоопасных и огнеопасных веществ и растворителей в лаборатории. Ответственность за хранение и организацию учета возлагается приказом по учреждению на заведующего лабораторией (при его отсутствии на лицо, выполняющее его функции).
6. Разместить в коридоре на видном, хорошо доступном месте пожарный щит с набором противопожарного инвентаря, установленный пожарный гидрант и огнетушитель. В помещениях, где производится работа с нагревательными приборами и взрывоопасными реактивами, установить огнетушитель. Следует помнить о том, что огнетушители подлежат периодической проверке, в случае необходимости – перезарядке, а с инструкцией по обращению с огнетушителями должны быть знакомы все работающие в лаборатории.
При возникновении пожара в лаборатории требуется:
· немедленно сообщить о пожаре в пожарную аварийно-спасательную службу по телефону 101 (при этом четко назвать адрес, место пожара, свою должность и фамилию, а также сообщить о наличии в здании людей);
· задействовать систему оповещения о пожаре;
· приступить к тушению пожара имеющимися первичными средствами пожаротушения, эвакуации людей и материальных ценностей;
· организовать встречу подразделений пожарной аварийно-спасательной службы;
· принять меры по вызову к месту пожара руководителя учреждения или замещающего должностного лица.
Самостоятельные меры для ликвидации возгорания предусматривают:
· немедленно выключить ток при загорании электрических проводов. При этом следует помнить, что тушить загоревшиеся провода можно только сухим песком;
· при возгорании одежды набросить на пострадавшего плотное одеяло или пальто;
· по-возможности, не давать пламени приближаться к местам, где хранятся легковоспламеняющиеся вещества;
· воспользоваться огнетушителем.
1.5.6. Правила безопасной работы с едкими веществами (кислоты, щелочи)
При работе с концентрированными кислотами и щелочами соблюдают следующие меры предосторожности:
· всю работу проводят в вытяжном шкафу, во время работы надевают очки, резиновые перчатки, нарукавники и резиновый фартук;
· при приготовлении разведенных растворов кислот вначале в сосуд наливают необходимое количество воды, а затем понемногу приливают кислоту;
· при приготовлении растворов щелочей определенную навеску щелочи опускают в большой сосуд с широким горлом, заливают необходимым количеством воды и тщательно перемешивают;
· большие количества кислот и щелочей хранят в специальных складских помещениях, оборудованных вентиляцией, и имеющих достаточные количества нейтрализующих веществ (содовые и известковые растворы) для «погашения» пролитых кислот;
· емкости с горючими и взрывоопасными жидкостями должны храниться в специальных ящиках. Место, где находится ящик, должно быть удалено от выделяющих тепло поверхностей и проходов;
· хранение легковоспламеняющихся огне- и взрывоопасных веществ с кислотами и щелочами запрещается, так как при смешивании паров возможно образование самовоспламеняющихся, взрывоопасных, ядовитых продуктов;
· бутыли с кислотами, щелочами и др. едкими веществами переносят вдвоем в специальных ящиках или корзинах или перевозят на специальной тележке. На каждую банку, склянку или другой сосуд, в который помещается реактив, нужно немедленно наклеить этикетку, написав на ней название вещества и его концентрацию;
· концентрированные растворы кислот должны храниться в специальных бутылях (склянках) с притертой пробкой, поверх которых необходимо надевать стеклянный притертый колпачок;
· щелочи следует хранить в широкогорлых банках оранжевого стекла, закрытых корковыми или полиэтиленовыми пробками и залитых слоем парафина (закупоривать стеклянными пробками нельзя, так как в результате отложения карбонатов пробку заклинивает);
· биксы, банки, бутыли с летучими веществами необходимо открывать только в момент непосредственного пользования ими.
1.5.7. Первая помощь пострадавшим в лаборатории
Неотложная помощь при термических ожогах:
· Быстрое прекращение действия термического агента.
· Охлаждение обожженного участка (20 – 30 минут под проточной холодной водой, пузырями со льдом, снегом). Обезболивание.
· Обильное питье (теплый чай, минеральная вода, соляные растворы).
· На раневые поверхности накладывают сухие асептические повязки. Пузыри не прокалывать, не вскрывать! На лицо повязки не накладывают!
Доврачебная помощь при химических ожогах:
· Ожоговую поверхность обливают холодной водой в течение 1 часа.
· Ожоги негашеной известью водой не промывают, а обрабатывают поверхность растительным или вазелиновым маслом.
· Обезболивание. На рану накладывают сухие асептические повязки.
Доврачебная помощь при электротравмах:
· успокоить пострадавшего и дать седативные средства (настойка валерианы, пустырника и др.);
· наложить сухую асептическую повязку на местные повреждения;
· обязательная 100% госпитализация! Даже при легкой электротравме могут наблюдаться нарушения ритма в работе сердца спустя несколько часов после поражения, что может привести к остановке сердца.
Доврачебная помощь при тяжелой электротравме:
· Освободить пострадавшего от контакта с источником тока, соблюдая при этом правила собственной безопасности (выключение рубильника, выключателя, отбрасывание электрических проводов с помощью деревянной палки, веревки и т. д.).
· При отсутствии дыхания и сердечной деятельности немедленно начать сердечно-легочную реанимацию (искусственное дыхание и непрямой массаж сердца).
· Срочная госпитализация.
|
Часть 2 |
Техническое обеспечение КЛИНИЧЕСКИХ ЛАБОРАТОРНЫХ исследований |
2.1. Лабораторная посуда и инструментарий
Лабораторная посуда представляет собой емкости различного объема и формы, используемые для сбора биоматериалов и других манипуляций, связанных с проведением анализа. Лабораторная посуда может быть многоразового и одноразового использования. Многоразовая посуда чаще всего изготавливается из стекла. Основным недостатком ее является необходимость специальной подготовки к работе (очистка, мытье, сушка и т.д.).
Одноразовая посуда очень удобна в эксплуатации, так как не нуждается в мытье. Она чаще всего изготавливается из пластмассы. Использование одноразовой посуды позволяет без значительных затрат времени персонала соблюдать все правила санитарно-противоэпидемического режима и, ввиду невысокой стоимости пластиковой посуды отечественного производства, делает ее использование экономически выгодным. К тому же использование пластиковой посуды позволяет предотвратить аварии в центрифугах, связанные с раздавливанием стеклянных пробирок, что снимает необходимость проведения дополнительных мероприятий по обеззараживанию и очистке центрифуги.
В соответствии с функциональным назначением лабораторную посуду принято делить следующим образом:
1. посуда общего назначения;
2. мерная посуда;
3. посуда специального назначения.
Посуда общего назначения. Пробирки различаются по размерам и предназначению (химические, градуированные, центрифужные, с притертой пробкой и др.). Выбор пробирок для работы определяется целью манипуляции и объемом реакционной смеси. При работе с пробирками следует помнить, что необходимо заполнение их не более 2/3 от объема. В противном случае возможно проливание содержимого при перемешивании или центрифугировании. Нельзя перемешивать содержимое пробирки, закрывая ее отверстие пальцем. Перемешивание выполняется встряхиванием пробирки, либо стеклянной палочкой.
Воронки служат для переливания и фильтрования жидкостей. Выпускаются различных размеров и формы (обычные, аналитические, делительные и.т.д.).
Химические стаканы – тонкостенные, различной вместимости, изготавливаются из химически стойкого стекла. Химические стаканы можно нагревать, но не на открытом пламени (например, на водяной бане).
Колбы. Очень разнообразны по формам и размерам (круглодонные, плоскодонные, конические и т. д.). Они могут быть изготовлены и обычного стекла, а также из специального термостойкого или термоcтойкого химически стойкого стекла (маркировка соответственно ТС и ТХС).
Мерная посуда. Применяется для измерения объема жидкости. На наружной стенке мерной посуды нанесены деления, указывающие объем в миллилитрах. Выпускается грубо калиброванная посуда (мерные пробирки, стаканы, мензурки, цилиндры) и посуда для точного отмеривания жидкостей (пипетки, мерные колбы).
Стеклянные градуированные пипетки все еще применяются в КДЛ. Они бывают емкостью от 0,1 мл до 10 мл. Имеют деления по всей рабочей длине, что позволяет отмеривать не только конечные, но и любые промежуточные объемы жидкости. В зависимости от способа нанесения градуировки различают пипетки концевые и неконцевые. В концевых пипетках вся рабочая емкость вместе с оттянутым носиком отградуирована и рассчитана на измеряемые объемы жидкости. В неконцевых пипетках оттянутый носик и прилегающая к нему часть не градуированы и представляют собой «мертвый объем», не входящий в объем измеряемой жидкости.
Наиболее точными из всех видов мерной посуды являются мерные колбы. Они представляют собой обычно круглую плоскодонную колбу с длинным узким горлом, на котором нанесена кольцевая метка, ограничивающая точно измеренный объем. Выпускаются мерные колбы емкостью от 25 до 2000 мл. Их нельзя нагревать, так как это приводит к деформациям стекла и изменению первоначального объема. Не рекомендуется также в мерных колбах долго хранить приготовленные растворы.
При работе с любой мерной посудой важно уметь правильно выполнять сам процесс отсчета измеряемого объема жидкости. Если работа ведется с водными растворами (смачивают стекло и образуют вогнутый мениск), отсчет ведут по нижнему уровню мениска. Жидкости, не смачивающие стекло, образуют выпуклый мениск, и отсчет производится по верхнему уровню мениска. В клинических лабораториях часто приходится измерять объемы окрашенных непрозрачных жидкостей, смачивающих стекло (кровь, молоко и др.), когда нижний уровень мениска не виден. Для таких жидкостей отсчет ведут по верхней кромке мениска. Во всех случаях сосуд с измеряемой жидкостью следует располагать так, чтобы мениск жидкости находился на уровне глаз.
Посуда специального назначения бывает различных типов. Среди наиболее часто используемых в клинико-диагностических лабораториях следует назвать чашки Петри, пастеровские пипетки, капельницы, эксикаторы и пр.
Эксикатор служит для предохранения от увлажнения гигроскопичных веществ. Представляет собой толстостенный двухкамерный сосуд с притертой крышкой. В нижнюю камеру помещают какое-либо вещество, поглощающее влагу (концентрированная серная кислота, прокаленный хлорид кальция, силикагель). Дном верхней камеры служит фарфоровая пластина с отверстиями. На ней размещают сосуды с препаратами. Притертые поверхности крышки и эксикатора смазывают вазелином. При закрывании крышки ее слегка поворачивают для лучшего притирания. Иногда в лабораториях используют эксикаторы с противоположной целью – для создания влажной камеры. В этом случае на дно нижней камеры наливают воду, а на фарфоровую пластину помещают препараты, которые следует предохранить от высыхания (например, агаровые гели).
Правила ухода за лабораторной посудой
Чистота посуды в значительной степени влияет на качество проводимых исследований. Вся посуда, контактировавшая с биологическим материалом, подвергается очистке от остатков материала и дезинфицируется в соответствии с действующими правилами санитарно-противоэпидемического режима. Значительные механические загрязнения удаляются разнообразными ершами, которые также затем обеззараживаются.
Обычно хорошая очистка достигается уже после замачивания посуды в моющем комплексном растворе. Затем посуда промывается проточной водой и ополаскивается дистиллированной водой. С хорошо вымытой посуды вода стекает струйками, не задерживаясь в виде капель. После сушки она абсолютно прозрачная и не имеет подтеков. Высушивают посуду в сухожаровых шкафах. Можно сушить и на любых приспособлениях, где обеспечивается свободный отток воды с посуды.
Для некоторых исследований предъявляются очень высокие требования к чистоте посуды. Тогда используют более эффективные химические методы очистки. Из них наиболее распространенным является мытье хромовой смесью.
Хромовую смесь готовят следующим образом: растворяют 25 г двухромовокислого калия (К2Сr2О7) в 150 мл концентрированной технической серной кислоты. Полученную смесь интенсивно взбалтывают и перед употреблением выдерживают сутки. Хранят хромовую смесь в сосуде из темного стекла. При стоянии смесь расслаивается на жидкую часть и осадок. Полного растворения бихромата калия не происходит. Правильно приготовленная смесь имеет темно-оранжевую окраску. В случае непригодности цвет изменяется на темно-зеленый. Посуду, подлежащую очистке, выдерживают в хромовой смеси не менее 2 часов, но обычно замачивают на ночь. Посуда должна быть полностью погружена в смесь. Очищенную посуду тщательно промывают проточной водой и дистиллятом. Работать с хромовой смесью следует в резиновых перчатках, прорезиненном фартуке и в защитных очках. Смесь, попадая на кожу или слизистые оболочки, может вызвать сильные ожоги. Не применяют хромовую смесь, если посуда загрязнена парафином, минеральными маслами. Необходимо избегать попадания в хромовую смесь спиртов, которые приводят ее в негодность.
Можно для очистки посуды использовать хромовый раствор. Готовят его по следующей прописи: растворяют 20 г бихромата калия в 100 мл концентрированной азотной кислоты. В данном случае осадок бихромата не выпадает, так как образуется истинный раствор. Такой раствор по моющим свойствам превосходит хромовую смесь.
Каждый способ мытья посуды имеет свои преимущества и недостатки. Мытье хромпиком обеспечивает высокую степень чистоты. Кроме того, мытье хромпиком с последующим высушиванием в горячем сушильном шкафу значительно уменьшает микробную обсемененность посуды и способствует лучшей сохранности реактивов. В то же время данный метод достаточно трудоемок и требует соблюдения определенных мер предосторожности. С моющими средствами работать значительно удобнее, но они часто адсорбируются на стекле, что требует дополнительного многократного промывания водой. Поэтому для каждого вида анализов подбирается адекватный, не слишком трудоемкий, но достаточно надежный метод мытья посуды.
Сушка посуды осуществляется в специальных сушильных шкафах. В ряде случаев лабораторная посуда нуждается в стерилизации. Наиболее широко используется стерилизация автоклавированием при 1200С, давление 1 атм. Некоторые из видов пластмасс (например, полипропиленовая посуда) также выдерживают эти режимы обработки. При планировании работы в лаборатории следует предусмотреть возможности стерилизации пластмассовой посуды.
2.2. Средства пробоподготовки в лаборатории. Дозирующие устройства
Отмеривание растворов является одной из наиболее часто выполняемых лабораторных процедур. При этом от точности дозирования существенно зависят результаты исследования. В современных лабораториях для отмеривания растворов широко применяют разнообразные дозирующие устройства – дозаторы (пипетки), дилютеры и диспенсеры. Дилютеры – дозирующие устройства с одновременным разбавлением дозируемых жидкостей. Диспенсеры – устройства, обеспечивающие многократную выдачу доз при однократном взятии дозируемого раствора. Дозирующие устройства можно подразделить на несколько групп.
1. По способу забора и выдачи доз их подразделяют на пипеточные, клапанные и перистальтические дозаторы.
Пипеточные – это бесклапанные дозаторы, где забор и выдача пробы осуществляются через один и тот же наконечник дозатора. Забор дозирующей жидкости осуществляется в съемную насадку – наконечник, что обеспечивает высокую чистоту при выполнении операции дозирования, практически исключает загрязнение последующей пробы предыдущей. Перемещение дозируемой жидкости в насадке осуществляется путем передачи через воздушный тракт разрежения или давления воздуха, создаваемого в поршневой или плунжерной паре пипетки. Многие пипеточные дозаторы имеют устройства для сброса наконечников. Для повышения точности дозирования в конструкции корпуса некоторых пипеток предусмотрены теплоизолирующие кожухи, уменьшающие влияние температуры руки оператора на воздушный тракт дозатора.
Пипеточные дозаторы нашли самое массовое применение в лабораторной практике. Они наиболее часто используются в следующих режимах: прямое дозирование, обратное дозирование, многократное дозирование (см. пипеточный диспенсер) и режим разведения (см. пипеточный дилютер).
Прямое дозирование – наиболее распространенный режим дозирования, при котором весь забранный объем жидкости сбрасывается за один полный ход поршня. Этот режим в большей степени подходит для дозирования водных растворов.
Обратное дозирование – используется для дозирования очень малых объемов, а также при работе с вязкими и пенящимися жидкостями. При этом в наконечник набирается несколько больший, по сравнению с дозируемым, объем жидкости. Остающийся в наконечнике некоторый объем жидкости нивелирует погрешность, связанную с образованием пены или мениска.
Клапанный дозатор имеет входной канал, куда поступает дозируемая жидкость, и выходной канал, через который выдается доза.
Перистальтические дозаторы чаще всего применяются в качестве дозатора-насоса подачи проб и реагентов в проточных анализаторах, как составная часть последних.
2. По способу установки дозы дозирующие устройства подразделяют на дозаторы с фиксированным объемом дозы и дозаторы с регулируемыми переменными объемами дозы.
3. По количеству каналов дозирования дозаторы разделяются на одноканальные и многоканальные. Одноканальные дозаторы не привязаны к форме носителя проб и реакционной смеси, в связи с чем они универсальны. Многоканальные дозаторы ориентированы на специальные носители, так как имеют фиксированное количество каналов с определенным расстоянием между наконечниками. Они наиболее удобны при работе с микропланшетами и стрипами.
4. По способу управления дозирующие устройства можно разделить на дозаторы с ручным приводом, автоматическим приводом и автоматическим приводом с микропроцессорным управлением – электронные дозаторы, среди которых наибольшее распространение получили электронные пипетки.
Следует помнить, что дозаторы относятся к измерительным устройствам и, следовательно, должны подлежать метрологической проверке.
2.3. Центрифугирование
Центрифугирование позволяет произвести разделение жидкого и твердого вещества, либо различных частиц по их поведению в центробежном поле. Разделение обусловлено тем, что частицы, имеющие разную плотность, форму или размеры, осаждаются с разной скоростью.
В клинических лабораториях центрифугирование применяется очень широко для подготовки биоматериалов к исследованию, а также на различных этапах аналитической процедуры.
Условия воздействия на разделяемые компоненты часто выражают как скорость вращения центрифуги (об/мин). Однако более правильным является учет силы, воздействующей на биоматериал, находящийся в центрифуге (так называемой относительной силы центрифугирования). Ее выражают в величине ускорения силы тяжести (g) и рассчитывают по формуле:
g = 1,118 х10-5 х r х n2,
где 1,118 х10-5 – коэффициент для расчета,
r – расстояние от центра ротора до дна сосуда, установленного в центрифугу;
n – скорость вращения ротора (об/мин)
Для упрощения работы можно пользоваться специальными номограммами (рисунок 2.1).
 |
Рис. 2.1 – Номограмма для расчета центробежного ускорения
Для определения g соединяют прямой линией значения радиуса и скорости вращения ротора на крайних шкалах (А и С). Точка пересечения этой прямой со средней шкалой дает искомую величину центробежного ускорения.
В клинико-диагностических лабораториях наиболее широко используются центрифуги с угловым ротором с максимальной скоростью вращения до 10000 об/мин (типа ОПн-8) и центрифуги с так называемым «лепестковым» ротором со скоростью вращения до 3000 об/мин. В центрифугах с «лепестковыми» роторами (горизонтального типа) расстояние r обычно больше, чем в центрифугах с угловым ротором, так как пробирки в такой центрифуге при центрифугировании принимают горизонтальное положение.
Время центрифугирования для полного отделения частиц от жидкой фазы и необходимая величина g зависит от высоты столбика жидкости в пробирке, размера отделяемых частиц и ряда других условий.
Для безопасного и качественного центрифугирования необходимо соблюдение ряда условий. Наполненные жидкостью центрифужные пробирки должны быть попарно уравновешены. Уравновешивание их производится на специальных весах. Уравновешенные пробирки располагают в противоположно расположенных гнездах центрифуги. Затем центрифугу закрывают предохранительной крышкой и включают. После выключения необходимо дать центрифуге остановиться самой, и только после этого вынуть пробирки. Центрифуга должна располагаться на ровной поверхности. При появлении сильной вибрации при включении центрифуги ее необходимо тут же отключить от сети.
При работе с термолабильными ингредиентами может потребоваться центрифугирование при низкой температуре. Для этого применяют центрифуги с охлаждением (так называемые «рефрижераторные»). Системой охлаждения обычно снабжают и центрифуги с высокой скоростью вращения (25000 об/мин и более) для предотвращения нагревания, возникающего вследствие трения при вращении ротора.
Центрифуги специального назначения имеют различные конструктивные варианты исполнения под те или иные специальные задачи или виды исследований. К таким центрифугам относятся центрифуги с нагревательной рубашкой, микроцентрифуги, центрифуги со специальными роторами для стрипов и другие.
2.4. Перемешивающие и термостатирующие устройства
Выполнение ряда исследований в клинической лабораторной диагностике предполагает использование перемешивающих и термостатирующих устройств, имеющих различное конструктивное исполнение в виде как самостоятельных приборов, так и объединенных в единую конструкцию. Кроме этого, термостатирующие и перемешивающие устройства могут входить в качестве блоков в общую структуру автоматических анализаторов.
Термостаты по принципу передачи тепловой энергии подразделяются на жидкостные, суховоздушные, сухие. В жидкостных термостатах передача тепловой энергии от источника тепла к объекту термостатирования происходит через жидкую среду. В суховоздушных термостатах тепловая энергия передается за счет циркулирующего потока воздуха. Выбор способа термостатирования и конкретной конструкции термостата во многом определяется назначением, емкостью и формой термостатируемого объекта.
Диапазон температур обычно лежит в пределах 20 – 70°С, причем может регулироваться достаточно плавно, или диапазон может быть представлен несколькими фиксированными значениями. Чаще всего среди фиксированных значений применяются температуры 25, 30 и 37°С. Температуру в камере термостата контролируют термометрами, при этом прочно их укрепляя.
Часто термостаты имеют единую конструкцию с перемешивающими устройствами.
Перемешивающие устройства предназначены для перемешивания реакционной смеси с целью ускорения проведения реакции и улучшения воспроизводимости результатов исследования. Перемешивание не должно вызывать появления пены и пузырей, которые могут повлиять на результаты измерения. В автоматических анализаторах перемешивание может осуществляться непосредственно струёй впрыскиваемого в кювету автоматическим дозатором реагента. Вибротермостат предназначен для подготовки проб и проведения реакций с использованием планшетов для иммунологических реакций. Вибротермостат позволяет осуществлять одновременное или раздельное перемешивание и термостатирование образцов в широком диапазоне частот и температур.
Шейкеры применяются для создания вращательного движения жидкости в лабораторной посуде различного вида: планшеты, пробирки, колбы. Платформа совершает орбитальное движение в горизонтальной плоскости.
Встряхиватель применяется для перемешивания компонентов в любых пробирках. Гнездо прибора совершает орбитальное вращение с амплитудой 2 мм и частотой, регулируемой от 300 до 1800 об/мин.
Магнитомешалка (магнитный смеситель) позволяет производить перемешивание жидкостей, помещенных в различные емкости из неферромагнитных материалов. Перемешивание жидкости происходит с помощью помещенного в посуде с жидкостью миксера (якоря) в покрытии из тарнамида либо тарфлена, приводимого во вращение с помощью магнитного поля. Электрический двигатель с магнитом помещен в корпусе смесителя. Магнитные смесители могут иметь дополнительный нагревающий вкладыш, что позволяет при необходимости поддерживать повышенную температуру перемешиваемой жидкости.
2.5. Весоизмерительная техника
Взвешивание является неотъемлемой частью работы в лаборатории. Взвешивание – это процедура сравнения массы взвешиваемого тела с заранее известной массой гирь, осуществляемая с помощью весов. В зависимости от точности весы подразделяются на весы грубого взвешивания (точность до граммов), точного взвешивания (точность от 1 до 10 мг) и аналитические.
В клинических лабораториях для точного взвешивания наиболее широко используются аптечные и торсионные весы. Весы оснащаются набором гирек (их называют разновесами), на каждой из которых обозначена ее номинальная масса. В комплект входят граммовые и миллиграммовые гири. Для удобства распознавания их делают разной формы. Каждая миллиграммовая гирька имеет загнутый край, за который ее берут пинцетом.
Аптечные (ручные) весы имеют предельную нагрузку до 100 г. Весы обычно устанавливают на штативе, и осуществляют взвешивание только после контроля правильности установки.
Торсионные весы предназначены для взвешивания грузов до 500 мг.
Аналитические весы обеспечивают наиболее высокую точность взвешивания. Они всегда заключены в футляр, обычно застекленный, с поднимающейся передней стенкой и открывающимися боковыми дверцами. Аналитические весы требуется размещать в специальной весовой комнате, предохраняя от резких потоков воздуха и вибрации, попадания прямого солнечного света, вдали от отопительных приборов. Аналитические весы лучше всего устанавливать на специальных подставках, укрепленных на кронштейнах в капитальной стене. В виде исключения аналитические весы могут быть расположены на массивных утяжеленных столах. В любом случае непременно должна быть исключена вероятность сотрясений весов. Перед каждыми весами необходимо иметь осветители. В нерабочее время все дверцы весов должны быть закрыты.
Аналитические весы дают возможность взвешивать с точностью до 0,0001 или 0,0002 г. Для взвешивания на аналитических весах применяют так называемый аналитический разновес, то есть набор очень точных гирь, собранных в особом футляре с крышкой. В каждом футляре имеется пинцет с роговыми, костяными или пластмассовыми наконечниками. Применение стального пинцета может поцарапать миллиграммовый разновес и этим изменить его массу. Все гири берут только пинцетом.
Важнейшими качествами аналитических весов являются их чувствительность и устойчивость (то есть постоянство показания). Особенности процедуры взвешивания зависят от типа аналитических весов.
2.6. Лабораторные реагенты
Реактивы для проведения лабораторных исследований должны обладать достаточной степенью химической чистоты.
Степень чистоты реактивов квалифицируется следующим образом:
· чистый (ч) – содержание примесей не превышает 0,1%;
· чистый для анализа (чда) – содержание примесей не превышает 0,07%.;
· химически чистый (хч) – содержит примесей не более 0,03%.;
· особо чистый (осч) – минимальное содержание отдельных примесей (менее 0,00001%).
При квалификации импортных реактивов наиболее часто встречаются следующие обозначения:
· analitical grade, pro anal. – препараты высокой степени чистоты, используются для аналитических работ;
· research grade, reinst. – лабораторные реагенты высокого качества для исследовательских и рутинных целей, а также коммерческие препараты, отвечающие фармакопейным требованиям;
· pure, rein — очищенные коммерческие препараты с содержанием основного вещества около 95%, широко используемые в лабораториях;
· puriss. — реагенты с содержанием основного вещества около 99%, предназначенные для проведения точных работ;
· pract. — коммерческие препараты с содержанием основного вещества в пределах 90–95%, предназначенные, в основном, для синтеза;
· tech. – технические реагенты.
Квалификация реактива указывается на заводской этикетке, вместе с его названием, химической формулой и массой. Там же указывают условия хранения, соблюдение которых обеспечивает неизменность качества реагентов в течение декларированного срока. Стабильность реагентов зависит от природы веществ, чистоты и условий хранения. Устойчивость твердых веществ в целом значительно больше, чем их растворов.
Правила работы с реактивами
1. Емкости с реактивами, утратившие этикетки с указанием состава их содержимого, из работы изымаются. Это же относится к реактивам с истекшим сроком годности.
2. Перед взвешиванием реактивы, хранившиеся в холодильнике, должны быть выдержаны при комнатной температуре не менее 20 минут.
3. Реактивы нужно беречь от загрязнения. Для повседневной работы реактив следует отсыпать из заводской тары в более мелкую посуду и снабдить этикеткой. Если для проведения исследований взято слишком большое количество реактива, его не разрешается ссыпать или сливать обратно, а следует перенести в другую чистую посуду, сделать на ней надпись и использовать в дальнейшем.
4. Нельзя путать пробки от разных реактивов, а также хранить реактивы без пробок или крышек.
5. Нельзя брать реактивы руками. Порошкообразные реактивы берут специальными ложечками, жидкие реактивы – пипетками.
6. Для ускорения растворения твердого вещества можно предварительно измельчить его в фарфоровой ступке. Растворимость вещества в растворе можно повысить, нагревая емкость с раствором на водяной бане. При этом надо соблюдать осторожность, чтобы не вызвать разложение вещества.
7. При необходимости растворения кислоты в воде следует соблюдать особые предосторожности. Всегда надо наливать кислоту в воду, а не наоборот, так как при растворении, например, серной кислоты выделяется много тепла, и вода, если она попадает на кислоту сверху, может вскипеть и разбрызгать опасные капли серной кислоты.
8. Если нужно понюхать реактив, то его нельзя непосредственно подносить к носу, так как многие реактивы имеют очень резкий запах и весьма ядовиты. Нужно нюхать, направляя к себе ладонью струю выделяющегося газа, чтобы дошла лишь незначительная часть газа, а запах хорошо бы чувствовался. Это позволяет предотвратить химический ожог слизистых носа и глаз.
9. Пробовать реактивы на вкус категорически запрещается. Все реактивы за небольшим исключением в той или иной степени ядовиты.
1. Реактивы должны содержаться в хорошо закрывающейся таре, как правило, в стеклянной. Исключение составляет плавиковая кислота и ее соли, которые разрушают стекло. Их хранят в полиэтиленовых сосудах. Укупоривать емкости лучше всего навинчивающимися пластиковыми крышками, можно пробками корковыми либо резиновыми. Следует иметь в виду, что резиновые пробки разрушаются галогенами и концентрированными кислотами, поэтому непригодны для сосудов, содержащих йод, бром и другие едкие вещества. Такие сосуды закрывают притертыми стеклянными пробками. Наоборот, для хранения растворов щелочей непригодны стеклянные пробки, лучше подходят резиновые. Иногда, если реактив гигроскопичен, или его дано очень точное количество, которое может измениться при хранении с пробкой, или он легко испаряется, его невозможно сохранить, пользуясь пробкой. В таком случае реактив хранят в ампулах. В них реактив можно хранить очень долгое время.
2. Необходимо соблюдать температуру хранения, указанную на этикетке. Если температура хранения реактивов не оговаривается, то они хранятся при комнатной температуре в шкафах, специально для этого предназначенных. Емкости с реактивами обычно расставляют в шкафах в определенном порядке: по классам соединений (соли, кислоты, основания), в алфавитном порядке и.т.д. Хранящиеся в шкафах реактивы регистрируют в специальном журнале или в памяти компьютера, отмечая номер шкафа, отсека и полки, где хранится данный реактив. Это значительно облегчает поиск нужного реактива.
3. Реактивы, чувствительные к действию света (перекись водорода, гипосульфит и др.) хранят в склянках из оранжевого стекла или обертывают темной бумагой.
4. Яды и легко воспламеняющиеся реактивы требуют особых условий хранения. Яды содержат в сейфе, ключ от которого находится у ответственного лица. Должен быть налажен строгий учет расходования ядов. Они выдаются по весу под расписку, в которой указано, для каких целей и сколько требуется вещества.
Огнеопасные вещества размещают в местах, удаленных от открытого пламени и мест возможного искрения электроприборов. Следят за тем, чтобы они были очень хорошо закупорены. На рабочих местах легко воспламеняющиеся реактивы должны быть в количествах, не превышающих дневную норму. Большие количества легко воспламеняющихся реактивов хранятся вне помещения лаборатории – в кладовых, подвалах с соблюдением всех мер предосторожности.
5. В лаборатории должен быть налажен учет движения реактивов. Обычно, это учет по каталожному принципу. На каждый реактив заводится карточка, где указывается дата и количество поступления, дата и количество расходования, выводится остаток на текущий момент. При наличии в лаборатории компьютера эти данные вводятся в память компьютера. Хорошо налаженная форма учета позволяет иметь четкую информацию о наличии реактивов, своевременно их пополнять и составлять отчет о расходовании реактивов.
Приготовление реактивов для проведения анализа проводится либо непосредственно на одном из участков клинико-диагностической лаборатории, либо (в крупных лабораториях) осуществляется централизованно. Для централизованного приготовления реактивов из штата сотрудников лаборатории выделяется должность химика-аналитика. Оборудуется химико-аналитический кабинет, в котором должны быть химические столы, сейф для хранения ядовитых веществ, вытяжной шкаф, весоизмерительная техника, рН-метры, центрифуги, стеклянная мерная и другая посуда. Там же концентрируется вся документация по учету движения реактивов. Такая форма работы обеспечивает качественный уровень приготовления реактивов, эффективное использование реактивов и повышает производительность труда в целом лабораторных работников.
Правила оформления этикеток на реактивах
На каждом реактиве, поступающем в лабораторию, должна быть этикетка со следующими обозначениями:
1. Название вещества и его химическая формула. В тех случаях, когда молекулярная химическая формула слишком сложна или не дает быстрого и полного представления о характере вещества (например, в органических веществах), вместо формулы пишут наиболее распространенное название вещества.
2. Вес реактива.
3. Номер ГОСТ (за исключением импортных реактивов).
4. Квалификация реактива.
5. Номер партии.
6. Дата изготовления.
7. Срок годности.
В лаборатории реактивы по мере надобности расфасовывают в более мелкую посуду, с которой удобнее обращаться. В этом случае на каждую емкость наклеивают свою этикетку аналогичного содержания.
Готовые аналитические формы реактивов
Современные лаборатории для повседневной работы в большинстве случаев используют готовые наборы реактивов. Набор реактивов – это два или более лабораторных материалов, упакованных вместе, предназначенных для выполнения определенной процедуры и снабженные инструкцией.
Использование готовых наборов позволяет сократить расход реактивов, время анализа, а также гарантирует более высокое качество исследования. Они широко используются для работы на биохимических автоанализаторах, определения гормонов, опухолевых маркеров и т. п.
Набор реактивов сопровождается подробной инструкцией, в которой указывается следующая информация:
1. Наименование и назначение.
2. Принцип реакции со ссылкой на литературный источник.
3. Указания по технике безопасности при работе с набором (если необходимо).
4. Стабильность. Если возможно, приводятся физические, биологические или химические признаки нестабильности и порчи реактивов.
5. Для каждого компонента набора указываются наименование и количество (концентрация или активность). Приводится информация о любых добавках, не участвующих в реакции (например, буфер, консервант, стабилизатор), которые могут повлиять на тест. Дается описание процедуры растворения и смешивания.
6. Оборудование. Описание любых специальных требований к оборудованию, чтобы пользователь мог сделать соответствующий выбор.
7. Способ отбора исследуемого образца, подготовка пациента, рекомендуемые добавки (антикоагулянты, консерванты), рекомендации по хранению, транспортировке образца, интерферирующие вещества.
8. Детальное описание процедуры выполнения теста.
9. Преимущества, ограничения применения набора, его аналитические характеристики (воспроизводимость, правильность (в сравнение с референтным методом, если возможно), специфичность, линейность, чувствительность).
10. Нормальные значения определяемого параметра.
11. Наименование и адрес изготовителя.
При выборе набора реактивов следует в первую очередь учесть принцип метода, положенный в основу работы набора, и его надежность. Если критерии аналитической надежности подтверждены, необходимо оценить практичность набора, особенно с точки зрения экономии времени анализа и сокращения числа этапов исследования. Здесь прежде всего учитывают число определений, на которое рассчитан набор; срок хранения рабочих реагентов, необходимость предварительной подготовки образца, зависимость от типа оборудования и возможности автоматизации.
Следует помнить, что наборы реактивов, предназначенные для ручного выполнения, могут быть адаптированы к открытым автоматизированным системам, чаще всего путем пропорционального уменьшения объемов пробы и реактивов.
Для закрытых аналитических систем, представляющих собой комбинацию прибора и реагентов, выпускаются специальные наборы реактивов, и другие реактивы не могут использоваться в таких системах.
2.7. Правила приготовления растворов
В лабораторной диагностике применяются в основном растворы реагентов, приготовленные на дистиллированной воде. Для получения дистиллированной воды используют специальные приборы – аквадистилляторы. В ряде случаев (если требует методика) используют бидистиллированную воду, то есть перегнанную дважды, а также деионизированную воду. Для получения воды с заданными свойствами удобно использование специальных коммерческих систем.
Для некоторых анализов требуется вода, не содержащая СО2 (в частности, для рН-метрии). В этом случае бидистиллят кипятят в течение 5 – 10 мин, охлаждают без доступа воздуха и используют в течение нескольких часов.
Приготовление раствора включает взвешивание необходимого количества реактива с последующим растворением в растворителе (чаще в воде). Количество растворителя отмеривается с помощью специальной мерной посуды – цилиндров, мерных колб, а при малых количествах – автоматическими пипетками. Количественный состав раствора определяется его концентрацией. Концентрацию можно выразить как количество или массу (вес) вещества, содержащееся в определенном объеме жидкости. В клинико-диагностических лабораториях наиболее широко используют «процентные» и «молярные» растворы. Процентным принято называть раствор, в 100мл которого содержится определенное количество грамм вещества. Например, 5% раствор хлористого натрия подразумевает, что в 100 мл раствора содержится 5 г NaCl.
Если раствор приготавливают из вещества с известной молекулярной массой, то для расчета концентрации используют единицу количества вещества (моль). Такие растворы называют «молярные» (молярность – число молей растворенного вещества, содержащихся в 1 л раствора).
В ряде случаев возникает потребность в получении приблизительных растворов путем разбавления более концентрированных. Для этого удобно пользоваться способом, именуемым «правилом креста»
Например, если требуется получить 5% раствор хлористого натрия из более концентрированного (20%) составляют первую запись:
![]()
где 20 – показатель концентрации взятого раствора, 0 – вода, 5 – требуемая концентрация. Из 20 вычитают 5 и полученное значение записывают в правом нижнем углу. Разность между 0 и 5 записывают в правом верхнем углу. После этого схема принимает следующий вид:
![]()
Это означает, что для получения 5% раствора необходимо 5 частей 20% раствора смешать с 15 частями воды (например, 5 мл и 15 мл, 5 л и 15 л и т.д.).
Если требуется приготовить раствор промежуточной концентрации из двух исходных растворов, то в вышеприведенной схеме вместо нуля (левый нижний угол) ставится концентрация второго раствора. Например, надо приготовить 20% раствор из 35% и 10%. В этом случае схема будет иметь вид:
![]()
Это означает, что для приготовления 20% раствора требуется взять 10 частей 35% раствора и 15 частей 10% раствора.
В случае, когда расходные материалы для исследований готовятся на основании двух растворов реактивов, обычно указывают какое количество частей одного раствора (А) необходимо смешать с определенным количеством частей другого раствора (В). Такой подход, в частности, используют при приготовлении буферных растворов (см. ниже). Возможно также обозначать соотношение частей в растворе знаком «двоеточие» (:). Так, запись «спирт:эфир 1:2» означает, что данная смесь получена путём смешивания 1 объёма спирта и двух объемов эфира. Мерой объема при этом может быть любая величина, в зависимости от требуемого количества расходного материала (например, мл, л и т.д.).
Для приготовления многих растворов в качестве растворителя используются буферные растворы – водные растворы, сохраняющие определенную концентрацию ионов Н+ (рН) при добавлении небольших количеств сильных кислот и щелочей.
Буферные растворы представляют собой растворы слабой кислоты и ее соли, или слабого основания и его соли, взятых в определенном соотношении. Буферные растворы также можно составлять из смеси солей многоосновной кислоты, константы диссоциации которой сильно отличаются друг от друга, например, из смеси одно- и двузамещенных фосфатов.
Р-р В: КН2РО4 1/15 М: растворить 9,078 г КН2РО4 в 1000 мл воды.
Для получения буфера с определенной рН необходимо смешать растворы А и В в нижеуказанных соотношениях:
|
рН |
Р-р А в мл |
Р-р В в мл |
рН |
Р-р А в мл |
Р-р В в мл |
||
|
5,8 |
8,0 |
92,0 |
7,2 |
72,0 |
28,0 |
||
|
5,9 |
9,9 |
90,1 |
7,25 |
74,4 |
25,6 |
||
|
6,0 |
12,2 |
87,8 |
7,3 |
76,8 |
23,2 |
||
|
6,1 |
15,3 |
84,7 |
7,35 |
78,9 |
21,1 |
||
|
6,2 |
18,6 |
81,4 |
7,4 |
80,8 |
19,2 |
||
Продолжение таблицы
|
рН |
Р-р А в мл |
Р-р В в мл |
рН |
Р-р А в мл |
Р-р В в мл |
||
|
6,3 |
22,4 |
77,6 |
7,45 |
82,5 |
17,5 |
||
|
6,4 |
26,7 |
73,3 |
7,5 |
84,1 |
15,9 |
||
|
6,5 |
31,8 |
68,2 |
7,55 |
85,7 |
14,3 |
||
|
6,6 |
37,5 |
62,5 |
7,6 |
87,0 |
13,0 |
||
|
6,7 |
43,5 |
56,5 |
7,65 |
88,2 |
11,8 |
||
|
6,8 |
49,6 |
50,4 |
7,7 |
89,4 |
10,6 |
||
|
6,85 |
52,5 |
47,5 |
7,75 |
90,5 |
9,5 |
||
|
6,9 |
55,4 |
44,6 |
7,8 |
91,5 |
8,5 |
||
|
6,95 |
58,2 |
41,8 |
7,5 |
93,2 |
6,8 |
||
|
7,0 |
61,1 |
38,9 |
8,0 |
94,7 |
5,3 |
||
|
7,05 |
63,9 |
36,1 |
8,1 |
95,8 |
4,2 |
||
|
7,1 |
66,6 |
33,4 |
8,2 |
97,0 |
3,0 |
||
|
7,15 |
69,2 |
30,8 |
|
|
|
||
При разведении (до соотношения 1:100) рН буферного раствора практически не меняется, однако отражается на его емкости. Буферная емкость – число молей сильной кислоты или сильного основания, добавление которого к буферному раствору изменяет его рН на единицу. Фактически это характеристика способности раствора противостоять прибавлению кислоты или щелочи. Буферная емкость тем больше, чем концентрированнее раствор.
Для приготовления буферных растворов необходимо использовать перекристаллизованные реактивы квалификации “хч” и бидистиллированную воду; значение рН – контролировать потенциометрически (см. ниже).
Перекристаллизация (восстановление кристаллической структуры реагента) достигается путем прокаливания. Необходимость кристаллизации диктуется тем, что при неправильном хранении реактивов (кристаллогидратов) может происходить частичная потеря кристаллизационной воды (выветривание), из-за чего вещество переходит в аморфное состояние. Такой реактив без предварительного прокаливания не пригоден к приготовлению растворов, так как исходно закладывается ошибка при подсчете молекулярной массы кристаллогидрата.
С увеличением температуры константа диссоциации воды возрастает, соответственно увеличивается и концентрация водородных ионов, а рН уменьшается. Поэтому когда указывается точная концентрация водородных ионов в растворе или оптимальный рН какой-либо химической реакции, должна быть указана и температура, к которой эта величина относится, иначе сведения носят лишь приблизительный характер.
Буферные растворы используются в тех случаях, когда анализ проводится при определенном значении рН, в частности при определении активности ферментов.
Приготовление растворов из фиксаналов
Фиксанал представляет собой ампулу, содержащую навеску (либо концентрат) вещества, из которого необходимо приготовить раствор заданной концентрации (молярный, нормальный или процентный). Каждая ампула фиксанала рассчитана на приготовление раствора в определенном объеме растворителя (количество растворителя указывается на этикетке фиксанала). Приготовление растворов производится в соответствии с инструкцией к фиксаналу, выполнение которой обеспечивает полное перенесение вещества в раствор.
Целый ряд веществ, переходя из недиссоциированного состояния в ионизированное, меняет цвет, поэтому окраска раствора зависит от рН. Эти вещества называются кислотно-щелочными индикаторами. Они принадлежат к различным типам органических соединений, но все являются слабыми кислотами или слабыми основаниями. Их недиссоциированные молекулы окрашены иначе, чем диссоциированные. Индикаторы могут использоваться как добавки к растворам реактивов для контроля за изменением рН. Например, в растворе Хенкса (среда, используемая для работы с клетками) в качестве индикатора добавлен феноловый красный. В диапазоне нейтральной рН раствор имеет оранжево-красный цвет, при закислении среды – меняется на желтый, а при защелачивании – на малиновый.
При хранении растворов надо иметь в виду, что основными причинами, которые могут привести к случайному изменению рН, являются попадание угольной кислоты из воздуха и выщелачивание стекла. Углекислота воздуха сказывается главным образом на растворах, рН которых выше 7, поскольку более кислые растворы угольную кислоту не поглощают. Уберечься от ее влияния проще всего, закрывая флаконы с реактивами пробками. Выщелачивание посуды зависит в первую очередь от сорта стекла, а также от длительности хранения реактива. Оценить его влияние в условиях клинической лаборатории непросто, поэтому надо проявлять определенную осторожность. Пластмассовые флаконы, пробирки и кюветы, как правило, делаются из материала, который не выщелачивается.
В лабораториях растворы реактивов обычно приготавливают на несколько дней (до нескольких недель). Стабильность растворов зависит от их концентрации. При необходимости длительного хранения лучше готовить концентраты растворов (например, 10х кратные), так как они более стабильны. Растворы, необходимые непосредственно для работы (рабочие растворы), готовят накануне путем разбавления матричных растворов и используют в течение одного или нескольких дней.
2.7.1. Определение рН растворов
Ориентировочное представление о рН раствора можно получить с помощью лакмусовой полоски или по изменению цвета индикатора (см. выше). Однако для контроля рН в реакциях, требующих строго определенной концентрации водородных ионов, необходимо применение более точных методов. В клинической лабораторной диагностике для этих целей используются потенциометрические методы. К потенциометрии относятся различные варианты приборов для исследования рН и кислотно-щелочного состояния, а также ионселективные электроды.
Потенциометрические методы основаны на измерении электрического потенциала, который возникает на границе двух сред в том случае, когда ионы одного заряда проникают через эту границу легче, чем противоположно заряженные. Это различие обусловлено свойствами специальной мембраны с избирательной проницаемостью, разделяющей два раствора – один известного состава (эталонный), другой – исследуемый.
Оба раствора посредством солевых мостиков, то есть трубочек, заполненных раствором соли (обычно хлористым калием), контактируют с металлическими электродами, на границе которых с раствором всегда одна и та же разность электрических потенциалов. Материал металлического электрода (его называют полуэлемент) и состав раствора, в который он погружен, подбираются таким образом, чтобы величина этого потенциала была максимально устойчивой. Наиболее часто в качестве полуэлементов используют хлорсеребряные электроды – кусочки серебряной проволоки, покрытые слоем хлористого серебра. Исправный хлорсеребряный электрод должен быть темного цвета, когда он портится, хлористое серебро осыпается и видна светлая металлическая поверхность.
Конструктивно ионоселективные электроды изготовляют так, что эталонный раствор (или заменяющая его масса плотной консистенции, которая ведет себя как эталонный раствор) вместе с мембраной объединены в один блок с металлическим электродом (полуэлементом), к которому подведен электрический провод. Вторая половина электрической цепи также изготовляется в виде отдельного блока, который называется электродом сравнения или референтным.
На границе растворов электролитов разных концентраций, разделенных перегородкой с избирательной проницаемостью, ионы из более концентрированного раствора диффундируют в менее концентрированный, но через полупроницаемую перегородку могут проходить ионы только одного заряда. Поэтому на границе раздела возникает разность потенциалов, которую фиксирует прибор (рисунок 2.2).
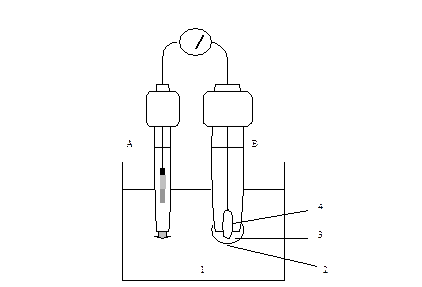
Рисунок 2.2 – Принцип потенциометрических измерений
А – электрод сравнения (референтный). В – измерительный электрод (индикаторный). 1 – исследуемый раствор; 2 – ионоселективная мембрана (избирательно пропускает определенные виды ионов); 3 - эталонный раствор; 4 – хлорсеребряный электрод.
Электроды очень чувствительны к попаданию посторонних веществ – щелочей, кислот, поверхностно-активных веществ, дезинфицирующих агентов, а также к нагреванию. Они имеют ограниченный срок работы (со временем теряют чувствительность) и нуждаются в постоянной и систематической калибровке.
2.7.2. Фильтрование
Фильтрованием называется отделение от жидкости находящихся в ней частиц при помощи фильтрующей перегородки. Жидкость, отделяемая при фильтровании, называется фильтратом. Существуют различные фильтрующие материалы, а также различные способы фильтрования.
В биохимических лабораториях наиболее часто используются фильтрование через бумажные фильтры. Такой вид фильтрования называют поверхностным. Частицы остаются на поверхности фильтра, если размеры превышают размер диаметра пор. Фильтровальная бумага, в отличие от обычной бумаги, более чиста по составу и волокниста, что и обусловливает ее фильтрующую способность. Фильтровальная бумага бывает обычная и беззольная. Фильтры, приготовленные из беззольной бумаги, при сжигании дают очень незначительное количество золы (оно указывается на фабричной этикетке на каждой пачке). Беззольную бумагу употребляют при точных аналитических работах, связанных со сжиганием осадка вместе с фильтром. В клинико-диагностических лабораториях чаще используют обычные фильтры.
Плотность фильтра условно обозначают определенным цветом бумажной ленты, которой оклеивают упаковку. Приняты следующие обозначения:
1. Розовая или черная лента – быстро фильтрующая бумага. Предназначена для отделения студенистых осадков, например гидроокисей металлов.
2. Белая лента – бумага средней проницаемости. Используется в лабораториях в большинстве случаев.
3. Синяя лента – плотные фильтры. Применяются для фильтрования мелкозернистых осадков. Фильтрование идет очень медленно.
4. Желтая лента – обезжиренные фильтры. Применяются при исследованиях липидов.
Обычно в методике, по которой проводится то или иное количественное определение, указано, какой плотности фильтр надо выбрать.
В качестве фильтрующего материала могут быть использованы многослойные материалы – хлопок, стекловолокно и другие. При этом частицы задерживаются как на поверхности, так и в глубине фильтра, поэтому такой вид фильтрования называют «глубоким».
Обычное фильтрование происходит под влиянием силы тяжести. При этом скорость фильтрации, как правило, небольшая, и существенно зависит от характера фильтрующего материала, размера пор, размера частиц в растворе. Для фильтрования при комнатной температуре и атмосферном давлении применяют стеклянные воронки. Воронку располагают таким образом, чтобы ее носик немного входил в емкость для фильтрата и прикасался к его стенке. При этом конец трубки должен быть на достаточной высоте от дна емкости, чтобы при наполнении емкости фильтратом трубка воронки не была погружена в жидкость. В воронку вставляют фильтр такого размера, чтобы его края были ниже краев воронки на 0,5–1 см. Затем смачивают фильтр водой, прижимают пальцем плотно к стеклу и начинают фильтрование.
Если жидкость проходит свободно через фильтр, надо раствор лить непрерывно. Если жидкость проходит через фильтр медленно, новую порцию доливают, когда бόльшая часть жидкости пройдет через фильтр.
Для увеличения скорости фильтрования можно использовать фильтрование под вакуумом. При этом к действию силы тяжести добавляется сила всасывания. Для вакуумной фильтрации применяют специальные фильтры с повышенной плотностью. В простейшем виде фильтрование под вакуумом можно реализовать с помощью водоструйного насоса, к которому присоединяют колбу Бунзена.
Одним из вариантов фильтрования является так называемая «ультрафильтрация». Она осуществляется через фильтры с чрезвычайно узкими порами, через которые проходят молекулы небольшого размера, но задерживаются крупные молекулы (например, белки). Использование таких фильтров помогает повысить концентрацию макромолекул (например, концентрацию белков в биологическом материале).
В настоящее время широкое применение получают фильтры с заданным размером пор, изготовленные из полимерных материалов – целлюлозы, полвинилхлорида, полиамида, нейлона и др. Их называют мембранные фильтры. Выбор материала и размера пор зависит от цели применения фильтра. Наиболее широко используют фильтры с размером пор 0,45 μm и 0,2 μm для предстерилизации и стерилизации сред для культивирования и реактивов. Мембранные фильтры с размером пор, соизмеримым с размерами клеток (5-8 μm) могут использоваться для сепарации клеток.
2.7.3. Определение плотности растворов
Плотность веществ является одной из главных физических величин, характеризующих его свойства, и представляет собой количество массы в единице объема. В повседневной практике обычно пользуются относительной плотностью, то есть отношением плотности данного вещества к плотности дистиллированной воды при температуре 4°С. Относительная плотность выражается отвлеченным числом.
Для определения относительной плотности в клинико-диагностических лабораториях наиболее широко используются ареометры. Они представляют собой стеклянные трубки с расширением книзу, заполненным дробью или специальной массой. В узкой верхней части ареометра имеется шкала с делениями. Наименьшее значение относительной плотности нанесено на шкале вверху, а наибольшее – внизу, так как глубина погружения ареометра зависит от плотности жидкости. В промежутках между цифрами имеются более мелкие деления, которые позволяют определять относительную плотность с точностью до третьего десятичного знака. Существуют специальные наборы ареометров, рассчитанные для жидкостей с относительной плотностью меньше единицы и больше единицы, позволяющие определять относительную плотность в широких интервалах.
Измерение относительной плотности раствора производят следующим образом. Исследуемую жидкость наливают в стеклянный цилиндр. Размер цилиндра подбирают таким образом, чтобы ареометр свободно размещался в нем, не касаясь стенок и дна. Ареометр осторожно погружают в раствор, не выпуская его из рук до тех пор, пока не станет очевидным, что он плавает. Правильность измерения обеспечивается при положении ареометра в центре цилиндра. Отсчет по делениям шкалы ареометра производят по верхнему мениску жидкости, расположив цилиндр на уровне глаз. По окончании работы ареометр промывают в воде и, вытерев его насухо, убирают в специальный футляр или ящик. Ареометры легко бьются, поэтому обращаться с ними следует очень осторожно.
При определении относительной плотности раствора следует учитывать, что данный параметр существенно зависит от температуры. При понижении температуры раствора его относительная плотность обычно увеличивается, а при повышении – уменьшается. Поэтому необходимо всегда замечать и записывать ту температуру, при которой производилось ее измерение. Стандартной температурой, при которой рекомендуют вести определение относительной плотности, является +20°С.
2.7.4. Измерение температуры растворов
Измерение температуры в клинико-диагностических лабораториях производят термометрами. По принципу своего действия термометры бывают различными. Чаще всего применяют дилятометрические термометры, представляющие собой стеклянные трубки с капилляром внутри и с резервуаром, заполненным различными жидкостями (ртутью, этиловым спиртом, толуолом).
Наиболее широко распространенными являются ртутные термометры. Спиртовые термометры менее точные, потому что при нагревании спирт расширяется неравномерно, так как точка его кипения лежит низко (+78,3°). Спиртовые термометры могут применяться для измерения очень низких температур (до –130 0С), для которых ртутные термометры не могут быть использованы (при – 39,4 0С ртуть замерзает).
У нас в стране принято градуировать термометры в градусах Цельсия. При измерении температуры жидкостей термометр погружают в нее так, чтобы он находился на одинаковом расстоянии от стенок сосуда и не касался их. Кончик термометра должен быть полностью погружен в жидкость. При отсчете показаний по шкале глаз должен находиться на одной линии с уровнем ртути.
По окончании работы термометр охлаждают, промывают, вытирают и убирают в футляр. Если футляра нет, то термометр хранят в ящике лабораторного стола на мягкой подстилке. Для установления максимальных и минимальных температур применяют специальные максимальные и минимальные термометры.
Максимальный термометр представляет собой ртутный термометр, который устроен таким образом, что, показав самую высокую температуру, имевшую место в период наблюдения, он может сохранить свое показание, несмотря на последующее понижение температуры. Возвращение ртути к нулевым показателям достигается встряхиванием термометра.
Минимальный термометр обычно бывает спиртовой. Внутри его капиллярной трубки, заполненной спиртом, находится небольшой подвижный штифт, изготовленный из темного стекла и имеющий на концах утолщения в виде булавочных головок. При повышении температуры спирт, расширяясь, свободно проходит мимо штифта, а при понижении температуры, напротив, столбик спирта уменьшается, и поверхностная пленка увлекает за собой штифт вниз, к резервуару, и останавливается в положении, соответствующем минимуму наблюдавшейся температуры.
Находят применение термометры, позволяющие определять как максимальную, так и минимальную температуру (комбинированные).
Кроме дилятометрических, имеются манометрические термометры (основаны на измерении давления, меняющегося с изменением температуры в замкнутом пространстве), термометры сопротивления (работают на принципе измерения сопротивления металлов с изменениями температуры), термохимические термометры (основаны на применении веществ, изменяющих окраску при колебаниях температуры), а также основанные на других принципах. Для пользования указанными приборами следует руководствоваться специально прилагаемыми к ним инструкциями, содержащими подробное описание прибора и правила его эксплуатации.
2.8. Оборудование клинико-диагностической лаборатории
Оптические измерительные приборы. К ним относятся приборы для измерения светопоглощения – фотометры и спектрофотометры; для измерения окраски и светопоглощения плёнок – денситометры; для измерения флюоресценции – флюориметры, спектрофлюориметры, поляризационные флюориметры; для измерения интенсивности светоизлучения (окраски пламени, эмиссии) – пламенные фотометры; для измерения количества излученного света - люминометры; для измерения светорассеивания – нефелометры. Среди выше перечисленных оптических приборов наиболее широкое использование в рутинной практике получили спектрофотометры и фотометры, в том числе вертикальные (для иммуноферментных исследований).
Приборы для электрохимических измерений – потенциометры, полярографы и др. По установившейся традиции прибор для измерения электрического потенциала при минимальном значении текущего тока называется потенциометром, а метод – потенциометрией. Если же измеряется сила тока при постоянном значении электрического напряжения –это амперметрия. Если в процессе измерения величина потенциала изменяется по тому или иному закону, такой метод называется вольтамперметрией или полярогрофией. Из электрохимических приборов в КДЛ наиболее широко применяются рН-метры и датчики для непрерывного измерения различных параметров внутренней среды, в первую очередь, кислотно-щелочного равновесия.
Приборы для разделения веществ и определения их количества в различных фракциях – аппараты для электрофореза, хроматографы.
Кроме того, современные клинико-диагностические лаборатории оснащены автоматическими анализаторами, работающими в непрерывном режиме (когда все пробы обрабатываются последовательно, как на конвейере), либо в дискретном (когда одновременно обрабатываются серии из определенного количества проб, причем следующую серию можно анализировать только тогда, когда анализ окончен).
|
Часть 3 |
Принципы налаживания клинических лабораторных исследований |
3.1. Основные этапы процесса производства лабораторных анализов
Выделяют три основных этапа лабораторного исследования:
· преаналитический
· аналитический
· постаналитический
Преаналитический этап – это время с момента направления пациента на лабораторное обследование до момента поступления биологического материала в лабораторию. Соблюдение необходимых условий на данном этапе обеспечивается совместными усилиями лечащих врачей и лаборатории. Лечащий врач составляет запрос на анализ, обеспечивает соответствующую подготовку пациента к исследованиям, правильное взятие биологического материала, а также его своевременную и правильную транспортировку. Лаборатория обязана предоставить полную информацию о правильном выполнении данного этапа: особенностях подготовки пациента, способах взятия и хранения биологического материала для исследований и его транспортировки. Все выше перечисленные процессы осуществляются до поступления материала в лабораторию, поэтому эту часть преаналитического этапа часто называют предлабораторной.
С момента поступления материала в лабораторию начинается лабораторная часть преаналитического этапа, которая включает:
· подготовку расходных материалов и оборудования
· прием и регистрацию проб для исследования
· подготовку биоматериалов для исследований (пробоподготовку).
Аналитический этап – время непосредственного выполнения аналитической процедуры по определению того или иного, указанного в направлении врача, исследования.
Постаналитический этап, как и преаналитический, делится на внутрилабораторную и внелабораторную части. Внутрилабораторная часть подразумевает оценку врачом лабораторной диагностики достоверности полученного результата и выдачу клинико-лабораторного заключения. Интерпретация результатов врачом-клиницистом с последующим принятием на этой основе решений по тактике лечебно- диагностического процесса является внелабораторной частью постаналитического этапа.
Схема взаимодействия лечащего врача и клинико-диагностической лаборатории на различных этапах выполнения лабораторных исследований представлена на рисунке 3.1.
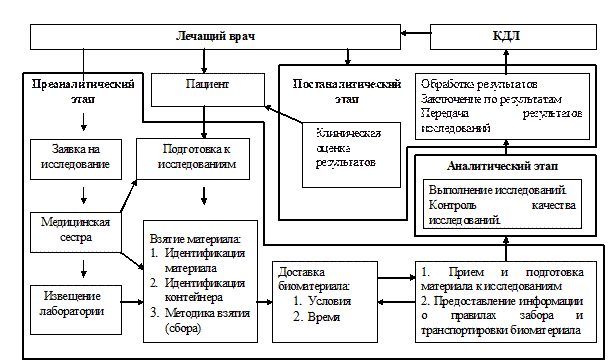
Рисунок 3.1 – Схема взаимодействия лечащего врача и клинико-диагностической лаборатории
3.2. Запрос на анализ
Лабораторные исследования назначают для установления и подтверждения диагноза, проведения дифференциальной диагностики заболеваний, определения прогноза, обоснования тактики лечения, его изменения или оценки эффективности проводимой терапии.
Первой операцией процесса производства лабораторных анализов является составление врачом-клиницистом заявки на исследование. От того, насколько правильно и рационально она составлена, во многом зависит качество результатов лабораторных исследований. Это особенно актуально при большом перечне современных лабораторных исследований. Избыточные необоснованные назначения приводят к ненужным расходам на дорогостоящие лабораторные исследования без пользы для пациента. С другой стороны, отсутствие нужного теста, который может сыграть важную роль в постановке правильного диагноза, приводит к ошибочной оценке состояния больного. Поэтому заявка на исследование должна включать минимально достаточный перечень лабораторных тестов для обследования пациента. Назначению лабораторных анализов должны предшествовать сбор анамнеза и физикальное обследование пациента.
Второй существенный момент – избыточное повторение лабораторных тестов. Избыточность исследований приводит к перегрузке лаборатории и увеличению числа ошибок при выполнении анализов. Оптимальные интервалы между исследованиями основываются на оценке состояния пациента.
Рациональные формы организации лабораторной диагностики предусматривают применение программ, комплексов, алгоритмов лабораторных исследований применительно к отдельным синдромам и конкретным заболеваниям.
При составлении заявки на исследование важное значение имеет учет дополнительных факторов:
1. Своевременность назначения (сопоставление времени назначения исследований с динамикой патологического процесса). Например, бессмысленно назначать исследование миоглобина для диагностики инфаркта миокарда на 5-е сутки после острого сердечного приступа; проводить исследование коагулограммы через 1 ч после введения больному гепарина и т. д.
2. Учет врачом закономерностей изменений исследуемого показателя (период полураспада определяемого вещества, особенности метаболизма). Например, исследование онкомаркеров может оказаться неинформативным, если не учесть периода их естественного распада и выведения, и назначить исследования на 2 – 3 сутки после оперативного лечения опухоли.
3. Оценка диагностической чувствительности и специфичности назначаемого теста. Наиболее чувствительный тест (т.е. такой, который при наличии болезни обычно дает положительный результат) следует выбрать, если есть риск пропустить опасную, но вполне излечимую болезнь (инфаркт миокарда, сифилис и т.д.). Чувствительный тест рекомендуется применять на ранних стадиях диагностического поиска для сужения его рамок, когда возможных вариантов много и лабораторные тесты позволяют исключить некоторые из них, то есть сделать вывод, что эти заболевания маловероятны. Специфические тесты нужны для подтверждения (установления) диагноза, предположенного на основании других данных. Высокоспецифичные тесты особенно показаны, если ложноположительный результат может нанести вред пациенту.
При составлении запроса на исследование необходимо грамотно заполнить направление и организовать своевременную и правильную доставку биологического материала в лабораторию.
Направление на лабораторные исследования должно содержать следующую информацию:
1. Фамилия, имя, отчество, дата рождения, пол, адрес пациента.
2. Диагноз (дополнительно указать проводимое лечение и принимаемые больным лекарства).
3. Больничное отделение, отправившее материал; ФИО врача.
4. Режим исследования: плановый, дежурный, неотложный.
5. Вид исследования или профиль, назначенные тесты.
6. Вид исследуемого материала.
7. Дата и время взятия материала.
8. Подпись врача (направление должно быть обязательно подписано, так как его следует рассматривать как финансовый документ).
3.3. Взятие материала
Правильное взятие биологического материала обеспечивается слаженной работой лечащего врача и клинико-диагностической лаборатории. В любом случае лаборатория должна подготовить СОП, информировать клиническое отделение о правилах взятия и транспортировки биологического материала и контролировать этот процесс. Существенное значение при этом имеет вид биологического материала и вид назначенных исследований. Тем не менее, существуют общие требования, которые необходимо соблюдать, чтобы обеспечить получение достоверного результата:
· забор материала проводить натощак (через 12 часов после приема пищи), за исключением исследований, требующих иной подготовки пациента;
· исследование выполнять до начала лечения. В случаях, когда это невозможно, материал следует забирать до утреннего приема лекарств;
· взятие материала не следует проводить у пациентов после физической нагрузки, ночной смены, находящихся в состоянии нервного напряжения и т.п.;
· стандартизировать время забора материала (как правило, утренние часы, например, 7:00 -9:00);
· за исключением тяжело больных, кровь у пациентов забирать в положении сидя;
· обеспечить сопровождение биологического материала, поступающего в лабораторию, необходимой информацией (см. выше);
· доставить биологический материал в лабораторию в оптимальные сроки с соблюдением необходимых условий транспортировки.
Наиболее часто используемым в клинико-диагностической лаборатории биологическим материалом является кровь и моча, особенности получения которых приведены в таблице.
Таблица 3.1 – Наиболее часто используемый в КДЛ биологический материал и правила его получения
|
Цельная капиллярная кровь |
Капиллярная кровь забирается, как правило, из дистальной фаланги кисти. У детей – из мочки уха или пятки. |
|
Цельная венозная кровь |
Берется из крупных вен (чаще из локтевой) в пробирку, содержащую антикоагулянты. Этот материал после соответствующего разведения физиологическим раствором хлористого натрия или цитратом может быть использован для исследования СОЭ. ВНИМАНИЕ! Кровь для исследований не должна забираться из вены, в которую проводятся инфузии растворов. |
|
Плазма |
Кровь необходимо взять с антикоагулянтом*. Затем производят отстаивание или центрифугирование, отделяют клеточные элементы и получают плазму. |
|
Сыворотка |
Кровь на сыворотку берут в сухую стеклянную или пластиковую пробирку, содержащую активаторы свертывания. После того, как произошло свертывание крови, кровь следует отцентрифугировать и отделить сыворотку от сгустка. |
|
Моча для «общего анализа» |
Используется вся утренняя порция мочи. |
|
«Суточная» моча |
Первая утренняя порция мочи не учитывается, затем собирают все порции мочи в течение суток, включая утреннюю порцию мочи следующего дня. Перемешивают, отмечают объем, отливают 50 мл мочи в отдельную емкость, доставляют в лабораторию вместе с информацией об объеме суточной мочи |
* - антикоагулянты – вещества, препятствующие свертыванию крови и увеличивающие сохранность клеток крови. В клинической лабораторной диагностике в качестве антикоагулянтов наиболее часто используют соли этилендиаминтетрауксусной кислоты (ЭДТА) – К2ЭДТА, К3ЭДТА и Nа2ЭДТА, цитрат натрия, оксалат натрия и гепарин. Действие ЭДТА обусловлено образованием комплекса с кальцием, что препятствует свертыванию и обеспечивает в течение первых 3-5 часов минимальные изменения клеточной морфологии. Цитрат натрия (Na3C6Н5O7) используется, как правило, для определения СОЭ. Механизм действия основан на связывании ионов кальция. Оксалат натрия (Na2C2O2) используется при подсчете количества клеток крови и их морфологии. Механизм действия аналогичен цитрату натрия. Гепарин (чаще применяют гепаринат натрия или лития) является физиологическим антикоагулянтом, используется в гематологических и иммунологических исследованиях. Гепарин препятствует переходу протромбина в тромбин и фибриногена в фибрин. Следует помнить, что выбор антикоагулянта определяется конкретной методикой исследования!
В современных лабораториях для взятия венозной крови все более широко используются специальные пробирки с вакуумными системами (Vacutainer). Они производятся из стекла или прозрачного безлатексного полиэтилентерефталата (ПЭТ), который легче и практически не бьется, в отличие от стекла. Пробирки защищены безлатексными крышками, имеющими цветовые коды в соответствии с типом содержащихся в них химических реагентов (например, зеленый код указывает на содержание в пробирке гепарина, черный – цитрата натрия, белый – К2ЭДТА и т.д.). Коды отвечают международным стандартам. Стерильные иглы в данных системах имеют ультратонкие стенки и могут использоваться для отбора нескольких проб за одну процедуру венепункции. Иглы снабжены защитным колпачком, что значительно снижает риск случайной травмы от укола иглы и передачи инфекции. Имеются специально разработанные комплекты для забора крови из труднодоступных вен и специальные одноразовые педиатрические иглы. Применение пробирок типа Vacutainer позволяет унифицировать такие преаналитические параметры как порядок отбора крови, время наложения жгута, перемешивание, условия транспортировки.
3.4. Правила транспортировки и хранения биологического материала
Все биологические материалы должны быть максимально сохранены и доставлены в лабораторию в максимально короткие сроки. Для этого необходимо строго соблюдать оптимальные режимы транспортировки образцов от места забора до лаборатории, учитывая влияние времени, температуры и механических воздействий во время транспортировки. В целом, способы доставки проб в отдаленные лаборатории и хранение проб в лаборатории должны быть стандартизированы. Сроки доставки и способы хранения материала различаются в зависимости от вида биологического материала и планируемого исследования. Приведем некоторые примеры.
Капиллярную кровь для общего анализа крови получают в лаборатории и исследуют на месте или осуществляют получение материала в отделении и доставляют в лабораторию.
Венозная кровь из отделений в лабораторию транспортируется в пластиковых или стеклянных пробирках, закрытых резиновыми пробками. Пробирки располагаются в штативах, последние устанавливают в транспортные контейнеры, на дно которых положена белая ткань в 3-5 слоев. Сопроводительные документы запрещено вкладывать внутрь контейнеров.
Во время сбора суточной мочи материал следует хранить в холодильнике, а если это невозможно, то следует добавить в сосуд для сбора мочи консервирующий раствор (около 5 мл 10% раствора тимола в изопропаноле или несколько кристаллов тимола).
Для общего анализа мочи берут утреннюю порцию мочи, которую следует как можно быстрее доставить в лабораторию (в течение 1 часа).
Спинномозговую жидкость для клинического исследования следует доставить в лабораторию немедленно.
3.5. Порядок приема и регистрации проб для исследования
Материал для исследований в плановом режиме принимается в рабочие дни в фиксированное утреннее время (например, с 8:0 до 10:00).
Материал для исследований в неотложном режиме ("cito") принимается ежедневно и круглосуточно в лаборатории неотложного анализа. Результаты исследований, выполняемых в неотложном режиме, подготавливаются и доступны для передачи в отделения больницы в течение 1 часа с момента поступления материала в лабораторию на бумажном носителе или по телефону.
Как указывалось выше, пробирки (или иные емкости) с биологическим материалом, поступающие в лабораторию, должны сопровождаться надежно закрепленным и правильно оформленным направлением на лабораторное исследование. При поступлении материала в лабораторию проверяют соответствие проб прилагаемому направлению, состояние проб, отмечают время поступления. Лаборатория может и должна отказать в приеме материала на исследование в следующих случаях: при наличии расхождения между данными заявки и маркировки на пробирке; при отсутствии этикетки на пробирке или невозможности прочесть заявку или этикетку. Не могут быть приняты к исследованию пробы биологического материала с превышением сроков доставки.
Весь поступающий материал регистрируется лаборантом или фельдшером-лаборантом. Регистрация биологического материала подразумевает запись в специальном журнале регистрации проб, присвоение образцу кодового идентификационного номера и маркирование пробирок с материалом. Если в лаборатории налажен механизированный учет, на пробирки наносится специальный штрих-код, который считывается лаборантами на последующих этапах обработки и анализа проб с помощью специальных детекторов (ридеров).
Пробоподготовка проводится на специально оборудованных рабочих местах (или в отдельном помещении) и предусматривает первичную обработку образцов биоматериалов (термостатирование, центрифугирование, отделение сыворотки, дозирование отдельных проб и.т.д.). Для этого рабочее место оснащается специальным оборудованием и устройствами (центрифуги, термостаты и др.), о чем указывалось выше. Режим центрифугирования регламентируется определенным стандартным протоколом.
После проведения центрифугирования могут быть забракованы пробы, имеющие высокую степень гемолиза, липемии в зависимости от метода измерения аналита.
3.6. Выбор метода и режима исследования
При выборе метода исследования учитываются следующие основные критерии:
1. Аналитические характеристики метода. Они связаны с оценкой возможностей метода – его специфичностью, чувствительностью, воспроизводимостью и т. д. (см. раздел 3.7).
2. Технико-экономические критерии – расход рабочего времени и материальных ресурсов на проведение одного исследования, которые определяются наличием необходимого оборудования и приборов, наличием подготовленного персонала и уровнем его квалификации и т. п. Сюда же относится стоимость одного исследования, наличие необходимого оборудования, подготовленного персонала, стоимость исследования и т.д.
3. Биомедицинские параметры, отражающие диагностическую значимость показателей выбранного метода. Они значительно различаются в зависимости от целей анализа, то есть его клинического предназначения. Такими предназначениями могут быть:
· плановое обследование (амбулаторное или стационарное);
· скрининг с целью выявления групп риска;
· экспресс-анализ.
При плановом обследовании критериями выбора метода служит оптимальный баланс выше перечисленных факторов. Особое внимание обращается на информативность и аналитическую надежность, так как результаты используются для подтверждения или уточнения диагноза, контроля за результатами лечения. При экспресс-анализах одним из важнейших дополнительных требований является продолжительность выполнения анализа. При проведении скрининговых исследований, например, с целью выявления групп риска по какому-либо заболеванию, напротив, время выполнения исследований не является очень существенным, так как такие исследования затрагивают в основном амбулаторных пациентов или практически здоровых людей. На первый план здесь выступает экономичность теста, учитывая массовый характер обследования. Кроме того, предпочтение отдается более чувствительным методам (даже в ущерб специфичности).
В зависимости от потребностей клинического отделения, заказывающего анализ, исследования в лаборатории могут выполняться в различных режимах:
1. Плановые исследования – это все исследования, назначенные накануне, материал для которых поступает в лабораторию утром. Время выполнения этих исследований – до 6 часов, в отдельных случаях требуется более длительная аналитическая процедура.
2. Неотложные исследования ("cito") – материал принимается круглосуточно, время выполнения – до 45 минут со времени поступления материала. В таком режиме выполняются исследования, результаты которых необходимы врачу для принятия срочных решений и которые могут быть выполнены за такой короткий срок. Это, прежде всего, гематокрит, группы крови, параметры кислотно-основного состояния, уровень глюкозы, коагулограмма, мочевина, креатинин и ряд других. Эти исследования проводятся в так называемых экспресс-лабораториях.
3. Дежурные исследования – это исследования, выполняемые в лаборатории неотложного анализа и дежурным лаборантским (врачебным) постом ежедневно с 15:30 до 8:00. Время выполнения – до 2 часов.
В настоящее время в связи с интенсивным международным сотрудничеством, миграцией населения все более актуальной становится стандартизация и унификация всего аналитического процесса. Здесь подразумевается прежде всего единство методов определения тех или иных параметров, а в более широком смысле – и стандартный уровень изготовления приборов и реактивов. Использование унифицированных и стандартизованных методов обеспечивает высокий уровень надежности методов и возможность сопоставления результатов, полученных в различных лабораториях.
В целях обеспечения унификации и стандартизации деятельности клинических лабораторий в Украине лабораторное оборудование и диагностические наборы проходят обязательную регистрацию в Министерстве здравоохранения, свидетельство о которой выдается на основании проведения клинических испытаний. Для оборудования и диагностических наборов импортного производства обязательным является предоставление свидетельства о регистрации продукции в стране-производителе и соответствии документам ISO.
Для организации системы стандартизации в мировом масштабе создана Международная Организация по Стандартизации (ISO). Национальные организации, входящие в состав ISO, принимают участие в разработке Международных Стандартов через технические комитеты, международные и национальные организации как государственные, так и негосударственные. Для обеспечения качества в лабораториях выпущено Руководство ISO/IEC №25, оно же используется для признания их компетентности, в частности, через аккредитацию.
В Европе используются европейские стандарты, обозначенные EN 45000. Такими стандартами по клинической биохимии являются:
EN 45002 – критерии аккредитации клинико-диагностических лабораторий;
EN 45003 – критерии для организаций, проводящих аккредитацию лабораторий;
EN 45011 - 45013 – критерии для государственных органов, проводящих сертификацию производства, лабораторий, производства.
Использование стандартов ISO требует в первую очередь создания референтных лабораторий. Референтные лаборатории обязаны работать референтными методами. Международной федерацией клинической химии выделено 4 типа методов: дефинитивные, референтные I уровня, референтные II уровня и обычные или рутинные методы. Наиболее высокой степенью точности обладают дефинитивные или окончательные методы. Результаты, полученные этими методами, наиболее близки к истинной величине.
Референтный метод – это метод, у которого после всестороннего теоретического и практического изучения установлено, что аналитическая ошибка составляет примерно ±1%. Референтные методы подразделяются на I и II типа. Референтные методы I типа аттестованы также как дефинитивные. Примером является определение атомно-абсорбционной спектрофотометрией элементов Са, Na, К, Mg и других. Референтные методы П типа имеют такую же аналитическую ошибку, как и I типа, но достигнуто это за счет тщательного выполнения всех этапов. Отдельные ферментативные методы, в частности гексокиназный метод определения глюкозы, относят к референтным методам. Окончательные и референтные методы должны использоваться для оценки рутинных методов. В Республике Беларусь в системе Министерства здравоохранения референтных лабораторий пока нет.
К рутинным методам относят методы, повседневно используемые в лабораторной диагностике. Они характеризуются доступностью для повседневного воспроизведения в обычных клинических лабораториях и, одновременно, достаточно высокой точностью в соответствии с потребностями клинической диагностики.
Подытоживая вышесказанное, следует подчеркнуть, что детали налаживания метода исследования во многом зависят от того, идет речь о ручной или автоматизированной работе, используются готовые наборы реактивов или они должны готовиться непосредственно в лаборатории. При внесении тех или иных модификаций в методику с учетом имеющегося оборудования и опыта сотрудников лаборатории отклонения от стандартного протокола должны быть подробно документированы, согласованы с главным внештатным специалистом по клинической лабораторной диагностике республиканского или областного уровня. Протокол выполнения методики должен быть утвержден руководителем учреждения здравоохранения.
На рабочем месте следует иметь протокол методики, оформленный так, что каждая новая процедура начинается с новой строки, а сами процедуры пронумерованы по порядку их выполнения. Полезно в описании методики привести прописи всех используемых в процессе анализа реактивов с указанием квалификации их чистоты.
Использование готовых наборов реактивов заводского изготовления (так называемых тест-систем) значительно упрощает налаживание методики. В этом случае лаборатории остается только приготовить растворы согласно инструкции и тщательно придерживаться описанной в инструкции технологии производства анализа.
3.7. Обеспечение качества лабораторных исследований
В связи с тем, что клиническая лаборатория несет ответственность за качество представляемого результата, она обязана контролировать все этапы выполнения лабораторного исследования (см. раздел 3.1). Этот контроль начинается уже с момента назначения врачом-клиницистом лабораторного исследования. Основные объекты контроля в преаналитической фазе приведены в таблицах 3.2-3.3.
Таблица 3.2 – Объекты контроля в преаналитической фазе
|
Объекты контроля |
Обязанности лаборатории |
|
Подготовка пациента к взятию материала |
Дать информацию о необходимых правилах подготовки, соблюдению диеты, оптимальном времени взятия, положении тела и т.д. |
|
Взятие материала |
Дать информацию о соблюдении правил идентификации пациента, особенностях получения материала в зависимости от вида анализа (время и место взятия, положение тела и др.), необходимости использования антикоагулянтов, стабилизаторов, сепарирующих гелей, обеспечение необходимого количества материала. |
|
Транспортировка |
Дать информацию о правильной транспортировке (обычные или термостатируемые транспортные контейнеры) и сроках доставки материала в лабораторию. |
|
Обработка проб |
Осуществляется непосредственно в лаборатории – регистрация, центрифугирование, распределение проб, перемешивание, идентификация, экстрагирование |
|
Хранение |
Время хранения, выбор места и температуры, перемешивание после хранения |
Таблица 3.3 – Факторы преаналитического этапа, влияющие на результаты лабораторных исследований (Меньшиков В.В., 2002)
|
1. Ошибки идентификации пациента и образца биоматериала 2. Биологические факторы а) учитываемые: пол, возраст, этнос (н., у народностей, употребляющих острую, пряную пищу показатели коагулограммы будут увеличены), физиологическое состояние (физическая тренированность, беременность и др.), биологические ритмы, влияния среды обитания б) устранимые: прием пищи, голодание, положение тела, физическая активность, курение, употребление алкоголя 3. Ятрогенные факторы а) диагностические процедуры (пальпация, пункции, биопсии; функциональные тесты, физический стресс при нагрузках, эргометрии; эндоскопия; введение контрастных сред) б) оперативные вмешательства в) различные лечебные процедуры (вливания и переливания; диализ и др.) г) лекарства (в том числе принимаемые без назначения врача) 4. Условия взятия, временного хранения и транспортировки биоматериала а) время взятия, срок сбора б) подготовка участка тела для взятия материала в) процедуры взятия крови, мочи, других биоматериалов г) посуда (чистота, материал) д) воздействие факторов среды (температура, газы воздуха) е) консерванты, антикоагулянты ж) процедуры первичной обработки (смешивание, центрифугирование, охлаждение, замораживание) 5. Свойства аналита а) биологический полупериод жизни аналита б) стабильность в крови при различных температурах в) метаболизм in vitro, включая чувствительность к свету и т. п. |
Наиболее часто источником предлабораторных ошибок являются:
· неправильная подготовка пациента;
· неправильный забор материала;
· применение неадекватного антикоагулянта;
· гемолиз;
· несвоевременное отделение плазмы;
· доставка материала в лабораторию с большим опозданием;
· неправильное хранение материала;
· ошибки в идентификации проб (замена пробирок или карточек с сопровождающей информацией).
Меры обеспечения качества на аналитическом этапе
Лабораторное исследование на аналитическом этапе сопровождается измерением значений какого-то параметра, а, следовательно, несет в себе определенную аналитическую погрешность случайного или систематического характера.
Погрешности измерения – это отклонения результатов от истинного значения измеряемой величины. Они могут быть вызваны рядом причин: плохим качеством реактивов, грязной посудой, плохо откалиброванными приборами, случайным смешиванием образцов из различных пробирок, ошибками в дозировании, низкой квалификацией лаборантов и др. Погрешности могут быть систематическими и случайными. Систематические ошибки имеют однонаправленное отклонение от истинного значения, то есть результаты лабораторных исследований либо завышены, либо занижены. Зависят такие ошибки от одинаковых причин, а их влияние распространяется на всю аналитическую серию исследования. В каждом конкретном случае возможны различные виды систематических ошибок. Так, ошибки методического характера зависят от особенностей метода анализа и могут быть вызваны интерференцией посторонних примесей. Особенно подвержены таким влияниям колориметрические методы, уступающие в этом отношении спектрофотометрическим, флуориметрическим и иммуноферментным методам.
Систематические ошибки могут быть связаны с состоянием применяемых приборов и реактивов (неточные весы, нечувствительность фотоэлементов, использование реагентов с истекшим сроком годности, отсутствие соответствующего качества воды и др.). Своевременная метрологическая поверка средств измерения (приборов и оборудования) является необходимым условием получения достоверных результатов исследования. Метрологическая поверка контролирует как стабильность работы оборудования, чем предохраняет от случайных ошибок, так и правильность его работы, что позволяет избежать систематических ошибок.
Случайная погрешность изменяется случайным образом при повторных измерениях одной и той же величины. Причины случайных ошибок в лаборатории многообразны. Это может быть неточность работы персонала: ошибки при пипетировании, выполнении разведений, считывании результата и т.д. Они могут возникать в случае утомления лаборанта и приводить к так называемым «грубым» ошибкам. Грубые ошибки, как правило, являются ошибками одиночного значения. Результаты исследования при этом выходят за пределы нормальных и даже патологических значений определяемого показателя. Причинами таких ошибок, кроме недостаточной квалификации и тщательности работы персонала, могут быть нарушения в подготовке к работе лабораторной посуды, реактивов, приборов и оборудования. Такие ошибки наименее опасны, так как обычно сразу замечаются и результаты этих исследований отбрасываются.
Случайные ошибки могут быть вызваны свойствами самой пробы. Правильно подготовленная к анализу проба должна быть равномерно перемешана, то есть быть гомогенной. Еще одним источником случайных ошибок может быть неточная (некачественная), нестабильная работа приборов и оборудования: дозаторов, пипеток, фотометров и др. Для устранения этой причины, как уже указывалось, необходимо своевременное проведение метрологической поверки измерительного оборудования.
Специалисты по лабораторной диагностике должны наладить и постоянно реализовать систему мер, обеспечивающих минимизацию случайных и систематических ошибок, то есть обеспечить их аналитическую надежность. Для этого предназначена система контроля работы, которая должна давать ежедневную информацию о качестве получаемых в лаборатории результатов в процессе повседневного использования метода (внутрилабораторный контроль качества), а также выявлять погрешности в работе, зависящие от метода исследования путем сопоставления результатов различных лабораторий (межлабораторный контроль качества) (см. раздел 3.7.1).
Для характеристики аналитических качеств метода исследования, также влияющих на надежность лабораторной информации, дополнительно используются такие критерии как специфичность и чувствительность
Аналитическая специфичность метода – способность метода измерять лишь тот компонент или те компоненты, для определения которых он предназначен. Низкая специфичность приводит к получению ложноположительных результатов и должна быть указана в описании метода.
Аналитическая чувствительность метода определяется его способностью выявлять наименьшие различия между двумя концентрациями исследуемого вещества. Нижний предел чувствительности метода – это концентрация исследуемого вещества, которая соответствует наименьшему результату определения, статистически достоверно отличающемуся от показателей холостой пробы. Нижний предел чувствительности метода может быть охарактеризован количественно.
Такие параметры как специфичность и чувствительность принимаются во внимание при выборе метода исследования (см. раздел 3.6).
Обеспечение качества на постаналитическом этапе представляет собой проведение адекватной интерпретации результатов и принятие оптимальных решений по дальнейшему обследованию и тактике лечения пациента.
3.7.1. Система управления качеством лабораторных исследований
Контроль качества клинических лабораторных исследований – важнейшая составная часть работы каждой клинико-диагностической лаборатории. Контроль качества представляет собой систему мер, обеспечивающих выполнение качественных лабораторных исследований, предупреждение и устранение ошибок на всех этапах лабораторного анализа, повышение диагностической надежности результатов анализов.
Контроль качества лабораторных исследований в клинико-диагностических лабораториях Украины регламентируется стандартами ДСТУ EN ISO15189:2015 “Медичні лабораторії. Вимоги до якості та компетентності”, ДСТУ ISO 9001:2015 “Системи управління якістю. Вимоги”, ДСТУ ISO 9000:2015 “Системи управління якістю», которые включают «Основні положення та словник термінів”, инструкции о порядке проведения внутреннего и внешнего контроля качества лабораторных исследований, определен порядок изучения инструкций в медицинских университетах, предусмотрена курация сотрудниками профильных кафедр.
Основной формой контроля качества всех видов исследований является внутренний (внутрилабораторный) контроль.
Внутрилабораторный контроль качества исследований имеет своей целью достижение максимально высокой точности измерений (минимальной погрешности измерения). Точность измерений – это качество измерений, которое отражает близость результатов к истинному значению измеряемой величины. Высокая точность измерений соответствует малым погрешностям (отклонениям результатов измерения от истинного значения).
Внутрилабораторный контроль качества исследований включает определение воспроизводимости и правильности исследований.
Воспроизводимость можно определить как совпадение лабораторных показателей при повторных исследованиях. Качество измерений, отражающее близость друг к другу результатов измерений, выполняемых в одной и той же аналитической серии, называется внутрисерийной воспроизводимостью.
Внутрисерийную воспроизводимость иначе еще называют сходимостью результатов измерений. При этом необходимо определить понятие аналитической серии. Понятие аналитическая серия обозначает совокупность результатов измерений лабораторного показателя, которые выполнены в одно и то же время и в одних и тех же условиях. При этом настройка и калибровка аналитической системы не меняются. В том случае, когда рассматривается близость друг к другу результатов измерений, выполняемых в разных аналитических сериях (различные аналитические системы, калибровки, персонал), производится оценка качества измерений по межсерийной воспроизводимости.
При оценке качества измерений используется также понятие общая воспроизводимость, которое отражает близость друг к другу результатов всех измерений. Определяется общая воспроизводимость внутрисерийной и межсерийной воспроизводимостью.
Мерой воспроизводимости является величина (разброс данных) и частота встречаемости случайных ошибок. Чем меньше частота и величина случайных ошибок, тем лучше воспроизводимость. Количественной характеристикой воспроизводимости является величина среднеквадратического отклонения (S) и коэффициент вариации (CV). Среднеквадратическое отклонение (S) и коэффициент вариации (СV) рассчитываются по формулам:
![]() и
и 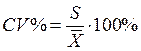 ,
,
где Х – величина определяемого показателя в пробе или контрольном материале;
![]() – средняя
величина определяемого показателя;
– средняя
величина определяемого показателя;
n – число дней исследования при выполнении одного исследования в день.
Правильность измерения – это качество измерений, отражающее близость к нулю систематических погрешностей в их результатах. Таким образом, для проведения контроля правильности лабораторных исследований необходимо выявление систематических ошибок – завышения либо занижения результатов.
Воспроизводимость и правильность измерений можно проиллюстрировать на хорошо известном примере мишени (рисунок 3.2).
|
А
|
В
|
С
|
D
|
Рисунок 3.2 – Варианты различного качества измерений
Центр мишени соответствует истинному содержанию вещества в пробе.
А – высокая точность измерений; В – хорошая воспроизводимость, плохая правильность; С – плохая воспроизводимость, хорошая правильность; D – плохая воспроизводимость, плохая правильность.
Сочетание правильности и воспроизводимости измерений, как основных составляющих точной и надежной лабораторной информации находят отражение в международном стандарте качества лабораторных исследований (ISO) (таблица 3.4).
Таблица 3.4 – Концепция точности, правильности и воспроизводимости измерения
|
Точность измерения |
|
|
Правильность измерения – степень близости среднего значения измерений и истинного значения |
Воспроизводимость измерения – степень близости результатов измерения одного и того же объекта друг с другом |
|
Систематический компонент погрешности |
Случайные компоненты погрешности |
|
Выражается через смещение (bias) |
Выражается через стандартное отклонение и коэффициент вариации в % (CV %) |
Для осуществления контроля правильности лаборатория должна располагать контрольными сыворотками с известным содержанием компонентов, допущенными в установленном порядке к применению на территории Украины. Контроль воспроизводимости может осуществляться контрольными сыворотками, как с известным содержанием компонентов, так и сыворотками с неизвестным содержанием компонентов. Все контрольные сыворотки должны быть идентичны по физико-химическим свойствам исследуемому образцу, обладать стабильностью, при исследовании давать минимальную вариабельность внутри серии. Контрольный материал должен быть однородным, результаты исследования его, в таком случае, могут служить для оценки погрешности выполняемого аналитического измерения. Исследование контрольных материалов выполняется на аналитическом этапе лабораторного исследования и позволяет оценить погрешности этого этапа. Следует помнить, что контрольный материал не может быть использован одновременно в качестве калибратора.
Порядок проведения и стадии внутрилабораторного контроля качества описаны в главах 5 и 6 приложения № 1 к вышеуказанному приказу № 873. Результаты проведенного контроля качества отражаются в специальных картах и подлежат оценке по предупредительным и контрольным критериям.
Предупредительные критерии позволяют обнаружить ошибки в работе лаборатории. Само появление предупредительных критериев указывает, что анализ может выйти из-под контроля. В этом случае необходимо провести поиск причин, устранить их, и после этого повторно провести контроль качества, причем обязательно выполнение контроля правильности с использованием контрольной сыворотки с известным содержанием компонентов (аттестованной сывороткой). При наличии предупредительных критериев проводится проверка качества калибровочных или стандартных растворов, качества реактивов и их сроков годности. К предупредительным критериям относят следующие варианты контрольных карт:
1. Шесть результатов подряд находятся по одну сторону от средней линии.
2. Три результата подряд располагаются за пределами одного среднеквадратического отклонения (± 1S).
3. Один результат находится за пределами двух среднеквадратических отклонений (± 2S).
4. Шесть результатов подряд имеют
тенденцию наклона в одну сторону от средней величины показателя (![]() ).
).
При осуществлении оперативного контроля качества результатов определения исследуемого показателя с использованием построенных карт существуют критерии, которые ставят под сомнение результаты лабораторного исследования, так называемые контрольные критерии. Появление этих критериев означает, что анализ вышел из-под контроля и до исправления недостатков результаты анализов не должны выдаваться в клинические отделения. В этих случаях проверке подлежат все этапы выполнения лабораторного анализа. Проверяется качество реактивов, стандартов или калибраторов, контрольной сыворотки, исправность приборов и оборудования, качество лабораторной посуды и т.п.
Такими контрольными критериями являются следующие:
1. Восемь результатов подряд находятся по одну сторону от средней арифметической величины.
2. Пять результатов подряд расположены за линией одного среднеквадратического отклонения (± 1S).
3. Три результата подряд выходят за рамки (± 2S).
4. Один результат располагается за пределами (± 3S).
Вышеназванный приказ № 873
предусматривает возможность оценки контрольных карт с использованием правил
Вестгарда («множественные правила Westgard»). Они основаны на том,
что ключевым моментом в оценке качества результатов анализа контрольных
материалов является выход результата за пределы (![]() ±
2S). В таком
случае последовательно проверяется наличие следующих признаков:
±
2S). В таком
случае последовательно проверяется наличие следующих признаков:
1. Одно из контрольных измерений выходит
за пределы (![]() ± 3S);
± 3S);
2. Два последних контрольных измерения
превышают предел (![]() + 2S) или лежат ниже предела (
+ 2S) или лежат ниже предела (![]() -
2S);
-
2S);
3. Два контрольных измерения в рассматриваемой
аналитической серии расположены по разные стороны от коридора ![]() ± 2S (это правило
не применяется к одному измерению в серии единственного контрольного
материала);
± 2S (это правило
не применяется к одному измерению в серии единственного контрольного
материала);
4. Четыре последних контрольных
измерения превышают (![]() + 1S)
или лежат ниже предела (
+ 1S)
или лежат ниже предела (![]() - 1S).
- 1S).
5. Десять последних контрольных
измерений располагаются по одну сторону от значения соответствующего ![]() .
.
Аналитическая серия признается
неудовлетворительной, если в дополнение к выходу за пределы ![]() ± 2S
присутствует, хотя бы один из пяти
вышеперечисленных признаков.
± 2S
присутствует, хотя бы один из пяти
вышеперечисленных признаков.
Некоторые варианты контрольных карт приведены на рисунке 3.3.
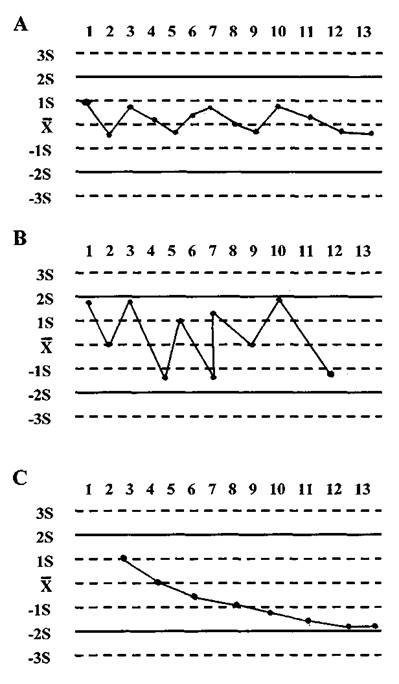
Рисунок 3.3 - Варианты контрольных карт
А – качество исследований определяемого параметра хорошее; В – выявлены предупредительные критерии (три результата подряд за пределами 1S) и высокая вариабельность результатов; требуется проверить качество калибровочных растворов и реактивов и качество выполнения работ персоналом; С – выявлено наличие контрольных признаков, выдачу результатов из лаборатории следует прекратить и проверить все этапы выполнения лабораторного анализа.
Изложенные выше процедуры контроля качества касаются аналитического этапа и выполняются в клинико-диагностической лаборатории. Ответственным за проведение внутрилабораторного контроля качества является заведующий лабораторией. При всей сложности процедур выполнение контроля качества специалистами клинико-диагностической лаборатории, имеющими единую подчиненность облегчает решение задачи.
Представление о том, что обеспечение качества результатов лабораторных исследований базируется лишь на контроле выполнения аналитического этапа, является неполным и не может считаться достаточной гарантией надежности лабораторной информации. Важнейшей составляющей является организация и обеспечение контроля качества на преаналитическом и постаналитическом этапах лабораторного исследования. Необходимо отметить, что аналитический этап легче подлежит контролю, так как выполняется только специалистами КДЛ, тогда как в реализации преаналитического и постаналитического этапов участвуют сотрудники различных подразделений учреждения здравоохранения (лечебные отделения, поликлинические отделения и т.д.) и сотрудники КДЛ (лабораторный этап). Не случайно, по данным литературы, на долю преаналитического этапа в развитых странах приходится до 75% ошибок.
Основа обеспечения качества на преаналитическом этапе базируется на разработке и строгом соблюдении инструкций по качеству проведения этой стадии лабораторного исследования. Информацию о правилах выполнения процедур преаналитического этапа предоставляет клинико-диагностическая лаборатория (см. раздел 3.1). На этом этапе необходимо обеспечить максимальную стандартизацию получения, транспортировки, хранения (при необходимости) и подготовки к исследованию биологического материала. Основной формой контроля преаналитического этапа являются периодические внешние (городским и областным специалистами) и внутренние (заведующий лабораторией) инспекционные проверки.
На постаналитическом этапе, как и на преаналитическом, самым эффективным способом обеспечения качества является стандартизация, которая заключается в единых подходах к оценке полученных результатов исследования (выбор референтных значений, учет биологической вариации и т. д.). Основной момент лабораторной части постаналитического этапа – выдача лабораторным специалистом клинико-лабораторного заключения. Врач клинико-диагностической лаборатории должен оценить результат анализа на предмет его достоверности и сделать интерпертацию результата.
1. Внешний контроль качества имеет целью проведение объективной оценки результатов лабораторных исследований во всех КДЛ учреждений здравоохранения Украины. Он осуществляется на региональном, республиканском и международном уровнях. Порядок проведения внешнего контроля качества лабораторных исследований в клинико-диагностических лабораториях определен приложениями к ДСТУ EN ISO 15189: 2015 «Медичні лабораторії. Вимоги до якості та компетенції»
. В приложениях указаны цели и задачи внешнего контроля качества, его организация, мероприятия, связанные с его проведением, методы статистической обработки и оценки результатов внешнего контроля качества. В Инструкции приведена форма протокола республиканского (регионального) межлабораторного контроля качества. Республиканский (региональный) контроль качества осуществляется республиканским и региональными (областными) центрами по контролю качества под непосредственным руководством главных внештатных специалистов по клинической лабораторной диагностике Министерства здравоохранения Украины, управлений здравоохранения областных исполнительных комитетов.
Для эффективного выполнения мероприятий по контролю качества лабораторных исследований в каждом учреждении здравоохранения целесообразно создать свою систему управления качеством лабораторных исследований, которая предполагает активное влияние на состояние качества лабораторного процесса на всех его этапах. Система управления качеством базируется на ДСТУ EN ISO 15189: 2015, но при этом учитывает профиль учреждения (особенности структуры лабораторных исследований), его уровень (республиканский, областной, городской, районный), материальную базу КДЛ, уровень подготовки персонала. Система управления качеством лабораторных исследований конкретного учреждения предусматривает ответственных за выполнение конкретных мероприятий (определяются приказом руководителя учреждения).
Таким образом, обеспечение качества – это выполнение совокупности планируемых и систематически проводимых мероприятий, необходимых для создания уверенности в достоверности результатов лабораторного исследования. По европейским стандартам качество, применительно к клинико-диагностическим лабораториям, – это правильно и своевременно назначенный тест для нуждающегося в нем пациента, выполненный на достаточном аналитическом уровне с необходимой информацией для его интерпретации.
3.8. Представление результатов лабораторных исследований
Результаты выполненных в клинико-диагностической лаборатории анализов заносятся в бланк лабораторного исследования. При этом количественное выражение результатов рекомендовано осуществлять в международной системе единиц СИ (Systeme Internationale — SI).
В основу СИ положена метрическая система (от греческого слова «метрон» - мера). СИ состоит из единиц трех типов: основных (7), дополнительных (2), производных (таблицы 3.5 – 3.6).
|
Величина |
Единица |
||
|
наименование |
Обозначение |
||
|
международное |
русское |
||
|
Длина |
метр |
m |
м |
|
Масса |
килограмм |
kg |
кг |
|
Время |
секунда |
s |
с |
|
Сила электрического тока |
ампер |
А |
А |
|
Термодинамическая температура |
кельвин |
К |
К |
|
Количество вещества |
моль |
mol |
моль |
|
Сила света |
кандела |
cd |
кд |
Дополнительные единицы – радиан и стерадиан. Производные единицы образуются из основных в соответствии с правилами Международной системы единиц. Сочетая две или более основных единиц, путем умножения или деления можно получить производные единицы.
|
Величина |
Единица |
||
|
наименование |
Обозначение |
||
|
международное |
Русское |
||
1 |
2 |
3 |
4 |
Площадь |
квадратный метр |
m2 |
м2 |
|
Объем, вместимость |
кубический метр |
m3 |
м3 |
|
Давление |
паскаль |
Ра |
Па |
|
Удельный объем |
кубический метр на килограмм |
m3/kg |
м3/кг |
|
Массовая концентрация |
килограмм на кубический метр |
kg/m3 |
кг/м3 |
Продолжение таблицы3.6.
1 |
2 |
3 |
4 |
|
Плотность |
килограмм на кубический метр |
kg/m3 |
кг/м3 |
|
Молярная концентрация |
моль на кубический метр |
mol/m3 |
моль/м3 |
|
Моляльность (растворенного компонента) |
моль на килограмм |
mol/kg |
моль/кг |
|
Активность катализатора (фермента) |
моль в секунду |
mol/s |
моль/с |
|
Скорость химической реакции |
моль в секунду на кубический метр |
mol (s.m3) |
моль (с.м3) |
Некоторым производным единицам даны специальные названия – паскаль, ньютон, джоуль и другие. Для удобства использования единиц СИ в практических целях предложены приставки, с помощью которых возможно образование десятичных кратных и дольных единиц (таблица 3.7).
|
Множитель |
Приставка |
Обозначение приставки |
Множи-тель |
Пристав-ка |
Обозначение приставки |
||
|
Между-народ-ное |
русское |
Междуна-родное |
русское |
||||
|
1018 |
экса |
Е |
Э |
10-1 |
деци |
d |
д |
|
1015 |
пета |
Р |
П |
10-2 |
санти |
с |
с |
|
1012 |
тера |
Т |
Т |
10-3 |
милли |
m |
м |
|
109 |
гига |
G |
Г |
10-6 |
микро |
m |
мк |
|
106 |
мега |
М |
М |
10-9 |
нано |
n |
н |
|
103 |
кило |
k |
к |
10-12 |
пико |
Р |
п |
|
102 |
гекто |
h |
г |
10-15 |
фемто |
f |
ф |
|
101 |
дека |
da |
да |
10-18 |
атто |
a |
а |
В клинической лабораторной диагностике Международную систему единиц рекомендуется применять в соответствии со следующими правилами.
1. В качестве единиц объема следует применять литр. Не рекомендуется в знаменателе применять дольные или кратные от литра (1 мл, 100 мл).
2. Концентрация измеряемых веществ указывается как молярная (моль/л) или как массовая концентрация (г/л).
3. Молярная концентрация используется для веществ с известной относительной молекулярной массой. Ионная концентрация указывается в виде молярной.
4. Массовую концентрацию используют для веществ, относительная молекулярная масса которых неизвестна.
5. Плотность указывается в г/л, клиренс — в мл/с.
6. Активность ферментов на преформированное количество веществ по времени и объему выражается как моль/(с.л); мкмоль/(с.л) нмоль/(с.л).
7. Выведение вещества с мочой выражается обычно относительно 24 часов, иногда в пересчете на единицу массы выводимого креатинина.
1. Порядок выдачи результатов лабораторных исследований регламентирован Приказом МОЗ України № 1 від 04.01.01 р. «Медична облікова документація, що використовується в лабораторних лікувально-профілактичних закладах»
. Приказом предусмотрены формы журналов регистрации лабораторных исследований и бланков результатов исследования биологического материала.
Наиболее существенным отличием этих форм представления результатов лабораторных исследований от ранее используемых является наличие клинико-лабораторного заключения по результатам анализа. Клинико-лабораторное заключение делается врачом лабораторной диагностики на основе сопоставления полученных результатов исследования с диагнозом конкретного пациента, а также с учетом различных интерферирующих воздействий (прежде всего, принимаемого лечения). Результаты исследования и клинико-лабораторное заключение заверяются подписью врача лабораторной диагностики.
Клиническая лабораторная диагностика дает объективные данные о состоянии здоровья человека, обеспечивая врача информацией, необходимой для наиболее эффективных лечебно-диагностических и профилактических мероприятий. Основанием для принятия диагностических и лечебных решений служит сравнение полученных данных о содержании компонентов в биоматериале с «нормой». Ошибочная оценка результатов может быть следствием недостаточно точного определения лабораторией того или иного компонента (погрешность результата), а также неправильно выбранного интервала нормы.
3.9.1. Допустимая погрешность результатов лабораторных исследований в клинике
Следует понимать, что любой лабораторный анализ несет в себе определенную погрешность (аналитическая вариация), а, кроме того, на результат анализа влияют различные биологические факторы (биологическая вариация). Соотношение между различными видами вариации определяется следующим уравнением:
S2общ=S2ан + S2биол
где S2общ – общая вариация; S2ан – аналитическая вариация; S2биол – биологическая вариация.
Мероприятия, направленные на минимизацию аналитической вариации, изложены в разделе 3.7.
Понятие «биологическая вариация» учитывает влияние внутрииндивидуальных (течение физиологических процессов в организме обследуемого в связи с циркадными ритмами, физической активностью, характером питания, изменением положения тела) и межиндивидуальных (расовые, половые, возрастные признаки, место обитания) факторов (S2биол= S2межиндивид+ S2внутрииндивид). Влияние некоторых из этих факторов, например, циркадных ритмов, физической активности, положение тела при проведении анализа может быть устранено, в частности, за счет оптимизации преаналитического этапа, поэтому их называют «устранимыми». Такие биологические факторы как пол, возраст, расовая принадлежность называют «учитываемыми».
Казалось бы следует стремиться к максимальной точности результата лабораторного исследования, однако это будет неправильно и экономически не оправдано. Необходимый уровень точности, соответствующий клиническим целям, или допустимый предел погрешности результатов лабораторных исследований должен быть установлен на научной основе. Для достижения точности, необходимой и достаточной для клинических целей, необходимо сопоставление величины аналитической вариации с биологической вариацией. Установлено, что при отношении Sан к Sбиол меньше 0,4 влияние аналитической вариации на общую будет незначительным. Существуют и другие способы определения соотношения аналитической и биологической вариаций. Например, по D. Tonks (1968), коэффициент вариации метода не должен превышать 1/8 области нормальных пределов в процентах от средней величины нормы. При этом нормальные величины рассматриваются как совокупность аналитической и биологической вариации.
Для решения вопроса о необходимой точности результата лабораторного исследования следует помнить, что в организме существует группа веществ, имеющих гомеостатическую регуляцию в узких пределах (т.е. имеющих наименьшую биологическую вариацию). К ним относятся такие вещества, как натрий, хлор, калий и другие. Понятно, что результаты определения таких веществ должны соответствовать наибольшей точности. К точности определения параметров, имеющих в норме широкую биологическую вариацию (например, концентрация креатинина, мочевины, мочевой кислоты, количество форменных элементов крови и др.) предъявляются менее высокие требования.
Ниже приведены допустимые пределы аналитической вариации в процентах для ряда веществ, принятые в Российской Федерации (таблица 3.8).
Таблица 3.8 – Допустимые пределы аналитической вариации (CV%) по основным биохимическим тестам (Меньшиков В.В., 2002)
|
Наименование показателя |
CV% |
Наименование показателя |
CV% |
|
Аспартатаминотрансфераза |
10 |
Креатинкиназа |
20 |
|
Аланинаминотрансфераза |
15 |
Лактатдегидрогеназа |
10 |
|
Альбумин |
4 |
Магний |
6 |
|
α-Амилаза |
10 |
Мочевая кислота |
7 |
|
Белок общий |
3 |
Мочевина |
10 |
|
Общий билирубин |
15 |
Натрий |
2 |
|
Глюкоза |
5 |
Триглицериды |
15 |
|
Железо |
16 |
Фосфор неорганический |
7 |
|
Калий |
4 |
Фосфатаза щелочная |
10 |
|
Кальций |
3 |
Хлориды |
3 |
|
Креатинин |
7 |
Холестерин |
7 |
Таким образом, необходимая точность определения должна устанавливаться индивидуально для каждого вещества. При этом, в зависимости от поставленной в клинике цели обследования, будут меняться и требования к точности результатов. Поэтому медицински допустимые пределы погрешностей в различных клинических ситуациях будут различными. Например, при повторном исследовании лабораторного показателя у одного и того же больного с целью оценки эффективности терапии медицински допустимые пределы погрешности будут более строгими. При диспансеризации населения, когда требуется лишь разделить норму и патологию, требования к точности могут быть снижены.
Одним из подходов для оценки медицински допустимых пределов погрешностей результатов лабораторных исследований, является сопоставление данных, полученных различными специалистами при изучении определенной патологии. Такой подход позволяет установить клинически значимый верхний и нижний пределы нормальных значений по каждому из параметров. Например, для глюкозы в сыворотке крови установлен верхний предел нормальных значений 5,7 ммоль/л, а предел, выше которого начинается, определенный вид патологии (сахарный диабет), – 6,5 ммоль/л. Величина, превышающая верхний предел нормальных значений (0,8 ммоль/л в нашем примере) является мерой медицински допустимого отклонения.
Определение медицински допустимых пределов погрешностей позволяет не добиваться большей точности, чем требуется в определенных клинических обстоятельствах, и тем самым избежать увеличения расходов на проведение анализов.
Для характеристики диагностической значимости лабораторных исследований в клинике используется ряд критериев, таких как чувствительность; специфичность; значимость; эффективность.
Диагностическая чувствительность теста (ДЧ) при каком-либо конкретном заболевании определяется как процентное выражение случаев истинно положительных результатов исследования у пациентов с этим конкретным заболеванием. В идеальных случаях чувствительность равна 100%, это означает, что у каждого пациента определяется соответствующее его заболеванию патологическое значение исследуемого параметра, то есть ложноотрицательные результаты отсутствуют. Исследованием с большой диагностической чувствительностью является определение активности аминотрансфераз при заболеваниях печени, антинуклеарного фактора при системной красной волчанке, миоглобина при инфаркте миокарда. Малая диагностическая чувствительность характерна для тимоловой пробы и определения общего белка. ДЧ не следует путать с аналитической чувствительностью (см. раздел 3.7).
Диагностическая специфичность теста (ДС) при конкретном заболевании определяется как процентное выражение случаев истинно отрицательных результатов исследования у лиц, не страдающих данным конкретным заболеванием. 100% ДС означает, что только определенные патологические состояния приводят к появлению результатов, выходящих за границы нормальных величин (отсутствуют ложно положительные результаты). Высокой ДС обладают такие тесты, как опредение антител к ДНК при системной красной волчанке, тропонина Т и I при инфаркте миокарда и др.
Диагностическая эффективность (ДЭ) определяется как процентное отношение истинных (то есть правильно отражающих состояние обследуемых пациентов) результатов исследований к общему числу исследований. Считается, что анализ, для которого высчитанная таким образом эффективность менее 80%, не является диагностически значимым. Идеальным диагностическим тестом считается тест со 100% чувствительностью и 100% специфичностью. Однако, факторы, увеличивающие рост специфичности теста, имеют тенденцию уменьшать его чувствительность и наоборот. Поэтому, как уже указывалось выше, на первом этапе обследования врач, как правило, должен выбирать более чувствительные тесты.
3.9.2. Референтные интервалы лабораторных показателей
Под «нормой» обычно понимают характеристики, соответствующие состоянию здоровья. Понятие здоровья имеет много взаимно увязанных определений, как в медицине, так и в философии, в зависимости от применяемого критерия оценки. По определению А. Д. Адо «Здоровье – это форма жизнедеятельности, обеспечивающая наиболее совершенную деятельность и адекватные условия существования». Всемирная организация здравоохранения определяет здоровье как «Состояние полного физического, духовного и социального благополучия, а не только отсутствие болезней и физических дефектов». Однако, несмотря на разнообразие факторов, определяющих состояние здоровья, одним из ключевых его критериев является соответствие физиологических параметров организма нормальным значениям. Поэтому понятие «норма» является весьма близким к понятию «здоровье» и успешно используется в клинической медицине для оценки состояния здоровья.
Следует обратить внимание, что медицинская норма является не фиксированным типичным стандартом, а скорее конкретным переменчивым оптимумом. В зависимости от целого ряда параметров, как внутренних, так и внешних, организм обладает способностью варьировать признак в определенных пределах, «приспосабливаться», что позволяет ему выживать в постоянно меняющихся условиях жизни. Параметры нормальных значений колеблются в зависимости от экологических условий, особенностей физиологических процессов в организме человека, возраста, пола, в соответствии с циркадными ритмами, физической активностью, характером питания и рядом других факторов. То есть каждый параметр имеет свои нормальные переменные пределы, которые называют референтным интервалом. Термин «референтные значения» или «референтный интервал» в современной литературе сменил ранее употребляемый термин «норма».
Установление референтных интервалов колебаний для каждого параметра внутренней среды организма имеет чрезвычайно важное значение для обеспечения клинической надежности лабораторной информации. В то же время, определение референтных интервалов представляет значительные организационные и практические трудности, в связи с необходимостью контролируемого обследования больших групп практически здоровых лиц разного возраста. Наиболее часто используются два основных подхода. Первый из них предполагает динамическое обследование людей в состоянии полного клинического здоровья, отобранных в соответствии с жесткими критериями, учитывающими влияние различных физиологических состояний, отклоняющих результаты лабораторных исследований в сторону повышения или понижения. Его недостатками является возможность реализации лишь у очень ограниченного круга пациентов, высокая стоимость и сложность проведения. Второй подход является более доступным и предполагает массовое обследование неорганизованного контингента практически здоровых лиц с последующей статистической обработкой полученных показателей. Осуществляется сбор всех результатов в памяти больничного компьютера, селекция результатов на основе отбрасывания тех из них, которые получены у пациентов с патологией, способной повлиять на показатели соответствующего теста; а затем группировка отобранных результатов по половым и возрастным группам и статистическая обработка результатов в каждой группе. Такой подход реализуется значительно легче и поэтому используется наиболее широко.
Совокупность результатов, полученных для популяций здоровых людей, может быть описана статистическими методами в следующем виде:
1. Симметричное распределение, соответствующее нормальному распределению Гаусса. Гауссово распределение означает, что в обследуемой однородной группе здоровых людей статистическая обработка результатов лабораторного исследования определенного параметра биоматериала позволяет вычислить среднюю величину и стандартное отклонение, причем в интервале M±2SD (средняя арифметическая ± 2 среднеквадратичных отклонения) окажутся примерно 95% показателей, полученных в обследуемой группе, а 5% показателей здоровых людей окажутся вне этого интервала (рисунок). Этой математической закономерности подчиняются результаты небольшой части показателей химического и клеточного состава крови.
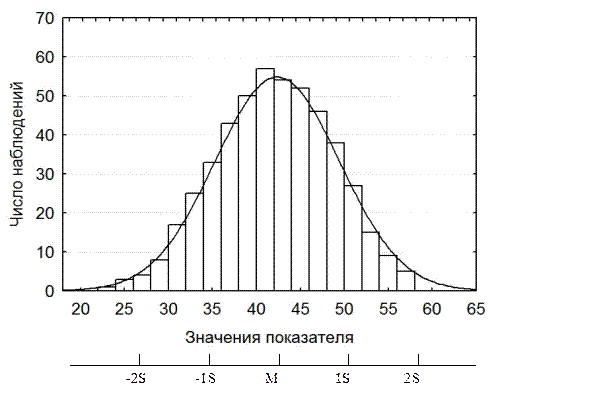
Рисунок 3.4 – Гистограмма распределения результатов определения количества Т-хелперов при обследовании здоровых лиц
Отчетливо видно, что среднее арифметическое значение (М) совпадает с медианой (центр, от которого половина значений будет меньше, а половина больше медианы). В интервале M±2SD (средняя арифметическая ± 2 среднеквадратичных отклонения) сосредоточены примерно 95% наблюдений.
2. Несимметричное распределение. Этот тип распределения называется биноминальным и требует применения непараметрических методов статистической обработки. Пример несимметричного распределения приведен на рисунке 3.5.
Рисунок 3.5 – Гистограмма распределения результатов определения количества лейкоцитов (х109/л) у здоровых лиц
Кривая линия представляет ожидаемое нормальное распределение.
Такой закономерности подчиняется большинство лабораторных параметров. Для определения интервала нормы в этих случаях наиболее часто применяют метод перцентильных границ. Весь диапазон значений разбивают на 4 интервала, получая, соответственно, 25%, 50%, 75% квантили. Внутри интерквартильного интервала (25% - 75%) лежат 50% наиболее типичных (близких к центральному) значений.
Выбор референтного интервала должен производиться, исходя из клинических соображений. Если выбрать в качестве референтного интервала интерквартильный размах (25-75%), диагностическая чувствительность теста становится выше в ущерб специфичности, так как часть результатов, попадающих в так называемую «серую зону», будут расцениваться как положительные (измененные), тогда как на самом деле могут быть и ложно положительными (рисунок 3.6). При выборе в качестве диапазона нормы границы 5-95% диагностическая специфичность повышается, то есть выход значений лабораторного параметра за указанные пределы будет более точно свидетельствовать о патологии, что позволяет произвести надежную дискриминацию показателей здорового и больного человека.
![]()
Рисунок 3.6 - Варианты выбора диапазона нормальных значений показателя
Следует помнить, что референтные колебания должны быть установлены для каждого параметра внутренней среды организма. Учитывая обилие факторов, влияющих на результат лабораторного анализа, оптимальным является установление каждой лабораторией своих референтных интервалов с учетом всех требований, предъявляемых к качеству лабораторного анализа. Это имеет существенное значение для всей проблемы надежности лабораторной информации, так как именно сравнение каждого показателя с референтным интервалом служит основанием для принятия диагностических и лечебных решений.
В клинической лабораторной диагностике используется также такое понятие как «индивидуальная норма», когда производится сопоставление результатов пациента с его же собственными параметрами, полученными в период полного здоровья. Индивидуальная норма признается наиболее удобным ориентиром для оценки состояния здоровья у каждого конкретного человека. Однако при отсутствии систематического диспансерного наблюдения за пациентом такими индивидуальными интервалами удается воспользоваться лишь в отношении очень ограниченного круга пациентов.
|
Часть 4 |
КОЛИЧЕСТВЕННЫЕ МЕТОДЫ АНАЛИЗА В КЛИНИЧЕСКОЙ ЛАБОРАТОРНОЙ ДИАГНОСТИКЕ |
4.1. Оптические методы анализа
Для измерения продуктов биохимической реакции в клинической лабораторной диагностике чаще всего используются оптические измерительные приборы. Оптический количественный анализ основывается на регистрации изменений, происходящих с лучом света при прохождении его через исследуемый раствор.
Оптические методы количественного анализа подразделяются следующим образом:
1. рефрактометрия;
2. поляриметрия;
3. фотометрия:
а) абсорбционная:
• спектрофотометрия
• нефелометрия (собственно нефелометрия и турбидиметрия)
• атомно-абсорбционная фотометрия
б) эмиссионная:
• флюориметрия
• пламенная фотометрия
• атомно-эмиссионный спектральный анализ.
Рефрактометрия базируется на измерении показателя преломления света при прохождении его через оптически неоднородные среды. Ранее метод рефрактометрии применялся в основном для определения содержания общего белка в плазме (сыворотке) крови. Поскольку преломляющая способность сыворотки зависит от уровня не только белков, но и небелковых компонентов, рефрактометрический анализ давал ложно завышенные результаты, и в настоящее время для данного анализа не применяется.
В основе поляриметрии лежит свойство прозрачных веществ вращать плоскость поляризованного луча света. Известно, что естественный, неполяризованный луч представляет собой совокупность волн, колебательные движения которых равномерно распределены вдоль множества плоскостей, проходящих через линию распространения луча. Если луч сложного (белого) света пропустить через пластинку поляроида или призму николя (кальцит), то каждая волна этого пучка разложится на составляющие, направленные по взаимно перпендикулярным осям поляроида. Так как поляризующий материал обладает способностью поглощать одну из этих составляющих, электромагнитные колебания в выходящем пучке света происходят только в одной плоскости, в связи с чем такой луч света называют плоскополяризованным. Если на его пути поместить второй поляроид, то через него подобным же образом пройдет только та составляющая луча, плоскость колебаний которой будет параллельна оси поляроида. Поскольку же в пучке поляризованного света колебания совершаются только в одном направлении, при повороте второго поляроида (анализатора) на 90 градусов мощность светового пучка падает до нуля. Поляризованный луч света будет проходить через призмы николя только в том случае, если их оси находятся в одной плоскости. Регистрации результатов производится по изменению плоскости поляризованного луча света. В современных КДЛ данный метод не нашел широкого применения.
Фотометрия – измерение интенсивности света, прошедшего через раствор. В основе всех методов фотометрии лежит закон Бугера-Ламберта-Бера, независимо от того, в какой области спектра (видимой, ультрафиолетовой или инфракрасной) выполняется измерение, а также от того, каким способом измеряется интенсивность светового потока и как проводится расчет. Закон описывает взаимозависимость между интенсивностью падающего на раствор монохроматического света и интенсивностью светового потока, выходящего из раствора:
Е = logIo/It = Сlε
Е – экстинция раствора (оптическая плотность);
Io – интенсивность падающего на раствор света;
It – интенсивность светового потока, выходящего из раствора;
С – концентрация вещества в растворе;
l – длина оптического пути (толщина кюветы фотометра);
ε – молярный показатель поглощения.
В упрощенном виде уравнение можно представить таким образом:
Е = К х С, где К – константа, являющаяся произведением коэффициента поглощения на толщину рабочего слоя; С – концентрация вещества в растворе. То есть оптическая плотность раствора при прочих равных условиях прямо пропорциональна концентрации вещества.
Следует учитывать, что эта зависимость сохраняется только при условии монохроматического света и физической однородности раствора. Она подтверждается экспериментальным путем для данного прибора и данных условий измерений и воплощается в калибровочных графиках, где на оси абсцисс откладывают известные концентрации раствора, а на оси ординат – значения экстинции. Соответствие закону Ламберта-Бера, то есть линейная зависимость, имеет место лишь на определенном участке калибровочного графика (обычно в середине, при не слишком высокой и не слишком низкой концентрации вещества). На основании калибровочного графика можно рассчитывать коэффициент пересчета (см. ниже).
Фотометрия может выполняться в различных вариантах.
Абсорбционная фотометрия – метод анализа, основанный на измерении степени ослабления монохроматического светового потока в результате избирательного поглощения света растворенным веществом. Является самым широко используемым в клинической лабораторной диагностике методом измерения результатов реакции.
Основными методами абсорбционной фотометрии являются спектрофотометрия и нефелометрия.
Спектрофотометрия (в общем смысле колориметрия) – измерение интенсивности окраски раствора анализируемого вещества относительно интенсивности окраски эталонного раствора. В работе может использоваться любая область спектра, но наиболее широко применяется ультрафиолетовый и видимый диапазон. Измерения осуществляются с помощью специальных приборов – фотометров и спектрофотометров.
Основными элементами фотометра являются источник света, монохроматическое устройство, кюветное отделение и фотоприемник (рисунок 4.1).
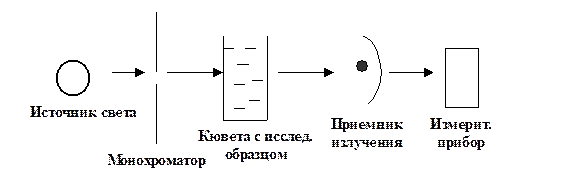
Рисунок 4.1 – Общая схема устройства фотометра (пояснения в тексте)
Источник света зависит от рабочего диапазона. В качестве источника ультрафиолетового света (длина волны менее 400 нм) обычно используется дейтериевая лампа, а в качестве источника видимого излучения – лампа накаливания. В последнее время все более широкое применение находят светодиоды – полупроводниковые устройства, излучающие монохроматический свет. Основное их преимущество – отсутствие нагревания во время работы и необходимости применения монохроматоров.
Монохроматоры служат для получения монохроматического света. В фотометрах нужные спектральные диапазоны выделяются при помощи светофильтров. Поэтому число участков спектра, в котором может проводиться измерение, равно числу светофильтров (чаще всего используются цветные стекла). В спектрофотометре участки света выделяются с помощью призм или дифракционных решеток, поэтому можно установить любую длину волны в заданном диапазоне. Дифракционная решетка представляет собой зеркало, на поверхности которого нанесены параллельные штрихи (несколько сот штрихов на миллиметр), что обеспечивает дифракцию, поэтому под определенным углом отражается только свет соответствующей длины волны. Обычно спектрофотометры – это приборы более высокого класса, в них можно выделить более узкий (монохроматический) участок спектра.
Кюветы и кюветные отделения. В кюветных отделениях для проведения измерений устанавливаются кюветы с фотометрируемым раствором. Их размещают в специальных кюветодержателях.
Современные фотометры и спектрофотометры имеют термостатированные кюветные отделения. Это позволяет проводить измерения при фиксированной температуре, что особенно важно для кинетического определения активности ферментов.
Точность фотометрии значительно возрастает, если нет необходимости каждый раз вынимать кювету для заполнения новой порцией раствора. Для этого существуют различные конструкции проточных кювет. Необходимо, однако, помнить, что количество раствора должно быть достаточным, чтобы промыть кювету.
В качестве приемника излучения для видимой и ультрафиолетовой области используются специальные фотоэлементы, для инфракрасной области – фотосопротивления. Воспринимаемый ими световой поток вызывает пропорциональный его интенсивности фототок, который измеряется специальными приборами.
Большинство фотометрических приборов устроено так, что они непосредственно указывают величину оптической плотности. Как правило, имеется возможность отсчитывать результаты и по другой шкале – в процентах поглощенного или прошедшего света относительно фоновых величин. Например, на фотоэлектроколориметре (ФЭК) шкала оптических плотностей нанесена красной краской, а шкала процентов пропускания – черной. Если оптическая плотность 1, это значит, что через раствор прошло только 10% света, а остальные 90% поглотились в нем. Для большинства приборов высокого класса это предельная величина, выше которой уже трудно получить надежные результаты.
Современные лаборатории оснащены фотометрами различной степени сложности. Наиболее широко распространены фотоэлектроколориметры и фотометры Solar. Они являются базовыми приборами в клинико-диагностических лабораториях небольшой мощности и позволяют обеспечить выполнение биохимических и коагулологических исследований. Полуавтоматические фотометры оснащаются микропроцессорами, управляющими процессами фотометрического измерения, термостатирования, расчета результатов, что значительно ускоряет и облегчает работу.
Широкое применение, особенно для иммунохимических методов анализа, получили многоканальные фотометры, работающие по вертикальной схеме. Луч света идет снизу вверх или сверху вниз. Вместо измерительных кювет в этих случаях используются прозрачные пластмассовые планшеты на 96 лунок (микрокювет).
Нефелометрия – метод анализа, связанный с оценкой степени мутности исследуемого раствора. Мутность возникает в результате взвешивания в растворителе мельчайших твердых частиц вещества, которые рассеивают лучи света, проходящего через раствор. Интенсивность рассеивания света возрастает с увеличением размера и числа рассеивающих частиц. Причем такая закономерность в сильно разбавленных растворах находится в соответствии с основным законом фотометрии, что позволяет определять концентрацию вещества по степени мутности образуемых им растворов.
В зависимости от способа регистрации луча света, проходящего через мутный раствор, нефелометрию делят на 2 вида: а) собственно нефелометрия; б) турбидиметрия.
Собственно нефелометрия предусматривает, что источник света и приемник света расположены на взаимно-перпендикулярных осях (рисунок 4.2).

Рисунок 4.2 – Общая схема нефелометрического анализа (пояснения в тексте)
При этом измеряется интенсивность светового потока, возникшего вследствие рассеяния падающего на взвесь света. Для проведения таких измерений существуют специальные приборы – нефелометры. Метод позволяет определять небольшие концентрации взвешенных частиц в слабо мутных растворах. При высокой мутности растворов возникает значительная погрешность измерения. Основным недостатком метода является влияние размеров частиц на интенсивность рассеянного света – при увеличении размеров частиц в анализируемой взвеси зависимость интенсивности анализируемого излучения от длины волны ослабляется.
Турбидиметрия предусматривает, что источник света и приемник света находятся на одной оси (схема аналогична рис. 4.1). Регистрируется световой поток, прошедший через пробу, содержащую частицы (мутный раствор), и ослабленный преимущественно вследствие поглощения и в меньшей степени рассеяния. Метод обычно используется для исследования более оптически плотных растворов (в сравнении с нефелометрией). Турбидиметрия очень широко используется в клинической биохимии. Практически все нефелометрические методы в клинике относятся к турбидиметрии (тимоловая проба, определение серомукоидов, бета-липопротеидов и др.)
Атомно-абсорбционная фотометрия – метод определения состава вещества в газовом или плазменном состоянии по интенсивности спектрального поглощения света атомами и молекулами анализируемого вещества. В основу его положено известное физическое явление, заключающееся в том, что, если атомное облако облучать светом, то происходит абсорбция этого излучения на частотах, характерных для данного вещества. Причем эта абсорбция в значительной степени подчиняется закону Бугера-Ламберта-Бера. Поэтому измеряя интенсивность и спектр светового потока, прошедшего через атомный пар, а не жидкость, как при обычной фотометрии, можно измерить концентрацию интересующего элемента в жидкости, веществе или газе.
Атомно-абсорбционная спектрофотометрия позволяет обеспечить высокую чувствительность, проводить анализ микроколичеств вещества в жидком, газообразном и твердом состояниях. Недостаток метода – высокая стоимость аппаратуры, ее громоздкость, сложности с эксплуатацией. Поэтому атомно-абсорбционные анализаторы используются в медицине, в основном, при проведении научных исследований.
Эмиссионная фотометрия – это метод анализа, основанный на измерении энергии, излучаемой веществом при переходе из энергетически возбужденного состояния в невозбужденное. Энергетическое возбуждение (метастабильное состояние) вещества может быть достигнуто с помощью различных воздействий:
· при облучении интенсивным световым потоком из внешнего источника при комнатной температуре (флюориметрия)
· в результате химической реакции (хемилюминесценция)
· за счет кинетической энергии теплового движения при высокой температуре пламени (пламенная фотометрия).
Флуориметрия выполняется на специальных аппаратах – флуориметрах, которые производят измерение интенсивности флуоресценции (рисунок 4.3).
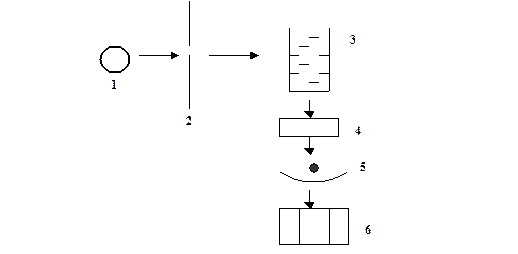
Рисунок 4.3 - Схема устройства флюориметра
1) источник света возбуждения; 2) монохроматор (светофильтр) света возбуждения; 3) кювета с исследуемым раствором; 4) монохроматор света флуоресценции; 5) детектор; 6) измерительный прибор.
Для возбуждения исследуемого вещества чаще всего используется жесткое коротковолновое облучение (ультрафиолетовые лучи). В ряде методик в аналитическую систему специально добавляются флуоресцирующие вещества – флуорохромы. Из флуоресцирующих веществ в клинической лабораторной диагностике наиболее часто используются карбоциклические органические красители (акридиновый оранжевый, флуоресцеинизотиоцианат – ФИТЦ, пропидиум иодид, этидиум бромид и др.), а также редкоземельные металлы, относящиеся к группе лантанидов. Спектры абсорбции (а, следовательно, и возбуждения флуоресценции) большинства флуоресцирующих веществ лежат в области 300-550 нм. Это позволяет использовать в качестве источников света яркие лампы с широким спектром (ксеноновую, кварцевую или галогеновую).
По чувствительности флуориметрия намного выше колориметрических методов (в 100-1000 раз). Однако именно с высокой чувствительностью связаны недостатки метода – прежде всего, необходимость предварительной очистки исследуемого раствора от примесей, которые вносят фоновые искажения. Поэтому в клинических лабораториях данный метод используют не слишком широко (например, для определения катехоламинов – адреналина, норадреналина, диоксифенилаланина).
Хемилюминесценция основана на измерении энергии молекул, перешедших в возбужденное состояние в результате химической реакции. Этот принцип широко используется в иммунохимических исследованиях для детекции ферментных меток. Она значительно чувствительнее и удобнее колориметрической или флуоресцентной детекции. Основными хемилюминесцентными метками служат сульфонамиды и эфиры акридина, а для инициации их свечения используют смесь перекиси водорода и гидроокиси натрия (окислители).
Пламенная фотометрия использует в качестве энергетического агента, вызывающего состояние возбуждения исследуемого вещества, пламя газовой горелки. Ионы металлов окрашивают пламя в различный цвет, в соответствии с характерными для них спектрами испускания. Для выделения излучения отдельных ионов применяют специальные светофильтры (рисунок 4.4).
В клинических лабораториях пламенную фотометрию применяют в основном для определения концентрации ионов калия и натрия, так как для возбуждения этих ионов достаточно энергии низкотемпературного пламени сгорания метана в воздухе. Пламенная фотометрия является высоко чувствительным методом исследования, однако его широкое применение значительно ограничивается необходимостью газового оборудования. Поэтому в современной клинической лаборатории эти методы заменяют на ионоселективные и потенциометрические (см. раздел 2.7.1).
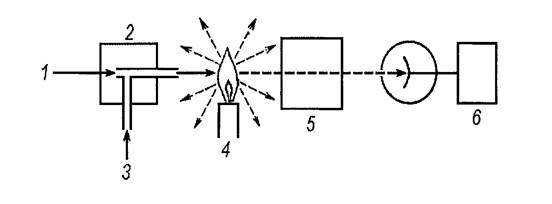
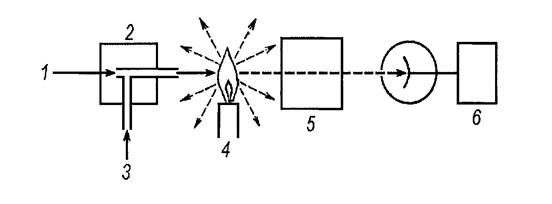
Рисунок 4.4 – Схема пламенной фотометрии
1) поток воздуха от компрессора; 2) распылитель; 3) образец; 4) горелка; 5) монохроматор; 6) измерительный прибор.
Атомно-эмиссионный спектральный анализ позволяет определять отдельные элементы в биологическом материале при возбуждении атомной флуоресценции с помощью соответствующего источника. После переведения пробы в атомарное состояние излучение от внешнего источника поглощается атомами исследуемого вещества, которые переходят в возбужденное состояние, а часть из них начинает флуоресцировать. Интенсивность флуоресценции пропорциональна концентрации исследуемых компонентов пробы. В клинико-диагностических лабораториях метод практически не используется в связи со сложностью исследований и дороговизной оборудования.
4.1.1. Основные условия измерений при работе с фотометрической аппаратурой
1. Материал оптической кюветы и толщина рабочего слоя. Оптическая плотность вещества в растворе находится в прямо пропорциональной зависимости от толщины рабочего слоя, то есть чем толще рабочий слой кюветы, тем выше будет оптическая плотность измеряемых в ней растворов вещества. Поэтому при расчете результатов фотометрии толщина рабочего слоя (так называемая «длина оптического пути») должна обязательно учитываться. При проведении измерения в видимом спектре применяют оптические кюветы из обычного стекла, с толщиной 5, 10, редко 3 мм. Оптимальным в смысле чувствительности, точности и удобства работы оказываются кюветы с длиной оптического пути 1 см, что и реализовано в большинстве фотометров.
Для измерений в ультрафиолетовой области спектра используется материал, не поглощающий ультрафиолетовые лучи – увиолевое, реже кварцевое стекло, толщина кюветы 10 мм.
2. Длина световой волны. Как правило, для фотометрии выбирается та область спектра, где поглощение анализируемого вещества максимально. Это увеличивает точность количественного измерения и повышает его чувствительность. С другой стороны, учитывается возможность адсорбции света холостой пробой (реактивом сравнения). Для уменьшения интерференции посторонних веществ производят вычитание значений холостой пробы из опытной (холостая проба содержит то же, что и опытная, за исключением анализируемого материала).
В рутинной клинической практике необходимая для осуществления той или иной методики длина волны указывается в описании к выполнению метода и зависит, в первую очередь от физико-химических свойства исследуемых растворов. Визуально они могут быть: а) прозрачные неокрашенные; б) мутные неокрашенные; в) прозрачные окрашенные. Вариант «мутные окрашенные» растворы в строгом смысле исследованию не подлежит.
Прозрачные неокрашенные растворы фотометрируют обычно в ультрафиолетовом диапазоне (например, определение содержания молекул средней массы в сыворотке или плазме крови).
Мутные неокрашенные растворы подлежат нефелометрическому (турбидиметрическому) анализу. Наиболее часто используется длина волны 540 нм (зеленый светофильтр) или 640 нм (красный светофильтр).
Если в результате биохимических реакций получают прозрачные окрашенные растворы, то концентрацию веществ определяют колориметрически. Используемая при этом длина волны обусловлена принципом дополнительности цветов исследуемого раствора и светофильтра. Например, для растворов, окрашенных в желтый цвет, используется синий светофильтр (440 нм); для растворов синего цвета – желтый (590нм), иногда красный – 640 нм.
Справка: видимая область спектра – 400-700 нм;
более 700 нм – инфракрасная (в КДЛ практически не используется);
300-400 нм – УФ длинноволновая;
220-300 нм – УФ коротковолновая.
3. Оптическая плотность исследуемого раствора. Если оптическая плотность исследуемого раствора слишком высока, то количество прошедшего через него света соответственно уменьшается и, следовательно, может плохо улавливаться фотоприемником, что резко увеличивает погрешность измерения. Работа с растворами, имеющими слишком низкую оптическую плотность, тоже может увеличивать погрешность измерения, так как закон Ламберта-Бера в таких условиях не выполняется. Поэтому при налаживании методики анализа важно выбрать условия измерения, обеспечивающие максимальную точность.
4.1.2. Способы измерений, расчета и представления результатов фотометрии
Способы измерений результатов реакции при проведении фотометрических исследований в клинических лабораториях:
· по конечной точке
· по фиксированному времени
· кинетически
Определение по конечной точке состоит в учете образования продукта за некоторое время (необходимое для того, чтобы реакция произошла). Расчет результатов производится по стандарту. Такой подход используется, например, для определения альбумина биуретовым методом, глюкозы глюкозооксидазным методом и т.д.
Оценка результатов по фиксированному времени предполагает установление количества нарабатываемого (или расходуемого) продукта за определенное (фиксированное) время с последующим расчетом концентрации по стандарту. Примером может служить определение мочевины уреазным методом.
Кинетический метод исследования, как правило, является ферментативным. Он требует применения специальных термостатируемых кювет для поддержания постоянной температуры анализируемой жидкости. В образце производят измерение оптической плотности в ходе реакции через определенные промежутки времени. Из полученных значений рассчитывают среднюю величину изменения абсорбции (∆) и с использованием определенных (соответствующих температуре инкубации) коэффициентов производят расчет результатов. Такой подход является оптимальным, особенно при определении активности ферментов.
Расчет результатов фотометрических измерений производится следующими основными методами:
1. Условные единицы (у.е.).
Это фактически непосредственное выражение единиц оптической плотности исследуемого раствора. Для удобства единицы оптической плотности умножают на коэффициент 100 или 1000 для выражения у.е. в больших целых числах. Например, сиаловые кислоты 130-200 у.е. соответствует коэффициенту экстинции 0,13-0,20, умноженному на коэффициент 1000.
2. Расчеты результатов исследований по стандартным (эталонным) растворам. Эталонные растворы обрабатываются параллельно с серией исследуемого биоматериала и находятся в тех же условиях, что исследуемый материал. Недостаток – повышенный расход реактивов и рабочего времени. Рациональность применения стандартных растворов определяется рамками реальной необходимости. Требуется строго подходить к подготовке эталонного раствора: из реактива квалификации не менее «хч», взвешивание на аналитических весах с высокой точностью (для флуориметрии, а для колориметрии можно на торсионных), растворение в мерной колбе. Концентрация вещества в эталонном растворе должна быть близка к нормальным значениям данного показателя в организме. Расчет исследований по стандартным растворам производится по способу простой арифметической пропорции: стандарт умножить на пробу разделить на стандарт.
3. Расчет результатов по калибровочному графику. Недостаток –ограниченное количество методик со стабильными условиями проведения и с хорошим подчинением результатов основному закону фотометрии. Тем не менее данный подход является одним из самых распространенных способов расчета результатов.
Калибровочные графики строятся для каждого фотометра отдельно. Перенос на другой аппарат недопустим даже в случае использования однотипных фотометров, так как у каждого аппарата свои технические особенности. Калибровочные графики проверяются не реже 1 раза в год.
Для построения калибровочного графика проводят исследование серии стандартных растворов, различающихся между собой концентрацией. Диапазон концентраций должен охватывать как значение физиологической нормы, так и наиболее вероятные пределы патологии для данного исследуемого компонента. Для приготовления стандартных растворов навески берутся только на аналитических весах, обязательно в параллелях (для снижения вероятности ошибок, связанных с погрешностями взвешивания), растворяются в мерной колбе.
Калибровочный график должен содержать:
¨ название метода исследования,
¨ заводской номер фотометра, к которому построен график,
¨ указать длину световой волны, толщину слоя кюветы,
¨ исходные данные для построения,
¨ дата построения.
4. Расчет результатов исследований с помощью коэффициента пересчета. Является наиболее простым и быстрым. Используется формула: С = F х Е, где С – концентрация исследуемого компонента, F – коэффициент пересчета, Е – экстинция. Недостаток данного подхода как в п. 3.
Коэффициент пересчета является величиной специфической для каждого отдельного теста и обычно указывается в описании метода исследования. Коэффициент можно рассчитывать самому на основании исследования стандартных растворов, но обязательно с выполнением методических требований, аналогичных таковым при исследовании биологического материала. За основу можно взять ранее построенный калибровочный график. Коэффициент требует проверки не реже 1 раза в год. Коэффициенты пересчета используются в анализаторах. Они вводятся в память компьютера и выдаются автоматически.
4.2. Иммунохимические методы анализа в клинической лаборатории
Иммунохимические методы исследований – методы, основанные на специфической реакции взаимодействия антигена с антителом. В связи с отличными аналитическими характеристиками (высокая чувствительность и специфичность) иммунохимические методы используются в ситуациях, когда необходимо определить концентрации веществ, содержащихся в очень низких концентрациях в биологическом материале. Так, они широко применяются для определения опухолевых маркеров, гормонов, цитокинов, лекарственных веществ и т.д.
Принципиальная схема иммунохимического анализа:
AГ + AТ = комплекс AГ-АТ
Целью анализа может быть детекция антигена в биоматериале, либо детекция антител. В первом случае тест-система должна иметь в своём составе соответствующее антитело (например, для определения концентрации дигоксина надо иметь в тест-системе антитела к нему). Во втором случае тест-система должна содержать в своём составе соответствующий антиген (например, для определении антител к НbSAg в тест системе должен содержаться синтетический HbSAg).
Для проведения иммунохимических реакций могут использоваться моноклональные или поликлональные антитела. Поликлональные антитела являются производными нескольких клеточных клонов и направлены против разных эпитопов одного и того же антигена. Их получают путем иммунизации животных антигенами.
Моноклональные антитела направлены к определенному эпитопу антигена. Они вырабатываются одним клоном, являющимся потомством одной исходной клетки. Моноклональные антитела обладают высокой специфичностью действия, поэтому их применение в иммунохимических анализах является предпочтительным. Их искусственно получают в лабораториях с использованием гибридомной технологии.
Гибридомы представляют собой клоны клеток, полученных путем слияния антителообразующей клетки человека с опухолевыми клетками. Гибридная клетка получает от антителообразующей клетки способность продуцировать иммуноглобулины, а от опухолевой клетки – способность к самоподдержанию и неограниченному росту. Такая гибридная клетка, помещенная в питательную среду, размножается и вырабатывает в надосадочную жидкость антитела. В процессе культивирования проводят постоянный контроль антител на специфичность иммунохимическими методами. Полученные антитела являются молекулярно однородными и доступными для получения в относительно больших количествах.
В зависимости от технологии выполнения все иммунохимические методы подразделяются следующим образом:
1. Гомогенный иммунохимический анализ
Исследуемый образец смешивается с необходимыми реагентами. Об образовании комплекса АГ-АТ судят по появлению новых свойств метки (например, потеря активности). В процессе выполнения тестов, основанных на технологии гомогенного иммуноанализа, отсутствуют процедуры разделения между несколькими реакционными стадиями, что является их главной отличительной особенностью. Данные тесты выполняются относительно быстро.
2. Гетерогенный иммунохимический анализ
В этих методах один из компонентов реакции (антиген или антитело) фиксирован на твёрдой фазе. В процессе реакции, фиксированные антитела (или антигены) связываются с молекулами исследуемого антигена (или антител) пробы или с реагентом. Избыток реагентов или не связавшихся с фиксированными антителами антигенов пробы удаляют из реакционной смеси в процессе стадии отмывки, после которой детектируется меченый реагент, связанный с фиксированными на твёрдой фазе антителами. Следует отметить, что, благодаря стадии отмывки, представляется возможность устранить влияние на процесс анализа различных компонентов, содержащихся в исследуемой пробе. Таким образом, гетерогенные иммунохимические методы позволяют определять вещества в очень низких концентрациях. Технологические приёмы, используемые при постановке различных тестов, в основе которых лежит технология гетерогенного иммунохимического анализа, многообразны. Наиболее часто используют два основных подхода – конкурентный и неконкурентный иммуноанализ.
Конкурентный иммуноанализ (конкурентное связывание, сатурационный анализ) – вид исследования, основанный на конкурентном связывании некоторых веществ (лигандов) с анализируемым веществом и его меченым аналогом, добавленным извне. Они конкурируют за лиганд, который используется в таком количестве, чтобы его связывающая способность полностью насытилась (рисунок 4.5).
![]()
Рисунок 4.5 – Схема конкурентного иммунохимического анализа.
Антитела связаны с твердой фазой. На первом этапе фиксированные АТ инкубируют с анализируемым антигеном (сыворотка больного) и строго определенным количеством стандартного меченого АГ, которые конкурируют между собой за связывание с АТ. Несвязавшиеся антигены удаляют отмывкой (2). В результате реакции количество меченого антигена, связавшегося с фиксированными АТ обратно пропорционально концентрации исследуемого антигена пробы (3).
Исследование можно проводить и в другом варианте, когда с твердой фазой связан антиген. При этом на первом этапе реакции добавляют меченые АТ и исследуемую пробу (исследуемый антиген). Связывание меченых АТ с фиксированным на твердой фазе антигеном конкурентно тормозится тестируемым антигеном. Несвязавшиеся АГ и АТ удаляют отмыванием, а образовавшиеся на твердой основе комплексы АГ-АТ визуализируют в зависимости от типа метки (ферментная, радиоактивная и др.). Учет реакции аналогичен вышеописанному – чем выше в пробе пациента концентрация исследуемого антигена, тем ниже количество меченых антител связывается с адсорбированными на твёрдой фазе антигенами.
Конкурентный метод используют для детекции веществ, содержащихся в пробе в низких концентрациях, таких как кортизол, тироксин (Т4) ,лекарственные вещества (дигоксин и др.). Диапазон детекции – от 10-6 до 10-12 моль/л.
Сэндвич-метод применяется для определения концентрации субстратов с высокой молекулярной массой, являющихся достаточно большими для связывания по крайней мере с двумя антителами. Технология этого теста предусматривает использование двух антител, одно из которых связано с твёрдой фазой, а другое содержит ферментную метку (рисунок 4.6). В клинической практике данный подход используется для определения концентрации белковых гормонов, таких как ТТГ; опухолевых маркёров (раково-эмбриональный антиген), а также определения инфекционных маркёров (НвSАg и др.). Диапазон детекции от 10-8 моль/л до 10-13 моль/л.
А В
Рисунок 4.6- Схема иммунохимического анализа типа «сэндвич»
А – вариант метода с фиксированными на твердой фазе АТ. На первом этапе фиксированные АТ инкубируют с исследуемой пробой, содержащей антиген (например, сывороткой больного). Несвязавшийся антиген удаляют отмыванием (2) и добавляют меченые специфические антитела (3), избыток которых также удаляется отмыванием. В результате реакции количество меченых антител, связавшихся с твердой фазой, прямо пропорционально количеству антигена в анализируемой пробе.
В – вариант метода с фиксированным на твердой фазе стандартным антигеном. На первом этапе производят инкубацию с исследуемым материалом, содержащим искомые АТ. Несвязавшиеся АТ удаляют отмыванием (2). Добавляют меченые АТ против иммуноглобулинов человека, избыток которых удаляют отмыванием (3) и производят учет результатов в зависимости от используемой метки. Количество АТ в исследуемом материале прямо пропорционально концентрации меченых продуктов реакции.
3. Иммунохимические методы на основе диффузии и электрофореза
В процессе иммунодифузии растворённый антиген и растворённое антитело взаимодействуют между собой с образованием нерастворимого комплекса АГ-АТ (преципитат). Детекцию можно проводить либо визуально, либо при помощи специальной измерительной аппаратуры. При этом следует отметить, что здесь очень большое значение имеет точность в соотношении концентраций между антигенами и антителами. Согласно закономерности Гейдельберга-Кенделла (рисунок 4.7), видимая преципитация с образованием крупных комплексов возможна только при определенном (эквивалентном) соотношении концентраций антигена и антител.
А В С
Рисунок 4.7 – Кривая Heidelberger-Kendall
Антитела обычно бивалентны, то есть имеют два участка связывания с соответствующим антигеном. Антигены, в свою очередь, имеют много участков связывания с АТ (то есть мультивалентны). В условиях избытка АТ (зона А), они стремятся занять все участки связывания на молекуле антигена. При этом количество молекул антител, соединяющих между собой в виде ”мостика” две молекулы антигена, является низким, преципитация мало выражена, измерительный сигнал низкий.
В зоне эквивалентности (зона В) в реакционной смеси количество участков связывания для антител в молекулах антигенов сравнимо с количеством мест связывания антигенов в молекулах антител, поэтому перекрёстное связывание АГ-АТ достигает максимума. В результате формируются большие иммунные агрегаты и измерительный сигнал максимальный.
В зоне избытка антигена (зона С) в реакционной смеси каждая молекула антигена стремится к взаимодействию с двумя свободными (не входящими в состав иммунопреципитата) молекулами антител, предотвращая тем самым процесс перекрёстного взаимодействия между ними (избыток антигена как бы «растаскивает» сетку иммунопреципитата на отдельные компоненты).
Реакция иммунопреципитации может происходить не только в жидкостях, но и в гелях. Пассивная иммунодифузия антигена и антитела может быть активизированна при помощи различных электрофоретических методик (см. раздел 4.3.2).
4.2.1. Способы детекции результатов иммунохимической реакции
Способ измерения результатов иммунохимической реакции зависит от характеристик антигена (размеры, количество, структура) и антител (авидность, специфичность). Возможны следующие варианты:
1. Прямая детекция – результат реакции можно наблюдать визуально. Примером может служить радиальная иммунодиффузия. Она основана на том, что расстояние, на которое передвигается антиген, взаимодействующий с антителом в геле, зависит от концентрации антигена (см. ниже). Для оценки концентрации анализируемого вещества измеряется диаметр окружности преципитата.
2. Непрямая детекция используется, когда прямая визуализация реакции невозможна (результат невидим). Но если лиганд связан с твердой фазой, то реакция становится видимой (пример – латексная агглютинация). Количественная оценка реакции осуществляется путем измерения степени мутности раствора (турбидиметрия).
3. Детекция на основе меченого антигена или антитела (immunoassay) применяется для обнаружения и определения антител (или антигенов) в низких концентрациях. Один из компонентов реакции (антиген или антитело) соединяют с веществом-меткой. В зависимости от применяемой метки количественный учет результатов реакции может быть различным:
· Фотометрия используется, например, при проведении иммуноферментного анализа. В результате фермент-субстратного взаимодействия образуется окрашенный раствор, который фотометрируется с помощью специальных вертикальных фотометров.
· Детекция флуоресценции основана на том, что один из компонентов реакции (антиген или антитело) метят специальными веществами (флюорофорами), которые при воздействии на них внешнего излучения возбуждаются и при переходе к покоящемуся состоянию испускают энергию в виде фотонов. Реакция регистрируется при помощи флюориметра.
· Детекция люминесценции основана на введении в реакцию АГ-АТ химических веществ (люминофоров), которые в процессе реакции окисления испускают свет определенной длины волны. Реакция окисления люминофоров может ускоряться определёнными медиаторами, такими как ионы металлов (хемилюминесценция), ферментами (биолюминесценция). Продуцируемый световой поток регистрируется при помощи люминометра.
· Детекция радиоактивности основана на использовании в качестве меток в реакции АГ-АТ радиоактивных изотопов (например, I125, I131), которые в течение определенного промежутка времени распадаются с испусканием радиоактивной энергии (бета или гамма излучения). Реакция регистрируется при помощи бета, либо гамма счетчиков.
4.2.2. Краткий обзор некоторых иммунохимических тестов
Традиционный турбидиметрический тест
Может использоваться, если результатом взаимодействия АГ и АТ является появление мутности раствора (реакция преципитации). Степень мутности определяется турбидиметрически или нефелометрически. Метод применяется для определения концентрации белков, содержащихся в биологических жидкостях человека в достаточно высоких концентрациях (сывороточные иммуноглобулины классов А, М, G; компоненты комплемента – C3,C4; С-реактивный белок; трансферрин; аполипопротеины). Диапазон детекции – от 10-3 до 10-8 моль/л. Преимуществами этих тестов является возможность выполнения с использованием обычных фотометров, но при этом легкая адаптация к биохимическим анализаторам, быстрота выполнения
Латекс-тест. Принцип метода заключается в том, что на частицах латекса (диаметр от 15 до 600 нм) неспецифически адсорбированы антитела. При добавлении исследуемого материала (в случае наличия соответствующего антигена) происходит агглютинация частиц. Учет реакции может быть качественным (есть агглютинация или нет), полуколичественным (разводят сыворотку физиологическим раствором и учитывают максимальное разведение, при котором еще наступает агглютинация) или количественным (измеряется степень мутности пробы турбидиметрически, а затем концентрация анализируемого вещества рассчитывается при помощи калибровочной кривой).
Латексный турбидиметрический тест используется в случаях, когда анализируемое вещество содержится в пробе пациента в концентрациях ниже 10-6 моль/л и называется в международной практике Latex Particle enhanced ImmunoAssay (LPIA). Используется для детекции белков, содержащихся в биоматериалах в низких концентрациях (ревматоидный фактор, антистрептолизин-О, ферритин). Диапазон детекции 10-5 до 10-11 моль/л.
Преимущества метода:
· бόльшая чувствительность по сравнению с традиционным турбидиметрическим тестом;
· быстрое выполнение теста.
Среди недостатков метода можно отметить ограниченную чувствительность.
Флуоресцентный поляризационный иммуноанализ (Fluorescence-Polarization Immuno- Assay(FPIA)
Это конкурентный тест, в котором искусственный антиген метят флуорофором (например, флуоресцеином), а свечение возбуждают поляризованным светом. Степень поляризации испускаемого света зависит от скорости вращения флюоресцентной метки в реакционной смеси. Если за время, прошедшее между поглощением возбуждающего света и его испусканием, молекула флюорофора не изменила своего положения в пространстве, тогда свет флюоресценции будет поляризован в той же плоскости, в которой поляризован и возбуждающий свет. Связывание меченого антигена с антителами препятствует вращению (то есть изменению местоположения) флюорофора в пространстве. После добавления пробы (исследуемого антигена) к этим реагентам, завершения иммунологической реакции и достижения между ними равновесного состо- яния реакционную смесь облучают поляризованным светом. Поскольку впоследствии измерение интенсивности флюоресцирующего света осуществляется в плоскости, перпендикулярной относительно плоскости поляризации возбуждающего света, детектируются молекулы свободного меченого флюорофором антигена, а молекулы меченого антигена, входящие в комплекс с антителом, не детектируются, поскольку весь излучаемый ими свет флюоресценции поляризован в той же плоскости, что и возбуждающий свет. Значения поляризации пересчитываются в концентрации при помощи калибровочной кривой.
Тест используется для детекции веществ с низкой молекулярной массой – гормонов (T4, кортизол и др.) и лекарственных веществ (теофиллин, фенитоин и др.). Диапазон детекции - от 10-4 до 10-10 моль/л. Недостатком технологии является невозможность адаптации к биохимическим автоанализаторам, а также ограниченность применения (только для низкомолекулярных веществ).
Радиальная иммунодифузия (рисунок 4.8)
Служит методом количественного определения белков, например, содержания иммуноглобулинов классов А, М, G в сыворотке крови. Диапазон детекции – от 10-3 до 10-7 моль/л.
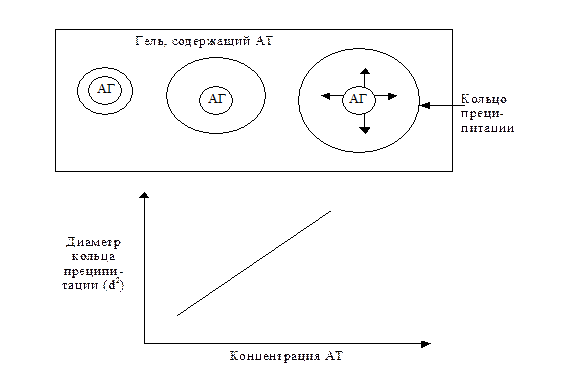
Рисунок 4.8 – Схема реакции радиальной иммунодиффузии
Исследуемая проба (антиген – АГ) вносится в лунки геля, содержащего антитела, и диффундирует в нём по окружности. Концентрация внесённого в лунку антигена снижается по мере диффузии его в гель. В точке эквивалентности концентрации АГ и АТ формируются нерастворимые иммунные комплексы в виде кругов преципитации. Чем больше присутствует исследуемого вещества, тем дальше оно успевает продиффундировать, следовательно, тем больше диаметр кольца преципитации (верхняя часть рисунка). Концентрация исследуемого антигена устанавливается при помощи калибровочной линии, полученной при измерении диаметров колец, образуемых стандартным материалом с известной концентрацией антигена (нижняя часть рисунка).
Преимуществами данной технологии является простота, относительно низкая стоимость. Недостатки – большая продолжительность процесса преципитации (для определения сывороточных иммуноглобулинов – 24-72 часа), отсутствие возможности автоматизации, трудоемкость, субъективность оценки (особенно в измерении кольца преципитации), ограниченная чувствительность.
Тесты, основанные на принципе агглютинации
Агглютинация – процесс агрегации и осаждения различных частиц, суспензированных в водной среде. Оценка реакции осуществляется визуально. В качестве частиц-носителей используют латекс, бактерии или эритроциты, связанные с антигенами или антителами. В случае присутствия в исследуемом биологическом материале соответствующих антител или антигенов происходит образование конгломератов частиц. Тесты могут выполняться в пробирках либо на плоской поверхности. В клинической практике тесты агглютинации используются для определения ревматоидного фактора, С-реактивного белка, антистрептолизина-О и других веществ. Преимуществами технологии являются простота, быстрота выполнения и экономичность. Недостатки – относительно низкая чувствительность, невозможность автоматизации, субъективность оценки результатов, ограниченная область применения.
Тесты, основанные на технологии торможения процесса гемолиза
В качестве примера таких тестов приводим реакцию связывания комплемента (рисунок 4.9).

Рисунок 4.9 – Схема реакции связывания комплемента
Как видно из рисунка, кроме АГ и АТ в реагирующую смесь вводится третий компонент – комплемент, который способен связываться с комплексом АГ-АТ. Для обнаружения связывания комплемента используют дополнительную индикаторную гемолитическую систему – эритроциты барана, обработанные антисывороткой к эритроцитам барана. Лизис эритроцитов возможен только при наличии комплемента. Если антиген-диагностикум и исследуемые антитела (сыворотка больного) не образуют комплексов АГ-АТ, комплемент остается свободным и вызывает лизис эритроцитов (верхний рисунок). Если в опытной системе образовался комплекс АГ-АТ, который связал комплемент, лизиса эритроцитов в индикаторной гемолитической системе не наблюдается. При этом реакция связывания комплемента считается положительной (нижний рисунок).
Преимуществами данной технологии является простота, быстрота и экономичность, а недостатками – невозможность автоматизации, только полуколичественная оценка результатов, ограниченная область применения.
4.2.3. Радиоиммунологический анализ
Радиоиммунологический анализ применяется с исследовательскими целями с 1960 г. Характерной чертой радиоиммунологических методов является сочетание специфичности, свойственной реакциям АГ-АТ, с простотой и высокой чувствительностью определения, которые дает применение радиоактивных изотопов, введенных в состав АГ или АТ. Существующие методические варианты постановки РИА очень многообразны (конкурентные тесты, сэндвич-тесты, методы двойных АТ).
Радиоиммунологическое определение состоит из четырех основных этапов: инкубации, разделения, радиометрического исследования и учета результатов. Инкубация осуществляется при различных температурных режимах. Длительность ее зависит от молекулярной массы реагирующих антигенов и температуры, при которой происходит реакция. Для антигенов с малой молекулярной массой (тироксин, трийодтиронин, кортизол) время инкубации составляет от 30 минут до 2 ч; для антигенов с большой молекулярной массой (соматотропин, тиротропин и др.) – 24 ч. Если инкубация проводится при комнатной температуре, этот процесс сокращается, при низкой температуре (4°С) – удлиняется. На втором этапе комплекс «антиген—антитело» отделяется от непрореагировавших компонентов и подвергается радиометрическому исследованию. Для этого используют сцинтилляционные счетчики. Гормоны белковой и пептидной природы, содержащие аминокислоты тирозин и гистидин, обычно метят 125I, который обладает достаточно длительным периодом полураспада (60 сут) и низкоэнергетическим гамма-излучением. Антигены, не содержащие указанных аминокислот, обычно метят по тритию, являющемуся источником чистого бета-излучения с очень низкой энергией и длительным периодом полураспада (12 лет).
Один из наиболее простых вариантов применения радиоиммунологических исследований – радиоаллергосорбентный тест (РАСТ), приведен на рисунке 4.10.
![]()
Рисунок 4.10 – Принцип радиоаллергосорбентного теста
Аллерген химически связан с планшетом (нитрат целлюлозы или агарозные шарики). При добавлении сыворотки пациента специфический IgЕ связывается с иммобилизованным аллергеном. Несвязавшиеся ингредиенты удаляются промывкой. Затем добавляется радиоактивно-меченый антииммуноглобулин, который прикрепляется к специфическому IgЕ, уже связавшемуся с аллергеном. Концентрация специфического IgЕ в крови пациента определяется по количеству радиоактивной метки.
В настоящее время радиоиммунологический анализ широко используется для количественного определения гормонов, онкомаркеров, фармацевтических препаратов, иммуноглобулинов, инфекционных антигенов и т.д. с целью диагностики и контроля самых различных патологических состояний (онкология, инфекционные болезни, аллергия, эндокринные нарушения).
4.2.4. Иммуноферментный анализ
Иммуноферментный анализ (ИФА) основан на том же принципе, что и радиоиммунный анализ, только вместо радиоактивной метки применяется ферментная. Метод предложен в начале 70-х годов тремя независимыми группами исследователей: Engvall и Perlmann в Швеции, van Weemen и Schuur в Нидерландах и Rubenstein с соавт. в США. По превращению субстрата ферментом можно судить о количестве вступившего во взаимодействие компонента реакции АГ-АТ. Методы ИФА обладают очень высокой чувствительностью, позволяя определять минимальные количества вещества (нанограммы).
Гомогенный вариант ИФА используется для определения низкомолекулярных субстанций (гаптены), например, для детекции лекарственных препаратов (теофиллин фенитоин), наркотических веществ. Диапазон детекции от 10-4 до 10-9 моль/л. В основе лежит ингибирование активности фермента (например, глюкозо-6-фосфат дегидрогеназы) при соединении его с гаптеном (активность фермента восстанавливается в результате реакции АГ-АТ) либо, наоборот, потеря активности маркерного фермента в результате реакции АГ-АТ. Активность фермента пересчитывается при помощи калибровочной кривой в концентрацию исследуемого антигена пробы.
В гетерогенных вариантах ИФА АГ или АТ фиксируется на твердой фазе (как правило, пластик), а непрореагировавшие компоненты реакции удаляются многократным отмыванием. Схема постановки гетерогенного ИФА (конкурентные и неконкурентные методы) в целом соответствует приведенным на рисунках 4.5 – 4.6 Отличие заключается в том, что после последнего этапа проводится ферментативная реакция. Учет реакции осуществляется по изменению интенсивности окраски раствора с использованием калибровочной кривой. Наиболее часто применяемые в качестве метки ферменты приведены в таблице 4.1.
Таблица 4.1 - Ферменты-маркеры, наиболее часто используемые в ИФА
|
Фермент |
Субстрат и индикатор реакции (хромоген) |
Реагент, останавливающий реакцию |
Длина волны для оценки реакции |
|
Пероксидаза
|
Н2О2 орто-дианизидин (или ортофенилендиамин) |
HCl 5 M Na2SO4 2 M |
535 нм
|
|
2,2–азино-диэтилбензтиазолин-сульфат (АБТС) |
NaOH 1 М |
405 нм
|
|
|
Щелочная фосфатаза |
Пара-нитрофенилфосфат |
NaOH 1 М |
402 нм |
|
Глюкозооксидаза
|
Н2О2 (пероксидаза) о-дианизидин или АБТС |
Н2SO4 0,5 M |
405 нм |
В качестве твердой фазы для ИФА применяют такие материалы как полистирол, поливинилхлорид, полипропилен, полиакриламид и др. Твердая фаза может быть использована в виде пробирок, планшетов, бусин, шариков, гранул, пленок. Необходимым прибором для ИФА является фотометр (при постановке реакции в планшетах – вертикальный). Воспроизводимость результатов ИФА зависит от ряда факторов, в том числе условий измерения, оптимизации фермент-субстратного взаимодействия, толщины слоя и поглощающих свойств анализируемых растворов. Негомогенность материала планшетов (неконтролируемый фактор) отрицательно влияет на воспроизводимость. Существенное значение имеет также аккуратность отмывки между отдельными этапами анализа. Коэффициент вариации ИФА составляет менее 10%.
Область применения и чувствительность ИФА соответствуют радиоиммунологическим методам исследования, но ИФА по сравнению с РИА обладает рядом преимуществ:
· не используются радиоактивные изотопы;
· стабильность конъюгатов позволяет хранить их в течение длительного времени;
· измерения проводят в оптическом диапазоне;
· имеется возможность полуколичественной оценки результатов (без применения аппаратуры);
· метод легко поддается автоматизации;
· используемые материалы и приборы дешевле, чем для РИА.
Учитывая преимущества ИФА, метод очень широко применяется в клинических лабораториях для определения гормонов, лекарственных средств, онкомаркеров, белков сыворотки (ферритин, фибронектин, гаптоглобин, иммуноглобулины, С-реактивный белок) и др.
4.2.5. Иммуноблотинг
Блотинг – перенос электрофоретически разделенных веществ на иммобилизованные матрицы. Иммуноблотинг дополнительно включает иммунохимический анализ разделенных фракций. Преимуществами методами являются:
· получение на матрице идеальной копии электрофоретического разделения веществ, присутствующих в геле;
· возможность проведения с образцом на матрице различных аналитических процедур (что в гелях невозможно);
· высокая чувствительность и специфичность метода.
Иммуноблотинг используется для анализа белков, ДНК, РНК.
Саузерн блотинг – метод переноса фрагментов ДНК (с агарозы на нитроцеллюлозу под действием капиллярных сил). Далее они гибридизируются с меченой радиоактивным изотопом известной ДНК для проверки комплементарных последовательностей. Если обе нуклеиновые кислоты одинаковы, происходит их гибридизация (образование двойной спирали), радиоактивная метка закрепляется, в противном случае – удаляется.
Норзерн блотинг по принципу аналогичен вышеописанному, но используется для идентификации РНК.
Вестерн блотинг –- метод переноса фрагментов белка (с додецилсульфатполиакриламидных гелей на полосу чистой немодифицированной нитроцеллюлозы) (рисунок 4.11).
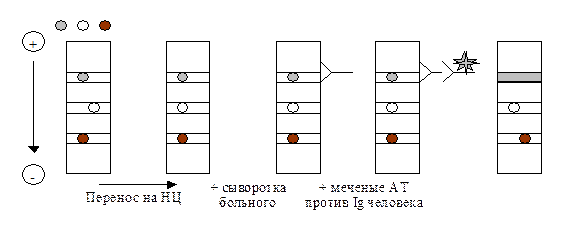
Рисунок 4.11 – Схема иммуноблотинга (Вестерн блотинг)
На первом этапе проводится электрофоретическое разделение белков в соответствии с их молекулярными массами методом электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН) с добавлением 2-меркаптоэтанола. В среде с ДСН все белки приобретают отрицательный заряд, а 2-меркаптоэтанол способствует разрыву дисульфидных мостиков. В результате белки теряют свой характерный заряд и форму и разделяются только в соответствии с молекулярными массами. На следующем этапе осуществляют перенос (блотинг) белков из геля на нитроцеллюлозную мембрану, которую обрабатывают сывороткой больного. При наличии в ней специфических к разделенным антигенам антител происходит реакция АГ-АТ, которая визуализируется путем обработки мечеными антителами против иммуноглобулинов человека.
4.3. Методы фракционирования биологических жидкостей
4.3.1. Хроматография
Хроматография (от греч. chroma, родительный падеж chromatos - цвет, краска) – один из наиболее избирательных методов разделения близких по химической структуре веществ. Основан на распределении компонентов биологической пробы между неподвижной и подвижной фазами, перемещающимися друг относительно друга. В зависимости от строения разделяемые компоненты в различной степени удерживаются той и другой фазами, в результате чего могут быть отделены друг от друга. Процесс разделения складывается из многократных (повторяющихся сотни раз) актов перехода веществ из одной фазы в другую. Вещество, более родственное с неподвижной фазой, продвигается медленнее через систему, чем вещество более родственное с подвижной фазой. Взаимодействие растворенных веществ с подвижной и неподвижной фазами регулируется физико-химическими процессами: поверхностной адсорбцией, разделением жидкостей, ионным обменом, молекулярным сродством и т. д. На основании этого выделяют различные виды хроматографии (см. ниже).
Метод разработан в 1903 российским ученым М.С. Цветом, который показал, что при пропускании смеси растительных пигментов через слой бесцветного сорбента индивидуальные вещества располагаются в виде отдельных окрашенных зон. Полученный таким образом послойно окрашенный столбик сорбента М. Цвет назвал хроматограммой, а метод – хроматографией. Впоследствии термин «хроматограмма» стали относить к разным способам фиксации результатов многих видов хроматографии.
Хроматография позволяет разделять вещества очень близкого строения: природные соединения, белки, нуклеиновые кислоты, и даже некоторые биологические объекты, что делает этот метод широко применимым. Особенно это касается белков и нуклеиновых кислот – их разделение хроматографическим методом очень точно позволяет выделять и анализировать вещества близкие по химическому строению (например, Т3 и Т4). В современных модификациях (например, высокоэффективная жидкостная хроматография – ВЭЖХ) возможен анализ, идентификация и разделение очень малых количеств веществ (около 0,000001г) за очень короткое время – 15-20 минут.
Принципы разделения и основные термины хроматографии
Основа разделения. Молекулы с разным составом или строением осаждаются (сорбируются) на твёрдой поверхности по-разному. Одни – прикрепляются немного прочнее, другие – несколько слабее. Одни – дольше находятся в связанном состоянии и меньше в растворе; другие – чуть дольше задерживаются в растворе и быстрее увлекаются потоком растворителя. Поэтому смесь различных веществ постепенно разделяется на составные части. Каждая такая часть сосредоточивается в своём слое и соответствует какому-то одному химическому соединению.
Основные понятия хроматографии
Сорбент – вещество-поглотитель = неподвижная фаза.
Элюент – раствор = подвижная фаза.
При хроматографическом разделении компоненты смеси многократно распределяются между двумя несмешивающимися фазами – подвижной и неподвижной. Захваченные поверхностью твердого тела – сорбента молекулы могут переходить обратно в раствор – элюент, снова поглощаться и вновь растворяться, бесчисленное множество раз меняя своё состояние.
Хроматографические системы разделяются по следующим критериям:
· агрегатное состояние подвижной и
неподвижной фаз;
механизм
взаимодействия между разделяемым веществом и фазами;
· геометрические характеристики системы;
· способ относительного перемещения фаз.
1. Агрегатное состояние фаз. В качестве подвижной фазы используется газ или жидкость. В качестве неподвижной, или стационарной фазы применяются твёрдые вещества или жидкости (таблица 4.2).
Таблица 4.2 – Виды хроматографии в зависимости от агрегатного состояния применяемых фаз
Подвижная фаза |
Неподвижная фаза |
Тип метода |
Вид метода |
|
Газ |
Жидкость
Твёрдое вещество |
Газовая хроматография |
Газожидкостная хроматография Газоадсорбционная хроматография |
|
Жидкость |
Жидкость
Твёрдое вещество |
Жидкостная хроматография |
Жидкостно-жидкостная хроматография Жидкостно-адсорбционная хроматография |
2. Механизм взаимодействия между разделяемым веществом и фазами
Взаимодействие между разделяемым веществом и фазами хроматографической системы может осуществляться или на поверхности фазы или в объеме. В первом случае хроматография называется адсорбционной, во втором – распределительной. Распределительная хроматография может быть основана на различиях в растворимости вещества, биоспецифических взаимодействиях (например, аффинная хроматография), различном проникновении молекул веществ в поры геля (гель-хроматография).
3. Геометрические характеристики системы
По расположению фаз (геометрические характеристики) хроматографические системы подразделяют на две группы: плоскостные и колоночные. В колоночной сорбентом заполняют специальные трубки – колонки. Подвижная фаза движется внутри колонки, благодаря перепаду давления. Разновидность колоночной хроматографии – капиллярная, когда тонкий слой сорбента наносится на внутренние стенки капиллярной трубки.
Плоскостная хроматография подразделяется на тонкослойную и бумажную. В тонкослойной хроматографии тонкий слой гранулированного сорбента наносится на стеклянные или металлические пластинки. В случае бумажной ХГ используют специальную хроматографическую бумагу. В плоскостной ХГ перемещение подвижной фазы происходит благодаря капиллярным силам.
4. Способ относительного перемещения фаз
В зависимости от способа перемещения разделяемой смеси вдоль слоя сорбента различают следующие варианты хроматографии: проявительный (элюентный), фронтальный и вытеснительный (рисунок 4.12).
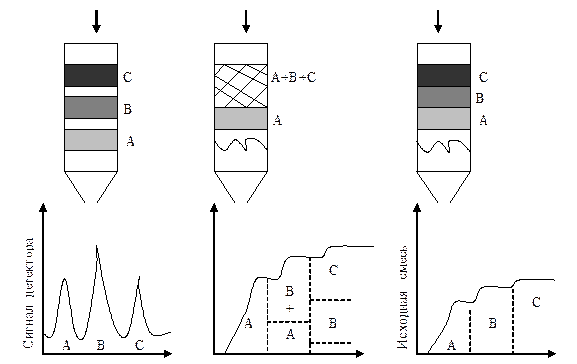
Рис. 4.12 – Варианты хроматографического анализа (пояснения в тексте)
Сущность проявительного метода (левая часть рисунка 4.12) заключается в следующем. Заполненную сорбентом колонку промывают жидкой или газообразной фазой. Затем, не прекращая потока подвижной фазы, в верхнюю часть колонки вводят анализируемую пробу, состоящую из компонентов А, В, С. Попав на слой сорбента, эти вещества взаимодействуют с подвижной фазой и начинают перемещаться вдоль слоя сорбента по направлению движения подвижной фазы. Если эти вещества обладают разным сродством к неподвижной фазе, то скорость их перемещения разная: в нашем случае компонент А сорбируется слабее, значит продвигается быстрее, за ним движется компонент В, следом – С. В итоге зоны с компонентами будут постепенно образовывать отдельные участки, разделенные чистым элюентом. Таким образом, в данном случае компоненты пробы мигрируют независимо друг от друга, разделение происходит за счет разных скоростей их перемещения. Достоинством данного способа является возможность практически полного разделения смеси на отдельные компоненты (левый график на рис.4.12), недостатком – значительное разбавление компонентов растворителем, что снижает их концентрации на выходе из колонки. При колоночной хроматографии данный вариант используется наиболее широко, постепенно вытесняя все остальные.
Фронтальный вариант (рисунок 4.12, центр) является наиболее простым. Анализируемую биопробу, которая одновременно служит подвижной фазой, непрерывно пропускают через слой сорбента. Предположим, исследуемая биопроба содержит 3 исследуемых компонента – А, В и С, различающихся по сродству к сорбенту (А<В<С). Поступающие в верхний слой колонки компоненты биопробы постепенно вытесняют из колонки растворитель. Передний край называют фронтом, откуда и происходит название. В первой зоне находится только наименее удерживаемое вещество А, которое движется быстрее всего. Вторая зона содержит вещество А и В. Третья зона включает смесь веществ – А, В, С. Метод позволяет выделить из смеси только одно, наиболее слабо сорбирующееся вещество (в нашем примере А). Кроме того, недостатком метода является необходимость значительного объема анализируемой пробы.
Вытеснительный вариант хроматографии (правая часть рис. 4.12) основан на том, что десорбцию компонентов пробы осуществляют потоком раствора, содержащего специальное вещество – вытеснитель, которое сорбируется лучше любого из разделяемых компонентов. Колонку промывают подвижной фазой, затем вводят биопробу (компоненты А, В, С) и пропускают поток подвижной фазы, содержащей вытеснитель. В результате подвижная фаза вытесняет и проталкивает все компоненты. Сначала она вытесняет наиболее сильно сорбирующийся компонент С, который в свою очередь вытесняет компонент В, а тот вытесняет наименее сорбирующийся компонент А. Таким образом компоненты биопробы перемещаются вдоль колонки в порядке увеличения их сорбционных свойств. На хроматограмме получается ступенчатая кривая (правый график на рис. 4.12), но каждая ступенька соответствует только одному компоненту. В результате каждый компонент не отделяется зоной чистого растворителя (как при проявительном варианте), так как зоны частично перекрываются. Это является существенным недостатком описанного метода. Преимуществом данного варианта является экономность расходования реагентов и биоматериала, так как биопроба не разбавляется растворителем, и емкость сорбента используется очень эффективно.
Для проведения хроматографии используют приборы, которые называют «хроматографы».
Хроматографический анализ может быть качественным и количественным. Для качественного хроматографического анализа определяют время от момента ввода пробы до выхода каждого компонента из колонки при данной температуре и при использовании определённого элюента. Это время соотносят с известным временем выведения стандартных растворов изучаемых веществ различной концентрации. Для количественного анализа определяют высоты или площади хроматографических пиков с учётом коэффициентов чувствительности используемого детектирующего устройства к анализируемым веществам. При этом важна форма зон (пиков) на хроматограмме. В идеале требуется, чтобы они были как можно более узкими и высокими и более удалены друг от друга, в этом случае легче будет провести анализ и он будет более точным.
Сорбенты хроматографического анализа
Сорбент является важнейшей частью хроматографической системы, именно от его характеристик и типа зависит возможность разделения веществ.
Основные параметры сорбента, имеющие значение для разделения веществ:
1. Размеры частиц. В классической колоночной хроматографии используются сорбенты с размерами частиц 30-200 мкм при высоте колонке 1 м. Однако главный недостаток крупнозернистых сорбентов – большая длина диффузии внутри зерен. В этом случае приходится применять небольшие скорости движения потока. В настоящее время все шире используют так называемые объемно-пористые сорбенты, в которых диаметр частиц равен 3–10 мкм. Преимуществом объемно-пористых сорбентов является большая емкость, что позволяет их использовать не только в аналитических целях, но и для препаративного разделения веществ.
2. Свойства материала сорбентов. Используют самые разные вещества природного происхождения и синтетические – органические и неорганические полимеры. Прежде всего, это сорбенты на основе целлюлозы, агарозы, окиси алюминия, силикагели.
3. Возможность химической модификации. При введении в состав сорбента каких-либо функциональных групп можно получить сорбент с требуемыми свойствами, сродством к определенным классам соединений.
4. Механическая прочность, химическая стойкость.
Одним из самых распространенных сорбентов является силикагель, или его многочисленные модификации. Это определяется тем, что силикагель можно легко модифицировать, получать определенный размер частиц, размер пор, определенную удельную поверхность и т.д. К тому же сорбенты на основе силикагеля механически прочны и химически стойки.
Основные виды хроматографии
Адсорбционная хроматография. В этом случае разделение веществ осуществляется за счёт выборочной (селективной) адсорбции веществ на неподвижной фазе. Такая селективная адсорбция обусловлена сродством того или иного соединения к твёрдому адсорбенту (неподвижной фазе), а оно, в свою очередь, определяется полярными взаимодействиями их молекул. Поэтому часто хроматографию такого типа используют при анализе соединений, свойства которых определяются числом и типом полярных групп.
Ионообменная хроматография. В качестве неподвижной фазы используют ионообменные смолы как в колонках, так и в виде тонкого слоя на пластинке или бумаге.
Метод основан на способности некоторых твёрдых веществ – ионообменников обменивать ионы при контакте с растворами электролитов. В качестве ионообменников (ионитов) используют нерастворимые высокомолекулярные вещества природного или синтетического происхождения. Ионообменники бывают двух типов: анионоообменники – аниониты и катионоообменники – катиониты. Особенностью метода является то, что сорбент (ионообменник) способен ионизироваться, отдавая подвижные ионы (H, Na) в подвижную фазу, при этом сам ионообменник приобретает заряд.
Гель-фильтрация (гель-хроматография) основана на различной способности молекул разного размера проникать в поры нейтрального геля, который служит неподвижной фазой. В качестве сорбентов в гель-фильтрации наиболее широко используются сефадексы с различными размерами пор, полиакриловые гели и гели агарозы. Они представляют собой мелкие частицы, внутри пронизанные нитями (фибриллами). Диффузия компонентов разделяемого вещества внутрь этих частиц лимитируется размерами, а точнее подвижностью молекул, которая зависит от их молекулярной массы. Чем меньше молекулы, тем легче они способны проникать вовнутрь гранул геля. Соответственно более тяжелые частицы практически не проникают в гранулы. Частицы, попавшие внутрь гранул, надолго там задерживаются, так как пространство внутри гранул геля пронизано нитями, и молекулы претерпевают многочисленные столкновения с сетью фибрилл. Таким образом, скорость продвижения через колонку легких молекул будет меньше скорости движения более тяжелых молекул. Метод очень эффективен для разделения белков и других высокомолекулярных соединений.
Аффинная хроматография представляет собой метод разделения веществ, основанный на их специфическом взаимодействии с сорбентом. Сорбентом в данном виде хроматографии служит гель типа агарозы, к которому ковалентно привязаны подходящие лиганды (например, субстрат какого-либо фермента). Когда через такой сорбент пропускают подвижную фазу, то из нее будет сорбироваться только соответствующий фермент. При модификации сорбента соответствующими антителами можно удерживать заданные вирусы, при модификации антигеном удерживать антитела. Метод аффинной хроматографии высоко эффективен из-за селективности специфических взаимодействий. Используется для выделения антигенов, вирусов, белков, лектинов и т.д.
Колоночная жидкостная хроматография низкого давления позволяет разделять разнообразные вещества – от низкомолекулярных соединений до сложных биополимеров и их комплексов при нормальном или несколько повышенном давлении. При нормальном давлении производят разделение на мягких сорбентах (сефадексы, гели агарозы, полистирольные гели). Первостепенное значение для эффективности разделения имеет конструкция колонки (длина, толщина, материал). Их обычно изготавливают из инертных материалов (стекло, тефлон, нержавеющая сталь). Скорость элюирования устанавливают в зависимости от типа сорбента и свойств разделяемых веществ. В адсорбционной и ионообменной хроматографии удовлетворительное разделение получают при высокой скорости элюирования, а при гель-хроматографии скорость элюирования должна быть низкой (≈ 10 см/час). Колоночная жидкостная хроматография может применяться для препаративного разделения неорганических (ионообменная хроматография), органических (адсорбционная и распределительная хроматография) веществ и биополимеров (ионообменная, аффинная, гель-хроматография).
Высокоэффективная жидкостная хроматография (ВЭЖХ) представляет собой метод разделения веществ на мелкозернистых сорбентах (с размерами частиц 3–15 мкм) при повышенном давлении. Метод характеризуется высокой эффективностью разделения в сочетании с высокой скоростью процесса. Разделяющая способность колонок при ВЭЖХ существенно выше жидкостной хроматографии низкого давления в результате небольших размеров частиц сорбента и их однородности. Продолжительность процесса сокращается за счет использования коротких колонок, это же уменьшает расход реагентов. ВЭЖХ используется для анализа, разделения и очистки синтетических полимеров, лекарственных препаратов, детергентов, белков, гормонов и других биологически важных соединений. Использование высокочувствительных детекторов позволяет работать с очень малыми количествами веществ (10-11-10-9 г), что исключительно важно в биологических исследованиях. Метод широко применяется в токсикологических лабораториях.
Тонкослойная хроматография основана на различии скоростей перемещения компонентов анализируемой пробы в плоском тонком слое сорбента при движении по нему растворителя (элюента) под действием капиллярных или гравитационных сил. Неподвижной фазой служит либо сухой сорбент (адсорбционная хроматография), либо сорбент, покрытый жидкой фазой, например, слоем воды (распределительная хроматография). Разделенные компоненты в виде пятен на пластинке можно идентифицировать различными аналитическими методами: ультрафиолетовой спектрофотометрией, специальными способами окрашивания и т. д. Метод имеет ряд преимуществ, прежде всего, простота и легкость исследования, высокая скорость, экономичность, отсутствие необходимости предварительной подготовки биопробы, возможность анализа нестойких веществ, причем, одновременно в нескольких образцах. Различные варианты тонкослойной хроматографии приобретают в настоящее время широкое распространение в клинико-диагностических лабораториях для анализа жиров, углеводов, белков, а также неорганических соединений.
4.3.2. Электрофорез
Электрофорез – процесс разделения заряженных частиц под действием внешнего электрического поля. В результате проведения электрофореза можно осуществлять идентификацию и определение количества различных макромолекул, микрочастиц, клеток по их подвижности в направлении силовых линий электрического поля.
Электрофорез применяют для исследования веществ, молекулы которых в соответствующих условиях заряжены и различаются по электрофоретической подвижности. Конкретные условия для разделения подбирают путем изменения характеристик внешней среды (рН среды, температуры, состава и концентрации буферного раствора или носителя). На примере разделения белков принцип метода можно представить следующим образом. Белки являются амфотерными веществами, которые в кислой среде присоединяют протон и ведут себя как катионы, а в щелочной среде – отдают протон и приобретают свойство анионов. В изоэлектрической точке они становятся ионами с нулевым суммарным зарядом, то есть нейтральными молекулами, в которых противоположные заряды пространственно разделены. Суммарный заряд молекул зависит от рН буфера, в котором растворен белок. Изменяя этот параметр, можно менять направление и скорость миграции белков в электрическом поле, то есть разделять белки в анализируемой биопробе. Эффективность разделения зависит не только от суммарного заряда молекул, но и от их размеров. При этом крупные молекулы с высоким суммарным зарядом могут мигрировать на то же расстояние, что и небольшие молекулы с низким суммарным зарядом. Определяющим параметром при этом является соотношение заряд/масса, которое и определяет электрофоретическую подвижность молекул исследуемого компонента.
Электрофорез можно осуществлять в растворе или использовать специальные носители из пористого материала, не проводящие ток. Среда-носитель служит для поддержания стабильности различий в плотности раствора разделяемого вещества и буфера, а также электрофоретических зон, которые легко разрушаются от нагрева, возникающего при прохождении электрического тока через буферный раствор. Однако следует иметь в виду, носитель может оказывать влияние на условия электрофореза и тем самым изменять эффективность разделения (за счет размера пор, адсорбции, собственных химических свойств и т.д.).
По эффективности разделения можно выделить две группы материалов-носителей:
1. Ацетацеллюлоза, агар, агароза. Это относительно инертные материалы с порами больших размеров, которые слабо влияют на эффективность разделения.
2. Крахмальные и акриламидные гели. Эти носители содержат поры, сравнимые по размерам с размерами белковых молекул. Поэтому на них возможно разделение веществ с одинаковыми суммарными зарядами, но различными молекулярными массами. Электрофореграммы, полученные на таких носителях, содержат больше фракций, чем на ацетатцеллюлозе, агаре и агарозе. Так, электрофорез на полиакриламидном геле позволяет выделить 20 и более фракций белков из сыворотки.
Электрофорез осуществляется с помощью специальных приборов для электрофореза. Процедура состоит в том, что носитель помещается в электрофоретическую камеру, содержащую буферный раствор. Буферный раствор выполняет двоякую роль: проводит электрический ток и поддерживает определенную рН, определяя электрический заряд растворенного вещества. Избыток буферного раствора удаляют. Исследуемый биоматериал (например, сыворотка крови) наносится на носитель, устанавливается требуемая сила тока. По окончании электрофореза смесь макромолекул оказывается разделенной на дискретные зоны, каждая из которых состоит из частиц с близкими значениями электрофоретической подвижности. Носитель вынимают из камеры, высушивают (или закрепляют для предупреждения диффузии компонентов пробы), а затем окрашивают специфичным для данного класса веществ красителем. Для окрашивания электрофореграмм белков используют амидочерный, бромфеноловый голубой и другие красители. Окрашивание позволяет визуализировать отдельные зоны на электрофореграмме. По положению зон относительно места старта осуществляется идентификация отдельных фракций разделенного вещества (рисунок 4.13).
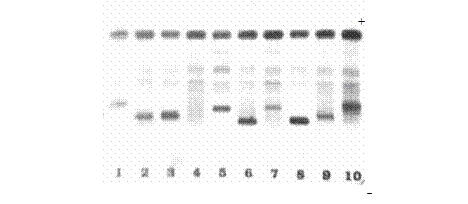
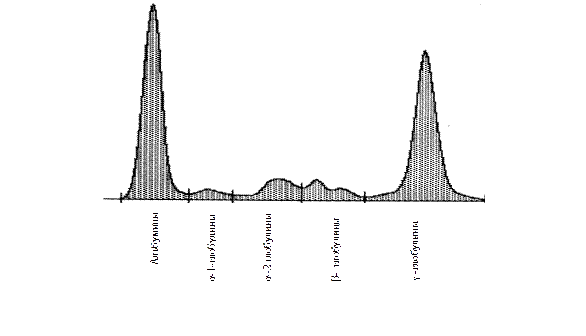
Рисунок 4.13 – Электрофореграмма белков сыворотки крови на ацетатцеллюлозной пленке
На нижнем рисунке – результат количественного определения основных белковых фракций крови методом денситометрии (денситограмма).
Количественная оценка содержания разделенных компонентов осуществляется по интенсивности окрашивания разделенных зон с помощью специального фотометрического прибора – денситометра, работающего в отраженном от препарата потоке излучения оптического диапазона. Результаты выражаются в графической форме (в виде пиков) и в цифровой форме (рис)
В клинической практике электрофорез широко применяется в исследовании белков и их компонентов, липопротеинов и нуклеиновых кислот.
Одним из наиболее современных и перспективных методов электрофореза является изоэлектрическое фокусирование (ИЭФ). Метод используется преимущественно для исследования белков. Сущность ИЭФ заключается в том, что молекулы белков мигрируют под действием электрического поля в среде с линейным и стабильным градиентом рН до достижения области, соответствующей их изоэлектрической точке (значение рН, при котором белок теряет заряд, а, следовательно, и подвижность в электрическом поле). Если в стабилизирующей среде создать градиент рН, то заряженные молекулы белка, двигаясь по электрическому полю, попадают в область носителя с рН, равным их изоэлектрической точке, и теряют подвижность: каждый белок фокусируется на среде со своей изоэлектрической точкой. Таким образом, ИЭФ использует зависимость знака и величины заряда молекулы белка от рН окружающего раствора. Метод обладает очень высокой разрешающей способностью: удается надежно разделить два белка, отличающиеся по ИЭТ всего на 0,02 ед. рН.
В данную группу объединены методы, конечный этап разделения которых основан на специфической реакции связывания антигена пробы с антителом добавляемой в носитель сыворотки, что позволяет определить состав исходной смеси антигенов. Существует несколько десятков модификаций иммуноэлектрофореза. Рассмотрим некоторые из них.
Классический иммуноэлектрофорез. На первом этапе производят разделение белков в забуференном агаровом или агарозном геле, а затем латерально, параллельно разделенным компонентам прорезают щели, которые заполняют антисывороткой. Выдерживают в течение некоторого времени для диффузии компонентов (обычно ночь). Взаимодействие антиген-антитело обнаруживается по дугам преципитации (рисунок 4.14). Метод позволяет выявить антигенный состав сложной смеси белков и идентифицировать отдельные компоненты смеси с помощью моноспецифических антисывороток. В клинике используется для типирования парапротеинов сыворотки и выявления белков Бенс-Джонса. Недостаток метода – отсутствие возможности количественного анализа.
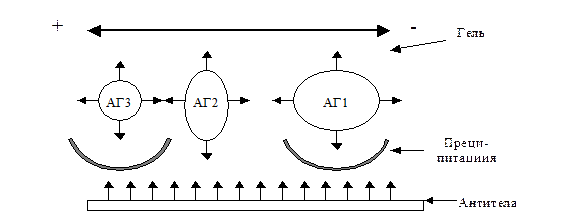
Процесс включает следующие стадии: 1) электрофоретическое разделение белков (антигенов) в геле; 2) внесение иммунной сыворотки в канавку, сформированную в геле; 3) диффундирование АГ и АТ в геле навстречу друг другу, в результате чего в месте их взаимодействия (при условии соответствия АГ и АТ) возникают дуги преципитации. Процесс иммунодиффузии продолжается около 24 часов во влажной камере; 3) промывка пластины геля для удаления белков, которые не участвовали в преципитации; 4) сушка и окрашивание образцов специальными красителями. Результат оценивают по количеству, положению и форме зон преципитации.
Ракетный имуноэлектрофорез (двумерный) происходит по схеме, представленной на рисунке 4.15.

Рисунок 4.15 – Схема проведения ракетного электрофореза
Электрофорез происходит в геле агарозы, содержащем специфические антитела. При этом антигены (Ag) движутся по направлению к аноду и взаимодействуют с АТ в геле. Это приводит к образованию длинных ракетоподобных участков преципитации, которые легко увидеть при окрашивании геля. Процесс завершается, конца зона преципитации образует на конце острие. Длина и площадь зоны преципитации пропорциональны концентрации исследуемого антигена.
Описанный метод позволяет провести количественное определение концентрации антигена, сравнивая тестовые и контрольные образцы, одновременно подвергшиеся электрофорезу. Общая продолжительность реакции 3-18 часов. Используется специальная электрофоретическая камера с охлаждением. Существует модификация данного метода с применением ацетат-целлюлозных мембран.
Проводят электрофорез (чаще на целлюлозно-ацетатных мембранах), а затем идентифицируют белки с помощью антисывороток. Для этого пластину делят на сегменты, которые затем погружают в антисыворотку. Обработанный сегмент (в нем образуется преципитат) прокрашивают (например, красителем понсо S или нигрозином). Метод удобен для определения белков Бенс-Джонса, парапротеинов в низкой концентрации.
Встречный иммуноэлектрофорез отличается тем, что взаимодействие антигена и антител происходит не вследствие свободной диффузии, а в постоянном электрическом поле, в результате чего и формируются зоны преципитации. Ввиду различного состава белков, они передвигаются в щелочной среде буферного раствора с различной скоростью и в разных направлениях: большинство АГ имеет отрицательный заряд и двигается к аноду, в то время как АТ обычно практически нейтральны и вместе с током жидкости передвигаются в обратном направлении – к катоду. Таким образом, АГ и сыворотка, содержащая специфичные к нему АТ, двигаются в слое геля навстречу друг другу. При контакте АГ и АТ образуются четкие зоны преципитации. Оценка реакции производится качественно в сравнении с контрольным рисунком, в качестве которого используется рисунок зон преципитации, образовавшийся при взаимодействии известных АГ и АТ. Метод используется для диагностики различных инфекционных заболеваний и считается методом второго поколения по сравнению с методами иммунодиффузии (чувствительность ≈ в 10 раз выше, продолжительность реакции меньше – около 3-х часов в сравнении с 24 часами при иммунодиффузии).
В целом следует отметить, что методы иммуноэлектрофореза достаточно трудоемки для выполнения и требуют большого количества дополнительного оборудования (камеры для электрофореза, электроды, камеры для окрашивания и сушки образцов и др.). Учет результатов чаще проводится качественно, но возможна и количественная оценка за счет использования оптических денситометров. Эти приборы позволяют определять оптические характеристики зон преципитации с последующим вычислением концентрации вещества в каждой фракции.
4.4. Методы микроскопии в клинико-диагностической лаборатории
Микроскоп (от лат. micros – малый и scopein – рассматривать, наблюдать) – прибор, позволяющий получать увеличенное изображение объектов и структур, недоступных глазу человека.
Основу микроскопических методов исследования составляет световая и электронная микроскопия. Световая микроскопия основывается на законах геометрической оптики и волновой теории образования изображения, в качестве освещения используются естественный или искусственные источники света. Электронная микроскопия обеспечивает получение электронно-оптического изображения с помощью потока электронов. Построение изображения основывается на законах геометрической и волновой оптики, а также теории электромагнитных полей. Световые микроскопы обеспечивают увеличение до 2-3 тысяч раз, а электронные микроскопы – в 20000 раз. Однако, несмотря на широкие возможности, электронные микроскопы в основном используются в научно-исследовательских лабораториях.
Основными характеристиками микроскопа являются разрешающая способность и контраст. Разрешающая способность – это минимальное расстояние, на котором находятся две точки, демонстрируемые микроскопом раздельно. Разрешение светового микроскопа – выше 0.2 мкм. Контраст изображения – это различие яркостей изображения и фона. Если это различие составляет менее 3 - 4 %, то его невозможно уловить глазом; тогда изображение останется невидимым, даже если микроскоп разрешает его детали. На контраст влияют как свойства объекта, которые изменяют световой поток по сравнению с фоном, так и способности оптики уловить возникающие различия в свойствах луча. Возможности светового микроскопа ограничены волновой природой света. Физические свойства света – длина волны, яркость (амплитуда волны), фаза, плотность и направление распространения волны изменяются в зависимости от свойств объекта. Эти различия и используются в современных микроскопах для создания контраста.
Общее увеличение микроскопа определяется как произведение увеличения объектива на увеличение окуляра. У наиболее распространенных в КДЛ биологических микроскопов увеличение окуляра равно 7х, 10х, а увеличение объективов – 10х, 20х, 40х и 90х (или 100х). Соответственно, общее увеличение таких микроскопов составляет до 1000 раз. Некоторые современные биологические исследовательские микроскопы имеют увеличение до 2000 раз. Еще более высокое увеличение не имеет смысла, так как при этом разрешающая способность не улучшается, напротив, качество изображения ухудшается.
Методы микроскопии выбираются (и обеспечиваются конструктивно) в зависимости от характера и свойств изучаемых объектов, так как последние, как отмечалось выше, влияют на контрастность изображения.
Метод светлого поля в проходящем свете применяется при изучении прозрачных препаратов с включенными в них абсорбирующими (поглощающими свет) частицами. В отсутствие препарата пучок света из конденсора, проходя через объектив, даёт вблизи фокальной плоскости окуляра равномерно освещенное поле. При наличии в препарате абсорбирующего элемента происходит частичное поглощение и частичное рассеивание падающего на него света, что и обусловливает появление изображения. Возможно применение метода и при наблюдении неабсорбирующих объектов, но лишь в том случае, если они рассеивают освещающий пучок настолько сильно, что значительная часть его не попадает в объектив. Этот метод микроскопии используется в КДЛ наиболее часто – например, исследование осадка мочи, окрашенных мазков крови и др.
Метод тёмного поля в проходящем свете используется для получения изображений прозрачных неабсорбирующих объектов, которые не могут быть видны, если применить метод светлого поля. Для работы используются конденсоры специальной конструкции – так называемые конденсоры тёмного поля. Основная особенность темнопольных конденсоров заключается в том, что центральная часть у них затемнена и прямые лучи от осветителя в объектив микроскопа не попадают. Объект освещается косыми боковыми лучами и в объектив микроскопа попадают только лучи, рассеянные частицами, находящимися в препарате (рисунок 4.16).
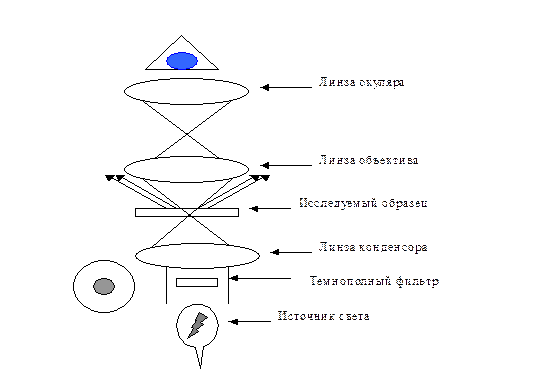
Рисунок 4.16 – Схема световой микроскопии с темнопольным конденсором (пояснения в тексте)
Перед началом работы свет устанавливают и центрируют по светлому полю, затем светлопольный конденсор удаляют и заменяют темнопольным конденсором. Препарат готовят по методу «раздавленной капли», делая его как можно более тонким. В поле зрения на тёмном фоне видны светлые изображения элементов структуры препарата, отличающиеся от окружающей среды показателем преломления.
Темнопольная микроскопия наиболее широко применяется в микробиологии для повышения контраста изображения объекта, например, для изучения живых неокрашенных микроорганизмов (при исследовании подвижности бактерий, которые в живом состоянии не видны в светлом поле) и т.п.
Метод фазового контраста предназначен для получения изображений прозрачных и бесцветных объектов, невидимых при наблюдении по методу светлого поля. К таковым относятся, например, живые неокрашенные клетки. Суть метода в том, что даже при очень малых различиях в показателях преломления разных элементов препарата световая волна, проходящая через них, претерпевает разные изменения по фазе (приобретает так называемый «фазовый рельеф»). Не воспринимаемые непосредственно глазом эти фазовые изменения с помощью специального оптического устройства преобразуются в изменения амплитуды световой волны, то есть в изменения яркости («амплитудный рельеф»), которые уже различимы глазом. Получаемое таким образом изображение называется фазово-контрастным.
Фазово-контрастное устройство может быть установлено на любом световом микроскопе и состоит из специального конденсора с револьвером диафрагм и центрирующим устройством; объективы заменяют на иммерсионные объективы-апохроматы (рисунок 4.17).
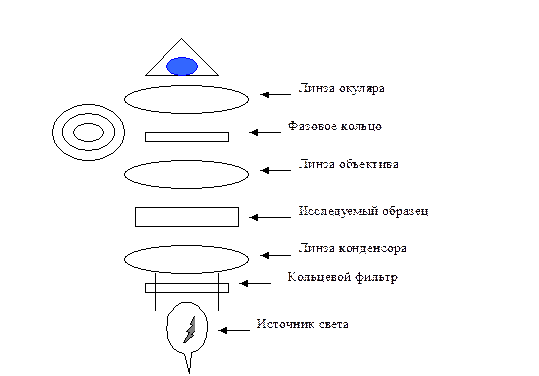
Рисунок 4.17 – Схема фазово-контрастной микроскопии
В конденсоре вместо ирисовой диафрагмы размещен кольцевой фильтр, который через конденсорную оптику освещает препарат. Весь пучок света поступает в объектив. Фазовое кольцо объектива выполняет две функции: гасит как серый фильтр сильный прямой свет, поступающий из кольцевой диафрагмы конденсора, и придает этому свету постоянное фазовое смещение. Объекты, содержащиеся в препарате (клетки, их ядра), отклоняют свет из прямого луча на новую траекторию. Этот свет не проходит через фазовое кольцо в объективе и таким образом не ослабляется и не задерживается. Лучи, поступающие с различной задержкой, накладываются друг на друга и взаимно усиливаются или ослабляются. В результате исследуемая клетка становится видимой для глаза. Препарат должен быть максимально тонким, иначе в результате пространственного наложения нескольких структур изображение становится нечетким.
Настройка фазового контраста заключается в следующем:
6. Вынимают из тубуса окуляр и вставляют на его место вспомогательный телескоп. Настраивают его так, чтобы были резко видны фазовая пластинка (в виде темного кольца) и кольцевая диафрагма (в виде светлого кольца того же диаметра). С помощью регулировочных винтов на конденсоре совмещают эти кольца. Вынимают вспомогательный телескоп и вновь устанавливают окуляр.
В отличие от метода темного поля, выявляющего лишь контуры объекта, метод фазового контраста позволяет увидеть элементы внутренней структуры рассматриваемого прозрачного объекта. Фазово-контрастная микроскопия применяется при исследовании неокрашенных объектов, например, для подсчета тромбоцитов в камере Горяева, выявления микроорганизмов. Благодаря применению этого способа микроскопии контраст живых неокрашенных микроорганизмов резко увеличивается, и они выглядят темными на светлом фоне (позитивный фазовый контраст) или светлыми на темном фоне (негативный фазовый контраст).
Фазово-контрастная микроскопия применяется также для изучения клеток культуры ткани, наблюдения цитопатогенного действия и т. п. В этих случаях часто применяют биологические микроскопы с обратным расположением оптики – инвертированные микроскопы (см. ниже).
Исследование в поляризованном свете. В этом методе используется линейно поляризованный свет, то есть световые волны, имеющие одинаковое направление колебаний. Такой свет создается поляризаторами, фильтрующими из хаотичных направлений колебаний в естественном свете одно преимущественное направление. Метод предназначен для микроскопического исследования препаратов, включающих оптически анизотропные элементы, то есть структуры, которые изменяют скорость распространения поляризованного света в зависимости от его направления по продольной или поперечной оси объекта. Если показатель преломления света вдоль структуры больше, чем в поперечном направлении, возникает положительное двойное лучепреломление, при обратных взаимоотношениях – отрицательное двойное лучепреломление. Изменение поляризации при прохождении (или отражении) лучей света через различные структурные компоненты клеток и тканей позволяет судить об основных оптических характеристиках анизотропных микрообъектов.
Для проведения таких исследований используются специальные поляризационные микроскопы. Поляризация света достигается применением пленчатых поляроидов или призм Николя, которые помещают в микроскопе между источником света и препаратом. Наблюдение можно проводить как в проходящем, так и в отражённом свете.
Поляризационная микроскопия используется в гистологических, цитологических, микробиологических исследованиях. Многие биологические объекты являются анизотропными, например, миофибриллы, реснички мерцательного эпителия, коллагеновые волокна и др. При этом в поляризованном свете можно исследовать как окрашенные, так и неокрашенные и нефиксированные (нативные) препараты.
Исследования в свете люминесценции. Метод основан на наблюдении свечения микроскопических объектов под воздействием сине-фиолетового света или ультрафиолетовых лучей.
Для люминесцентной микроскопии тканей используют первичную и вторичную люминесценцию. Первичной люминесценцией (люминесцентное свечение, возникающее без предварительной обработки препаратов) с достаточной интенсивностью обладают некоторые вещества, входящие в состав клеток и тканей: некоторые витамины, гормоны, белки и др. Принцип первичной люминесценции положен в основу цитохимического изучения содержания различных компонентов клеток (например, белков) с помощью метода люминесценции в УФ-лучах.
Вторичная люминесценция достигается с помощью обработки препаратов флуорохромами. Флуорохромы – красители, не вызывающие сильной окраски объектов в обычном свете, но флуоресцирующие при облучении. Флуорохромы обладают способностью на экстремально короткое время (миллиардные доли секунд) поглощать свет, а затем снова испускать его. Этот испускаемый свет имеет смещение в сторону увеличения длины волны. Например, если поглощается синий свет, то испускается зеленый, а невидимое УФ-излучение преобразуется в видимый свет (так называемое смещение Стокса по фамилии открывателя эффекта). Особенностью флюорохромов является возможность применения в очень малых концентрациях (до нескольких мкг/мл) и способность окрашивать не только фиксированные, но и живые клетки. Кроме того, различные флуорофоры, в зависимости от их химического строения (а иногда и от их окружения), имеют определенные спектры поглощения (а, следовательно, и испускания света), что позволяет использовать их в комбинации для маркировки различных структур. Наибольшее распространение в клинической лабораторной диагностике получили ФИТЦ (флюоресцеинизотиоцианат), акридиновый оранжевый, родамин. Флюорохромы могут распределяться в клетке диффузно либо избирательно окрашивают отдельные клеточные структуры или определенные химические соединения биологического объекта. На этом основано использование люминесцентной микроскопии при цитологических и гистохимических исследованиях.
По сравнению с методами обычной микроскопии исследование в свете люминесценции обладает рядом преимуществ: цветное свечение, высокая степень контрастности светящихся объектов на темном фоне, возможность исследования как прозрачных, так и непрозрачных живых объектов, а также различных жизненных процессов в динамике их развития. Для проведения люминесцентной микроскопии используются либо специальные люминесцентные микроскопы (см. ниже), либо приставки к обычным биологическим микроскопам, позволяющие применять их для наблюдения люминесценции микрообъектов.
В патоморфологии с помощью люминесцентной микроскопии распознают злокачественные опухоли в гистологических и цитологических препаратах, выявляют амилоид в биоптатах тканей и т.д. В микробиологических исследованиях данная методика используется для обнаружения различных возбудителей инфекционных заболеваний в биологическом материале (например, хламидий, микобактерий туберкулеза и др.).
Парк современных микроскопов для медико-биологических исследований включает в себя следующие основные группы:
· биологические микроскопы (микроскопы проходящего света);
· инвертированные биологические микроскопы (инвертированные микроскопы проходящего света);
· люминесцентные микроскопы;
· поляризационные микроскопы проходящего света;
· анализаторы изображения;
· стереоскопические микроскопы.
По степени сложности (и стоимости соответственно) каждая группа делится на:
· учебные (обучающие);
· рутинные;
· рабочие;
· лабораторные;
· исследовательские.
Биологический микроскоп предназначен для наблюдения в проходящем свете в светлом поле окрашенных и неокрашенных мазков крови, препаратов костного мозга, осадков мочи, клеточных концентратов, тканевых биоптатов и т.д.
Основные функциональные части микроскопа:
· механическая
· оптическая
· осветительная система
Основу механической части микроскопа составляет штатив, который включает в себя основание и тубусодержатель. Основание представляет собой блок, на котором крепится весь микроскоп. В простых микроскопах на основание устанавливают осветительные зеркала или накладные осветители. В более сложных моделях осветительная система встроена в основание без или с блоком питания. На тубусодержателе крепятся несколько узлов: для револьверного устройства, предметного столика, крепления различных насадок и т.д. Предметные столики могут быть подвижными и неподвижными. Неподвижные столики применяют в самых простейших моделях микроскопов. При оснащении микроскопов подвижными столиками возможно механическое перемещение или управление от электродвигателя (сканирующий).
Оптическая часть микроскопа обеспечивает основную функцию микроскопа – создание увеличенного изображения объекта с достаточной степенью достоверности по форме, соотношению размеров составляющих элементов и цвету. Основными оптическими элементами микроскопа являются объективы и окуляры. Объективы микроскопа представляют собой оптические системы, предназначенные для построения микроскопического изображения в плоскости. Они имеют сложную оптико-механическую конструкцию, которая включает несколько одиночных линз и компонентов, склеенных из 2-х или 3-х линз. Количество линз обусловлено кругом решаемых объективом задач. Чем выше качество изображения, даваемое объективом, тем сложнее его оптическая схема. Общее число линз в сложном объективе может доходить до 14.
Данные о каждом объективе указываются на его корпусе:
1) увеличение («х»-крат, раз): 10х, 40х, 90х; 2) числовая апертура: 0,20; 0,65, пример: 40/0,65 или 40х/0,65 (числовая апертура используется для выражения разрешающей способности оптической системы и характеризует интенсивность света, приходящегося на единицу площади изображения); 3) дополнительная буквенная маркировка (например, МИ/Oil – масляная иммерсия; ВИ/W – водная иммерсия; ГИ/Glyc - глицериновая иммерсия).
Окуляры – оптические системы, предназначенные для построения микроскопического изображения на сетчатке глаза наблюдателя. В общем виде окуляры состоят из двух групп линз: глазной – ближайшей к глазу наблюдателя, и полевой – ближайшей к плоскости, в которой объектив строит изображение рассматриваемого объекта. На окуляре указывается увеличение – 7х, 10х и т.д.
Осветительная система микроскопа представляет собой систему линз, диафрагм и зеркал, обеспечивающую равномерное освещение объекта и полное заполнение апертуры объектива, и состоит из двух частей – коллектора и конденсора. Коллектор при встроенной осветительной системе проходящего света расположен вблизи источника света в основании микроскопа и предназначен для увеличения размера светящегося тела. Для обеспечения настройки коллектор может быть выполнен подвижным и перемещаться вдоль оптической оси. Вблизи коллектора располагается полевая диафрагма микроскопа.
Конденсор предназначен для увеличения количества света, поступающего в микроскоп. Конденсор располагается между объектом (предметным столиком) и осветителем (источником света). Чаще всего конденсор выполнен несъемным и неподвижным. В более сложных микроскопах конденсор является съемной частью и при настройке освещения имеет фокусировочное перемещение вдоль оптической оси и центрировочное перемещение, перпендикулярное оптической оси. При конденсоре всегда находится осветительная апертурная ирисовая диафрагма.
Конденсор является одним из основных элементов, обеспечивающих работу микроскопа по различным методам освещения и контрастирования:
1) косое освещение (диафрагмирование от края к центру и смещение осветительной апертурной диафрагмы относительно оптической оси микроскопа);
2) контраст (кольцевое освещение объекта, при этом изображение светового кольца вписывается в фазовое кольцо объектива).
Для расширения функциональных возможностей биологических микроскопов их комплектуют дополнительными принадлежностями, наиболее часто применяемыми из которых являются: накладные осветители, бинокулярная насадка, фазово-контрастное устройство, съемный люминесцентный осветитель, оптические светофильтры, микрофотонасадки.
В практической работе целесообразно учесть следующие рекомендации:
Инвертированные микроскопы проходящего света имеют следующие основные конструктивные особенности:
По сравнению с обычным биологическим микроскопом инвертированные микроскопы позволяют исследовать более толстые полупрозрачные образцы (например, культуры клеток) и производить с ними манипуляции прямо под микроскопом.
Инвертированные микроскопы применяются в молекулярной биологии, биотехнологии, иммунологии, причем наиболее широко в исследовательских целях.
Принцип действия микроскопа основан на использовании явления люминесценции наблюдаемых объектов, возникающей под действием света определенного спектрального состава.
Люминесцентный микроскоп, в отличие от биологического (проходящего света), снабжен мощным источником освещения с большой поверхностной яркостью, максимум излучения которого находится в коротковолновой области видимого спектра, системой светофильтров, а также интерференционной светоделительной пластинкой, применяемой при возбуждении люминесценции падающим светом. Источниками освещения для люминесцентного микроскопа чаще являются ртутно-кварцевые лампы сверхвысокого давления, а также лампы накаливания – ксеноновые и кварцево-галогенные. Для возбуждения люминесценции при люминесцентной микроскопии обычно используют длинноволновую ультрафиолетовую и сине-фиолетовую область спектра (чаще всего 400-550 нм). Освещение объектов светом, возбуждающим люминесценцию, производится сверху через опак-иллюминатор и объектив.
В практической работе целесообразно учесть следующие рекомендации:
· Лучше всего работать в затененном помещении, так как это позволяет наблюдать даже слабую флуоресценцию. Во время работы не следует выходить в светлые помещения, смотреть на свет лампы.
· Во время перерывов в работе следует перекрыть свет возбуждения специальной задвижкой с фильтром в флуоресцентном иллюминаторе для предотвращения выцветания препарата.
· В работе следует применять только специальные нефлюоресцирующие иммерсионные среды. В противном случае фон становится светлее и контрастность снижается.
· При подготовке препарата к микроскопированию следует принять меры к удалению несвязавшихся флуорофоров, так как их излишек осветляет фон и делает изображение элементов в препарате менее контрастным.
Стереоскопический микроскоп
Стереоскопический микроскоп дает прямое и объемное изображение рассматриваемого предмета как в проходящем, так и в отраженном свете. Как известно, человек обладает стереоскопическим зрением, то есть видит предметы объемными при наблюдении их двумя глазами. Стереоскопические микроскопы способны усиливать стереоскопический эффект невооруженного глаза. Оптическая система микроскопа обеспечивает наблюдение объекта под разными углами. Стереоскопические микроскопы применяются в лаборатории для просмотра гелей и пленок, например, для оценки результатов иммунопреципитации в агаре.
4.4.3. Уход за микроскопом
Срок службы микроскопа рассчитан приблизительно на 15 лет с учетом естественного старения. Для длительного сохранения микроскопа в рабочем состоянии необходимо выполнять следующие правила эксплуатации и ухода:
· В нерабочее время микроскоп убирают в футляр или, еще лучше, оставляя на рабочем столе, накрывают специальным чехлом, нижний край которого плотно, без щелей соприкасается с поверхностью стола.
· Удаление пыли с микроскопа производят мягкой чистой кистью, затем протирают сухой, мягкой, совершенно чистой салфеткой.
· Жидкости, попадающие на микроскоп во время работы, тщательно удаляют (кедровое масло и канадский бальзам смываются бензином, наркозным эфиром или ксилолом).
· Особое внимание следует обращать на чистоту оптических частей микроскопа, особенно объективов. Нельзя прикасаться к поверхностям линз пальцами, так как это загрязняет их жиром и потом. Для чистки внешних поверхностей линз объективов используют мягкую тряпочку, смоченную чистым спиртом (можно использовать также бензин, наркозный эфир или ксилол). Особое внимание следует обратить на очистку иммерсионных объективов после использования. Масло стирают сухой мягкой тряпочкой, при необходимости объективы протирают чистым спиртом. Развинчивать и разбирать объектив нельзя во избежание его порчи.
4.5. Сухая химия
Сухая химия («dry сhemistry») подразумевает анализ биологических жидкостей с помощью технологий использования сухих реагентов на твердофазных носителях. После нанесения исследуемой жидкости на тест-системы происходит активация реагентов и химическая реакция (как в пробирке). Учет результатов может быть качественным, полуколичественным и количественным.
Среди простейших диагностических тестов на твердофазном носителе следует назвать экспресс-тесты в виде моно- (на один компонент) и политестов (на несколько компонентов) для исследования мочи (рН, кетоны, глюкоза, белок, билирубин, уробилиноген, эритроциты, гемоглобин, нитриты, удельный вес) и некоторых компонентов в сыворотке крови (например, мочевина, глюкоза, псевдо-холинэстераза). Оценка результатов производится визуально по цветной шкале и позволяет проводить полуколичественные определения.
Количественные методы «сухой химии» связаны с использованием измерительных приборов. Наиболее часто они основаны на принципах отражательной фотометрии, флюоресцентной спектроскопии, кондуктометрии.
Разработка систем “сухой химии” проводится по двум основным направлениям: с использованием многослойных пленок (слайдов) и с применением импрегнированных волокон.
Аналитические слайды состоят из нескольких слоев, каждый из которых выполняет свою функцию:
1. распределительный слой представляет собой полимер капиллярной структуры со свободным объемом 80%. Он обеспечивает быстрое и равномерное распространение анализируемой жидкости в более глубокие слои. При спектрофотометрическом определении этот слой служит отражающей поверхностью. Свет определенной длины волны проникает через прозрачное основание пленки, отражается от нижней поверхности распределительного слоя, улавливается фотодетектором и измеряется.
2. буферный слой содержит компоненты буферных смесей для поддержания оптимальной для химической реакции рН.
3. реакционный слой (каталитический). В этом слое происходит химическая реакция.
4. разделительный слой. Если продукты химических превращений мешают определению исследуемого вещества, их действие нивелируется физическими или химическими способами.
5. проявительный слой содержит красители или специальные реагенты для образования окрашенных продуктов реакции, которые могут быть определены количественно.
Технологии, основанные на использовании слайдов, впервые были предложены в лабораториях фирмы Коdak. В настоящее время микрослайдовые технологии этой фирмы широко используются в различных областях медицины (военной, экстремальной и.т.д.).
В тестах второго типа в качестве носителя используют импрегнированные волокна из чистой альфа-целлюлозы. Бумажные матрицы имеют стандартную плотность волокон и определенную толщину. Реактивы абсорбируются на носителе путем погружения в соответствующие растворы с последующим высушиванием. Ведущим производителем таких систем является фирма «Roche Diagnostics». Эти системы «сухой химии» позволяют определить количественно различные компоненты биожидкостей: ферменты, субстраты (глюкоза, холестерин, белок, билирубин и др.).
Системы “сухой химии” являются удобным диагностическим средством для тех ситуаций, когда необходимо получение быстрых и надежных результатов (скорая помощь; у постели больного; полевые условия, профосмотры, скрининговые обследования, амбулаторные приемы).
К их достоинствам относятся:
· быстрота и простота анализа;
· малый объем биопробы жидкости, необходимый для анализа;
· возможность получения качественных и полуколичественных результатов без использования оборудования и высококвалифицированного персонала;
· возможность проведения анализа в цельной крови (во многих случаях);
· простота обслуживания приборов для количественного определения.
Недостатками систем «сухой химии» являются:
· довольно высокая стоимость анализа;
· зависимость выбора метода от производителя;
· возможность интерференции лекарств.
Основная часть стоимости приходится на дорогостоящую технологию, так как каждая партия требует калибровки, и специфическая информация для каждого носителя реактивов должна быть нанесена на магнитный код.
4.6. Молекулярно-биологические методы исследований
Молекулярно-биологические исследования – группа методов, предназначенных для детекции в биологическом материале нуклеиновой кислоты (РНК, ДНК).
В основе молекулярно-биологических исследований лежит воспроизведение механизма дублирования наследственной информации в геноме. Последовательность нуклеотидов в одиночной цепи ДНК или РНК закономерно воспроизводится в последовательности нуклеотидов комплементарной цепи благодаря исключительным биологическим свойствам азотистых оснований и специфических ферментных систем.
Технология амплификации, то есть производства множества копий ДНК из участка искомой ДНК или РНК, в клинико-диагностических лабораториях наиболее широко используется в формате полимеразной цепной реакции (ПЦР).
Полимеразная цепная реакция была разработана сотрудником американской компании «Cetus» К. Мюллисом в 1983 г. Спустя 10 лет за это открытие ему была присуждена Нобелевская премия. В основе ПЦР лежит комплементарное достраивание ДНК-матрицы (репликация ДНК), осуществляемое in vitro с помощью фермента ДНК-полимеразы. Число копий специфического фрагмента ДНК увеличивается экспоненциально. Благодаря этому, последовательности, присутствующие в изучаемом материале в минимальном количестве (например, при исследовании клеток всего одна аномальная последовательность на 100 тыс – 1 млн клеток) и не поддающиеся обнаружению никакими другими методами, легко выявляются с помощью ПЦР.
Организация лаборатории для ПЦР и правила работы регламентируются нормативными документами. Требования к площади: 2 – 3 несмежных помещения общей площадью не менее 20-30 м2, оснащенных водопроводом и приточно-вытяжной вентиляцией. В случае использования электрофореза для разделения ампликонов, три процедуры (подготовка анализируемых проб, амплификация и детекция результатов) должны быть физически изолированы друг от друга для предотвращения контаминации, и проводиться в разных помещениях, оснащенных предбоксами. Работа проводится в лабораторной одежде, сменяемой при переходе из одного помещения в другое.
Минимальный комплект оборудования (при электрофоретической детекции результатов): амплификатор (термоциклер); термостат для термоподготовки проб; настольная центрифуга; центрифуга-вортекс; камера для электрофореза; источник питания для электрофореза; трансиллюминатор («столик с подсветкой») для просмотра гелей, ламинарный бокс.
ПЦР-диагностика включает следующие этапы:
¨ подготовка образца для тестирования;
¨ постановка и проведение собственно ПЦР (проведение реакции, направленной на накопление объекта исследования – амплификация);
¨ оценка результата (детекция ампликонов).
Подготовка образца для тестирования включает взятие материала и выделение мишеневой ДНК. Для проведения ПЦР необходимо выбрать биологический материал, с наибольшей вероятностью содержащий искомую ДНК (РНК). При этом для получения адекватных результатов большое значение имеет качество взятия образца для исследования, его хранение, транспортировка и предварительная обработка. ПЦР-анализ относится к прямым методам лабораторного исследования – образец анализируется на наличие ДНК (например, возбудителя). Поэтому для ПЦР-анализа пригоден любой клинический материал, потенциально содержащий возбудителей инфекций (соскоб эпителиальных клеток, мазок, плазма крови, сыворотка, лейкоцитарная масса, осадок мочи, слюна, спинномозговая жидкость, биоптаты и др.). При взятии биопроб для ПЦР-диагностики инфекционных заболеваний необходимо соблюдать следующие общие рекомендации:
· Взятие материала производить из предполагаемого места обитания микробов. При этом учитывать, что различные микроорганизмы имеют свои особенности локализации, пути распространения и выделения.
· Взятие биологического материала производить, по-возможности, в период обострения инфекции. За 10 дней до взятия материала на исследование необходимо прекратить прием химиопрепаратов и лечебные процедуры. У женщин материал следует брать перед менструацией или через 1-2 дня после ее окончания, причем накануне обследования женщины не должны проводить туалет наружных половых органов и спринцевание. Взятие биоматериала для контроля эффективности лечения должно проводиться не ранее чем через 3-4 недели после окончания терапии.
· Количество материала, забираемого для исследования, не должно быть избыточным, так как вместе с возбудителем в пробу попадают вещества, которые могут вызвать ингибирование ПЦР или способствовать деградации ДНК при хранении и транспортировке. При взятии мазков и соскобов наиболее адекватным инструментом является специальный урогенитальный зонд (щеточка), который собирает необходимое количество эпителия, не травмируя слизистую, и хорошо отдает собранный материал в жидкую транспортную среду.
· Для взятия биопроб необходимо пользоваться только одноразовым инструментом и одноразовыми пластиковыми контейнерами (или пробирками с транспортной средой) с плотно закрывающейся или завинчивающейся крышкой.
· При использовании венозной крови получают материал натощак из локтевой вены в одноразовую пластиковую пробирку с антикоагулянтом (ЭДТА иди цитрат натрия; гепарин использовать не рекомендуется) при необходимости исследования плазмы или без него (если предполагается исследовать сыворотку). Для исследования необходимо 1 мл отделенной плазмы или сыворотки.
Биологический материал, доставленный в ПЦР-лабораторию, исследуется в течение 2-х часов, а при необходимости сохраняется в замороженном виде (-18…-200С) в течение 2-х недель (допускается только одно замораживание-оттаивание материала).
Для проведения ПЦР-анализа доставленный материал подвергается специальной обработке, в результате которой происходит лизис клеточного материала, удаление белковых и полисахаридных фракций, и получение раствора ДНК или РНК, свободной от ингибиторов и готовой для следующего этапа (амплификации). Выбор методики выделения ДНК (РНК) определяется, прежде всего, характером обрабатываемого клинического материала.
Накопление объекта исследования (амплификация)
Процесс амплификации проводится в специальном программируемом термостате – амплификаторе, который по заданной программе автоматически осуществляет смену температур согласно числу циклов амплификации.
Каждый цикл амплификации при полимеразной цепной реакции протекает в присутствии следующих основных компонентов:
· ДНК-матрица (ДНК или ее часть, содержащая искомый специфический фрагмент ДНК в образце любого происхождения);
· два синтетических олигонуклеотидных праймера, ограничивающих искомую мишеневую последовательность ДНК. Праймеры – синтетические олигонуклеотидные цепочки (20-30 нуклеотидов) со строго заданной последовательностью нуклеотидов, комплементарные определенным участкам на мишеневой ДНК.
· четыре дезоксирибонуклеотида – аденозин, цитидин, гуанозин, тимидин, которые являются материалом для синтеза новых комплементарных цепей ДНК;
· термостабильная ДНК-полимераза (Taq-полимераза), выдерживающая нагревание до 95°С, катализирующая удлинение цепей праймеров путем последовательного присоединения нуклеотидных оснований из смеси дезоксирибонуклеотидов к растущей цепи синтезируемой ДНК;
· реакционная среда с обязательным присутствием ионов магния, необходимых для поддержания активности ДНК-зависимой ДНК-полимеразы.
Исследователь должен заранее определиться какой участок ДНК из известной нуклеотидной последовательности определенного фрагмента ДНК-матрицы будет являться мишеневым (то есть подлежать копированию). В качестве мишеневой ДНК обычно выбирают высококонсервативные области генома, являющиеся специфичными, уникальными, например, для данного вида возбудителя. Следует помнить, что правильный выбор маркерного участка ДНК предопределяет специфичность реакции. Этот этап имеет важнейшее значение, так как может существенно повлиять на результат исследований и таит в себе наибольшее количество ошибок.
В основе данного этапа ПЦР лежат особенности синтеза ДНК. Известно, что комплементарное достраивание цепи ДНК начинается не в любой точке последовательности ДНК, а только в определенных стартовых блоках – коротких двунитевых участках. В случае присоединения таких блоков к специфическим участкам ДНК можно направить процесс синтеза новой цепи только в этом участке, а не по всей длине цепи ДНК. Для создания стартовых блоков в заданных участках ДНК используют две олигонуклеотидные «затравки» (их называют праймеры), содержащие 20-30 нуклеотидов, которые комплементарны последовательностям ДНК на правой и левой границах специфического фрагмента и ориентированы таким образом, что достраивание новой цепи ДНК происходит только между ними.
Для получения достаточного количества копий искомого специфического фрагмента амплификация ДНК должна включать несколько (20–40) циклов, каждый из которых состоит из 3-х основных этапов (рисунок 4.18).
![]()
Рисунок 4.18 - Основные этапы процесса амплификации
1. Денатурация ДНК – плавление ДНК (при 93-950С в течение 30 – 40 с) и разъединение цепей, в результате чего цепочки ДНК становятся доступными для праймеров.
2. Присоединение праймеров (отжиг), происходит комплементарно к соответствующим последовательностям противоположных однонитевых цепей ДНК на границах cпецифического участка. Присоединенные праймеры ориентированы в направлении 5' -3', при этом 3' концы обращены друг к другу. Для каждой пары праймеров существует своя температура отжига в интервале 50 – 65 0С. Продолжительность отжига 20-60 с.
3. Элонгация – комплементарное достраивание ДНК, происходит от 5'-конца к 3'-концу цепи в противоположных направлениях, начиная с участков присоединения праймеров. Материалом для синтеза новых цепей являются присутствующие в реакционной среде дезоксирибонуклеотиды. Процесс синтеза происходит при температуре 70-720С, продолжительность этапа – 20-40 с.
Цель первого цикла амплификации – получение двух копий заданного гена. После первого цикла амплификации синтез первых двух копий мДНК заканчивается произвольно (праймерами не ограничен), поэтому на обоих их 3' концах образуются «лохмотья», то есть участки нити ДНК различной длины. Со второго цикла амплификации начинают синтезироваться ампликоны. Ампликоны – короткие, ограниченные по длине с 3' и 5' концов праймерами, продукты амплификации мишеневой ДНК.
Циклы амплификации повторяются многократно (30-50 раз), в результате каждого последующего цикла количество ампликонов удваивается и становится достаточным для детекции.
Детекция продуктов амплификации в традиционной ПЦР осуществляется следующими основными методами:
· электрофоретическое разделение ампликонов с последующей их визуализацией окрашиванием, например, бромидом этидия;
· гибридизационные методы детекции в планшетном формате с использованием иммуноферментной реакции с флюорогенными субстратами или прямого измерения флюоресценции олигонуклеотидного зонда после его гибридизации с продуктами реакции в жидкой фазе, либо на специальной подложке;
· высокоэффективная жидкостная хроматография.
Среди перечисленных методов детекции наиболее широко используется электрофорез ПЦР-амплификационной смеси на агарозном или полиакриламидном гелях. Специфичность полученного ампликона подтверждается его положением (размерами) по отношению к маркерным фрагментам или ДНК-стандарту, обязательно входящему в состав диагностической ПЦР тест-системы. Этап электрофореза увеличивает время и трудоемкость анализа, а значит, и стоимость. Поэтому в последние годы разработаны методы, позволяющие производить оценку результатов без процедуры электрофореза или с использованием скоростных и механизированных вариантов.
Специфичность ПЦР в разных лабораториях – 97-98%. Ложноположительные результаты обычно являются следствием контаминации (попадание из внешней среды в реакционную смесь специфических молекул ДНК). Перекрестная контаминация от пробы к пробе может наблюдаться в процессе обработки биоматериала или при раскапывании реакционной смеси. Она приводит к появлению спорадических ложноположительных результатов (случайные ошибки). С другой стороны, возможна контаминация продуктами амплификации (ампликонами), имеющая наибольшее значение, так как ампликоны в процессе реакции накапливаются в огромных количествах и могут загрязнять посуду, автоматические пипетки, лабораторные столы или даже поверхность кожи сотрудников через аэрозоли и загрязнение приборов. Такая контаминация приводит к появлению систематических ложноположительных результатов. Отсюда необходимость жестких требований к условиям организации ПЦР-лабораторий и проведению ПЦР-анализа (см. выше).
4.6.1. Применение ПЦР в клинической практике
Наиболее широко молекулярно-биологические методы используются в микробиологии, вирусологии и в онкологии.
В микробиологии и вирусологии этим методом определяют клинически важные виды бактерий, грибов, вирусов, а также оценивают их вирулентность и устойчивость штаммов к лекарствам. Применение ПЦР как метода микробиологической диагностики имеет ряд преимуществ по сравнению с традиционными методами:
· Прямое определение наличия возбудителей
· Высокая чувствительность
Чувствительность ПЦР тест-систем составляет 10–1000 клеток возбудителя в анализируемой пробе, в то время как чувствительность иммунологических, паразитологических тестов колеблется в пределах 103–105 клеток.
Следует, однако, отметить, что высокая чувствительность ПЦР создает и определенные клинические проблемы. В частности, встает вопрос о клиническом значении выявляемых ПЦР чрезвычайно низких количеств патогена. Кроме того, метод ПЦР сложно использовать для мониторирования эффективности терапии, в связи с тем, что метод детектирует как живые, так и погибшие микроорганизмы.
· Высокая специфичность
Высокая специфичность метода обусловлена тем, что в исследуемом материале выявляется уникальный, характерный только для данного вида фрагмент ДНК либо РНК. Специфичность задается нуклеотидной последовательностью специфических праймеров и специально отрабатываемыми жесткими условиями их присоединения или «отжига» к искомой молекуле ДНК.
· Простота исполнения, возможность полной автоматизации и быстрота получения результатов
· Использование для анализа непосредственно клинического и патологического материала
Метод ПЦР позволяет проводить определение возбудителя заболеваний непосредственно в клиническом материале (кровь, мазки, смывы, соскобы, слюна, мокрота, спинномозговая жидкость, желудочный сок, биоптаты и т.д.). Для проведения анализа не требуется выделения и выращивания культуры возбудителя.
· Малое количество используемого материала для исследований
Количество исследуемого материала может составлять несколько десятков микролитров, так как в результате проведения ПЦР концентрация анализируемого участка ДНК (РНК) выявляемого возбудителя увеличивается в сотни и тысячи раз.
· Возможность выявления некультивируемых, труднокультивируемых или персистирующих форм патогенных организмов
Особенно это важно при обследовании серонегативных пациентов на самых ранних стадиях развития патологического процесса, когда лечение наиболее эффективно. При диагностике с помощью ПЦР достигается размножение не тестируемого организма, а только специфического фрагмента его ДНК, являющегося маркерным для данного вида.
· Исключение возможности инфицирования персонала в процессе проведения ПЦР
Исследуемый материал может быть дезинфицирован химической или термической обработкой в момент его взятия, следовательно, исключается возможность инфицирования персонала в процессе проведения ПЦР.
В онкологии метод используется для поиска клинически значимых маркеров злокачественности и определения их количества у пациентов, для определения микрометастазов и минимальной остаточной болезни, а также для контроля за результатами терапии. Метод хорошо зарекомендовал себя как очень чувствительный (~1 раковая клетка на 106 нормальных клеток) и высокоточный метод для детекции раковых клеток в жидкостях организма.
В акушерстве перспективно использование ПЦР в предимплантационной и пренатальной диагностике, скрининге новорожденных. В терапевтической практике – для оценки генетической предрасположенности к различным заболеваниям, генотипирования ферментов метаболизма лекарственных средств и выявления степени чувствительности или резистентности к определенным препаратам.
4.6.2. ПЦР в реальном времени
Полимеразная цепная реакция в реальном времени (real-time PCR) – реакция, в ходе которой детекция продуктов ПЦР происходит непосредственно во время амплификации по мере накопления в каждом цикле, то есть в режиме реального времени.
Преимущества real-time PCR:
· возможность размещения в одной комнате;
· исключение контаминации продуктами реакции;
· снижение трудозатрат;
· быстрота выполнения;
· параллельная детекция до 4-х возбудителей в одном образце.
Для постановки ПЦР в реальном времени необходим специальный прибор, в котором одновременно проводится амплификация, гибридизация с флуоресцентным зондом и детекция результатов по флуоресцентному свечению метки.
Для детекции продуктов амплификации используют 2 основных подхода:
· Интеркалирующие красители. Принцип – флуоресценция метки (бромистого этидия) значительно возрастает при внедрении в двойную цепь молекулы ДНК, а, следовательно, дает возможность наблюдать накопление продуктов амплификации.
· Использование ДНК-зондов, в состав которых входят флюоресцентная метка и гаситель флюоресценции. Когда зонд находится в растворе, гаситель поглощает испускаемое меткой излучение и свечение отсутствует. Когда в ходе ПЦР происходит присоединение ДНК-зонда к комплементарной цепи ДНК, происходит разъединение метки и гасителя, что приводит к увеличению детектируемого свечения (рисунок 4.19). Чем больше ампликонов наработано, тем интенсивнее флюоресценция.
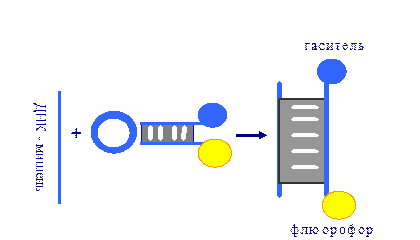
Рисунок 4.19 – Схема работы ДНК-зонда (пояснения в тексте)
В настоящее время real-time PCR считается наиболее чувствительным способом для определения количества специфической нуклеиновой кислоты в сложном биологическом образце. Метод позволяет определять относительное и абсолютное количество последовательности-мишени в широком диапазоне (7–8 порядков величины в сравнении с 3–4 порядками для традиционной ПЦР) при общей продолжительности анализа от 30 мин до 2 ч.
ПЦР in situ
Этот метод стал активно развиваться в последнее время, благодаря тому, что он, в отличие от ПЦР, проводимой в растворе, позволяет не только амплифицировать какую-либо последовательность ДНК, но и локализовать ее внутри клетки. По чувствительности метод сравним с ПЦР, проводимой в растворе. Исследование проводится с клеточным монослоем или срезом ткани, который после фиксации обрабатывают протеолитическими ферментами, а затем определяют продукты ПЦР. Метод очень перспективен в изучении латентных вирусных инфекций и оценке эффекта действия новых лекарственных средств на клеточном и молекулярном уровне.
Приложение I
Перевод общепринятых единиц в единицы СИ (Меньщиков В.В., 2002)
|
Аналит/параметр |
Общепринятые единицы |
Коэффициент |
Единицы СИ |
|||
|
в СИ |
в общеприн. ед. |
|
||||
|
Адреналин |
нг/л |
5,46 |
0,183 |
пмоль/л |
||
|
Адреналин (моча) |
мкг/24часа |
5,46 |
0,183 |
нмоль/сут |
||
|
Адренокортикотропин |
нг/л |
0,220 |
4,541 |
пмоль/л |
||
|
Альбумин |
г/100мл |
10 |
0,10 |
г/л |
||
|
Альдостерон |
мг/100 мл |
27,74 |
0,036 |
пмоль/л |
||
|
Амикацин |
мкг/мл |
1,71 |
0,585 |
мкмоль/л |
||
|
δ - Аминолевулиновая кислота |
мг/24часа |
7,626 |
0,131 |
мкмоль/сут |
||
|
Аммиак |
мг/100 мл |
0,587 |
1,703 |
мкмоль/л |
||
|
3'-5'-циклический АМФ |
нг/мл |
3,04 |
0,329 |
нмоль/л |
||
|
Аскорбиновая кислота |
мг/100 мл |
56,78 |
0,0176 |
мкмоль/л |
||
|
Ацетилсалициловая кислота |
мг/л |
0,00724 |
138 |
ммоль/л |
||
|
Белок |
мг/100 мл |
10,0 |
0,1 |
г/л |
||
|
Белок (моча) |
мг/г креатинина |
0,113 |
8,85 |
г/моль креатинина |
||
|
Билирубин |
мг/lW мл |
17,1 |
0,0585 |
мкмоль/л |
||
|
Вальпроевая кислота |
мг/л |
6,93 |
0,144 |
мкмоль/л |
||
|
Ванилилминдальная кисл. |
мг/24часа |
5,03 |
0,199 |
мкмоль/сут |
||
|
Ванкомицин |
мкг/мл |
0,690 |
1,449 |
мкмоль/л |
||
|
Витамин А |
мкг/100 мл |
0,0349 |
28,65 |
мкмоль/л |
||
|
Витамин В1 |
мкг/100 мл |
33,3 |
0,03 |
нмоль/л |
||
Витамин В6 |
нг/Мл |
3,82 |
0,262 |
нмоль/л |
||
|
Витамин В12 |
мг/100 мл |
0,738 |
1.355 |
мкмоль/л |
||
|
Витамин С |
мг/100 мл |
56,78 |
0,0176 |
мкмоль/л |
||
|
25-гидрокси-Витамин Д |
нг/мл |
2,50 |
0,401 |
нмоль/л |
||
|
Витамин Е (α - токоферол) |
мг/100 мл |
23.2 |
0,043 |
мкмоль/л |
||
|
Галактоза |
мг/100 мл |
0,0555 |
18,02 |
ммоль/л |
||
|
Галактоза (моча) |
мг/24 часа |
0,0055 |
180,2 |
ммоль/сут |
||
|
Гаптоглобин |
мг/100 мл |
0,0100 |
100,00 |
г/л |
||
|
Гемоглобин |
мг/100 мл |
0,621 |
1,61 |
мкмоль/л |
||
|
Гентамицин |
мкг/мл |
2,09 |
0,478 |
мкмоль/л |
||
|
5 Гидроксиндолилуксусная кислота |
мг/24часа |
5,23 |
0,191 |
мкмоль/сут |
||
|
17-Гидроксикортикостероиды |
мг/100 мл |
27,9 |
0,036 |
мкмоль/л |
||
|
17-Гидроксипрогестерон |
нг/мл |
3,03 |
0,330 |
нмоль/л |
||
|
Гидроксипролин |
мг/л |
7,626 |
0.131 |
мкмоль/л |
||
|
Глицерин |
мг/100 мл |
0,109 |
9.209 |
ммоль/л |
||
|
Глюкоза |
мг/100 мл |
0,0555 |
18,02 |
ммоль/л |
||
|
Гомоцистеиновая кислота |
мг/л |
7,41 |
0,135 |
мкмоль/л |
||
|
Дигитоксин |
мкг/л |
1,31 |
0,763 |
нмоль/л |
||
|
Дигоксин |
мкг/л |
1,28 |
0,781 |
нмоль/л |
||
|
Дизопирамид |
мг/л |
2,95 |
0,339 |
мкмоль/л |
||
|
Дофамин |
нг/л |
6,54 |
0,153 |
пмоль/л |
||
|
Дофамин (моча) |
мкг/24часа |
6,54 |
0,153 |
нмоль/сут |
||
|
Железо |
мкг/100 мл |
0,179 |
5.59 |
мкмоль/л |
||
|
Железо (моча) |
мкг/24часа |
0,0179 |
55,9 |
мкмоль/сут |
||
|
Железосвязывающая способность |
мкг/100 мл |
0,179 |
5,59 |
мкмоль/л |
||
|
Инсулин |
мкЕд/мл |
7,241 |
0,138 |
пмоль/л |
||
|
Калий |
мг/100 мл |
0,256 |
3,91 |
ммоль/л |
||
|
Кальций |
мг/100 мл |
0,250 |
4,01 |
ммоль/л |
||
|
Кальций (моча) |
мг/24часа |
0,025 |
40,1 |
ммоль/сут |
||
|
Кальций (моча) |
мг/г креатинина |
0,00282 |
355 |
моль/моль креатинина |
||
|
Кальцитонин |
мг/л |
0,28 |
3.57 |
пмоль/л |
||
|
Карбамазепин |
мг/л |
4.23 |
0,236 |
мкмоль/л |
||
|
Каротин |
мкг/100 мл |
0,0186 |
53.69 |
мкмоль/л |
||
|
Копропорфирины |
мкг/л |
1,527 |
0,655 |
нмоль/л |
||
|
Кортизол |
мкг/100 мл |
0,0276 |
36.25 |
мкмоль/л |
||
|
Кортизол (моча) |
мг/24часа |
2,76 |
0.363 |
нмоль/сут |
||
Кофеин |
мкг/мл |
5,15 |
0,194 |
мкмоль/л |
||
|
Креатин |
мг/100 мл |
76,25 |
0,0131 |
мкмоль/л |
||
|
Креатин (моча) |
мг/24часа |
0,0753 |
131 |
ммоль/сут |
||
|
Креатинин |
мг/100 мл |
88,4 |
0,0113 |
мкмоль/л |
||
|
Креатинин (моча) |
г/24часа |
8,84 |
0,113 |
ммоль/сут |
||
|
Лактат |
мг/100 мл |
0,111 |
9,008 |
ммоль/л |
||
|
Лейцин |
мг/100 мл |
76,3 |
0,0131 |
мкмоль/л |
||
|
Лецитин |
мг/100 мл |
12,5 |
0,080 |
мкмоль/л |
||
|
Лидокаин |
мг/л |
4,27 |
0,234 |
мкмоль/л |
||
|
Магний |
мг/100 мл |
0,411 |
2,431 |
ммоль/л |
||
|
Магний (моча) |
мг/24часа |
0,0411 |
24,31 |
ммоль/сут |
||
|
Магний (моча) |
мг/г креатинина |
0,00465 |
215 |
моль/моль креатинина |
||
|
Медь |
мкг/100 мл |
0,157 |
6,354 |
мкмоль/л |
||
|
Медь (моча) |
мг/24часа |
0,0157 |
63,54 |
мкмоль/сут |
||
|
Метгемоглобин (НЬ/4:М= 16114,5) |
мг/100 мл |
621,1 |
0,0016 |
мкмоль/л |
||
|
Миоглобин |
мг/100 мл |
0,585 |
1,71 |
мкмоль/л |
||
|
Мочевая кислота |
мг/100 мл |
59,5 |
0,0168 |
мкмоль/л |
||
|
Мочевая кислота (моча) |
г/24часа |
5,95 |
0,168 |
ммоль/сут |
||
|
Мочевая кислота (моча) |
мг/г креатинина |
0,00067 |
1487 |
моль/моль креатинина |
||
|
Мочевина |
мг/100 мл |
0,167 |
6,006 |
ммоль/л |
||
|
Мочевина (моча) |
г/24часа |
16,7 |
0,06 |
ммоль/сут |
||
|
Мочевина (моча) |
г/г креатинина |
1,88324 |
0,531 |
моль/моль креатинина |
||
|
Натрий |
мг/100 мл |
0,435 |
2.30 |
ммоль/л |
||
|
Натрий (моча) |
г/г креатинина |
4,90 |
0,204 |
моль/моль креатинина |
||
|
Норадреналин |
нг/л |
5,91 |
0,169 |
пмоль/л |
||
|
Норадреналин (моча) |
мг/24часа |
5,91 |
0,169 |
нмоль/сут |
||
|
Оксалат (моча) |
мг/24часа |
11,4 |
0,088 |
мкмоль/сут |
||
|
Оксигемоглобин |
% |
0,0100 |
100,00 |
1 |
||
|
Пируват |
мг/100 мл |
113,6 |
0,0088 |
мкмоль/л |
||
|
Порфирин (моча) |
мкг/24часа |
1,2 |
0,833 |
нмоль/сут |
||
|
Порфобилиноген |
мг/л |
4,42 |
0,226 |
мкмоль/л |
||
|
Примидон |
мг/л |
4,58 |
0,218 |
мкмоль/л |
||
|
Прогестерон |
нг/мл |
3,18 |
0,314 |
нмоль/л |
||
|
Прокаинамид |
мг/л |
4,23 |
0,236 |
мкмоль/л |
||
|
Пролактин |
нг/мл |
27,6 |
0,0362 |
мЕд/л |
||
|
рС02 |
мм рт.ст. |
0,133 |
7,502 |
кРа |
||
|
р02 |
мм рт.ст. |
0,133 |
7,502 |
кРа |
||
|
Ртуть |
мкг/л |
0,0050 |
200,60 |
мкмоль/л |
||
|
Салицилат |
мг/л |
0,00724 |
138 |
ммоль/л |
||
|
Свинец |
мкг/100мл |
0,0483 |
20,72 |
мкмоль/л |
||
|
Селен |
мкг/л |
0,0127 |
78,96 |
мкмоль/л |
||
|
Сорбитол |
мг/100 мл |
54,9 |
0,018 |
мкмоль/л |
||
|
Таллий |
мкг/д |
5,92 |
0,169 |
нмоль/л |
||
|
Тестостерон |
нг/мл |
3,47 |
0,288 |
нмоль/л |
||
|
Теофиллин |
мг/л |
5,55 |
0,180 |
мкмоль/л |
||
|
Тироксин (Т4) |
мкг100 мл |
12,87 |
0,078 |
нмоль/л |
||
|
Тироксин свободный (FT4) |
мг/100 мл |
12,87 |
0,078 |
пмоль/л |
||
|
Тироксинсвязывающий глобулин |
мкг/мл |
1 |
1 |
мг/л |
||
|
Тобрамицин |
мг/л |
2,14 |
0,467 |
мкмоль/л |
||
|
Трансферрин |
мг/100 мл |
0,114 |
8,80 |
мкмоль/л |
||
|
Триглицериды |
мг/100 мл |
0,0114 |
87,5 |
ммоль/л |
||
|
Трийодтиронин (ТЗ) |
нг/мл |
1,536 |
0,651 |
нмоль/л |
||
|
Трийодтиронин свободный (FТЗ) |
пг/мл |
1,536 |
0,651 |
пмоль/л |
||
|
Уробилиноген |
мг/100 мл |
16,9 |
0,059 |
мкмоль/л |
||
|
Фенилаланин |
мг/100 мл |
0,061 |
16,5 |
ммоль/л |
||
|
Фенитоин |
мг/л |
3,96 |
0,252 |
мкмоль/л |
||
|
Фенобарбитал |
мг/л |
4,31 |
0,232 |
мкмоль/л |
||
|
Ферритин |
нг/л |
1 |
1 |
мкг/л |
||
|
Флюорид |
мкг/л |
0,053 |
19,0 |
мкмоль/л |
||
|
Фолиевая кислота |
мкг/100 мл |
22,66 |
0,0441 |
нмоль/л |
||
|
Фосфат неорганический |
мг/100 мл |
0,3229 |
3,097 |
ммоль/л |
||
|
Фосфат (моча) |
г/24 часа |
32,3 |
0,031 |
ммоль/сут |
||
|
Фосфат (моча) |
мг/г креатинина |
0,00361 |
277 |
моль/моль креатинина |
||
|
Фосфолипиды |
мг/100 мл |
0,0129 |
77,52 |
ммоль/л |
||
|
Фруктоза |
мг/100 мл |
0,0555 |
18,02 |
ммоль/л |
||
|
Фруктоза (моча) |
мг/24 часа |
0,0055 |
180,2 |
ммоль/сут |
||
|
Хинидин |
мг/л |
3,08 |
0,325 |
мкмоль/л |
||
|
Хлориды |
мг/100 мл |
0,282 |
3,545 |
ммоль/л |
||
|
Хлориды (моча) |
г/г креатинина |
3,18 |
0,314 |
моль/моль креатинина |
||
|
Хлорамфеникол |
мкг/мл |
3,09 |
0,323 |
мкмоль/л |
||
|
Холестерин |
мкг/100 мл |
0,026 |
38,66 |
ммоль/л |
||
|
Церулоплазмин |
мкг/100 мл |
0,0625 |
16 |
мкмоль/л |
||
|
Цистин (моча) |
мг/24 часа |
8,34 |
0,12 |
мкмоль/сут |
||
|
Цинк |
мкг/100 мл |
0,153 |
0,537 |
мкмоль/л |
||
|
Цитрат |
мкг/100 мл |
52,1 |
0,019 |
мкмоль/л |
||
|
Цитрат (моча) |
мг/24часа |
0,0052 |
192 |
ммоль/сут |
||
|
Эстрадиол |
пг/мл |
3,67 |
0,272 |
пмоль/л |
||
|
Эстриол |
мкг/100 мл |
34,68 |
0,0288 |
нмоль/л |
||
|
Эстрон |
мкг/100 мл |
3,698 |
0,270 |
нмоль/л |
||
|
Этанол |
мг/100 мл |
0,217 |
4,608 |
ммоль/л |
||
|
Этосуксимид |
мг/л |
7,08 |
0,141 |
мкмоль/л |
||
Коэффициенты перевода единиц активности ферментов.
|
Единица |
Коэффициент |
Единица |
|
мккат/л |
60 |
Ед/л |
|
нкат/л |
0,06 |
Ед/л |
|
Ед/л |
0,0167 |
мккат/л |
|
Ед/л |
16,67 |
нкат/л |
|
Соответствие единиц |
||
|
1 мккат/л = 1 мкмоль/(с.л) 1 |
мкмоль/мин = 16,67 нкат |
|
|
1 нкат/л = 1 нмоль/(с.л) 1 |
мкмоль/мин = 1 Ед |
|
Приложение II
ПЕРЕЧЕНЬ
исследований в клинической лабораторной диагностике, выполняемых врачами
лабораторной диагностики и фельдшерами-лаборантами
(Рекоменндации)
|
№ п/п |
Наименование исследований |
Специалист, выполняющий исследование |
|
|
1 |
2 |
3 |
|
|
Глава 1. Общеклинические исследования |
|||
|
1.1 |
Исследование мочи: |
||
|
1.1.1 |
определение количества, цвета, прозрачности, наличия осадка, относительной плотности, pH |
Фельдшер-лаборант |
|
|
1.1.2 |
обнаружение глюкозы экспресс-тестом |
Фельдшер-лаборант |
|
|
1.1.3 |
обнаружение белка экспресс-тестом |
Фельдшер-лаборант |
|
|
1.1.4 |
обнаружение белка с сульфосалициловой кислотой |
Фельдшер-лаборант |
|
|
1.1.5 |
определение белка с сульфосалициловой кислотой |
Фельдшер-лаборант |
|
|
1.1.6 |
определение белка с пирогаллоловым красным |
Фельдшер-лаборант |
|
|
1.1.7 |
обнаружение белка Бенс-Джонса по реакции коагуляции с уксусной кислотой |
Фельдшер-лаборант |
|
|
1.1.8 |
обнаружение кетоновых тел экспресс-тестом |
Фельдшер-лаборант |
|
|
1.1.9 |
обнаружение билирубина экспресс-тестом |
Фельдшер-лаборант |
|
|
1.1.10 |
обнаружение уробилиновых тел экспресс-тестом |
Фельдшер-лаборант |
|
|
1.1.11 |
исследование комплекса параметров общего анализа мочи посредством полуавтоматических анализаторов на основе методов сухой химии |
Фельдшер-лаборант |
|
|
1.1.12 |
микроскопическое исследование осадка мочи в норме |
Фельдшер-лаборант |
|
|
1.1.13 |
микроскопическое исследование осадка мочи при патологии |
Врач лабораторной диагностики; |
|
|
1.1.14 |
подсчет количества форменных элементов в суточном объеме мочи по методу Каковского-Аддиса |
Врач лабораторной
диагностики; |
|
|
1.1.15 |
подсчет количества форменных элементов в 1 мл мочи по методу Нечипоренко |
Врач лабораторной
диагностики; |
|
|
1.1.16 |
определение концентрационной способности почек по Зимницкому |
Фельдшер-лаборант |
|
|
1.2 |
Исследование спинномозговой жидкости: |
|
|
|
1.2.1 |
определение цвета, прозрачности, относительной плотности, фибринозной пленки |
Фельдшер-лаборант |
|
|
1.2.2 |
обнаружение белка по реакции Панди |
Фельдшер-лаборант |
|
|
|
определение белка с сульфосалициловой кислотой |
Фельдшер-лаборант |
|
|
1.2.3 |
определение белка с пирогаллоловым красным |
Фельдшер-лаборант |
|
|
1.2.4 |
определение количества клеточных элементов (цитоз) и их дифференцированный подсчет в нативном препарате |
Врач лабораторной диагностики |
|
|
1.2.5 |
микроскопическое исследование в окрашенном препарате |
Врач лабораторной диагностики |
|
|
1.3 |
Исследование экссудатов и транссудатов: |
|
|
|
1.3.1 |
определение количества, характера, цвета, прозрачности, относительной плотности |
Фельдшер-лаборант |
|
|
1.3.2 |
обнаружение белка по реакции Ривальта |
Фельдшер-лаборант |
|
|
1.3.3 |
микроскопическое исследование транссудатов и экссудатов |
Фельдшер-лаборант |
|
|
1.4 |
Исследование мокроты: |
|
|
|
1.4.1 |
определение количества, цвета, характера, консистенции, запаха |
Фельдшер-лаборант |
|
|
1.4.2 |
микроскопическое исследование мокроты в нативном препарате |
Фельдшер-лаборант |
|
|
1.4.3 |
микроскопическое исследование мокроты в окрашенном препарате |
Фельдшер-лаборант |
|
|
1.4.4 |
обнаружение микобактерий туберкулеза в окрашенном препарате |
Фельдшер-лаборант |
|
|
1.4.5 |
микроскопия на кислотоупорные микробактерии в окрашенных по Цилю-Нильсену препаратах количественным методом в 100 полях зрения |
Фельдшер-лаборант |
|
|
1.5 |
Исследование желудочного содержимого: |
|
|
|
1.5.1 |
определение количества, цвета, слизи и патологических примесей |
Фельдшер-лаборант |
|
|
1.5.2 |
определение кислотности методом титрования |
Фельдшер-лаборант |
|
|
1.5.3 |
микроскопическое исследование |
Фельдшер-лаборант |
|
|
1.6 |
Исследование дуоденального содержимого: |
|
|
|
1.6.1 |
определение количества, цвета, прозрачности, относительной плотности, pH |
Фельдшер-лаборант |
|
|
1.6.2 |
микроскопическое исследование (в 3 порциях) |
Фельдшер-лаборант |
|
|
1.7 |
Исследование синовиальной жидкости: |
|
|
|
1.7.1 |
определение физико-химических свойств |
Фельдшер-лаборант |
|
|
1.7.2 |
микроскопическое исследование с подсчетом количества форменных элементов (цитоз) в нативном препарате |
Фельдшер-лаборант |
|
|
1.7.3 |
микроскопическое исследование в окрашенном препарате |
Фельдшер-лаборант |
|
|
1.8 |
Исследование кала: |
||
|
1.8.1 |
определение цвета, формы, запаха, примесей, слизи, pH |
Фельдшер-лаборант |
|
|
1.8.2 |
обнаружение крови бензидиновой пробой |
Фельдшер-лаборант |
|
|
1.8.3 |
микроскопическое исследование (в 3 препаратах) |
Фельдшер-лаборант |
|
|
1.8.4 |
обнаружение простейших |
Фельдшер-лаборант |
|
|
1.8.5 |
обнаружение яиц гельминтов методом Като |
Фельдшер-лаборант |
|
|
1.8.6 |
обнаружение анкилостом |
Фельдшер-лаборант |
|
|
1.8.7 |
обнаружение микрофилярий в крови |
Фельдшер-лаборант |
|
|
1.8.8 |
исследование мочи на шистосомы |
Фельдшер-лаборант |
|
|
1.8.9 |
исследование кала на шистосомы |
Фельдшер-лаборант |
|
|
1.8.10 |
стронгилоидоз (метод Бермана) |
Фельдшер-лаборант |
|
|
1.9 |
Исследование соскоба на энтеробиоз |
Фельдшер-лаборант |
|
|
1.10 |
Исследование отделяемого мочеполовых органов: |
||
|
1.10.1 |
обнаружение трихомонад и гонококков в препаратах отделяемого мочеполовых органов, окрашенных метиленовым синим |
Фельдшер-лаборант |
|
|
1.10.2 |
обнаружение трихомонад и гонококков в препаратах отделяемого мочеполовых органов, окрашенных по Граму |
Врач лабораторной диагностики; |
|
|
1.11 |
Исследование эякулята человека: |
||
|
1.11.1 |
определение физико-химических свойств спермы |
Фельдшер-лаборант |
|
|
1.11.2 |
микроскопия нативного препарата |
Фельдшер-лаборант |
|
|
1.11.3 |
микроскопия окрашенного мазка |
Врач лабораторной диагностики; |
|
|
1.11.4 |
определение фруктозы в семенной жидкости |
Фельдшер-лаборант |
|
|
1.11.5 |
исследование эякулята с помощью автоматических анализаторов спермы |
Фельдшер-лаборант |
|
|
Глава 2. Гематологические исследования |
|||
|
2.1 |
Определение гемоглобина гемоглобин-цианидным методом |
Фельдшер-лаборант |
|
|
2.2 |
Подсчет эритроцитов в счетной камере |
Фельдшер-лаборант |
|
|
2.3 |
Определение гематокрита |
Фельдшер-лаборант |
|
|
2.4 |
Подсчет ретикулоцитов |
Врач лабораторной диагностики |
|
|
2.5 |
Подсчет эритроцитов с базофильной зернистостью |
Фельдшер-лаборант |
|
|
2.6 |
Подсчет тромбоцитов в окрашенных мазках по Фонио |
Фельдшер-лаборант |
|
|
2.7 |
Подсчет тромбоцитов фазово-контрастным методом |
Фельдшер-лаборант |
|
|
2.8 |
Определение скорости оседания эритроцитов |
Фельдшер-лаборант |
|
|
2.9 |
Подсчет лейкоцитов в счетной камере |
Фельдшер-лаборант |
|
|
2.10 |
Подсчет лейкоцитарной формулы с описанием морфологии форменных элементов крови |
Врач лабораторной диагностики; |
|
|
2.11 |
Подсчет миелокариоцитов |
Врач лабораторной диагностики |
|
|
2.12 |
Подсчет миелограммы |
Врач лабораторной диагностики |
|
|
2.13 |
Подсчет мегакариоцитов |
Врач лабораторной диагностики |
|
|
2.14 |
Подсчет LE-клеток по Новоселовой |
Врач лабораторной диагностики |
|
|
2.15 |
Исследование крови на малярийные паразиты с приготовлением толстой капли |
Врач лабораторной диагностики |
|
|
2.16 |
Исследование крови на малярийные паразиты в окрашенном мазке |
Врач лабораторной диагностики |
|
|
2.17 |
Определение активности щелочной фосфатазы методом азосочетания в периферической крови |
Врач лабораторной диагностики |
|
|
2.18 |
Определение активности щелочной фосфатазы в мазках костного мозга |
Врач лабораторной диагностики |
|
|
2.19 |
Определение активности кислой фосфатазы методом азосочетания в периферической крови |
Врач лабораторной диагностики |
|
|
2.20 |
Определение активности кислой фосфатазы в нейтрофилах |
Врач лабораторной диагностики |
|
|
2.21 |
Определение активности кислой фосфатазы в лимфоцитах |
Врач лабораторной диагностики |
|
|
2.22 |
Определение активности кислой фосфатазы в мазках костного мозга |
Врач лабораторной диагностики |
|
|
2.23 |
Определение активности кислой фосфатазы при ингибировании тартратом натрия |
Врач лабораторной диагностики |
|
|
2.24 |
Определение активности альфа-нафтил-A-S-D-хлорацетатэстеразы в периферической крови |
Врач лабораторной диагностики |
|
|
2.25 |
Определение активности альфа-нафтил-A-S-D-хлорацетатэстеразы в мазках костного мозга |
Врач лабораторной диагностики |
|
|
2.26 |
Определение активности альфа-нафтил-ацетатэстеразы в периферической крови |
Врач лабораторной диагностики |
|
|
2.27 |
Определение активности альфа-нафтил-ацетатэстеразы в мазках костного мозга |
Врач лабораторной диагностики |
|
|
2.28 |
Определение активности альфа-нафтил-ацетатэстеразы при ингибировании фторидом натрия |
Врач лабораторной диагностики |
|
|
2.29 |
Определение активности пероксидазы в клетках периферической крови |
Врач лабораторной диагностики |
|
|
2.30 |
Определение активности пероксидазы в клетках костного мозга |
Врач лабораторной диагностики |
|
|
2.31 |
Определение активности глюкозо-6-фосфат-дегидрогеназы в эритроцитах |
Врач лабораторной диагностики |
|
|
2.32 |
Определение активности сукцинатдегидрогеназы в периферической крови |
Врач лабораторной диагностики |
|
|
2.33 |
Определение активности альфа-глицерофосфатдегидрогеназы в клетках периферической крови |
Врач лабораторной диагностики |
|
|
2.34 |
Определение липидов в клетках периферической крови |
Врач лабораторной диагностики |
|
|
2.35 |
Определение липидов в клетках костного мозга |
Врач лабораторной диагностики |
|
|
2.36 |
Определение нейтральных мукополисахаридов (ШИК-реакция) в клетках периферической крови |
Врач лабораторной диагностики |
|
|
2.37 |
Определение нейтральных мукополисахаридов (ШИК-реакция) в мазках костного мозга |
Врач лабораторной диагностики |
|
|
2.38 |
Подсчет сидероцитов и сидеробластов в клетках периферической крови |
Врач лабораторной диагностики |
|
|
2.39 |
Подсчет сидероцитов и сидеробластов в клетках костного мозга |
Врач лабораторной диагностики |
|
|
2.40 |
Исследования с использованием гематологических анализаторов: |
||
|
2.40.1 |
полуавтоматических, без дифференцировки лейкоцитарной формулы |
Фельдшер-лаборант |
|
|
2.40.2 |
автоматических, без дифференцировки лейкоцитарной формулы |
Фельдшер-лаборант |
|
|
2.40.3 |
автоматических, с дифференцировкой лейкоцитарной формулы |
Фельдшер-лаборант |
|
|
Глава 3. Цитологические исследования |
|||
|
3.1 |
Тонкоигольная пункционная биопсия щитовидной железы одного образования с микроскопией 5 стекол |
Врач лабораторной диагностики; |
|
|
Глава 4. Биохимические исследования |
|||
|
4.1 |
Определение хлора меркуриметрическим методом в сыворотке крови |
Фельдшер-лаборант |
|
|
4.2 |
Исследования с использованием фотоэлектроколориметров и одноканальных биохимических автоматических фотометров: |
||
|
4.2.1 |
определение общего белка сыворотки крови |
Фельдшер-лаборант |
|
|
4.2.2 |
определение альбумина сыворотки крови |
Фельдшер-лаборант |
|
|
4.2.3 |
тимоловая проба |
Фельдшер-лаборант |
|
|
4.2.4 |
определение мочевины сыворотки крови |
Фельдшер-лаборант |
|
|
4.2.4.1 |
конечно-точечным ферментативным методом |
Фельдшер-лаборант |
|
|
4.2.4.2 |
кинетическим методом |
Фельдшер-лаборант |
|
|
4.2.5 |
определение креатинина сыворотки крови по реакции Яффе |
Фельдшер-лаборант |
|
|
4.2.5.1 |
конечно-точечным методом |
Фельдшер-лаборант |
|
|
4.2.5.2 |
кинетическим методом |
Фельдшер-лаборант |
|
|
4.2.6 |
определение глюкозы в сыворотке крови ферментативным методом |
Фельдшер-лаборант |
|
|
4.2.7 |
определение глюкозы в цельной крови экспресс-методом |
Фельдшер-лаборант |
|
|
4.2.8 |
определение общих бета-липопротеинов в сыворотке крови |
Фельдшер-лаборант |
|
|
4.2.9 |
определение холестерина альфа-липопротеинов после осаждения пре-бета- и бета-липопротеинов с расчетом коэффициента атерогенности |
Врач лабораторной диагностики; |
|
|
4.2.10 |
определение общего холестерина сыворотки крови ферментативным методом |
Фельдшер-лаборант |
|
|
4.2.11 |
определение триацилглицеринов в сыворотке крови ферментативным методом |
Фельдшер-лаборант |
|
|
4.2.12 |
определение билирубина и его фракций в сыворотке крови методом Йендрашека-Клеггорн-Грофа |
Фельдшер-лаборант |
|
|
4.2.13 |
определение калия в сыворотке крови фотометрическим методом |
Фельдшер-лаборант |
|
|
4.2.14 |
определение натрия в сыворотке крови фотометрическим методом |
Фельдшер-лаборант |
|
|
4.2.15 |
определение хлора в сыворотке крови фотометрическим методом |
Фельдшер-лаборант |
|
|
4.2.16 |
определение железа в сыворотке крови феррозиновым методом |
Врач лабораторной диагностики; |
|
|
4.2.17 |
определение общей железосвязывающей способности сыворотки феррозиновым методом |
Фельдшер-лаборант |
|
|
4.2.18 |
определение неорганического фосфора в сыворотке крови: |
||
|
4.2.18.1 |
с фосфорно-молибденовой кислотой (многошаговая реакция) |
Фельдшер-лаборант |
|
|
4.2.18.2 |
с использованием диагностических наборов с одношаговой реакцией |
Фельдшер-лаборант |
|
|
4.2.19 |
определение общего кальция в сыворотке крови: |
||
|
4.2.19.1 |
с орто-крезол-фталеиновым комплексом |
Фельдшер-лаборант |
|
|
4.2.19.2 |
с глиоксаль-бис-гидроксианалином (реактив ГБОА) |
Фельдшер-лаборант |
|
|
4.2.20 |
определение активности альфа-амилазы в сыворотке крови: |
||
|
4.2.20.1 |
амилокластическим методом |
Фельдшер-лаборант |
|
|
4.2.20.2 |
кинетическим методом |
Фельдшер-лаборант |
|
|
4.2.21 |
определение активности аспартатаминотрансферазы в сыворотке крови: |
||
|
4.2.21.1 |
методом Райтмана-Френкеля |
Фельдшер-лаборант |
|
|
4.2.21.2 |
кинетическим методом |
Фельдшер-лаборант |
|
|
4.2.22 |
определение активности аланинаминотрансферазы в сыворотке крови: |
||
|
4.2.22.1 |
методом Райтмана-Френкеля |
Фельдшер-лаборант |
|
|
4.2.22.2 |
кинетическим методом |
Фельдшер-лаборант |
|
|
4.2.23 |
определение активности лактатдегидрогеназы в сыворотке крови кинетическим методом |
Фельдшер-лаборант |
|
|
4.2.24 |
определение активности липазы в сыворотке крови турбидиметрическим методом |
Фельдшер-лаборант |
|
|
4.2.25 |
определение активности щелочной фосфатазы в сыворотке крови кинетическим методом |
Фельдшер-лаборант |
|
|
4.2.26 |
определение активности креатинфосфокиназы кинетическим методом |
Фельдшер-лаборант |
|
|
4.2.27 |
определение активности гаммаглутамилтранспептидазы кинетическим методом |
Фельдшер-лаборант |
|
|
4.2.28 |
определение активности кислой фосфатазы в сыворотке крови: |
||
|
4.2.28.1 |
по гидролизу p-нитрофенилфосфата |
Фельдшер-лаборант |
|
|
4.2.28.2 |
кинетическим методом |
Фельдшер-лаборант |
|
|
4.2.28.3 |
определение активности тартратлабильной фракции кислой фосфатазы: |
||
|
4.2.28.3.1 |
по гидролизу р-нитрофенилфосфата |
Фельдшер-лаборант |
|
|
4.2.28.3.2 |
кинетическим методом |
Фельдшер-лаборант |
|
|
4.2.29 |
определение активности холинэстеразы в сыворотке крови: |
||
|
4.2.29.1 |
по гидролизу ацетилхолинхлорида |
Фельдшер-лаборант |
|
|
4.2.29.2 |
кинетическим методом |
Фельдшер-лаборант |
|
|
4.3 |
Определение глюкозы посредством анализатора «ЭКСАН Г» |
Фельдшер-лаборант |
|
|
4.4 |
Исследования с использованием пламенной фотометрии: |
Врач лабораторной диагностики; |
|
|
4.4.1 |
определение натрия в сыворотке крови |
Врач лабораторной диагностики; |
|
|
4.4.2 |
определение калия в сыворотке крови |
Врач лабораторной диагностики; |
|
|
4.5 |
Исследования с использованием ионоселективных методов: |
||
|
4.5.1 |
определение калия и натрия в сыворотке крови |
Фельдшер-лаборант |
|
|
4.5.2 |
определение калия, натрия и хлора посредством автоматических анализаторов |
Фельдшер-лаборант |
|
|
4.5.3 |
определение калия, натрия и кальция посредством автоматических анализаторов |
Фельдшер-лаборант |
|
|
4.6 |
Определение показателей кислотно-основного состояния крови посредством автоматических анализаторов |
Фельдшер-лаборант |
|
|
4.7 |
Осмолярность крови |
Фельдшер-лаборант |
|
|
4.8 |
Электрофоретические исследования в сыворотке крови на пленках из ацетата целлюлозы и на агарозных гелях |
Фельдшер-лаборант |
|
|
4.9 |
Определение гормонов: |
||
|
4.9.1 |
определение гормонов иммуноферментным методом: |
||
|
4.9.1.1 |
методом иммуноферментного анализа с автоматизированным расчетом |
Фельдшер-лаборант |
|
|
4.9.1.2 |
методом иммуноферментного анализа с полуавтоматическим расчетом |
Фельдшер-лаборант |
|
|
4.9.2 |
методом радиоиммунного анализа |
Врач лабораторной диагностики; |
|
|
4.10 |
Определение кардиомаркеров: |
||
|
4.10.1 |
методом сухой химии |
Фельдшер-лаборант |
|
|
4.10.1.1 |
качественное определение тропонина |
Фельдшер-лаборант |
|
|
4.10.1.2 |
количественное определение (одновременное) тропонина, миоглобина, МВ-фракции креатинфосфокиназы |
Фельдшер-лаборант |
|
|
4.10.2 |
иммунохимическим методом |
Врач лабораторной диагностики; |
|
|
4.10.2.1 |
определение тропонина в венозной крови |
Фельдшер-лаборант |
|
|
4.10.2.2 |
определение миоглобина в венозной крови |
Фельдшер-лаборант |
|
|
4.10.2.3 |
определение МВ-фракции креатинфосфокиназы в венозной крови |
Фельдшер-лаборант |
|
|
4.11 |
Определение канцеромаркеров методом иммуноферментного анализа: |
||
|
4.11.1 |
полуавтоматизированный расчет |
Фельдшер-лаборант |
|
|
4.11.2 |
автоматизированный расчет |
Фельдшер-лаборант |
|
|
4.12 |
Проведение исследований с помощью многоканальных биохимических автоматических фотометров: |
||
|
4.12.1 |
конечно-точечные исследования |
Фельдшер-лаборант |
|
|
4.12.2 |
кинетические исследования |
Фельдшер-лаборант |
|
|
4.13 |
Проведение исследований с помощью многоканальных биохимических автоанализаторов: |
||
|
4.13.1 |
малой производительности (характеристика производительности – до 100 исследований в час) |
Фельдшер-лаборант |
|
|
4.13.2 |
средней производительности (характеристика производительности – от 100 до 300 исследований в час) |
Фельдшер-лаборант |
|
|
4.13.3 |
высокой производительности (характеристика производительности – свыше 300 исследований в час) |
Фельдшер-лаборант |
|
|
4.14 |
Определение концентрации магния в сыворотке и плазме крови фотометрическим методом |
Фельдшер-лаборант |
|
|
4.15 |
Токсикологические исследования: |
||
|
4.15.1 |
обнаружение и количественное определение метадона в биологических жидкостях с использованием тонкослойной хроматографии |
Фельдшер-лаборант |
|
|
4.15.2 |
обнаружение и количественное определение опийных алкалоидов, их производных и синтетических заменителей в биологических жидкостях с использованием тонкослойной хроматографии |
Фельдшер-лаборант |
|
|
4.15.3 |
обнаружение и количественное определение амфетамина, метамфетамина и их дериватов, эфедрина, эфедрона, калипсола в биологических жидкостях с использованием тонкослойной хроматографии |
Фельдшер-лаборант |
|
|
4.15.4 |
обнаружение каннабиноидов с использованием тонкослойной хроматографии |
Фельдшер-лаборант |
|
|
4.15.5 |
обнаружение и количественное определение производных фенотиазина и 1,4-бензодиазепина, амитриптилина, димедрола, кофеина, галоперидола, дроперидола, атропина и его изомеров, кокаина, трициклических антидепрессантов, фентанила и его производных, трамала в биологических жидкостях с использованием тонкослойной хроматографии |
Фельдшер-лаборант |
|
|
4.15.6 |
обнаружение и количественное определение производных барбитуровой кислоты в биологических жидкостях с использованием тонкослойной хроматографии и спектрометрии |
Врач лабораторной диагностики; |
|
|
4.15.7 |
обнаружение клофелина в биологических жидкостях с использованием тонкослойной хроматографии |
Фельдшер-лаборант |
|
|
4.15.8 |
обнаружение наркотических средств и психотропных веществ в биологических жидкостях по схеме (тонкослойная хроматография – скрининг) |
Фельдшер-лаборант |
|
|
4.15.9 |
обнаружение и количественное определение наркотических средств и психотропных веществ в биологических жидкостях с помощью анализатора лекарственного мониторинга «Эбботт» Tdx/Flx |
Фельдшер-лаборант |
|
|
4.15.10 |
обнаружение и количественное определение фенилалкиламинов, эфедрина, производных 1,4-бенздиазепина, барбитуровой кислоты и фенотиазина в биологических жидкостях методом высокоэффективной жидкостной хроматографии |
Врач лабораторной диагностики; |
|
|
4.15.11 |
обнаружение и количественное определение опийных алкалоидов, их производных и синтетических заменителей в биологических жидкостях методом высокоэффективной жидкостной хроматографии |
Врач лабораторной диагностики; |
|
|
4.15.12 |
обнаружение наркотических средств и психотропных веществ в биологических жидкостях с помощью тестов «Иммуно-Хром-5 Мульти-Экспресс» |
Фельдшер-лаборант |
|
|
4.15.13 |
обнаружение и количественное определение этилового спирта в биологических жидкостях методом газожидкостной хроматографии |
Врач лабораторной диагностики; |
|
|
4.15.14 |
обнаружение и количественное определение летучих токсических веществ в биологических жидкостях методом газожидкостной хроматографии |
Врач лабораторной диагностики; |
|
|
4.15.15 |
определение аминолевулиновой кислоты/креатинина в моче |
Фельдшер-лаборант |
|
|
4.15.16 |
определение ртути в моче (атомно-абсорбционный метод) |
Врач лабораторной диагностики; |
|
|
4.15.17 |
определение неорганического свинца в моче |
Фельдшер-лаборант |
|
|
4.15.18 |
обнаружение и количественное определение жирных кислот в составе липидной фракции в биологических жидкостях методом газожидкостной хроматографии |
Врач лабораторной диагностики; |
|
|
4.15.19 |
обнаружение и количественное определение свободных аминокислот в биологических жидкостях методом высокоэффективной жидкостной хроматографии |
Врач лабораторной диагностики; |
|
|
4.15.20 |
определение микроэлементов в биологических средах (атомно-абсорбционный метод) |
Врач лабораторной диагностики; |
|
|
Глава 5. Исследования состояния гемостаза |
|||
|
5.1 |
Определение активированного времени рекальцификации плазмы с суспензией каолина |
Фельдшер-лаборант |
|
|
5.2 |
Определение протромбинового (тромбопластинового) времени: |
||
|
5.2.1 |
с тромбопластин-кальциевой смесью |
Фельдшер-лаборант |
|
|
5.2.2 |
экспресс-методом (сухая химия) |
Фельдшер-лаборант |
|
|
5.3 |
Проба на коррекцию по протромбиновому времени с тромбопластин-кальциевой смесью |
Фельдшер-лаборант |
|
|
5.4 |
Определение активированного частичного тромбопластинового времени с эритрофосфатидкаолиновой смесью |
Фельдшер-лаборант |
|
|
5.5 |
Проба на коррекцию по активированному частичному тромбопластиновому времени с эритрофосфатидкаолиновой смесью |
Фельдшер-лаборант |
|
|
5.6 |
Определение содержания фибриногена в плазме крови: |
||
|
5.6.1 |
методом иммуноферментного анализа |
Фельдшер-лаборант |
|
|
5.6.1.1 |
полуавтоматизированный расчет |
Фельдшер-лаборант |
|
|
5.6.1.2 |
автоматизированный расчет |
Фельдшер-лаборант |
|
|
5.6.2 |
весовым методом |
Фельдшер-лаборант |
|
|
5.6.3 |
на полуавтоматическом коагулометре |
Фельдшер-лаборант |
|
|
5.6.4 |
на автоматическом коагулометре |
Фельдшер-лаборант |
|
|
5.7 |
Определение продуктов деградации фибрина (фибриногена) в сыворотке крови методом иммуноферментного анализа: |
||
|
5.7.1 |
полуавтоматизированный расчет |
Фельдшер-лаборант |
|
|
5.7.2 |
автоматизированный расчет |
Фельдшер-лаборант |
|
|
5.8 |
Определение быстродействующих антиплазминов методом Невяровского с использованием лиофилизированного плазминогена в модификации Пасторовой |
Врач лабораторной диагностики; |
|
|
5.9 |
Определение растворимых комплексов фибринмономеров – паракоагуляционные тесты с протаминсульфатом |
Фельдшер-лаборант |
|
|
5.10 |
Определение тромбинового времени со стандартным количеством тромбина |
Фельдшер-лаборант |
|
|
5.11 |
Определение фибринолитической активности плазмы (время лизиса эуглобулинов плазмы) |
Фельдшер-лаборант |
|
|
5.12 |
Определение антитромбина III методом Абильгарда со стандартным количеством тромбина |
Врач лабораторной диагностики; |
|
|
5.13 |
Электрокоагулография (тромбоэластография) |
Врач лабораторной диагностики; |
|
|
5.14 |
Определение фактора XIII (фибринстабилизирующего) методом Сигга и Дукерта |
Врач лабораторной диагностики; |
|
|
5.15 |
Определение фактора V в плазме крови с применением плазмы с дефицитом фактора V |
Врач лабораторной диагностики; |
|
|
5.16 |
Определение фактора VIII в плазме крови с применением плазмы с дефицитом фактора VIII |
Врач лабораторной диагностики; |
|
|
5.17 |
Определение фактора IX в плазме крови с применением плазмы с дефицитом фактора IX |
Врач лабораторной диагностики; |
|
|
5.18 |
Определение фактора X в плазме крови с применением плазмы с дефицитом фактора X |
Врач лабораторной диагностики; |
|
|
5.19 |
Определение фактора XI в плазме крови с применением плазмы с дефицитом фактора XI |
Врач лабораторной диагностики; |
|
|
5.20 |
Исследование агрегации тромбоцитов при стимуляции: |
Фельдшер-лаборант |
|
|
5.20.1 |
аденозиндифосфатом |
Фельдшер-лаборант |
|
|
5.20.2 |
адреналином |
Фельдшер-лаборант |
|
|
5.20.3 |
коллагеном |
Фельдшер-лаборант |
|
|
5.20.4 |
ристомицином |
Фельдшер-лаборант |
|
|
5.21 |
Определение времени кровотечения |
Фельдшер-лаборант |
|
|
5.22 |
Определение времени свертывания цельной крови |
Фельдшер-лаборант |
|
|
5.23 |
Определение фактора II в плазме крови с применением плазмы с дефицитом фактора II |
Врач лабораторной диагностики; |
|
|
5.24 |
Определение фактора VII в плазме крови с применением плазмы с дефицитом фактора VII |
Врач лабораторной диагностики; |
|
|
5.25 |
Определение фактора XII в плазме крови с применением плазмы с дефицитом фактора XII |
Врач лабораторной диагностики; |
|
|
5.26 |
Определение антигена фактора Виллебранда турбидиметрическим методом |
Врач лабораторной диагностики; |
|
|
5.27 |
Определение ристоцетин (ристомицин)-кофакторной активности плазменного антигена фактора Виллебранда |
Врач лабораторной диагностики; |
|
|
5.28 |
Определение ингибитора VIII фактора методом Bethesda (Бетезда) |
Врач лабораторной диагностики; |
|
|
5.29 |
Определение ингибитора IX фактора методом Bethesda (Бетезда) |
Врач лабораторной диагностики; |
|
|
5.30 |
Определение активированного парциального тромбопластинового времени реагентом, чувствительным к волчаночному антикоагулянту |
Фельдшер-лаборант |
|
|
5.31 |
Определение волчаночного антикоагулянта клоттинговым методом |
Фельдшер-лаборант |
|
|
5.32 |
Определение гепарина II с хромогенным субстратом на автоматическом коагулометре |
Фельдшер-лаборант |
|
|
5.33 |
Определение анти-ХА с хромогенным субстратом на автоматическом коагулометре |
Фельдшер-лаборант |
|
|
5.34 |
Определение антитромбина III с хромогенным субстратом на автоматическом коагулометре |
Фельдшер-лаборант |
|
|
5.35 |
Определение плазминогена с хромогенным субстратом на автоматическом коагулометре |
Фельдшер-лаборант |
|
|
5.36 |
Определение антиплазмина с хромогенным субстратом на автоматическом коагулометре |
Фельдшер-лаборант |
|
|
5.37 |
Определение протеина С с хромогенным субстратом на автоматическом коагулометре |
Фельдшер-лаборант |
|
|
5.38 |
Определение протеина S с хромогенным субстратом на автоматическом коагулометре |
Фельдшер-лаборант |
|
|
5.39 |
Определение Д-димеров на автоматическом коагулометре |
Фельдшер-лаборант |
|
|
5.40 |
Исследование параметров коагулограммы на автоматических коагулометрах: |
||
|
5.40.1 |
определение активированного частичного тромбопластинового времени |
Фельдшер-лаборант |
|
|
5.40.2 |
определение протромбинового времени с расчетом МНО |
Фельдшер-лаборант |
|
|
5.40.3 |
определение тромбинового времени |
Фельдшер-лаборант |
|
|
Глава 6. Иммунологические исследования |
|||
|
6.1 |
Определение групп крови по системе АВ0 с использованием стандартных сывороток или перекрестным способом |
Врач лабораторной диагностики |
|
|
6.2 |
Определение групп крови и резус-фактора с использованием цоликлонов |
Врач лабораторной диагностики |
|
|
6.3 |
Определение резус-фактора методом конглютинации с применением желатина или экспресс-методом |
Врач лабораторной диагностики |
|
|
6.4 |
Определение неполных резус-антител методом конглютинации с применением желатина |
Врач лабораторной диагностики |
|
|
6.5 |
Определение титра неполных резус-антител методом конглютинации с применением желатина |
Врач лабораторной диагностики |
|
|
6.6 |
Прямая проба Кумбса |
Врач лабораторной диагностики |
|
|
6.7 |
Непрямая проба Кумбса |
Врач лабораторной диагностики |
|
|
6.8 |
Определение функциональной активности Т- и В-лимфоцитов: |
Фельдшер-лаборант |
|
|
6.8.1 |
методом Е-розеткообразования |
Фельдшер-лаборант |
|
|
6.8.2 |
в реакции бласттрансформации лимфоцитов на митогены и специфические антигены (с морфологическим учетом результатов) |
Фельдшер-лаборант |
|
|
6.8.3 |
в реакции торможения миграции лейкоцитов на митогены (для Т-лимфоцитов) |
Фельдшер-лаборант |
|
|
6.8.4 |
с использованием моноклональных антител |
Фельдшер-лаборант |
|
|
6.8.4.1 |
иммуноморфологическим исследованием |
Врач лабораторной диагностики; |
|
|
6.8.4.2 |
методом проточной цитометрии |
Фельдшер-лаборант |
|
|
6.9 |
Определение концентрации основных классов и подклассов иммуноглобулинов: |
||
|
6.9.1 |
методом радиальной иммунодиффузии |
Фельдшер-лаборант |
|
|
6.9.1.1 |
с приготовлением и заливкой агара, построением калибровочной кривой |
Фельдшер-лаборант |
|
|
6.9.1.2 |
с использованием готовых иммунодиффузионных планшет |
Фельдшер-лаборант |
|
|
6.9.2 |
методом иммуноэлектрофореза на геле агара или агарозы |
Фельдшер-лаборант |
|
|
6.9.3 |
турбидиметрическим методом |
Фельдшер-лаборант |
|
|
6.9.4 |
методом иммуноферментного анализа |
Фельдшер-лаборант |
|
|
6.9.4.1 |
полуавтоматизированный расчет |
Фельдшер-лаборант |
|
|
6.9.4.2 |
автоматизированный расчет |
Фельдшер-лаборант |
|
|
6.10 |
Определение общего иммуноглобулина Е методом иммуноферментного анализа: |
||
|
6.10.1 |
полуавтоматизированный расчет |
Фельдшер-лаборант |
|
|
6.10.2 |
автоматизированный расчет |
Фельдшер-лаборант |
|
|
6.11 |
Определение специфического иммуноглобулина Е методом иммуноферментного анализа: |
||
|
6.11.1 |
полуавтоматизированный расчет |
Фельдшер-лаборант |
|
|
6.11.2 |
автоматизированный расчет |
Фельдшер-лаборант |
|
|
6.12 |
Определение секреторных иммуноглобулинов: |
Фельдшер-лаборант |
|
|
6.12.1 |
методом радиальной иммунодиффузии |
Фельдшер-лаборант |
|
|
6.12.1.1 |
с приготовлением и заливкой агара, построением калибровочной кривой |
Фельдшер-лаборант |
|
|
6.12.1.2 |
с использованием готовых иммунодиффузионных планшет |
Фельдшер-лаборант |
|
|
6.12.2 |
методом иммуноферментного анализа |
Фельдшер-лаборант |
|
|
6.12.2.1 |
полуавтоматизированный расчет |
Фельдшер-лаборант |
|
|
6.12.2.2 |
автоматизированный расчет |
Фельдшер-лаборант |
|
|
6.13 |
Определение циркулирующих иммунных комплексов (с выделением и типированием): |
Фельдшер-лаборант |
|
|
6.13.1 |
методом радиальной иммунодиффузии |
Фельдшер-лаборант |
|
|
6.13.1.1 |
с приготовлением и заливкой агара, построением калибровочной кривой |
Фельдшер-лаборант |
|
|
6.13.1.2 |
с использованием готовых иммунодиффузионных планшет |
Фельдшер-лаборант |
|
|
6.13.2 |
методом иммуноферментного анализа |
Фельдшер-лаборант |
|
|
6.13.2.1 |
полуавтоматизированный расчет |
Фельдшер-лаборант |
|
|
6.13.2.2 |
автоматизированный расчет |
Фельдшер-лаборант |
|
|
6.14 |
Определение фагоцитарной активности лейкоцитов: |
||
|
6.14.1 |
латекс-тест |
Фельдшер-лаборант |
|
|
6.14.2 |
нитросиний тетразолий-тест |
Фельдшер-лаборант |
|
|
6.14.3 |
прямым визуальным методом определения фагоцитоза |
Фельдшер-лаборант |
|
|
6.14.4 |
спектрофотометрическим методом |
Фельдшер-лаборант |
|
|
6.14.5 |
лизосомально-катионный тест |
Фельдшер-лаборант |
|
|
6.15 |
Определение комплементарной активности сыворотки крови: |
||
|
6.15.1 |
методом титрования по 50%-му гемолизу |
Фельдшер-лаборант |
|
|
6.15.2 |
турбидиметрическим методом |
Фельдшер-лаборант |
|
|
6.16 |
Определение индивидуальных белков сыворотки крови (СРБ, С3, С4, С5, С1-ингибитор и т.д.): |
Фельдшер-лаборант |
|
|
6.16.1 |
методом радиальной иммунодиффузии |
||
|
6.16.1.1 |
с приготовлением и заливкой агара, построением калибровочной кривой |
Фельдшер-лаборант |
|
|
6.16.1.2 |
с использованием готовых иммунодиффузионных планшет |
Фельдшер-лаборант |
|
|
6.16.2 |
турбидиметрическим методом |
Фельдшер-лаборант |
|
|
6.17 |
Определение активности анти-0-стрептолизина в сыворотке крови: |
||
|
6.17.1 |
методом пассивного гемолиза |
Фельдшер-лаборант |
|
|
6.17.2 |
латекс-тест |
Фельдшер-лаборант |
|
|
6.18 |
Определение активности антигиалуронидазы в сыворотке крови методом с ферментом гиалуронидазы |
Фельдшер-лаборант |
|
|
6.19 |
Определение аутоантител (к тиреоглобулину, к микросомальной фракции тиреоцита, к ДНК, к гистоновым белкам, к коллагенам, к экстрагируемым ядерным антигенам, к кардиолипину, к миелину, к фосфатидилсерину, к антигенам спермы, к аутоантигенам), антинуклеарного фактора и др.: |
||
|
6.19.1 |
реакцией прямой гемагглютинации |
Фельдшер-лаборант |
|
|
6.19.2 |
методом иммуноферментного анализа |
Фельдшер-лаборант |
|
|
6.19.2.1 |
полуавтоматизированный расчет |
Фельдшер-лаборант |
|
|
6.19.2.2 |
автоматизированный расчет |
Фельдшер-лаборант |
|
|
6.19.3 |
методом непрямой иммунофлюоресценции |
Фельдшер-лаборант |
|
|
6.19.4 |
определение антител к туберкулезным антигенам |
Фельдшер-лаборант |
|
|
6.19.4.1 |
реакцией прямой гемагглютинации |
Фельдшер-лаборант |
|
|
6.19.4.2 |
определение суммарных антител (Ig G, A, M) к антигенам M. tuberculosis методом иммуноферментного анализа с полуавтоматизированным расчетом |
Фельдшер-лаборант |
|
|
6.20 |
Определение антител к нативной ДНК латекс-тестом |
Фельдшер-лаборант |
|
|
6.21 |
Определение ревматоидного фактора в сыворотке крови: |
Фельдшер-лаборант |
|
|
6.21.1 |
реакция гемагглютинации (Ваалер-Розе) |
Фельдшер-лаборант |
|
|
6.21.2 |
латекс-тест |
Фельдшер-лаборант |
|
|
6.22 |
Идентификация моноклональных белков методом иммунофиксации |
Фельдшер-лаборант |
|
|
6.23 |
Реакция деструкции тучных клеток |
Фельдшер-лаборант |
|
|
Глава 7. Бактериологические исследования |
|||
|
7.1 |
Исследование на аэробные и факультативные анаэробные микроорганизмы в крови (культуральное исследование) |
Врач лабораторной диагностики; |
|
|
7.2 |
Исследование крови на аэробные, факультативно-анаэробные микроорганизмы с помощью автоматизированных систем |
Врач лабораторной диагностики; |
|
|
7.3 |
Исследования на аэробные и факультативные анаэробные микроорганизмы в спинномозговой жидкости (культуральное исследование) |
Врач лабораторной диагностики; |
|
|
7.4 |
Исследование спинномозговой жидкости на аэробные, факультативно-анаэробные микроорганизмы с помощью автоматизированных систем |
Врач лабораторной диагностики; |
|
|
7.5 |
Исследования на аэробные и факультативные анаэробные микроорганизмы в мокроте и промывных водах бронхов (культуральное исследование, количественный метод) |
Врач лабораторной диагностики; |
|
|
7.6 |
Исследование на аэробные, факультативно-анаэробные микроорганизмы в мокроте и промывных водах бронхов с идентификацией до вида с использованием автоматизированных систем |
Фельдшер-лаборант |
|
|
7.7 |
Исследования на аэробные и факультативные анаэробные микроорганизмы в моче (культуральное исследование, полуколичественный метод) |
Врач лабораторной диагностики; |
|
|
7.8 |
Исследование на аэробные, факультативно-анаэробные микроорганизмы в моче с идентификацией до вида с использованием автоматизированных систем |
Фельдшер-лаборант |
|
|
7.9 |
Исследования на аэробные и факультативные анаэробные микроорганизмы в желчи (культуральное исследование) |
Врач лабораторной диагностики; |
|
|
7.10 |
Исследование на аэробные, факультативно-анаэробные микроорганизмы в желчи с идентификацией до вида с использованием автоматизированных систем |
Фельдшер-лаборант |
|
|
7.11 |
Исследования на аэробные и факультативные анаэробные микроорганизмы в гное, отделяемом ран, инфильтратов, абсцессов, в транссудатах, экссудатах и т.д. (культуральное исследование) |
Врач лабораторной диагностики; |
|
|
7.12 |
Исследование отделяемого ран, инфильтратов, абсцессов и так далее на аэробные, факультативно-анаэробные микроорганизмы с помощью автоматизированных систем |
Фельдшер-лаборант |
|
|
7.13 |
Исследование отделяемого половых органов без забора материала в лаборатории: |
||
|
7.13.1 |
микроскопия нативных препаратов |
Фельдшер-лаборант |
|
|
7.13.1.1 |
микроскопия препаратов, окрашенных по Граму |
Фельдшер-лаборант |
|
|
7.13.1.2 |
микроскопия препаратов, окрашенных метиленовым синим |
Фельдшер-лаборант |
|
|
7.13.1.3 |
культуральное исследование |
Врач лабораторной диагностики; |
|
|
7.13.2 |
исследование на аэробные, факультативно-анаэробные микроорганизмы в отделяемом половых органов с идентификацией до вида с использованием автоматизированных систем |
Фельдшер-лаборант |
|
|
7.13.3 |
культуральное исследование отделяемого половых органов на уреаплазмы |
Врач лабораторной диагностики; |
|
|
7.14 |
Исследования на аэробные и факультативные анаэробные микроорганизмы в отделяемом глаз (культуральное исследование) |
Врач лабораторной диагностики; |
|
|
7.15 |
Исследование на аэробные, факультативно-анаэробные микроорганизмы в отделяемом глаз с идентификацией до вида с использованием автоматизированных систем |
Фельдшер-лаборант |
|
|
7.16 |
Исследования на аэробные и факультативные анаэробные микроорганизмы в отделяемом носоглотки и носа (культуральное исследование) |
Врач лабораторной диагностики; |
|
|
7.17 |
Исследование на аэробные, факультативно-анаэробные микроорганизмы в отделяемом носоглотки и носа с идентификацией до вида с использованием автоматизированных систем |
Фельдшер-лаборант |
|
|
7.18 |
Исследование отделяемого половых органов на гарднереллу: |
||
|
7.18.1 |
микроскопия окрашенных (по Граму) препаратов нативного материала |
Фельдшер-лаборант |
|
|
7.18.2 |
культуральное исследование |
Врач лабораторной диагностики; |
|
|
7.18.3 |
с использованием автоматизированных систем |
Фельдшер-лаборант |
|
|
7.19 |
Культуральное исследование мочи на уреа-микоплазму |
Врач лабораторной диагностики; |
|
|
7.20 |
Культуральное исследование мокроты на микоплазму пневмонии |
Врач лабораторной диагностики; |
|
|
7.21 |
Исследование микробиоценоза кишечника (дисбактериоз) |
Врач лабораторной диагностики; |
|
|
7.22 |
Исследование на облигатно-анаэробные микроорганизмы в отделяемом ран, флегмон, половых органов, в экссудатах, транссудатах и т.д.: |
||
|
7.22.1 |
микроскопия окрашенных (по Граму) препаратов нативного материала |
Фельдшер-лаборант |
|
|
7.22.2 |
культуральное исследование |
Врач лабораторной диагностики; |
|
|
7.23 |
Исследование с идентификацией до вида с использованием анаэродисков и коммерческих тест-систем (считывание визуальное): |
||
|
7.23.1 |
родов Пептококков, Пептострептококков, Вейлонелла |
Фельдшер-лаборант |
|
|
7.23.2 |
рода Бактероидов |
Фельдшер-лаборант |
|
|
7.23.3 |
рода Фузобактерий |
Фельдшер-лаборант |
|
|
7.23.4 |
родов Актиномицет и Эубактерий |
Фельдшер-лаборант |
|
|
7.23.5 |
рода Клостридий |
Фельдшер-лаборант |
|
|
7.24 |
Определение чувствительности одного штамма микроорганизма к антибиотикам: |
||
|
7.24.1 |
диск-диффузионным методом к 6 препаратам |
Фельдшер-лаборант |
|
|
7.24.2 |
методом серийных разведений |
Фельдшер-лаборант |
|
|
7.24.3 |
определение чувствительности одного штамма микроорганизма к антибиотикам с использованием автоматизированных систем |
Фельдшер-лаборант |
|
|
7.25 |
Биохимическая идентификация микроорганизма до вида: |
||
|
7.25.1 |
рутинным методом |
Фельдшер-лаборант |
|
|
7.25.1.1 |
рода Стафилококка |
Фельдшер-лаборант |
|
|
7.25.1.2 |
родов Стрептококка и Энтерококка |
Фельдшер-лаборант |
|
|
7.25.1.3 |
семейства Энтеробактерий |
Фельдшер-лаборант |
|
|
7.25.1.4 |
семейства Нейссерий |
Фельдшер-лаборант |
|
|
7.25.1.5 |
рода Гемофилов |
Фельдшер-лаборант |
|
|
7.25.1.6 |
рода Псевдомонад |
Фельдшер-лаборант |
|
|
7.25.1.7 |
неферментирующих бактерий |
Фельдшер-лаборант |
|
|
7.25.1.8 |
рода Коринебактерий |
Фельдшер-лаборант |
|
|
7.25.1.9 |
грибов рода Аспергилус |
Фельдшер-лаборант |
|
|
7.25.1.10 |
дрожжеподобных грибов Кандида и других |
Фельдшер-лаборант |
|
|
7.25.1.11 |
грамположительные палочки родов Бациллюс, Лактобациллюс, Клостридий и других |
Фельдшер-лаборант |
|
|
7.25.2 |
идентификация урогенитальных микоплазм, определение обсемененности образца и чувствительности к антибиотикам с применением коммерческих тест-систем |
Фельдшер-лаборант |
|
|
7.25.3 |
микрометодом с использованием коммерческих тест-систем: автоматическое считывание |
Фельдшер-лаборант |
|
|
7.25.4 |
биохимическая идентификация одного штамма микроорганизма до вида с использованием автоматизированных систем |
Фельдшер-лаборант |
|
|
7.26 |
Вирусологические исследования в культуре клеток |
Фельдшер-лаборант |
|
|
7.27 |
Латекс-агглютинация |
Фельдшер-лаборант |
|
|
7.28 |
Реакция непрямой агглютинации с одним антигеном |
Фельдшер-лаборант |
|
|
7.29 |
Реакция пассивной гемагглютинации с одним диагностикумом |
Фельдшер-лаборант |
|
|
7.30 |
Реакция связывания комплемента при диагностике сифилиса |
Фельдшер-лаборант |
|
|
7.31 |
Количественный метод реакции связывания комплемента (реакция Вассермана) с кардиолипиновым и трепонемным антигенами |
Фельдшер-лаборант |
|
|
7.32 |
Реакция иммунофлюоресценции |
Фельдшер-лаборант |
|
|
7.33 |
Реакция непрямой иммунофлюоресценции |
Фельдшер-лаборант |
|
|
7.33.1 |
реакция непрямой иммунофлюоресценции РИФ-200 и реакция иммунофлюоресценции с адсорбцией – качественный метод |
Фельдшер-лаборант |
|
|
7.33.2 |
реакция непрямой иммунофлюоресценции РИФ-200 – количественный метод |
Фельдшер-лаборант |
|
|
7.34 |
Определение вирусных и бактериальных антигенов: |
||
|
7.34.1 |
методом иммунохроматографии (экспресс-тест) |
Фельдшер-лаборант |
|
|
7.34.2 |
методом иммуноферментного анализа с полуавтоматизированным расчетом |
Фельдшер-лаборант |
|
|
7.34.3 |
методом иммуноферментного анализа с автоматизированным расчетом |
Фельдшер-лаборант |
|
|
7.34.4 |
иммуноморфологическим исследованием с моноклональными антителами |
Врач лабораторной диагностики; |
|
|
7.35 |
Определение антител к вирусным и бактериальным антигенам методом иммуноферментного анализа с полуавтоматизированным расчетом |
Фельдшер-лаборант |
|
|
7.36 |
Определение антител к вирусным и бактериальным антигенам методом иммуноферментного анализа с автоматизированным расчетом |
Фельдшер-лаборант |
|
|
7.37 |
Микрореакция преципитации с кардиолипиновым антигеном: |
||
|
7.37.1 |
с инактивированной нативной сывороткой крови – качественный метод |
Фельдшер-лаборант |
|
|
7.37.2 |
с инактивированной сывороткой крови – количественный метод |
Фельдшер-лаборант |
|
|
7.37.3 |
с плазмой крови при непосредственном взятии крови из пальца |
Фельдшер-лаборант |
|
|
7.38 |
Реакция иммобилизации бледных трепонем с инактивированной нативной сывороткой крови (при взятии крови у морских свинок и сифилитического орхита у кроликов) – меланжерная методика |
Врач лабораторной диагностики; |
|
|
7.39 |
Бактериоскопическое исследование нативных препаратов для обнаружения бледной трепонемы |
Врач лабораторной диагностики; |
|
|
7.40 |
Реакция агломерации лейкоцитов с капиллярной кровью |
Фельдшер-лаборант |
|
|
7.41 |
Определение экспрессии онкогенов, возбудителей инфекционных и паразитарных заболеваний методом генной диагностики (полимеразная цепная реакция): |
||
|
7.41.1 |
определение экспрессии онкогенов методом генной диагностики (полимеразная цепная реакция) |
Врач лабораторной диагностики; |
|
|
7.41.2 |
определение ДНК возбудителей инфекционных и паразитарных заболеваний методом генной диагностики (полимеразная цепная реакция) |
Врач лабораторной диагностики; |
|
|
7.41.3 |
определение РНК возбудителей инфекционных и паразитарных заболеваний методом генной диагностики (полимеразная цепная реакция) |
Врач лабораторной диагностики; |
|
|
7.42 |
Исследование кожи и слизистых, ногтей, волос на дерматофиты и дрожжеподобные грибы с забором материала в лаборатории: |
||
|
7.42.1 |
микроскопия нативных препаратов |
Врач лабораторной диагностики; |
|
|
7.42.2 |
культуральное исследование |
Врач лабораторной диагностики; |
|
|
7.42.3 |
обнаружение чесоточного клеща в исследуемом материале |
Врач лабораторной диагностики; |
|
|
7.42.4 |
обнаружение Demodex foliorum hominis в исследуемом материале |
Врач лабораторной диагностики; |
|
|
7.43 |
Микробиологические исследования на туберкулез: |
||
|
7.43.1 |
микроскопия на кислотоустойчивые микобактерии в окрашенных по Цилю-Нильсену препаратах количественным методом в 100 полях зрения |
Фельдшер-лаборант |
|
|
7.43.2 |
микроскопия на микобактерии в препаратах, окрашенных люминесцентными красителями количественным методом в 100 полях зрения |
Фельдшер-лаборант |
|
|
7.43.3 |
культуральное исследование |
Фельдшер-лаборант |
|
|
7.43.4 |
определение чувствительности микобактерий к противотуберкулезным препаратам методом абсолютных концентраций |
Врач лабораторной диагностики; |
|
|
7.43.5 |
микробиологические исследования на туберкулез с использованием автоматизированных систем |
Врач лабораторной диагностики; |
|
|
7.43.6 |
определение чувствительности микобактерий к противотуберкулезным препаратам методом пропорций |
Врач лабораторной диагностики; |
|
|
7.44 |
Микробиологические исследования клинического материала на холеру |
Врач лабораторной диагностики; |
|
|
7.45 |
Типирование клеток по антигенам и генам гистосовместимости (HLA) I и II класса и антигену HLA В27: |
||
|
7.45.1 |
типирование лимфоцитов по антигенам гистосовместимости (HLA) I класса серологическими методами |
Врач лабораторной диагностики; |
|
|
7.45.2 |
типирование лимфоцитов по антигену HLA В27 серологическими методами |
Врач лабораторной диагностики; |
|
|
7.45.3 |
ДНК типирование генов гистосовместимости (HLA) I класса методом полимеразной цепной реакции (ПЦР-SSR) |
Врач лабораторной диагностики; |
|
|
7.45.4 |
ДНК типирование генов гистосовместимости (HLA) II класса методом полимеразной цепной реакции (ПЦР-SSR) |
Врач лабораторной диагностики; |
|
|
Глава 8. Генетика |
|||
|
8.1 |
Определение кариотипа в лимфоцитах периферической крови и клетках костного мозга человека |
Врач лабораторной диагностики; |
|
|
8.2 |
Определение кариотипа в клетках амниотической жидкости |
Врач лабораторной диагностики; |
|
|
8.3 |
Определение кариотипа в клетках длительной культуры биоптата ворсин хориона |
Врач лабораторной диагностики; |
|
|
8.4 |
Определение кариотипа в клетках биоптата ворсин хориона и плаценты полупрямым методом |
Врач лабораторной диагностики; |
|
|
8.5 |
Определение 17-ОН-прогестерона в пятнах крови |
Фельдшер-лаборант |
|
|
8.6 |
Определение иммунореактивного трипсина в пятнах крови |
Фельдшер-лаборант |
|
|
8.7 |
Нагрузочные тесты сахарозой, лактозой, ксилозой |
Фельдшер-лаборант |
|
|
8.8 |
Биохимический скрининг беременных 1-го триместра: |
Фельдшер-лаборант |
|
|
8.8.1 |
определение альфа-фетопротеина |
Фельдшер-лаборант |
|
|
8.8.2 |
определение свободной бета-цепи хорионического гонадотропина |
Фельдшер-лаборант |
|
|
8.8.3 |
определение плацентарного белка А |
Фельдшер-лаборант |
|
|
8.9 |
Биохимический скрининг беременных 2-го триместра: |
Фельдшер-лаборант |
|
|
8.9.1 |
определение альфа-фетопротеина |
Фельдшер-лаборант |
|
|
8.9.2 |
определение хорионического гонадотропина |
Фельдшер-лаборант |
|
|
Глава 9. Морфологические исследования |
|||
|
9.1 |
Исследование биопсийного и операционного материала |
Врач лабораторной диагностики; |
|
|
9.2 |
Иммуногистохимическое исследование |
Врач лабораторной диагностики; |
|
|
Глава 10. Радиометрические исследования, выполняемые с использованием счетчика излучений человека (СИЧ) |
|||
|
10.1 |
Всего тела (инкорпорированные радионуклиды) |
Фельдшер-лаборант |
|
Приложение III
ИНСТРУКЦИЯ
о порядке проведения внутреннего контроля качества лабораторных исследований в клинико-диагностических лабораториях
(Рекомендации)
Глава 1. ВВЕДЕНИЕ
Контроль качества клинических лабораторных исследований – система мер, направленная на выполнение качественных лабораторных исследований на всех этапах их осуществления – от подготовки пациента к процедуре взятия биологического материала до использования полученных результатов в процессе оказания медицинской помощи.
Основной формой контроля качества всех видов исследований, проводимых в клинико-диагностических лабораториях (далее – КДЛ), является внутренний (внутрилабораторный) контроль.
Под внутренним (внутрилабораторным) контролем качества понимают проверку результатов измерений каждого лабораторного показателя (аналита) в каждой аналитической серии.
Внутренний (внутрилабораторный) контроль качества должен выполняться во всех КДЛ ежедневно по всем видам лабораторных исследований.
Мероприятия по проведению контроля качества в клинико-диагностической лаборатории в каждом ее отделе выполняет медицинский работник, который работает на данном участке в настоящее время.
Ответственность за обеспечение и проведение внутрилабораторного контроля качества возлагается на заведующего клинико-диагностической лабораторией.
Контроль за функционированием системы внутрилабораторного контроля качества в КДЛ организаций здравоохранения возлагается на территориальные органы управления здравоохранением, управления здравоохранения облисполкомов и комитет по здравоохранению Мингорисполкома.
Глава 2. ЦЕЛЬ, ЗАДАЧИ, КРИТЕРИИ КОНТРОЛЯ КАЧАСТВА
Цель: обеспечить точность и правильность выполняемых в КДЛ исследований, предупредить, выявить и устранить грубые, случайные и систематические ошибки количественного анализа биологического материала.
Задачи:
Обеспечить качественное выполнение лабораторных исследований:
предупредить отрицательное влияние на качество результатов лабораторных исследований диагностических и лечебных процедур, создающих помехи правильному отражению результатов исследований состояния внутренней среды обследуемых пациентов;
предупредить нарушение правил взятия, маркировки, первичной обработки, условий хранения и транспортировки в лабораторию образцов биологических материалов, взятых у пациентов;
обеспечить качественное выполнение технологических операций (калибровка и настройка измерительного оборудования, использование контрольных материалов и качественных реагентов).
Повысить эффективность использования трудовых и материальных ресурсов (исключить повторные исследования и другие).
Обеспечить достоверность лабораторных исследований.
Критерии контроля качества:
точность измерений – качество измерений, отражающее близость результатов измерений к истинному значению измеряемой величины. Высокая точность измерений соответствует малым погрешностям всех видов, как случайных, так и систематических;
правильность измерений отражает близость к нулю систематических погрешностей в измеряемых результатах. Правильность измерений оценивается величиной отклонения или смещения результата от установленного значения величины сравнения. Правильность измерений характеризует отсутствие систематических погрешностей для всей серии выполняемых исследований;
грубые ошибки – погрешности одиночного значения, результаты которых выходят далеко за пределы области измеряемого компонента;
случайные ошибки – погрешности одиночного значения, результаты которых не выходят далеко за пределы области измеряемого компонента, и влияют на индивидуальные результаты. Наличие случайных ошибок проявляется в том, что при повторном определении в одинаковых условиях одного и того же показателя результаты исследования отличаются между собой.
Величина случайной ошибки является мерой воспроизводимости лабораторных результатов. Чем меньше случайных ошибок, тем лучше воспроизводимость (совпадение) лабораторных показателей. Воспроизводимость результатов характеризуется величиной среднеквадратического отклонения (S);
систематические ошибки – это погрешности, одинаковые по знаку, то есть результаты лабораторных исследований либо завышены, либо занижены. Такие ошибки имеют однонаправленное отклонение от истинного значения, зависят от одинаковых причин и влияют на всю аналитическую серию исследований. Величина систематической ошибки характеризует правильность результатов анализа.
Механизмы реализации Инструкции 1 - внедрение Инструкции во всех КДЛ для постоянного осуществления внутрилабораторного контроля качества лабораторных исследований.
Реализация Инструкции позволит проводить систематический контроль качества по всем видам лабораторных исследований, повысить уровень надежности получаемых результатов, своевременно принимать меры по предупреждению возможных погрешностей на всех этапах лабораторного исследования.
Глава 3. КОНТРОЛЬНЫЕ МАТЕРИАЛЫ
Контроль качества осуществляется с помощью специальных контрольных материалов, а также ряда способов, не требующих контрольных материалов.
При внутрилабораторном контроле используются контрольные материалы промышленного производства, допущенные в установленном порядке к применению на территории Республики Беларусь.
Для проведения внутрилабораторного контроля качества требуется контрольный материал по всем видам проводимых в лаборатории исследований - гематологический, биохимический, общеклинический и другие. Наиболее подходящим для проведения внутрилабораторного контроля качества являются нормальные и патологические контрольные сыворотки, плазма, моча, взвесь клеток и другие материалы, изготовленные промышленным путем.
Паспортные значения контрольного материала могут использоваться как для контроля правильности результатов, так и для первоначальной оценки сходимости (воспроизводимости в серии) и в дальнейшем воспроизводимости результатов во времени (воспроизводимость изо дня в день).
Контрольный материал нельзя использовать одновременно в качестве калибровочного материала. Подготовка контрольного материала к исследованию проводится строго в соответствии с инструкцией производителя и используется так же, как и пробы пациентов.
Для экономного использования контрольного материала допускается разлить содержимое флакона на аликвоты. Объем аликвот (не менее 0,5 мл) в пробирки или флаконы с герметичными крышками, хранить при t -20 °С и более низких температурах для дальнейшего использования. Допускается однократное замораживание и оттаивание контрольного материала.
В случаях невозможности приобретения контрольных материалов промышленного производства в достаточном количестве, в лаборатории для контроля воспроизводимости могут быть использованы приготовленные непосредственно в лаборатории материалы - слитые сыворотки, плазма, моча и др.
Глава 4. ЭТАПЫ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ, ПОДЛЕЖАЩИЕ КОНТРОЛЮ КАЧЕСТВА
Оценка качества лабораторных исследований проводится на всех этапах получения (производства) результатов анализов:
Преаналитическом внелабораторном;
Преаналитическом, лабораторном;
Аналитическом лабораторном;
Постаналитическом.
Преаналитический этап - комплекс мероприятий, включающий составление заявки лечащим врачом на исследование, выбор тестов, подготовка пациента и биологического материала к проведению аналитического измерения.
Контролю на преаналитическом этапе лабораторных исследований подлежат следующие процедуры:
подготовка пациента к исследованию;
взятие биологического материала;
транспортировка проб;
идентификация проб;
первичная обработка биологического материала;
использование стабилизаторов;
хранение проб до начала исследования.
Лабораторная часть преаналитического этапа начинается с момента доставки пробы и заявки в КДЛ. Контролю качества на данном этапе подлежат:
организация приема проб и заявок;
регистрация проб и пациентов;
идентификация проб (соответствие их направлениям, время поступления в КДЛ, достаточность количества материала для проведения назначенных тестов);
центрифугирование и другие манипуляции по подготовке биологического материала к исследованию;
условия и сроки хранения проб до проведения анализа;
деление проб или формирование вторичных пробирок с повторной маркировкой;
распределение проб по рабочим местам.
Критериями отказа в приеме материала на исследование может быть расхождение между сведениями, указанными в заявке и маркировке пробирки, отсутствие маркировки, невозможность прочесть заявку и (или) маркировку и другие объективные причины. В случае отказа в исследовании медицинский работник КДЛ сообщает об этом лечащему врачу, назначившему исследование.
Контролю качества на аналитическом этапе подлежат:
проверка срока годности реагентов;
проверка наличия контрольного материала и стандартов;
проверка состояния аналитического оборудования, калибровки прибора, регулярного и своевременного технического обслуживания и метрологического контроля.
Постаналитический этап включает аналитическую и клиническую оценку полученных результатов и своевременное их использование для оценки состояния пациентов.
Глава 5. ПРОВЕДЕНИЕ ВНУТРИЛАБОРАТОРНОГО КОНТРОЛЯ
КАЧЕСТВА
Проведение внутрилабораторного контроля осуществляется после выбора контрольного материала и определения продолжительности аналитической серии для каждого анализа, измеряемого в лаборатории.
Полученные данные исследования контрольного материала должны быть документально оформлены. Результаты внутрилабораторного контроля качества вносятся в журналы регистрации лабораторных исследований и их результатов.
После этого проводится статистическая обработка полученных результатов контрольного материала, заполняются контрольные карты, проводится последующая их оценка. Допускается использование компьютерных программ для оценки внутрилабораторного контроля качества.
При выявлении систематических погрешностей на аналитическом этапе выполнение методики прекращается, и предпринимается комплекс мероприятий по устранению ошибки. Для этого осуществляется проверка стандартов, качества химических реактивов, состояния оборудования и проведения контроля правильности с использованием нескольких контрольных материалов. Данные мероприятия осуществляет врач КДЛ, ответственный за проведение контроля качества при непосредственном участии заведующего КДЛ.
При недостаточном количестве или отсутствии некоторых контрольных материалов программа контроля качества может проводиться с использованием следующих методов: исследования параллельных проб (дубликатов), случайных, повторных и смешанных проб; метода средних нормальных величин.
На постаналитическом этапе исследования осуществляется интерпретация полученных результатов, делается клинико-лабораторное заключение. Результаты анализов должны своевременно поступать лечащему врачу, назначившему лабораторное исследование.
Глава 6. СТАДИИ ВНУТРИЛАБОРАТОРНОГО КОНТРОЛЯ
КАЧЕСТВА
Ведение внутрилабораторного контроля качества для каждого метода состоит из трех последовательных стадий:
Оценка внутрисерийной воспроизводимости (сходимости) методики выполняется в 10 параллельных измерениях одномоментно с использованием пробы пациента или контрольного материала со значением показателя в нормальном диапазоне. Рассчитывают среднюю арифметическую величину (Xср), среднее квадратическое отклонение (S) и коэффициент вариации (CV, %). Для большинства биохимических показателей, а также гемоглобина, гематокрита предел аналитической вариации (разброса) результатов составляет 2-5%, для клеток крови, активности ферментов — 7-10%.
Оценка систематической погрешности и общей воспроизводимости методики, построение контрольных карт. Проводится после получения удовлетворительных результатов на сходимость. Продолжают исследовать тот же материал в течение 10 (минимум) – 20 (предпочтительно) последующих дней, выполняя по одному измерению в день (воспроизводимость во времени) в каждой аналитической серии. При использовании контрольного аттестованного материала полученные ежедневные результаты должны укладываться в референтный диапазон, указанный в паспорте к контрольному материалу. Полученная величина Хср за 10 (20) дней не должна отклоняться более чем на 10% (величина смещения, систематическая погрешность) от среднего значения контрольного материала.
После получения результатов исследования рассчитывают показатели Хср., S, контрольные пределы Хср. ± 1S; Xср. ± 2S; Хср. + 3S и коэффициент общей аналитической вариации CV (%), который должен соответствовать приведенному выше допустимому аналитическому разбросу.
Результаты, выходящие за пределы Xср. ± 2S, устраняют и проводят повторную статистическую обработку результатов.
После получения результатов, отвечающих требуемому коэффициенту вариации (допустимому аналитическому разбросу), переходят к построению контрольной карты для каждого показателя соответствующей аналитической серии.
Проведение текущего контроля качества результатов лабораторных исследований (оценка контрольных карт) в каждой аналитической серии проводится по предупредительным и контрольным критериям, а также с использованием правил Вестгарда. Для этих целей продолжают ежедневно исследовать тот же контрольный материал в тех же условиях.
По результатам внутрилабораторного контроля качества клинических лабораторных исследований врач КДЛ заполняет карту внутрилабораторного контроля качества клинических лабораторных исследований .
Карта внутрилабораторного контроля качества
клинических лабораторных исследований
за __________________________20___г.
(указать месяц)
|
Показатель: |
|
|
|
|
||
|
Контрольный материал: |
|
(указать) |
|
|||
|
Оборудование: |
|
|
(указать) |
|
||
|
Используемые реагенты: |
|
(указать) |
|
|||
|
|
|
|
(указать) |
|
||
|
№ п/п |
Дата |
Результат (X1) |
Результат (X2) |
Единицы измерения |
||
|
1. |
|
|
|
|
||
Рассчитывают статистические показатели Хср., S, CV (%) и строят контрольную карту.
|
Статистические показатели |
Дата |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
+3S |
|
|
|
|
|
|
|
|
|
|
|
+2S |
|
|
|
|
|
|
|
|
|
|
|
+1S |
|
|
|
|
|
|
|
|
|
|
|
Х ср |
|
|
|
|
|
|
|
|
|
|
|
-1S |
|
|
|
|
|
|
|
|
|
|
|
-2S |
|
|
|
|
|
|
|
|
|
|
|
-3S |
|
|
|
|
|
|
|
|
|
|
Врач по контролю качества
клинических лабораторных
исследований__________________________ ______________________________
(подпись) (инициалы, фамилия)
Дата выдачи результатов контроля «___»________________20__г.
Рекомендуемая литература
1. Біохімічний склад рідин організму та їх клініко-діагностичне значення / За ред. О.Я Солярова. – К.: Здоров"я, 2004. -192с.
2. Воронцова, Л. Л. Лабораторні методи досліджень імунної системи : навч.-метод. посібник / Л. Л. Воронцова ; ЗМАПО. - Запоріжжя : Вид-во "Орбіта-Юг", 2009. - 112 с.
3. Гигранович В.И., Гигранович А.В. Биохимия. – Минск: ТетраСистемс, 2010. – 528 с.
4. Герасимов,А.Н. Медицинская статистика : учеб.пособ. / А.Н.Герасимов.- М.:ООО"Медицин. информ.агентство",2007.- 480с
5. Горячковский, А.М. Клиническая биохимия в лабораторной диагностике / А. М. Горячковский. – Одесса:Экология. – 2005. – 616с.
6. Губський,Ю.І. Біологічна хімія : підруч. / Ю.І. Губський.- Вінниця : Нова книга,2007.- 666с.
7. Застосування швидких тестів у лабораторній діагностиці інфекційних хвороб : метод. рекомендації з наказом МОЗ України № 467 від 23.09.2004 та наказом МОЗ України № 158 від 24.03.2006 / КМАПО ; сост.: В. П. Широбоков [и др.]. - К. : Б.В., 2006. - 33 с.
8. Камышников, В.С. Справочник по клинико-биохимическим исследованиям и лабораторной диагностике / В. С. Камышников. – М.: МЕДпресс-информ., 2009. – 896 с.
9. Камышников, В.С. Техника лабораторных работ / В. С. Камышников. – Мн.: Белорусская наука, 2001. – 286 с.
10. Клінічна біохімія (підручник) / За загальною редакцією д.мед.н., професора Луньової Г.Г. - Київ: «Атіка».-2013.- С.954.
11. Клиническая лабораторная диагностика (методы и трактовка лабораторных исследований) : учеб. пособие / В. С. Камышников [и др.] ; ред. В. С. Камышников. - М. : "МЕДпресс-информ", 2015. - 720 с
12. Клінічна лабораторна діагностика : учеб. пособие / Б. Д. Луцик [и др.] ; ред. Б. Д. Луцик. - К. : ВСВ "Медицина", 2011. - 288 с.
13. Кучеренко М.Є. Сучасні методи біохімічних досліджень.-К.:Фітосоціоцентр. 2001. – 424 с.
14. Лабораторні та інструментальні методи в діагностиці хронічного панкреатиту : Метод. рекоменд.- Запоріжжя, 2003.- 19с.
15. Медична генетика. Підручник. / За ред. О.Я. Гречаніної, Р.В. Богатирьової, О.П. Волосовця - К.: Медицина, 2007. - 534с.
16. Методи клінічного дослідження крові: Учеб. –метод. посібник. –Запоріжжя, 2005. -95с.
17. Методи дослідження, аналіз та діагностичне значення показників гемограми : навч. посібник / Л. Л. Воронцова [и др.] ; МОЗ України, ДЗ "ЗМАПО МОЗ України". - Запоріжжя : Б. В, 2014. - 140 с.
18. Мошкин, А.В. Обеспечение качества в клинической лабораторной диагностике: Практическое руководство / А.В.Мошкин, В.В. Долгов. – М., Медиздат. – 2004. – 216с.
19. Назаренко, Г.И. Управление качеством лабораторных исследований / Г.И.Назаренко, А.А.Кишкун. – М., Медицина. – 2001.
20. Никулин, Б.А. Пособие по клинической биохимии / Б.А. Никулин. – М.: ГЭОТАР-МЕД., 2007. – 254 с.
21. Обеспечение качества лабораторных исследований преаналитический этап: справочное пособие / под ред. В.В. Меньшикова. – М., 1999. –320с.
22. Управление качеством клинических лабораторных исследований. Нормативные документы / под ред. В.В. Меньшикова. – Москва: Лабпресс, 2000. –152с.
23. Чиркин А.А., Данченко Е.О., Биохимия - М.: Медицинская литература, 2010., 605 с.
24. Шевряков М.В. Практикум з біологічної хімії. – Суми: ВТД «Університетська книга», 2003. – 204 с.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.