
СОДЕРЖАНИЕ
1.Хранение и отбор использование углеводородов
2.Приготовление растворов сравнение
3. Список используемой литературы
Косвенные методы
отгонки.
Методы отгонки основаны на том, что определяемый компонент выделяют из анализируемой пробы в виде газообразного вещества. Различают прямуюотгонку, когда непосредственно измеряют массу выделившихся газов, и косвенную, где масса газов оценивается по изменению массы пробы в ходе анализа. Метод прямой отгонки используют при оценке влажности пищевых продуктов, например, муки; при производстве биопрепаратов, анализе почв. Эти методы не являются универсальными, но нередко их используют в сочетании с другими видами анализа и разделения веществ, например, с экстракцией, хроматографией и т. д. На рисунках 5.2 и 5.3 показаны простейшие устройства для выполнения отгонки холодным способом (без нагрева) и горячим (с нагревом).
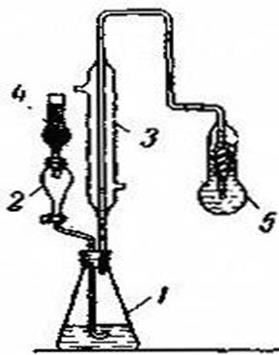
Рисунок 5.2. Прибор для
определения ![]() (без нагрева):
(без нагрева):
1 – коническая колба с пробой; 2 – капельная воронка; 3 – холодильник;
4 – хлоркальциевая трубка; 5 – приемник.
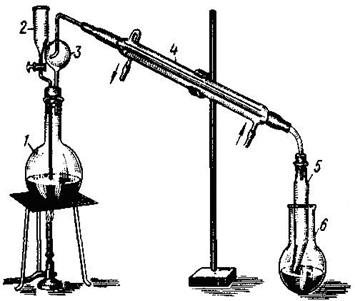
Рисунок 5.3 – Прибор для отгонки аммиака (с нагревом):
1 – колба для отгонки аммиака; 2 – воронка; 3 – каплеуловитель;
4 – холодильник; 5 – аллонж; 6 – приемник.
Примером применения прямой отгонки может служить определение содержания карбоната кальция по массе выделившегося диоксида углерода. Для этого можно использовать либо его реакцию с кислотой (5.1) – холодная отгонка, либо термического разложения (5.2) – горячая отгонка.
![]() (5.1)
(5.1)
![]() (5.2)
(5.2)
Выделяющийся в ходе реакции
диоксид углерода поглощается натронной известью (смесь ![]() и
и ![]() ),
массу которой определяют до и после реакции. По изменению массы поглотителя
находят массу выделившегося газа и выполняют расчет содержания
),
массу которой определяют до и после реакции. По изменению массы поглотителя
находят массу выделившегося газа и выполняют расчет содержания ![]() по
формуле:
по
формуле:
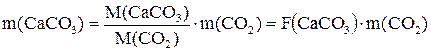
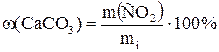 (5.3)
(5.3)
где ![]() – масса
навески
– масса
навески ![]() ;
; ![]() – масса выделившегося
газа;
– масса выделившегося
газа; ![]() – факторный множитель по
определяемому компоненту.
– факторный множитель по
определяемому компоненту.
В методах косвенной отгонки, летучий компонент отгоняют из навески исследуемого вещества, а о содержании летучего компонента судят по уменьшению ее массы, взвешивая навеску до и после проведения анализа. Таким способом можно определять количество адсорбированной и кристаллизационной воды в солях, влажность продуктов питания (мука, хлеб). Анализ на влажность выполняют с использованием стеклянных или металлических боксов. Навеску вещества (1 – 10 г) взвешивают на технохимических весах с точностью до 0,01 г, просушивают до постоянной массы и рассчитывают содержание влаги по формуле:
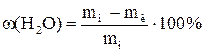 , (5.4)
, (5.4)
где ![]() – начальная
масса, а
– начальная
масса, а ![]() – конечная масса навески.
– конечная масса навески.
Метод осаждения.
Метод осаждения —один из самых распространенных и основательно разработанных в гравиметрическом анализе.
К основным этапам гравиметрического анализа в методе осаждения в общем случае относятся следующие:
• расчет массы навески анализируемой пробы и объема (или массы) осадителя;
• взвешивание (взятие) навески анализируемого образца;
• растворение навески анализируемого образца;
• осаждение, т. е. получениеосаждаемой формыопределяемого компонента;
• фильтрование (отделение осадка от маточного раствора);
• промывание осадка;
• высушивание и (при необходимости) прокаливание осадка до постоянной массы, т.е. получениегравиметрической формы,взвешивание гравиметрической формы;
• расчет результатов анализа, их статистическая обработка и представление. Рассмотрим кратко каждую из этих операций.
Масса навески, предназначенной для анализа и, следовательно, для взвешивания на аналитических весах, берется не произвольно. Если масса навески взята слишком малой, тоотносительныепотери при последующих операциях могут привести к заметной относительной ошибке анализа. Если, напротив, навеска взята слишком большой, то при получении осаждаемой формы образуется значительная масса осадка, что затрудняет его фильтрование и промывание, способствует соосаждению из раствора значительных количеств примесей, увеличивает продолжительность анализов и расход реактивов. Поэтому требуется оценить оптимальную массу навески. При расчете оптимальной массы навески анализируемого вещества учитывают возможную массовую долю определяемого компонента в анализируемой пробе и в гравиметрической форме, массу гравиметрической формы, систематическую ошибку взвешивания на аналитических весах (обычно ±0,0002 г), характер получаемого осадка —аморфный, мелкокристаллический, крупнокристаллический.
Часто исходят из того, чтобы относительная ошибка гравиметрического анализа не превышала ± 0,2%.Используют такие методики анализа, при которых основной вклад в ошибку анализа вносит погрешность взвешивания на аналитических весах, тогда как ошибки, связанные с растворимостью осадка в маточном растворе, с потерями при его промывании, были бы меньше погрешности взвешивания на аналитических весах.
Относительная ошибкаeвзвешивания на аналитических весах определяется соотношением (7.2)
e=Dm×100%/m, (7.2)
гдеDm = 0,0002г, т —навеска анализируемого вещества в граммах. Поскольку относительная ошибка гравиметрического анализа не должна превышать по абсолютной величине 0,2%, а она определяется относительной погрешностью взвешивания, то е = 0,2% (не больше). Тогда, согласно (7.2),
0,2% = 0,0002×100%/m.
Следовательно, оптимальная массанавески, при которой допустима относительная ошибка гравиметрического анализа не более ±0,2%, должна быть не меньше, чем
т = 0,0002 • 100 %/0,2 = 0,1г.
Конечно, в соответствии с (2.2) чем больше масса,тем меньше относительная ошибка анализа. Однако брать слишком большую навеску не рекомендуется по причинам, упоминавшимся выше.
В методе осаждения взвешивают не только исходную навеску определяемого вещества, но и конечную навеску гравиметрической формы, масса которой в соответствии с изложенным выше также должна быть не меньше 0,1г. Это условие необходимо иметь в виду при расчете массы исходной навески анализируемого вещества.
На практике при расчете оптимальной массы исходной навески исходят из того, чтобы оптимальная масса конечной гравиметрической формы была бы не меньше 0,1г.
В результате обобщения многочисленных исследований было рекомендовано задавать оптимальную массу гравиметрической формы, следующей:
для объемистых аморфных осадков —около 0,1г,
для кристаллических осадков —от 0,1до 0,5г (для легких осадков — от 0,1до 0,2г, для тяжелых осадков —от 0,4до 0,5г).
Зная требуемую массу гравиметрической формы, ее состав, а также примерное содержание определяемого компонента в исходной анализируемой пробе, можно рассчитать массу исходной навески в каждом конкретном случае.
Обычно масса исходной навески указывается в методике анализа. Проиллюстрируем сказанное простыми примерами.
Пример 1.Расчет массы исходной навески при гравиметрическом определении железа(III)в хлоридеFеCl3×6Н2О осаждением раствором аммиака в виде гидроксида железа(III) Fе(ОН)3(осаждаемая форма) с последующим прокаливанием осаждаемой формы доFе2О3(гравиметрическая форма). Получение осаждаемой формы:
FeCl3+3NH3×H2O®Fe(OH)3+3NH4CI
Осаждаемая форма представляет собой аморфный сильно гидратированный осадок гидроксида железа (III), практически нерастворимый в воде. Получение гравиметрической формы:
2Fе(ОН)3 800-900°C® Fe2O3+ 3H2O
В соответствии с изложенным выше (осадок аморфный) задаваемую массу гравиметрической формы примем равной (Fe2O3) = 0,1г.
Число атомов железа(Ш)в одном моле гравиметрической формы равно двум, а в одном моле исходного хлорида железа(Ш) —единице. Следовательно, число молей хлорида железа(Ш)в исходной навеске должно быть в два раза больше числа молей оксида железа(Ш)в навеске гравиметрической формы. Тогда масса исходной навески хлорида железа(Ш)будет равна:
|
m(FеС13•6Н2O) = |
2m(Fe2O3) × М(FeCI3 × 6Н2O) |
= |
2×0,1 ×270,3 |
» 0,340г |
|
M(Fе2О3) |
159,7 |
Таким образом, масса исходной навески хлорида железа(Ш)не должна быть меньше ~ 0,340г.
Пример 2. Расчет массы исходной навески при гравиметрическом определении бария в нитрате бария Ва(NО3)2в виде хромата бария ВаСrO4(гравиметрическая форма). Осаждаемая форма —также хромат бария —представляет собой мелкокристаллический осадок.
В соответствии с изложенным ранее задаваемую массу гравиметрической формы примем равной(BaCrO4) = 0,3г (поскольку осадок — мелкокристаллическое вещество).
Масса исходной навески нитрата бария[Ва(NО3)2] равна произведению числа молейнитрата бария, содержащихся в этой навеске, на молярную массу нитрата бария[Ва(NО3)2]:
m[Ва(NО3)2] =n M[Ва(NО3)2]
Число молей нитрата бария в исходной навеске равно числу молей хромата бария в гравиметрической форме, т.е.
|
п = |
m(ВаСrО4) |
|
MВаСrO4) |
Тогда окончательно
|
m[Ва(NО3)2] = |
m(BaCrO4) × M[Ва(NО3)2] |
= |
0,3×261,3 |
» 0,31г |
|
М(ВаСrO4) |
253,3 |
Таким образом, масса исходной навески нитрата бария не должна быть меньше -0,31г.
В общем случае нижний предел оптимальной массы тисходной навески анализируемого вещества (в граммах) рассчитывают по формуле (7.3):
|
m = |
100m(ГФ)F |
|
W(X) |
(7.3)
Где(ГФ) —масса гравиметрической формы в граммах;F —гравиметрический фактор (фактор пересчета, аналитический множитель),W(Х) — массовая доля (в %)определяемого компонента в анализируемом веществе.
Гравиметрический фактор F, численно равен массе определяемого компонента в граммах, соответствующей одному грамму гравиметрической формы.
Гравиметрический фактор рассчитывается по формуле (7.4)как отношение молярной массыM/(Х) определяемого компонента Х к молярной массе гравиметрической формыМ(ГФ),умноженное на числомолей определяемого компонента, из которого получается один моль гравиметрической формы:
F = nM(X)/М(ГФ) (7.4)
Так, если из двух молей FеС13 •6Н2О получается один моль гравиметрической формы Fе2О3, топ = 2.Если из одного моля Ва(NО3)2получают один моль гравиметрической формы ВаСrO4, топ = 1.
В таблице 7.1приведены в качестве примеров величины гравиметрического фактора для ряда гравиметрических форм.
Расчет количества (объема или массы) осадителяведут с учетом возможного содержания определяемого компонента в анализируемой пробе. Для увеличения полноты выделения осадка применяют умеренный избыток осадителя. Большой избыток осадителя брать не рекомендуется во избежание загрязнения осадка избыточным осадителем. Если осадитель летуч —удаляется при нагревании осадка (например, осадитель — раствор НС1), то берут двух-трехкратный его избыток по сравнению со стехиометрическим (т.е. соответствующим уравнению реакции образования осадка). Если осадительнелетуч (например, раствор хлорида барияBaCl2), берут меньший его избыток —примерно полуторакратный.
Таблица 7.1
Гравиметрические (аналитические) факторы F для пересчета массы
гравиметрической формы m(ГФ) в массу m(Х) определяемого компонента X: m(Х) = Fт(ГФ)
|
Х |
Гравиметрическая форма |
F |
|
Li |
Li3PO4 |
3M(Li)/M(Li3PO4) =0,1798 |
|
К |
K2PtCI6 |
2 M (K)/ M (K2PtCl6) = 0,1609 |
|
Mg |
Mg2P2O7 |
2 M (Mg)/ M Mg2P2O7) = 0,2184 |
|
Mg |
Mg(C9H6ON)2 —оксихинолят |
M(Mg)/MMg(C,H«ON)2] = 0,07775 |
|
Са |
CaO |
MСа)/ M(СаО)=0,7147 |
|
Ca |
CaC2O4 • H2O |
M (Ca)/ M CaC2O4-×H2O) = 0,2743 |
|
Са |
CaSO4 |
M(Ca)/M(CaSO4) = 0,2944 |
|
Sr |
SrC2O4 • H2O |
M (Sr)/ M (SrC2O4 × H2O) = 0,4524 |
|
Ba |
BaSO4 |
M (Ba)/ M (BaSO4) = 0,5884 |
|
Al |
Al2O3 |
M(А1)/ M(А12O3)= 0,5293 |
|
Сu |
Cu(C9H6ON)2 —оксихинолят |
M (Cu)/ M[Cu(C9H6ON)] = 0,1806 |
|
Ag |
AgCI |
M (Ag)/ M (AgCI) = 0,7526 |
|
Zn |
Zn2P2O7 |
2 M (Zn)/ M (Zn2P2O7) = 0,4292 |
|
Cr |
ВаСrO4 |
M(Сr)/ MВаСrO4) = 0,2053 |
|
Fe |
Fe2O3 |
2 M(Fе)/ M(Fе2O3)= 0,6994 |
|
F3O4 |
F2О3 |
2 M(Fе3О4)/3 M(Fе2O3) = 0,9666 |
|
Ni |
NiC8H14N4O4 — бисдиметилглиоксимат |
M (Ni)/ M (NiC8H14N4O4) = 0,2031 |
|
P |
Mg2P2O7 |
M (P)/ M (Mg2P2O7) = 0,2783 |
|
P2O5 |
Mg2P2O7 |
M(P2O7)/M(MgP2O7) = 0,6378 |
|
SO4 |
BaSO4 |
M (SO4)/ M (BaSO4) = 0,4116 |
|
Cl |
AgCI |
M (Cl/ M AgCl) = 0,2774 |
|
Br |
AgBr |
M (Br)/ M (AgBr)= 0,4255 |
|
H2SO4 |
BaSO4 |
M (H2SO4)/ M (BaSO4) = 0,4202 |
|
SCN |
AgSCN |
M /(SCN)/ M (AgSCN) = 0,3500 |
Основные требования, предъявляемые к осадителю.
1)Осадитель должен быть специфичным, селективным по отношению к осаждаемому иону.
2)Осадитель должен быть по возможности летучим, т.е. должен легко удаляться при нагревании или прокаливании осаждаемой формы.
Так, например, катионы бария осаждаются из водного раствора в форме сульфата бария при прибавлении раствора серной кислоты, растворов сульфатов натрия, калия и других растворимых сульфатов. Примеси сорбированной осадком серной кислоты удаляются при последующем нагревании и прокаливании осадка сульфата бария, тогда как сорбированные примеси сульфатов натрия или калия не удаляются. Поэтому для осаждения бария в виде сульфата бария следует применять раствор серной кислоты, а не растворы сульфатов металлов.
К важнейшим неорганическим осадителям относятся растворы НС1, H2SО4, Н3РО4,NaOH,NH3,AgNO3,BaCl2, (NH4)2C2О4, (NH4)2HPО4и др.
В качестве органических осадителей применяют растворы диметилгли-оксима, 1-нитрозо-2-нафтола, 8-оксихинолина, щавелевой кислоты и т..д.
Применение органических осадителей, образующих с катионами металлов устойчивые внутрикомплексные соединения, обладает рядом преимуществ по сравнению с использованием типичных неорганических осадителей.
1)Внутрикомплексные соединения металлов, как правило, обладают незначительной растворимостью в воде, что обеспечивает высокую полноту осаждения определяемого катиона металла.
2)Адсорбционная способность осадков внутрикомплексных соединений, имеющих молекулярную кристаллическую решетку, ниже адсорбционной способности неорганических осадков с ионной структурой. Поэтому осадки внутрикомплексных соединений адсорбируют из раствора меньше примесей и получаются более чистыми.
3)Возможно селективное или даже специфическое осаждение того или иного катиона металла из раствора в присутствии других катионов.
4)Благодаря сравнительно большой молекулярной массе внутрикомплексных соединений относительная ошибка определения понижается (уменьшается значение гравиметрического фактора F)по сравнению с использованием неорганических осадителей с невысокой молекулярной массой.
Расчет объема раствора осадителяпроводят, исходя из требуемого количества осадителя и его концентрации. Как отмечено выше, применяют избыток осадителя. При этом масса осаждаемого вещества, остающаяся в растворе вследствие некоторой (пусть и незначительной) его растворимости, не должна, как правило, превышать 0,0002г, т. е. ошибки взвешивания на аналитических весах. В противном случае необходимо вносить поправки на потери определяемого компонента вследствие частичного растворения осадка.
Пример.Рассчитаем количество осадителя и оптимальный объем раствора осадителя для гравиметрического определения серной кислоты в виде сульфата барияBaSO4(осаждаемая и гравиметрическая форма). Ориентировочная масса серной кислоты в растворе объемом 100мл около 0,2г:m(H2SO4) = 0,2г. Осадитель —водный 0,2моль/л раствор хлорида бария ВаСl2.
При прибавлении раствора осадителя к анализируемому раствору серной кислоты выделяется белый мелкокристаллический осадок сульфата бария (осаждаемая форма):
BaCl2 +H2SO4 ®BaSO4 + 2HCl
Осадок (после его созревания под маточным раствором) отделяют, промывают, высушивают, прокаливают и взвешивают.
Решение. 1)Рассчитаем приблизительное количество(H2SO4) серной кислоты в анализируемом растворе:
n(H2SO4) = m(H2SO4) / M (H2SO4) = 0,2/98,08 » 0,002 моль.
2)Рассчитаем объемV(BaCl2) 0,2моль/л раствора хлорида бария, необходимый для стехиометрического превращения всей серной кислоты в сульфат бария. Количество хлорида бария, требуемое для связывания0,002моля серной кислоты, также равно 0,002моля, что следует из стехиометрии реакции.
В 1000мл 0,2моль/л раствора ВаСl2содержится 0,2моляBaCl2.
В V(BaCl2) мл 0,2моль/л того же раствора содержится 0,002моляBaCl2. Следовательно,V(ВаС12) = 0,002×1000/0,2=10мл.
3)Поскольку осадитель —хлорид бария —нелетучее вещество, то в соответствии с изложенным выше следует брать примерно полуторакратный его избыток, т. е. оптимальный объем раствора осадителя равен1,5 •10мл = 15мл.
В приведенном примере была известна молярная концентрация раствора осадителя. Если же задается не молярная концентрация, а массовая доля осадителя в растворе, то для расчета количества осадителя и объема раствора осадителя необходимо знать плотность раствора осадителя.
Взвешивание исходной навески анализируемого вещества проводят на аналитических весах с погрешностью взвешивания, чаще всего равной ±0,0002 г. Обычно навеску помещают в чистый сухой стеклянный бюкс, предварительно взвешенный на тех же аналитических весах. Иногда навеску вначале взвешивают на технических или аптечных весах и уже после этого —на аналитических весах. По разности масс бюкса с навеской и пустого бюкса вычисляют массу навески.
Навеску растворяют в подходящем растворителе в условиях, предусмотренных методикой анализа. Наиболее часто в качестве растворителя применяют дистиллированную воду или водные растворы кислот. Если в качестве растворителя используют дистиллированную воду, то в оптимальном варианте берут 100—150мл воды.
Эта операция —одна из важнейших в методе осаждения.
Основные цели при получении осаждаемой формы состоят в том, чтобы
- свести к минимуму потери за счет растворения осадка в маточном растворе;
- осадок не содержал примесей других веществ (вследствие их адсорбции на осадке, окклюзии, соосаждения);
- частицы осадка были бы достаточно крупными, не проходили через поры фильтра и не забивали их.
В методе осаждения приходится сталкиваться с кристаллическими и аморфными осадками, хотя провести четкую границу между теми и другими затруднительно.
Кристаллические осадки состоят из более крупных частиц, чем аморфные, меньше сoрбируют примесей из раствора, легче фильтруются. Поэтому в большинстве случаев (когда это возможно) стараются получить не аморфные, а кристаллические осадки, по возможности крупнокристаллические, проводя осаждение в условиях, благоприятствующих образованию таких осадков.
Требования к осаждаемой форме
1)Определяемый компонент должен переходить в осадок количественно. Растворимость осадка должна быть незначительной: масса растворившегося осадка не должна превышать ошибку взвешивания на аналитических весах, т. е. 0,0002г. Поэтому, при прочих равных условиях, в качестве осаждаемой формы следует выбирать наименее растворимую.
Так, например, сульфат-ионы осаждаются из водных растворов в форме осадков CaSO4,SrSO4,BaSO4,PbSO4. Произведение растворимости этих сульфатов при комнатной температуре соответственно равно2,5•10-5, 3,2•10-7, 1,1•10-10, 1,6 •10-8.Наименьшей растворимостью обладает сульфат бария. Следовательно, в качестве осаждаемой формы нужно выбрать сульфат бария, т. е. проводить осаждение сульфат-ионов растворами солей бария.
2)Осадок не должен растворяться в избытке осадителя с образованием растворимых комплексных соединений.
3)Осадок не должен содержать посторонние примеси.
4)Осадок должен быть устойчивым к внешним воздействиям —не окисляться, не восстанавливаться и др.
5)Осаждаемая форма должна при высушивании или прокаливании нацело превращаться в гравиметрическую форму без потерь определяемого компонента.
6)Структура осадка должна обеспечивать оптимальное проведение фильтрования и промывания осадка от примесей. Наиболее удобны, как уже отмечалось, крупнокристаллические осадки, так как они не забивают поры фильтра, имеют малую поверхность (т. е. мало адсорбируют посторонние частицы из раствора), легко промываются.
Кроме перечисленных общих требований в аналитических методиках могут указываться и некоторые другие, обусловленные спецификой анализа конкретного объекта.
Условия образования кристаллических и аморфных осадков.
Из разбавленных растворов осадки не выпадают. В насыщенных растворах устанавливается гетерогенное равновесие между осадком и раствором, поэтому масса осадка остается неизменной. Осадок образуется только тогда, когда концентрация раствора становится выше, концентрации насыщенного раствора, т. е. осадок выпадает из метастабильного пересыщенного раствора.
Пересыщенные растворы характеризуются относительным пресыщением или степенью пресыщение, Рв соответствии с уравнением (7.5):
P=(c ‑ S)/S, (7.5)
где с —концентрация данного пересыщенного раствора,S —равновесная концентрация насыщенного раствора (растворимость данного вещества). Очевидно, чтос >S.Чем больше величинаР,тем более пересыщенным является данный раствор.
Если величина Рвелика, то обычно образуется аморфный осадок; если величинаРмала, то при прочих равных условиях образуется кристаллический осадок.
Пересыщенные растворы термодинамически неустойчивы (метастабильны) и рано или поздно самопроизвольно выделяют осадки растворенных веществ до тех пор, пока раствор станет насыщенным —перейдет в термодинамически устойчивое состояние. Границы (концентрационные и температурные условия) метастабильного существования пересыщенных растворов для различных сочетаний растворенных веществ и растворителей различны.
Процесс образования осадка сложный. Вначале появляются мелкие кристаллические зародыши —центры кристаллизации. Они возникают за счет собственно образования мельчайших зародышей кристаллов; однако образование зародышей инициируется также присутствием мелких частиц посторонних веществ (например, пылинок, мелких частиц стекла, образующихся при потирании стенки стеклянного сосуда стеклянной палочкой, и т. п.), которые практически всегда присутствуют в растворе. Возникшие мелкие центры кристаллизации могут либо снова раствориться; либо расти, увеличиваясь в размерах, — наблюдается рост кристаллов.
Скорость n1образования центров кристаллизации и скоростьn2роста кристаллов по-разному зависят от степени пересыщенияраствораРв соответствии с уравнениями (7.6)и (7.7):
n1 =k1 P² (7.6)
n2 =k2 P (7.7)
где п » 4;k1иk2—коэффициенты, причемk1 < k2.
Согласно (7.6)и (7.7),при малой степени пересыщенияn2 >n1, поэтому преобладает рост кристаллов, тогда как образование новых центров кристаллизации происходит медленнее. В этих условиях получаются кристаллические осадки, частицы которых имеют сравнительно большие размеры.
Напротив, при высоких значениях степени пересыщения раствора Р ужеn1>n2, т.е. доминирует образование новых центров кристаллизации; рост же кристаллов идет медленнее. В этих условиях получаются либо аморфные, либо мелкокристаллические осадки, частицы которых имеют малые размеры, поэтому обладают повышенной адсорбционной способностью (адсорбируют примеси посторонних веществ из раствора), могут либо проходить через поры фильтра, либо забивать их, что в целом затрудняет проведение анализа и повышает ошибку гравиметрического определения.
При очень низкой растворимости осадка высокая степень пересыщения. раствора достигается сразу, при прибавлении малых количеств осадителя. В этих условиях формируются коллоидные частицы (с размером порядка ~10-7см). При их коагуляции получают аморфные студенистые осадки. Такие осадки образуются, например, в следующих случаях:
|
состав осадка |
произведение растворимости |
|
Fе(ОН)3 |
6,3 • 10-38 |
|
А1(ОН)3 |
3,2 • 10-34 |
|
CuS |
6,3 •-10-36 |
|
Ag2S |
6,3•10-50 |
Обычно стараются проводить осаждение в таких условиях, когда степень пересыщения мала. Это достигается за счет медленного (по каплям) прибавления раствора осадителя (особенно в начале процесса осаждения), при интенсивном (но осторожном!) перемешивании всего раствора во избежание возникновения локальных областей с повышенной степенью пересыщения; за счет нагревания анализируемого раствора и раствора осадителя (при повышении температуры, как правило, возрастает растворимость осадка, поэтому мелкие частицы растворяются и затем осаждаются на поверхности более крупных центров кристаллизации); за счет введения веществ, увеличивающих растворимость осадка (например, иногда добавляют небольшое количество кислоты), что также приводит к растворению мелких и росту более крупных кристаллов.
Образовавшийся осадок находится в динамическом равновесии с маточным раствором. Он постоянно обменивается ионами с маточным раствором. Происходит самопроизвольный рост более крупных кристаллов за счет растворения мелких частиц, совершенствуется кристаллическая структура осадка, сокращается его удельная поверхность, вследствие чего десорбируются и переходят в раствор примеси поглощенных ранее веществ, а окклюдированные (захваченные при выпадении осадка) капельки растворителя (раствора) высвобождаются из осадка. Эти процессы, как правило, ускоряются при повышении температуры. В целом подобное преобразование осадка обычно называютсозреванием осадка.
Для созревания и формирования хорошо фильтрующихся кристаллических осадков их после выпадения из раствора оставляют на некоторое время (от нескольких часов до нескольких десятков часов) вместе с маточником. Время созревания кристаллических осадков можно сократить, нагревая раствор с осадком.
Учитывая изложенное, можно указать на следующие основные условия получения кристаллических осадковв гравиметрическом методе осаждения.
1)Осаждение следует вести из разбавленного анализируемого раствора разбавленным раствором осадителя.
2)Раствор осадителя прибавляют медленно, по каплям (особенно в начале осаждения), при непрерывном осторожном перемешивании раствора.
3)Осаждение следует вести из горячего анализируемого раствора горячим раствором осадителя.
4)В некоторых случаях осаждение полезно вести в присутствии веществ (например, небольших количеств кислоты), слегка повышающих растворимость осадка, ноне образующих с ним растворимые комплексные соединения.
5)Выпавший осадок оставляют на некоторое время вместе с маточником для созревания осадка.
Однако в гравиметрическом анализе не всегда имеют дело только с кристаллическими осадками. Так, при определении железа (Ш) или алюминия получают объемистые аморфные, сильно гидратированные осадки гидроксидов железа (Ш)или алюминия. Обладая развитой поверхностью, такие осадки способны адсорбировать примеси из раствора. Кроме того, они склонны к образованию коллоидных растворов. Для предотвращения образования коллоидных растворов (для коагуляции коллоидных частиц) в анализируемый раствор вводят электролит-коагулятор и повышают температуру.
Придлительномвыдерживании с маточным раствором аморфные осадки часто подвергаются старению, изменяя до некоторой степени свои свойства, вследствие чего плохо фильтруются. Правда, иногда их оставляют на какое-то время вместе с маточником для созревания осадка (что обязательно оговаривается в соответствующей методике анализа). При промывании аморфных осадков возможна их пептизация и частичная потеря вместе с промывной жидкостью, поэтому их промывают горячей водой, иногда содержащей электролиты, препятствующие пептизации осадка.
Если в качестве осаждаемой формы образуется аморфный осадок, то его стремятся получить как можно более плотным, с тем чтобы улучшить его фильтрование и уменьшить потери при его промывании.
Условия получения аморфных осадков
1)К горячему концентрированному анализируемому раствору прибавляют горячий концентрированный раствор осадителя. В этих условиях происходит коагуляция коллоидных частиц и осадки получаются более плотными.
2)Горячий раствор осадителя прибавляют быстро, что уменьшает вероятность образования коллоидных растворов.
3)При необходимости в раствор вводят электролит-коагулятор.
4)Избегают длительного выдерживания осадка с маточным раствором.
Обычно условия осаждения (получения осаждаемой формы) подробно регламентируются методикой анализа
Отделение осадка от маточного раствора фильтрованием проводят после его созревания (кристаллические осадки) или сразу после осаждения (аморфные осадки).
Фильтрование проводят с использованием стеклянных или беззольных бумажных (чаще всего) фильтров.
Бумажные беззольные фильтры имеют разную плотность и размеры пор, что обозначается разным цветом надписей на упаковках фильтров или цветом ленты (полосы) на пачке с фильтрами. Наиболее плотные фильтры снабжаются синей лентой, фильтры средней плотности —белой, наименее плотные —черной или красной. Наиболее плотные фильтры и фильтры средней плотности используют для фильтрования кристаллических осадков, наименее плотные —для фильтрования аморфных осадков. Обычный диаметр круглых беззольных фильтров фабричного производства составляет 6, 7, 9и 11см. Беззольные бумажные фильтры при сгорании и прокаливании образуют остаток —золу, масса которой меньше ошибки взвешивания на аналитических весах и поэтому обычно не учитывается при измерении массы гравиметрической формы.
При фильтровании вначале пропускают через фильтр прозрачный надосадочный раствор. Оставшийся осадок обычно промывают вначале непосредственно в стакане, в котором проводили осаждение, сливая на фильтр промывную жидкость вместе с частицами осадка, а затем количественно переносят на фильтр весь осадок. На фильтре осадок также промывают несколькими порциями промывной жидкости. Состав промывной жидкости (горячая, холодная вода или раствор какого-то вещества) и условия промывания указываются в аналитической методике.
При необходимости учитывают потери осадка за счет его растворения в маточном растворе и в промывной жидкости, для чего требуется знать объем маточного раствора, промывной жидкости и растворимость (концентрацию насыщенного раствора) осаждаемой формы. Примеры подобных расчетов приведены далее в разделе 7.5.1(примеры 6—8).
Осадок (осаждаемая форма) после его перенесения на фильтр и промывания высушивают вместе с фильтром в сушильном шкафу при температуре около 100°С. Сухой фильтр с осадком помещают в предварительно прокаленный и взвешенный тигель (чаще всего фарфоровый) и озоляют в пламени газовой горелки, следя за тем, чтобы фильтр тлел, но не воспламенялся (во избежание потерь осадка при сгорании фильтра). По окончании обеззоливания тигель с осадком обычно прокаливают в муфельной печи до постоянной массы при температуре, зависящей от природы осадка.
Например, сульфат барияBaSO4прокаливают при 700—900°С; при этом состав осадка не изменяется, а удаляются только примеси. Гидроксид железа(III) прокаливают при 800—900 °С;осаждаемаяформаFe(OH)3переходит в гравиметрическуюFе2О3. ОсадокCaSO4прокаливают около 900 °С;при этом его состав не изменяется.
Гравиметрическая форма должна отвечать ряду требований, важнейшими из которых являются следующие.
Требования, предъявляемые к гравиметрической форме
1)Состав гравиметрической формы должен точно соответствовать ее стехиометрии (например,CaSO4, ВаSО4, ВiРО3, Аl2О3,Fе2Оз, СаО и т. д.).
2)Гравиметрическая форма должна быть стабильной на воздухе, не разлагаться, не подвергаться окислительно-восстановительным процессам и т. п.
3)Гравиметрический факторFдолжен иметь по возможности минимальное значение, так как при этом понижается относительная ошибка гравиметрического определения.
Взвешивание гравиметрической формы.Доведение гравиметрической формы до постоянной массы проводят в процессе прокаливания осадка. Для этого после первого прокаливания в течение времени, указанного в методике анализа (часто —около часа —полутора часов), тигель с осадком быстро переносят из муфельной печи в эксикатор, охлаждают до комнатной температуры около получаса и взвешивают на аналитических весах. Затем прокаливание, охлаждение и взвешивание повторяют до тех пор, пока разность двух последних взвешиваний не будет превышать ошибки взвешивания на аналитических весах (±0,0002 г). Иногда аналитическая методика предусматривает менее жесткие требования к разности между двумя последними взвешиваниями (от 0,0003до0,0005г).
Исследуемое вещество или компонент смеси количественно выделяют в свободном состоянии и взвешивают. Метод выделения применяют, например, для установления качества лекарственных препаратов, зольности угля или нефти, количества сухого остатка при анализе природных и сточных вод.
Список используемой литературы
1. Золотов Ю.А., Основы аналитической химии: В 2 томах Том 1.- М.: Академия,2014
2. Золотов Ю.А., Основы аналитической химии: В 2 томах Том 2.- М.: Академия,2014
3. Ищенко А.А., Аналитическая химия и физико-химические метады анализа: в томах. Том 1 М.: Академия,2014
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.