
Тема урока «Тепловые эффекты химических реакций» 9класс
Цель: Познакомить с понятием “тепловой эффект химических реакций”, классификацией химических реакций (явлений) по тепловому эффекту. Уметь составлять термохимические уравнения и производить расчеты теплоты по уравнению реакции. Владеть понятиями “теплота”, “энергия”, “экзо- и эндотермические реакции”, “тепловой эффект”, “термохимическое уравнение”, выделение и поглощение энергии.
Задачи:
Образовательная: Сформировать понятие об экзо- и эндотермических реакциях, тепловом эффекте химической реакции, термохимическом уравнении. Научиться составлять термохимические уравнения и производить расчеты теплоты по уравнению реакции.
Развивающая: Развитие логического мышления и умений сравнивать, обобщать, анализировать , наблюдать, анализировать природные явления и проводимый химический эксперимент.
Воспитательная: Воспитание интереса к предмету химия. Формирование у учащихся коммуникативных навыков, чувства товарищества и взаимопомощи, умения работать в парах.
Тип урока: Изучение материала
Ход урока:
I. Организационно-мотивационный этап
Приветствие учащихся.
II. Актуализация знаний учащихся
На столе зажженная свеча.
Зачитывается отрывок из стихотворения Б.Пастернака «Зимняя ночь»
Мело, мело по всей земле
Во все пределы.
Свеча горела на столе,
Свеча горела.
О каком явлении идет речь в этом стихотворении? О горении свечи. А горение свечи это какое явление физическое или химическое? Правильно, химическое. А как иначе называются химические явления? Верно, химическими реакциями. Опишите признаки наблюдаемой реакции. Выделение света и тепла. А все ли реакции сопровождаются выделением тепла и света?
Давайте проведем химический эксперимент и найдем ответ на поставленный вопрос.
III. Объяснение нового материала
Приступим к выполнению эксперимента:
Демонстрация:
Опыт 1. Взаимодействие основания с кислотой.
В пробирку с основанием осторожно приливаем раствор кислоты HCl, что наблюдаете? (термометр)
Давайте запишем уравнение данной реакции и укажем ее признаки.
NaOH+H2SO4=Na2SO4+H2O+ Q
Признаками проводимой реакции будут выделение газа и теплоты.
Опыт 2. Растворение хлорида аммония в воде
В пробирку с белым кристаллическим веществом прилейте имеющуюся воду, встряхните. (термометр)
NH4Cl + H2O ⇄ NH4OH + HCl – Q
Признаком проводимой реакции будет поглощение теплоты.
Мы провели с вами 2 реакции, по какому признаку можно их классифицировать ?
Правильно, по поглощению или по выделению теплоты.
Тема сегодняшнего урока. Тепловой эффект химической реакции.
Количество теплоты, которое выделяется или поглощается при химической реакции, называют тепловым эффектом реакции.
Тепловой эффект обозначается Q и измеряется в Дж или кДж.
Давайте запишем классификацию химических реакций по тепловому эффекту.
Реакции, протекающие с выделение теплоты, называют экзотермическими.
Реакции, протекающие с поглощением теплоты, называют эндотермическими.
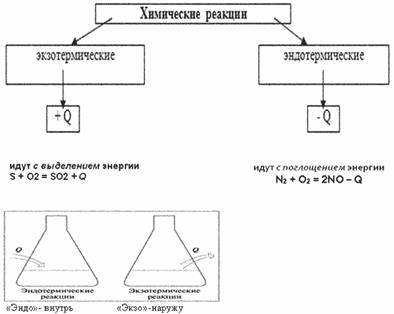
Химические уравнения, в которых указывается тепловой эффект, называют термохимическими.
Например: 2HgO —> 2Hg + O2 – 180 кДж, С(тв) + O2(г) —> СO2(г) + 394 кДж
Раздел химии, в задачу которого входит определение и изучение тепловых эффектов реакции называется Термохимией.
4. По термохимическим уравнениям реакций можно проводить различные расчёты. Для решения задач по термохимическим уравнениям реакций нужно записать само уравнение и провести необходимые расчеты по нему.
Алгоритм решения задач по термохимическому уравнению реакции
1.Кратко записать условия задачи (“дано”).
2.Записать термохимическое уравнение реакции (ТХУ), одной чертой в уравнении реакции подчеркивают то, что известно, двумя чертами подчёркивают то, что необходимо определить.
3.Провести вспомогательные вычисления. m=M* v
3.Составить пропорцию, используя вспомогательные вычисления и условия задачи, и решить ее.
4.Записать ответ.
Объяснение решения задач:
1. Вычислите массу разложившегося мела (СаСО3), если известно, что на его разложение затрачено 1570 кДж.
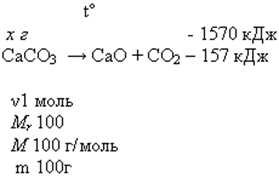
Мr (СаСО3) = Аr(Са) + Аr(С) + Аr(О) 3 = 40 + 12 + 16 3 = 100
Мr = Мr m = v * М
M(СаСО3) = 1 моль* 100 г/моль = 100г
100г СаСО3 - 157 кДж -
х г СаСО3 - 1570 кДж
100г : 157 кДж = х г : 1570 кДж
х = 1000г СаСО3
Ответ: m (СаСО3) = 1 кг (или разложилось 1000г мела)
IV.Закрепление:
Задача № 1 По термохимическому уравнению реакции Н2 + СI2 = 2HCI + 184 кДж определите, сколько теплоты выделится при сгорании 4 граммов водорода в хлоре. ( Ответ: 368 кДж)
Задача № 2 При сжигании 48 граммов метана выделилось 2676 кДж теплоты. Найдите тепловой эффект
реакции ( Q ). Уравнение реакции:СН4 + 2О2 = СО2 + 2Н2О + Q ( Ответ: 892 кДж)
Задача № 3 Найти тепловой эффект реакции, если при сгорании 3,5 граммов азота поглотилось 45,2 кДж теплоты. При сгорании азота образуется оксид азота ( II) – NO ( Ответ: 361,6 кДж)
V.Рефлексия: Рефлексия
(подведение итогов занятия)
Беседа:
― С реакциями, какого типа мы познакомились на уроке?
― Чем экзотермические реакции отличаются от эндотермических?
― Что такое тепловой эффект реакции?
― Какие данные нужно обязательно указывать при составлении
термохимических уравнений?
― Приведите примеры экзо- и эндотермических реакций.
Приём «Личный результат»
Я знаю… Я умею…. Я затрудняюсь….. Мне было….
VI. Домашнее задание: §
|
№ воп-роса |
1 вариант |
№ воп-роса |
2 вариант |
|
1 |
1. Что доказал А.Лавуазье своими опытами в 1774г.? |
1 |
Наличие каких 5 простых веществ составе воздуха было доказано в конце 19 в.? |
|
2 |
2. Каково содержание азота в воздухе по объему и по массе? |
2 |
Каково содержание кислорода в воздухе по объему и по массе? |
|
3 |
3. Напишите уравнение реакции горения С3Н6 |
3 |
Напишите уравнение реакции горения С2Н6 |
|
4 |
4. Назовите 2 условия прекращения горения |
4 |
Назовите 2 условия возникновения горения |
|
5 |
Почему рекомендуют выходить из зоны горения пригнувшись, или даже ползком? |
5 |
Почему нельзя открывать окна и двери при пожаре? |
|
6 |
Перечислите 3 вида твердого топлива |
6 |
Перечислите 3 вида жидкого топлива |
Тест по теме «Воздух. Горение»
Тест по теме: «Воздух»
Выберите один правильный ответ
1. Воздух это –
А) вещество, которое одновременно может находиться в разных состояниях: жидком, твёрдом и газообразном
Б) смесь газов, пыли и пара В) любое вещество природы.
2. В состав воздуха входит
А) водород и кислород Б) углекислый газ, азот и кислород
В) азот, кислород, углекислый газ и различные примеси.
3. Для горения и дыхания необходим
А) азот Б) кислород В) углекислый газ
4. При спуске к поверхности Земли температура воздуха
А) увеличивается Б) уменьшается В) не изменяется
5. Простейшие свойства воздуха:
А) белый цвет, без запаха и вкуса Б) бесцветный, нет запаха и имеет вкус
В) бесцветный, нет запаха и вкуса
6. Где больше всего кислорода?
А) над городом Б) над озером В) над лесом
7. Воздух обладает
А) твердостью и упругостью Б) сжимаемостью и упругостью
В) только упругостью
Воздух. Кислород. Горение».
1-вариант
1. Является окислительным процессом:
а) дыхание; в) взаимодействие СuО и Н2; с) горение; д) гниение.
2. Коэффициентами уравнения ... Li + ... O2 = ... Li2O являются:
а) 4, 0, 2; в) 4, 1, 2; с) 2, 1, 2; д) 4, 1, 2.
3. Когда кислород собирают способом вытеснения воздуха, то сосуд держат:
а) произвольно; в) вверх дном; с) вниз дном; д) горизонтально.
4. Формула оксида азота(II):
а) N2O; в) NO; с) N2O5; д) NO2.
5. Речь идет о простом веществе кислород:
а) кислород входит в состав оксидов;
в) в молекуле оксида фосфора(V) содержится пять атомов кислорода;
с) кислород поддерживает горение;
д) в земной коре содержится 49% кислорода.
6. Является реакцией горения:
а) СuО + Н2 = Сu + Н2О; в) Zn + 2HCl = ZnCl2 + H2; с) Zn + S = ZnS; д) 4Р + 5О2 = 2Р2О5
7. Воздух – это:
а) газ; в) смесь газов; с) азот и кислород; д) смесь газов, водяного пара и пыли.
8. Какой посуде хранят газообразного кислорода
А) в обыкновенной стеклянной посуде В) в пластмассовой посуде С) Сосуд Дьюара Д) Стальной баллоне
9. Аллотропной модификацией кислорода является:
а) азот; в) озон; с) сера; д) водород.
10. Из веществ, названия и формулы которых приведены, к числу простых относится:
а) кислород О2; в) оксид азота (II) NO; с) оксид алюминия Аl2О3; д) оксид серы (IV) SO2.
11. Защищает растения и живые организмы от ультрафиолетовых лучей
А) озон В) кислород С) атмосферный воздух Д) азот
«Воздух. Кислород. Горение» 2 вариант
1. Взаимодействие металла с кислородом приводит к образованию:
A) кислотного оксида B) бескислородной кислоты C) гидрида металла D) основного оксида
2.Формула оксида хрома(VI):
а) CrO6; в) СrO; с) Cr2O3; д) CrO3
3. Основное сырье для получения кислорода:
а) вода; в) КМnО4; с) воздух; д) КСlO3.
4. Относительная атомная масса кислорода:
а) 16 в)32 с) 12 д) 14
5. Кислород обладает следующими свойствами:
а) легче воздуха, в) плохо растворим в воде, с) поддерживает дыхание, д) не поддерживает горение.
6. Кислород выделяется в результате процесса:
а) брожения фруктовых соков в) гниения отмерших частей растений
с) фотосинтеза д) дыхания человека и животных
7. Название химическому элементу кислороду дал:
а) Дальтон, в) Лавуазье, с) Шееле д) Д.И. Менделеев
8. Кислород в лаборатории можно собрать методом:
а) вытеснения воздуха, в) методом вытеснения воды,
с) обоими перечисленными методами, д) ни одним из этих методов.
9. Бесцветный газ, не имеющий вкуса и запаха:
А) озон В) кислород С) водород Д) углерод
10.Образуется под влиянием электрических разрядов, молний и окисления древесных смол сосновых деревьев:
А) кислород В) водород С) углерод С) озон
11. В составе воздуха по объему больше
А) азота В) кислорода С) углекислого газа С) водорода
«Воздух. Кислород. Горение» 3- вариант
1. Кислороду не соответствует свойство:
A) мало растворим в воде B) поддерживает дыхание C) бесцветный газ D) легче воздуха
2. В атмосфере кислорода приблизительно:
а) 16% в) 8% с)21% д) 7%
3. Газ голубоватого цвета, обладающий характерным запахом:
А) озон В) кислород С) водород Д) углерод
4. Кислород впервые экспериментальным способом был получен :
А) Д.М. Менделеевым В) А. Лавуазье С) А. Авогадро Д) К. Шееле и Дж. Пристли
5. Вещества которые ускоряют химические реакции, но сами не участвуют в них остаются без изменения называются:
А) катализаторами В) индикаторами С) ферментами Д) реактивами
6. В лаборатории кислород получают:
А) перегонкой жидкого газа В) фотосинтеза С) из перманганата калия Д) из серной кислоты
7. Напишите взаимодействие фосфора с кислородом
A) C + O2= CO2 B) S + O2= SO2 C) 4 P + 5O2= 2P2 O5 D)3 Fe + 2O2 = Fe 3O4
8. В процессе фотосинтеза в атмосферу выделяется
А) водород В) углекислый газ С) кислород Д) азот
9. Коэффициентами уравнения …Zn+ …O= …ZnO являются:
А)3,2,1 В) 2,1,2 С) 2,2,1 Д) 4,1,2
10. В промышленности кислород получают:
А) перегонкой жидкого газа В) фотосинтеза С) из перманганата калия Д) из серной кислоты
11. Какой посуде хранят жидкий кислород
А) в обыкновенной стеклянной посуде В) в пластмассовой посуде С) Сосуд Дьюара Д) Стальной баллоне
«Воздух. Кислород. Горение» 4 – вариант
1.В организме человека содержится кислорода:
А) 65% В)2,4% С)24% Д)7,4%
2. Газ необходимый для дыхания живых организмов:
А) углекислый В) азотный С) кислород Д) Водород
3. Взаимодействие вещества с кислородом называется реакцией:
А) расщепления В) разложения С) окисления Д) соединения
4. Аллотропным видоизменением кислорода является;
А) озон В) углекислый газ С) водород Д) углерод
5.При какой температуре кислород переходит в твердое состояние
А) -2180С В) -200 0С С) -1180С Д) -1830С
6. В чистом воздухе меньше всего по объему газа
A) Кислорода. B) Аргона. C) Углекислого газа D) Азота.
7. Впервые состав воздуха установил
А) Д. И. Менделеев В) А. Лавуазье С) А. Авогадро Д) К. Шееле
8. Напишите взаимодействие углерода с кислородом
A) C + O2= CO2 B) S + O2= SO2 C) 4 P + 5O2= 2P2 O5 D)3 Fe + 2O2 = Fe 3O4
9. Газ который 1,5 раза тяжелее кислорода:
А)азот В)водород С)гелий Д)озон
10. Процесс горения возникает только при нагревании вещества до определенной температуры, которая называется:
А) удельной теплотой сгорания В) температурой плавления
С) температурой воспламенения Д) температурой сгорания
11. Кислород собирают способом вытеснения:
а) воздуха, держа сосуд вверх дном; в) воздуха, держа сосуд горизонтально;
с) воды, держа сосуд вниз дном; д) воздуха, держа сосуд вниз дном
Самоанализ урока химии по теме
На уроке использованы элементы ФГОС, что способствовало осознанному восприятию учащимися темы урока.
Взаимное приветствие учителя и учеников на этапе организации создало доброжелательную атмосферу. Чтение отрывка из стихотворения Б.Пастернака показало, что литературный символ (горящая свеча) может стать предметом для «химического» разговора.
Определение темы и целеполагание на данном уроке не только настроило на рабочий лад, но и создало ситуацию прогнозирования познавательной деятельности.
Метод химического эксперимента позволил наглядно продемонстрировать результаты термохимических реакций. Решение проблемного вопроса было наглядно и доказательно.
Теоретические сведения были введены в процессе экспериментальной работы. Микроитог урока подведён с помощью самостоятельного формулирования учащимися основных вопросов темы.
Мною был дан образец решения задачи, связанной с термохимическим уравнением для данной реакции. Мини-тестирование, проведённое на следующем этапе, позволило подвести промежуточные итоги с помощью самопроверки.
Самооценка и взаимооценка – важные этапы урока, так как позволяют учащимся оценить собственную учебную деятельность и присмотреться к одноклассникам с точки зрения их обучаемости.
Рефлексия – мощный мотивирующий метод, задачами которого является формирование умения посмотреть на себя «вглубь» и взглянуть «вдаль» - на перспективу.
Знания, полученные учениками на этом уроке, рассчитаны на долгосрочную перспективу. Большинство химических реакций являются термохимическими, поэтому данные знания будут использоваться на протяжении всего курса изучения химии. Кроме того, коммуникативные навыки, приёмы и методы познавательной деятельности на уроке являются важными составляющими учебно-воспитательного процесса.
В целом школьники показали хороший уровень самостоятельного мышления, высокую познавательную активность, хороший уровень усвоения и использования материала. Это значит, что цели урока достигнуты.
Урок начинается с мотивация учебной деятельности, целью этапа является: развитие познавательного интереса, интереса к изучению химии, с помощью проблемного метода.
На уроке Хадижат Ахмедовна использовала следующие приемы: интонационное выделение логически важных моментов изложения; повторное, более краткое предъявление учащимся готового знания; подробное резюмирование каждого отдельного законченного этапа изложения; сопровождение обобщенных выводов с приведением конкретных примеров; предъявление учащимся переформулированных вопросов, облегчающих понимание их смысла; инструктаж учащихся по составлению (заполнению) таблиц; членение излагаемого учителем материала на развивающие смысловые моменты.
Применение компьютерной техники на данном уроке было обоснованным, так как дало возможность:
-разнообразить задания для активизации знаний обучающихся;
-активизировать работу на уроке в целом;
-использовать яркую и красочную наглядность;
-увеличить темп и плотность урока.
При изучении нового материала были выбраны методы объяснительно- иллюстративный, словесный и частично – поисковый. Знания не давались в готовом виде. На этом этапе был проведен эксперимент с веществами, которые окружают нас в повседневной жизни. Для того, чтобы приблизить химию к жизни, Хадижат Ахмедовна намерено брала вещества такие, как карбонат натрия, дрожжи, что привело к достижению цели данного этапа. На данном этапе при выполнении практической работы учащиеся были активными, с интересом наблюдали за проведением химического эксперимента, делали выводы, наблюдали, обобщали, сравнивали. На уроке была использована проблемная ситуация, которая способствовала повышению познавательного интереса при изучении новой темы.
Между этапами урока прослеживается логическая связь, по всем этапам урока были подведены промежуточные итоги.
Все время на уроке использовалось рационально. На каждый этап было отведено оптимальное для данной работы время.
В течении всего урока обеспечивалась высокая работоспособность учащихся. Это стало возможным благодаря частой смене деятельности учащихся и разными видами предлагаемых заданий.
Доброжелательная атмосфера урока поддерживалась за счет культуры общения с учащимися, а также эмоционального настроя в начале урока.
При закреплении знаний учащимся были предложены вопросы на выявление степени усвоения нового материала.
На уроке четко был виден деятельностный подход, так как большую часть урока ученики работали самостоятельно и осознанно, что позволило успешно реализовать цели урока. В течении урока шла активизация учебной и познавательной деятельности обучающихся. Этому способствовали такие методы: словесный, практический, иллюстративный, метод самостоятельной работы. Была создана ситуация успеха через формирование ответственного отношения к учению.
Характер домашнего задания, полученного учащимися, позволяет закрепить новые знания, активизировать их. Домашнее задание обеспечило целостность и завершенность всего урока.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.