
O’ZBEKISTON RESPUBLIKASI OLIY VA O’RTA MAXSUS TA’LIM VAZIRLIGI
SAMARQAND IQTISODIYOT VA SERVISE INSTITUTI
“SERVISE” FAKULTETI
“SERVIS” KAFEDRASI
Маvzu: Oqsillar denaturyatsiyasi va uning ovqatlanish mahsulotlarini ishlab chiqarishdagi ahamiyati
|
Bajardi: “Servis” fakulteti, “Servis” ta’lim yo’nalishi, 3-kurs XC – 119 guruhi talabasi Habibullayev Bunyodxon |
|
Ilmiy rahbar: “Servis” kafedrasi o’qituvchisi Suvonov.Z |
KURS ISHI
SAMARQAND-2021
Reja
Kirish
1. Oqsillar turlari, tuzilishi va fiziologik ahamiyati
2. Oqsillar denaturatsiyasi
3. Oqsillar denatursining restoran taomlarini ishlab chiqarishdagi ahamiyati
4. Oqsillar gidradlanishi va degidratlanishi
Xulosa va takliflar
Foydalanilgan adabiyotlar
KIRISH
Kurs ishi mavzusining dolzarbligi: Oqsillarning tirik tabiatdagi muhim ahamiyatini hisobga olib, shuningdek, oqsillarning tirik organizm massasining yarmini tashkil etishi va qator ajoyib xususiyatlarga ega bo‘lishi, oqsil strukturasi va funksiyasini tushunish, biologiya va tibbiyot uchun muhim muammolarni yechishda asos bo‘lishi, tibbiyot institutlarida biokimyo kursini o‘rganishni – shu sinf, organik moddalardan boshlashni taqozo etadi. Tirik organizmlar uchun xos bo‘lgan turli-tuman va juda ko‘p funksiyalarni oqsillar bajaradi, biz ularning ba’zilari bilan kursni o‘rganish davomida tanishamiz.
Hozirgi kunda ovqatlanish shahobchalarida har bir ovqatni tayyorlanishiga e’tibor qaratimoqda shu jumladan oqsil darajasi ham juda muhum sanaladi shu sababli ekespertlar har bir ovqat uchun meyor darajasida oqsil berilgan.
Restoranlarda ham hozirgi kunda aynan shunday talablarga rioya qilgan holda ovqatlar tayyorlanmoqda. Oqsil ko’rsatkichi har bir mamlakatda har xil masalan koreyada bizga qaraganda 2 barobar kam shu yo’sinda boshqa davlatlar ham o’z urf – odatlariga mos holda bo’ladi.
Kurs ishi maqsadi va vazifalari: Bu kurs ishidan ko’zlangan asosiy maqsad bu Oqsillar denaturatsiyasini amaliy jihatdan o’rganish va uni amaiyotga tadbiq etishdir bunda quydagi vazifalar bajariladi:
![]() Oqsillarning tarkibini aniqlash
Oqsillarning tarkibini aniqlash
![]() Oqsil denotsidining parchalanish uchun
muhumliligini tahlil qilish kerak
Oqsil denotsidining parchalanish uchun
muhumliligini tahlil qilish kerak
![]() Restaoranarda ovqat tatyyorlash bosqichida oqsil
genotsidining
Restaoranarda ovqat tatyyorlash bosqichida oqsil
genotsidining
Kurs ishi predmeti: Restoranlarda ovqat tayyorlash jarayonida oqsil denotsidining o’rnini aniqlash va uni amaliy jihatdan o’rganib chiqishdir.
Kurs ishining tarkibiy tuzilishi: Kirish, 4ta reja, xulosa va takliflar, foydalanilgan adabiyotlar ro’yxati va ilovalardan iborat.
1. Oqsillar turlari, tuzilishi va fiziologik ahamiyati
Oqsillarning tirik tabiatdagi muhim ahamiyatini hisobga olib, shuningdek, oqsillarning tirik organizm massasining yarmini tashkil etishi va qator ajoyib xususiyatlarga ega bo‘lishi, oqsil strukturasi va funksiyasini tushunish, biologiya va tibbiyot uchun muhim muammolarni yechishda asos bo‘lishi, tibbiyot institutlarida biokimyo kursini o‘rganishni – shu sinf, organik moddalardan boshlashni taqozo etadi. Tirik organizmlar uchun xos bo‘lgan turli-tuman va juda ko‘p funksiyalarni oqsillar bajaradi, biz ularning ba’zilari bilan kursni o‘rganish davomida tanishamiz.
Shved kimyog‘ari I.Ya.Berselius 1938-yilda azot saqlovchi organik birikmalarni o‘simlik va hayvon to‘qimalaridan ajratib olib, uni proteinlar deb nomlagan (grekcha protos – birlamchi, muhim demakdir). Hozirgi tibbiyot adabiyotlarida azot saqlovchi yuqori molekulli birikmalarni oqsillar deyiladi. Oqsil termini – tuxum oqsilini qizdirilganda oq rang hosil bo‘lishiga asoslangan. Oqsillar har qanday tirik organizm to‘qimasining asosiy qismi hisoblanib, to‘qimada bo‘ladigan turli jarayonlarda muhim ahamiyatga ega. Oqsillar tirik organizmlar ham strukturasi, ham funksiyasining asosini tashkil etadi.
Molekulyarbiologiya asoschilaridan bo‘lgan F.Krikning ta’biri bo‘yicha, oqsillar juda muhim moddalar bo‘lib, turli funksiyalarni juda yengil va nozik bajarishlari mumkin. Tabiatda taxminan 1010-1012 turli oqsillar bo‘lib, 106 turli tirik organizmlar, viruslardan boshlab odamgacha, faoliyatini ta’minlab beradi. Bugungi kunda, ko‘p sondagi tabiiy oqsillardan juda kam qismining tuzilishi va strukturasi aniqdir. Har bir organizm o‘ziga xos oqsillar to‘plami bilan xarakterlanadi. Fenotipik belgilar va funksiyalarning turli-tumanligi bu oqsillarning spetsifikligi, ko‘pchilik holda multimolekulyar strukturaga ega bo‘lishi bilan belgilanadi. biologiya asoschilaridan bo‘lgan F.Krikning ta’biri bo‘yicha, oqsillar juda muhim moddalar bo‘lib, turli funksiyalarni juda yengil va nozik bajarishlari mumkin. Tabiatda taxminan 1010-1012 turli oqsillar bo‘lib, 106 turli tirik organizmlar, viruslardan boshlab odamgacha, faoliyatini ta’minlab beradi. Bugungi kunda, ko‘p sondagi tabiiy oqsillardan juda kam qismining tuzilishi va strukturasi aniqdir. Har bir organizm o‘ziga xos oqsillar to‘plami bilan xarakterlanadi. Fenotipik belgilar va funksiyalarning turli-tumanligi bu oqsillarning spetsifikligi, ko‘pchilik holda multimolekulyar strukturaga ega bo‘lishi bilan belgilanadi.
E.coli hujayrasida 3000 ga yaqin, odam organizmida esa 100000 dan ortiq turli xil oqsillar mavjuddir. Barcha tabiiy oqsillar ko‘p bo‘lmagan oddiy struktur bloklardan tashkil topgan bo‘lib, monomer molekulalar aminokislotalardan iboratdir. Aminokislotalar polipeptid zanjirda bir-biri bilan bog‘langan. Tabiiy oqsillar 20 xil aminokislotalardan tashkil topgan. Bu aminokislotalar turli ketma-ketliklarda bog‘lanishlari mumkin. Shuning uchun ular, juda ko‘p miqdordagi, turli-tuman oqsillarni hosil qiladilar. Ko‘rsatilgan sondagi aminokislotalarni polipeptidda turlicha joylashtirish orqali har xil izomerlarni hosil qilish mumkin. Agar 2 ta aminokislotadan faqat 2 izomer hosil qilish mumkin bo‘lsa, 4 aminokislotadan, nazariy jihatdan, 24 izomer hosil qilish mumkin. DNK molekulasida nukleotidlarning ketma-ket joylashishi sintezlanayotgan oqsil polipeptid zanjiridagi aminokislota qoldiqlarining ketma-ketligini belgilaydi. Hosil bo‘lgan polipeptid zanjiri funksional axborotga ega bo‘lib, unga mos ravishda o‘z-o‘zidan stabil uchlamchi strukturaga ega bo‘ladi.
Oqsil inson organizmi massasining 25% gacha, quritilgandan keyin esa 45-50% ni tashkil qiladi. Oqsillarning turli a’zo va to‘qimalardagi miqdori turlicha bo‘ladi (1-jadval). Oqsil inson va hayvon organizmlarida quyidagi vazifalarni bajaradi:
1. Strukturali funksiya – barcha to‘qimalar, hujayralar va organoidlar oqsildan tashkil topgan. Bu yerda fibrillar oqsillar (kollagen, keratin, elastin va boshqalar) muhim vazifani bajaradi.
2. Katalitik funksiya – organizmdagi biokatalizatorlar – fermentlar oqsil tabiatiga ega va barcha biokimyoviy reaksiya sodir bo‘lishini boshqaradilar, ya’ni reaksiyalar tezligini ma’lum tartibda borishiga va boshqarilishiga imkon beradi.
3. Energetik funksiya – oqsillar oshqozon ichak traktida parchalanib, oddiy aminokislotalar shaklida so‘riladi. Aminokislotalarning ma’lum qismi oksidlanib energiya hosil qiladi.
4. Transport vazifasi. Oqsillar suvda, qonda yaxshi eriydigan xususiyatga ega va suvda, qonda erimaydigan moddalar bilan kompleks hosil qilib ularning eruvchanligini, tashilishini ta’minlaydi. Masalan: qon plazmasi oqsili albumin yog‘ kislotalar, lipidlar, boshqa oqsillar temir, mis, vitamin, gormonlarni nishon a’zolarga tashiydi.
5. Qisqaruv funksiyasi – mushak oqsillari tarkibiga kiruvchi aktin, miozin, troponinlar qisqaruv qobiliyatiga ega. Bu oqsillar muskullar tarkibiga kirib mexanik ish bajarishda qatnashadi. Qisqarish funksiyasi sitoskelet oqsillariga ham xosdir, ular hujayra hayot faoliyati jarayonlarini (mitoz jarayonida, xromosomalar ajralishida) ta’minlaydi.
6. Himoya funksiyasi. Organizmga tushgan begona oqsillar, viruslar, bakteriyalar toksinlari antigenlar deb hisoblanadi va ularga qarshi himoya oqsillar-antitelolar hosil bo‘lib antigenlar bilan birikib zararsizlantiradi. Qon plazmasidagi fibrinogen va trombin oqsillari qon ivishida ishtirok etib, organizmni turli jarohatlanish sodir bo‘lganda, qon yo‘qotishdan saqlaydi.
7. Tayanch vazifasini bajaradi. Teri, suyak, tirnoq, soch, pay, tog‘ay oqsillardan tashkil topgan bo‘lib, inson tanasida tayanch vazifasini bajaradi.
8. Boshqaruv vazifasi. Ba’zi boshqaruv moddalar – gormonlar oqsil tabiatiga ega. Masalan, insulin gormoni, yuqori biologik aktiv modda bo‘lib, modda almashinuvini boshqaruvida ishtirok etadi.
9. Irsiy vazifasi. Irsiy axborotni saqlovchi xromosomalar murakkab oqsillar nukleoproteidlardan iborat.
Oqsillarning elementar tarkibi quyidagicha: uglerod 50,6 – 54,5%, azot 15- 17%, kislorod 21,5 – 23,5%, vodorod 6,5 – 7,3%, oltingugurt – 0,5% ni tashkil qiladi. Oqsil molekulasida azot miqdori doimiy bo‘ladi va o‘rtacha 16%ni tashkil etadi. Bu elementlardan tashqari oz miqdorda fosfor temir, rux, mis, marganets, magniy va yod uchraydi. Azot miqdoridan foydalanib plazmadagi oqsil miqdori aniqlanadi. Oqsillar kislota, ishqor va ferment yordamida gidrolizlanganda aminokislotalar hosil bo‘ladi.
Oqsillar tarkibiga 20 xil aminokislotalar kiradi. Bu aminokislotalar L-qator α -aminokislotalar hisoblanadi. Oqsil molekulasidagi aminokislotalar quyidagi guruhlarga bo‘linadi:
1. Strukturasi bo‘yicha aminokislotalar 3 sinfga bo‘linadi: alifatik, aromatik va geterotsiklik.
2. Elektrokimyoviy xossalari bo‘yicha aminokislotalarni quyidagi uch sinfga bo‘lish mumkin: nordon, neytral va asosli xossaga ega bo‘lgan.
Zamonaviy ratsional aminokislota tasnifi radikallarning polyarligiga (R-guruhlar), ya’ni pHning fiziologik qiymatlarida suv bilan reaksiyaga kirish qobiliyatiga asoslangan (pH 7,0ga yaqin). Radikallarni saqlovchi aminokislotalarning 5 sinfi quyidagicha tafovut etiladi (2-jadval):
a) nopolyar (gidrofob); b) polyar (gidrofil);
d) aromatik (ko‘pincha nopolyar); e) manfiy zaryadlangan;
f) musbat zaryadlangan.
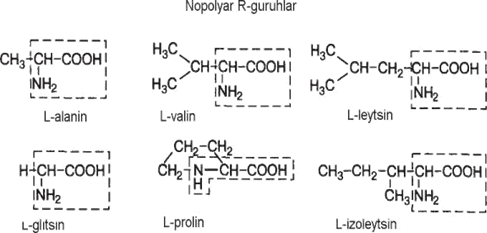

Oqsillarda sanab o‘tilgan aminokislotalar turli miqdorda va ketma-ketlikda uchraydilar. Vaholanki, ba’zi individual oqsillar bu aminokislotalarning barchasini saqlamasligi mumkin. Ba’zi oqsillarda ko‘rsatilgan aminokislotalardan tashqari ularning unumlari aniqlangan: oksiprolin, oksilizin, diyodtirozin, fosfoserin va fosfotreonin:
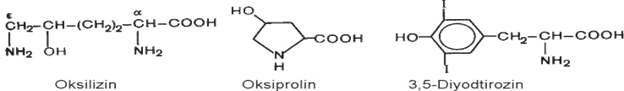
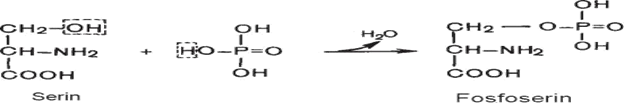
Oksilizin va oksiprolin biriktiruvchi to‘qima oqsili kollagenda, diyodtirozin esa qalqonsimon bez gormoni strukturasining asosi hisoblanadi. Mushak oqsili miozinda L-N-metillizin; protrombin tarkibida γ -karboksiglutamin kislota, glutationperoksidazada selenotsistein bo‘ladi:
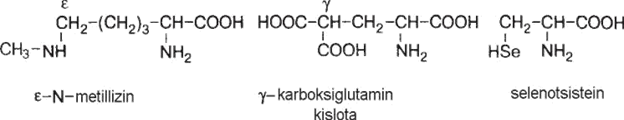
Qator α-aminokislotalar, oqsil tarkibiga kirmasa ham modda almashinuvida muhim vazifalarni bajaradilar, ularga ornitin, sitrullin, gomoserin, gomotsistein, dioksifenilalanin va boshqalar kiradi.
3. Biologik va fiziologik funksiyasi bo‘yicha aminokislotalar almashinadigan va almasha olmaydigan sinflarga bo‘linadi.
Almashib bo‘lmaydigan aminokislotalar inson tanasida boshqa moddalardan sintezlanmaydi. Ular asosan oziq-ovqat tarkibida qabul qilinadi. Bu sinfga quyidagi 8 ta aminokislota kiradi: valin, leytsin, treonin, lizin, metionin, izoleytsin, fenilalanin va triptofanlar.
Qisman almashadigan aminokislotalar inson tanasida kam miqdorda sintezlanadi. Shuning uchun, bu aminokislotalarni inson qisman oziq-ovqat orqali qabul qilib turishi lozim. Bu aminokislotalarga arginin, gistidinlar kiradi.
Almashinadigan aminokislotalar inson tanasida yetarli darajada uglevod va boshqa aminokislotalar metabolitlaridan sintezlanadi. Bu aminokislotalarsiz inson tanasida biokimyoviy jarayonlar uzoq vaqt buzilmaydi. Bularga glitsin, alanin, serin, sistein, prolin, sistin, asparagin va glutamin kislotalar kiradi. Aminokislotalar kimyoviy jihatdan amfoter elektrolitlar deyiladi. Suvda eriganda eritmada dipol va gidrat qobiq hosil qiladi.
Glitsindan boshqa hamma aminokislotalar optik faol moddalar bo‘lib, ular D, L-izomer holida uchraydi. Aminokislotalarning D va L izomerlari fazoviy izomer bo‘lgani sababli moddaning ko‘zgudagi ko‘rinishiga o‘xshash bo‘ladi.
D-qatordagi aminokislotalar oqsil tarkibida uchramaydi. Ular antibiotik va bakteriya tarkibidan topilgan.
Hozirgi paytda aniqlanishi bo‘yicha, barcha oqsillar molekulasida ayrim aminokislotalar ko‘p miqdorda uchraydi. Masalan, prota’minda 85% – arginin, fibrinda – 50% glitsin, kollagenda prolin, oksiprolin va lizinlar ko‘p miqdorda bo‘ladi. Biokimyoda aminokislota atamalarini qisqartirib birinchi uch harfi bilan yozish qabul qilingan. Masalan: ala, gli, tri, liz, gis va hokazo.
Oqsillarda o‘ziga xos bo‘lgan eritmalarning yuqori yopishqoqligi, kam diffuziya, bo‘kish qobiliyati, optik faolligi, elektr maydonida harakatlanishi, past osmotik bosim va yuqori onkotik bosim, 280 nmda nurlarni yutish kabi fizik-kimyoviy xususiyatlari mavjud.
Oqsillarda erkin NH2- va COOH-guruhlari bo‘lganligi sababli aminokislota kabi amfoterlik xususiyatiga egadirlar. Ular uchun kislota va asoslarning barcha xususiyatlari xosdir. Muhit pHi, kislota va asos tabiatiga ega bo‘lgan aminokislotalarning nisbatiga bog‘liq ravishda oqsillar eritmalarda manfiy yoki musbat zaryadga ega bo‘lib, anod yoki katodga qarab harakatlanadilar. Ularning bu xususiyatidan elektroforez usuli bilan oqsillarni ajratishda foydalaniladi. Shuningdek, oqsillarda gidrofil xususiyatlari ham mavjuddir.
Oqsillar yuqori molekulali biopolimerlar bo‘lib, molekulyar massasi 6 mingdan bir necha milliongacha bo‘lib, ular oqsil strukturasidagi polipeptid zanjirlarning soniga bog‘liq.
Oqsillarning massasi turli usullar bilan aniqlanadi. Masalan, ultratsentrafugirlash, gelfiltratsiya va elektroforez usullari. Ayrim oqsillarning molekulyar massasi quyidagicha daltonlarga teng bo‘ladi:
3-jadval
Ba’zi oqsillarning molekulyar massalari
|
Ribonuklaza |
13700 |
|
|
|
|
Mioglobin |
176600 |
|
|
|
|
Qon zardobi albumini |
69000 |
|
|
|
|
Qon zardobi globulini |
176000 |
|
|
|
|
Inson fibrinogeni |
450000 |
|
|
|
|
Aktomiozin |
5000000 |
|
Nukleoproteid TMV |
40000000 |
Massa birligi dalton (Da) vodorod atom massasiga to‘g‘ri keladi (1,0000). Massa birligi kilodalton (kDa) 1000 daltonga to‘g‘ri keladi. Ko‘pchilik oqsillarning massasi 10 dan 100 kilodaltonga tengdir.
Bir necha ming oqsillarning aminokislota tarkibi va ketma -ketligi aniqlangan. Shuning uchun, ularning molekulyar og‘irligini yuqori aniqlik bilan topish mumkin. Oqsillar molekulyar og‘irligini sedimentatsion analiz usuli bilan aniqlash ultratsentrifugalarda o‘tkaziladi, bunda 200000 dan ortiq, ya’ni yer tortish kuchidan yuqori markazdan qochuvchi tezlanishni (g) hosil qilish mumkin bo‘ladi. Odatda, molekulyar og‘irlikni oqsil molekulasining sedimentatsion tezligi yoki sedimentatsion muvozanati bo‘yicha hisoblab topadilar. Molekulalarning markazdan periferiyaga siljishi davrida erituvchi-oqsil o‘rtasida keskin chegara hosil bo‘ladi (avtomatik aniqlanadi). Erituvchi va oqsilning optik xususiyatlaridan sedimentatsiya tezligini aniqlashda foydalaniladi va u sedimentatsiya konstantasi S bilan belgilanadi, oqsil zarrachasining massasi va shakliga bog‘liq:
V
S= ———,
ω2.r
bunda, V – erituvchi – oqsil chegarasining tezligi, sm/s; ω− rotorning burchak tezligi, rad/s; r – rotor markazidan oqsil eritmasi solingan yacheyka o‘rtasigacha bo‘lgan masofa (5 m).
Sedimentatsiya konstantasi shartli ravishda birlik deb qabul qilingan va Svedberg (S) deb nomlangan. Ko‘pchilik oqsillarning sedimentatsiya konstantasi 1-50 S oralig‘ida bo‘ladi, ba’zi hollarda bu qiymat 100S dan ortiq bo‘lishi mumkin.
Molekulyar og‘irlikni topish uchun sedimentatsiya konstantasidan tashqari svedberg tenglamasi uchun erituvchi va oqsilning zichligi haqida qo‘shimcha ma’lumotlar zarur:
R.T.s
M = —————,
D(1-υp)
Bunda R – gaz doimiyligi erg (mol.grad); T – absolyut harorat (Kelvin shkalasi bo‘yicha); s – sedimentatsiya konstantasi; p – eritma zichligi; υ– oqsil molekulasining parsial solishtirma hajmi; D –diffuziya koeffitsienti.
Ultratsentrifugalash usuli bilan oqsillar molekulyar og‘irligini aniqlash murakkab, ko‘p vaqt va qimmatbaho apparatlar talab etadi. Shuning uchun, keyingi yillarda, 2 ta oddiy usul ishlab chiqilgan (gelxromatografiya va elektroforez). Gel-xromatografiyadan foydalanganda birinchi navbatda kolonkani kalibrlash zarur. Buning uchun, sefadeksli kolonka orqali molekulyar og‘irligi ma’lum bo‘lgan bir necha oqsillar o‘tkaziladi va grafik chiziladi, bunda molekulyar og‘irlik logarifm ko‘rsatkichlari ularning elyutsion hajmlari to‘g‘risiga joylashtiriladi, ularni 1-rasmda ko‘rsatilganidek topiladi.

1-rasm. Elyutsia (Ve) hajmini o‘lchash
Ma’lumki, sferik shaklli oqsil molekulyar og‘irligining logarifmi va evolyutsion hajmi o‘rtasida to‘g‘ri bog‘lanish mavjud. Shuning uchun, tekshiriluvchi oqsil molekulyar og‘irligini aniqlash oson. Bu usulning ikkinchi turi bo‘lib yupqa qavatdagi gel-xromatografiya hisoblanadi. Sefadeksning yupqa qavati bo‘yicha oqsilning siljish uzunligi (mmlarda) oqsil molekulyar og‘irligiga logarifmik bog‘liqdir (2-rasm). Gel-xromatografiya soddaligi va tezligidan tashqari quyidagi qo‘shimcha afzalliklarga ega: oqsilni toza holda ajratishni talab etmaydi, chunki boshqa oqsillar aralashmasining aniqlashga ta’siri yo‘q. Negaki, ularning har biri kolonka orqali o‘ziga xos tezlik bilan molekulyar og‘irligiga bog‘liq ravishda o‘tadi. Bu holat enzimologiyada ko‘p qo‘llaniladi. Boshqa o‘xshash katalitik faollikga ega bo‘lmagan oqsillar bo‘lganda ham juda kam miqdorda bo‘lgan fermentlarning molekulyar og‘irligini aniqlash mumkin.
Oqsillar molekulyar og‘izligini disk-elektroforezda poliakrilamid geldan foydalanib aniqlanganda, kalibrlangan oqsillar molekulyar og‘irligi logarifmi va poliakrilamidda oqsil zarrachalari harakatlanishiga bog‘liq bo‘lgan grafik chiziladi, so‘ngra tekshiriluvchi oqsil haraktlanishini aniqlab, grafikdan uning molekulyar og‘irligi topiladi.

2-rasm. G-150 sefadeksi yupqa qavatida gel-xromosomalari qochish masofasi va ular molekulyar og‘irligi o‘rtasidagi bog‘liqlik. 1-ribonukleaza; 2-ximotripsinogen; 3-tuxum albumini; 5-g-globin; x-noma’lum molekulyar og‘irlikli oqsil
Dodesilsulfat natriy detergenti ishtirokida elektroforez o‘tkaziladi, chunki bu holatda oqsil molekulyar og‘irligi va harakatchanligi o‘rtasida to‘g‘ri proporsionallik kuzatiladi. To‘rtlamchi strukturaga ega oqsillar bu sharoitda subbirliklarga parchalanadi. Shuning uchun, bu usul oqsil subbirliklari molekulyar og‘irligini aniqlash uchun keng qo‘llanilmoqda.
Yaqinda yangi mass-spektrometrik usul (lazer desorbsion-ionizatsion usul) taklif etilgan; u katta bo‘lmagan peptid (vazopressin, insulin) va yirik biopolimer molekula va, undan tashqari, biomolekulalar strukturasini aniqlashga imkon beradi.
Oqsil molekulalarining shakli ultratsentrifugalash, rentgenstruktur analiz asosida yoki elektron mikrosko‘pda aniqlanadi. Tahlillar shuni ko‘rsatdiki, oqsil molekulalari har uch o‘lchami bo‘yicha assimetrik moddalardir.
Tabiiy oqsillar molekulasining shakliga qarab 2 guruhga bo‘linadi: globulyar va fibrillyar. Fibrillyar oqsillarning molekulasi ipsimon bo‘lib, uzunligi diametriga nisbatan 100 marta ko‘proqdir.
Globulyar oqsil molekulasi sferik shaklga ega bo‘lib, uning uzunligi diametriga qaraganda 3-10 marta ortiqdir. Masalan: elastin oqsil molekulasining diametri 70 nm bo‘lib oval shaklda, gemoglobin oqsilini diametri 220 nm bo‘lib ozgina cho‘zinchoq shaklda, miozin molekulasining diametri 100 nm bo‘lib, uzunligi ming angstremga teng. Shunday qilib, miozin oqsili tolasimon bo‘ladi.
Fibrillyar va globulyar oqsillarining xossasi xar xil bo‘ladi. Ayrimlari suvda va tuz eritmalarida eriydi. Ko‘pchilik fibrillyar oqsillar suvda erimaydi. Fibrillyar oqsillarga – miozin, ipak, fibrinogen, kollagen va elastinlar kiradi.
Oqsillar optik faol moddalar bo‘lgani uchun, ular qutblangan nur sathini ma’lum burchak hosil qilib buradi. Oqsil eritmalari yorug‘lik nurini sindirish, tarqatish, ultrabinafsha nurlarini yutish qobiliyatiga ega. Oqsillarning bu fizik xossasidan foydalanib ularning miqdorini, molekulyar massasini va boshqa ko‘rsatkichlarini aniqlash mumkin. Oqsillarning molekulyar massasi yuqori bo‘lganligi uchun eritilganda kolloid eritmalar hosil qiladi. Oqsillar suvda eriganda suvning qutbli molekulalarining oqsil zaryadiga qarama-qarshi joylashib suv qobiq‘i hosil qiladi. Oqsilning suvdagi zarrachalari diametri 0,001 mkm dan yuqori bo‘lgani uchun kolloid eritma hosil bo‘ladi va yorug‘lik sochish (Tindal effekti) xususiyatiga ega bo‘ladi. Oqsillar molekulasi hayvon va inson membranasining mayda teshiklari orqali o‘ta olmaydi.
Oqsillarning bu xossasidan foydalanib yarim o‘tkazgich membranalar yordamida ularni kichik molekulali moddalardan tozalash mumkin. Bu usul dializ deyiladi.
Gidrofil kolloidlarning eng muhim xususiyatlaridan biri gel hosil qilishdir. Kolloid zarrachalari o‘zaro yopishib to‘rsimon g‘ovak struktura hosil qiladi. Hosil bo‘lgan struktura bo‘shliqlariga suv molekulalari yig‘ilib oqsilni turli darajada bo‘ktirishi mumkin.
Oqsillarning molekulasida -NH2 va COOH- guruhlari borligi uchun amfoterlik xossasini namoyon qiladi. Oqsil molekulasida erkin karboksil guruhi kislotali, aminogruppa esa asosli xossasini namoyon qiladi. Uni quyidagicha ifodalash mumkin:
![]() COO –
COO –
R
NH3+
Oqsil molekulasining zaryadi tarkibidagi zaryadlangan aminokislotalarga bog‘liq. Monoaminomonokarbon aminokislotalar oqsil molekulasiga neytral zaryad belgilaydi. Aksincha, monoaminodikarbon aminokislotalar oqsil molekulasini manfiy zaryadlaydi. Diaminomonokarbon aminokislotalar oqsil molekulasini musbat zaryadlaydi.
Oqsil molekulasining zaryadi zaryadlangan guruhlarining yig‘indisi bilan belgilanadi. Bir vaqtda erkin manfiy va musbat zaryad saqlagan oqsillar amfoter xususiyatga ega.
Erkin karboksil guruhning dissotsiatsiyalanish darajasi aminogruppaga nisbatan ozgina yuqori bo‘lganligi uchun bu funksional guruhlarning miqdori teng bo‘lganda oqsil molekulasining zaryadi manfiy bo‘lishi mumkin. Eritmadagi vodorod ionlari konsentratsiyasini, ya’ni muhitning pH ko‘rsatkichini o‘zgartirish orqali oqsil molekulasidagi amino- va karboksil guruhlarning dissotsiatsiyalanishini kuchaytirish yoki pasaytirish mumkin.
Eritma pH ko‘rsatkichini o‘zgartirish yo‘li bilan oqsil molekulasining zaryadini nolga keltirish mumkin, bunda oqsillar elektr maydonida anod yoki katod tomon harakatlana olmaydi. Bu holat oqsilning izoelektrik nuqtasi deyiladi. Oqsil izoelektrik holatda bo‘lgan eritmaning pH ko‘rsatkichini shu oqsilning izoelektrik nuqtasi (IEN) deb ataladi. Oqsillar izoelektrik nuqtada eng beqaror holatda bo‘ladi. Turli ta’sirlar yordamida oqsillar eritmadan juda oson cho‘kmaga tushadi. Shu usul bilan turli biologik aralashmalardan oqsillarni toza holda ajratib olinadi. Ya’ni izoelektrik nuqtada oqsilni cho‘ktirish qulay hisoblanadi (4-jadval).
Rus olimi A.Ya.Danilevskiy va nemis bioximigi E.Fisher va boshqalar tomonidan oqsil molekulasidagi aminokislotalar o‘zaro peptid (-CO-NH-) bog‘i yordamida birikib polipeptid hosil qilishi aniqlangan. Shunga asosan ikki molekula aminokislotadan dipeptid hosil bo‘ladi.
Dipeptid molekulasidagi erkin amino- yoki karboksil guruhlari yana uchinchi aminokislota molekulasini biriktirib tripetid hosil bo‘ladi:
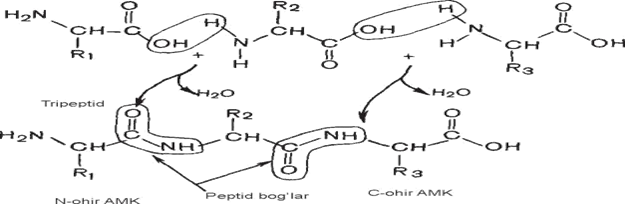
Tripeptidga yana bir molekula aminokislota birikib tetrapeptid, beshinchi aminokislota birikib pentapeptid hosil bo‘ladi. Shu yo‘l bilan geksapeptid va polipeptidlar hosil bo‘lishi mumkin.
Oqsil molekulasining tuzilishi to‘g‘risida juda ko‘p gipotezalar taklif qilingan. Bulardan ko‘pchilik biokimyog‘arlar polipeptid nazariyasini qabul qilganlar.
Polipeptid nazariyasi birinchi bo‘lib, 1902-yilda rus olimi A.YA. Danilevskiy va nemis olimi E. Fisher tomonidan yaratilgan. Bu nazariyaga binoan oqsil molekulasida aminokislotalarni o‘zaro peptid bog‘i yordamida birikib polipeptid zanjirni tashkil qiladi. Bu nazariyani isbotlash uchun E.Fisher va E.Abdergalden sintetik polipeptidlar tayyorlab ularni fizik-kimyoviy xossalarini o‘rgangan va sintetik polipeptidlar va oqsillar o‘rtasida o‘xshashlik borligini aniqlashgan.
Aminokislota qoldiqlarida erkin holda amin, karboksil, gidrooksil, fenol, amid va boshqa guruhlari mavjuddir. Shu sababli bu guruhlar polipeptid zanjirlarining fazoviy konfiguratsiyasiga (shakllanishiga) juda katta ta’sir ko‘rsatadi.
Hozirgi vaqtda oqsillarning to‘rt xil struktura darajasi borligi aniqlangan:
v Birlamchi strukturasi.
v Ikkilamchi strukturasi.
v Uchlamchi strukturasi.
v To‘rtlamchi strukturasi.
Oqsillarning birlamchi strukturasi
Oqsillarning birlamchi strukturasi deb, aminokislotalarni polipeptid zanjirida ketma-ket joylanish tartibiga aytiladi. Oqsilning birlamchi strukturasi aminokislotalarning sifat va miqdoriga bog‘liq bo‘ladi.
Birlamchi struktura asosini peptid bog‘lari tashkil etadi.
Peptid bog‘larining o‘ziga xos xususiyatlari bo‘lib, ya’ni ulardagi hamma atomlar bog‘larining bir tekislikdaligi bo‘ladi (3-rasm, a, b). Ular ikki xil shaklda, ya’ni keto- hamda yenol- shakllarida bo‘ladi.
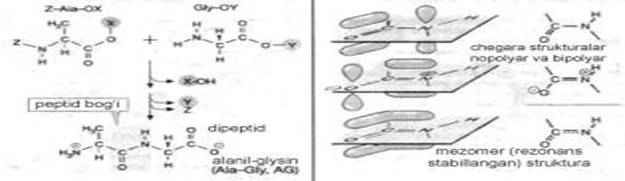
3-rasm. A. Peptid sintezi B.Peptid bog‘i mezomeriyasi
Undan tashqari aminokislotalar sis- va trans- izomer shaklda ham uchraydi. Fazoda aminokislotalar o‘zaro vodorod bog‘i hosil qilish xossasiga ega. Oqsil molekulasida polipeptid zanjirining -NH2 tutgan oxiriga N- oxiri va -COOH tutgan oxiriga esa C-oxiri deb ataladi.
N - oxirgi aminokislota qoldig‘ini Sanger va Edman usullari bo‘yicha oqsil dinitroftorbenzol (DNFB) bilan reaksiyaga kiritiladi. Bu reaktiv erkin holdagi aminoguruh bilan reaksiyaga kirishadi va DNF-oqsil birikmasini hosil qiladi.
Hosil bo‘lgan DNF-oqsil gidrolizlanganda N-oxirgi aminokislota qoldig‘i ajralib chiqadi. Shunday qilib, oqsilning birlamchi strukturasini o‘rganish mumkin.
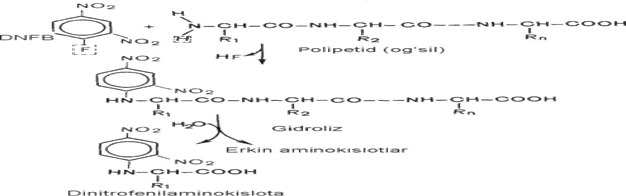
Edman usuli bo‘yicha oqsil fenilizotiotsionat reaktivi bilan reaksiyaga kiritiladi. Fenilizotiotsianat oqsilning N - oxirgi aminokislotasi bilan birikadi.
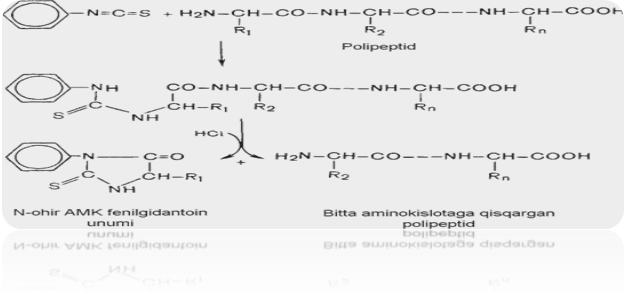
Hosil bo‘lgan birikmaga suvsiz HCl ta’sir ettirilsa oxirgi aminokislota feniltiogidantoinga aylanadi. Oqsil molekulasining qolgan qismi erkin holda ajralib chiqadi.
C-oxiri aminokislota qoldig‘ini aniqlashda yapon olimi Akabori tomonidan gidrazinoliz usuli taklif etilgan. Bu usul bo‘yicha oqsilga gidrazin ta’sir etib, hosil bo‘lgan birikmani dinitrobenzol bilan reaksiyaga kiritiladi.
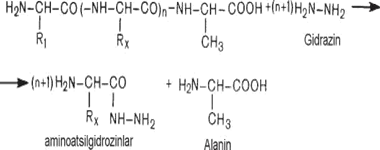
Hosil bo‘lgan aminokislota gidrozidi ikki molekula DNFB bilan va C-oxiri aminokislota esa bir molekula DNFB bilan birikadi.
DNF aminokislota gidrazidi DNF aminokislotadan sirka - etil-efir yordamida ekstraksiya qilib ajratib bo‘linadi. DNF-aminokislota xromatografik usul bilan aniqlanadi.
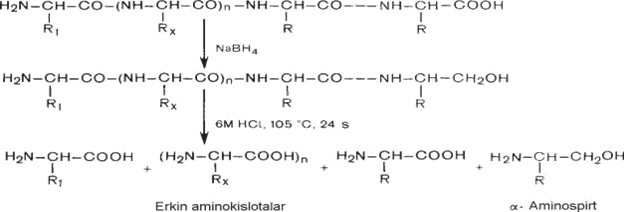
Oqsillardagi C-oxirgi aminokislotani karboksipeptidaza fermenti yordamida aniqlanadi. N- va C-oxirgi aminokislotalar aniqlangandan keyin ularning miqdoriga qarab oqsil molekulasi polipeptid zanjiridagi aminokislotalar soni aniqlanadi. Oqsil molekulasidagi polipeptid zanjiri yoyilgan hamda o‘ralgan holda bo‘ladi.
O‘ralgan polipeptid zanjirini ayrim qismlari o‘zaro disulfid (S-S) bog‘i yordamida bog‘lanadi (4-rasm). Masalan: ribonukleaza bitta polipeptid zanjirdan tashkil topgan oqsil bo‘lib, 4 joyidan disulfid bog‘lar orqali bog‘lanadi. Disulfid bog‘lar oksidlanish va qaytarish reaksiyasi yordamida isbotlanadi.

4-rasm. RNKazaning birlamchi strukturasi. Qora bilan disulfid bog‘lar ko‘rsatilgan
Disulfid bog‘lari uzilgandan keyin polipeptidlar qisman gidrolizlanadi. Bunda fermentlardan foydalaniladi. Proteolitik fermentlardan tripsin arginin yoki lizinning karboksil guruhi ishtirokida hosil qilgan peptid bog‘larini uzsa, pepsin aromatik (fenilalanin yoki tirozin) yoki monoaminodikarbon (aspartat va glutamat) kislotalar hosil qilgan peptid bog‘larni uzadi. Hosil bo‘lgan peptidlar aralashmasi ajratib alohida analiz qilinadi. Bunda xromatografiya yoki elektroforez usullaridan foydalaniladi.
Oqsillarning ikkilamchi strukturasi
Polipeptid zanjirining fazoviy konfiguratsiyasiga, α-spiral yoki β-strukturasini hosil qilishi, oqsillarni ikkilamchi strukturasi deyiladi.
Polipetid zanjirining hamma qismi bir xilda spirallangan bo‘lmay oz qismi to‘g‘ri amorf holda bo‘lishi mumkin. Oqsillarning ikkilamchi strukturasi polipeptid molekulasining fazodagi konfiguratsiyasini (joylashuvini) belgilaydi.
Oqsil molekulasining ikkilamchi strukturasi hosil bo‘lishida karbonil va imid guruhlari o‘rtasida vodorod bog‘lari hosil bo‘lishi ahamiyatlidir.
Vodorod bog‘lari kovalent bog‘lanishga nisbatan kuchsiz bo‘lib, ular sonining ko‘p bo‘lishi natijasida hosil bo‘lgan spiral prujinadek mustahkam saqlashga imkon beradi. Oqsilning ikkilamchi strukturasi ikki tipga bo‘linadi α−spiral, β−burmalik (qavat-qavat ko‘rinishida) struktura (5-6-rasm).

5-rasm. a-spiral stukturasi va o‘lchamlari
6-rasm. Polipeptid zanjir b-strukturasi
Polipeptid zanjir α-spiral va β-struktura ko‘rinishida bo‘lishini Poling va mualliflar rentgen struktura analizi yordamida aniqladilar. α-spiral o‘ng va chap tomonga buralgan holda bo‘lishi mumkin.
Polipeptid zanjirning α-spirallanishida har bir aylanishiga 3,6ta aminokislota qoldig‘i to‘g‘ri keladi. Spiral qismining to‘liq takrorlanishi 18 ta aminokislota qoldig‘idan keyin ro‘y beradi.
Ularning uzunligi 0,5 nm va 2,7 nmga teng va har bir aminokislota qoldig‘i to‘g‘ri keladigan masofa 0,15 nm ga teng. Oqsil molekulasining β-strukturasi polipeptid zanjiri yonma-yon joylanishi natijasida hosil bo‘ladi. Vodorod bog‘lari parallel yoki antiparallel holda joylashgan polipeptid zanjirining peptid bog‘lari o‘rtasida hosil bo‘ladi. Natijada polipeptid zanjirlari takrorlanib qavatma-qavat bo‘lib joylashadi. Oqsillarda alfa-strukturadan β-strukturaga o‘tishi mumkin va u holda vodorod bog‘lari qayta tuzilishi mumkin. Bu holat sochdagi keratin oqsilida kuzatilgan. Agar sochlarni ishqoriy eritmalar bilan yuvilganda oqsilning strukturasi buziladi. β-keratin alfa-keratinga aylanadi. Oqsilning ikkilamchi strukturasi (α-spiral va β-struktura) qizdirish natijasida buziladi. Bunda polipeptidlar o‘rtasidagi vodorod bog‘lari uzilib, polipeptid zanjiri esa tartibsiz holatga keladi.
Shunday qilib, oqsilning ikkilamchi strukturasining turg‘unligi vodorod bog‘lari yordamida ta’minlanadi. Bundan boshqa bog‘lar (disulfid bog‘idan tashqari) ishtirok etmaydi. Ko‘pchilik oqsillarda bir vaqtda α-spiral va β-strukturali qismlari bo‘ladi.
Oqsillarning biologik xususiyatlari (ferment, gormon, antitela, antigen va boshqalar) ularning ikkilamchi va uchlamchi strukturalariga bog‘liq bo‘lib, ular nativ konformatsiyasi deb ataladi. Oqsil molekulasining uchlamchi strukturasi funksional konformatsiyani saqlaydi, uni akad. V.A. Engelgard intramolekulyar axborot deb nomlagan.
Oqsillarning to‘rtlamchi strukturasi
Ba’zi oqsil molekulalari bir necha polipeptid zanjirdan iborat bo‘lib, ular subbirliklar yoki protomerlar deb nomlanadi. Har bir protomer o‘ziga xos birlamchi, ikkilamchi va uchlamchi strukturalariga ega.
 Protomerlar va ular qismlarining bir-biriga
nisbatan fazoda joylashuvi oqsil molekulasining to‘rtlamchi strukturasi deb
nomlanadi.Ayrim oqsillar to‘rtlamchi strukturasida
protomerlar globulyar ko‘rinishda bo‘ladi.
Protomerlar va ular qismlarining bir-biriga
nisbatan fazoda joylashuvi oqsil molekulasining to‘rtlamchi strukturasi deb
nomlanadi.Ayrim oqsillar to‘rtlamchi strukturasida
protomerlar globulyar ko‘rinishda bo‘ladi.
8-rasm. Gemoglobin modeli (Perutts bo‘ycha) α-zanjinlar;
β-zanjinlar qora
Masalan: gemoglobin oqsili molekulasida polipeptid spirallari vintsimon simmetrik holda birlashgan bo‘ladi (8-rasm).
To‘rtlamchi strukturaga gemoglobin, tamaki virusi oqsili, RNK-polimeraza, laktatdegidrogenaza, katalaza va boshqalar ega bo‘ladi. Demak, birgina polipeptid zanjiridan iborat bo‘lgan oqsil molekulasi to‘rtlamchi strukturaga ega bo‘la olmaydi.
To‘rtlamchi strukturaga ega bo‘lgan oqsil molekulasiga oligomer oqsil deyiladi. Masalan: gemoglobin molekulasi (M=64500) 4ta subbirlikdan yoki polipeptid zanjirlaridan tashkil topgan. Bu polipeptidlarning har biri birlamchi, ikkilamchi va uchlamchi strukturaga egadir.
To’rtta polipeptid zanjirining har ikkitasi bir xil birlamchi strukturaga ega, shuning uchun ikkita α va ikkita β -polipeptidlar gemoglobin molekulasini to’rtlamchi strukturasini hosil qiladi. α -polipeptid zanjirida 141, β−polipeptid zanjirida esa 146 ta aminokislotalar qoldig’i joylashgan. Gemoglobin oqsili globulyar konfiguratsiyada bo’ladi.
Turli subbirliklarni o‘zaro tutashib turishini aminokislotalar qoldiqlarini qutbli guruhlari ta’minlaydi. Qutbli guruhlar orasida ionli, vodorodli, ayrim vaqtlarda disulfidli bog‘lar hosil bo‘lib, subbirliklar o‘zaro mustahkam bog‘lanadi. Vodorod bog‘ini uzuvchi moddalar ta’sirida, disulfid bog‘larini qaytaruvchi moddalar ta’sirida protomerlar dezagregatsiyaga uchraydi va oqsilning to‘rtlamchi strukturasi buziladi. Oqsil multimerlari (oligomerlari) ko‘pincha juft sonli protomerlardan tuziladi. (2 dan 4 gacha oz miqdorda, 6 dan 8 gacha, 10, 12 gacha va hk.). Natijada massasi har xil bo‘lgan molekulalar hosil bo‘lib bir necha ming, hattoki 100000 Dga teng bo‘ladi.
To‘rtlamchi strukturaga ega bo‘lgan gemoglobin 4 subbirlikdan, piruvatdegidrogenaza kompleksi 72 subbirlikdan, RNK-polimeraza 5 subbirlikdan, LDG – 4 subbirlikdan iborat bo‘ladi.
Ikkilamchi, uchlamchi va to‘rtlamchi strukturalar birlashib makrostruktura yoki oqsillarning konformatsiyasi, oqsillarning fazoviy strukturasini tashkil etadi.
2. Oqsillar denaturatsiyasi
Oqsillarni tabiiy xossalarini (eruvchanlik, elektroforez harakati, fermentativ, gormonal, immunofaollik) turli fizik va kimyoviy ta’sirlar natijasida buzilishiga (yo‘qolishiga) denaturatsiya deyiladi.
Denaturatsiya natijasida oqsil molekulasining fazoviy konformatsiyasi, ya’ni ikkilamchi, uchlamchi va to‘rtlamchi strukturasi buziladi, ammo birlamchi strukturasi saqlanib qoladi. Denaturatsiya natijasida oqsilning peptid zanjiri uzilmaydi, asosan disulfid va vodorod bog‘lari uziladi.
Denaturatsiya natijasida oqsil molekulasi dumaloq, koptoksimon shakldan cho‘zilib ipsimon shaklga aylanadi va agregatsiyaga uchraydi. Agregatlar o‘zaro birikib, katta agregatga aylanib cho‘kmaga tushadi. Denaturatsiyalovchi omilning ta’siri to‘xtatilsa ba’zi oqsillar qisman yoki umuman o‘z tabiiy holatiga (nativ holatiga) qaytadi. Bunday holat oqsilning renaturatsiyasi deyiladi.
Buni ribonukleaza oqsili misolida kuzatish mumkin. Denaturatsiyadan keyin ma’lum vaqt o‘tishi bilan ribonukleaza fermenti kislorod ta’sirida o‘zining boshlang‘ich faolligiga ega bo‘ladi va bunda disulfid bog‘lari o‘z holiga qaytadi. Oqsil denaturatsiyasining oldini olish uchun fermentlarni ajratib olish va saqlash past temperaturada olib boriladi (00-40C).
Oqsillarni denaturatsiyaga uchrashdan saqlash uchun turli kimyoviy moddalar qo‘llaniladi (oddiy shakar, glitserin, organik moddalar).
Oqsillarni hayvonlar to‘qimasidan, makroorganizmlardan maxsus usullar yordamida ajratib olinadi.
1. Oqsillarni ajratib olishda gomogenizatsiya usuli.
Oqsillarni hayvonlar to‘qimasidan, makroorganizmlardan ajratib olish uchun avvalo to‘qimalar yaxshilab maydalaniladi, ya’ni gomogenizatsiyalanadi. Bunda hujayra strukturasi buziladi oqsillar eritmaga o‘tadi. Gomogenizatsiya qilish uchun quyidagi usullardan foydalaniladi:
1. Chinni hovonchada to‘qimani qum bilan ezish (maydalash).
2. Potter-Elvegay gomogenizatorida maydalash.
3. Sharsimon tegirmonchalarda maydalash.
4. Kuchli ravishda muzlatib, keyin eritish yo‘li.
5. Ultratovush ta’sirida maydalash.
6. Bosim ta’sirida (muzlatilgan to‘qimani mayda teshikli po‘lat to‘rdan o‘tkazish).
7. Azot gazi yordamida (azot gazini bosim ostida to‘yintiriladi keyin keskin bosim pasaytiriladi. Natijada azot hujayrani oson parchalab oqsilni eritmaga o‘tkazadi).
Yuqoridagi usullar bilan hosil qilingan gomogenatdan oqsillarni ajratib olish uchun ekstraksiya usulidan foydalaniladi. Olingan gomogenatni 8-10% li tuz eritmasida eritiladi. Oqsillarni ekstratsiyalash uchun ko‘pincha ma’lum pHga ega bo‘lgan bufer eritmalardan, organik erituvchilardan va ionsiz detergentlardan foydalaniladi. Bu maqsadda organik moddalardan ko‘pdan beri ishlatib kelinadigan eritmalar – glitserinning suvdagi eritmasi, saxaroza eritmasi, limon kislota va borat bufer aralashmalar, tris-bufer eritmalardan foydalaniladi.
Qon zardobi oqsilini ajratish uchun etil spirti, atseton, butil spirti ta’sirida cho‘ktiriladi. Gomogenatdan toza holda oqsillarni olish uchun har xil detergentlar ishlatiladi. Ular oqsil-yog‘ kompleksini va oqsil-oqsil bog‘larini yaxshi parchalaydi. Oqsillarni (fermentlarni) tozalashda mitoxondriya biomembranasi bilan yoki hujayra organoidlari bilan mustahkam birikadigan modda triton X-100, natriy dodetsilsulfat va natriy dezoksixolat ishlatiladi. Bu detergentlar oqsil-oqsil komplekslarini parchalaydi va oqsillarning to‘rtlamchi strukturasini buzadi.
Oqsillar ekstratsiya qilingandan so‘ng ekstraktni sentrifugalash yordamida to‘qima elementlaridan tozalaniladi va eritmaga o‘tgan oqsillarni fraksiyalash yo‘li bilan ajratiladi. Hozirgi paytda quyidagi usullar bilan oqsillar fraksiyalarga ajratiladi: tuzlar ta’sirida cho‘ktirish, issiqlik ta’sirida denaturatsiyalash usuli, organik erituvchilar yordamida cho‘ktirish, xromatografiya, gelfiltratsiya, elektroforez, ultratsentri-fugalash usullari.
Oqsillarni ishqoriy va ishqoriy yer metall tuzlari ta’sirida cho‘ktirib fraksiyalanganda ular o‘z xossalarini saqlab qoladi, chunki dializ yoki gelfiltratsiya usuli bilan oqsil cho‘kmasidan tuzlar ajratib olinsa, oqsil eritmaga o‘tadi. Bu usul biologik faollikka ega bo‘lgan fermentlarni ajratib olishda katta ahamiyatga egadir.
Klinik laboratoriyalarda qon zardobidan globulin oqsillarini ammoniy sulfatning yarim to‘yingan eritmasi, albumin oqsillarini to‘yingan eritmasi yordamida ajratib olinadi. Tuzlar bilan oqsilni cho‘ktirishda oqsilning tabiati tuzlarning konsentratsiyasi hamda eritmani pH va temperatura ahamiyatga ega bo‘ladi.
Yuqori molekulali moddalarni past molekulali moddalardan yarim o‘tkazgich membranalar yordamida ajratish usuliga dializ deyiladi. Dializ usuli kolloid zarrachalarni yarim o‘tkazgich membranalardan o‘tmasligiga asoslangan. Yarim o‘tkazgich membranalarga kollodiy, sellofan, pergament qog‘ozlari misol bo‘ladi.
Inson va hayvon organizmida buyrakdagi Boumen – Shumlyanskiy kapsulasining pardalari ham yarim o‘tkazuvchandir. Dializ uchun ishlatiladigan asbobni dializator deyiladi. Oddiy dializator sifatida kollodiy va sellofan qopchasi ishlatiladi. Cho‘ktirib ajratilgan oqsil cho‘kmasini kollodiy yoki sellofan xaltachasiga joylab, distillangan suv solingan idishga tushiriladi. Bunda vaqt o‘tishi bilan kichik molekulali moddalar (tuzlar) xaltacha tashqarisidagi distillangan suvga chiqadi. Oqsil esa yarim o‘tkazuvchi parda teshikchalaridan o‘tolmaydi va xaltacha ichida qoladi.
Oqsillar aralashmasini ion almashuvchi, adsorbsiyalovchi xromatografiya, gelfiltratsiyalash va afin xromatografiya yordamida ham fraksiyalarga ajratiladi.
a) Ion almashuv xromatografiyasi.
Bu usulda ikki xil ion almashtiruvchi adsorbentlar sifatida ishlatiladi.
1. Kuchli va kuchsiz asosli anion almashtiruvchilar. Bularga polistrol va sellyuloza hosilalari kiradi.
2. Kation almashtiruvchi polistirollarga sulfat birikmalari va karboksilmetilsellyuza kiradi.
Ion almashtiruvchi moddalarni kolonkaga (uzun shisha naycha) solib kuchsiz kislota yoki asos bilan yuviladi. So‘ngra oqsil eritmasi o‘tkaziladi. Bunda oqsil molekulasi anion yoki kation gruppalarga bo‘linishi natijasida oqsillarni tuzlarning turli pHli eritmasi yordamida ajratib olinadi.
b) Adsorbsion xromotografiya.
Bu usulda adsorbent sifatida faollashtirilgan ko‘mir va alyumin oksidi ishlatiladi. Adsorbent kolonkaga solinib, erituvchi quyiladi va oqsil eritmasi qo‘shiladi, bunda oqsil adsorbent bilan birikadi. So‘ngra oqsil fraksiyalari turli pH li bufer eritmalari yordamida ajratib olinadi.
Oqsillarni fraksiyalarga ajratishda taqsimlanuvchi xromatografiya usulidan foydalaniladi. Taqsimlanish xromatografiyasi adsorbsion xromatografiyani turi bo‘lib, adsorbent sifatida xromatografiya qog‘ozi, kraxmal, silikagel va boshqalar ishlatiladi.
d) Gel xromatografiyasi.
Bu usulda har xil gellar ishlatiladi, masalan: dekstrandan tayyorlangan, turli markadagi sefadekslar, dekstran – yuqori molekulali glyukoza qoldiqlaridan tarkib topgan polimer moddadir, uni ishqoriy muhitda epixloridgidrin bilan reaksiyaga kiritilsa, gel hosil bo‘ladi. Poliakrilamid gelini hosil qilish uchun suvda yaxshi eriydigan monomer akrilamid olib bu funksional reagentlar ishtirokida polimerlashtiriladi.
Oqsillarni molekulalari katta yoki kichikligiga qarab gelxromatografiya kolonkasiga gel to‘ldirilib undan oqsillar aralashmasi o‘tkazilsa avvalo, kichik molekulali oqsillar gel g‘ovaklari orqali, gel zarrachasining ichiga kirib diffuziyalanadi.
Yirik molekulali oqsillar bu g‘ovakchadan o‘tolmaydi, ular zarrachaning tashqarisida qoladi va eritma bilan kolonkadan oqib chiqadi.
e) Afin xromatografiya.
Bu xromatografiya usulli quyidagi prinsiplarga asoslangan bo‘ladi: ajratib olinishi lozim bo‘lgan oqsilga spetsifik bo‘lgan modda Z-ligandda erimaydigan M moddasiga mustahkam qilib biriktiriladi. Shunday qilib, tayyorlangan MZ-adsorbenti xromatografiya kolonkasiga solinadi va u orqali oqsil aralashmasi o‘tkaziladi. Bunda P oqsili spetsifik adsorbent bilan birikadi. MZ+P=MZP. So‘ngra kolonka yaxshilab yuviladi va birikkan P-oqsilining birikmasini dissotsiatsiya qiluvchi eritma bilan ajratib kolonkadan chiqariladi.
Elektroforez usuli
Bu usul bo‘yicha oqsillar elektr maydonida har xil harakatlanish tezligiga asoslanib fraksiyalarga bo‘linadi. Filtr qog‘ozida o‘tkaziladigan elektroforez usuli yordamida inson qon zardobidagi oqsillarni fraksiyaga ajratish mumkin. Qog‘ozda o‘tkaziladigan elektroforezdan tashqari hozirgi vaqtda kraxmal geli, poliakrilamid va sellyulozada oqsillarni elektroforez yordamida fraksiyalarga bo‘lish va ajratish mumkin.
Filtr qog‘ozi o‘rniga yuqorida ko‘rsatilgan moddalar elektroforezda ishlatilganda qon zardobi oqsillarini ko‘proq fraksiyalarga ajratish mumkin. Masalan: kraxmal gelida 10 ta, poliakrilamid gelida 18 ta oqsil fraksiyalarini olish mumkin. Elektroforez yordamida ajratilgan oqsilni aniqlash uchun qog‘oz va gellar bromfenol yoki 10 V amid qora bo‘yog‘i bilan va boshqa oqsil bilan rang beruvchi reaktivlar bilan ishlanadi.
Oqsillarni gomogen holda ajratib olish ularning birlamchi, ikkilamchi, uchlamchi va to‘rtlamchi strukturasini o‘rganishga imkoniyat tug‘diradi. Oqsilning aminokislota tarkibini aniqlash uchun oqsil to‘la aminokislotalargacha gidroliz qilinadi va analizatorlar yordamida aminokislotalar tekshiriladi.
Oqsilning ikkilamchi strukturasini esa izotop almashinish usuli, ultrabinafsha va infraqizil spektrosko‘p usullari yordamida aniqlanadi. Bu usullar polipeptid zanjirni spirallanish darajasini aniqlashga imkoniyat beradi. Oqsilning uchlamchi va to‘rtlamchi strukturasi – elektron mikrosko‘p va rengenostruktur tahlil yordamida aniqlanadi.
Oqsillarning tarkibi va strukturasi yetarli o‘rganilmaganligi sababli ularning ayrim belgilariga qarab, ajratib olingan manbaiga qarab nomlangan. Fizik-kimyoviy xossalariga, struktura va funksiyasiga qarab oqsillar sinflanadi.
Oqsillar kimyoviy tarkibiga qarab ikki katta guruhga bo‘linadi:
Oddiy oqsillar.
Murakkab oqsillar.
Oddiy oqsillar faqat aminokislotalardan tuzilgan bo‘ladi. Murakkab oqsillar oqsil va oqsil bo‘lmagan qismlardan tashkil topgandir. Oqsil bo‘lmagan qismini tuzilishiga qarab murakkab oqsillar nukleoproteinlar, glikoproteinlar, lipoproteinlar, xromoproteinlar, metallproteinlarga bo‘linadi. Oddiy oqsillarga gistonlar, prota’minlar, glyutelinlar, albuminlar misol bo‘ladi.
Hozirgi vaqtda oqsillar biologik funksiyasiga qarab quyidagi guruhlarga bo‘linadi:
Katalitik funksiya. Barcha biologik katalizatorlar – fermentlar
– oqsil tabiatiga egadirlar. Hozirgi vaqtda 2100 dan ortiq fermentlar ma’lumdir. Oqsillarning bu funksiyasi noyob bo‘lib, biologik sistemalardagi kimyoviy reaksiyalar tezligini aniqlab beradi. Ozuqa (rezerv) funksiya. Bu funksiyani rezerv oqsillar amalga oshiradi, ular homilaning rivojlanishi uchun ozuqa manbai bo‘ladilar, masalan tuxum oqsili (ovalbumin) bunga misol bo‘ladi. Sutning asosiy oqsili kazein ham ozuqa vazifasini bajaradi. Boshqa qator oqsillardan, shubhasiz, organizm aminokislota manbai sifatida foydalanadi, ular o‘z navbatida modda almashinish jarayonini boshqaruvchi biologik faol moddalarning o‘tmishdoshi hisoblanadilar.
1. Transport funksiyasi. Qonning nafas funksiyasi, xususan kislorodning tashilishi eritrotsitlar oqsili gemoglobin molekulasi yordamida amalga oshiriladi. Lipidlarning tashilishida qon zardobining albumin oqsillari ishtirok etadilar. Boshqa qon zardobi oqsillari yog‘lar, mis, temir, tiroksin, vitamin A bilan kompleks hosil qiladilar va ularni nishon-a’zolarga yetkazib berilishlarini ta’minlaydilar.
2. Himoya funksiyasi. Organizmda asosan himoya funksiyasini immun sistemasi bajaradi. U organizmga tushgan bakteriya, toksin yoki viruslarga qarshi himoya oqsil – qarshi tanachalarning sintezini ta’minlab beradi.
3. Qisqarish funksiyasi. Mushakning qisqarish va bo‘shashish jarayonida juda ko‘p oqsillar ishtirok etadilar. Lekin bu muhim jarayonda asosiy rolni aktin va miozin – mushak to‘qimasining spetsifik oqsillari o‘ynaydilar.
4. Struktur funksiya. Struktur vazifani bajaruvchi oqsillar odam organizmidagi boshqa oqsillarga nisbatan o‘z miqdori jihatidan birinchi o‘rinni egallaydilar. Ularga biriktiruvchi to‘qima kollageni, soch, tirnoq va teridagi keratin, qon tomir devoridagi elastin va boshqalar kiradi. Uglevod va lipidlar bilan oqsillarning hosil qilgan kompleksi katta ahamiyatga ega.
Gormonal funksiya. Organizmdagi modda almashinuvi turli mexanizmlar yordamida boshqariladi. Bu boshqaruvda ichki sekretsiya bezlarida ishlab chiqariladigan gormonlar asosiy o‘rinni egallaydi. Ko‘pchilik gormonlar oqsil yoki polipeptid tabiatiga egadirlar (gipofiz, oshqozon osti bezi gormonlari).
Lekin bu sanab o‘tilgan funksiyalar oqsillar bajaradigan barcha funksiyalar emas, haqiqatda oqsillar bajaradigan funksiyalar juda ko‘pdir. Hayvonlar to‘qima va a’zolari oqsilga boydir. Ko‘pchilik bu oqsillar suvda yaxshi eriydilar. Lekin tog‘ay, soch, tirnoq, suyak to‘qimasidan ajratilgan suvda erimaydigan ba’zi organik moddalar ham oqsillar guruhiga kiritilgan, chunki ular o‘zining kimyoviy tarkibi bo‘yicha mushak to‘qimasi, qon zardobi, tuxum oqsillariga yaqin.
Oqsillar mushak, o‘pka, qora taloq, buyrak quruq massasining 70-80%ini, odam tanasi quruq vaznining 45%ni tashkil etadi. Hayvon to‘qimalaridan farqli ravishda o‘simliklarda oqsillar kam saqlanadi.
Oqsillarning kimyoviy tarkibi, tuzilishi va xususiyatlarini o‘rganish uchun odatda ularni suyuq to‘qimalar yoki oqsilga boy bo‘lgan hayvon a’zolaridan, masalan: qon zardobi, sut, mushak, jigar, teri, soch, tirnoqdan ajratiladi.
Oqsillar molekula shakliga ko‘ra quyidagi guruhlarga bo‘linadi:
1. Globulyar oqsillar – suvda yaxshi eruvchan.
2. Fibrillyar – suvda erimaydigan oqsillar.
Oqsillarning spetsifiklik va biologik xossasi ularning birlamchi strukturasiga bog‘liq bo‘ladi. Agar birlamchi strukturadagi birorta aminokislota qoldig‘i o‘rniga boshqa aminokislota qoldig‘i almashtirilsa, oqsillarning spetsifiklik va biologik faolligi yo‘qoladi, funksiyasi va xossasi o‘zgaradi.
Masalan: gemoglobin tarkibi 574 aminokislota qoldig‘idan tashkil topgan bo‘lib, shundan bitta aminokislota qoldig‘i o‘rniga boshqa aminokislota almashtirilganda gemoglobin kislorod tashish xossasini yo‘qotadi. Bu esa anemiya (kamqonlik) kasalligiga olib keladi. Eritrotsitlar sferik shakldan o‘roqsimon shaklga o‘tadi. Molekulasi 5250000 aminokislota qoldig‘idan iborat bo‘lgan virus oqsilining uchta aminokislotasi almashtirilsa zararsiz virus o‘lim chaqiruvchi virusga aylanadi.
Oqsillarning biologik faolligini ularning birlamchi strukturasiga bog‘liq bo‘ladi.
Turli hayvonlar insulini uglevod almashuvida bir xil funksiyani bajaradi. Ammo bu insulin oqsillari o‘zaro bitta yoki ikkita aminokislota qoldig‘i boshqa aminokislotaga almashganligi bilan farq qiladi. Turli hayvonlar insulinining A-polipeptid zanjirida 8-, 9- va 10-o‘rinlarida aminokislota qoldig‘ini boshqa aminokislotalarga almashganligi bilan bir-biridan farq qiladi. Shu bilan birga har xil hayvonlardan olingan insulin oqsillarining B-polipeptid zanjirini C-oxiridagi aminokislota qoldig‘i boshqa bo‘ladi. Insulin molekulasi A va B polipeptid zanjiri quyidagi sxema bo‘yicha tuzilgan:
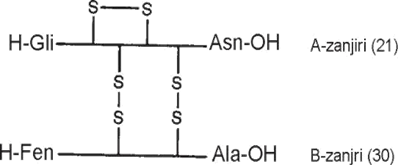
I
nsulin A-polipeptid zanjiri 21 aminokislota, B-zanjiri esa 30 aminokislota qoldig‘idan tuzilgan. Bu ikki polipeptid zanjir o‘zaro ikkita disulfid bog‘i bilan bog‘langan bo‘ladi.
|
Turlar |
Aminokislota qoldig‘ining nomerlari |
||
|
|
8 |
9 |
10 |
|
Odam |
Tre |
Ser |
Ile |
|
Buqa |
Ala |
Ser |
Val |
|
|
|
|
|
|
Cho‘chqa |
Tre |
Ser |
Ile |
|
Ot |
Tre |
Gli |
Ile |
|
|
|
|
|
|
Qo‘y |
Ala |
Gli |
Val |
|
|
|
|
|
|
Kit |
Tre |
Ser |
Ile |
5-jadvalTurli insulininlar A-polipeptid zanjiridagi aminokislota
qoldiqlarining farqi
Odam, cho‘chqa va kit insulini bir-biridan farq qilmasa ham, lekin odam insulini kit va cho‘chqa insulini o‘zaro B -polipeptid zanjirini C-oxirgi aminokislotasi bilan farqlanadi. Bunda alanin o‘rniga treonin almashgan bo‘ladi (5-6-jadvallar).
|
Turlar |
Aminokislotaning C-oxiri |
|
Odam |
Tre |
|
Quyon |
Ser |
|
Cho‘chqa |
Ala |
|
Qo‘y |
Ala |
|
Ot |
Ala |
6-jadval Odam va har xil hayvon insulinining B-polipeptid zanjiri C-oxiridagi aminokislotalar qoldig‘i
Oqsillarning birlamchi strukturasidagi farqi elektroforez, xromatografiya usuli yordamida aniqlanadi. Oqsillarning fermentlar (tripsin, ximotripsin) yordamida qisman gidroliz qilingandan so‘ng gidrolizatdagi peptidlar avvalo, elektroforez usuli yordamida guruhlarga ajratiladi. So‘ngra bu peptid guruhlari xromatografiya usuli bilan individual peptidlarga ajratiladi. Elektroforez, xromatografiya kvadrat formali filtr qog‘ozida o‘tkaziladi. Shunday qilib, «peptid kartasi» olinadi. Filtr qog‘ozini organik erituvchidan quritiladi va ningidrinning atsetondagi eritmasi bilan bo‘yaladi va peptidlarning binafsha rangli dog‘lari hosil bo‘ladi. Shunday qilib, «peptid kartalari» hosil bo‘ladi. Turli oqsil gidrolizatlaridan olingan, «peptid kartalarini» solishtirib, ularning birlamchi strukturasidagi farqi aniqlanadi.
Turli oqsillar har xil spetsifikligiga qarab organizmda turlicha immunologik reaksiyalarda ishtirok etadi.
Oqsillarning biologik xossasi (fermentlar, gormonlar, qarshi tanachalar, antigenlar va boshqalar) ular molekulasining konformatsiyasiga bog‘liq bo‘ladi.
Biologik faol oqsil molekulasi normal sharoitda oddiy haroratda, neytral pH da ma’lum informatsiyaga ega bo‘ladi. Oqsilning faol konformatsiyasi uni ajratib olishda polipeptid zanjirning uzilmasligiga, denaturatsiyaga uchramasligiga bog‘liq bo‘ladi.
Faol oqsil konformatsiyasining o‘zgarishi qisman yoki to‘liq biologik xossasini yo‘qotishiga olib keladi. Bunda vodorod, disulfid, ion va boshqa bog‘lar uziladi.
Oqsil molekulasi har xil qismlarining fazoda bir-biriga nisbatan joylashuvi konformatsion struktura deb nomlanadi. Molekulaning bir qismiga ta’sir etilsa shu molekulaning boshqa qismlarida ham o‘zgarishlar kuzatiladi va bu o‘zgarishlar konformatsion o‘zgarishlar deb nomlanadi
Oqsillar funksiyasini bajargan vaqtida ularning molekulasida konformatsion o‘zgarish kuzatiladi. Masalan: gemoglobin molekulasi kislorod bilan birikkanda uning birinchi subbirligining konformatsiyasi o‘zgaradi bu esa o‘z navbatida gemoglobin molekulasi qolgan subbirliklarida konformatsion o‘zgarishga olib keladi. Natijada qolgan subbirliklarning kislorodga bo‘lgan moyilligi ortadi.
Fermentlar katalitik funksiya bajarish vaqtida molekulasining konformatsiyasi o‘zgaradi. Bunda molekulada «cho‘ntak» hosil bo‘ladi. Natijada fermentning faol markaziga substrat birikadi va ferment-substrat kompleksi hosil bo‘ladi. Bu cho‘ntakka S (substrat) kirib joylashganda katalitik reaksiya tezlashadi. Muzlatilganda oqsil va ferment konformatsiyasi o‘zgarmaydi. Bunda oqsil funksiyasi vaqtincha to‘xtaydi. Agar oqsil asta-sekin eritilsa, oqsil molekulasi konformatsiyasining o‘zgarishi hisobiga biologik funksiyasi qayta tiklanadi.
Teri, soch, tirnoq, mo’yna va shoxlar tarkibiga struktur oqsillar kiradi, ular tayanch to’qimalarni hosil bo’lishida ishtirok etadi. Jumladan, biriktiruvchi to’qima, tog’ay va suyak oqsillari globulyar oqsilga qaraganda oddiy strukturada bo’ladi. Keratin oqsili polipeptid zanjiri α−spiral shaklida, arqonga o’xshash bo’ladi yoki uch tolali kabelga o’xshashdir, har qaysi tola α−spiraldan tashkil topgan bo’ladi. Boshqa strukturali oqsil β−keratin qisman fibrillyar shaklda bo’lib, polipeptid zanjirining konformatsiyasi β−strukturaga ega bo’ladi va qavatma-qavat holda joylashadi. Biriktiruvchi to’qima oqsillari kollagen va elastin asosiy struktura oqsillari hisoblanadi. Kollagen oqsilini polipeptid zanjiri uch tarmoqli spiral strukturaga ega. Fibrillyar oqsillar uch xil struktura darajasiga ega bo’ladi.
3. Oqsillar denatursining restoran taomlarini ishlab chiqarishdagi ahamiyati
Restoran — murakkab tarzda tayyorlangan taomlarning keng assortimentini tayyorlaydigan umumiy ovkatlanish korxonasidir. Bular ichiga buyurtma va firma taomlari,vino-aroklar, tamaki va qandolat maxsulotlari kiradi. Mijozlarning yaxshi dam olishlari uchun yuksak darajada xizmat qilinadi.
Restoranlar markaziy, odamlar gavjum kuchalarda, temir yul, avtomobil vokzallarida, aeronortlar, kemalar tuxtash joylarida, teploxod, dengiz kemalarida, suzuvchi dam olish uylarida, shuningdek, stadion, shaxarlararo xududlarda. ma'muriy, tomosha maskanlari majmualarida, tarixiy va arxitektura yodgorliklari joylashgan yerlar-da, o’zbekiston sharoitida katta bozorlar, uyingoxlar yakinida ochiladi.
Restoranlarda xurandalarga restoran xodimlari, bosh ofitsiant va ofitsiantlar xizmat kiladi. Taomlar va ichimliklarni oliy darajadagi iazandalar tayyorlaydi. Restoranda xizmat kiluvchi xodimlar bir xil kiyimlarda buladi, ularning poyafzallari yagona namunaga ega bulishi shart.
Xorijiy turistlarga xizmat qiladigan restoran ofisiantlari bironta chet tilni bilishi va mexmonlar bilan gaplasha opishi lozim.
Restoranlar ayrim xurandalargagina xizmat qilish bilan cheklanmaydi. Davlat mikyosidagi katta anjumanlar, majlislar, konferensiya, seminar, rasmiy kechalar, qabul marosimlari, tuylar, oila tantanalari, banket, tematik kechalar va boshkalarga xizmat qiladi.
Restoranlarda mijozlarga asosan tushlik va kechki ovqat beriladi, katta yiginlar, kengashlar, konferensiya katnashchilariga taomning tula ratsioni beriladi.
Kupgina restoranlarda bayram kuni oldidan, shanba va yakshanba kunlari milliy taomlar ta'mini aniklash (degustatsiya) tadbiri o’tkaziladi. Ba'zi restoranlar faoliyatida oilaviy ovqatlanish tajribasi amalga oshirilmoqda. Xizmatning bu turida maxsus taomnoma tuziladi, bunda yosh bolalar xisobga olinadi, ammo ozik-ovqat uncha qimmat bulmasligi kerak.
Lyuks toifadagi restoranda buyurtma va firma taomlaridan tashkari taomnomada yozilmagan taomlarning buyurtmasini xam qabul qilish mumkin. Restoranda maxsulotlar assortimentida shokolad, konfetlar, turli xul mevalar va boshqalar bulishi kerak.
Lyuks va oliy toifadagi restoran vitrinalari turli manzarali badiiy materiallar, optik yoritqichlar, rangli diapozitivlar, fotosuratlar bilan bezatiladi. Vitrinalar shunday yasatiladiki, unda korxonaning xususiyatlari yaqqol kurinsin, oshxonaning uziga xos xususiyati, mijozlarga kursatiladigan xizmat majmui aks etsin.
Birinchi toifadagi restoranlarda vitrinalarni bezash oddiyrok bo’ladi.
Restoran zallarida mijozlar uchun qulayliklar yaratish maksadida arxitektura konstruktiv manzarali elementlar, mebel va boshka jixozlar urnatish uchun may-donlar barpo etiladi.
Restoranlarda mebellarning asosiy turlari: ikki, turt, olti kishi sig’adigan stollar (tugri burchakli, kvadrat, dumaloq va boshka shaklda); restoran kreslolari, divanlar, ofitsiantlar uchun servantlar, guldonlar, xizmat uchun stollar va xokazo.
Lyuks toifadagi restoranlar uchun oshxona idish-tovoklari, priborlar maxsus buyurtma bo’yicha tayyorlanadi (zanglamaydigan pulatdan, oliy darajadagi chinni, shishadan eng yaxshi ishlov berilib tayyorlanadi).
Oshxona va xizmat xususiyatlari xisobga olingan xolda idish-tovoqlar tanlanadi. Chinnidan yasalgan xar bir buyumda uni ishlab chiqaruvchining tamgasi bulishi shart. Banketlarda, qabul tantanalarida chinnidan va billurdan ishlangan buyumlardan foydalaniladi.
Oshxonalarda foydalaniladigan matodan qilingan buyumlar ~ sochiklar, dasturxon, salfetkalar, qo’l sochiqlari zal xususiyatiga karab buyurtma bilan tayyorlanadi. Bu buyumlarning xar birida restoran tamg’asi bulishi shart. Stollarga dasturxonar bir yangi mexmon uchun yangi yoziladi. Ingliz, fransuz, nemis tillarida bosiladi. Taomnomaning firmali jildi, reklama afishalari, bukletlar, varaqalar, tabrik va taklif qogozlar va boshka nashr reklamalari zich, qalin kog’ozlar yoki yaltiroq ishlov berilgan kartondan tayyorlanadi. Taomnomaning jildida restoran nomi va tamg’asidan tashqari restoranning mavzu yunalishini ifodalovchi rasm xam bo’ladi.
Lyuks va oliy toifadagi restoranlarda orkestr chiqishiga muljaldangan joy buladi. Ansabllar, teatr guruxlari konsert dasturlari bilan mijozlarning yaxshi dam olishiga sharoit yaratiladi. Lyuks toifali restoranlarda yuqori sifatli stereofonik radio ainaraturadan foydalaniladi, xar bir stolda ovozni bir me'yorda tartibga soluvchi dinamiklar buladi.
Restoranlar bir-birlaridan quyidagilar bilan farklanadi:
— tayyorlab beriladigan taomlar assortimenti buyicha (baliq milliy taomlar, xorijiy mamlakat taomlari);
— urnashgan joyi — shaxarda, vokzallarda, mexmonxonada, dam olish
yo'qotishiga zonasi, vagon-restoran va boshqalar.
Oqsil denaturatsiyasi Bu harorat, pH yoki ba'zi kimyoviy moddalar kabi turli xil atrof-muhit omillari tufayli uch o'lchovli strukturaning yo'qolishidan iborat. Tuzilishning yo'qolishi, u oqsil bilan bog'liq bo'lgan biologik funktsiyani olib keladi, u fermentativ, tarkibiy, tashuvchisi va boshqalar.
Oqsilning tuzilishi o'zgarishlarga juda sezgir. Bitta muhim vodorod bog'lanishining destabilizatsiyasi oqsilni denaturatsiya qilishi mumkin. Xuddi shu tarzda, o'zaro ta'sirlar mavjud bo'lib, ular protein funktsiyasini bajarish uchun juda muhim emas va agar ular beqarorlashtirilsa, funktsiyaga ta'sir qilmaydi.
Denaturatsiya natijasida oqsil molekulasi dumaloq, koptoksimon shakldan cho‘zilib ipsimon shaklga aylanadi va agregatsiyaga uchraydi. Agregatlar o‘zaro birikib, katta agregatga aylanib cho‘kmaga tushadi. Denaturatsiyalovchi omilning ta’siri to‘xtatilsa ba’zi oqsillar qisman yoki umuman o‘z tabiiy holatiga (nativ holatiga) qaytadi. Bunday holat oqsilning renaturatsiyasi deyiladi.
Buni ribonukleaza oqsili misolida kuzatish mumkin. Denaturatsiyadan keyin ma’lum vaqt o‘tishi bilan ribonukleaza fermenti kislorod ta’sirida o‘zining boshlang‘ich faolligiga ega bo‘ladi va bunda disulfid bog‘lari o‘z holiga qaytadi. Oqsil denaturatsiyasining oldini olish uchun fermentlarni ajratib olish va saqlash past temperaturada olib boriladi (00-40C).
Oqsillarni denaturatsiyaga uchrashdan saqlash uchun turli kimyoviy moddalar qo‘llaniladi (oddiy shakar, glitserin, organik moddalar).
Oqsillarni hayvonlar to‘qimasidan, makroorganizmlardan maxsus usullar yordamida ajratib olinadi.
1. Oqsillarni ajratib olishda gomogenizatsiya usuli.
Oqsillarni hayvonlar to‘qimasidan, makroorganizmlardan ajratib olish uchun avvalo to‘qimalar yaxshilab maydalaniladi, ya’ni gomogenizatsiyalanadi. Bunda hujayra strukturasi buziladi oqsillar eritmaga o‘tadi. Gomogenizatsiya qilish uchun quyidagi usullardan foydalaniladi:
8. Chinni hovonchada to‘qimani qum bilan ezish (maydalash).
9. Potter-Elvegay gomogenizatorida maydalash.
10. Sharsimon tegirmonchalarda maydalash.
11. Kuchli ravishda muzlatib, keyin eritish yo‘li.
12. Ultratovush ta’sirida maydalash.
13. Bosim ta’sirida (muzlatilgan to‘qimani mayda teshikli po‘lat to‘rdan o‘tkazish).
14. Azot gazi yordamida (azot gazini bosim ostida to‘yintiriladi keyin keskin bosim pasaytiriladi. Natijada azot hujayrani oson parchalab oqsilni eritmaga o‘tkazadi).
Yuqoridagi usullar bilan hosil qilingan gomogenatdan oqsillarni ajratib olish uchun ekstraksiya usulidan foydalaniladi. Olingan gomogenatni 8-10% li tuz eritmasida eritiladi. Oqsillarni ekstratsiyalash uchun ko‘pincha ma’lum pHga ega bo‘lgan bufer eritmalardan, organik erituvchilardan va ionsiz detergentlardan foydalaniladi. Bu maqsadda organik moddalardan ko‘pdan beri ishlatib kelinadigan eritmalar – glitserinning suvdagi eritmasi, saxaroza eritmasi, limon kislota va borat bufer aralashmalar, tris-bufer eritmalardan foydalaniladi.
Qon zardobi oqsilini ajratish uchun etil spirti, atseton, butil spirti ta’sirida cho‘ktiriladi. Gomogenatdan toza holda oqsillarni olish uchun har xil detergentlar ishlatiladi. Ular oqsil-yog‘ kompleksini va oqsil-oqsil bog‘larini yaxshi parchalaydi. Oqsillarni (fermentlarni) tozalashda mitoxondriya biomembranasi bilan yoki hujayra organoidlari bilan mustahkam birikadigan modda triton X-100, natriy dodetsilsulfat va natriy dezoksixolat ishlatiladi. Bu detergentlar oqsil-oqsil komplekslarini parchalaydi va oqsillarning to‘rtlamchi strukturasini buzadi.
Oqsillar ekstratsiya qilingandan so‘ng ekstraktni sentrifugalash yordamida to‘qima elementlaridan tozalaniladi va eritmaga o‘tgan oqsillarni fraksiyalash yo‘li bilan ajratiladi. Hozirgi paytda quyidagi usullar bilan oqsillar fraksiyalarga ajratiladi: tuzlar ta’sirida cho‘ktirish, issiqlik ta’sirida denaturatsiyalash usuli, organik erituvchilar yordamida cho‘ktirish, xromatografiya, gelfiltratsiya, elektroforez, ultratsentri-fugalash usullari.
Oqsillarni ishqoriy va ishqoriy yer metall tuzlari ta’sirida cho‘ktirib fraksiyalanganda ular o‘z xossalarini saqlab qoladi, chunki dializ yoki gelfiltratsiya usuli bilan oqsil cho‘kmasidan tuzlar ajratib olinsa, oqsil eritmaga o‘tadi. Bu usul biologik faollikka ega bo‘lgan fermentlarni ajratib olishda katta ahamiyatga egadir.
Klinik laboratoriyalarda qon zardobidan globulin oqsillarini ammoniy sulfatning yarim to‘yingan eritmasi, albumin oqsillarini to‘yingan eritmasi yordamida ajratib olinadi. Tuzlar bilan oqsilni cho‘ktirishda oqsilning tabiati tuzlarning konsentratsiyasi hamda eritmani pH va temperatura ahamiyatga ega bo‘ladi.
Yuqori molekulali moddalarni past molekulali moddalardan yarim o‘tkazgich membranalar yordamida ajratish usuliga dializ deyiladi. Dializ usuli kolloid zarrachalarni yarim o‘tkazgich membranalardan o‘tmasligiga asoslangan. Yarim o‘tkazgich membranalarga kollodiy, sellofan, pergament qog‘ozlari misol bo‘ladi.
Inson va hayvon organizmida buyrakdagi Boumen – Shumlyanskiy kapsulasining pardalari ham yarim o‘tkazuvchandir. Dializ uchun ishlatiladigan asbobni dializator deyiladi. Oddiy dializator sifatida kollodiy va sellofan qopchasi ishlatiladi. Cho‘ktirib ajratilgan oqsil cho‘kmasini kollodiy yoki sellofan xaltachasiga joylab, distillangan suv solingan idishga tushiriladi. Bunda vaqt o‘tishi bilan kichik molekulali moddalar (tuzlar) xaltacha tashqarisidagi distillangan suvga chiqadi. Oqsil esa yarim o‘tkazuvchi parda teshikchalaridan o‘tolmaydi va xaltacha ichida qoladi.
Oqsillar aralashmasini ion almashuvchi, adsorbsiyalovchi xromatografiya, gelfiltratsiyalash va afin xromatografiya yordamida ham fraksiyalarga ajratiladi.
a) Ion almashuv xromatografiyasi.
Bu usulda ikki xil ion almashtiruvchi adsorbentlar sifatida ishlatiladi.
3. Kuchli va kuchsiz asosli anion almashtiruvchilar. Bularga polistrol va sellyuloza hosilalari kiradi.
4. Kation almashtiruvchi polistirollarga sulfat birikmalari va karboksilmetilsellyuza kiradi.
Ion almashtiruvchi moddalarni kolonkaga (uzun shisha naycha) solib kuchsiz kislota yoki asos bilan yuviladi. So‘ngra oqsil eritmasi o‘tkaziladi. Bunda oqsil molekulasi anion yoki kation gruppalarga bo‘linishi natijasida oqsillarni tuzlarning turli pHli eritmasi yordamida ajratib olinadi.
b) Adsorbsion xromotografiya.
Bu usulda adsorbent sifatida faollashtirilgan ko‘mir va alyumin oksidi ishlatiladi. Adsorbent kolonkaga solinib, erituvchi quyiladi va oqsil eritmasi qo‘shiladi, bunda oqsil adsorbent bilan birikadi. So‘ngra oqsil fraksiyalari turli pH li bufer eritmalari yordamida ajratib olinadi.
Oqsillarni fraksiyalarga ajratishda taqsimlanuvchi xromatografiya usulidan foydalaniladi. Taqsimlanish xromatografiyasi adsorbsion xromatografiyani turi bo‘lib, adsorbent sifatida xromatografiya qog‘ozi, kraxmal, silikagel va boshqalar ishlatiladi.
d) Gel xromatografiyasi.
Bu usulda har xil gellar ishlatiladi, masalan: dekstrandan tayyorlangan, turli markadagi sefadekslar, dekstran – yuqori molekulali glyukoza qoldiqlaridan tarkib topgan polimer moddadir, uni ishqoriy muhitda epixloridgidrin bilan reaksiyaga kiritilsa, gel hosil bo‘ladi. Poliakrilamid gelini hosil qilish uchun suvda yaxshi eriydigan monomer akrilamid olib bu funksional reagentlar ishtirokida polimerlashtiriladi.
Oqsillarni molekulalari katta yoki kichikligiga qarab gelxromatografiya kolonkasiga gel to‘ldirilib undan oqsillar aralashmasi o‘tkazilsa avvalo, kichik molekulali oqsillar gel g‘ovaklari orqali, gel zarrachasining ichiga kirib diffuziyalanadi.
Yirik molekulali oqsillar bu g‘ovakchadan o‘tolmaydi, ular zarrachaning tashqarisida qoladi va eritma bilan kolonkadan oqib chiqadi.
e) Afin xromatografiya.
Bu xromatografiya usulli quyidagi prinsiplarga asoslangan bo‘ladi: ajratib olinishi lozim bo‘lgan oqsilga spetsifik bo‘lgan modda Z-ligandda erimaydigan M moddasiga mustahkam qilib biriktiriladi. Shunday qilib, tayyorlangan MZ-adsorbenti xromatografiya kolonkasiga solinadi va u orqali oqsil aralashmasi o‘tkaziladi. Bunda P oqsili spetsifik adsorbent bilan birikadi. MZ+P=MZP. So‘ngra kolonka yaxshilab yuviladi va birikkan P-oqsilining birikmasini dissotsiatsiya qiluvchi eritma bilan ajratib kolonkadan chiqariladi.
Elektroforez usuli
Bu usul bo‘yicha oqsillar elektr maydonida har xil harakatlanish tezligiga asoslanib fraksiyalarga bo‘linadi. Filtr qog‘ozida o‘tkaziladigan elektroforez usuli yordamida inson qon zardobidagi oqsillarni fraksiyaga ajratish mumkin. Qog‘ozda o‘tkaziladigan elektroforezdan tashqari hozirgi vaqtda kraxmal geli, poliakrilamid va sellyulozada oqsillarni elektroforez yordamida fraksiyalarga bo‘lish va ajratish mumkin.
Filtr qog‘ozi o‘rniga yuqorida ko‘rsatilgan moddalar elektroforezda ishlatilganda qon zardobi oqsillarini ko‘proq fraksiyalarga ajratish mumkin. Masalan: kraxmal gelida 10 ta, poliakrilamid gelida 18 ta oqsil fraksiyalarini olish mumkin. Elektroforez yordamida ajratilgan oqsilni aniqlash uchun qog‘oz va gellar bromfenol yoki 10 V amid qora bo‘yog‘i bilan va boshqa oqsil bilan rang beruvchi reaktivlar bilan ishlanadi.
Oqsillarni gomogen holda ajratib olish ularning birlamchi, ikkilamchi, uchlamchi va to‘rtlamchi strukturasini o‘rganishga imkoniyat tug‘diradi. Oqsilning aminokislota tarkibini aniqlash uchun oqsil to‘la aminokislotalargacha gidroliz qilinadi va analizatorlar yordamida aminokislotalar tekshiriladi.
Oqsilning ikkilamchi strukturasini esa izotop almashinish usuli, ultrabinafsha va infraqizil spektrosko‘p usullari yordamida aniqlanadi. Bu usullar polipeptid zanjirni spirallanish darajasini aniqlashga imkoniyat beradi. Oqsilning uchlamchi va to‘rtlamchi strukturasi – elektron mikrosko‘p va rengenostruktur tahlil yordamida aniqlanadi.
Oqsillarning tarkibi va strukturasi yetarli o‘rganilmaganligi sababli ularning ayrim belgilariga qarab, ajratib olingan manbaiga qarab nomlangan. Fizik-kimyoviy xossalariga, struktura va funksiyasiga qarab oqsillar sinflanadi.
Oqsillar kimyoviy tarkibiga qarab ikki katta guruhga bo‘linadi:
Oddiy oqsillar.
Murakkab oqsillar.
Oddiy oqsillar faqat aminokislotalardan tuzilgan bo‘ladi. Murakkab oqsillar oqsil va oqsil bo‘lmagan qismlardan tashkil topgandir. Oqsil bo‘lmagan qismini tuzilishiga qarab murakkab oqsillar nukleoproteinlar, glikoproteinlar, lipoproteinlar, xromoproteinlar, metallproteinlarga bo‘linadi. Oddiy oqsillarga gistonlar, prota’minlar, glyutelinlar, albuminlar misol bo‘ladi.
Hozirgi vaqtda oqsillar biologik funksiyasiga qarab quyidagi guruhlarga bo‘linadi:
Katalitik funksiya. Barcha biologik katalizatorlar – fermentlar – oqsil tabiatiga egadirlar. Hozirgi vaqtda 2100 dan ortiq fermentlar ma’lumdir. Oqsillarning bu funksiyasi noyob bo‘lib, biologik sistemalardagi kimyoviy reaksiyalar tezligini aniqlab beradi. Ozuqa (rezerv) funksiya. Bu funksiyani rezerv oqsillar amalga oshiradi, ular homilaning rivojlanishi uchun ozuqa manbai bo‘ladilar, masalan tuxum oqsili (ovalbumin) bunga misol bo‘ladi. Sutning asosiy oqsili kazein ham ozuqa vazifasini bajaradi. Boshqa qator oqsillardan, shubhasiz, organizm aminokislota manbai sifatida foydalanadi, ular o‘z navbatida modda almashinish jarayonini boshqaruvchi biologik faol moddalarning o‘tmishdoshi hisoblanadilar.
Transport funksiyasi. Qonning nafas funksiyasi, xususan kislorodning tashilishi eritrotsitlar oqsili gemoglobin molekulasi yordamida amalga oshiriladi. Lipidlarning tashilishida qon zardobining albumin oqsillari ishtirok etadilar. Boshqa qon zardobi oqsillari yog‘lar, mis, temir, tiroksin, vitamin A bilan kompleks hosil qiladilar va ularni nishon-a’zolarga yetkazib berilishlarini ta’minlaydilar.
Himoya funksiyasi. Organizmda asosan himoya funksiyasini immun sistemasi bajaradi. U organizmga tushgan bakteriya, toksin yoki viruslarga qarshi himoya oqsil – qarshi tanachalarning sintezini ta’minlab beradi.
Qisqarish funksiyasi. Mushakning qisqarish va bo‘shashish jarayonida juda ko‘p oqsillar ishtirok etadilar. Lekin bu muhim jarayonda asosiy rolni aktin va miozin – mushak to‘qimasining spetsifik oqsillari o‘ynaydilar.
Struktur funksiya. Struktur vazifani bajaruvchi oqsillar odam organizmidagi boshqa oqsillarga nisbatan o‘z miqdori jihatidan birinchi o‘rinni egallaydilar. Ularga biriktiruvchi to‘qima kollageni, soch, tirnoq va teridagi keratin, qon tomir devoridagi elastin va boshqalar kiradi. Uglevod va lipidlar bilan oqsillarning hosil qilgan kompleksi katta ahamiyatga ega.
4. Oqsillar gidradlanishi va degidratlanishi
Kondensatsiya reaktsiyasi deb ham ataladigan suvsizlanish sintezi suvni (H2O) olib tashlashdan keyin kattaroq birliklarni (polimerlar deb ataladi) hosil qilish uchun kichik molekulalarni (monomerlar deb ataladi) birlashtirish jarayonidir:
Bu jarayonda bir komponentdan vodorod ioni (H+) va keyingi komponentdan gidroksid ioni (OH-) chiqariladi. Keyin vodorod ioni va gidroksid suv hosil qilish uchun birlashadi, shuning uchun komponentlar "suvni yo'qotadi" yoki "suvsizlanadi".
Dehidratsiya sintezi "kondensatsiya reaktsiyasi" deb ham ataladi, chunki ikkalasi ham katta molekuladan suvning kondensatsiyasi va hosil bo'lishi bilan tavsiflanadi.
Monosaxaridlarning murakkab qandlarga aylanishi, aminokislotalardan oqsil hosil boʻlishi, yogʻ kislotalarining murakkab yogʻlarga aylanishi va nukleotidlardan nuklein kislotalarning hosil boʻlishi suvsizlanish sintez reaksiyalariga misol boʻla oladi.
Quyidagi diagramma polimerlarda suvsizlanish sintezi qanday sodir bo'lishini ko'rsatadi.
Degidratatsiya sintezining turlari
Biologik organizmlardadegidratatsiya sintezining har xil turlari sodir bo'ladi. Bular quyidagilar asosida tasniflanadi:
Masalan, ushbu mezon biomolekulalar va ularning qurilish bloklari bir-biriga birlashtirilgan kimyoviy elementlar va funktsional guruhlardan tuzilganligi bilan bog'liq. Asosan, ushbu turkum ularni omin guruhi, karboksil guruhi va boshqalarga tegishli deb tasniflaydi. Tirik organizmlarda pH, harorat va sho'rlanish kabi kimyoviy ko'rsatkichlar o'zgaruvchan. Demak, biologik katalizatorlar yoki kimyoviy reaktsiyalarni tezlashtiradigan fermentlar kerak. Shu bilan birga degidratlanish sintezining turi reaksiyani harakatlantiruvchi katalizator nomi bilan ataladi.
Avval aytib o'tganimizdek, degidratatsiyalanish sintezi turli xil polimer mahsulotlarini ishlab chiqarishi mumkin. Shuning uchun ushbu turdagi reaktsiyalar oddiy shakarlardan murakkab uglevodlarni hosil qiladimi, atsetil-KoA dan yog ' kislotalarini yaratadimi va boshqalarmi guruhlanadi.
Degidratatsiya sintezi jarayoniga nisbatan gidroliz shunchaki teskari hisoblanadi. Suv molekulalari yordamida murakkab molekulalar kichik birliklarga bo'linadi.
• Katta molekulalar suv molekulalari orasidagi bog'lanishni buzish orqali parchalanadi. Bu jarayonda bir komponentga vodorod ioni (H+), ikkinchisiga gidroksid ioni (OH-) qo‘shiladi.
• Suv bo'linganligi sababli, u "gidroliz" deb ataladi, bu so'zma-so'z "suvni ajratish" degan ma'noni anglatadi.
• Gidrolitik reaksiyalarga murakkab qandlar, oqsillar, murakkab yog‘lar va nuklein kislotalarning monosaxaridlar, aminokislotalar, yog‘ kislotalari va nukleotidlarga parchalanishi misol bo‘la oladi.
Gidroliz turlari
Tirik organizmlarda gidrolizning har xil turlari sodir bo'ladi. Quyida keltirilgan uchta tur mavjud:
Bu tuz suvda eriganida sodir bo'ladi. Keyin suv vodorod ionlariga (H+) va gidroksil ionlariga (OH-) aylanadi, chunki tuz kationlar va anionlarga ajraladi. Bronsted-Louri nazariyasiga ko'ra, suv kislota yoki asos sifatida harakat qilishi mumkin. Suv molekulasi proton ehson bo'lsa (h+), suv kislota sifatida harakat deb aytiladi.
Yuqorida aytib o'tilganlarga nisbatan suv molekulasi asos bo'lib xizmat qilishi va molekulalarni gidrolizlashi mumkin. Agar molekula protonni (H+) suvdan qabul qilsa, molekula tayanch vazifasini bajaradi deyiladi.
Avval aytib o'tganimizdek, degidratatsiya gidrolizi to'rtta asosiy makromolekulada xuddi shunday ishlaydi. Quyidagi jadval sizga ularning reaktsiyalarining soddalashtirilgan ko'rinishini beradi:
Agar ko'proq masallarni kerak bo'lsa, quyida bu YouTube video tekshirish mumkin:
Ko'pgina avtotrof organizmlarda kichik molekulalarning uzun zanjirlarini hosil qilish uchun suvsizlanish sintezidan foydalaniladi. Masalan, bu jarayon ortiqcha glyukozani uni konvertatsiya qilish orqali saqlash uchun ishlatiladi glikogen (hayvonlarda uglevodlarni saqlash shakli) yoki kraxmal (uglevodlarni saqlash shakli) o'simliklarda.
O'simliklarda suvsizlanish sintezining yana bir keng tarqalgan misoli-bu suv molekulasining bo'shashishi natijasida hosil bo'lgan ikkita glyukoza birligining birlashuvidan maltoza (malt shakar) ishlab chiqarish. Uglevodlarning boshqa polimerlari ham shu tarzda hosil bo'ladi.
Boshqa tomondan, geterotrofik (fotosintez qila olmaydigan) organizmlarda ovqatni kichik moddalarga hazm qilish ozuqa moddalarini singdirish va ularni yanada foydali energiya shakliga aylantirish uchun muhimdir. Organizmga biosintezlash uchun energiya kerak bo'lganda, ATP shaklidagi bu energiya gidrolizga uchraydi va undan keyin endi foydalanish mumkin. Hayvonlarda ovqat hazm qilish gidrolizning eng keng tarqalgan namunalaridan biridir. Ovqat hazm qilish traktida mavjud bo'lgan turli xil fermentlar tomonidan oziq-ovqat kichik bo'laklarga bo'linadi (gidrolizlanadi). Bunday ingichka ichakda ozuqa moddalarining oson singishi uchun yo'l ochadi.
|
Organik birikma turi |
Jalb qilingan obligatsiya turi |
Degidratatsiya Sintezi |
Gidroliz |
|
Uglevodlar |
Glikozid bog |
Ikki yoki undan ortiq monosaxaridlar birlashtirilgan = disaxarid / polisaxarid + H2O |
Disaxarid / polisaxarid + H2O = monosaxarid birliklari |
|
Oqsillar |
Peptid bond |
Ikki yoki undan ortiq aminokislotalar =dipeptid / oqsil + H2O |
Dipeptid / oqsil + H2O = ikki yoki undan ortiq aminokislotalar |
|
Lipidlar |
Ester bond |
3 yog ' kislotalari + glitserol = Lipid molekulasi |
Lipid molekulasi + 3 H2O = 3 yog ' kislotalari + glitserin |
|
Nuklein kislotalar |
Fosfodiester bog'i |
10 nukleotidlar = nuklein kislota + h2O |
Nuklein kislota + H2o = 10 nukleotidlar |
Boshqa tomondan, geterotrofik (fotosintez qila olmaydigan) organizmlarda ovqatni kichik moddalarga hazm qilish ozuqa moddalarini singdirish va ularni yanada foydali energiya shakliga aylantirish uchun muhimdir. Organizmga biosintezlash uchun energiya kerak bo'lganda, ATP shaklidagi bu energiya gidrolizga uchraydi va undan keyin endi foydalanish mumkin. Hayvonlarda ovqat hazm qilish gidrolizning eng keng tarqalgan namunalaridan biridir. Ovqat hazm qilish traktida mavjud bo'lgan turli xil fermentlar tomonidan oziq-ovqat kichik bo'laklarga bo'linadi (gidrolizlanadi). Bunday ingichka ichakda ozuqa moddalarining oson singishi uchun yo'l ochadi.
Boshqa misollarga yog'ning gidrolizi kiradi, chunki bu ularning oldini olishga yordam beradi ivish tananing turli qismlarida.
Fotosintezni osonlashtiruvchidan molekulyar birikmalarning quruvchisi yoki to'suvchisi bo'lishgacha bo'lgan chanqovni qondiruvchidan tortib, molekulyar darajada suv tirik organizmlar uchun shubhasiz zarurligini ko'rdik. Sizningcha, ushbu birikmaning boshqa qobiliyatlari va ishlatilishi qanday?
Xulosa va takliflar
Xuloa qilib aytadigan bo’lsak Biologik organizmlardadegidratatsiya sintezining har xil turlari sodir bo'ladi. Bular quyidagilar asosida tasniflanadi:
Masalan, ushbu mezon biomolekulalar va ularning qurilish bloklari bir-biriga birlashtirilgan kimyoviy elementlar va funktsional guruhlardan tuzilganligi bilan bog'liq. Asosan, ushbu turkum ularni omin guruhi, karboksil guruhi va boshqalarga tegishli deb tasniflaydi. Tirik organizmlarda pH, harorat va sho'rlanish kabi kimyoviy ko'rsatkichlar o'zgaruvchan. Demak, biologik katalizatorlar yoki kimyoviy reaktsiyalarni tezlashtiradigan fermentlar kerak. Shu bilan birga degidratlanish sintezining turi reaksiyani harakatlantiruvchi katalizator nomi bilan ataladi.
Avval aytib o'tganimizdek, degidratatsiyalanish sintezi turli xil polimer mahsulotlarini ishlab chiqarishi mumkin. Shuning uchun ushbu turdagi reaktsiyalar oddiy shakarlardan murakkab uglevodlarni hosil qiladimi, atsetil-KoA dan yog ' kislotalarini yaratadimi va boshqalarmi guruhlanadi.
Degidratatsiya sintezi jarayoniga nisbatan gidroliz shunchaki teskari hisoblanadi. Suv molekulalari yordamida murakkab molekulalar kichik birliklarga bo'linadi.
• Katta molekulalar suv molekulalari orasidagi bog'lanishni buzish orqali parchalanadi. Bu jarayonda bir komponentga vodorod ioni (H+), ikkinchisiga gidroksid ioni (OH-) qo‘shiladi.
• Suv bo'linganligi sababli, u "gidroliz" deb ataladi, bu so'zma-so'z "suvni ajratish" degan ma'noni anglatadi.
• Gidrolitik reaksiyalarga murakkab qandlar, oqsillar, murakkab yog‘lar va nuklein kislotalarning monosaxaridlar, aminokislotalar, yog‘ kislotalari va nukleotidlarga parchalanishi misol bo‘la oladi.
Gidroliz turlari
Tirik organizmlarda gidrolizning har xil turlari sodir bo'ladi. Quyida keltirilgan uchta tur mavjud:
Bu tuz suvda eriganida sodir bo'ladi. Keyin suv vodorod ionlariga (H+) va gidroksil ionlariga (OH-) aylanadi, chunki tuz kationlar va anionlarga ajraladi. Bronsted-Louri nazariyasiga ko'ra, suv kislota yoki asos sifatida harakat qilishi mumkin. Suv molekulasi proton ehson bo'lsa (h+), suv kislota sifatida harakat deb aytiladi.
Yuqorida aytib o'tilganlarga nisbatan suv molekulasi asos bo'lib xizmat qilishi va molekulalarni gidrolizlashi mumkin. Agar molekula protonni (H+) suvdan qabul qilsa, molekula tayanch vazifasini bajaradi deyiladi.
Avval aytib o'tganimizdek, degidratatsiya gidrolizi to'rtta asosiy makromolekulada xuddi shunday ishlaydi. Quyidagi jadval sizga ularning reaktsiyalarining soddalashtirilgan ko'rinishini beradi:
|
Organik birikma turi |
Jalb qilingan obligatsiya turi |
Degidratatsiya Sintezi |
Gidroliz |
|
Uglevodlar |
Glikozid bog |
Ikki yoki undan ortiq monosaxaridlar birlashtirilgan = disaxarid / polisaxarid + H2O |
Disaxarid / polisaxarid + H2O = monosaxarid birliklari |
|
Oqsillar |
Peptid bond |
Ikki yoki undan ortiq aminokislotalar =dipeptid / oqsil + H2O |
Dipeptid / oqsil + H2O = ikki yoki undan ortiq aminokislotalar |
|
Lipidlar |
Ester bond |
3 yog ' kislotalari + glitserol = Lipid molekulasi |
Lipid molekulasi + 3 H2O = 3 yog ' kislotalari + glitserin |
|
Nuklein kislotalar |
Fosfodiester bog'i |
10 nukleotidlar = nuklein kislota + h2O |
Nuklein kislota + H2o = 10 nukleotidlar |
Agar ko'proq masallarni kerak bo'lsa, quyida bu YouTube video tekshirish mumkin:
Ko'pgina avtotrof organizmlarda kichik molekulalarning uzun zanjirlarini hosil qilish uchun suvsizlanish sintezidan foydalaniladi. Masalan, bu jarayon ortiqcha glyukozani uni konvertatsiya qilish orqali saqlash uchun ishlatiladi glikogen (hayvonlarda uglevodlarni saqlash shakli) yoki kraxmal (uglevodlarni saqlash shakli) o'simliklarda.
· O'simliklarda suvsizlanish sintezining yana bir keng tarqalgan misoli-bu suv molekulasining bo'shashishi natijasida hosil bo'lgan ikkita glyukoza birligining birlashuvidan maltoza (malt shakar) ishlab chiqarish. Uglevodlarning boshqa polimerlari ham shu tarzda hosil bo'ladi.
Boshqa tomondan, geterotrofik (fotosintez qila olmaydigan) organizmlarda ovqatni kichik moddalarga hazm qilish ozuqa moddalarini singdirish va ularni yanada foydali energiya shakliga aylantirish uchun muhimdir. Organizmga biosintezlash uchun energiya kerak bo'lganda, ATP shaklidagi bu energiya gidrolizga uchraydi va undan keyin endi foydalanish mumkin.
· Hayvonlarda ovqat hazm qilish gidrolizning eng keng tarqalgan namunalaridan biridir. Ovqat hazm qilish traktida mavjud bo'lgan turli xil fermentlar tomonidan oziq-ovqat kichik bo'laklarga bo'linadi (gidrolizlanadi). Bunday ingichka ichakda ozuqa moddalarining oson singishi uchun yo'l ochadi.
· Boshqa misollarga yog'ning gidrolizi kiradi, chunki bu ularning oldini olishga yordam beradi ivish tananing turli qismlarida.
Fotosintezni osonlashtiruvchidan molekulyar birikmalarning quruvchisi yoki to'suvchisi bo'lishgacha bo'lgan chanqovni qondiruvchidan tortib, molekulyar darajada suv tirik organizmlar uchun shubhasiz zarurligini ko'rdik. Sizningcha, ushbu birikmaning boshqa qobiliyatlari va ishlatilishi qanday?
Oqsil inson organizmi massasining 25% gacha, quritilgandan keyin esa 45-50% ni tashkil qiladi. Oqsillarning turli a’zo va to‘qimalardagi miqdori turlicha bo‘ladi (1-jadval). Oqsil inson va hayvon organizmlarida quyidagi vazifalarni bajaradi:
10. Strukturali funksiya – barcha to‘qimalar, hujayralar va organoidlar oqsildan tashkil topgan. Bu yerda fibrillar oqsillar (kollagen, keratin, elastin va boshqalar) muhim vazifani bajaradi.
11. Katalitik funksiya – organizmdagi biokatalizatorlar – fermentlar oqsil tabiatiga ega va barcha biokimyoviy reaksiya sodir bo‘lishini boshqaradilar, ya’ni reaksiyalar tezligini ma’lum tartibda borishiga va boshqarilishiga imkon beradi.
12. Energetik funksiya – oqsillar oshqozon ichak traktida parchalanib, oddiy aminokislotalar shaklida so‘riladi. Aminokislotalarning ma’lum qismi oksidlanib energiya hosil qiladi.
13. Transport vazifasi. Oqsillar suvda, qonda yaxshi eriydigan xususiyatga ega va suvda, qonda erimaydigan moddalar bilan kompleks hosil qilib ularning eruvchanligini, tashilishini ta’minlaydi. Masalan: qon plazmasi oqsili albumin yog‘ kislotalar, lipidlar, boshqa oqsillar temir, mis, vitamin, gormonlarni nishon a’zolarga tashiydi.
14. Qisqaruv funksiyasi – mushak oqsillari tarkibiga kiruvchi aktin, miozin, troponinlar qisqaruv qobiliyatiga ega. Bu oqsillar muskullar tarkibiga kirib mexanik ish bajarishda qatnashadi. Qisqarish funksiyasi sitoskelet oqsillariga ham xosdir, ular hujayra hayot faoliyati jarayonlarini (mitoz jarayonida, xromosomalar ajralishida) ta’minlaydi.
15. Himoya funksiyasi. Organizmga tushgan begona oqsillar, viruslar, bakteriyalar toksinlari antigenlar deb hisoblanadi va ularga qarshi himoya oqsillar-antitelolar hosil bo‘lib antigenlar bilan birikib zararsizlantiradi. Qon plazmasidagi fibrinogen va trombin oqsillari qon ivishida ishtirok etib, organizmni turli jarohatlanish sodir bo‘lganda, qon yo‘qotishdan saqlaydi.
16. Tayanch vazifasini bajaradi. Teri, suyak, tirnoq, soch, pay, tog‘ay oqsillardan tashkil topgan bo‘lib, inson tanasida tayanch vazifasini bajaradi.
17. Boshqaruv vazifasi. Ba’zi boshqaruv moddalar – gormonlar oqsil tabiatiga ega. Masalan, insulin gormoni, yuqori biologik aktiv modda bo‘lib, modda almashinuvini boshqaruvida ishtirok etadi.
18. Irsiy vazifasi. Irsiy axborotni saqlovchi xromosomalar murakkab oqsillar nukleoproteidlardan iborat. Shved kimyog‘ari I.Ya.Berselius 1938-yilda azot saqlovchi organik birikmalarni o‘simlik va hayvon to‘qimalaridan ajratib olib, uni proteinlar deb nomlagan (grekcha protos – birlamchi, muhim demakdir). Hozirgi tibbiyot adabiyotlarida azot saqlovchi yuqori molekulli birikmalarni oqsillar deyiladi. Oqsil termini – tuxum oqsilini qizdirilganda oq rang hosil bo‘lishiga asoslangan. Oqsillar har qanday tirik organizm to‘qimasining asosiy qismi hisoblanib, to‘qimada bo‘ladigan turli jarayonlarda muhim ahamiyatga ega. Oqsillar tirik organizmlar ham strukturasi, ham funksiyasining asosini tashkil etadi.
Molekulyarbiologiya asoschilaridan bo‘lgan F.Krikning ta’biri bo‘yicha, oqsillar juda muhim moddalar bo‘lib, turli funksiyalarni juda yengil va nozik bajarishlari mumkin. Tabiatda taxminan 1010-1012 turli oqsillar bo‘lib, 106 turli tirik organizmlar, viruslardan boshlab odamgacha, faoliyatini ta’minlab beradi. Bugungi kunda, ko‘p sondagi tabiiy oqsillardan juda kam qismining tuzilishi va strukturasi aniqdir. Har bir organizm o‘ziga xos oqsillar to‘plami bilan xarakterlanadi. Fenotipik belgilar va funksiyalarning turli-tumanligi bu oqsillarning spetsifikligi, ko‘pchilik holda multimolekulyar strukturaga ega bo‘lishi bilan belgilanadi. biologiya asoschilaridan bo‘lgan F.Krikning ta’biri bo‘yicha, oqsillar juda muhim moddalar bo‘lib, turli funksiyalarni juda yengil va nozik bajarishlari mumkin. Tabiatda taxminan 1010-1012 turli oqsillar bo‘lib, 106 turli tirik organizmlar, viruslardan boshlab odamgacha, faoliyatini ta’minlab beradi. Bugungi kunda, ko‘p sondagi tabiiy oqsillardan juda kam qismining tuzilishi va strukturasi aniqdir. Har bir organizm o‘ziga xos oqsillar to‘plami bilan xarakterlanadi. Fenotipik belgilar va funksiyalarning turli-tumanligi bu oqsillarning spetsifikligi, ko‘pchilik holda multimolekulyar strukturaga ega bo‘lishi bilan belgilanadi.
E.coli hujayrasida 3000 ga yaqin, odam organizmida esa 100000 dan ortiq turli xil oqsillar mavjuddir. Barcha tabiiy oqsillar ko‘p bo‘lmagan oddiy struktur bloklardan tashkil topgan bo‘lib, monomer molekulalar aminokislotalardan iboratdir. Aminokislotalar polipeptid zanjirda bir-biri bilan bog‘langan. Tabiiy oqsillar 20 xil aminokislotalardan tashkil topgan. Bu aminokislotalar turli ketma-ketliklarda bog‘lanishlari mumkin. Shuning uchun ular, juda ko‘p miqdordagi, turli-tuman oqsillarni hosil qiladilar. Ko‘rsatilgan sondagi aminokislotalarni polipeptidda turlicha joylashtirish orqali har xil izomerlarni hosil qilish mumkin. Agar 2 ta aminokislotadan faqat 2 izomer hosil qilish mumkin bo‘lsa, 4 aminokislotadan, nazariy jihatdan, 24 izomer hosil qilish mumkin. DNK molekulasida nukleotidlarning ketma-ket joylashishi sintezlanayotgan oqsil polipeptid zanjiridagi aminokislota qoldiqlarining ketma-ketligini belgilaydi. Hosil bo‘lgan polipeptid zanjiri funksional axborotga ega bo‘lib, unga mos ravishda o‘z-o‘zidan stabil uchlamchi strukturaga ega bo‘ladi. Oqsillarni tabiiy xossalarini (eruvchanlik, elektroforez harakati, fermentativ, gormonal, immunofaollik) turli fizik va kimyoviy ta’sirlar natijasida buzilishiga (yo‘qolishiga) denaturatsiya deyiladi.
Foydalanilgan adabiyotlar
I. O‘zbekiston Respublikasi Qonunlari, Vazirlari Mahkamasi qarorlari, Prezident farmonlari va asarlari.
O‘zbekiston Respublikasining “Servis sohasida”gi qonuni, 25.12.1998 y
O‘zbekiston Respublikasining “Xizmat ko’rstatish” haqidagi qonun, 06.01.2012 y
O‘zbekiston Respublikasi Prezidentining “O‘bekiston Respublikasini yanada rivojlantirish bo‘yicha Harakatlar strategiyasi to‘g‘risida”gi PF-4947-son Farmoni.// “Xalq so‘zi”, 8 fevral 2017 yil
Mirziyoyev Sh.M. Buyuk kelajagimizni mard va olijanob xalqimiz bilan birga quramiz. “O‘zbekiston” NMIU, 2017 – 485 b.
Mirziyoyev Sh.M. Qonun ustuvorligi va inson manfaatlarini ta’minlash yurt taraqqiyoti va xalq farovonligining garovi. “O‘zbekiston” NMIU, 2017. – 47 b.
II. Asosiy adabiyotlar.
1. T.Xudoyshukurov va boshqalar – Ovqatlanish asoslarini tashkil etish
2. T.Xudoyshukurov va boshqalar – Oziq – ovqat kimyosi
3. Kempbell, N. A., va Reece, J. B. (2007). biologiya. Panamerican Medical Ed.
4. Devlin, T. M. (2004). Biokimyo: Klinik qo'llanmalar bilan darslik. Men orqaga qaytdim.
5. Koolman, J., & Röhm, K. H. (2005). Biokimyo: matn va atlas. Panamerican Medical Ed.
6. Melo, V., Ruiz, V. M., va Kuamatzi, O. (2007). Metabolik jarayonlarning biokimyosi. Reverte.
7. Pacheco, D., & Leal, D. P. (2004). Tibbiy biokimyo. Tahririyat Limuzasi.
8. Pena, A., Arroyo, A., Gomes, A. va Tapia, R. (1988). Biokimyo. Tahririyat Limuzasi.
9. Sadava, D., va Purves, W. H. (2009). Hayot: Biologiya fani. Panamerican Medical Ed.
10. Tortora, G. J., Funke, B. R., & Case, C. L. (2007). Mikrobiologiyaga kirish. Panamerican Medical Ed.
11. Voet, D., Voet, J. G., & Pratt, C. W. (2007). Biokimyo asoslari. Panamerican Medical Ed.
III. INTERNET MA’LUMOTLARI:
www.lex.uz
www.stat.uz
www.ziyonet.uz
www.gov.uz
https://uz.denemetr.com/docs/134/index-21811.html
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.