
|
Раздел долгосрочного плана Скорость химической реакции |
Школа: НИШ ХБН г. Атырау |
|||||
|
Дата: |
ФИО учителя: Ким Е.Г. |
|||||
|
Класс: 8 |
Количество |
отсутствующих: |
||||
|
присутствующих: |
||||||
|
Тема урока: Скорость химической реакции с точки зрения теории частиц |
||||||
|
Цели обучения |
- предсказывать факторы, которые могут повлиять на скорость химической реакции, с точки зрения теории частиц |
|||||
|
Цели урока |
Все учащиеся должны: - понимать и объяснять влияние факторов на скорость химической реакции с точки зрения теории частиц Большинство учащихся должны: - уметь объяснять зависимость скорости химической реакции, опираясь на экспериментальные данные и применять для объяснения теорию частиц Некоторые учащиеся должны уметь: - предсказывать факторы (температура, концентрация реагентов, площадь соприкосновения реагентов, природа реагентов, наличие катализатора), которые могут повлиять на скорость реакции |
|||||
|
Критерии успеха |
Учащийся достиг цели обучения, если: - знает и объясняет влияние факторов на скорость химической реакции - приводит примеры для конкретных реакций - может построить график зависимости скорости химической реакции от концентрации и температуры - может интерпретировать график зависимости скорости реакции от изученных факторов и пояснить его теорией частиц |
|||||
|
Языковые цели |
Использовать специфичную лексику, относящуюся к предмету. Предметная лексика и терминология – учащиеся смогут, используя слова и словосочетания для демонстрации своего понимания: скорость реакции, изменение концентрации, изменение температуры, влияние температуры. Используя термины, пояснять процесс: если увеличить температуру, то скорость реакции будет; если измельчить, то…
|
|||||
|
Привитие ценностей |
Обучение на протяжении всей жизни – понимание значимости и важности умения управлять химическими процессами для получения продукта, что в конечном результате приводит к экономическому росту. |
|||||
|
Межпредметные связи |
Математика, физика – решение задач, построение графиков . |
|||||
|
Предварительные знания |
Окисление «медленное» и «быстрое» (7.4А), Применение теории частиц для объяснения протекания химического процесса (7.1С) |
|||||
|
Ход урока |
||||||
|
Организационный момент (1 мин) |
Приветствие. Проверка готовности класса к работе. Определение отсутствующих. |
|||||
|
Задание 1 10 мин опрос с обоснованием теории частиц
|
Деятельность учителя/ученика |
Ресурсы |
||||
|
Проверка усвоения темы прошлого урока T&F по теме «Факторы, влияющие на скорость реакции». 1. Увеличивая концентрацию реагента, можно увеличит скорость реакции + 2. Скорость реакции зависит от концентрации каждого реагента +. 3. На скорость реакции влияет концентрация продукта реакции -. 4. При разбавлении соляной кислоты скорость реакции взаимодействия ее с цинком уменьшается +. 5. Скорость реакции взаимодействия металлов с водой можно увеличить нагревая воду +. 6. Скорость реакции взаимодействия меди с водой можно увеличить, взяв горячую воду - 7. Растворение кальция в воде – мгновенная реакция -. 8. Выпадение осадка гидроксида меди – мгновенная реакция +. 9. Твердые вещества реагируют быстрее при измельчении +. 10. Скорость растворения серебра в соляной кислоте можно увеличить путем измельчения серебра -. Анализ, оценивание правильности ответов и комментарии учителя. |
Карточки «T» & «F» Изучить дидактический материал по теории частиц 15 |
|||||
|
Задание 2 5 мин с Дифференциацией
|
Деятельность учителя/ученика |
Ресурсы |
||||
|
Организует выполнение работы по построению графика на основании экспериментальных данных. Предложить учащимся нарисовать график по полученным результатам и дать объяснения по выполнению данного задания. Приложение 1.
|
Приложение 1. Сильным – 9-12 Средним 6-8 зад |
|||||
|
Задание 3 10 мин |
Деятельность учителя/ученика |
Ресурсы |
||||
|
Организует работу в парах. Решение задач Приложение 2. Дифференцированный подход Подготовка олимпиадников
|
Приложение 2. |
|||||
|
Задаие 4 10 мин
|
Деятельность учителя/ученика |
Ресурсы |
||||
|
Работа с анимацией по ссылке http://www.freezeray.com/chemistry.htm . Учитель демонстрирует учащимся приемы работы с анимацией. Работа с ноутбуками.
|
http://www.freezeray.com/chemistry.htm аннимации Rates of Reactions |
|||||
|
Домашнее задание 2 мин |
Интернет урок http://interneturok.ru/ru/school/chemistry/9-klass/fakultativ/skorost-himicheskih-reaktsiy-laboratornaya-rabota on line тестирование http://www.tutorvista.com/chemistry/animations/factors-affecting-rate-of-reaction-an-activity-animation |
|
Рефлексия занятия (2 мин) |
сегодня я узнал... было трудно… было интересно узнать, что… было интересно узнать, что… меня удивило… |
||
|
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? |
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? |
Здоровье и соблюдение техники безопасности |
|
|
Наиболее способные учащиеся на вводном этапе уроке смогут дать ответы на поставленные вопросы. |
Используйте данный раздел для записи методов, которые Вы будете использовать для оценивания того, чему учащиеся научились во время урока |
Здоровье сберегающие технологии.
|
|
|
Дифференциация урока будет реализована на начальном этапе при проведении мозгового штурма и при выполнении заданий на закрепление материала. |
Оценивание выполняется при комментировании ответов при работе с карточками «T» и «F» |
|
|
|
Рефлексия по уроку |
Используйте данный раздел для размышлений об уроке. Ответьте на самые важные вопросы о Вашем уроке из левой колонки. |
||
|
Были ли цели урока/целиобучения реалистичными? |
|
||
|
Все ли учащиеся достигли ЦО? |
|
||
|
Если нет, то почему? |
|
||
|
Правильно ли проведена дифференциация на уроке? |
|
||
|
Выдержаны ли были временные этапы урока? |
|
||
|
Какие отступления были от плана урока и почему? |
|
||
|
Общая оценка |
|||
|
Какие два аспекта урока прошли хорошо (подумайте, как о преподавании, так и об обучении)? 1. 2. Что могло бы способствовать улучшению урока (подумайте как о преподавании, так и об обучении)? 1. 2. Что я выявил(а) за время урока о классе или достижениях/трудностях отдельных учеников, на что необходимо обратить внимание на последующих уроках? |
|||
Приложение 1
Задание. Ученик исследовал скорость реакции взаимодействия кислоты с содой (гидрокарбонатом натрия) и данные записывал в таблицу. Используя данные таблицы постройте график и сформулируйте правило зависимости скорости от исследуемого фактора.
|
Пробирка |
1 |
2 |
3 |
4 |
5 |
|
Раствор 10г кислота/вода (г/г) |
2 |
4 |
5 |
6 |
8 |
|
Вода |
8 |
6 |
5 |
4 |
2 |
|
Сода (г) |
2 |
2 |
2 |
2 |
2 |
|
Время окончания реакции, (сек) |
120 |
80 |
60 |
40 |
20 |
Приложение 2
Задание 1. Закончите словесно уравнения реакции.
1.1Укажите реакцию, которая будет протекать с большей скоростью.
1.2 Назовите фактор, который в каждой паре увеличивает скорость реакции.
А) Кабронат кальция (порошок)+ соляная кислота (5%)
Карбонат кальция (порошок) + соляная кислота (10%)
____________________________________________________________________
В) Цинк (гранула) + соляная кислота (10%)
Цинк (пыль) + соляная кислота (10%)
________________________________________________________________________
С) натрий + вода
цинк + вода
__________________________________________________________________________
D) железо + серная кислота t
железо + серная кислота
___________________________________________________________________________
Задание 2. Как можно объяснить, что между твердыми веществами нитратом серебра (AgNO3) и хлоридом натрия (NaCl) реакция не идет, а сливая растворы этих веществ, мы наблюдаем мгновенное образование в растворе белого осадка.
Задание 3. Смесь опилок железа и серы может долгое время оставаться без изменений. Но при нагревании этой смеси мы получим новое соединение – сульфид железа. Запишите словесное уравнение реакции. Объясните явление.
Задание 4.
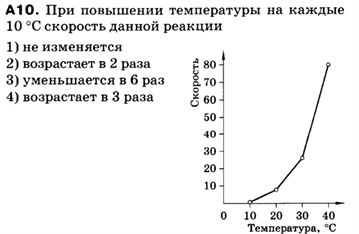
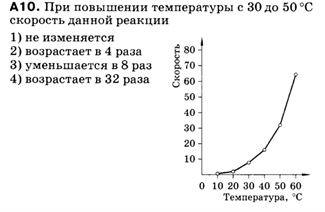
Задание 5.

. 
Задание 6. Если внести на железной ложечке уголек в пламя горелки и, когда уголек раскалится, вынуть его из пламени и подержать на воздухе, то он некоторое время тлеет, а потом гаснет. На воздухе уголь горит плохо. Если вновь раскаленный уголек внести в банку с кислородом, то он раскаляется добела и горит без пламени и дыма, постепенно уменьшаясь в размерах. Дайте теоретическое обоснование описанным выше наблюдениям. Как изменится скорость горения уголька, если его перед сжиганием мелко измельчить? Дайте полное объяснение процессу.
Задание 7. В стакан с медной стружкой ученик налил раствор азотной кислоты, поставил его на весы и полученные данные записал в таблицу.
|
Время / мин |
Масса стакана с содержимым / г |
|
0.0 |
200.00 |
|
1.0 |
197.50 |
|
2.0 |
195.45 |
|
3.0 |
193.55 |
|
4.0 |
191.70 |
|
5.0 |
189.90 |
|
6.0 |
188.15 |
|
7.0 |
186.45 |
|
8.0 |
184.80 |
Используя эти данные:
А) Вычислите среднюю скорость реакции в промежутке времени от 2 до 6 мин.
В) Определите массу выделившегося газа в первые 5 минут.
Задание 8. Используя табличные данные, вычислите среднюю скорость реакции для каждого временного интервала. Постройте график зависимости концентрации от времени и по нему определите скорость реакции при 600-ой секунде
|
Время, с |
Концентрация соляной кислоты, моль/л |
Средняя скорость, моль/л |
|
0.0 |
0.1000 |
|
|
50.0 |
0.0905 |
|
|
100.0 |
0.0820 |
|
|
150.0 |
0.0741 |
|
|
200.0 |
0.0671 |
|
|
300.0 |
0.0549 |
|
|
400.0 |
0.0448 |
|
|
500.0 |
0.0368 |
|
|
800.0 |
0.0200 |
|
|
1000.0 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Задание 9. Рассмотрите скорость следующей реакции:
Железо + соляная кислота = хлорид железа (2+) + водород
А) Зависит ли скорость этой реакции от температуры? Почему? Теория частиц
В) Зависит ли скорость этой реакции от давлении? Почему? Теория састиц
С) Зависит ли скорость этой реакции от размера частиц? Почему? Теория частиц
Задание 10. Рассмотрите скорость следующей реакции:
Гипохлорит(р-р) = хлорид натрия(р-р) + кислород(г)
А) Зависит ли скорость этой реакции от температуры? Почему?
В) Зависит ли скорость этой реакции от давлении? Почему?
С) Зависит ли скорость этой реакции от размера частиц? Почему?
D) Зависит ли скорость этой реакции от концентрации гипохлорита натрия? Почему?
Задание 11. При взаимодействии мрамора с соляной кислотой выделяется
углекислый газ.
А) В каком виде необходимо взять карбонат кальция, чтобы увеличить скорость
реакции? Почему?
В) Определите по графику сколько времени нужно для полного расхода реагентов.
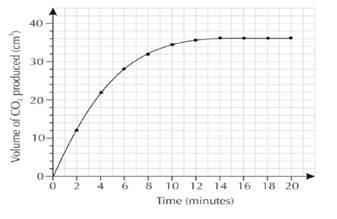
С) Вычислите и объясните скорость реакции в начале 2 минуты.
Задание 12. Реакция сгорания серы протекает согласно уравнению:
Сера + Кислород = Оксид серы(IV).
Исходные концентрация кислорода – 2,5 моль/л. Определите среднюю скорость реакции, если через 20 мин концентрация кислорода снизилась до 2,1 моль/л.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.