
Понятие об адиабатном процессе. Законы термодинамики.
Применение первого закона ТД к изопроцессам. Графическая интерпретация работы газа
Адиабатный процесс – процесс, протекающий в теплоизолированной системе. То есть без подвода газу или выделения газом теплоты.
Так как: ![]()
Первый закон термодинамики
приобретает вид: ![]() или
или
![]() ;
;
![]()
То есть в результате выполнения над газом работы внешними силами его внутренняя энергия, а следовательно, и температура увеличивается, а при выполнении работы газом – уменьшается.
Наглядными примерами последних двух утверждений являются следующие опыты.
1. В закрытом подвижным поршнем цилиндре находится небольшое количество топлива. После быстрого нажатия на поршень топливо воспламеняется.
2. В
закрытом пробкой с продетым шлангом насоса сосуде находится небольшое
количество воды. После нагнетания в сосуд определенно количества воздуха,
пробка быстро вылетает и в сосуде наблюдается туман (рис. 1).

Рис. 1. Наглядные примеры адиабатных процессов (Источник)
В двух случаях газ выполняет разные по знаку работы, и, следовательно, изменение внутренней энергии и температуры имеет разные знаки. В обоих случаях делается акцент на быстром изменении объёма потому, что невозможно создать идеально изолированную систему, но если рассматривать очень скоротечный процесс, то тепло не успеет передаться, и процесс можно считать адиабатным.
График адиабатных процессов в координатах P-V выглядит следующим образом (рис. 2).
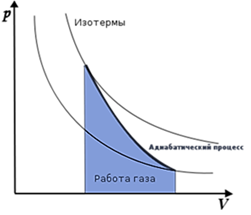
Рис. 2. График адиабатного процесса
Название «термодинамика» можно трактовать как «превращение энергии». Поэтому понятно, что основной закон, который работает в термодинамике, – это закон сохранения энергии.
Закон сохранения энергии гласит: энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы в другую.
А теперь обратимся к термодинамической формулировке закона сохранения энергии. Он называется первым законом термодинамики. Любое тело (система тел) обладает внутренней энергией. Если тело участвует в некотором процессе, где происходит передача тепла и/или совершается работа, внутренняя энергия тела может измениться. При анализе таких процессов важно учитывать знаки количества теплоты и работы. Эти знаки зависят от направления передачи тепла (от тела к среде или наоборот) и от того, что (давление газа или внешняя сила) совершает работу.
Первый закон термодинамики: если
при переходе системы из одного состояния в другое ее внутренняя энергия
изменяется от некоторого начального значения ![]() до конечного
до конечного ![]() , то изменение внутренней
энергии
, то изменение внутренней
энергии ![]() равно сумме работы внешних
сил и количества теплоты, переданного системе:
равно сумме работы внешних
сил и количества теплоты, переданного системе: ![]() .
.
Этот же закон можно записать в другом виде.
Перенесем ![]() в
левую часть уравнения, поменяв знак:
в
левую часть уравнения, поменяв знак: ![]() .
Мы уже сказали, что
.
Мы уже сказали, что ![]() :
работа газа равна работе, совершенной над газом, взятой с противоположным
знаком. Тогда запишем:
:
работа газа равна работе, совершенной над газом, взятой с противоположным
знаком. Тогда запишем: ![]() .
.
При переходе системы из одного
состояния в другое количество теплоты ![]() , переданное системе, затрачивается
на изменение внутренней энергии системы
, переданное системе, затрачивается
на изменение внутренней энергии системы ![]() и выполнение газом
работы
и выполнение газом
работы ![]() .
.
Заметим, что внутренняя энергия, количество теплоты, работа измеряются в одинаковых (энергетических) единицах – джоулях – и равноправно входят в первый закон термодинамики. Однако между ними есть принципиальная разница.
Внутренняя энергия – это так называемая функция состояния системы.
Каждое тело обладает внутренней
энергией, однозначно определяемой состоянием, т.е. набором макропараметров
состояния (![]() и
т.п.). Так, внутренняя энергия разреженного газа
и
т.п.). Так, внутренняя энергия разреженного газа ![]() является
функцией температуры
является
функцией температуры ![]() ,
для более плотного газа
,
для более плотного газа ![]() и
пр.
и
пр.
Работа и количество теплоты
функциями состояния не являются: нельзя говорить, что тело в данном состоянии
содержит столько-то теплоты или работы. ![]() и
и ![]() –
это характеристики процесса изменения внутренней энергии.
–
это характеристики процесса изменения внутренней энергии.
![]() определяет изменение
внутренней энергии за счет теплопереноса, а
определяет изменение
внутренней энергии за счет теплопереноса, а ![]() –
за счет совершения механической работы.
–
за счет совершения механической работы.
Мы рассматривали три способа перехода газа из одного состояния в другое: изобарный, изотермический и изохорный процессы. Прежде, чем применять первый закон термодинамики к конкретным процессам в идеальном газе, рассмотрим второй закон термодинамики.
Второй закон термодинамики
Закон сохранения энергии утверждает, что энергия сохраняется при любых ее превращениях. Для тепловых процессов этот закон формулируется как первый закон термодинамики. Энергия не может появиться ниоткуда. Если энергия тела изменяется, то только за счет изменения энергии другого тела и/или совершения работы. Однако не все допустимые с точки зрения сохранения энергии процессы могут осуществляться в природе.
Нагретое тело передает часть
внутренней энергии окружающим более холодным телам. В силу первого закона
термодинамики внутренняя энергия рассматриваемой теплоизолированной системы тел
сохраняется. Обратный процесс передачи энергии от холодного тела горячему
первому закону термодинамики не противоречит. Однако никогда не протекает
самопроизвольно. Например, представим, что мы могли бы нагреть руки от холодной
батареи. С точки зрения энергии внутренняя энергия наших рук увеличилась бы
на ![]() :
: ![]() .
При этом по закону сохранения энергии внутренняя энергия батареи уменьшится на
ту же величину (
.
При этом по закону сохранения энергии внутренняя энергия батареи уменьшится на
ту же величину (![]() )
и батарея станет еще более холодной. Закон сохранения не нарушается, однако мы
хорошо знаем, что такой процесс невозможен.
)
и батарея станет еще более холодной. Закон сохранения не нарушается, однако мы
хорошо знаем, что такой процесс невозможен.
Возможные направления тепловых процессов указывает второй закон термодинамики. Он был установлен экспериментально и доказан методами молекулярно-кинетической теории. Одна из возможных формулировок второго закона термодинамики звучит так: невозможно перевести тепло от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или в окружающих телах.
Но мы ведь знаем такие приборы, как холодильник или кондиционер, которые охлаждают холодные предметы, забирая у них тепло и передавая его более нагретым телам. Действие этих бытовых приборов не противоречит второму закону термодинамики (и первому тоже). Дело в том, что такая необычная передача тепла связана с изменениями в окружающих телах: охлаждение достигается за счет работы внешних устройств.
Итак, второй закон термодинамики утверждает, что все тепловые процессы самопроизвольно протекают в одном определенном направлении. Они необратимы.
Замечание
Законы термодинамики верны не только для газа. Мы сейчас рассматривали их в основном для газообразных тел только потому, что имеем для них хорошую физическую модель – идеальный газ. Эта модель позволила нам найти уравнение состояния газа, выражение для внутренней энергии и пр.
Для жидкостей и твердых тел в общем виде законы термодинамики полностью применимы, вся сложность в том, что выражения для внутренней энергии, уравнения состояния и т.п. значительно сложнее, чем для газа. Но сами законы термодинамики выглядят так же и означают то же.
С помощью первого закона термодинамики можно делать важные заключения о характере протекающих процессов. Рассмотрим различные процессы, при которых одна из физических величин, характеризующих состояние газа, остаётся неизменной (то есть изопроцессы). Естественно, что для простоты мы будем считать газ идеальным одноатомным.
Пусть газ находится
в цилиндрическом сосуде, закрытом неподвижным поршнем. Что произойдёт,
если мы начнём подводить теплоту к газу? Если пренебречь тепловым
расширением сосуда, то объём газа остаётся практически неизменным, хотя
давление газа увеличивается. Следовательно, работа силы давления газа равна
нулю. А это, согласно первому закону термодинамики, означает, что при
изохорном процессе всё передаваемое газу количество теплоты идёт на увеличение
его внутренней энергии: ![]()
Очевидно, что если теплота отводится от газа, то изменение внутренней энергии отрицательно и внутренняя энергия газа уменьшается.

Изменение внутренней энергии
идеального одноатомного газа прямо пропорционально изменению его абсолютной
температуры и не зависит от других макроскопических параметров
системы: ![]()
Следовательно, при изохорном
процессе количество теплоты также пропорционально изменению абсолютной
температуры: ![]()
С другой же стороны,
количество теплоты, переданное термодинамической системе, прямо пропорционально
её массе и изменению абсолютной температуры: ![]()
В записанной
формуле cV — это удельная теплоёмкость газа при
постоянном объёме. Давайте подставим записанное уравнение в предыдущую
формулу: ![]()
Сократив полученное выражение
на массу газа и изменение его температуры, получим, что удельная
теплоёмкость газа при изохорном процессе обратно пропорциональна его молярной
массе: ![]()
Теперь предположим, что наш сосуд с газом под поршнем находится в термостате (напомним, что это устройство, в котором поддерживается постоянная температура). Если теперь, например, мы с помощью внешнего устройства начнём медленно перемещать поршень в сосуде так, чтобы объём газа увеличивался, то работа силы давления расширяющегося газа будет положительной. При одинаковой первоначальной температуре термостата и газа теплопередачи не происходит. Положительная работа силы давления расширяющегося газа совершается за счёт уменьшения его внутренней энергии, а значит, и температуры. Но как только температура газа начинает уменьшаться, тут же возникает теплопередача от термостата газу. При медленном перемещении поршня в сосуде температура газа успевает выровняться, а реально происходящий процесс близок к изотермическому.
Значит, и внутренняя
энергия идеального одноатомного газа остаётся постоянной,
а её изменение равно нулю: ![]()
Отсюда следует, что при
изотермическом процессе всё подведённое к газу количество теплоты идёт
на совершение газом работы: ![]()
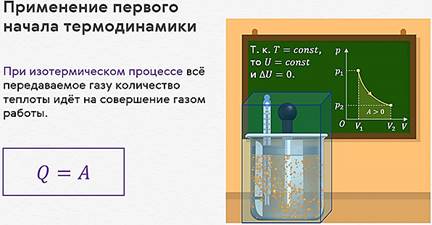
Если же внешнее устройство обеспечивает медленное уменьшение объёма газа в сосуде, то работа газа будет отрицательной. А это приводит к увеличению внутренней энергии и, следовательно, температуры газа. В результате возникает теплопередача от газа термостату.
Что касается теплоёмкости газа
при изотермическом процессе, то она стремится к бесконечности
(предлагаем вам самостоятельно доказать это): ![]()
Теперь предположим, что наш
газ находится в цилиндрическом сосуде, закрытом поршнем, который может
свободно перемещаться. Будем изобарно нагревать газ (напомним, что изобарный
процесс — это процесс, протекающий при постоянном давлении). Очевидно, что
в этом случае газ будет нагреваться, расширяться и совершать работу,
то есть будет изменяться его внутренняя энергия. Следовательно, при
изобарном процессе подведённое к газу количество теплоты частично
расходуется на увеличение внутренней энергии системы и частично
на совершение работы силой давления газа при его расширении: ![]()

Распишем величины, входящие
в формулу, согласно их определению: 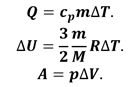
Величина cp — это удельная теплоёмкость газа при постоянном давлении.
Преобразуем формулу для работы
газа. Для этого запишем уравнение Клапейрона — Менделеева для двух его
состояний (а мы вправе это сделать, так как масса газа и его
химический состав в ходе процесса не изменялись): 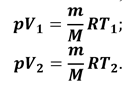
Теперь вычтем из второго
уравнения первое: ![]()
Сравнивая последнее уравнение
с формулой для работы, находим, что работа газа прямо пропорциональна
изменению его абсолютной температуры: ![]()
Перепишем первое начало термодинамики для изобарного процесса с учётом наших рассуждений:

Полученное равенство разделим
на массу газа и изменение его температуры: ![]()
Сравнивая полученное равенство
с выражением для удельной теплоёмкости газа при постоянном объёме, видим,
что удельная теплоёмкость газа при постоянном давлении всегда больше его
удельной теплоёмкости при постоянном объёме: ![]()
Это объясняется тем, что при постоянном давлении часть подводимой энергии расходуется на совершение силой давления газа работы при расширении.
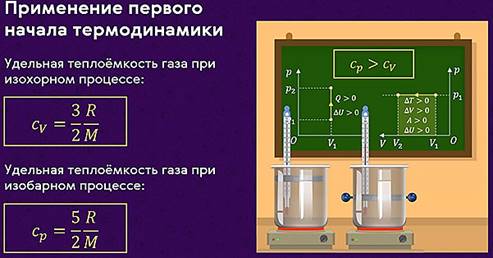
Расширение жидких и твёрдых тел при нагревании при постоянном давлении значительно меньше, чем газов. Поэтому их работа при расширении намного меньше, чем изменение внутренней энергии. Следовательно, их удельные теплоёмкости слабо зависят от характера процесса (ср ≈ сV).
Если бы мы смогли теплоизолировать цилиндр с газом и предоставили ему возможность самопроизвольно расширяться. Очевидно, что при этом газ будет совершать положительную работу. Но за счёт чего? Ведь теплообмен с окружающей средой отсутствует, то есть теплота не подводится (Q = 0).
Процесс, протекающий без теплообмена термодинамической системы с окружающей средой, называется адиабатным процессом.
Из первого закона
термодинамики следует, что работа газа при адиабатном процессе
совершаться только за счёт убыли его внутренней энергии: ![]()
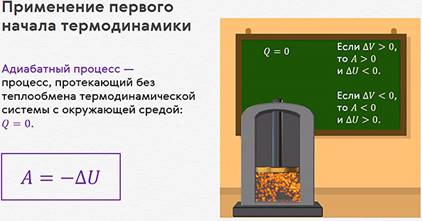
Таким образом, при адиабатном
расширении газ совершает работу и сам охлаждается. И наоборот, при
адиабатном сжатии работа совершается над газом и он нагревается.
А так как при адиабатном процессе количество теплоты равно нулю,
то и удельная теплоёмкость газа также равна нулю: ![]()
На практике адиабатный процесс осуществляется главным образом не за счёт теплоизоляции (нельзя окружить систему оболочкой, которая абсолютно не допускает теплопередачи), а за счёт скорости протекания процесса. Например, когда вы открываете охлаждённую газировку, то можете заметить облачко тумана, которое растекается из горлышка бутылки. Объясняется это тем, что при адиабатном расширении происходит уменьшение температуры газа и, как следствие, происходит конденсация пара.
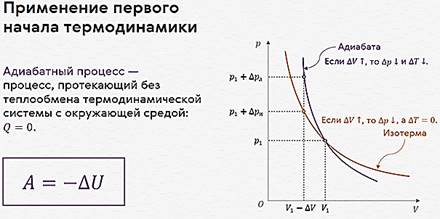
Адиабатный процесс, как и все изопроцессы, можно наглядно представить в виде графика зависимости давления газа от его объёма.
График адиабатного процесса в координатах (p, V), называется адиабатой.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.