
Практическая работа
Тема: Составление уравнений диссоциации электролитов, входящих в состав живых организмов.
Цели: повторить составление уравнений диссоциации электролитов, входящих в состав живых организмов.
Ход работы
I. Опорная информация для повторения или изучения.
Теория электролитической диссоциации.
Для объяснения особенностей водных растворов электролитов шведским ученым С.Аррениусом в 1887 г. была предложена теория электролитической диссоциации.
В дальнейшем она была развита многими учеными на основе учения о строении атомов и химической связи.
Современное содержание этой теории можно свести к следующим трем положениям:
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы -
положительные и отрицательные.
Они могут состоять из одного атома - это простые ионы (Na+, Mg2+, Аl3+ и т.д.) -
или из нескольких атомов - это сложные ионы (NО3-, SO2-4, РОЗ-4и т.д.).
2. Под действием электрического тока ионы приобретают направленное движение:
положительно заряженные ионы движутся к катоду, отрицательно заряженные - к аноду.
Поэтому первые называются катионами, вторые - анионами.
3. Диссоциация - обратимый процесс: параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов (ассоциация).
Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.
Основания – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид анионов – гидроксид-анионы OH–:
КОН = К+ + OH–
Са(ОН)2 = Са2+ + 2 OH–
Кислоты – это электролиты, в результате диссоциации которых в водных растворах образуется только один вид катионов – катионы водорода Н+ (точнее – катионы гидроксония H3O+).
Катион гидроксония образуется при взаимодействии Н+ с молекулой H2O. В результате образуется ещё одна ковалентная связь кислорода с водородом по донорно-акцепторному механизму:
Н+ + H2O = H3O+
Примеры диссоциации кислот:
НCl = Н+ + Cl– или НCl
+ H2O = H3O+ + Cl–
НСlO4 = Н+ + СlO4– или
НСlO4 + H2O = H3O+ + СlO4–
Многоосновные кислоты диссоциируют ступенчато: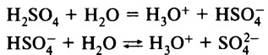
Суммарное уравнение: H2SO4 + 2Н2О = 2H3O+ + SO4
Соли – это электролиты, диссоциирующие в водном растворе на катионы металлов и анионы кислотного остатка.
Средние соли диссоциируют с образованием только катионов
металла и анионов кислотного остатка. 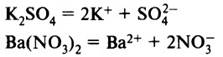
II. Задания для самостоятельного выполнения письменно.
1.Распределите вещества по группам
А. Кислоты, Б. Основания, В. Соли
Ca(OH)2; СаСl2KOH,; Н2S; HNO3; КNO3 NaOH; Аl(NO3)3; НСl
2.Назовите одним словом:
а) НВr; НСl; НNO3; Н3РО4; б) SO42-; Сl-; NO3-; РО43- в) К+; Са2+; Mg2+; Аl3+
3. Напишите уравнения диссоциации следующих веществ: Na2CO3, CaCl2, KOH
4.Дайте ответы на вопросы:
1. Положительно заряженный электрод -
2. Отрицательно заряженный электрод –
3 Направленное движение заряженных частиц -
4. Положительно заряженные частицы –
5.Отрицательно заряженные частицы –
6. Вещества, водные растворы или расплавы которых проводят электрический ток
7. Процесс распада электролита на ионы при растворении или расплавлении вещества
Сделать вывод по работе.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.