Данная презентация разработана для проведения открытого урока по предмету химия по теме " Щелочные металлы". Цель урока - изучить нахождение в природе, свойства и применение щелочных металлов. Тип проведения урока " научно- исследовательский институт". В презентации по шагово изложен весь материал по данной теме. Разработаны слайды с маршрутными картами для выполнения заданий. В конце презентации находятся слайды для закрепления пройденного материала. Данная презентация полностью соответствует выбранной теме и в полном объеме отражает материал. Может быть рекомендована в качестве материала , как для проведения учебного урока, так для открытого урока.презентация " Щелочные металлы"
ОТКРЫТЫЙ УРОК ПО ХИМИИ ПО ТЕМЕ
« ЩЕЛОЧНЫЕ МЕТАЛЛЫ»
Разработал: преподаватель первой категории, к.т.н.
Соболева Алена Алексеевна
2017 год
1
Первый слог – предлог
известный,
Слог второй трудней найти:
Часть его составит цифра,
К ней добавьте букву «Й».
Чтобы целое узнать,
Надо вам металл назвать …
Я растворчик изучал.
Лакмус в нем синее стал.
Поглощал раствор тотчас
Кислый углекислый газ!
Про такой раствор я знаю,
Что среда в нем …
3
Фрайци
й
Fr
Цезий
Cs
Лити
й
Li
Рубидий
Rb
Натрий
Na
Калий
K
4
План занятия
1 .Организационный момент (3 мин);
2. Определение темы студентами( 3 мин);
3. Постановка цели и задач (3 мин);
4.Самостоятельная работа: Ролевая игра
«Независимое расследование» (17 мин);
5. Выступления с сообщениями по блокам:
обобщение пройденного материала,
составление карты расследования (34 мин);
6. Закрепление материала с помощью тестов
(15 мин);
7. Подведение итогов, домашнее задание (5
5
мин).
Карта расследования
История
Геология
Биология
Физика
Химия
Применен
ие
6
История открытия
(камней);
название
назвать
предложил
Литий был открыт в 1817 г. А.
Арфведсоном
в минерале петалите.
Берцелиус
ее
литионом (Lithion), поскольку эта щелочь
впервые была найдена
"царстве
минералов"
это
произведено от греч.- камень. Натрий (от
англ. и франц. Sodium, нем. Natrium от
древнеевр. neter — бурлящее вещество. В
1807 г. Г.Дэви получил свободный металл
- натрий, назвав его содий (Sodium). В
следующем году Гильберт предложил
именовать новый металл натронием;
Берцелиус сократил последнее название
до "натрий" (Natrium).
в
Арфведсон
Юхан
Август
Гемфри Дэви
7
Калий (англ. Potassium, франц.
Potassium, нем. Kalium) открыл в 1807
Г.Дэви, который именовал новый
металл потассием (Potassium), но это
название не прижилось. Крестным
отцом металла оказался Гильберт,
предложивший название "калий"; оно
было принято в Германии и России.
При спектроскопическом анализе
минерала лепидолит и обнаружились
две новые красные линии в красной
части спектра. Эти линии Р. Бунзен и
Г.Кирхгофф правильно отнесли к
новому металлу, который назвали
рубидием (лат. rubidus - красный) из-
за цвета его спектральных линий.
Гемфри
Дэви
Роберт Вильгельм
Бунзен
8
Цезий (англ. Cesium, франц.
Cesium, нем. Caesium) - первый
элемент, открытый с помощью
спектрального анализа Р.Бунзеном
и Г.Кирхгоффом Р.Бунзен назвал
вновь открытый металл цезием
(Casium) от лат. caesius - голубой,
светло-серый.
Этот элемент был предсказан
Д.И.Менделеевым
(как Эка-
цезий), и был открыт (по его
радиоактивности)
г.
сотрудницей
Маргаритой Пере,
Института радия в Париже с
порядковым номером Z = 87 и
периодом полураспада 21 мин. Она
же дала ему в 1964 г. название в
честь своей родины – франций.
1939
в
9
Густав Роберт
Кирхгоф
ПЕРЕ
Маргарита
Сподуменн
Натрий
литиевых
образом
связаны
—
рассолы
Литий Месторождения литиевых минералов
с
главным
редкометалльными
гранитными
включениями, в числе которых есть и
литий. Другой тип месторождений
лития
некоторых
сильносоленых озёр. Наиболее крупные
разведанные
месторождения
руд
промышленных
находятся в России, Канаде, США,
Мексике, Чили, Зимбабве, Бразилии и
Намибии. Мировое производство этого
металла – около 39000 тонн в год. В
природе хлорид натрия встречается в
виде минерала
который
соли.
образует
Запасы
не
ограничены.
озёрных
11
месторождений России крупнейшие —
галита,
каменной
практически
залежи
натрия
Галит
Среди
Сильвин
Цезий
Калий Калий по распространенности в
земной коре занимает 7-е место.
Главные
минералы: сильвин, карналлит ,
каинит. Месторождения осадочного
происхождения находятся в
бассейнах: Верхнекамский
(Российская Федерация),
Прикарпатский (Украина), Припятский
(Белоруссия), Верхнерейнский
(Франция, Германия) и др. Мировые
запасы огромны, около 50 млрд. тонн.
Минералы цезия- поллуцит и редкий
авогадрит . Цезий присутствует в виде
примеси в богатых калием
алюмосиликатах. По добыче цезиевой
руды(поллуцита) лидирует Канада.
Поллуцит добывается в Намибии и
12
Зимбабве. В России его мощные
поллуцит
содержание
- микроэлемент,
Литий
в
организме человека около 70 мг. Соединения
лития у высших животных концентрируется в
печени, почках, селезенке, легких, крови,
молоке. Биологическая роль лития как
микроэлемента пока до конца не выяснена.
Натрий – основной внеклеточный ион. В
организме человека находится натрий в виде
его растворимых солей, главным образом:
хлорид натрия – NaCl, гидрокарбонат натрия –
NaHCO3. Натрий распределен по всему
крови,
спинномозговой жидкости, пищеварительных
соках, желчи, почках, коже, костной ткани,
легких, мозге.
сыворотке
организму:
в
14
общего
жидкости.
количества
Калий содержится в человеческом организме
(140г). Из
калия,
содержащегося в организме, 98% находится
внутри клеток и лишь около 2%
- во
внеклеточной
Калий
распространен по всему организму. Его
топография: печень, почки, сердце, костная
ткань, мышцы, кровь, мозг и т. д. Рубидий
содержится в морских водорослях, чае, кофе,
сахарном тростнике и табаке. Среднее
содержание в организме человека – 680 мг.
Суточная потребность организма: 1,5 – 6 мг.
Рубидий и цезий близки к калию, поэтому в
живых организмах ведут себя сходным
образом. При отравлении солями рубидия в
15
организм вводят соли калия.
Цезий содержится в человеческом организме,
золотисто-желтый
В виде простых веществ - мягкие,
серебристо белые металлы, цезий
имеет
цвет.
Плотности лития, натрия и калия
меньше плотности воды ( 1 г/см3),
плавно
температура
уменьшается от лития (180 С) к
цезию (28 С). Так же изменятся и
температура кипения - от 1337 С у
лития до 668 С у цезия. Твердость
щелочных металлов мала - они легко
16
режутся ножом.
плавления
Простые вещества-металлы,
при обычных условиях
представляют собой
твердые кристаллические
вещества. В узлах
кристаллической решетки
металлов находятся
положительные ионы и
атомы металлов, а между
узлами электроны. Эти
электроны могут свободно
перемещаться по всей
кристаллической решетке.
Связь в кристаллической
решетке металлов
17
называется металлической.
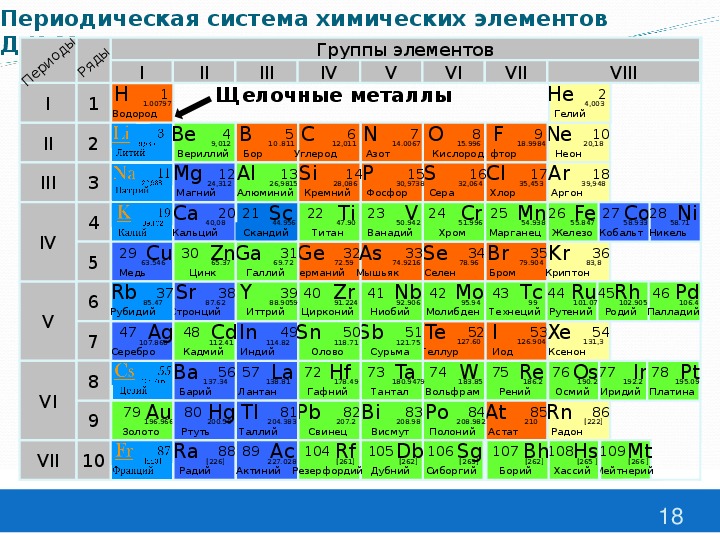
Периодическая система химических элементов
Д.И.Менделеева
Периоды
II
Группы элементов
IV
VII
III
V
I
11.00797
H
Водород
Cu
29 63.546
Медь
Rb
37
85.47
Рубидий
Ag
47
Серебро
107.868
Au
79 196.966
Золото
Ряды
1
2
3
4
5
6
7
8
9
10
I
II
III
IV
V
VI
VII
Гелий
Сера
Хром
фтор
Неон
Бор
Углерод
Азот
24,312
Магний
VIII
VI
He
Щелочные металлы
24,003
C
N
F
O
Ne
В
49,012
612,011
714.0067
918.9984
815.996
1020,18
510 .811
Вериллий
Кислород
Si
P
Cl
S
Ar
Al
1428,086
12
1530,9738
1632,064
1839,948
13
1735,453
26,9815
Кремний
Фосфор
Хлор
Аргон
Алюминий
27 58.933 Ni
Ti
V
24 51.996 Mn
Cr
Fe
Sс
22 47.90
23 50.942
25 54.938
26 55.847
21 44.956
28 58.71
Кобальт
Марганец
Ванадий
Титан
Железо
Скандий
Никель
Br
Se
As
Kr
Ga
Ge
3683,8
3478.96
3374.9216
3579.904
3169.72
3272.59
Селен
Бром
Криптон
Германий
Nb
Zr
Tс
Mo
Ru
Y
39
41
40
42
43
45
44
95.94
99
101.07
91.224
Иттрий
Ниобий
Цирконий
Технеций
Молибден
Рутений
Родий
In
Sn
Te
I
Xe
Sb
50
49
51
52127.60
53126.904
54131,3
118.71
114.82
121.75
Олово
Сурьма
Теллур
Иод
Ксенон
Индий
La
Hf
Ta
W
Re
Ir
Os
72
73
74
75
76
77
57
192.2
183.85
Лантан
Гафний
Тантал
Вольфрам
Рений
Осмий
Иридий
82207.2 Bi
Pb
85210 Rn
At
Po
Tl
81204.383
83208.98
84208.982
86[222]
Висмут
Радон
Полоний
Таллий
Астат
Свинец
Rf
Db
Sg
Bh
Ac
Hs
106 [263]
107 [262]
89 227.028
108 [265 ]
104 [261]
105 [262]
Сиборгий
Борий
Актиний
Хассий
Дубний
Резерфордий
Be
Mg
Ca
2040,08
Кальций
Zn
30 65.37
Цинк
Sr
38
Cd
48
Кадмий
Ba
56
137.34
Барий
Hg
80 200.59
Ртуть
Ra
88
Mt
109 [266 ]
Мейтнерий
46
106.4
Палладий
Pt
78
195.09
Платина
Rh
Co
[226]
Радий
178.49
180.9479
186.2
190.2
Pd
87.62
Стронций
Мышьяк
88.9059
92.906
Галлий
112.41
138.81
102.905
18
Периоды
I
II
III
IV
V
VI
VII
Ряды
1
2
3
4
5
6
7
8
9
10
I
II
Литий
Li
Na
K
Калий
36,939
11
22,989
19
39.102
Натрий
8
Группы элементов
IV
VI
VII
VIII
III
V
Щелочные
металлы
В главной подгруппе:
Число электронов на внешнем
слое
не изменяется
Rb
85.47
Рубидий
37
Cs
Цезий
55
132.905
Fr
[223]
Франций
87
Радиус атома увеличивается
Электроотрицательность
уменьшается
Восстановительные свойства
усиливаются
Металлические свойства
усиливаются
19
Электронное строение
атомов
20
Химические свойства
Щелочные металлы – это самые активные металлы и
восстановители. Во всех химических реакциях они легко
отдают электроны и превращаются в положительно
заряженные ионы. В соединениях преобладает ионная
связь.
1) Взаимодействие натрия с кислородом.
Литий образует нормальный оксид при сгорании на
воздухе, остальные щелочные металлы образуют
пероксиды:
2Li + О2 = Li2О
2Na +О2 = Na2 О2
21
Химические свойства
2)Взаимодействие с другими окислителями –
водородом, галогенами, серой:
2Na +Н2 = 2NaН ( гидрид натрия)
2Na +Сl2 = 2NaСl (хлорид натрия)
2Na + S = Na2S ( сульфид натрия)
3) Взаимодействие с водой:
Щелочные металлы бурно взаимодействуют с водой с
образованием щелочи и выделением водорода.
2Na + 2Н2О = 2NaОН + Н2↑
4) Взаимодействие с кислотами:
2Na + 2НCl = 2NaCl + Н2↑
22
Качественное определение
щелочных металлов
распознавания
соединений щелочных
Для
металлов по окраске пламени исследуемое
вещество вносится в пламя горелки на кончике
железной проволоки.
Li+ - карминово-красный K+ -
фиолетовый
Cs+ - фиолетово-синий Na+ - желтый
Rb + - красный
Li+ Na+
K+
23
Применение щелочных
Химические
источники
тока
металлов
Литий
Для
получения
трития
Получение
сплавов для
подшипнико
в
Пиротехника
Восстановите
ль
в
органическо
м синтезе
24
Калийные
удобрения
гальванотехник
В
е
Теплоносите
ль в
ядерных
реакторах
Калий
Термическое
получение
металлов
Для получения
перекиси калия
Катализатор
26
Физические свойства щелочных
металлов
-
Все
щелочные
блеском.
серебристо-желтого цвета,
Щелочные металлы - серебристо–белые вещества, за
исключением цезия
с
металлическим
металлы
характеризуются малой плотностью, малой твердостью,
низкими температурами плавления и кипения и хорошей
электропроводностью. Благодаря малой плотности Li, Na и
К всплывают на воде (Li–даже на керосине). Щелочные
металлы легко режутся ножом. Несветящееся пламя
газовой горелки щелочные металлы и их летучие соединения
окрашивают в характерные цвета: Li – в карминово–
красный, ,Na – в желтый, К – фиолетовый ,
Rb - красный и Cs – в фиолетово-синий.
29
Тест «Щелочные металлы»
1. Предложил назвать калий от арабского «алкали» щелочь
Г.Деви
2. В ряду от лития к францию атомный радиус:
увеличивается
3. Степень окисления щелочных металлов равна:
+1
4. Связь в кристаллической решетке
металлическая
5. Соединение NaOH называется.
каустическая сода
30
Nа2O
2
NаОН
NaCl
Na3
N
H2
H2
31
Физические свойства щелочных
металлов
-
Все
щелочные
блеском.
серебристо-желтого цвета,
Щелочные металлы - серебристо–белые вещества, за
исключением цезия
с
металлическим
металлы
характеризуются малой плотностью, малой твердостью,
низкими температурами плавления и кипения и хорошей
электропроводностью. Благодаря малой плотности Li, Na и
К всплывают на воде (Li–даже на керосине). Щелочные
металлы легко режутся ножом. Несветящееся пламя
газовой горелки щелочные металлы и их летучие соединения
окрашивают в характерные цвета: Li – в карминово–
красный, ,Na – в желтый, К – фиолетовый ,
Rb - красный и Cs – в фиолетово-синий.
33
Тест «Щелочные металлы»
1. Предложил назвать калий от арабского «алкали» щелочь
И. Арфведсон Г.Деви Й. Берцеллиус
2. В ряду от лития к францию атомный радиус:
уменьшается не изменяется увеличивается
3. Степень окисления щелочных металлов равна:
+1 1 +2
4. Связь в кристаллической решетке
ионная металлическая ковалентная
5. Соединение NaOH называется.
каустическая сода поташ кристаллическая сода
34
NаО
2
NаО
2
Cl
2
NaN
Na2
O
NаОН
Nа2O
2
H2
NaCl
H2
Na2
N
Na3
N
35
