
Работа и теплота как формы передачи энергии. Теплоемкость. Удельная теплоемкость.
Изменение состояния системы тел обусловлено передачей энергии от одного тела системы к другому. Передача энергии может происходить либо в форме механической работы А, либо в форме теплоты Q, обусловленной тепловым молекулярным движением.
Работа есть мера изменения механической энергии, переданной от одного тела к другому. Совершение работы всегда сопровождается перемещением тела в целом или его макроскопических частей.
Количество энергии, переданной от одного тела к другому в процессе теплопередачи, измеряется теплотой, отданной одним телом другому. Сообщение теплоты не связано с перемещением тел, а обусловлено тем, что отдельные молекулы более нагретого тела передают свою кинетическую энергию отдельным молекулам менее нагретого тела при соприкосновении этих тел.
Теплота и работа как две формы передачи энергии тесно связаны друг с другом.
Теплота может переходить в работу и, наоборот, работа — в теплоту. Эти преобразования энергии происходят в строго эквивалентных количествах.
В СИ работа и теплота измеряются в одинаковых единицах — джоулях.
Внесистемной единицей измерения теплоты является калория (кал). 1 кал равна теплоте, необходимой для нагревания 1 г воды от 19,5 до 20,5°С.
Подчеркнем еще раз, что макроскопическая работа и количество теплоты – это не просто формы энергии, а различные способы ее изменения и передачи от одного тела к другому. В то время как энергия характеризует состояние системы, теплота и работа характеризуют изменение состояния, то есть происходящие в системе процессы. Других способов передачи энергии при взаимодействии термодинамической системы с окружающей средой, кроме работы и теплоты, не существует.
Работа и теплота, будучи эквивалентными, в качестве возможных способов передачи энергии оказываются не вполне эквивалентными с точки зрения их взаимных переходов друг в друга. Различие, или, как говорят, асимметрия перехода "работа–тепло" и "тепло–работа", станет предметом дальнейшего рассмотрения, а пока отметим, что работа предполагает перенос энергии с использованием упорядоченного движения частиц окружающей систему среды. Совершая над системой работу, мы вынуждаем ее частицы двигаться упорядоченно, и наоборот, если система совершает работу над окружающей средой, она вызывает в ней упорядоченное движение.
Теплота означает перенос энергии с использованием неупорядоченного движения частиц окружающей среды.
При нагревании системы мы всегда вынуждаем ее частицы двигаться неупорядоченно, наоборот, когда теплота переходит от системы к окружающей среде, в ней возникает неупорядоченное движение. Именно отмеченное различие между теплотой и работой положено в основу микроскопического обоснования асимметрии при их взаимном преобразовании.
Передачей энергии путем совершения работы и путем теплообмена обусловлены все процессы, происходящие с термодинамической системой. Такая передача энергии не должна сопровождаться переходом вещества от внешних тел к системе или от системы к внешним телам.
Теплота Q представляет собой количественную меру хаотического движения частиц данной системы или тела. Энергия более нагретого тела в форме теплоты передается менее нагретому телу. При этом не происходит переноса вещества.
Работа А является количественной мерой направленного движения частиц, мерой энергии, передаваемой от одной системы к другой за счет перемещения вещества от одной системы к другой под действием тех или иных сил, например гравитационных.
Теплоту и работу измеряют в джоулях (Дж), килоджоулях (кДж) и мегаджоулях (МДж). Положительной считается работа, совершаемая системой против внешних сил (А > 0) и теплота, подводимая к системе (Q > 0).
Теплота и работа зависят от способа проведения процесса, т.е. они являются функциями пути.
Процесс передачи теплоты (количества теплоты или энергии) без совершения работы называется теплообменом или теплопередачей. Разделяется он по механизмам передачи, на три вида:
1. Теплопроводность
2. Конвекция
3. Излучение
В результате одного из этих процессов телу передаётся некое количество теплоты, на значение которого, собственно, и меняется внутренняя энергия. Охарактеризуем эту величину.
Количество теплоты
Обозначение – Q. Единицы измерения – Дж. При изменении температуры тела (что эквивалентно изменению внутренней энергии) количество теплоты, затраченное на это изменение, можно вычислить по формуле:
![]()
Здесь:![]() -
масса тела;
-
масса тела; ![]() -
удельная теплоёмкость тела;
-
удельная теплоёмкость тела; ![]() –
изменение температуры тела.
–
изменение температуры тела.
Причём, если ![]() ,
то есть при охлаждении, говорят, что тело отдало некоторое количество теплоты,
или же телу передали отрицательное количество теплоты. Если же
,
то есть при охлаждении, говорят, что тело отдало некоторое количество теплоты,
или же телу передали отрицательное количество теплоты. Если же ![]() ,
то есть наблюдается нагрев тела, количество переданной теплоты, конечно
же, будет положительным.
,
то есть наблюдается нагрев тела, количество переданной теплоты, конечно
же, будет положительным.
Особое внимание следует обратить на величину удельной теплоёмкости тела.
Удельная теплоёмкость
Удельная теплоёмкость – величина, численно равная количеству теплоты, которую необходимо передать, чтобы нагреть один килограмм вещества на один градус.
Удельная теплоёмкость – индивидуальная величина для каждого отдельного вещества. Поэтому это табличная величина, заведомо известная при условии, что нам известно, порции какого вещества передаётся тепло.
Единицу измерения
удельной теплоёмкости в системе СИ можно получить из вышеприведённого
уравнения: ![]()
Таким образом: ![]()
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики:
Q = ΔU + А.
Если к системе подводится теплота Q, то она расходуется на изменение внутренней энергии системы ΔU и на совершение системой работы А над окружающей средой.
Теплоту и работу можно измерить, отсюда,
ΔU = Q – А
Первый закон термодинамики является формой выражения закона сохранения энергии. Согласно этому закону, энергия не может ни создаваться, ни исчезать, но может превращаться из одной формы в другую. Его справедливость доказана многовековым опытом человечества.
Если система осуществляет переход из одного состояния в другое при постоянном объеме (реакция протекает в автоклаве), то работа расширения системы
А = рΔV = 0 и Qv = ΔU = U2 – U1,
т.е. если реакция протекает при постоянном объеме, то выделение или поглощение теплоты Q связано с изменением внутренней энергии системы.
Если на систему не действуют ни какие другие силы, кроме постоянного давления, т.е. химический процесс осуществляется в изобарных условиях, и единственным видом работы является работа расширения, то первый закон термодинамики запишется:
Qp = ΔU + pΔV.
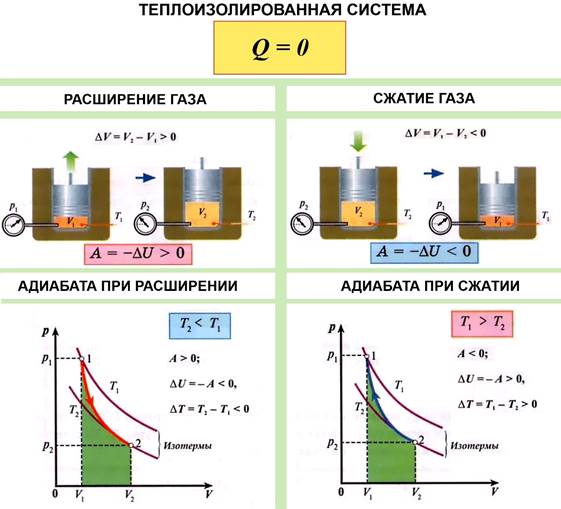
Адиабатный (адиабатический) процесс медленный процесс без теплообмена с окружающей средой.
В этом процессе Q = 0,
поэтому A = ∆U, то есть работа
газа равна убыли внутренней энергии газа.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.