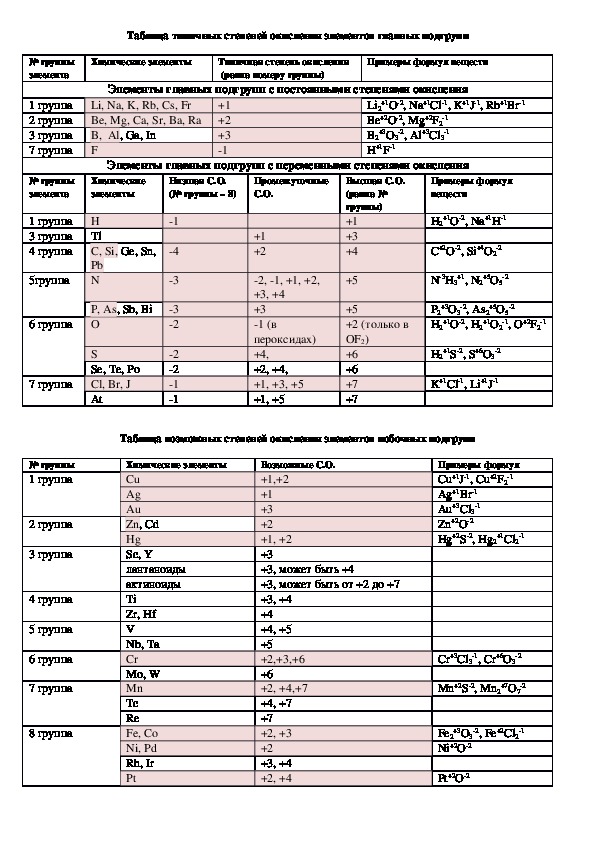
Раздаточные карточки "Таблицы степеней окисления" предназначены для использования на уроках химии с целью отработки навыка правильного составления молекулярных формул неорганических веществ изученных классов. Данные раздаточные карточки могут применяться на разных ступенях обучения, чаще всего на уроках в 7 и 8 классах, может быть использована в 9 и 11 классах. Могут быть использованы при изучении ПСХЭ.
Таблица типичных степеней окисления элементов главных подгрупп
№ группы
элемента
Химические элементы
Типичная степень окисления
(равна номеру группы)
Примеры формул веществ
Элементы главных подгрупп с постоянными степенями окисления
Li, Na, K, Rb, Cs, Fr
1 группа
2 группа Be, Mg, Ca, Sr, Ba, Ra
3 группа B, Al, Ga, In
7 группа
F
+1
+2
+3
1
+1O2, Na+1Cl1, K+1J1, Rb+1Br1
Li2
Be+2O2, Mg+2F2
1
B2
2, Al+3Cl3
+3O3
H+1F1
1
Элементы главных подгрупп с переменными степенями окисления
№ группы
элемента
Химические
элементы
Низшая С.О.
(№ группы – 8)
Промежуточные
С.О.
1 группа
3 группа
4 группа
5группа
6 группа
7 группа
№ группы
1 группа
2 группа
3 группа
4 группа
5 группа
6 группа
7 группа
8 группа
Н
Tl
C, Si, Ge, Sn,
Pb
N
P, As, Sb, Bi
O
S
Se, Te, Po
Cl, Br, J
At
1
4
3
3
2
2
2
1
1
+1
+2
2, 1, +1, +2,
+3, +4
+3
1 (в
пероксидах)
+4,
+2, +4,
+1, +3, +5
+1, +5
Высшая С.О.
(равна №
группы)
+1
+3
+4
Примеры формул
веществ
H2
+1O2, Na+1H1
C+2O2, Si+4O2
2
+5
N3H3
+1, N2
+5O5
2
+5
+2 (только в
ОF2)
+6
+6
+7
+7
P2
H2
+3O3
2, As2
+1O2, H2
+5O5
+1O2
2
1, O+2F2
1
H2
+1S2, S+6O3
2
K+1Cl1, Li+1J1
Таблица возможных степеней окисления элементов побочных подгрупп
Химические элементы
Сu
Ag
Au
Zn, Cd
Hg
Sc, Y
лантаноиды
актиноиды
Ti
Zr, Hf
V
Nb, Ta
Сr
Mo, W
Mn
Tc
Re
Fe, Co
Ni, Pd
Rh, Ir
Pt
Возможные C.O.
+1,+2
+1
+3
+2
+1, +2
+3
+3, может быть +4
+3, может быть от +2 до +7
+3, +4
+4
+4, +5
+5
+2,+3,+6
+6
+2, +4,+7
+4, +7
+7
+2, +3
+2
+3, +4
+2, +4
1
Примеры формул
Cu+1J1, Cu+2F2
Ag+1Br1
Au+3Cl3
1
Zn+2O2
Hg+2S2, Hg2
+1Cl2
1
Cr+3Cl3
1, Cr+6O3
2
Mn+2S2, Mn2
+7O7
2
2, Fe+2Cl2
1
Fe2
+3O3
Ni+2O2
Pt+2O2Ru, Os
+4,+8