
Гидролиз органических и неорганических соединений.
Химические источники тока.


Этот процесс происходит при растворении соли в воде.
МAn +HOH![]() MOH + HAn (соли
растворимы в Н2О),
MOH + HAn (соли
растворимы в Н2О),
где М- катион металла, An- анион группа. Исключение -образование кристаллогидратов.
CuSO4+ 5H2O = CuSO4∙5H2O (медный купарос)
В результате гидролиза изменяется кислотность среды в кислую (рН<7) или щелочную(рН>7) сторону (нейтральная среда 6,6≤ рН≤ 7). Это происходит при условии (таблица 1)
|
соль |
Гидролиз |
среда |
индикатор (...)- цвет |
||
|
катион+ |
анион- |
||||
|
сильного основания |
слабой кислоты |
по аниону |
щелочная |
рН>7-... |
|
|
малорастворимого основания |
сильной кислоты |
по катиону |
кислотная |
рН<7-... |
|
|
малорастворимого основания |
слабой кислоты |
по катиону и аниону |
нейтральная кислотная или(т.раст) щелочная |
|
|
|
сильного основания |
сильной кислоты |
_______ |
нейтральная |
|
|
Среда в результате гидролиза определяется по сильному компоненту соли (основанию или кислоте). Гидролиз протекает в направлении связывания ионов.
Сильные кислоты: H2SO4 , HClO4 , HNO3 , HClO3 , HI, HBr , HCl.
Сильные основания: KOH, NaOH, CaOH.
Определить среду раствора можно по окраске индикатора (какого?)
|
Индикатор |
кислотная среда |
нейтральная среда |
щелочная среда |
|
лакмус |
красный |
фиолетовый |
синий |
|
фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
метиловый оранжевый |
розовый |
оранжевый |
желтый |
Таким образом ионные уравнения :
1)
соль сильной кислоты + соль сильной кислоты = осадок(![]() )
)
2) соль слабой кислоты + сильная кислота = газ + вода
3) щёлочь + сильная кислота = вода
Гидролиз соли – это взаимодействие ее ионов с водой, приводящее к появлению кислотной или щелочной среды, но не сопровождающееся образованием осадка или газа (ниже речь идет о средних солях).
Процесс гидролиза протекает только с участием растворимых солей и состоит из двух этапов:
1) диссоциация соли в растворе – необратимая реакция (степень диссоциации α = 1, или 100 %);
2) собственно гидролиз, т. е. взаимодействие ионов соли с водой, – обратимая реакция (степень гидролиза α < 1, или 100 %).
Уравнения 1‑го и 2‑го этапов – первый из них необратим, второй обратим – складывать нельзя!
Отметим, что соли, образованные катионами щелочей и анионами сильных кислот, гидролизу не подвергаются, они лишь диссоциируют при растворении в воде. В растворах солей КCl, NaNO3, Na2SO4 и BaI2 среда нейтральная.
В случае взаимодействия аниона растворенной соли с водой процесс называется гидролизом соли по аниону.
1)
![]()
2)
![]()
Диссоциация соли KNO2 протекает полностью, гидролиз аниона NO2 – в очень малой степени (для 0,1М раствора – на 0,0014 %), но этого оказывается достаточно, чтобы раствор стал щелочным (среди продуктов гидролиза присутствует ион ОН‑), в нем рН = 8,14.
Гидролизу подвергаются анионы только слабых кислот (в данном примере – нитрит‑ион NO2‑, отвечающий слабой азотистой кислоте HNO2). Анион слабой кислоты притягивает к себе катион водорода, имеющийся в воде, и образует молекулу этой кислоты, а гидроксид‑ион остается свободным:
![]()
Список
гидролизующихся анионов: 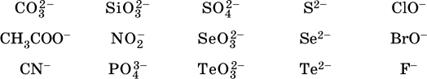
Примеры:
а)
![]()
б)
![]()
в)
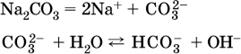
г)
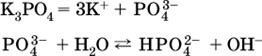
д)
![]()
Обратите внимание, что в примерах (в – д) нельзя увеличивать число молекул воды и вместо гидроанионов (HCO3‑, HPO42‑, HS‑) писать формулы соответствующих кислот (Н2СO3, Н3РO4, H2S). Гидролиз – обратимая реакция, и протекать «до конца» (до образования кислоты НnА) он не может.
Если бы такая неустойчивая кислота, как Н2СO3, образовалась в растворе своей соли Na2CO3, то наблюдалось бы выделение из раствора газа СO2 (Н2СO3 = СO2↓ + Н2O). Однако при растворении соды в воде образуется прозрачный раствор без газовыделения, что является свидетельством неполноты протекания гидролиза аниона СО| с появлением в растворе только гидроаниона угольной кислоты HCOg.
Степень гидролиза соли по аниону зависит от степени диссоциации продукта гидролиза – кислоты (HNO2, НClO, HCN) или ее гидроаниона (HCO3‑, HPO42‑, HS‑); чем слабее кислота, тем выше степень гидролиза. Например, ионы СО32‑, РО43‑ и S2‑ подвергаются гидролизу в большей степени (в 0,1 М растворах ~ 5 %, 37 % и 58 % соответственно), чем ион NO2, так как диссоциация Н2СO3 и H2S по 2‑й ступени, а Н3РO4 по 3‑й ступени (т. е. диссоциация ионов HCO3‑, HS‑ и HPO42‑) протекает значительно меньше, чем диссоциация кислоты HNO2. Поэтому растворы, например, Na2CO3, К3РO4 и BaS будут сильнощелочными (в чем легко убедиться по мылкости раствора соды на ощупь). Избыток ионов ОН в растворе легко обнаружить индикатором или измерить специальными приборами (рН‑метрами).
Если в концентрированный раствор сильно гидролизующейся по аниону соли, например Na2CO3, внести алюминий, то последний (вследствие амфотерности) прореагирует с ОН‑
![]()
и будет наблюдаться выделение водорода. Это – дополнительное доказательство протекания гидролиза иона СО32‑ (ведь в раствор Na2CO3 мы не добавляли щелочь NaOH!).
В случае взаимодействия катиона растворенной соли с водой процесс называется гидролизом соли по катиону:
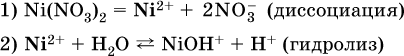
Диссоциация соли Ni(NO3)2 протекает полностью, гидролиз катиона Ni2+ – в очень малой степени (для 0,1 М раствора – на 0,001 %), но этого оказывается достаточно, чтобы раствор стал кислым (среди продуктов гидролиза присутствует ион Н+), в нем рН = 5,96.
Гидролизу подвергаются катионы только малорастворимых основных и амфотерных гидроксидов и катион аммония NH4+. Гидролизуемый катион притягивает к себе анион ОН‑, имеющийся в воде, и образует соответствующий гидроксокатион, а катион Н+ остается свободным:
![]()
Катион аммония в этом случае образует слабое основание – гидрат аммиака:
![]()
Список гидролизующихся катионов:
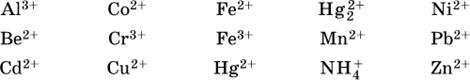
Примеры:
а)
![]()
б)
![]()
в)
![]()
г)
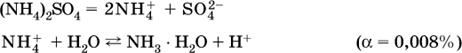
Обратите внимание, что в примерах (а – в) нельзя увеличивать число молекул воды и вместо гидроксокатионов FeOH2+, CrOH2+, ZnOH+ писать формулы гидроксидов FeO(OH), Cr(OH)3, Zn(OH)2. Если бы гидроксиды образовались, то из растворов солей FeCl3, Cr2(SO4)3 и ZnBr2 выпали бы осадки, чего не наблюдается (эти соли образуют прозрачные растворы).
Избыток катионов Н+ легко обнаружить индикатором или измерить специальными приборами. Можно также
проделать такой опыт. В концентрированный раствор сильно гидролизующейся по катиону соли, например AlCl3:
![]()
вносится магний или цинк. Последние прореагируют с Н+:
![]()
и будет наблюдаться выделение водорода. Этот опыт – дополнительное свидетельство протекания гидролиза катиона Al3+ (ведь в раствор AlCl3 мы не добавляли кислоту!).
Пример. Какая из солей не подвержена гидролизу?
1) хлорид натрия 3) хлорид алюминия;
3) хлорид магния 4) сульфат железа (III)
![]() Пояснение. Соль NaCl
Пояснение. Соль NaCl ![]() Na+ + Cl- NaОН- сильное
основание
Na+ + Cl- NaОН- сильное
основание
![]() НОН
НОН![]() ОН- + Н+ НCl - сильная кислота
ОН- + Н+ НCl - сильная кислота
Вывод: гидролезу не подвергается, т.к. среда нейтральная.



Д/з §21,с.97 №1-3 ;§22,с 102.№3-4
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.