
Тема 1. «Строение атома»
Методические рекомендации.
Строение электронной оболочки
Экспериментальные данные о наличии положительно заряженного ядра и его расположения в атоме, были получены английским ученым Э. Резерфордом, который предложил гипотезу о планетарном строении атома: т.е. атом это система из очень малого по размерам ядра (10-12 –10-13 см), вокруг которого по круговым орбитам движется такое количество электронов, что они своим отрицательным зарядом нейтрализуют положительный заряд ядра.
Датский ученый Н. Бор в 1913 году на основе квантовой теории излучения М. Планка, развил квантовую теорию строения атома согласно которой:
а) электрон может двигаться вокруг ядра атома не по любым орбитам, а только по вполне определенным – дозволенным:
при движении электронов по этим, дозволенным орбитам, атом не излучает энергию, излучение и поглощение энергии происходит при переходе электронов с одной орбиты на другую
б) при этом энергия излучается порциями, или квантами, каждому из которых соответствует определенная частота. Положению электрона на каждой из орбит соответствует определенный запас энергии. Когда электрон движется по первой орбите, прочность его связи с ядром максимальная, а запас энергии минимальный. Такое состояние атома называют нормальным.
Если подвести энергию к атому, то электрон переместится на одну из более удаленных орбит, при этом прочность связи его с ядром уменьшится, а запас энергии атома увеличится. Такое состояние атома называют возбужденным.
Электроны, которые находятся на внешнем энергетическом уровне атома, менее прочно связаны с ядром и могут быть легко отданы при химическом взаимодействии с другими атомами. Таким образом, валентность элементов определяется числом электронов на внешнем энергетическом уровне. Поэтому эти электроны называют валентными.
В основе нового квантово-механического подхода к строению атома лежат два основных пункта:
а) электрон можно рассматривать как частицу, которая при движении проявляет волновые свойства.
б) электрон может находиться на любом расстоянии от ядра, однако вероятность его пребывания в разных местах атома различна.
Развитие волновой механики привело к отказу от прежних представлений об определенных электронных орбитах. Электрон может находиться в любой точке пространства вокруг ядра. Поэтому квантовая механика вводит понятие электронного облака. Электронное облако (орбиталь) имеет разную геометрическую форму.
 Строение атомного ядра.
Строение атомного ядра.
На основании тщательного изучения ядерных реакций советские физики Д.Д. Иваненко, Е.П. Гапон и одновременно немецкий физик В. Гейзенберг предложили протонно-нейтронную теорию строения атомного ядра. Согласно этой теории, атомные ядра состоят из протонов и нейтронов. Оба вида частиц, объединяемых под общим названием нуклоны, обладают почти одинаковой массой, равной 1 а.е. м.
Так как практически вся масса атомов сосредоточена в ядре, можно считать что, массовое число – округленная относительная масса, А равно сумме протонов N (p) и нейтронов N(n):
A = N (p) + N(n)
Число нейтронов в ядре равно разности между массовым числом и числом протонов
N(n)= A – N (p)
 Так, атомы водорода имеют массовые
числа 1,2,3:
Так, атомы водорода имеют массовые
числа 1,2,3:
Ядра всех атомов содержат одинаковое число протонов, но разное число нейтронов, ядро протия состоит из 1 протона, ядро дейтерия из 1 протона и одного нейтрона, ядро трития из 1 протона и 2 нейтронов.
Атому имеющие одинаковый заряд ядра, но разные массовые числа называют изотопами.
В Периодической системе элементов Д.И. Менделеева, атомная масса элемента указывается как средняя величина массовых чисел всех его изотопов, взятых в процентном отношении, отвечающем их распространенности в природе.
Атомы различных изотопов одного и того же химического элемента, наряду с разными ядерными свойствами имеют одинаковое строение электронной оболочки, поэтому химические и физические свойства изотопов практически одинаковы. Изотопы занимают одно и то же место в Периодической системе.
Тема 2. Строение электронных оболочек атомов первых 20 элементов периодической системы Д. И. Менделеева
Электронная оболочка любого атома делится на энергетические уровни (1, 2, 3-й и т. д.), уровни делятся на подуровни (обозначаются буквами s, р, d, f). Подуровни состоят из атомных орбиталей — областей пространства, где вероятно пребывание электронов. Орбитали обозначаются как Is (орбиталь 1-го уровня s-подуровня), 2s, 2р, 3s, 3р, 3d, 4s... Число орбиталей в подуровнях:
|
Подуровень |
s |
P |
d |
f |
|
Число орбиталей |
1 |
3 |
5 |
7 |
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
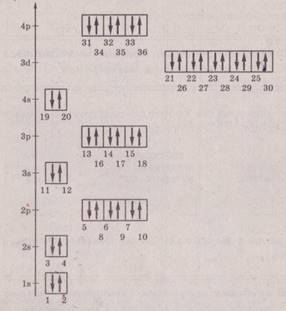
1) принцип минимума энергии Электроны заполняют орбитали, начиная с подуровня с меньшей энергией. Последовательность нарастания энергии подуровней: Is < 2s < 2р < 3s < Sp < 4s < 3d < 4p < 5s < 4d < 5p < 6s...
2) правило запрета (принцип Паули)В каждой орбитали может разместиться не более двух электронов.
Один электрон на орбитали называется неспаренным, два электрона — электронной парой:

3) принцип максимальной мулътиплетности (правило Хунда)
В пределах подуровня электроны сначала заполняют все орбитали наполовину, а затем — полностью.
Каждый электрон имеет свою собственную характеристику — спин (условно изображается стрелкой вверх или вниз). Спины электронов складываются как вектора, сумма спинов данного числа электронов на подуровне должна быть максимальной (мультиплетность):

Заполнение электронами уровней, подуровней и орбиталей атомов элементов от Н (Z = 1) до Кг (Z = 36) показано на энергетической диаграмме (номера отвечают последовательности заполнения и совпадают с порядковыми номерами элементов.
Задание 1. Напишите конспект текста, укажите определения и формулы, чертежи и условия их оформления.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.