
Силы и энергия межмолекулярного взаимодействия.
Строение газообразных, жидких и твердых тел. Скорости движения молекул и их измерение.
Ван-дер-Ваальс, объясняя свойства реальных газов и жидкостей, предположил, что на малых расстояниях между молекулами действуют силы отталкивания, которые с увеличением расстояния сменяются силами притяжения. Межмолекулярные взаимодействия имеют электрическую природу и складываются из сил притяжения (ориентационных, индукционных) и сил отталкивания.
Ориентационные силы действуют между полярными молекулами — молекулами, обладающими дипольными или квадрупольными моментами. Сила притяжения между молекулами зависит от их взаимной ориентации, поэтому они и называются ориентационными (рис. 3.7.1). Хаотическое тепловое движение непрерывно меняет ориентацию полярных молекул, но среднее по всем ориентациям значение силы не равно нулю.
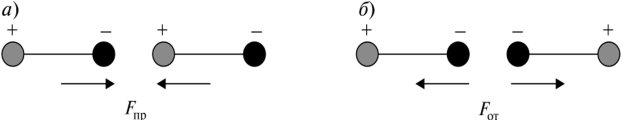
Рис. 3.7.1. Силы притяжения (а) и отталкивания (б) в связи с ориентацией молекул
Сила ориентационного взаимодействия убывает с расстоянием значительно быстрее, чем кулоновская сила взаимодействия заряженных частиц FKyn ~ г-2.
Индукционные (поляризационные) силы действуют между полярной и неполярной молекулами, а также между полярными молекулами. Полярная молекула создает электрическое поле, которое поляризует другую молекулу — индуцирует в ней дипольный момент. Потенциальная энергия межмолекулярного взаимодействия в этом случае пропорциональна дипольному моменту р] полярной молекулы и поляризуемости ос2 второй молекулы. Индукционные силы убывают по тому же закону, что и ориентационные.
Молекулярное взаимодействие возникает благодаря виртуальному нарушению электронейтральности молекулы в отдельные моменты времени. Мгновенный диполь поляризует соседние молекулы — возникает взаимодействие мгновенных диполей. Данное взаимодействие называется дисперсионным, его энергия определяется поляризуемостью молекул, а сила убывает по закону F исп ~ г-7. Обычно дисперсионные силы больше, чем ориентационные и индукционные. Например, при взаимодействии таких полярных молекул, как СО, HI, НВг и др., в десятки и сотни раз превосходит все остальные.
Отметим, что все три силы и энергии одинаковым образом убывают с расстоянием (рис. 3.7.2 и 3.7.3):
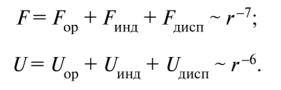
Силы отталкивания (см. рис. 3.7.2) действуют между молекулами на очень малых расстояниях, когда происходит взаимодействие электронных оболочек атомов, входящих в состав молекул. Принцип Паули запрещает проникновение заполненных электронных оболочек друг в друга. Возникающие при этом силы отталкивания зависят в большей степени, чем силы притяжения, от индивидуальных особенностей молекул.
К хорошему соответствию с данными экспериментов приводит допущение, что потенциальная энергия сил отталкивания возрастает с уменьшением расстояния по закону Um(r) ~ г-12, а соответственно, сила отталкивания растет как Fm ~ г-13. При больших расстояниях потенциальная энергия взаимодействия равна нулю. В этом случае кривая взаимодействия описывается потенциалом Леннарда — Джонса (см. рис. 3.7.3).
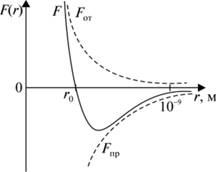
Рис. 3.7.2. Зависимость сил притяжения и сил отталкивания от расстояния
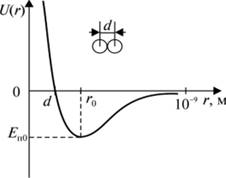
Рис. 3.7.3. Зависимость потенциальной энергии от расстояния
Глубина
потенциала ![]() (г0 —
расстояние, соответствующее наибольшей энергии связи молекул). Отметим, что в
данном потенциале не учтены ориентационные взаимодействия, существенные для
многоатомных молекул и кристаллов.
(г0 —
расстояние, соответствующее наибольшей энергии связи молекул). Отметим, что в
данном потенциале не учтены ориентационные взаимодействия, существенные для
многоатомных молекул и кристаллов.
Учитывая совместное действие сил притяжения и сил отталкивания и полученные поправки для объема и давления в уравнении Менделеева — Клапейрона, получим уравнение Ван-дер-Ваальса для реального газа
![]()
или для одного моля
![]()
Данное уравнение справедливо при условии vb « V и 2a/V2 « Р. Помимо этого предполагается, что частицы газа сферически симметричны. Поскольку реально это не так, то даже для неплотных газов величины а и Ъ зависят от температуры.
Для плотных газов уравнение Ван-дер-Ваальса как количественное соотношение не годится. Однако качественно оно позволяет описывать поведение газов при высоких давлениях, конденсацию газов и переход газов в критическое состояние.
Древние ученые считали, что всё на свете состоит из воды, земли, воздуха. Оказывается, в чем-то они были правы. Все вещества могут находиться в тех же состояниях, что вода, земля и воздух. Эти состояния называются жидким, твердым и газообразным.
Вспомним замечательную детскую сказку о Снегурочке. Когда Снегурочка прыгнула через костер, она растаяла. Ледяная внучка превратилась в лужицу воды, и эта вода очень быстро испарилась.
В этом фрагменте сказки идет речь о трех состояниях вещества: твердом, жидком и газообразном.

Рис. 1. Три состояния вещества
Отличительные признаки твердых тел, жидкостей и газов
Каждый знает, что изменить форму твердого тела достаточно трудно, будь то металлическое тело, пластмасса или даже пластилин. Даже для изменения формы пластилина нам все равно приходится прикладывать определенное усилие. Можно сказать, что твердые тела сохраняют свою форму и объем.

Рис. 2. Отличительные признаки твердых тел
А что можно сказать о форме и объеме жидкостей? Жидкость, которую мы налили в один из сосудов, приняла форму этого сосуда. Если перелить ее в сосуд другой формы, то жидкость примет форму другого сосуда. Всякий раз жидкость принимает форму того сосуда, куда ее наливают. Можно сделать вывод: жидкость может изменять свою форму, но ее объем сохраняется прежним.

Рис. 3. Отличительные признаки жидкостей
Совершенно по-иному ведет себя газ. И форму, и объем тел, состоящих из газа, изменить очень легко. Газ не обладает ни собственной формой, ни собственным объемом. Он принимает форму того сосуда, в который его поместили, и занимает весь предоставленный ему объем.

Рис. 4. Отличительные признаки газов
Молекулярное строение твердых тел
В чем причина столь разного поведения твердых, жидких тел и газов? Причина кроется в молекулярном строении вещества, а именно в расположении, движении и взаимодействии молекул, из которого вещество состоит.
Молекулы твердого тела упакованы очень близко друг к другу. Их расположение носит строго повторяющийся характер. Из-за того, что молекулы твердого тела расположены очень близко друг к другу, силы взаимного притяжения и отталкивания между ними очень велики. Именно поэтому изменить форму и объем твердого тела очень трудно. Взаимодействием молекул объясняется и характер их движения. Они не могут перемещаться по всему твердому телу, а лишь колеблются каждая вокруг своего положения равновесия. Молекулы твердого тела колеблются хаотично, пытаясь сдвинуться то в одну, то в другую сторону, но везде рядом с ними расположены точно такие же молекулы. Они отталкивают молекулу к положению ее равновесия.

Рис. 5. Расположение молекул твердого тела
Молекулярное строение жидкостей
Молекулы в жидкостях тоже расположены достаточно плотно друг к другу, но в их расположении уже нет такого строгого порядка, как у молекул твердого тела. Молекулы жидкостей расположены хаотично. Их движение сравнимо с перескоком. Они словно перепрыгивают от одного положения равновесия к другому, меняясь местами. А между этими перескоками они хаотично колеблются вокруг своих временных положений равновесия.
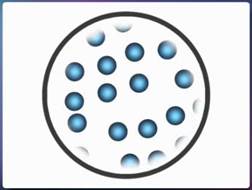
Рис. 6. Расположение молекул жидкости
Именно то, что молекулы жидкостей плотно упакованы, приводит к плохой сжимаемости жидкостей. А свою форму жидкость меняет очень легко, так как молекулы легко смещаются по отношению друг к другу.
Оказывается, обычное стекло – это чрезвычайно густая жидкость. Такие вещества называют аморфными (то есть лишенными формы), поскольку даже при комнатной температуре молекулы стекла не располагаются упорядоченно. Разогретое стекло становится текучим, так как с ростом температуры облегчаются перескоки молекул между временными положениями равновесия. Этим пользуются мастера стекольного дела, изготавливая из стекла предметы самой разнообразной формы.

Рис. 7. Текучесть разогретого стекла позволяет изготавливать из него предметы различной формы
Молекулярное строение газов
Молекулы газообразных веществ расположены уже на значительных расстояниях друг от друга. Так, расстояния между молекулами воздуха, которым мы с вами дышим, в среднем в 10–20 раз больше, чем размеры самих молекул. Такое удаление молекул друг от друга достаточно для того, чтобы силы притяжения и отталкивания между молекулами ослабли. Поэтому молекулы газа могут свободно передвигаться по всему предоставленному им объему. Именно в этом заключается причина того, что газы не сохраняют ни форму, ни объем.
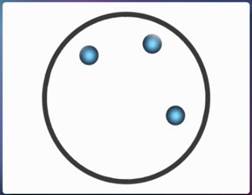
Рис. 8. Расположение молекул газа
Итак, причина того, что вещество может находиться в твердом, жидком и газообразном состояниях, – различное взаимное расположение, движение и взаимодействие его молекул.
Большие скорости молекул, предсказываемые молекулярно-кинетической теорией, казались многим ученым неправдоподобными, что было одним из главных возражений против этой теории. Например, приводили такой довод: запахи в воздухе распространяются со значительно меньшей скоростью, а ведь запахи тоже переносятся молекулами! «Разгадка», как мы знаем, состоит в том, что движение молекул вследствие частых столкновений носит хаотический характер: траектория движения каждой молекулы — чрезвычайно запутанная ломаная линия. Именно по этой причине среднее смещение молекулы в любом направлении в тысячи раз меньше того расстояния, которое она могла бы пройти, летя с той же скоростью в одном и том же направлении.
Одно из первых измерений скоростей молекул было выполнено в начале 20-го века немецким физиком Штерном. Вот как был поставлен этот опыт.
Платиновая проволока, покрытая тонким
слоем серебра, располагалась вдоль общей оси двух жестко соединенных
цилиндров ![]() и
и ![]() (рис. 27.2). Проволоку нагревали
электрическим током. Атомы серебра, испаряясь с поверхности проволоки и
пролетая через узкую щель в цилиндре
(рис. 27.2). Проволоку нагревали
электрическим током. Атомы серебра, испаряясь с поверхности проволоки и
пролетая через узкую щель в цилиндре ![]() осаждались в виде узкой светлой
полосы 1 на внутренней поверхности цилиндра
осаждались в виде узкой светлой
полосы 1 на внутренней поверхности цилиндра ![]()
Затем соединенные цилиндры приводили в
быстрое вращение вокруг оси (на рисунке — по часовой стрелке). При этом полоса
1 смещалась и расширялась, превращаясь в полосу 2 (см. рисунок). Смещение
полосы обусловлено тем, что за то время, пока атомы серебра пролетают от
цилиндра ![]() до
цилиндра
до
цилиндра ![]() эти
цилиндры вследствие вращения поворачиваются на некоторый угол. Зная радиусы
цилиндров и частоту их вращения, можно по величине смещения полосы рассчитать
скорость атомов серебра. Расширение же полосы обусловлено тем, что при
«тепловом» движении атомы движутся с различными скоростями.
эти
цилиндры вследствие вращения поворачиваются на некоторый угол. Зная радиусы
цилиндров и частоту их вращения, можно по величине смещения полосы рассчитать
скорость атомов серебра. Расширение же полосы обусловлено тем, что при
«тепловом» движении атомы движутся с различными скоростями.
|
|
Рис. 27.2. Схема опыта Штерна по измерению скоростей молекул. |
Результаты опыта Штерна подтвердили предсказания молекулярно-кинетической теории.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.