
Лекция № 47
Тема «Классификация и особенности органических реакций»
Существуют различные способы классификации органических реакций. Органические реакции чаще всего классифицируют по типу разрыва химических связей в реагирующих частицах. Согласно этой классификации в органической химии выделяют радикальные и ионные реакции.
В зависимости от внешних условий и от энергии связи ковалентная химическая связь может разрываться двумя способами: гомолитически и гетеролитически.
В результате гомолитического (радикального) разрыва связи каждый атом получает неспаренный электрон и образуются две частицы, называемые свободными радикалами:
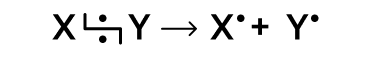
Гомолитический разрыв характерен для неполярных или слабополярных молекул и требует большого количества энергии, поэтому реакции с гомолитическим разрывом происходят при сильном нагревании или при облучении светом. Реакции, протекающие по радикальному механизму, характерны, например, для алканов.
Образующиеся радикалы, имеющие неспаренный электрон, обладают высокой реакционной способностью, поэтому химические процессы, протекающие с участием таких частиц, часто носят «цепной» характер, их трудно контролировать, а в результате реакции получается набор продуктов замещения. Так, при хлорировании метана продуктами замещения являются хлорметан , дихлорметан , хлороформ и четырёххлористый углерод .
Гетеролитически разрываются связи между атомами, электроотрицательность которых различается значительно. В результате гетеролитического (ионного) разрыва связи электронная пара остается у более электроотрицательного атома и образуются две заряженные частицы — ионы: катион (положительный) и анион (отрицательный):
![]()
Гетеролитический разрыв характерен соединений, в которых существуют полярные ковалентные связи, в которых электронная пара смещена к более электроотрицательному атому. Реакции с гетеролитическим разрывом связи протекают, как правило, а в полярных растворителях (воде, безводной уксусной кислоте, хлороформе). Примером реакции, протекающей по ионному механизму, может служить реакция взаимодействия галогеналканов с водным раствором щёлочи, например:
В результате гетеролитического разрыва связи образуются заряженные частицы: нуклеофильная (нуклеофил) и электрофильная (электрофил).
Нуклеофил («фил» — от гр. любить) частица, имеющая пару электронов на внешнем электронном уровне.
Нуклеофилы предоставляют электронную пару для образования новой связи.
Примерами нуклеофилов являются любые анионы, например , , и др., а также соединения, имеющие неподелённую электронную пару, например и др.
Электрофильная частица (электрофил)
частица, имеющая свободную орбиталь на внешнем электронном уровне.
Для образования ковалентной связи электрофил предоставляет свободные орбитали электронам частицы, с которой взаимодействует.
Частицу с положительным зарядом на атоме углерода называют карбокатионом. Наиболее устойчивы карбокатионы, у которых заряд находится на третичном атоме углерода. По возрастанию устойчивости карбокатионы можно расположить в ряд:

Рис. 3. Устойчивость карбкатионов
В органической химии, как и в неорганической, реакции можно классифицировать по структурному признаку. В соответствии с этим признаком различают следующие типы реакций.
Реакция присоединения
К ним относятся, например, реакции присоединения к алкенам по месту разрыва -связи:
,
К реакциями присоединения относят также реакции полимеризации, в результате которых происходит последовательное присоединение молекул друг к другу за счёт разрыва кратных связей, например:
Этилен Полиэтилен
Реакция замещения
В органической химии к реакциям замещения могут относиться реакции, в которых один атом или функциональная группа замещается на другой атом или функциональную группу :
Однако если в неорганической химии к реакциям замещения относят только реакции между простым и сложным веществами, то в органической химии в реакциях замещения могут также участвовать только одни сложные вещества. Примерами реакций замещения с участием органических веществ могут служить следующие реакции:
(реакция между простым и сложным веществом)
(реакция, в которой все участвующие вещества сложные).
Реакция отщепления (элиминирования)
Реакция изомеризации
К этому типу реакций принадлежит, например, изомеризация енолов в карбонильные соединения:
В органической химии выделяют также окислительно-восстановительные реакции. Часто окисление сопровождается введением в молекулу органического вещества кислорода и (или) отщеплением водорода. Так, в результате окисления первичных спиртов образуются альдегиды, которые затем окисляются до карбоновых кислот:
За некоторыми типами реакций закрепились особые названия. Так, реакции присоединения водорода называют гидрированием, а реакции отщепления водорода — дегидрированием. Приставка «де» означает лишение чего-либо. Аналогично, присоединение воды называют реакцией гидратации, а отщепление воды — реакцией дегидратации, присоединение галогеноводородов — гидрогалогенированием, а его отщепление — дегидрогалогенированием. Реакции, в результате которых в молекулу вводится галоген, называют реакциями галогенирования, –группа — нитрования и т. д.
Реакции, в результате которых вещество подвергается термическому разложению без доступа воздуха, называются пиролизом. Примеры пиролиза — сухая перегонка каменного угля, а также пиролиз метана.
Существуют также фотохимические реакции, протекающие в условиях освещения, например реакция фотосинтеза, которая происходит в зелёных растениях под действием света.
В органической химии большую роль играют условия проведения реакций, в зависимости от которых могут получаться разные продукты с одними и теми же реагентами. Например, реакция бромэтана с водным раствором щёлочи приводит к образованию этанола, а со спиртовым — этена:
При составлении уравнений реакций важно указывать условия проведения реакций.
Существуют разные системы классификации органических реакций, которые основаны на различных признаках. Среди них можно выделить классификации:
Взаимодействующие в органической реакции вещества подразделяют на реагент и субстрат. При этом считается, что реагент атакует субстрат.
Свободно-радикальный механизм: реакцию начинают свободные радикалы, образующиеся при гомолитическом разрыве связи в молекуле.
Наиболее типичный вариант — образование радикалов хлора или брома при УФ-облучении.
Электрофильный механизм: реакцию начинают частицы-электрофилы, получающие положительный заряд в результате гетеролитического разрыва связи. Все электрофилы — кислоты Льюиса.
Такие частицы активно образуются под действием кислот Льюиса, которые усиливают положительный заряд частицы. Чаще других используются , выполняющие функции катализатора.
Местом атаки частицы-электрофила являются те участки молекулы, которые имеют повышенную электронную плотность, т. е. кратная связь и бензольное кольцо.
Нуклеофильный механизм: реакцию начинают частицы-нуклеофилы, имеющие отрицательный заряд, образовавшиеся в результате гетеролитического разрыва связи. Все нуклеофилы — основания Льюиса.
В нуклеофильных реакциях реагент (нуклеофил) имеет на одном из атомов свободную пару электронов и является нейтральной молекулой или анионом ( и др.).
Нуклеофил атакует в субстрате атом с наименьшей электронной плотностью (т. е. с частичным или полным положительным зарядом).
Первой стадией реакции нуклеофильного замещения является ионизация субстрата с образованием карбjкатиона. При этом новая связь образуется за счёт электронной пары нуклеофила, а старая претерпевает гетеролитический разрыв с последующим отщеплением катиона. Примером нуклеофильной реакции может служить нуклеофильное замещение (символ ) у насыщенного атома углерода, например щелочной гидролиз бромпроизводных.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.