
Автор работы:
Дмитриченко Людмила Викторовна
МБОУ «Новоазовская школа №2»
учитель химии
Тема урока: Аммиак.
Цель урока: изучение строения молекулы аммиака, его физических и химических свойств, роли аммиака в жизни человека и его применение
Задачи урока:
ü обучающие: изучить состав и строение молекулы аммиака, его физические и химические свойства, способы получения в лаборатории и промышленности, применение; познакомить с водородной связью и донорно-акцепторным механизмом образования ковалентной связи.
ü воспитательные:воспитание положительной мотивации учения, правильной самооценки, уверенности и требовательности к себе, продолжить воспитание толерантности при работе в группе.
Тип урока: Изучение нового материала с элементами повторения и закрепления ранее изученного.
Методы и методические приемы: частично –поисковый, самостоятельная работа, тестовые задания, взаимопроверка, составление опорного конспекта.
Используемые технологии: технология проблемного обучения, использование ИКТ.
План урока:
Организационный момент (2 мин)
Опрос-повторение (5 мин.)
Мотивационно-ориентировочный этап (5 мин.)
Операционно – исполнительский этап(23 мин.)
Проверка усвоения знаний (7 мин.).
Подведение итогов урока. Рефлексия. Домашнее задание.(3 мин.)
Оборудование:
ü Таблица растворимости веществ
ü Периодическая система Д.И.Менделеева
ü Набор реактивов
ü Лабораторная посуда
Девиз урока: «Можно не любить химию, но прожить без неё сегодня и завтра нельзя» О.М.Нефёдов
Этапы урока:
I. Организационный этап (2 мин.)
Учитель проверяет готовность учащихся к уроку, организует начало урока. Отмечает отсутствующих.
II. Актуализация знаний (5 мин.)
На прошлом уроке мы изучили характеристику азота. Выполняем вводный контроль: тест по вариантам и проводим взаимопроверку (правильные ответы для контроля – на экране) (Приложение № 1)
III. Мотивационно - ориентировочный этап (5 мин.)
Создание проблемной ситуации.
Вводное слово учителя: Сегодня на уроке мы познакомимся с удивительным веществом с уникальными свойствами. Его использование может принести пользу или навредить.
Итак, эта история произошла во время I мировой войны. Английский крейсер вел преследование повреждённого в бою немецкого эсминца. Цель была почти достигнута, как вдруг между кораблями появилось плотное белое облако дыма, появился удушливый запах, раздражающий горло, стало трудно дышать. Крейсер был вынужден дать задний ход и выйти из дымового облака. Позже обнаружили, что пострадали не только люди, но и металлические части корабля. Что же это было за едкое облако и какой газ почувствовали люди?
Запах этого газа знаком каждому - даже тем, кто совсем далёк от химии. Кое – что о его свойствах тоже всем известно. Это вещество имеет древнюю историю. Арабские алхимики получали из оазиса Амон, находившегося около храма, бесцветные кристаллы. Они звали вещество «нушадир», его растирали в ступках, нагревали – и всякий раз получался едкий газ. Сначала это вещество называли аммониак, а потом сократили название до «аммиак».В средние века этот газ называли «щелочной воздух», а его раствор и сейчас называют «нашатырный спирт».
Итак, вещество, о котором пойдёт речь на нашем уроке – аммиак.
Вопросы: Что вам известно об этомвеществе?
«Достаточноли ваших знаний, чтобы правильно обращаться с этимвеществом»
(высказыванияучащихся)
Цель нашего урока: исследовать строение и свойства аммиака, изучить основные способы получения.
Давайте проведем небольшое исследование и решим, откуда у этого газа столь необычные свойства и названия.
IV. Операционно – исполнительский этап(23 мин.)
1. Строение молекулы
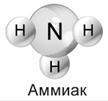
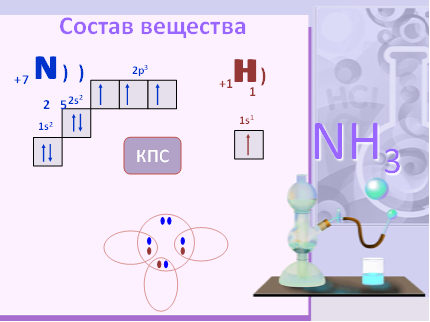
Формула аммиака – NH3, т.е. это водородное соединение азота.
Работа в группах:
Практическое задание: Моделирование молекулы аммиака (шаро – стержневые наборы)
Работа с учебником: § 17, стр. 47.
Ответьте на вопросы:
1. Изобразите электронную и структурную формулу аммиака.
2. Определите химическую связь в этой молекуле.
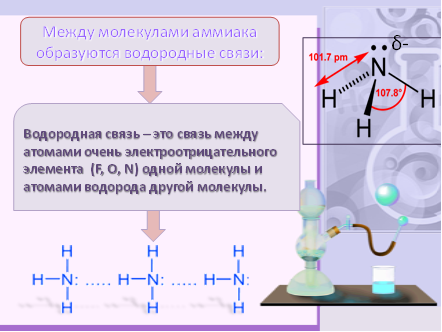
3. Какую пространственную форму имеет молекула аммиака? (Молекула аммиака имеет форму правильной пирамиды: в углах треугольника находятся атомы водорода, а в вершине пирамиды – атом азота.Угол между связями Н-N-Н равен 107.)
4. Кристаллическая решётка (Молекулярная)
Объяснение:
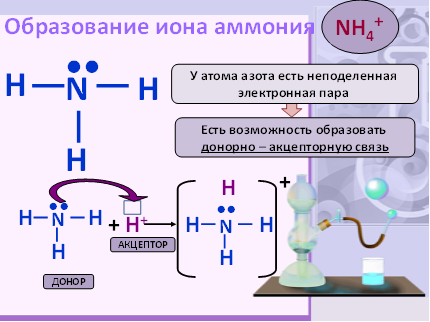
Атом азота образует с атомами водорода 3 ковалентные полярные связи (т.к. электроотрицательность азота больше, чем у водорода) за счет своих трех неспареных электронов; неподеленная электронная пара атома азота способна участвовать в образовании четвертой ковалентной связи по донорно-акцепторному механизму с атомами, имеющими вакантную орбиталь;
2. Физические свойства
Изучение свойств (объяснение с элементами беседы)
- Имеет ли газ специфический запах? (Характерный резкий запах, токсичен)
Физиологическое влияние на организм человека.
Относится к группе веществ удушающего действия, способных вызывать токсический отёк лёгких и тяжёлые поражения нервной системы. Пары сильно раздражают слизистые оболочки глаз и органы дыхания, а также кожные покровы. Вызывают обильное слёзотечение, боль в глазах, хим. ожог роговицы, потерю зрения, приступы кашля.
- Какого цвета исследуемый газ? (Аммиак бесцветный газ)
- Легче воздуха в 1,7 раз.
- Плотность 0,77 г/л
- Температура кипения аммиака - -33,40С, он сжижается, а при-77,80 С превращается в твёрдое белое вещество.
- Хорошо растворяется в воде: в 1 V:700 V
- Сжиженный аммиак при испарении поглощает тепло, при соприкосновении с кожей возникает обморожение различной степени.
3. Химические свойства:
Взаимодействие с водой (Н2О) Оформление в опорном конспекте и оформление на доске.
NH3 + H2O ![]() NH3×H2O (основание)
NH3×H2O (основание) ![]() NH4+ + ОН.
NH4+ + ОН.
Нашатырный спирт
Демонстрационный опыт «Аммиачный фонтан»
Проблема: Почему индикаторы меняют свой цвет в растворе аммиака?
NH3 + H2O ![]() NH3×H2O (основание)
NH3×H2O (основание) ![]() NH4+ + ОН.
NH4+ + ОН.
При растворении в воде образуется гидроксид аммония – основание, поэтому фенолфталеин окрашивает раствор в малиновый цвет.
Аммиак хорошо растворим в воде: при 20 С в 1 объёме воды растворяется до 700 объёмов аммиака.
Постановка проблемы.
Вопрос: Почему аммиак очень хорошо растворяется в воде?
Строение молекулы позволяет прогнозировать хорошую растворимость в воде. Это связано с возникновением между его молекулами особой химической связи - водородной. У атома азота есть свободная электронная пара в молекуле аммиака, наличие частичного (+) заряда на атоме водорода и наличие частичного (-) заряда на атоме азота.
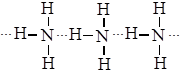
Водородной называется связь между атомами водорода одной молекулы и атомами электроотрицательных элементов другой молекулы (F, O, N )
(учащиеся записывают определение водородной связи)
Взаимодействие с кислотами.
Учитель: Давайте попробуем частично воспроизвести картину давних лет.
Демонстрационный эксперимент «Дым без огня». Что вы наблюдаете?( Дым.)
Учитель: Ребята, вас заинтересовало то, что вы сейчас увидели? Густой дым заполнил колбу и начал «выливаться» на стол. А представьте, как были взволнованы алхимики, когда работали с этим веществом.
Теперь бы вы смогли объяснить англичанам, почему между кораблем и судном противника появился едкий «дым», образовался хлорид аммония.
(записываем в опорный конспект и оформляем на доске химическое уравнение между соляной кислотой и аммиаком)
![]() NН3
+НСI NН4СI
(образование солей аммония, удобрения)
NН3
+НСI NН4СI
(образование солей аммония, удобрения)
Взаимодействие с серной кислотой (оформление опорного конспекта и оформление на доске)
![]()
![]() NН3
+Н2SО4
N Н4 НSО4
Недостаток гидросульфат аммония
NН3
+Н2SО4
N Н4 НSО4
Недостаток гидросульфат аммония
Аммиак горит в кислороде (оформление опорного конспекта и оформление на доске)
![]() 4 NН3+
3О2 2N2
+ 6Н2О
4 NН3+
3О2 2N2
+ 6Н2О
4. Получение аммиака в лаборатории.( просмотр видеоролика)
Нагревание смеси хлорида аммония с гидроксидом кальция.
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + H2O
Полученный аммиак растворяют в воде, в которую добавляем фенолфталеина. Раствор аммиака окрашивается в малиновый цвет.
Вопрос: Почему раствор аммиака окрасился в малиновый цвет?
(в растворе присутствует ион гидроксида, среда щелочная)
Учитель. В аммиачной воде большая часть аммиака содержится в виде молекул NH3, равновесие смещено влево, (т.к. NH3 - слабый электролит) и такая вода содержит много молекул NH3, поэтому она пахнет аммиаком.
Собирание газа - в перевернутую кверху дном пробирку.
Распознавание: а) по запаху; б) по посинению влажной лакмусовой бумажки
в) по появлению белого дыма от поднесенной стеклянной палочки, смоченной HClконц.
5. Получение аммиака в промышленности
Проблемный вопрос: Из какого сырья можно получить аммиак в промышленности?
Учащиеся предполагают, что из азота воздуха.
Задача эта была выдвинута перед отечественной наукой Д.И.Менделеевым, который писал: "Одну из задач прикладной химии составляет отыскание технически выгодного способа получения из азота воздуха его соединений, заключающих ассимилируемый азот. Будущность сельского хозяйства много зависит от открытия подобного способа".
Экономически наиболее выгодный способ промышленного связывания атмосферного азота - синтез аммиака из азота и водорода:
Учитель: Дайте характеристику данной реакции.
· экзотермическая
· обратимая
· каталитическая
· гетерогенная
· с уменьшением объема
Учитель: Какие условия смещения равновесия необходимо для увеличения выхода аммиака?
Учащиеся: уменьшение температуры, увеличение давления
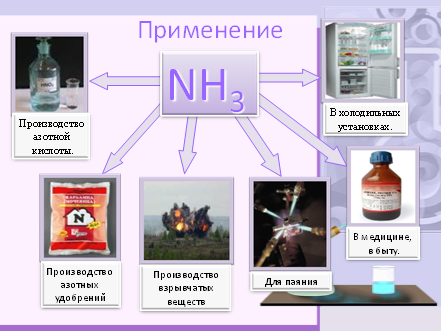
6. Применение
Методика опережающего обучения. Два ученика подготовили презентацию по теме: «Применение аммиака»
Причинно-следственная связь «свойство-применение»).
· Производство азотной кислоты.
· Для получения аммиачной воды.
· Производство азотных удобрений.
· В медицине, в быту.
· В холодильных установках.
· Для паяния.
· Взрывчатых веществ.
V. Проверка усвоения знаний (7 мин.) (контроль/самоконтроль знаний по теме)
1. Валентность азота в молекуле аммиака 4 –
2. Аммиак легче воздуха +
3. Нашатырный спирт – это хлорид аммония +
4. Нашатырный спирт – это спиртовой раствор аммиака –
5. Водный раствор аммиака окрашивает фенолфталеин в малиновый цвет +
6. Соли аммония – слабые основания –
7. Аммиак горит в атмосфере –
8. Растворение аммиака в воде – химический процесс +
VI. Подведение итогов урока. Рефлексия. Домашнее задание.(3 мин.)
Учитель организует фронтальную беседу по рефлексии итогов урока.
Объясняет домашнее задание:
§17, выполнить письменно упр. упр. №7,8 стр. 52
Технологическая карта урока химии в 9 классе по теме: «Аммиак»
|
№ |
Этап урока |
Деятельность учителя
|
Деятельность ученика |
Время (в мин.)
|
|
1 |
2 |
3 |
4 |
5 |
|
1 |
Организацион- ный этап |
Приветствие. Учитель проверяет готовность учащихся к уроку |
Приветствуют учителя |
2 мин |
|
2 |
Актуализация знаний
|
Выполняем вводный контроль: тест по вариантам и проводим взаимопроверку (правильные ответы для контроля – на экране) |
Выполнение теста и взаимопроверка |
5 мин |
|
3 |
Мотивационно - ориентировочный этап
|
Создание проблемной ситуации.Объявление темы урока; беседа с целью выявления знаний учащихся об аммиаке. Создание условий для определения целей, составления плана урока (на интерактивной доске заранее приготовлен план урока, который показан учащимся после обсуждения). |
Учащиеся слушают, наблюдают за экспериментом, пытаются объяснить явление, анализируют полученную информацию. Записывают тему урока в тетрадь.Вместе с учителем выдвигают цели урока. Предлагают план изучения, основываясь на причинно-следственных связях.
|
5 мин |
|
4
|
Операционно – исполнительский этап. |
|
|
23 мин |
|
4-1.Состав и строение молекулы аммиака |
Организует работу учащихся в группах
|
Записывают формулу аммиака, собирают шаро-стержневую модель, зарисовывают молекулу |
3 мин |
|
|
4-2. Физические свойства аммиака |
Организует групповую работу учащихся. |
Изучают физические свойства аммиака и записывают в конспект |
5 мин |
|
|
4-3. Водородная связь |
Постановка проблемы. Почему аммиак очень хорошо растворяется в воде? |
записывают определение водородной связи
|
5 мин
|
|
|
4-4. Химические свойства аммиака. |
Учитель объясняет новый материал. |
Учащиеся слушают и оформляют конспект. |
7 мин
|
|
|
4-5. Применение аммиака.
|
Учитель организует работу учащихся с учебником и презентацией. |
Выписывают из учебника основные направления применения аммиака |
3 мин. |
|
|
5
|
Проверка усвоения знаний
|
Организует фронтальный опрос по подготовленным вопросам. В чем заключается уникальность аммиака? Отметь особенности этого газа |
Учащиеся выполняют задания у доски и в тетради. |
7 мин |
|
6 |
Подведение итогов урока. Рефлексия. Домашнеезадание. |
Организует фронтальную беседу по рефлексии итогов урока. Ученики продолжают предложения: Я узнал………………… Меня удивило………… Хочу повторить………… Выскажите ваше мнение «Можно не любить химию, но прожить без неё сегодня и завтра нельзя» Объясняет домашнее задание. |
Записывают домашнее задание: §17,упр. №7,8 стр. 52
|
3мин
|
Приложение № 1
Вводный контроль, тест 5 мин. Цель: закрепить знания о строении и свойствах азота. Оценивание до 5 баллов при взаимопроверке.
1. Как изменяются неметаллические свойства элементов подгруппы азота с увеличением порядкового номера элемента?
а) увеличиваются; б) уменьшаются; в)остаются без изменения; г)сначала увеличиваются, потом уменьшаются
2. На каких энергетических подуровнях не могут располагаться валентные электроны атома азота?
а) 2S; б) 3D; в) 2P; г) 3P.
3. Формула вещества, в котором азот проявляет свою высшую степень окисления?
а)NO2; б) Ca3N2; в) HNO3; г) Ca(NO3)2.
4. Укажите формулы веществ, в которых азот проявляет свою минимальную степень окисления?
а)NH3; б) HNO2; в)Na3N; г)N2O.
5. Азот проявляет восстановительные свойства, реагируя с:
а)водородом; б)кислородом; в)магнием; г)фтором.

Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.