
Температура и её измерение. Шкала температур Цельсия.
Решение задач
 Что такое термометр, мы знаем с малых лет. А
известно ли вам, что термометрия - наука об измерении температуры - составляет
целый раздел физики и уходит корнями в глубь тысячелетий?
Что такое термометр, мы знаем с малых лет. А
известно ли вам, что термометрия - наука об измерении температуры - составляет
целый раздел физики и уходит корнями в глубь тысячелетий?
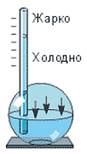
Изобретению термометра предшествовало создание термоскопа - прибора, который отмечал изменение температуры (см. рисунок). При потеплении воздух внутри шара расширялся и вытеснял воду из шара в трубку. По изменению уровня воды и судили об изменении температуры. В XVII веке термоскопы стали изготавливать в виде герметично запаянной трубки, заполненной ртутью или спиртом. С этого момента показания термоскопов перестали зависеть от атмосферного давления. Опыты с ними стали всеобщим увлечением, ими даже украшали комнаты. Но, чтобы термоскоп стал термометром, нужно было научиться выражать его показания в виде числа, то есть изобрести шкалу. Как же это сделать? Разные ученые поступали по-разному.
Известно, что соль, смешанная со льдом, разъедает его, частично превращая в воду. При этом смесь сильно охлаждается. Исследуя это явление, американец Д. Фаренгейт обнаружил, что температура их смеси не зависит ни от количества льда, ни от количества соли, ни от температуры в лаборатории. Температуру этой смеси он и принял за 0 °F (читается: ноль градусов по Фаренгейту). Француз Р. Реомюр предложил в качестве нуля градусов принять температуру замерзания воды. Температуру кипения воды он принял за 80 °R (читается: восемьдесят градусов по Реомюру).
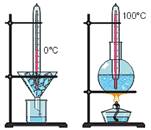 Проверку шкалы Реомюра выполнял шведский ученый А.
Цельсий. Он, в частности, писал: "Эти опыты я повторял два года, во
все зимние месяцы, при различной погоде и разнообразных изменениях состояния
барометра и всегда находил точно такую же точку на термометре. Я помещал
термометр не только в тающий лед, но также при сильных холодах приносил снег в
мою комнату на огонь до тех пор, пока он не начинал таять. Я помещал также
котел с тающим снегом вместе с термометром в топящуюся печь и всегда находил,
что термометр показывал одну и ту же точку, если только снег лежал плотно
вокруг шарика термометра".
Проверку шкалы Реомюра выполнял шведский ученый А.
Цельсий. Он, в частности, писал: "Эти опыты я повторял два года, во
все зимние месяцы, при различной погоде и разнообразных изменениях состояния
барометра и всегда находил точно такую же точку на термометре. Я помещал
термометр не только в тающий лед, но также при сильных холодах приносил снег в
мою комнату на огонь до тех пор, пока он не начинал таять. Я помещал также
котел с тающим снегом вместе с термометром в топящуюся печь и всегда находил,
что термометр показывал одну и ту же точку, если только снег лежал плотно
вокруг шарика термометра".
Тщательно проверив постоянство температуры таяния льда, Цельсий принялся за исследование температуры кипения воды. Он, в частности, обнаружил, что она зависит от наличия примесей и внешнего давления. В горах, например, где атмосферное давление низкое, вода закипает при меньшей температуре.
Усилиями А. Цельсия и другого шведского ученого, К. Линнея, была создана шкала, которой мы пользуемся и сегодня. В ней имеются две постоянные точки: 0 °С - температура сосуществования воды и льда, 100 °С - температура кипения воды при нормальном атмосферном давлении. Расстояние между этими так называемыми реперными точками шкалы, поделенное на 100 равных частей, называется градусом температурной шкалы Цельсия (лат. "градус" - шаг, ступень).
Таким образом, ученые XVIII века называли температурой то, что показывали их термометры. Поэтому в разных странах были приняты различные температурные шкалы. Единство измерений температуры стало возможным лишь век спустя, благодаря усилиям англичанина У. Томсона. Он вошел в историю физики тем, что ввел абсолютную шкалу температуры.


Измеряемая по шкале Цельсия температура может быть как положительной, так и отрицательной, в то время как абсолютная температура всегда неотрицательна. Наименьшая температура по абсолютной шкале - это абсолютный нуль.
При такой температуре р = 0, что согласно МКТ возможно, если средняя кинетическая энергия молекулы равна нулю.
На рисунке указано соответствие двух температурных шкал.
Таким образом, при абсолютном нуле температуры прекращается тепловое движение частиц вещества. Ниже этой температуры быть уже не может. Эта температура приблизительно равна - 273oС.
Единица абсолютной температуры называется кельвином [K].
Универсальность введения абсолютной шкалы ещё и в том, что цена деления шкалы совпадает со шкалой Цельсия: 1 К = 1oС
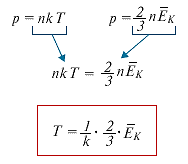
Опытным путем было установлено, что при постоянном объеме и температуре давление газа прямо пропорционально его концентрации. Объединяя экспериментально полученные зависимости давления от температуры и концентрации, получаем уравнение: р = nkT,
где - k коэффициент пропорциональности - постоянная Больцмана.
Постоянная Больцмана связывает температуру со средней кинетической энергией движения молекул в веществе. Это одна из наиболее важных постоянных в МКТ. Температура прямо пропорциональна средней кинетической энергии теплового движения частиц вещества. Следовательно, температуру можно назвать мерой средней кинетической энергии частиц, характеризующей интенсивность теплового движения молекул. Этот вывод хорошо согласуется с экспериментальными данными, показывающими увеличение скорости частиц вещества с ростом температуры.
Эти выводы справедливы не только для идеального, но и для реальных газов. Справедливы они и для жидкостей и твердых тел. В любом состоянии температура вещества характеризует интенсивность теплового движения его частиц.
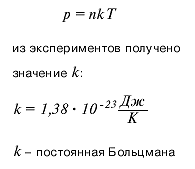
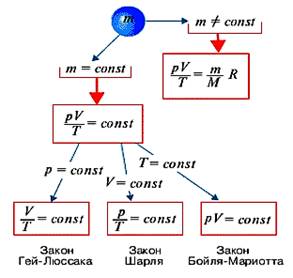
Уравнение состояния идеального газа, позволяет описать поведение идеального газа при любых изменениях параметров p, V, m, и Т.
Рассмотрим процессы, которые протекают при изменении только двух параметров, а третий остается постоянным. Эти процессы получили название изопроцессов (от греческого “изос” – равный, одинаковый).
Уравнения состояния газа для них легко получить из уравнения Клапейрона-Менделеева, положив один из параметров равным постоянной величине.
1. Если в уравнении состояния ![]() или уравнение Клапейрона-Менделеева
или уравнение Клапейрона-Менделеева ![]() считать Т = const, то вся его правая часть будет
величиной постоянной:
считать Т = const, то вся его правая часть будет
величиной постоянной: ![]() .
.
Полученная формула выражает закон,
установленный опытным путем в 1662 г. английским ученым Р.Бойлем и
в 1667 г. независимо от него французским физиком Э.Мариотта: ![]()
 Для данной массы газа при
постоянной температуре произведение объема газа на соответствующее ему давление
есть величина постоянная.
Для данной массы газа при
постоянной температуре произведение объема газа на соответствующее ему давление
есть величина постоянная.
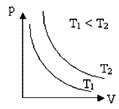
Данный процесс, протекающих при постоянной температуре, называют изотермическим. Закон Бойля – Мариотта можно проверить экспериментально. Представим этот процесс графически
Графически зависимость между давлением и объемом газа при постоянной температуре представлен виде гиперболы
Каждому значению температуры соответствует своя кривая (см. рис.). Эти кривые называют изотермой.
2. Газ находится в условиях, когда
постоянным сохраняется его давление Р. Переход газа из
одного состояния в другое, совершающийся при постоянном давлении,
называют изобарным. В этом случае постоянным будет отношение
объема газа к его температуре, из уравнения Клапейрона-Менделеева следует,
что ![]() следовательно, для данной массы газа
и постоянном давлении объем газа прямо пропорционален абсолютной температуре.
следовательно, для данной массы газа
и постоянном давлении объем газа прямо пропорционален абсолютной температуре.
Этот закон был установлен опытным
путем в 1802г. французским физиком Ж. Гей-Люссаком. Формулу
закона Гей-Люссака, его можно представить в виде: ![]() ,
, ![]() , при m = const.
, при m = const.
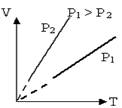 Графически такой процесс с помощью координатных
осей V, Т можно изображается прямой, продолжение
которой проходит через начало координат. Называется эта прямая изобара. Угол
ее наклона к оси температур зависит от давления газа: чем больше давление, тем
меньше угол наклона (см.рис. а).
Графически такой процесс с помощью координатных
осей V, Т можно изображается прямой, продолжение
которой проходит через начало координат. Называется эта прямая изобара. Угол
ее наклона к оси температур зависит от давления газа: чем больше давление, тем
меньше угол наклона (см.рис. а).
3. Рассмотрим поведение газа в
условиях, когда постоянным сохраняется его объем V. Из
уравнения Клапейрона – Менделеева следует, что в этом случае постоянным
будет отношение давления к его температуре: ![]() при
постоянном объеме давление газа прямо пропорционально его абсолютной температуре.
при
постоянном объеме давление газа прямо пропорционально его абсолютной температуре.
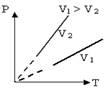 Этот закон был экспериментально установлен французским
ученым Ж.Шарлем. Его можно проверить экспериментально. Переход
газа из одного состояния в другое, совершающийся при постоянном объеме,
называют изохорным процессом. График этого процесса строится
по уравнению и представляет собой прямую линию, продолжение которой проходит
через начало координат; ее называют изохорой. Угол наклона
изохоры к оси температур тем больше, чем меньше объем газа.
Этот закон был экспериментально установлен французским
ученым Ж.Шарлем. Его можно проверить экспериментально. Переход
газа из одного состояния в другое, совершающийся при постоянном объеме,
называют изохорным процессом. График этого процесса строится
по уравнению и представляет собой прямую линию, продолжение которой проходит
через начало координат; ее называют изохорой. Угол наклона
изохоры к оси температур тем больше, чем меньше объем газа.
Выполняются ли этим законам реальные газы?Опыты показывают, что для всех реальных газов наблюдаются отступления от рассмотренных выше газовых законов, которые особенно заметны при больших давлениях и плотностях газа, а также при очень высоких или низких его температурах.
Оказывается, реальные газы подчиняются рассмотренным законам идеального газа при малых плотностях и при не очень высоких и не слишком низких температурах.
Решение задач
Задача № 1. Выразите в Кельвинах значения температуры: - 54 0C; 173 0С; 23 0С.
Решение: Т = t + 273;
Т1 = - 54 0C + 273 = 219 К;
Т2 = 173 0C + 273 = 446 К;
Т3 = 23 0C + 273 = 296 К.
Ответ: 219 К, 446 К, 296 К.
Задача № 2. Воспользуйтесь таблицей Менделеева и определите молярную массу ацетилена С2H2. Чему равна масса одной молекулы ацетилена в единицах в единицах СИ?

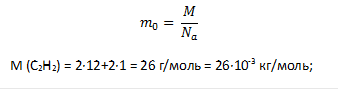 Дано: Решение:
Дано: Решение:
С2Н2
Nа = 6,02·1023 моль-1
М - ?
m0 - ?
Ответ: 26 · 10-3 кг/моль; 4,3 · 10-26 кг.

Задача № 3. Сколько молекул содержится в 10 г углекислого газа?
Дано: Си: Решение:
СО2
Nа = 6,02·1023 моль-1
m = 10 г 0,01кг
N - ?
Ответ: 1,37·1024
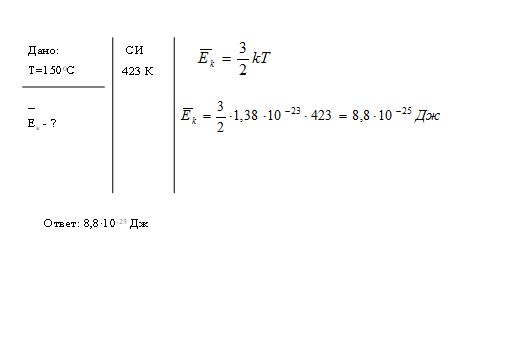
Задача № 4. Определите среднюю кинетическую энергию поступательного движения молекулы газа при температуре 1500С.
Задача №5. Какое давление на стенки сосуда производит кислород, если υ = 400 м/c, n =2,7·1019 м-3.
|
|
Решение:
|
|
O2 υ = 400 м/c n=2,7·1019 м-3
р-? |
p = 1/3 ·mo·n·υ2, m 0= M/ NA p = 1/3 · M /NA· υ2·n p = 1/3 ·2,7·1019 м -3 ·32·10-3кг/моль/6,02·1023 моль-1· (400 м/с)2 =72000 Па Ответ:72 кПа
|
Задача № 6. Найдите среднюю кинетическую энергию поступательного движения молекул гелия, если при давлении 0,5·105 Па их концентрация n=1,5·109 м-3
|
|
Решение:
|
|
He М (Не) =4·10-3 кг/моль р =0,5·105 Па n= 1,5·109 м-3
|
p = 2/3 n
·
Ответ: 5·10-21 Дж
|
|
"Основы МКТ" 1-вариант |
"Основы МКТ" 2-вариант |
"Основы МКТ" 3-вариант |
|||
|
1. Абсолютная температура тела равна 300 К. По шкале Цельсия чему она равна? |
1. Выразите в Кельвинах значения температуры: 37 °С |
1. Выразите в Кельвинах значения температуру: -43 °С |
|||
|
2. Опытным обоснованием существования промежутков между молекулами является ... 1) … броуновское движение 2) … диффузия 3) … кристаллизация 4) … испарение жидкости |
2. Броуновское движение – … 1) … движение молекул 2)…отрыв молекул с поверхности жидкости 3)…тепловое движение взвешенных частиц в жидкости (или газе) 4)…движение молекул, объясняющее текучесть жидкости |
2. Давление газа на стенки сосуда обусловлено … 1) прилипанием молекул к стенкам сосуда 2) столкновением молекул со стенками сосуда 3) столкновением молекул газа друг с другом 4) проникновением молекул сквозь стенки сосуда
|
|||
|
3. Количество вещества определяется ...
|
3. Число молекул вещества определяется отношением:
1)
|
3. Основное уравнение молекулярно-кинетической теории … 1) 3)
|
|||
|
4.
Какова молярная масса карбоната натрия |
4.
Какова молярная масса бромида магния |
4. Какова молярная
масса азотной кислоты |
|||
|
5. Сколько молекул содержится в 50г Аℓ? |
5. Рассчитать массу одной молекулы Н2SО4 |
5. Средняя квадратичная скорость молекул газа, находящегося при температуре 100 °С равна 540 м/c. Определить массу молекулы газа? |
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.