
Уравнение Менделеева – Клапейрона. Закон Дальтона.
Решение задач
Уравнение Клапейрона при m = const:
отношение произведения давления и объёма к температуре есть величина постоянная
для постоянной массы газа: ![]()
Если изменяется какой-либо макроскопический параметр газа постоянной массы, то два других параметра изменятся таким образом, чтобы указанное соотношение осталось постоянным.
Отношение произведения давления и
объёма к температуре равно универсальной газовой постоянной для одного моля
идеального газа: ![]()
Уравнение Менделеева при v = 1 моль: ![]()
Произведение постоянной Больцмана и постоянной Авогадро называется универсальной газовой постоянной.
![]() - уравнение состояния
идеального газа.
- уравнение состояния
идеального газа.
Уравнение состояния идеального газа получило название «уравнение Менделеева-Клапейрона».
Закон Дальтона
Сформулирован этот закон так: общее давление смесей газов, не реагирующих друг с другом, равно сумме парциальных давлении составных частей (компонентов).
P = p1 + p2 + p3 + ….. + pn (14)
где Р — общее давление смеси газов; p1, p2, p3, …., pn – парциальные давления компонентов смеси.
Парциальным давлением называется давление, оказываемое каждым компонентом газовой смеси, если представить этот компонент занимающим объем, равный объему смеси при той же температуре. Иными словами, парциальным давлением называется та часть общего давления газовой смеси, которая обусловлена данным газом.
Из закона Дальтона следует, что при наличии смеси газов п в уравнении (12) представляет собой сумму числа молей всех компонентов, образующих данную смесь, а Р— общее давление смеси, занимающей при температуре Т объем V.
Зависимость между парциальными давлениями и общим выражается уравнениями:
![]() ;
; ![]() ;
; ![]() (15а)
,
(15а)
,
где n1, n2 , n3 — число молей компонента 1, 2, 3, соответственно, в смеси газов.
Отношения ![]() называются
мольными долями данного компонента.
называются
мольными долями данного компонента.
Если
мольную долю обозначить через N, то парциальное давление любого i-го компонента
смеси (где i = 1,2,3,...) будет равно: ![]() .
.
Таким образом, парциальное давление каждого компонента смеси равно произведению его мольной доли па общее давление газовой смеси.
Помимо парциального давления у газовых смесей различают парциальный объем каждого из газов v1, v2, v3 и т. д.
Парциальным называют объем, который занимал бы отдельный идеальный газ, входящий в состав идеальной смеси газов, если бы при том же количестве, он имел давление и температуру смеси.
Сумма парциальных объемов всех компонентов газовой смеси равна общему объему смеси
V = v1, + v2 + v3 + ... + Vn (16) .
Отношение ![]() и
т. д. называется объемной долей первого, второго и т.д. компонентов газовой
смеси.
и
т. д. называется объемной долей первого, второго и т.д. компонентов газовой
смеси.
Для идеальных газов мольная доля равна объемной доле. Следовательно, парциальное давление каждого компонента смеси равно также произведению его объемной доли на общее давление смеси.
![]() ;
; ![]() ; pi = ri´P .
; pi = ri´P .
Парциальное давление обычно находят из величины общего давления с учетом состава газовой смеси. Состав газовой смеси выражают в весовых процентах, объемных процентах и в мольных процентах.
Объемным процентом называется объемная доля, увеличенная в 100 раз (число единиц объема данного газа, содержащегося в 100 единицах объема смеси)
![]() ;
; ![]()
Мольным процентом q называется мольная доля, увеличенная в 100 раз.
![]() ;
; ![]()
Весовой процент данного газа — число единиц массы его, содержащихся в 100 единицах массы газовой смеси.
![]() ;
; ![]()
где m1, m2 – массы отдельных компонентой газовой смеси; m – общая масса смеси.
Для
перехода от объемных процентов к весовым, что бывает необходимым в практических
расчетах, пользуются формулой: ![]() (18)
,
(18)
,
где ri (%) — объемное процентное содержание i-гo компонента газовой смеси; Mi —молекулярная масса этого газа; Мср - средняя молекулярная масса смеси газов, которую вычисляют по формуле
Мср = М1 · r1 + M2 · r2 + M3 · r3 + ….. + Mi´ri (19)
где М1, M2, M3, Mi — молекулярные мaccы отдельных газов.
Если состав газовой смеси выражен количеством масс отдельных компонентов, то среднюю молекулярную массу смеси можно выразить по формуле
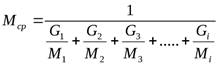 (20) ,
(20) ,
где
G1, G2, G3, Gi – доли масс
газов в смеси: ![]() ;
; ![]() ;
; ![]() и
т.д.
и
т.д.
Решение задач
1. Определить давление кислорода в баллоне объемом V = 1 м3 при температуре t=27 °С. Масса кислорода m = 0,2 кг.
|
Дано: V = 1 м3 μ = 0,032кг/моль m = 0,2 кг t=27 °С |
СИ:
Т=300К |
Решение: Записываем уравнение Менделеева-Клапейрона и находим из него давление, производимое газом:
|
|
Р-? |
2. Баллон емкостью V= 12 л содержит углекислый газ. Давление газа Р = 1 МПа, температура Т = 300 К. Определить массу газа.
|
Дано: V = 12 л μ =0,044кг/моль Т=300К Р =1 МПа |
СИ: 0,012м3
1∙106Па |
Решение: Записываем уравнение Менделеева-Клапейрона и находим массу газа
|
|
m -? |
3. При температуре Т = 309 К и давлении Р = 0,7 МПа плотность газа ρ = 12 кг/м3. Определить молярную массу газа.
|
Дано: V = 12 л Т=309К Р =0,7 МПа ρ = 12 кг/м3 |
СИ: 0,012м3
0,7∙106Па |
Решение: Записываем уравнение Менделеева-Клапейрона
Так как масса газа может быть определена через плотность газа и его объем имеем:
|
|
μ -? |
||
|
Отсюда находим молярную массу газа:
|
||
4. Какова плотность водорода при нормальном атмосферном давлении и температуре 20°С.
|
Дано: V = 12 л t=20°C Р =105 Па μ =0,002кг/моль |
СИ: 0,012м3 T=293К
|
Решение: Нормальное атмосферное давление – это давление, равное 105 Па. И эту информацию запишем как данные задачи. Записываем уравнение Менделеева-Клапейрона
|
|
ρ -? |
||
|
Так как масса газа может быть определена через плотность газа и его объем имеем:
Отсюда находим плотность газа:
|
||
5. До какой температуры Т1 надо нагреть кислород, чтобы его плотность стала равна плотности водорода при том же давлении ,но при температуре Т2 = 200 К?
|
Дано: Т2=200К ρ1 = ρ2 μ1 =0,032кг/моль μ2 =0,002кг/моль |
Решение: Записываем уравнение Менделеева-Клапейрона для кислорода и для водорода через плотности газов:
Так
как по условию давление у двух газов одинаковое, то можно приравнять правые
части данных уравнений: Сократим на R и на плотность ρ (по условию плотности газов равны) и найдем Т1 |
|
Т1 -?
|
|
|
|
|
6. В сосуде объемом 4·10-3 м3 находится 0,012 кг газа при температуре 177°С. При какой температуре плотность этого газа будет равна 6·10-6 кг /см3, если давление газа остается неизменным.
|
Дано: V=4·10-3 м3 m=0,012 кг t1=177°C ρ2=6·10-6 кг /см3 |
СИ:
Т1=450К 6 кг/м3 |
Решение:
|
|
Т2 -? |
|
|
Смесь газов
7. В баллоне объемом 25 литров находится 20 г азота и 2 г гелия при 301К. Найдите давление в баллоне.
|
Дано: V = 25 л μ1 = 0,028кг/моль m1 = 20 г μ2 = 0,004кг/моль m2 = 2 г Т=301К |
СИ: 0,025м3
0,02кг
0,002кг |
Решение: Записываем уравнение Менделеева для каждого газа и находим из него давление газов
По закону Дальтона результирующее давление в сосуде равно сумме парциальных давлений газов:
|
|
Р-? |
|
|
8. Определить плотность смеси, состоящей из 4 граммов водорода и 32 граммов кислорода при давлении 7°С и давлении 93кПа?
|
Дано: μ1 = 0,002кг/моль m1 = 4 г μ2 = 0,032кг/моль m2 = 32 г t=7°С Р =93кПа |
СИ: 0,004кг
0,032кг T=280K 93000Па |
Решение:
По
закону Дальтона:
|
|
ρ-? |
|
|
|
|
||
Задания
1. Установите соответствие между физическими величинами и приборами для их измерения. К каждой позиции первого столбца подберите нужную позицию второго и запишите в таблицу выбранные цифры под соответствующими буквами.
|
Физические величины |
Приборы для их измерения |
|
|
А) Давление Б) Температура |
1) Калориметр 2) Термометр 3) Манометр 4) Динамометр |
Ответ:
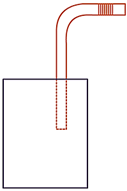 2. В герметично закрытый пакет из-под
сока вставлена изогнутая трубочка для коктейля (см. рисунок), внутри которой
находится небольшой столбик сока. Если обхватить пакет руками и нагревать его,
не оказывая на него давления, столбик сока начинает двигаться вправо к
открытому концу трубочки. Выберите все утверждения, которые верно характеризуют
процесс, происходящий с воздухом в пакете, и запишите номера выбранных
утверждений.
2. В герметично закрытый пакет из-под
сока вставлена изогнутая трубочка для коктейля (см. рисунок), внутри которой
находится небольшой столбик сока. Если обхватить пакет руками и нагревать его,
не оказывая на него давления, столбик сока начинает двигаться вправо к
открытому концу трубочки. Выберите все утверждения, которые верно характеризуют
процесс, происходящий с воздухом в пакете, и запишите номера выбранных
утверждений.
1) Воздух в пакете расширяется.
2) Воздух в пакете сжимается.
3) Температура воздуха понижается.
4) Температура воздуха повышается.
5) Давление воздуха в пакете остается неизменным.
6) Давление воздуха в пакете повышается.
Решение. 1) Нагревание происходит при постоянном давлении (капелька может перемещаться), значит, объём ……
2) Происходит нагревание воздуха в пакете, температура …….
3) Так как капелька перемещается, то давление ……….
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.