
Занятие №
Тема: Уравнение состояния идеального газа. Газовые законы.
Цели занятия: Дидактическая: сформировать умение описывать состояние термодинамической системы данной массы газа с помощью трех макроскопических параметров: давления, объема, температуры; выяснить физический смысл универсальной газовой постоянной; ввести понятие изопроцесса; изучить газовые законы; развивать навыки решения задач.
Воспитательная:дать возможность почувствовать свой потенциал каждому учащемуся, чтобы показать значимость полученных знаний;побудить к активной работе мысли;развивать кругозор студентов и патриотические чувства, гордости за свою страну, которая играла и играет в прогрессе человечества большую роль.
Развивающая: формировать умение вести рассказ с помощью опорного конспекта, выражать свои мысли правильным «физическим» языком; формировать умение выделять главное, обобщать и связывать имеющиеся знания со знаниями из других областей; Осуществляя проблемно-поисковый метод самостоятельно получить из уравнения состояния Менделеева –Клапейрона газовые законы для изо процессов; формировать умение наблюдать и анализировать явления, кратко и лаконично отвечать на вопросы.
Тип занятия:
изучение нового материала, с использованием элементов беседы.
Ход занятия.
1. Организационный момент. Проверка домашнего задания. Повторение пройденного материала.
Преподаватель. Здравствуйте ребята. Добрый день. Выполним с вами экспериментальную задачу. Определим атмосферное давление в нашем кабинете.
Оборудование: термометр, линейка (рассуждения студентов).
Студент. Термометром можно измерить температуру, линейкой измерить размеры комнаты и вычислить объем. А как установить зависимость между давлением, объемом и температурой?
Преподаватель. И это будет целью нашего урока, вывели физический закон,
устанавливающий зависимость между тремя макроскопическими параметрами -
p, V, T; научиться использовать закон при
решении задач.
Преподаватель. Что такое идеальный газ?
Студент. Идеальным газом называется модель реального газа. Молекулярно-кинетическая теория рассматривает идеальный газ как множество частиц (молекул), расстояние между которыми намного превышает размеры самих частиц, находящихся в состоянии непрерывного хаотичного движения.
Преподаватель. Назовите условия, при которых газ можно считать идеальным?
Студент. Газ, удовлетворяющий следующим условиям:
- Межмолекулярные взаимодействия отсутствуют.
- Взаимодействия молекул газа происходит только при соударениях, и являются упругими.
- Молекулы газа не имеют объема – материальные точки.
Преподаватель. Что называется концентрацией?
Студент. Концентрация – это число молекул в единице объема.
Преподаватель. Запишите и объясните физический смысл основного уравнения молекулярно-кинетической теории.
Студент. Давление идеального газа обусловлено ударами молекул о стенку сосуда, поэтому с помощью молекулярно-кинетической теории его можно выразить через концентрацию молекул, средние скорости молекул и массу одной молекулы. p=⅓nmoυ2 - основное уравнение МКТ (уравнение Клаузиуса), устанавливает связь между микро- и макромиром.
Постановка проблемного вопроса и решение его.
Преподаватель. Какие параметры, характеризующие газ и процессы, проходящие в
нем, называются микроскопическими параметрами (микропараметрами)?
Студент. Состояние
идеального газа и процессы, проходящие в нем, будут определяться количеством
частиц (молекул), из которых состоит газ, и их параметрами, такими как масса,
диаметр, скорость, энергия и пр.
Такие параметры называются микроскопическими или
микропараметрами.
Преподаватель. Какие параметры, характеризующие газ, и процессы, проходящие
в нем, называются макроскопическими параметрами (макропараметрами)?
Студент. Параметры, характеризующие свойства газа как целого называются макроскопическими или макропараметрами.
Преподаватель. Если состояние газа не меняется, то не меняются и эти параметры. Назовите макропараметры, характеризующие газ?
Студент. p – давление, V – объем, T – температура.
Преподаватель. Температуру, объем, давление и некоторые другие параметры принято называть параметрами состояния газа. Выведем уравнение, устанавливающее зависимость между этими параметрами.
2. Изучение нового материала
1.Постоянная Лошмидта.
Из основного уравнения МКТ идеального газа можно получить уравнение состояния идеального газа, связывающее между собой параметры состояния p, V и Т. p=n∙k∙T (1), если исключим из основного уравнения МКТ микроскопические параметры, заменяя их на макроскопические параметры, используя известные соотношения, получаем: (1)
Это соотношение позволяет по двум известным макроскопическим параметрам (давлению и температуре газа) оценить микроскопический параметр (концентрацию).
Нормальные условия:
атмосферное давление p=1,013*105 Па, температура 00С, или Т=273,15 К:
Найдем концентрацию молекул любого идеального газа при нормальных условиях (н.у.):
n=p/kT=1,01*105/ (1,38*10-23*273) м-3 ≈2,7*1025 м -3.
Это значение концентрации молекул идеального газа при нормальных условиях называется постоянной Лошмидта
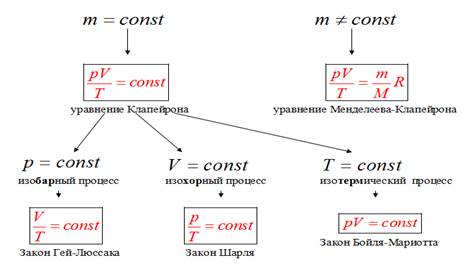
2.Уравнение Клапейрона.
Получим теперь с помощью равенства (1) новое
уравнение. Если известно полное число частиц газа N, занимающего объем V, то
число частиц в единице объема
n=N/V, N=const
С учетом этого выражение (1) приводится к виду
P=NkT/V
pV=NkT
pV/T=NkT (2)
p1V1/T1=p2V2/T2=
const
Так как Nk=const.
Для постоянной массы идеального газа отношение произведения давления на объем к данной температуре есть величина постоянная.
Выведенное нами уравнение связывает давление, объем и температуру, которые определяют состояние идеального газа, называется уравнением состояния идеального газа (уравнение Клапейрона)
Историческая справка. В 1834 г. Французский физик Б. Клапейрон, работавший длительное время в России (Петербурге), вывел уравнение состояние идеального газа при постоянной массе газа (m=const)
3. Уравнение Менделеева – Клапейрона.
Рассмотрим случай для произвольной массы газа
pV/T=kTN (2)
N=m/mo
mo= M/NA N=m·NA/M
pV= mkNAT/M
где: NA = 6,02·1023 моль-1 - число Авогадро,
k=1,38·10-23 Дж/К - постоянная Больцмана
R=kN A = 8,31Дж/( моль·К) – универсальная газовая постоянная.
pV=m/M R T
уравнение Менделеева – Клапейрона - уравнение состояния идеального газа, связывающее три макроскопических параметра (давление, объем и температуру) газа данной массы.
Историческая справка. Обобщив уравнение Клапейрона и введя понятие универсальной газовой постоянной, русский ученый Д. И. Менделеев в 1874 г. вывел общее уравнение для состояния идеального газа. ( Уравнение Менделеева – Клапейрона). С помощью данного уравнения можно описывать процессы сжатия и расширения, нагревания и охлаждения идеального газа.
4. Актуализация знаний.
Фронтальный опрос
* Что является объектом изучения МКТ? (идеальный газ)
* Что в МКТ называют идеальным газом? (идеальный газ- газ, в котором взаимодействие между молекулами можно не учитывать)
* Для того чтобы описать состояние идеального газа используют три термодинамических параметра. Какие? (давление, температура и объём)
* Ни один термодинамический параметр нельзя изменить, не затронув один, а то и два других параметра. Каким уравнением взаимосвязаны все три параметра? (уравнение Менделеева – Клапейрона)
* Назовите микроскопические параметры идеального газа (m,υ²,n,E)
* Как создаётся давление? (число ударов молекул)
* Как термодинамический параметр давление связан с микроскопическими параметрами? (основное уравнение МКТ)
* С какими микроскопическими параметрами связана температура? (υ² или E)
* Как объём связан с микроскопическими параметрами? (объём обратно пропорционален концентрации)
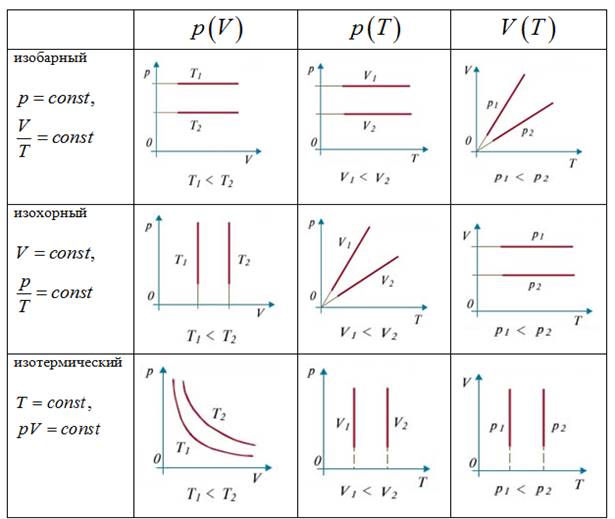
5. Изучение газовых законов.
Газовые законы - количественные зависимости между двумя параметрами газа при
фиксированном значении третьего параметра.
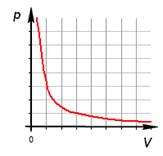
1. Изотермический процесс.
а) формула (P1 V1 = P2 V2 )
б) формулировка (Изотермическим процессом называются изменения состояния термодинамической системы, протекающие при постоянной температуре)
в) история открытия закона (Закон установлен
экспериментально до создания молекулярно-кинетической теории газов английским
физиком Робертом Бойлем в 1662 году и французским физиком Эдмоном Мариоттом в
1676 году)
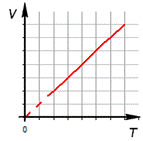
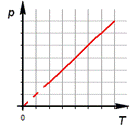
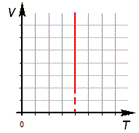
2. Изобарный процесс.
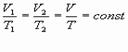
а) формула
б) формулировка (Изобарным процессом называют изменения состояния термодинамической системы, протекающие при постоянном давлении)
в) история открытия (Закон установлен в 1802 году французским физиком Гей-Люссаком, который определяет объём газа при различных значениях температур в пределах от точки кипения воды. Газ содержали в баллончике, а в трубке находилась капля ртути, запирающая газ, расположенная горизонтально)
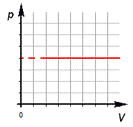
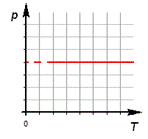
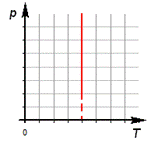
3.Изохорный процесс.
![]()
а) формула
б) формулировка (Изохорным процессом называют изменения состояния термодинамической системы, протекающие при постоянном объёме)
в) история открытия (В 1787 году французский ученый Жак Шарль измерял давление различных газов при нагревании при постоянном объёме и установил линейную зависимость давления от температуры, но не опубликовал исследование. Через 15 лет к таким же результатам пришёл и Гей – Люссак и, будучи на редкость благородным, настоял, чтобы закон назывался в честь Шарля.)
6. Закрепление знаний, умений и навыков
Беседа с
учащимися по вопросам.
Преподаватель. Каковы нормальные условия для идеального газа?
Студент. Нормальные условия для идеального газа: атмосферное давление p=1,013·105 Па, температура t=00С, или Т=273,15К
Преподаватель. Какова концентрация молекул идеального газа при нормальных
условиях?
Студент. n=p/kT=1,01·105/(1,38·10-23·273) м-3 ≈2,7·1025 м -3 ,
это значение концентрации – число Лошмидта.
Преподаватель. Какие величины характеризуют состояние газа?
Студент. Макропараметры p, V, T.
Преподаватель. Чем отличается уравнение состояния газа от уравнения Менделеева - Клапейрона? Какое из них полнее по содержанию? Почему?
Студент. Уравнение состояния идеального газа для постоянной массы газа. Уравнение Менделеева – Клапейрона для переменной массы газа
Преподаватель. Чему равна универсальная газовая постоянная в СИ?
Студент. R= 8,31Дж/ моль·К – универсальная газовая постоянная
Изобарный процесс.
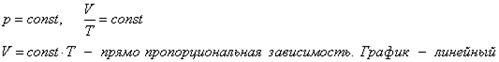
Изохорный процесс.
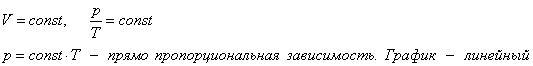
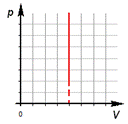
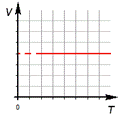
Изотермический процесс.
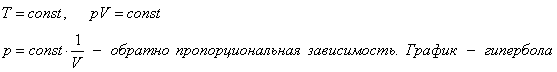
7. Подведение итогов занятия.
8. Домашнее задание. Сборник задач Рымкевич №527; №536
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.