Политика
5
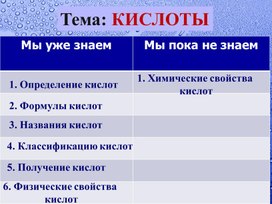
Эксперимент «Взаимодействие с металлами»
Вывод: С кислотами реагируют М, которые в ряде активности стоят до водорода.
К Cu прилили раствор HCl
II
К Zn прилили раствор HCl
I
Признаки
реакции
Уравнение реакции и её тип
Ход опыта
№
опыта
Взаимодействие кислот с простыми веществами
Политика
5
«Взаимодействие кислот с cолями»
Реакция обмена
кислота + соль = соль + кислота
(более (менее (более (менее
сильная) сильной сильной сильная)
кислоты) кислоты) или
летучая)
Взаимодействие кислот
со сложными веществами
CaCO3 + HCl =
(мел)
CaCl2 + H2CO3
CO2
Н2О
2
© ООО «Знанио»
С вами с 2009 года.
![]()