
Виды химических связей. Типы кристаллических решеток.
Причиной образования химической связи между частицами является стремление системы к минимуму энергии. Энергия образующейся системы — химической связи — меньше энергии, которой обладают изолированные частицы. Идет выигрыш в энергии.
Среди частиц самые устойчивые те, у которых внешний энергетический уровень завершен. Благородные газы на внешнем энергетическом уровне имеют октет электронов, у Не — 2е-. Таким образом, атомы, имеющие на внешнем энергетическом уровне меньше 8 электронов, стремятся приобрести структуру инертных газов, т. е. иметь октет электронов на внешнем энергетическом уровне.
Образование такой устойчивости может идти несколькими способами и приводит к образованию соединений с разными видами химической связи: ковалентной, ионной, металлической, водородной.
Любая химическая связь образуется только тогда, когда сближение частиц (двух или более) приводит к понижению полной энергии системы. Определяющими являются энергия взаимодействия — Е и межъядерное расстояние — r.
Важнейшим фактором характеристики атома при образовании химической связи является его электроотрицательность (ЭО) — способность притягивать электроны.
«Шкала ЭО по Полингу». ЭО усиливается к концу периода, к концу группы главной подгруппы.
Определение типа связи:
— если атомы обладают одинаковой ЭО, возникает ковалентная связь;
— если атомы обладают ЭО разной, но не резко отличаются, разность в ЭО < 1,7 — возникает ковалентная полярная связь;
— если атомы обладают ЭО разной, резко отличаются, разность в ЭО > 1,7 — возникает ионная связь.
По шкале ЭО по Полингу можно определить степень ионности — полярность связи: чем больше разность в ЭО, тем больше степень ионности, тем полярнее связь.
|
Разность в ЭО |
Степень ионности, % |
|
0 |
0 |
|
0,5 |
6 |
|
1,0 |
22 |
|
1,5 |
44 |
|
2,0 |
63 |
|
2,5 |
79 |
|
3,0 |
89 |
Таким образом, при разности в ЭО больше, чем 1,7, возникает ионная связь.
Ионная связь — связь за счет электростатического притяжения противоположно заряженных частиц (катионов — положительно заряженных и анионов — отрицательно заряженных). Ионная связь возникает между атомами, резко отличающимися в ЭО — типичные металлы и типичные неметаллы. Рассмотрим механизм образования ионной связи в соединении NaCl.
Это соединение образовалось между атомом Na — типичный металл, ЭОNa = 0,9, и атомом Сl — типичный неметалл, ЭОCl = 3,2.
Разность в ЭО = 2,3, следовательно, возникает ионная связь.
При взаимодействии Na с Сl2:
2Na + Cl2 = 2NaCl
в результате окислительно-восстановительной реакции образуются катионы сильно электроположительного элемента (металла) и анионы сильно электроотрицательного элемента.
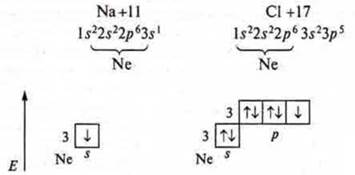
Наблюдается отдача одного s-электрона атома Na:
![]()
Возникает устойчивая частица с октетом электронов на внешнем энергетическом уровне: 1s22s22p6 — Na+, катион натрия. Атом хлора присоединяет электрон на р-подуровень:
![]()
Возникает устойчивая частица, так же с октетом электронов на внешнем энергетическом уровне — аннон хлора. Между образовавшимися ионами возникают силы электростатического притяжения, которые будут удерживать их друг около друга, осуществляется тем самым ионная связь. Она характерна для бинарных, образованных металлами и неметаллами, а также более, сложных — трехэлементных — соединений: щелочи, соли. В этом случае катионы и анионы могут быть не только простыми, но и сложными.
Пример: катион аммония — NH4+; сульфат — анион SO42-; гидроксид — анион ОН-.
Катионы и анионы, взаимодействуя друг с другом, образуют вещества в твердом состоянии с ионной кристаллической решеткой. В пространстве катионы и анионы упорядоченно располагаются. Чем меньше размер иона и чем больше его заряд, тем сильнее его электростатическое поле и тем прочнее химическая связь.
Так, энергия кристаллической решетки LiF — 1004 кДж/моль, а у NaCl — 755 кДж/моль. Все вещества с ионной кристаллической решеткой малолетучие, твердые, тугоплавкие, проводят электрический ток в растворах и расплавах. Однако кристаллы с ионной связью — ионы — очень хрупкие, т.к. при незначительном сдвиге плоскостей в кристалле наблюдается близкое приближение одноименно заряженных ионов, которые, отталкиваясь друг от друга, вызывают разрыв, появляется трещина в кристалле.
![]()
При высоких температурах многие вещества с ионной связью, например, галогениды, переходят в газообразные соединения. В газовой фазе могут находиться молекулы NaCl и их агрегаты (NaCl)2 с непрочными ковалентными связями, а также ионы Na+ и Сl-.
Следует знать, что соединений с ионной связью — ограниченное количество, чисто ионная связь в соединениях не существует. В этих случаях следует говорить о степени ионности. Чем она выше, тем связь более ионная.
По мере увеличения количества электронов на внешнем энергетическом уровне атома металла усиливается прочность их связи с ядром атома, уменьшается способность к образованию ионной связи. У алюминия с галогенами возникают ковалентные связи, однако под влиянием, например, полярных растворителей эти связи становятся ионными.
Ионная связь — крайний случай ковалентной полярной связи.
Что же такое ковалентная связь?
Связь посредством общих электронных пар называется ковалентной. Она возникает в случае разности в ЭО меньше 1,7, приближающейся к нулю. Если атомы обладают одинаковой ЭО — возникает ковалентная неполярная связь; если атомы обладают разной ЭО — возникает ковалентная полярная связь.
Существует два механизма возникновения ковалентной связи:
- обменный
- донорно-акцепторный.
Для обменного механизма необходимы следующие условия:
1) взаимодействующие атомы должны иметь неспаренные электроны, характеризующиеся различными спиновыми квантовыми числами:
![]()
2) в системе должна находиться частица с низким запасом энергии, которая поглощала бы энергию, выделяющуюся при образовании химической связи, т. к. образование связи — эндотермический процесс:
![]()
Частица X может быть либо А либо В с низким запасом энергии. Получив энергию, она может сама участвовать в образовании химической связи.
Данный механизм образования химической связи объясним методом валентных связей (МВС).
Пример: образование молекулы водорода Н2:
атом
водорода — ![]()
атом
водорода — ![]()
радиус атома Н — r
н = 0,053 нм
При образовании химической связи идет перекрывание АО (атомных орбиталей).
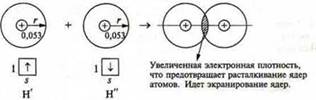
Если бы не было перекрывания орбиталей, то межъядерное расстояние было бы равно 2r = 0,053 х 2 = 0,106 (нм).
Однако в молекуле водорода это расстояние равно 0,074 нм, т.е. меньше. Следовательно, идет перекрывание орбиталей.
При сближении атомов водорода Н' и Н" силы электростатического притяжения электрона атома Н' к ядру атома Н" и электрона атома Н" к ядру атома Н' будут возрастать, начнут притягиваться друг к другу. Одновременно будут возрастать силы отталкивания между одноименно заряженными ядрами атомов Н' и Н". Это приводит к тому, что атомы могут сблизиться между собой настолько, что силы притяжения будут уравновешены полностью силами отталкивания и электронные облака начнут перекрываться между собой, что обеспечивает перемещение электрона одного атома Н' в поле притяжения ядра атома Н" и наоборот, и каждый атом в какой-то момент будет иметь завершенный внешний энергетический уровень, как у благородных газов.
Связь, осуществленная за счет образования общих электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной.
Разновидности ковалентной связи:
а) неполярная ковалентная связь возникает между атомами, обладающими одинаковой ЭО.
Пример: O2; O3; N2; Сl2; Н2 и т.д.
б) полярная ковалентная связь возникает между атомами, которые различаются не резко в ЭО.
Пример: НСl, NH3, Н2O и т. д. (если позволяет время урока в классах, где учащиеся воспринимают материал более осознанно, можно объяснить понятие «дипольный момент» для объяснения полярности связи).
Дипольный момент μ есть произведение длины диполя / (расстояние между двумя равными по величине и противоположными по знаку зарядов + q и -q) на абсолютную величину заряда: μ = lq.
Дипольный момент — величина векторная и направлен по оси диполя от отрицательного заряда к положительному.
Пример:
HF, μ = 6,4 · 10-30
НСl, μ = 3,5 · 10-30
НВr, μ = 2,6 · 10-30
HI, μ = 1,3 · 10-30
Наибольший дипольный момент у фтороводорода, где F обладает большей ЭО.
Молекула Н2O μ = 6,1 · 10-30.

Угловое строение молекулы
Молекула СO2,
![]()
Каждая связь полярна и μ = 9 · 10-30, однако молекула неполярна, μ = 0, т. к. связи С=0 расположены на одной прямой и компенсируют дипольные моменты друг друга. Почему такое строение в пространстве имеют молекулы СO2 и Н2O, это вопрос следующих уроков темы.
Следует различать понятия «полярность связи» и «полярность молекулы» в целом (опыт демонстрационный). В простых двухатомных молекулах дипольный момент и полярность связи равны, а в сложных соединениях Н2O, NH3, НСl, СO2 — не равны.
Дипольного момент = полярности связи нахождением разности в ЭО атомов, образующих соединение, а затем сделать вывод, какая связь более полярна.
Пример: HF и HI
![]()
Полярнее связь в соединении HF, т. к. разность в ЭО 1,9 больше 0,4.
Полярная ковалентная связь есть промежуточная между ковалентной неполярной и ионной связью.
Кроме обменного механизма образования ковалентной связи возможен и донорно-акцепторный механизм.
Для осуществления такого механизма необходимы следующие условия:
1. В
системе должны находиться две частицы. Одна — донор, имеющий неподеленную пару
электронов. ![]() другая — акцептор, имеющий свободную
орбиталь
другая — акцептор, имеющий свободную
орбиталь ![]()
Такие частицы образуются в результате обменного механизма, при перераспределении электронов.
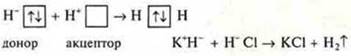
Пример:
![]() — свободная
орбиталь, акцептор (Н+Сl)
— свободная
орбиталь, акцептор (Н+Сl)
![]() — неподеленная
пара электронов, донор (К+Н-)
— неподеленная
пара электронов, донор (К+Н-)
2. В системе должна находиться частица, поглощающая энергию (как и при обменном механизме).
Пример: образование иона аммония.
[NН4] +; аммиак NH3, N +7.
1s22s22p3
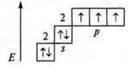
![]() - три связи
образованы по обменному механизму: у атома азота есть неподеленная пара
электронов 2s2, атом азота — донор, катион водорода
- три связи
образованы по обменному механизму: у атома азота есть неподеленная пара
электронов 2s2, атом азота — донор, катион водорода ![]() - акцептор
- акцептор
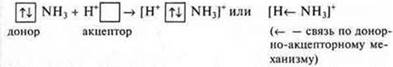
Кратность связи соответствует числу общих электронных пар. Одинарная связь — одна общая электронная пара, двойная связь — две общих электронных пары, тройная — три общих электронных пары.
При осевом перекрывании орбиталей возникает прочная, неполяризуемая трудноразрываемая σ-связь (сигма-связь).
При осевом перекрывании s-орбиталей σ-связь s—s:
![]()
При осевом перекрывании р-орбиталей σ-связь р—р:
![]()
При осевом перекрывании s-орбитали и р-орбитали; σ-связь s—р:
![]()
В случае двойной или тройной связи кроме образования σ-связи (осевого перекрывания орбиталей) образуется и π-связь (пи-связь). В этом случае идет боковое перекрывание орбиталей.
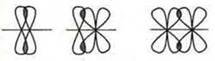
π-связь
В случае двойной связи — одна σ-связь, другая π-связь; тройной связи — одна σ-связь и 2 π-связи.
В некоторых случаях возможно нахождение связи в динамическом состоянии, т. е. электронные облака «размазаны» между двумя, тремя, четырьмя и т.д. атомами, тогда кратность связи дробная, полуторная. В бензоле С6Н6 6е- — π-облако, связь полуторная, если одинарная связь имеет длина 0,154 нм, двойная связь — 0,134 нм, то в ароматическом кольце ее длина — 0,140 нм.
Все вещества с ковалентной связью как правило при обычных условиях могут быть жидкостями, газами, твердыми по агрегатному состоянию; низкоплавкие, летучие.
Они могут образовывать два типа кристаллических решеток.
Атомные кристаллические решетки — в узлах кристаллической решетки — атомы, между которыми ковалентные связи.
Пример: алмаз, графит, бор, кремний,
SiC — карборунд; SiO2 — кварц; некоторые силициды, карбиды, оксиды: Аl2О3; Сr2O3; физические свойства веществ с атомной кристаллической решеткой — твердые, тугоплавкие, нелетучие, в воде нерастворимые.
Молекулярные кристаллические решетки — в узлах находятся молекулы, между которыми слабые силы межмолекулярного взаимодействия. Большинство веществ с такой решеткой — газыO2; N2; СO2; Сl2, жидкости — вода, спирт, кислоты, Вr2; твердые вещества — нафталин, I2, нефть, глюкоза, сахароза. Они обладают летучестью, хрупки в кристаллическом виде, имеют низкуюt ° кипения и t ° плавления. В зависимости от полярности молекул они могут быть растворимы в воде, диссоциировать, проводить электрический ток.
Металлическая и водородная связи. Единая природа химической
Все металлы объединяют свойства общего характера, такие как сравнительно высокая t° плавления, способность к отражению света, высокая тепло- и электропроводимость, пластичность. Оказывается, эти особенности обязаны существованию в металлах особого вида химической связи — металлической.
Металлическая связь — связь между положительно заряженными нонами металла в кристалле (атомы-ионы), осуществляемая за счет притяжения электронов, свободно перемещающихся в кристалле.
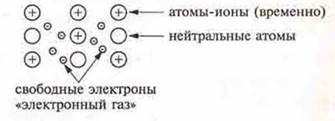
Атомы металлов в соответствии со строением на внешнем энергетическом уровне имеют от 1 до 3 электронов, реже — 4, они слабо связаны с ядром атома, т. к. радиус атомов металлов сравнительно большой. Электроны могут легко отрываться от атомов, в результате чего в кристаллической решетке появляются свободные электроны и атомы-ионы.
В кристаллической решетке существует большая свобода перемещения электронов: одни атомы будут терять электроны, образующиеся ионы могут принимать электроны из «электронного газа».
Свободные электроны общие для большинства ионов металлов кристалла. Этим металлическая связь отличается от ковалентной, где электронная пара общая только для двух атомов. В случае металлической связи электроны равномерно распределены по кристаллу. Этим объясняется пластичность метилов, т.е. возможность смещения ионов и атомов в любом направлении без нарушения связи. Энергия металлической связи в 3—4 раза меньше энергии ковалентной связи.
В газообразном состоянии (в виде пара) атомы металла связаны также непрочными ковалентными связями. Сравним энергию связи в Н2 - 432 кДж/моль; Li2 - 104; Na2 - 71,1; К2 — 49,6.
В кристалле металла связи намного прочнее, чем в состоянии пара: Li — 159; Na —106.
Водородная связь — своеобразная химическая связь. Она возникает вследствие взаимопритяжения положительно заряженного атома водорода одной молекулы (или части ее) и отрицательного заряда атома более электроотрицательного элемента или неподеленной электронной пары другой молекулы (или ее части).
Механизм возникновения водородной связи носит характер частично электростатический, частично донорно-акцепторный.
Молекула воды Н2О полярная ковалентная связь:

Молекула фтороводорода HF — ковалентная полярная связь:
![]()
Молекула аммиака NH3 — ковалентная полярная связь:
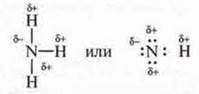
Молекула спирта:

Во всех случаях в молекулах есть общие электронные пары между атомами водорода и электроотрицательными атомами, такими как кислород, фтор, азот, которые смещаются в их сторону. Водород приобретает частично положительный заряд, а атом более электроотрицательного элемента — частично отрицательный заряд. Данные электроотрицательные атомы имеют и неподеленные пары электронов. Молекулы данных соединений взаимопритягиваются.
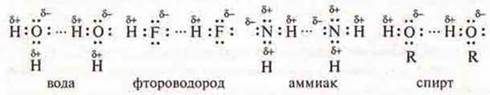
Водородная связь показывается тремя точками (...), она в 15— 20 раз слабее ковалентной связи.
Наличие водородной связи объясняет тот факт, что низкомолекулярные вещества (например, вода, фтороводород, аммиак) при обычных условиях — жидкости или сжижаются.
Водородная связь может возникнуть и между разными молекулами, например, воды и спирта.
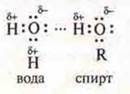
Водородная
связь, возникшая между молекулами, называется межмолекулярной. Молекулы воды
образуют ассоциаты (Н2O)2; (Н2O)3;
(Н2O)4; спирта — ![]() — ассоциатспирта. Этим и объясняется
увеличение температуры кипения спиртов по сравнению с углеводородами.
Наблюдается хорошее растворение метанола, этанола в воде.
— ассоциатспирта. Этим и объясняется
увеличение температуры кипения спиртов по сравнению с углеводородами.
Наблюдается хорошее растворение метанола, этанола в воде.
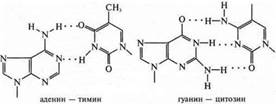
Наибольшее значение внутримолекулярная водородная связь имеет в образовании природной структуры биополимеров: вторичная структура белка, двойная спираль ДНК.
ДНК — биополимер, в котором сконцентрирована наследственная информация живых организмов. Биополимер ДНК состоит из нуклеотидов, располагающихся в полимерных цепях в строгом порядке. При образовании двойной спирали между ними возникают водородные связи и соблюдается принцип комплементарности: А—Т, Г—Ц.
Большие пуриновые основания с малыми пиримидиновыми образуют водородные связи, это энергетически и пространственно выгодно.
Все вещества, образующие водородные связи, по физическим свойствам — газы, легко переходящие в жидкости и, наоборот, легко испаряемые, имеют низкую температуру плавления.
Кристаллическая решетка по типу молекулярная. Пример: «сухой лед» — СO2; вода—лед.
Ионная связь — крайний случай ковалентной полярной связи. Степень ионности связи дает судить о том, какой вид связи преобладает.
Пример: LiF — степень ионности 80%, следовательно, в этом соединении 80% — ионная связь, 20% — ковалентная полярная. В ряду галогеноводородов (полярная ковалентная связь) Н—F, Н—Cl, Н—Вr, Н—I полярность связи уменьшается и у Н—At она становится почти неполярной, т. к. уменьшается разность в ЭО.
![]()
Металлическая связь совмещает в себе ковалентную связь — есть обобществленные электроны и ионную связь — наблюдается взаимопритяжение обобществленных электронов и ионов-атомов.
Большинство веществ имеют несколько видов связей.
Пример: основание NaOH. Между атомом кислорода и атомом водорода гидроксогруппы — ковалентная полярная связь, между катионом натрия и анионом гидроксогруппы — ионная связь.
Если рассматривать соли кислородосодержащих кислот, то в кислотном остатке возникает ковалентная полярная связь между атомами кислорода и центральным атомом неметалла, а между катионом металла и анионом кислотного остатка — ионная связь.
Пероксиды: К2O; Na2O2; между атомами кислорода — ковалентная неполярная связь, между металлом и кислородом — ионная связь.
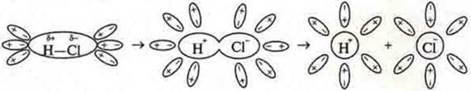
В зависимости от условий возможен переход одного вида связи в другой. При электролитической диссоциации соединений с ковалентной полярной связью наблюдается поляризация молекул сильно полярными молекулами воды и связь становится ионной.
Схема электролитической диссоциации полярной молекулы хлороводорода на гидратированные ионы
При испарении металлов металлическая связь превращается в ковалентную неполярную.
В органической химии ковалентная неполярная связь галогена Вr2 при его взаимодействии с непредельными углеводородами становится ионной.
Вывод: на основании изучения теории видов химической связи. механизмов их образования, типов кристаллических решеток нам необходимо умело определять в соединениях вид химической связи и характеризовать данное соединение по определенному плану.
1. Виды химической связи (учитывая ЭО элементов).
2. Механизмы их образования. Какие возникают связи σ-, π-, кратность связи.
3. Соответствующий тип кристаллической решетки, физические свойства данного вещества.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.