
4.6. Закони молекулярної дифузії.
4.6.1. Перший закон Фіка.
Кінетика процесу молекулярної дифузії описується першим законом Фіка, відповідно до якого кількість речовини dМ, що продифундувала, пропорційна градієнту концентрацій ∂c/∂n і площі масообмінної поверхні dF, перпендикулярної напрямку дифузійного потоку:
dМ = - D (∂c/∂n) dF dτ (4.21)
або для всієї поверхні масопереносу F
M = - D (∂c/∂n) F τ. (4.21a)
Густина дифузійного потоку (питомий дифузійний потік) дорівнює
j = dM / (dF dτ) = - D (∂c/∂n). (4.22)
Знак “-“ у виразах (4.21-4.22) показує, що напрямки векторів градієнта концентрацій і дифузійного потоку протилежні.
D – коефіцієнт молекулярної дифузії – залежить від природи речовини, що дифундує. Він не зв'язаний з динамікою процесу і характеризує здатність речовини проникати в яке-небудь середовище. Розмірність D можна визначити з виразу (4.21). Якщо концентрація виражена в кг/м3, то
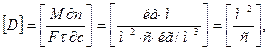
звідки випливає, що коефіцієнт молекулярної дифузії D показує, яка кількість речовини дифундує в одиницю часу через одиницю поверхні при градієнті концентрацій, що дорівнює одиниці. Коефіцієнт молекулярної дифузії D є аналогом коефіцієнта температуропровідності а для теплових процесів.
Значення D знаходять по довідниках або в окремих випадках розраховують за емпіричними залежностями. Наприклад,
для газів
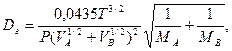 (4.23)
(4.23)
для рідин
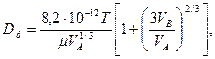 (4.24)
(4.24)
де Т – абсолютна температура, К; Р – тиск, Па; VА і VВ – молярні об’єми взаємодіючих речовин, см3/моль; МА і МВ – молярні маси, кг/кмоль; μ – в'язкість рідини, у якій відбувається дифузія, МПа·с.
Таким чином, коефіцієнт дифузії підвищується зі збільшенням температури, а для газів – також і зі зменшенням тиску. При цьому для рідин значення коефіцієнта молекулярної дифузії значно менше, ніж для газів.
4.6.2. Диференціальне рівняння молекулярної дифузії
(другий закон Фіка).
Аналогічно процесу теплопровідності, на основі матеріального балансу речовини, що проходить через елементарний паралелепіпед з об’ємом
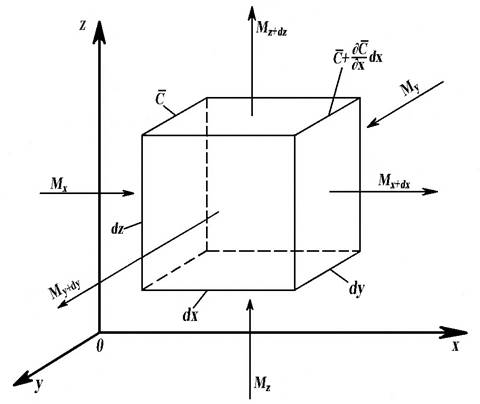
Рис. 4.3. До виведення диференціального рівняння молекулярної дифузії
dV=dxdydz (рис.4.3), можна одержати розподіл його концентрацій (поле концентрацій) – C = f (x, y, z, τ) у нерухомому середовищі або ламінарному потоці. У загальному виді воно описується диференціальним рівнянням молекулярної дифузії (другий закон Фіка):
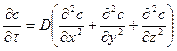 або
або ![]() . (4.25)
. (4.25)
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.