
УЧЕБНАЯ ДИСЦИПЛИНА: ХИМИЯ
Тема: Взаимосвязь неорганических веществ. Агрегатные состояния вещества. Кристаллические и аморфные вещества.
Цели урока: рассмотреть особенности молекулярного строения и свойства тел в различных агрегатных состояниях. ввести понятия «чистое вещество» и «смесь веществ», раскрыть значение смесей в природе и жизни человека, познакомить учащихся со способами разделения смесей.
Задачи урока: способствовать формированию знаний у учащихся о фазовых переходах, умения объяснять свойства вещества в различных агрегатных состояниях, на основе молекулярного строения вещества; развивать представление о материальности мира, содействовать развитию речи, мышления; воспитывать положительное отношение к предмету.
Задание№1
Ознакомиться с лекционным материалом по теме.
Задание№2
Выполните тестовое задание по теме.
1. Ковалентная связь между атомами образуется посредством:
1) общих электронных пар
2) электростатического притяжения ионов
3) «электронного газа»
4) электростатического притяжения молекул
2. Металлическая связь образуется между атомами:
1) кремния
2) цезия
3) фосфора
4) хлора
3. Формулы только ионных соединений находятся в ряду:
1) HCl, H2O, F2
2) Na, Сl2 ,
NН3
3) KCl, H2S,
SiO2
4) NaBr, ВаО, СаСl2
4. Ковалентная связь образуется между атомами, расположенными в периодической системе:
1) в 1 периоде, IA группе и во 2 периоде,
VIA группе
2) в 3 периоде, IIА группе и во 2 периоде, VIA группе
3) в 4 периоде, IА группе и в 3 периоде, VIIA группе
4) в 3 периоде, IA группе и во 2 периоде, VIIA группе
5. Для молекулы Н2S не верно, что:
1) между атомами существуют ковалентные
полярные связи
2) атом серы образует две одинарные связи
3) электронная плотность смещена к атому серы
4) атом серы образует двойную связь
6. Ковалентная неполярная связь существует между атомами в молекулах каждого из двух веществ:
1) хлороводород и аммиак
2) кислород и хлор
3) оксид серы (VI) и сульфид натрия
4) бромид лития и оксид алюминия
7. Для молекулы CO2 верно, что:
1) между атомами существуют двойные связи
2) электронная плотность связи С — О смещена к углероду
3) углерод образует 4 одинарные связи
4) связь С — О ковалентная неполярная
8. Наименее полярной является ковалентная связь в молекуле:
1) HF
2) NH3
3) H2O
4) CH4
9. В оксиде кальция имеются связи:
1) ковалентная полярная и ионная
2) ковалентная неполярная
3) только ионная
4) ковалентная полярная и неполярная
10. В соединении K2SO4 имеются связи:
1) ковалентная полярная и ионная
2) ковалентная неполярная
3) только ионная
4) ковалентная полярная и неполярная
11. Молекулярная кристаллическая решетка характерна для:
1) хлорида калия
2) углекислого газа
3) натрия
4) нитрата натрия
12. Для веществ с ионной кристаллической решеткой характерны физические свойства:
1) высокая температура плавления
2) хрупкость
3) ковкость
4) летучесть
5) металлический блеск
13. И для алмаза, и для диоксида кремния характерны физические свойства:
1) пластичность
2) высокая твердость
3) неспособность проводить электрический ток
4) низкие температуры плавления
5) хорошая растворимость в воде
14. Установите соответствие между веществом и типом химической связи между атомами в нем:
Вещество
А) сера
Б) бромоводород
В) бромид магния
Г) магний
Тип химической связи
1) металлическая
2) ковалентная полярная
3) ковалентная неполярная
4) ионная
5) водородная
15. Установите соответствие между веществом и его характеристиками:
Вещество
А) кальций
Б) хлороводород
В) азот
Г) хлорид кальция
Тип химической связи
1) между атомами — ковалентная неполярная
связь, молекулярная кристаллическая решетка, в обычных условиях — газ
2) между атомами — ионная связь, ионная кристаллическая решетка, твердое
вещество
3) между атомами — металлическая связь, металлическая кристаллическая решетка,
твердое вещество
4) между атомами — ковалентная полярная связь, молекулярная кристаллическая решетка,
газ
5) между атомами — ковалентная полярная связь, молекулярная кристаллическая решетка,
жидкость
Лекция
Агрегатные состояния вещества. Водородная химическая связь.

Вода – самое распространенное и самое удивительное вещество на нашей планете. Она вездесуща. На земле нет ничего, что не содержало бы воды. Покрывающий ¾ нашей земли океан, в котором миллиарды лет назад зародилась жизнь, - это вода. Снежные шапки горных вершин, бескрайние ледяные пустыни Арктики и Антарктики – это тоже вода. Тучи и облака, туман и осадки - и это вода.
В атмосферном воздухе всегда содержится вода в газообразном состоянии.
Часто вместо термина «газ» применительно к воде в газообразном состоянии используют слово «пар». Пары воды прозрачны и бесцветны, их невозможно увидеть. А вот в бытовом понимании водяным паром называют мельчайшие капельки сконденсированной влаги, например туман, пар из носика кипящего чайника. Процесс перехода вещества из газообразного в жидкое агрегатное состояние – конденсация. Процесс перехода вещества из жидкого в газообразное агрегатное состояние – испарение.
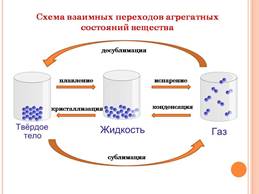
В жидкостях частицы вещества расположены гораздо ближе друг к другу, и благодаря силам взаимного притяжения молекул жидкости обладают такой важной характеристикой, как собственный объем. Поступательное движение молекул, хотя и затруднено по сравнению с газами, все-таки сохраняется. Это обусловливает такое важнейшее свойство жидкостей, как текучесть.
Большинство жидких веществ при охлаждении переходит в твердое агрегатное состояние. Такой процесс называют кристаллизацией. Для воды этот процесс происходит при температуре 00С. Процесс перехода вещества из твердого агрегатного состояния в жидкое – плавление.
Частицы твердого вещества находятся настолько близко друг к другу, что очень ограничены в движении. Они совершают колебания, главным образом относительно положения равновесия, а вот перемещаться для них – почти неразрешимая задача. Силы взаимного притяжения частиц в твердых веществах настолько велики, что последние, как правило, не обладают текучестью и имеют не только объем, но и форму.
Все низкомолекулярные вещества могут переходить из твердого состояния сразу в газообразное. Такой процесс называют сублимацией. Процесс, обратный сублимации, называют десублимацией.
Почему же вещества молекулярного строения, у которых ковалентные связи образуются между атомами только в пределах одной молекулы, бывают и твердыми, и жидкими? Что заставляет молекулы в таких веществах притягиваться друг к другу?
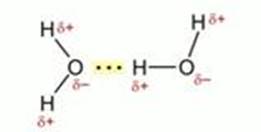
Одним из видов молекулярного взаимодействия называется водородной связью. Рассмотрим ее на примере воды. Химические связи между молекулами водорода и кислорода ковалентные полярные. Молекула воды имеет угловое строение. Помимо двух общих с водородом электронных пар у атома кислорода имеются две пары собственных электронов, которые называют неподеленными. Кислород как более электроотрицательный атом обладает частичным отрицательным зарядом. Атомы водорода несут частично положительный заряд. Вполне естественно, что между атомом водорода одной молекулы воды и неподеленной электронной парой атома кислорода другой молекулы возникает электростатическое напряжение:
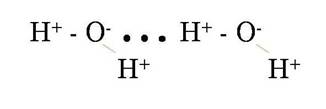
 В молекуле воды два атома
водорода и две неподеленные электронные пары атома кислорода. Следовательно,
каждая молекула способна к образованию не одной, а четырех водородных связей.
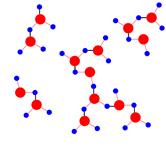
Образуется своеобразный каркас, скрепляющий между собой множество молекул воды.
В молекуле воды два атома
водорода и две неподеленные электронные пары атома кислорода. Следовательно,
каждая молекула способна к образованию не одной, а четырех водородных связей.
Образуется своеобразный каркас, скрепляющий между собой множество молекул воды.
Водородная связь может возникать между атомами водорода одной молекулы и атомами неметаллов с высокой электроотрицательностью, имеющими неподеленные электронные пары, другой молекулы.
Химическая связь между атомом элемента с высокой электроотрицательностью, имеющим неподеленные электронные пары (атом фтора, кислорода, азота), одной молекулы и атомом водорода другой молекулы называют водородной.
Водородная связь
Рассмотрим температуры кипения и плавления водородных соединений халькогенов: кислорода, серы, селена и теллура.
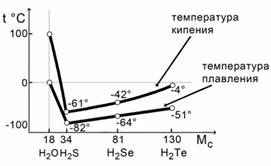 Рис.
1
Рис.
1
Если мысленно экстраполировать прямые температур кипения и плавления водородных соединений серы, селена и теллура, то мы увидим, что температура плавления воды должна примерно составлять -1000С, а кипения – примерно -800С. Происходит это потому, что между молекулами воды существует взаимодействие – водородная связь, которая объединяет молекулы воды в ассоциацию. Для разрушения этих ассоциатов требуется дополнительная энергия.
Механизм образования водородной связи
Водородная связь образуется между сильно поляризованным, обладающим значительной долей положительного заряда атомом водорода и другим атомом с очень высокой электроотрицательностью: фтором, кислородом или азотом. Примеры веществ, способных образовывать водородную связь, приведены на рис. 2.
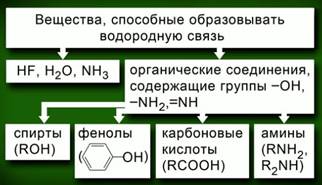
Рис. 2
Рассмотрим образование водородных связей между молекулами воды. Водородная связь изображается тремя точками. Возникновение водородной связи обусловлено уникальной особенностью атома водорода. Т. к. атом водорода содержит только один электрон, то при оттягивании общей электронной пары другим атомом, оголяется ядро атома водорода, положительный заряд которого действует на электроотрицательные элементы в молекулах веществ.
Сравним свойства этилового спирта и диметилового эфира. Исходя из строения этих веществ, следует, что этиловый спирт может образовывать межмолекулярные водородные связи. Это обусловлено наличием гидроксогруппы. Диметиловый эфир межмолекулярных водородных связей образовывать не может.
Сопоставим их свойства в таблице 1.
|
Вещество |
Т кип. |
Т пл. |
Растворимость в воде |
|
Этиловый спирт |
+78,150С |
-114,150С |
В любых пропорциях |
|
Диметиловый эфир |
-29,90С |
-138,50С |
Ограничена |
Табл. 1
Т кип., Т пл, растворимость в воде выше у этилового спирта. Это общая закономерность для веществ, между молекулами которых образуется водородная связь. Эти вещества характеризуются более высокой Т кип.,Т пл, растворимостью в воде и более низкой летучестью.
Физические свойства соединений зависят также и от молекулярной массы вещества. Поэтому проводить сравнение физических свойств веществ с водородными связями, правомерно только для веществ с близкими молекулярными массами.
Энергия одной водородной связи примерно в 10 раз меньше энергии ковалентной связи. Если в органических молекулах сложного состава имеется несколько функциональных групп, способных к образованию водородной связи, то в них могут образовываться внутримолекулярные водородные связи (белки, ДНК, аминокислоты, ортонитрофенол и др.). За счет водородной связи образуется вторичная структура белков, двойная спираль ДНК.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.