
Тема: Азотсодержащие органические соединения.
Амины. Аминокислоты. Белки.
Цели:
Сформировать понятие об аминокислотах, их классификация и строение. Продолжить формировать понятие о изомерии на примере оптической изомерии α-аминокислот, номенклатуре аминокислот, амфотерности аминокислот и ее причины. Биполярные ионы. Реакции конденсации. Пептидная связь. Синтетические волокна: капрон, энант. Классификация волокон. Получение аминокислот, их применение и биологическая функция.
Создать положительный настрой к обучению и готовность к активной мыслительной деятельности, используя видеоматериалы и метод лабораторного эксперимента; воспитывать культуру речи и труда. (ОК 10. Бережно относиться к историческому наследию и культурным традициям народов, уважать социальные, культурные и религиозные различия) ОК 1. Понимать сущность и социальную значимость своей будущей профессии, проявлять к ней устойчивый интерес.)
Развивать у студентов познавательный интерес к изучению химии, умение анализировать, сравнивать, делать выводы, самостоятельность учащихся. (ОК 3.: Принимать решения в стандартных и нестандартных ситуациях и нести за них ответственность)
Цели:
Сформировать понятие об аминокислотах, их классификация и строение. Воспитательные
Создать положительный настрой к обучению и готовность к активной мыслительной деятельности, воспитывать культуру речи и труда.
Развивающие
Развивать у студентов познавательный интерес к изучению химии, умение анализировать, сравнивать, делать выводы, самостоятельность учащихся.
Тип Урока: Комбинированный
Ход урока
1. Организационный материал
2. Актуализация знаний
3. Изучение нового материала
4.
Задание 1. Ознакомьтесь с теоретическим материалом занятия. Составить опорный конспект, используя различные источники литературы и интернет ресурсы по плану:
1. Определение.
2. Классификация.
3. Номенклатура и изомерия.
4. Физические свойства.
5. Химические свойства.
6. Применение.
Амины – азотсодержащие органические вещества, производные аммиака (NH3), в молекулах которых один или несколько атомов водорода замещены на углеводородный радикал (- R или – CnH2n+1)
Классификация аминов
К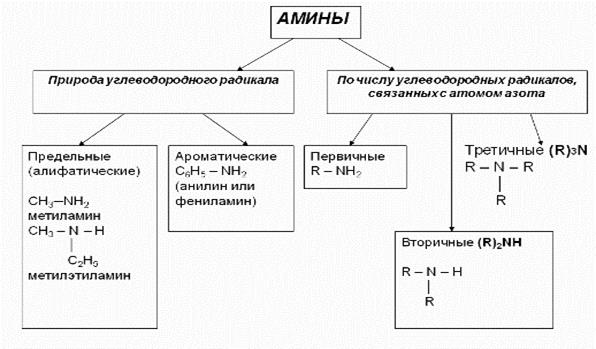
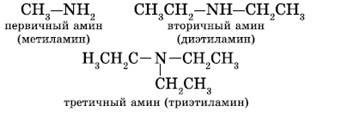
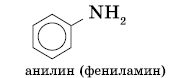
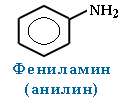
Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются ароматическими аминами.
Простейшим представителем этих соединений является аминобензол, или анилин:
Функциональная группа: - NH2 аминогруппа
Изомерия аминов
1. Для аминов характерна структурная изомерия:
а) изомерия углеродного скелета начиная с С4H9NH2:
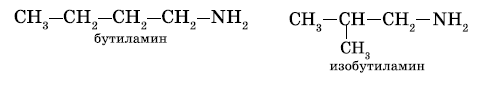
б) изомерия положения функциональной группы: начиная с С3H7NH2
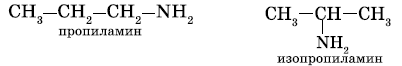
2. изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте, т.е. между типами аминов.
Первичные, вторичные и третичные амины изомерны друг другу (межклассовая изомерия):
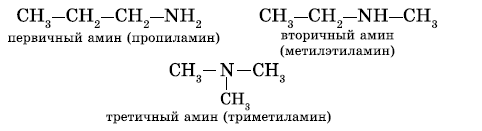
Как видно из приведенных примеров, для того чтобы назвать амин, перечисляют заместители, связанные с атомом азота (по порядку старшинства), и добавляют суффикс —амин.
Номенклатура аминов
1. В большинстве случаев названия аминов образуют из названий углеводородных радикалов и суффикса амин.
CH3-NH2 метиламин
CH3-CH2-NH2 этиламин
Различные радикалы перечисляются в алфавитном порядке.
CH3-CH2-NH-CH3 метилэтиламин
2. Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. В этом случае аминогруппа указывается в названии суффиксами амин (одна группа -NH2), диамин (две группы -NH2) и т.д. с добавлением цифр, отражающих положение этих групп в главной углеродной цепи.
Например:
CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
Нахождение аминов в природе
Амины широко распространены в природе, так как образуются при гниении живых организмов.
Получение аминов
1842 г Н. Н. Зинин получил анилин восстановлением нитробензола - в промышленности.
Восстановление нитросоединений:
R-NO2 + 6[H] t,kat-Ni → R-NH2 + 2H2O
(р. Зинина)
Другие способы:
1). Промышленный
CH3Br + 2NH3 t, ↑p → CH3-NH2 + NH4Br
Физические свойства аминов
ВИДЕО:
Изучение физических свойств анилина
Метиламин, диметиламин и триметиламин — газы, средние члены алифатического ряда - жидкости, высшие — твердые вещества.
Низшие амины имеют характерный «рыбный» запах, высшие не имеют запаха.
Анилин (фениламин) С6H5NH2 – важнейший из ароматических аминов:
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Химические свойства
Химические свойства аминов определяются в основном наличием у атома азота неподеленной электронной пары.
По химическим свойствам амины похожи на аммиак.
Амины как основания
ВИДЕО:
Получение гидроксида диметиламмония и изучение его свойств
ВИДЕО:
Изучение среды раствора анилина
Атом азота аминогруппы, подобно атому азота в молекуле аммиака, за счет неподеленной пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, выступая в роли донора. В связи с этим амины, как и аммиак, способны присоединять катион водорода, т. е. выступать в роли основания:
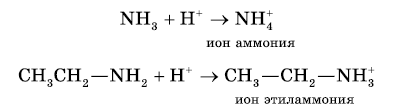
1. Реакция амионов с водой приводит к образованию гидроксид-ионов:
![]()
Раствор аммиака в воде обладает слабыми щелочными (основными) свойствами. Причина основных свойств аммиака — наличие у атома азота неподеленной электронной пары, которая участвует в образовании донорно-акцепторной связи с ионом водорода. По этой же причине амины также являются слабыми основаниями. Амины — органические основания.
2. Реакция с кислотами. Аммиак, реагируя с кислотами, образует соли аммония. Амины также способны вступать в реакцию с кислотами:
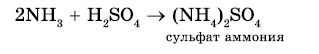
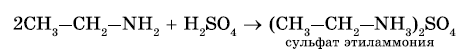
Взаимодействие с кислотами — образование солей (реакции нейтрализации). Аналогично при взаимодействии аминов с кислотами образуются соли замещенного аммония. Щелочи, как более сильные основания, вытесняют аммиак и амины из их солей.
Горение аминов
ВИДЕО:
Получение диметиламина и его горение
Амины являются горючими веществами. Продуктами горения аминов, как и других азотсодержащих органических соединений, являются углекислый газ, вода и свободный азот.
![]()
Применение
Амины используют при получении лекарственных веществ, красителей и исходных продуктов для органического синтеза. Гексаметилендиамин при поликонденсации с адипиновой кислотой дает полиамидные волокна.
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Аминокислоты — органические амфотерные соединения, в состав которых входят карбоксильные группы – СООН и аминогруппы -NH2.
Аминокислоты можно рассматривать как карбоновые кислоты, в молекулах которых атом водорода в радикале замещен аминогруппой.
Классификация
Аминокислоты классифицируют по структурным признакам.
1.В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α-, β-, γ-, δ-, ε- и т. д.
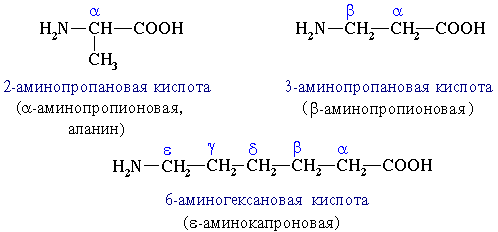
Строение аминокислот
Аминокислоты — гетерофункциональные соединения, которые обязательно содержат две функциональные группы:
аминогруппу — NH2 и карбоксильную группу —СООН, связанные с углеводородным радикалом.
Общую формулу простейших аминокислот можно записать так:
![]()
Так как аминокислоты содержат две различные функциональные группы, которые оказывают влияние друг на друга, характерные реакции отличаются от характерных реакций карбоновых кислот и аминов.
Изомерия и номенклатура аминокислот
По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе.
Нумерация углеродной цепи с атома углерода карбоксильной группы.
Например:
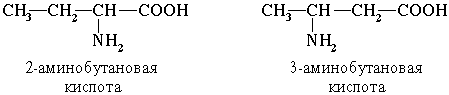
Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
Например:
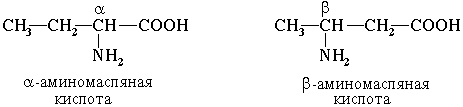
Для α-аминокислот R-CH(NH2)COOH
,которые играют исключительно важную роль в процессах жизнедеятельности животных и растений, применяются тривиальные названия.
Таблица. Некоторые важнейшие α-аминокислоты
|
Аминокислота |
Сокращённое обозначение |
Строение радикала ( R )
|
|
Глицин |
Gly (Гли) |
H - |
|
Аланин |
Ala (Ала) |
CH3 - |
|
Валин |
Val (Вал) |
(CH3)2CH - |
|
Лейцин |
Leu (Лей) |
(CH3)2CH – CH2 - |
|
Серин |
Ser (Сер) |
OH- CH2 - |
|
Тирозин |
Tyr (Тир) |
HO – C6H4 – CH2 - |
|
Аспарагиновая кислота |
Asp (Асп) |
HOOC – CH2 - |
|
Глутаминовая кислота |
Glu (Глу) |
HOOC – CH2 – CH2 - |
|
Цистеин |
Cys (Цис) |
HS – CH2 - |
|
Аспарагин |
Asn (Асн) |
O = C – CH2 – │ NH2 |
|
Лизин |
Lys (Лиз) |
NH2 – CH2- CH2 – CH2 - |
|
Фенилаланин |
Phen (Фен) |
C6H5 – CH2 - |
Изомерия
1. Изомерия углеродного скелета
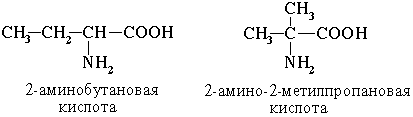
2. Изомерия положения функциональных групп
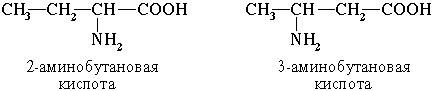
Физические свойства
Аминокислоты представляют собой кристаллические вещества с высокими (выше 250°С) температурами плавления, которые мало отличаются у индивидуальных аминокислот и поэтому нехарактерны. Плавление сопровождается разложением вещества.
Аминокислоты хорошо растворимы в воде и нерастворимы в органических растворителях, чем они похожи на неорганические соединения. Многие аминокислоты обладают сладким вкусом.
Способы получения
1.Взаимодействие α-галогенкарбоновых кислот с избытком аммиака. В ходе этих реакций происходит замещение атома галогена в галогенкарбоновых кислотах на аминогруппу. Выделяющийся при этом хлороводород связывается избытком аммиака в хлорид аммония.
2.Гидролиз белков.
При гидролизе белков обычно образуются сложные смеси аминокислот, однако с помощью специальных методов из этих смесей можно выделять отдельные чистые аминокислоты.
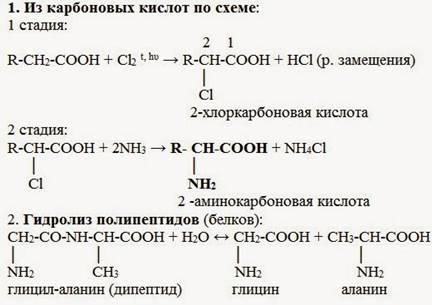
3. Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют α - аминокислоты белков.
Химические свойства
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. С основаниями (участвует аминогруппа).→ образуются соли:
NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa - натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р. этерификации): NH2-CH2-COOH + CH3OH HCl(газ)→ NH2-CH2-COOCH3 + H2O
NH2-CH2-COOCH3 - метиловый эфир 2- аминоуксусной кислоты
3С сильными кислотами (участвует карбоксильная группа).
→ соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl
или HOOC-CH2-NH2*HCl
4. Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе:
1. Внутримолекулярная нейтрализация → образуется биполярный цвиттер-ион:
Водные растворы электропроводны. Эти свойства объясняются тем, что молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе:
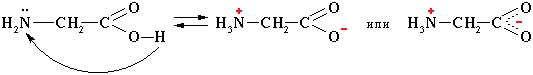
цвиттер-ион
Водные растворы аминокислот имеют нейтральную, кислую или щелочную среду в зависимости от количества функциональных групп.
Видео-опыт «Свойства аминоуксусной кислоты»
2. Поликонденсация → образуются полипептиды (белки):
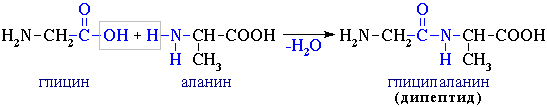
При взаимодействии двух α-аминокислот образуется дипептид.
3. Разложение → Амин + Углекислый газ:
NH2-CH2-COOH → NH2-CH3 + CO2↑
II. Свойства карбоксильной группы (кислотность)
1. С основаниями → образуются соли:
NH2-CH2-COOH + NaOH → NH2-CH2-COONa + H2O
NH2-CH2-COONa - натриевая соль 2-аминоуксусной кислоты
2. Со спиртами → образуются сложные эфиры – летучие вещества (р. этерификации): NH2-CH2-COOH + CH3OH HCl(газ)→ NH2-CH2-COOCH3 + H2O
NH2-CH2-COOCH3 - метиловый эфир 2- аминоуксусной кислоты
3. С аммиаком → образуются амиды:
NH2-CH(R)-COOH + H-NH2 → NH2-CH(R)-CONH2 + H2O
4. Практическое значение имеет внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона):
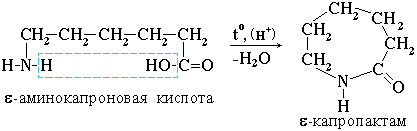
III. Свойства аминогруппы (основность)
1. С сильными кислотами → соли:
HOOC-CH2-NH2 + HCl → [HOOC-CH2-NH3]Cl
или HOOC-CH2-NH2*HCl
2. С азотистой кислотой (подобно первичным аминам):
NH2-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
гидроксокислота
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка)
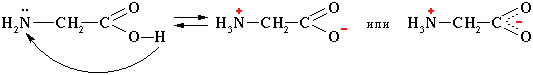
цвиттер-ион
Водные растворы аминокислот имеют нейтральную, кислую или щелочную среду в зависимости от количества функциональных групп.
Применение
1) аминокислоты широко распространены в природе;
2) молекулы аминокислот – это те кирпичики, из которых построены все растительные и животные белки; аминокислоты, необходимые для построения белков организма, человек и животные получают в составе белков пищи;
3) аминокислоты прописываются при сильном истощении, после тяжелых операций;
4) их используют для питания больных;
5) аминокислоты необходимы в качестве лечебного средства при некоторых болезнях (например, глутаминовая кислота используется при нервных заболеваниях, гистидин – при язве желудка);
6) некоторые аминокислоты применяются в сельском хозяйстве для подкормки животных, что положительно влияет на их рост;
7) имеют техническое значение: аминокапроновая и аминоэнантовая кислоты образуют синтетические волокна – капрон и энант.
4. Закрепление изученного материала
5. подведение итогов
6. Домашнее задание: конспект
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.