
Электролиз
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролита.
В данном пособии рассматривается электролиз с инертными электродами (угольными, платиновыми, графитовыми).
Электролиз расплава электролита. В расплаве электролита присутствуют только его ионы, поэтому на катоде восстанавливаются катионы электролита, а на аноде окисляются анионы (п р и м е р 1).
Электролиз раствора электролита. В отличие от расплава, в растворе электролита кроме ионов металла и кислотного остатка присутствуют молекулы воды и ионы Н+, ОН– – продукты диссоциации Н2О. Поэтому при электролизе раствора электролита на катоде и аноде между ионами электролита и молекулами воды происходит конкуренция.
Последовательность разрядки ионов на катоде зависит от положения металла в электрохимическом ряду напряжений.
1. Если у катода накапливаются катионы металлов, которые находятся в ряду напряжений после водорода, и молекулы воды, то на катоде восстанавливаются ионы металлов:
Меn+ + nē = Мео.
2. Если у катода накапливаются катионы металлов от лития по алюминий (включительно) и молекулы Н2О, то на катоде восстанавливаются ионы водорода из молекул воды:
2Н2О + 2ē = Н2 + 2ОН–.
Катионы этих металлов не восстанавливаются, остаются в растворе.
3. Если у катода накапливаются катионы металлов, которые расположены в ряду напряжений между алюминием и водородом, и молекулы воды, то на катоде восстанавливаются ионы этих металлов и частично ионы водорода из молекул воды:
Меn+ + nē = Мео,
а также 2Н2О + 2ē = Н2 + 2ОН–.
4. Если в растворе находится смесь катионов разных металлов, то первыми восстанавливаются катионы менее активного металла.
5. При электролизе растворов кислот на катоде восстанавливаются катионы водорода:
2Н+ + 2ē = Н2.
Катодные
процессы
в водных растворах солей
|
Электрохимический ряд напряжений металлов |
|||
|
Li, Rb, K, Ba, Sr, Ca, Na, Mg, Aℓ |
Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, Pb |
H2 |
Cu, Hg, Ag, Pb, Pt, Au |
|
2Н2О + 2ē = Н2 + 2ОН– |
Меn+ + nē = Мео 2Н2О + 2ē = Н2 + 2ОН– |
|
Меn+ + nē = Мео |
Последовательность разрядки ионов на аноде зависит от природы аниона.
1. При электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде окисляются анионы кислотных остатков:
2Cℓ– – 2ē = Cℓ2o.
2. При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде идет процесс окисления гидроксид-ионов из молекул воды:
2Н2О – 4ē = О2 + 4Н+.
3. При электролизе растворов щелочей окисляются гидроксид-ионы:
4ОН– – 4ē = О2o + 2Н2О (п р и м е р ы 2, 3).
Анодные процессы
в водных растворах солей
|
Кислотный остаток (анион) Аn– |
|
|
Бескислородный (Cℓ–, Br–, I–, S2– и др.) |
Кислородсодержащий (SO42–, NO3–, CO32– и др.) |
|
Окисление аниона (кроме фторидов) Аn– – nē = Ao |
В кислой, нейтральной средах: 2Н2О – 4ē = О2 + 4Н+ В щелочной среде: 4ОН– – 4ē = О2o + 2Н2О |
П р и м е р 1. При электролизе расплава хлорида кальция на аноде выделился хлор объемом 8,96 л (н. у.). Составьте схему электролиза расплава CaCℓ2, определите, какая масса кальция выделится на катоде.
Решение.
1. Составляем схему электролиза расплава CaCℓ2. В расплаве хлорид кальция диссоциирует на ионы:
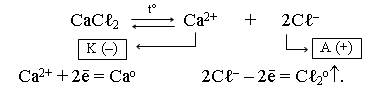
Складываем полуреакцию, протекающую на катоде, с полуреакцией, протекающей на аноде, и получаем ионно-молекулярное уравнение электролиза:
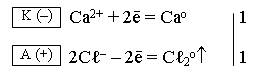
Ca2+ + 2Cℓ–
![]() Cao
+ Cℓ2o.
Cao
+ Cℓ2o.
Молекулярное уравнение электролиза:
CaCℓ2 ![]() Ca
+ Cℓ2.
Ca
+ Cℓ2.
2. Определяем количество вещества выделившегося хлора:
ν (Cℓ2)
= ![]() ;
ν (Cℓ2) =
;
ν (Cℓ2) = ![]() =
0,4 (моль).
=
0,4 (моль).
3. Находим массу полученного кальция. Из уравнения электролиза следует: ν (Са) : ν (Cℓ2) = 1 : 1 Þ ν (Cа) = 0,4 моль, отсюда по формуле: m (Ca) = ν (Ca) · M (Ca) = 0,4 · 40 = 16 (г).
П р и м е р 2. При электролизе раствора хлорида кальция на катоде выделился водород массой 5,6 г. Составьте схему электролиза раствора CaCℓ2, определите массу выделившегося газа на аноде и массу гидроксида кальция, образовавшуюся около катода.
Решение.
1. Составляем схему электролиза раствора CaCℓ2. Соль в растворе диссоциирует на ионы:
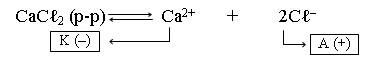
|
(H+) H2O и Са2+ – конкурирующие частицы. Кальций в ряду напряжений стоит левее алюминия, поэтому на катоде идет восстановление ионов водорода из молекул воды: 2Н2О + 2ē = Н2 + 2ОН– |
|
(ОH–) H2O и Сℓ– – конкурирующие частицы. Хлорид-ион – бескислородный кислотный остаток, поэтому на аноде идет окисление ионов хлора: 2Сℓ– – 2ē ® Сℓ2 |
Складываем полуреакцию, протекающую на катоде, с полуреакцией, протекающей на аноде, и получаем ионно-молекулярное уравнение электролиза:
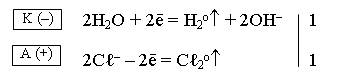
2Н2О + 2Cℓ–
![]() Н2o
+ Cℓ2o + 2ОН–
Н2o
+ Cℓ2o + 2ОН–
Молекулярное уравнение электролиза:
CaCℓ2 + 2Н2О
![]() Н2 +
Сℓ2 + Са(ОН)2.
Н2 +
Сℓ2 + Са(ОН)2.
2. Определяем количество вещества выделившегося водорода:
ν (Н2)
= ![]() =
2,8 (моль).
=
2,8 (моль).
3. Рассчитываем массу выделившегося хлора. Из уравнения электролиза следует:
ν (Н2) : ν (Cℓ2) = 1 : 1 Þ ν (Cℓ2) = 2,8 (моль),
по формуле:
m (Cℓ2) = ν (Cℓ2) · М (Cℓ2) = 2,8 · 71 = 198,8 (г).
4. Находим массу образовавшегося гидроксида кальция. Из уравнения следует:
ν (Cℓ2) : ν (Cа(ОН)2) = 1 : 1 Þ ν (Cа(ОН)2) = 2,8 моль,
или ν (Н2) : ν (Cа(ОН)2) = 1 : 1 Þ ν (Cа(ОН)2) = 2,8 моль,
по формуле:
m (Cа(ОН)2) = ν (Cа(ОН)2) · M (Cа(ОН)2) = 2,8 · 40 = 112 (г).
П р и м е р 3. При электролизе раствора нитрата серебра на катоде получили серебро массой 162 г. Составьте схему электролиза, определите объем (н. у.) выделившегося газа на аноде и массу образовавшейся азотной кислоты около анода.
Решение.
1. Составляем схему электролиза раствора AgNO3. В растворе нитрат серебра диссоциирует на ионы:
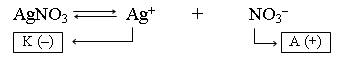
|
Ag+ и H+ (H2O) – конкурирующие частицы. Серебро в ряду напряжений стоит после водорода, поэтому на катоде идет восстановление ионов серебра: Ag+ + ē ® Ago |
ОH– (H2O) и NO3– – конкурирующие частицы. Нитрат-ион – кислородсодержащий кислотный остаток, поэтому на аноде окисляются гидроксид-ионы из молекул воды: 2H2O – 4ē ® О2о + 4Н+ |
Для уравнивания числа электронов полуреакцию, протекающую на катоде, умножим на 4 и складываем с полуреакцией, протекающей на аноде; получаем ионно-молекулярное уравнение электролиза:
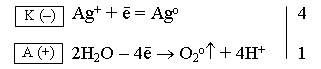
4Ag+ + 2H2O ![]() 4Ago
+ О2o + 4Н+.
4Ago
+ О2o + 4Н+.
Молекулярное уравнение электролиза:
4AgNO3 + 2Н2О ![]() 4Ag
+ O2 + 4HNO3.
4Ag
+ O2 + 4HNO3.
2. Находим количество вещества полученного серебра:
ν (Ag)
= ![]() =
1,5 (моль).
=
1,5 (моль).
3. Определяем объем выделившегося кислорода. Из уравнения электролиза следует:
ν (Ag)
: ν (O2) = 4 : 1 Þ
ν (O2) = ![]() =
0,375 (моль),
=
0,375 (моль),
по формуле:
V (O2) = ν (O2) · VM = 0,375 · 22,4 = 8,4 (л).
4. Рассчитываем массу образовавшейся азотной кислоты. Из уравнения электролиза следует:
ν (Ag) : ν (HNO3) = 4 : 4 = 1 : 1 Þ ν (HNO3) = 1,5 моль,
по формуле:
m (HNO3) = ν (HNO3) · M (HNO3) = 1,5 · 63 = 94,5 (г).
Реши самостоятельно:
1. Составьте схемы электролиза расплавов хлорида бария, гидроксида калия.
2. Укажите, как электролизом получить гидроксид калия из соли калия.
3. Электролизу подвергается раствор, содержащий хлорид натрия, сульфат меди (II), нитрат цинка. Укажите, какие процессы будут протекать на катоде и аноде, последовательность их протекания и то, какие ионы останутся в растворе после электролиза.
4. При электролизе расплава хлорида калия на аноде выделился газ объемом 44,8 л (н. у.). Составьте схему электролиза расплава соли. Определите, какое количество вещества соли подверглось электролизу. (4 моль.)
5. Укажите, какие вещества и в каких количествах образуются при электролизе расплава хлорида натрия массой 234 г. Определите массу железа, которая может вступить в реакцию с веществом, выделяющимся на аноде. (4 моль Na, 2 моль Cℓ2; 74,66 г Fe.)
6. При электролизе раствора нитрата меди (II) объемом 1 л (r = 1 г/мл) на аноде выделился газ объемом 3,36 л (н. у.). Составьте схему электролиза раствора Cu(NO3)2, определите массу вещества, которое выделилось на катоде, и массовую долю нитрата меди в исходном растворе (электролиз соли прошел полностью). (19,2 г Cu; w (Cu(NO3)2 = 5,64 %.)
7. При электролизе раствора хлорида двухвалентного металла на аноде выделился газ объемом 560 мл (н. у.), а на катоде за это же время – металл массой 1,6 г. Определите, какой это металл. (Медь.)
8. При электролизе раствора сульфата меди (II) на катоде выделилась медь массой 16 г. Составьте схему электролиза раствора CuSO4 и вычислите объем газа (н. у.), образующегося при этом. (2,8 л.)
9. Ток одинаковой силы пропущен через растворы нитрата ртути (II) и нитрата серебра. В процессе электролиза на одном из катодов выделилась ртуть массой 0,4 г. Определите, какое количество вещества серебра выделится на другом катоде. (0,004 моль.)
10. Ток одинаковой силы пропущен через растворы сульфата и хлорида цинка. На одном из катодов выделился водород массой 0,25 г. Определите, какая масса вещества выделится на другом катоде, на анодах. (8,17 г; 2,0 г; 8,875 г.)
11. При электролизе раствора сульфата калия на катоде выделился водород объемом 6,266 л (н. у.). Составьте схему электролиза раствора соли. Определите объем выделившегося газа на аноде и массу воды, которая разложилась при этом. (3,133 л; 5,03 г.)
12. Составьте схему электролиза раствора сульфата натрия. Вычислите массу вещества, выделяющегося на катоде, если на аноде выделяется 1,12 л газа (н. у.). Какая масса серной кислоты образуется при этом около анода? (0,2 г; 9,8 г.)
13. При электролизе раствора сульфата меди (II) в растворе (около анода) образовалась кислота, на нейтрализацию которой затрачен раствор объемом 16 мл с массовой долей гидроксида калия 6 % (r = 1,05 г/мл). Составьте схему электролиза раствора соли и определите массу меди, которая выделится на катоде. (0,576 г.)
14. При электролизе раствора сульфата марганца (II) на аноде выделился кислород объемом 16,8 л (н. у.). Составьте схему электролиза раствора соли и определите массу марганца, которая выделится на катоде, если выход металла составляет 84 %. (69,3 г.)
15. При электролизе раствора объемом 350 мл с массовой долей гидроксида натрия 9 % (r = 1,10 г/мл) на аноде выделился газ объемом 28 л (н. у.). Составьте схему электролиза раствора NaOH и вычислите массовую долю находящегося в растворе вещества после электролиза. (10,2 %.)
16. Электролиз раствора объемом 200 мл (r = 1,02 г/мл) с массовой долей сульфата меди (II) 6 % проводили до тех пор, пока масса раствора не уменьшилась на 5 г. Определите массовые доли вещества в оставшемся растворе и массы продуктов реакции, выделившихся на электродах. (w (CuSO4) = 1,13 %; w (H2SO4) = 3,08 %; m (Cu) = 4 г; m (О2) = 1 г.)
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.