
Индивидуальная работа
1. а Объясните смысл уравнения состояния идеального газа.
[1]
b В твердом контейнере объемом 0,020 м3 находится 1 моль
идеального газа. Определите давление газа, оказываемое на стенки сосуда, если
его температура равна 293 К .
[3]
2. В сосуде цилиндрической
формы
объемом 0,030
м3 находится воздух массой 4,0 г . Молярная
масса воздуха 29 г/моль.
а Определите давление, оказываемое газом на стенки сосуда при температуре
34 ° С.
[4]
b Какой станет
температура газа, если его температуру в пункте а увеличить вдвое?
[4]
3. На рисунке изображены два теплоизолированных сосуда с газом, соединенные тонкой трубкой. Трубка снабжена краном, который вначале находится в закрытом состоянии.
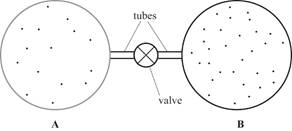
Объем каждого сосуда равен 2,0 ´ 10-2 м3 . Температура обоих сосудов равна -13 ° С.
Давление
газа в сосуде А равна 180 кПа, а в
сосуде B - 300 кПа.
а Покажите, что количество вещества газа в двух сосудах равно 4,4 моль.
[3]
b Когда
кран открыли газы в сосудах перемешались. Температура газа не изменилась.
Определите новое давление газа, оказываемое газом
на стенки сосудов.
[3]
[3]
Ответы:
1 a Pressure
× volume
= number of moles × universal gas constant ×
thermodynamic temperature [1]
b PV = nRT [1]
P = ![]() =
= ![]() [1]
[1]
P = 1.22 × 105 Pa » 1.2 × 105
Pa (120 kPa) [1]
2 a PV
= nRT [1]
n = ![]() = 0.138 moles [1]
= 0.138 moles [1]
P = ![]() =
= ![]() [1]
[1]
P = 1.17 × 104 Pa » 1.2 × 104
Pa (12 kPa) [1]
b ![]() is constant when the
volume of the gas is constant. [1]
is constant when the
volume of the gas is constant. [1]
The pressure is doubled, hence the absolute temperature of the gas is also
doubled. [1]
Therefore:
temperature = 2 × (273 + 34) = 614 K [1]
temperature in °C = 614 – 273 = 341 °C » 340 °C [1]
3 a n = ![]() [1]
[1]
n = ![]() +
+ ![]() [1]
[1]
n = 4.44 moles » 4.4 moles [1]
b Total volume, V = 4.0 × 10–2 m3, T = 273 – 13 = 260 K
P = ![]() [1]
[1]
P = ![]() [1]
[1]
P » 2.4 × 105 Pa (240 kPa) [1]
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.