
32 №Сабақ / Урок № 32
Сабақ жоспары / План урока
Сабақтың тақырыбы / Тема урока
Электрический ток в растворах и расплавах электролитов. Законы электролиза.
Электрический ток в жидкостях
Как известно, химически чистая (дистиллированная) вода является плохим проводником. Однако при растворении в воде различных веществ (кислот, щелочей, солей и др.) раствор становится проводником, из-за распада молекул вещества на ионы.
1. Электролитами – вещества, растворы которых проводят электрический ток (при этом наблюдается перенос вещества!!) Электролитами являются растворы кислот, щелочей и солей.

2. Электролитическая диссоциация – распад молекул вещества на ионы под действием растворителя
3. Ионами называются атомы или молекулы, потерявшие или присоединившие к себе один или несколько электронов.
4. Проводимость – ИОННАЯ (ток – движение «+» и «-» ионов) происходит с переносом вещества.
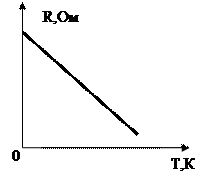
5. Зависимость сопротивления электролитов от температуры
При повышении температуры увеличивается степень диссоциации что приводит к увеличению концентрации ионов (количество ионов в жидкости). Сила тока в электролите возрастает, а сопротивление соответственно уменьшается (Рисунок 1).
 |
6. ВАХ для электролитов (Рисунок2)
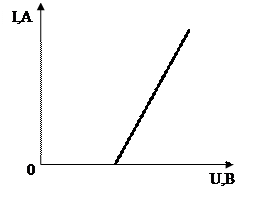 |
Рисунок 2 – ВАХ электролитов
График смещен так как, для того чтобы по цепи шел ток, то:
1. должна произойти диссоциация (распад молекул на ионы);
2. ионы начали упорядоченно двигаться.
7. Прохождение электрического тока через жидкости сопровождается электролизом – выделение вещества на электродах при прохождении через электролит тока (Рисунок 3). При подключении электродов к источнику тока ионы под действием электрического поля начинают упорядоченное движение: положительные ионы меди движутся к катоду, а отрицательно заряженные ионы хлора – к аноду. Достигнув катода, ионы меди нейтрализуются избыточными электронами катода и превращаются в нейтральные атомы, оседающие на катоде. Ионы хлора, достигнув анода, отдают по одному электрону. Хлор выделяется на аноде в виде пузырьков.
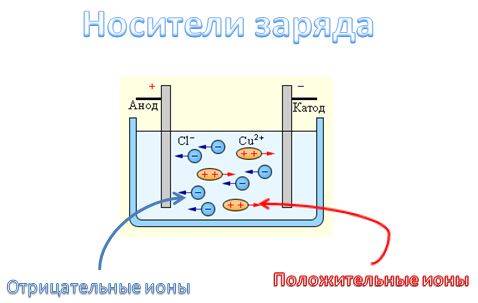
Рисунок 3 – Распад хлорида меди на ионы и процесс электролиза
8. Законы Фарадея
1. Первый закон электролиза (первый закон Фарадея):
масса вещества (m), выделяющегося на электроде за время (t), прямо пропорциональна электрическому заряду (q), прошедшему через электролит:
![]()
(поскольку q=It, I - сила постоянного тока, протекающего через раствор за время t), k – электрохимический эквивалент вещества
2. Второй закон электролиза (второй закон Фарадея):
Электрохимические эквиваленты веществ прямо пропорциональны отношениям их молярных (или атомных) масс М к валентности n:
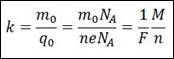
Здесь NA – постоянная Авогадро, M = m0NA – молярная масса вещества,
F = eNA=96485 Кл/моль – постоянная Фарадея
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества
Закон Фарадея для электролиза
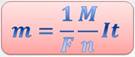
Протекание тока в жидкостях сопровождается выделением теплоты. При этом выполняется закон Джоуля-Ленца.
9. Определение заряда электрона
Закон Фарадея сыграл важную роль в истории развития физики. Именно закон, полученный Фарадеем опытным путем, послужил толчком к выдвижению гипотезы о существовании в природе элементарного электрического заряда. Закон Фарадея позволяет определить заряд одновалентного иона (заряд электрона). Из формулы электролиза:
![]()
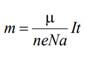
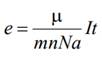
т.е. надо измерить на опыте только массу выделившегося вещества m и силу тока в цепи I.
10. Применение электролиза (работа с материалом, представленным ниже, на с.4-6 после конспекта урока):
ü никелирование;
ü хромирование;
ü омеднение;
ü гальванопластика- копии с рельефных поверхностей (в полиграфии);
ü получение чистых Ме, очистка Ме от примесей.
11. Пример решения задачи
Задач №1 За какое время t при электролизе водного раствора хлорной меди (CuCl2) на катоде выделится масса m=4,74 г меди, если ток I=2 A.
Решение. Вследствие электролитической диссоциации молекулы CuCl2 при растворении в воде распадаются на ионы Cu2+ и Cl-. Согласно закону Фарадея, на катоде отложится масса серебра m при электролизе водного раствора хлорной меди за время, равное:
![]()
Подставляя числовые значения, находим: t=2 ч. Ответ: 2 часа.
Домашнее задание
· Прочесть «Физика 10 класс. 2 часть» Б.Кронгарт, Д.Казахбаева, О.Иманбеков, Т.Қыстаубаев - Мектеп. 2019, с. 102-108.
· Составить опорный конспект, включая дополнительный материал по применению электролиза на стр. 4-6 конспекта урока.
· Из раздела «Решайте» с. 108 №1 решить задачу, записать в тетрадь с фотографировать, поместить в ворд и прикрепить на портал.
Применение электролиза
Гальваностегия. Покрытие металлических предметов тонким слоем другого металла с помощью электролиза. В электролитической ванне в качестве катода используется покрываемое изделие, а анод изготовлен из металла, которым изделие необходимо покрыть. Раствор соли того же металла служит электролитом. Перед погружением в ванну предмет тщательно очищается, обезжиривается и полируется.
Гальванопластика. С помощью электролиза можно не только покрывать предметы слоем металла, но и изготавливать их рельефные копии.В 1837 г. Этот процесс изобрел русский ученый Б.С. Якоби (1801-1874). Модель изготавливается из воска, парафина, или другого пластичного материала и покрывается слоем графита для создания проводящего слоя. Затем ее опускают в раствор соли металла, который используется для создания копии, в качестве катода. Анод изготавливается из того же металла. После осаждения слоя металла нужной толщины деталь извлекается из ванны и отделяется от восковой модели.
Рафинирование металлов. Для получения химически чистых металлов также применяется электролиз. Например, неочищенная медь используется в качестве анода, электролитом служит раствор медного купороса. В качестве катодов используют тонкие медные листы, смазанные жиром. При прохождении постоянного электрического тока чистая медь откладывается на катоде, а анод постепенно растворяется.
Электрометаллургия. С помощью электролиза извлекают алюминий из расплава смеси бокситов (глинозема) и минерала. Электродами служат опускаемые в расплав угольные стержни. Электролиз происходит при температуре свыше 9000C. Температура поддерживается за счет тепла, выделяющегося при прохождении электрического тока через расплав согласно закону Джоуля–Ленца. Производство алюминия требует больших затрат электроэнергии. Для получения 1000 кг алюминия необходимо около 15000 кВт·ч электроэнергии. Электролизом добываются также натрий, кальций, магний и т.д.
Электролитические конденсаторы. На явлении электролиза основано действие электролитических конденсаторов, в свое время широко применявшихся. При пропускании постоянного электрического тока через раствор положительный электрод покрывается тонкой
пленкой окислов алюминия, и ток падает до нуля. Получился конденсатор, в котором одна обкладка –положительный электрод, а вторая –электролит совместно с отрицательным электродом. Слой окисла алюминия является диэлектриком конденсатора и выдерживает напряжение до 40В. Благодаря ничтожно малой толщине диэлектрика, электроёмкость таких конденсаторов может быть очень большой. Главным недостатком является его полярность.
Гальвани́ческий элеме́нт
Гальвани́ческий элеме́нт — химический источник электрического тока, основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани.
Гальванические первичные элементы - это устройства для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Примером гальванического элемента является элемент Даниэля –Якоби.
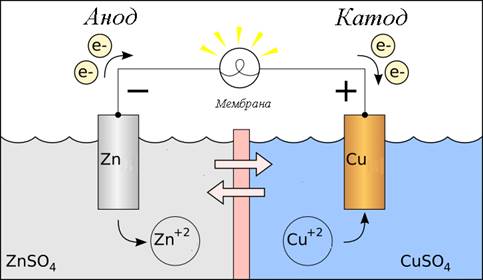
Широкое распространение получили марганцево-цинковые элементы, не содержащие раствора электролита (сухие элементы, батарейки). Так, в солевых элементах Лекланше цинковый электрод служит анодом, электрод из смеси диоксида марганца с графитом служит катодом, графит служит токоотводом. Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя.
Щелочные марганцево-цинковые элементы, в которых в качестве электролита используется паста на основе гидроксида калия, обладают целым рядом преимуществ, в частности существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки.
Солевые и щелочные элементы широко применяются для питания радиоаппаратуры и различных электронных устройств.
Электрохимические генераторы (топливные элементы) — это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента электроды не расходуются. Восстановителем является водород (H2), метанол (CH3OH), метан (CH4) в жидком или газообразном состоянии. Окислителем обычно является кислород воздуха или чистый. В кислородно-водородном топливном элементе со щелочным электролитом происходит превращение химической энергии в электрическую. Энергоустановки применяются на космических кораблях, они обеспечивают энергией космический корабль и космонавтов.
· Батарейки используются в системе сигнализации, фонарях, часах, калькуляторах, аудиосистемах, игрушках, радио, автооборудовании, пультах дистанционного управления.
· Аккумуляторы используются для запуска двигателей машин, возможно так же и применение в качестве временных источников электроэнергии в местах, удаленных от населенных пунктов.
· Топливные элементы применяются в производстве электрической энергии (на электрических станциях), аварийных источниках энергии, автономном электроснабжении, транспорте, бортовом питании, мобильных устройствах.
Аккумуляторы
Вторичные источники тока (аккумуляторы) — это устройства, в которых электрическая энергия внешнего источника тока превращается в химическую энергию и накапливается, а химическая — снова превращается в электрическую. Одним из наиболее распространенных аккумуляторов является свинцовый (или кислотный). Электролитом является 25—30 % раствор серной кислоты. Электродами кислотного аккумулятора являются свинцовые решетки, заполненные оксидом свинца, который при взаимодействии с электролитом превращается в PbSO4.
Также существуют щелочные аккумуляторы. Наибольшее применение получили никель-кадмиевые и никель-металлгидридные аккумуляторы, в которых электролитом служит KOH.
В различных электронных устройствах (мобильные телефоны, планшеты, ноутбуки), в основном, применяются литий-ионные и литий-полимерные аккумуляторы, характеризующиеся высокой ёмкостью и отсутствием эффекта памяти.
Электрический аккумулятор — химический источник тока многоразового действия, основная специфика которого заключается в обратимости внутренних химических процессов, что обеспечивает его многократное циклическое использование (через заряд-разряд) для накопления энергии и автономного электропитания различных электротехнических устройств и оборудования, а также для обеспечения резервных источников энергии в медицине, производстве и в других сферах
Электрические и эксплуатационные характеристики аккумулятора зависят от материала электродов и состава электролита. Сейчас наиболее распространены следующие аккумуляторы, представленные в Таблице 1.
Таблица 1 - Электрические и эксплуатационные характеристики аккумулятора
|
Тип |
ЭДС (В) |
Область применения |
|
свинцово-кислотные (Lead Acid) |
2,1 |
троллейбусы, трамваи, воздушные суда, автомобили, мотоциклы, электропогрузчики, штабелеры, электротягачи, аварийное электроснабжение, источники бесперебойного питания |
|
никель-кадмиевые (NiCd) |
1,2 |
замена стандартного гальванического элемента, строительные электроинструменты, троллейбусы, воздушные суда |
|
никель-металл-гидридные (NiMH) |
1,2 |
замена стандартного гальванического элемента, электромобили |
|
литий-ионные (Li‑ion) |
3,7 |
мобильные устройства, строительные электроинструменты, электромобили |
|
литий-полимерные (Li‑pol) |
3,7 |
мобильные устройства, электромобили |
|
никель-цинковые (NiZn) |
1,6 |
замена стандартного гальванического элемента |
По мере исчерпания химической энергии напряжение и ток падают, аккумулятор перестаёт действовать. Зарядить аккумулятор (батарею аккумуляторов) можно от любого источника постоянного тока с бо́льшим напряжением при ограничении тока. Наиболее распространённым считается зарядный ток (в амперах) в 1/10 номинальной ёмкости аккумулятора (в ампер⋅часах), однако эта величина не имеет никакого научного обоснования. Многие типы аккумуляторов имеют различные ограничения, которые необходимо учитывать при зарядке и последующей эксплуатации, например NiMH-аккумуляторы чувствительны к перезаряду, литиевые — к переразряду, напряжению и температуре. NiCd- и NiMH-аккумуляторы имеют так называемый эффект памяти, заключающийся в снижении ёмкости, в случае когда зарядка осуществляется при не полностью разряженном аккумуляторе. Также эти типы аккумуляторов обладают заметным саморазрядом, то есть они постепенно теряют заряд, даже не будучи подключенными к нагрузке. Для борьбы с этим эффектом может применяться капельная подзарядка.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.