
тема: Электролиз.
Презентация подготовлена учителем химии, Бекжановой Э.К, 2018 г
Электролизом называют ОВР, протекающие на электродах при
прохождении электрического тока через расплав или раствор электролита.
Что такое электролиты?
 Электролиз
расплавов электролитов
Электролиз
расплавов электролитов1. При плавлении электролиты распадаются на ионы.
2. Распавшиеся ионы не гидратированы.
3. При пропускании эл.тока через расплав ионы направляются к противоположно заряженным электродам и разряжаться на них.
Пример электролиза расплава хлорида натрия.
1) Напишите уравнение диссоциации расплава хлорида натрия.
2) Стрелками укажите,
направление ионов к электродам (аноду/катоду)
3) Составьте уравнения процессов восстановления и окисления на электродах.
|
4) Составьте итоговое уравнение электролиза расплава хлорида натрия. |
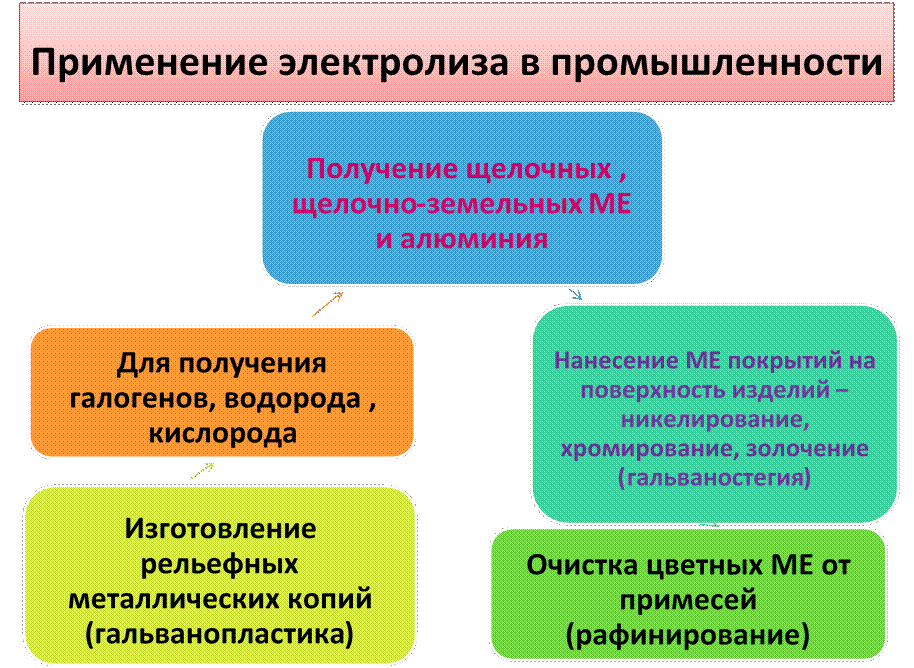
 Электролизом в промышленности
получают щелочные и щелочноземельные металлы, а также галогены.
Электролизом в промышленности
получают щелочные и щелочноземельные металлы, а также галогены.
|
Впервые электролиз использовал для получения щелочных металлов англ.ученый Г.Деви. |
Гемфри Дэви (17.12.1778 г –
29.05.1829 г)
Франц.химик А.Муассан электролизом жидкого фтороводорода смог первым получить фтор.
В 1906 г. А.Муассан был удостоен Нобелевской премии по химии за открытие и получение фтора. Интересно, но факт, что претендентом на эту премию был Д.И.Менделеев.
Не только из солей, но и из расплавов других соединений можно получить активные металлы.
Мировая промышленность использует для производства алюминия обезвоженные бокситы.
 Электролиз
растворов электролитов
Электролиз
растворов электролитовКакие частицы находятся в растворах электролитов? И как они ведут себя по отношению к эл.току?
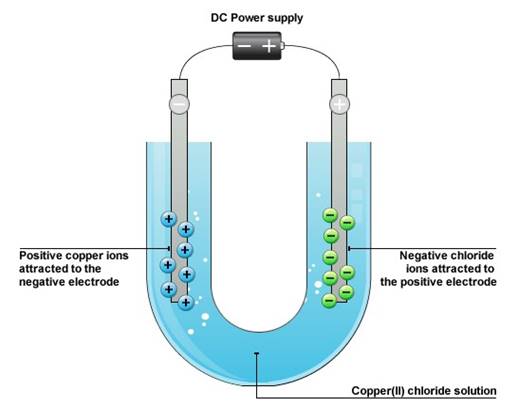
 Примеры электролиза солей различных типов
Примеры электролиза солей различных типовБромид меди (II) Хлорид натрия
Сульфат меди (II)
 ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ
Правила процесса электролиза на катоде зависят от положения катиона электролита в ЭХ ряду напряжений МЕ:
1) Если катион электролита расположен в ряду напряжений до марганца (вкл), то на катоде идет восстановление молекул воды с выделением газообразного водорода;
Катионы металла при этом остаются в растворе.
Если в водном растворе присутствуют катионы нескольких металлов, то первыми на катоде начнут восстанавливаться катионы менее
активных из них, т.е. тех, которые в электрохимическом ряду напряжений металлов расположены правее:
Li,K,Ca,Na,Mg,Al,Mn,Zn,Fe,Sn,Pb,(H2)Cu,Hg,Ag,Au
2) При электролизе растворов солей от Zn до Pb (вкл) на катоде восстанавливаются катионы металла.
При электролизе со значительной силой тока на катоде могут одновременно восстанавливаться и молекулы воды.
3) Если катионы электролита находятся в ряду напряжений после водорода, на катоде восстанавливается только металл.
Правила процесса электролиза на аноде зависят от материала, из которого изготовлен анод:
1) Если анод активный, т.е. растворяется (железо, цинк, медь, серебро и др.МЕ, которые окисляются в процессе электролиза), то независимо от природы аниона окисляется металл анода.
2) Если анод инертный (графит, платина, золото), то при электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона. При электролизе фторидов и кислородсодержащих кислот на аноде окисляются молекулы воды с выделением газообразного кислорода.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.