
Диаграмма состояний вещества.
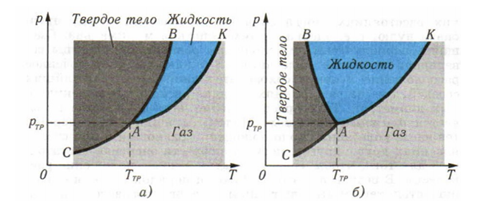
На рисунке изображены диаграммы трех фазовых состояний вещества.
Равновесному состоянию между жидкостью и ее паром соответствует кривая испарения АК. Равновесие между твердым и жидким состояниями вещества характеризует кривая плавления АВ. При давлениях и температурах, соответствующих точкам этой кривой, твердое тело и расплав, приведенные в соприкосновение, находятся в динамическом равновесии. Число молекул, переходящих в единицу времени из жидкости в твердое тело, равно числу молекул, переходящих границу раздела между ними в противоположном направлении. Кривая плавления идет почти вертикально, поскольку температура плавления слабо зависит от давления (на рисунке, а) она немного отклонена вправо. Этим иллюстрируется повышение температуры плавления с увеличением давления, наблюдаемое у большинства веществ. Для вещества, обладающего в твердом состоянии меньшей плотностью, чем в жидком (лед, висмут, серый чугун), увеличение давления способствует плавлению. Для таких веществ кривая плавления отклонена влево от вертикали (рис. б)). Кривая СА на диаграмме состояний вещества отвечает значениям давления и температуры, при которых устанавливается равновесие между процессами испарения молекул (атомов) твердого тела и конденсации их на поверхность твердого тела. Процесс испарения твердых тел называется сублимацией. Конечно, сублимации сопутствует и обратный процесс — кристаллизация из пара. При определенных сочетаниях температуры и давления система «кристалл — пар» находится в динамическом равновесии. С уменьшением температуры кристалла уменьшается и давление его насыщенного пара (см. кривую сублимации СА).
Тройная точка.
Кривые плавления и парообразования пересекаются в точке А. Эту точку называют тройной точкой, так как если при давлении Ртр и температуре Ттр некоторые части вещества в твердом, жидком и газообразном состояниях находятся в контакте, то без подведения или отвода тепла количество вещества, находящегося в каждом из трех состояний, не изменяется. Из диаграммы состояний вещества видно, что переход вещества при нагревании из твердого состояния в газообразное может совершиться, минуя жидкое состояние. Переход кристалл — жидкость — газ при нормальном атмосферном давлении происходит лишь у тех веществ, у которых давление в тройной точке ниже этого давления. Те же вещества, у которых давление в тройной точке превышает атмосферное, в результате нагревания при атмосферном давлении не плавятся, а переходят в газообразное состояние (сублимируют). Например, при атмосферном давлении твердая углекислота при нагревании не плавится, а сублимирует. Это объясняется тем, что тройной точке соединения СО2 соответствует давление, примерно в пять раз большее нормального атмосферного давления. Поскольку тройной точке соответствует вполне определенная температура, она может служить опорной (основной) точкой термометрической шкалы. Оказывается, что температура тройной точки воды равна 273,16 К (т. е. 0,01 °С). Это позволило ввести в Международной системе единиц следующее определение единицы термодинамической (абсолютной) температуры (1 К): кельвин равен 1/273,16 части термодинамической температуры тройной точки воды.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.