
Дидактический материал к уроку №1
Раздел долгосрочного плана
« ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ»
Тема урока №1: Основные положения молекулярно-кинетической теории газов и ее опытное обоснование.
Цель обучения 10.3.1.1 - описывать связь температуры со средней кинетической энергией поступательного движения молекул;
МКТ объясняет тепловые явления, свойства тел на основе представления о том, что все тела состоят из хаотически движущихся частиц.
Историческая справка:
В V в до н. э. древнегреческим учёным Демокритом была выдвинута атомистическая гипотеза: всё в мире состоит из атомов; между атомами находится пустота. Аргументы в пользу учения Демокрита можно найти в в знаменитой поэме древнеримского поэта Лукреция Кара «О природе вещей»:
… одежда сыреет на морском берегу,
А на солнце она высыхает.
Однако видеть нельзя,
Как влага на ней оседает и как она исчезает.
Значит, дробится вода на такие мельчайшие части,
Что недоступны они для нашего глаза.
IV в. до н. э. Аристотель – отверг гипотезу Демокрита.
Через полторы тысячи лет после появления атомистической гипотезы в средневековой Франции издаётся указ о запрещении распространении учения об атомах под страхом смертной казни. Церковь уничтожает все ростки нового и прогрессивного , не укладывающиеся в систему религиозных представлений о мире.
Только в XVII в. начала развиваться последовательная молекулярно – кинетическая теория. Большой вклад в развитие этой теории был сделан великим русским учёным - М.В. Ломоносовым. Он объяснил основные свойства газа беспорядочным движением молекул. Впервые им была объяснена природа теплоты.
ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ
В основе МКТ лежат три важнейших положения:
1) все вещества состоят из мельчайших частиц (атомов, молекул, электронов, ионов);
2) частицы вещества находятся в непрерывном хаотическом движении (его часто называют тепловым движением);
3) частицы вещества взаимодействуют друг с другом.
ОПЫТНОЕ ПОДТВЕРЖДЕНИЕ МКТ
Первое положение
1. Предположение о молекулярном строении вещества подтверждалось только косвенно. Размеры молекул и атомов так малы, что различить их в обычный микроскоп невозможно. Поэтому даже в XIX-м веке многие ученые еще сомневались в существовании молекул. Сегодня техника достигла уровня, при котором можно рассмотреть даже отдельные атомы при помощи ионных и электронных микроскопов. Убедиться в существовании молекул и оценить их размер можно довольно просто. Поместим очень маленькую капельку масла на поверхность воды. Масляное пятно будет растекаться по поверхности воды, но площадь масляной пленки не может превышать определенного значения. Естественно предположить, что максимальная площадь пленки соответствует масляному слою толщиной в одну молекулу. Например, капелька оливкового масла объемом 1 мм3 растекается по площади не более 1 м2. Отсюда следует, что размер молекулы масла порядка 10-9м.
2. Ещё одно подтверждение - опыт Бриджмена: масло, налитое в стальной сосуд сдавливают под сверхвысоким давлением, и замечают, что капельки масла появились на стенках сосуда. Вывод: масло состоит из мельчайших частиц, которые смогли пройти через промежутки между частицами стального сосуда.
Второе положение доказывает явление диффузии - взаимного проникновения молекул одного вещества в промежутки другого вещества.
1. Убедиться в том, что молекулы движутся, можно совсем просто: капните капельку духов в одном конце комнаты, и через несколько секунд этот запах распространится по всей комнате. В окружающем нас воздухе молекулы носятся со скоростями артиллерийских снарядов — сотни метров в секунду.
В жидкостях диффузия происходит медленнее. В стеклянный сосуд наливают водный раствор медного купороса. Этот раствор имеет темно-голубой цвет. Поверх раствора в сосуд очень осторожно, чтобы не смешать жидкости, наливают чистую воду. Медный купорос тяжелее воды и потому остается внизу сосуда. В начале опыта между двумя жидкостями видна резкая граница. Оставим сосуд в покое. Через несколько дней можно заметить, что граница раздела между жидкостями расплылась. А недели через две эта граница вообще исчезнет, и в сосуде будет находиться однородная жидкость бледно-голубого цвета. Итак, причиной диффузии является непрерывное и беспорядочное движение частиц вещества. При диффузии частицы одного вещества проникают в промежутки между частицами другого вещества, и вещества перемешиваются.
Медленнее всего диффузия происходит в твердых телах. В одном из опытов гладко отшлифованные пластины свинца и золота положили одна на другую и сжали грузом. Через пять лет золото и свинец проникли друг в друга на 1 мм.
Скорость протекания диффузии увеличивается с ростом температуры.
Диффузия имеет большое значение в процессах жизнедеятельности человека, животных и растений. Например, именно благодаря диффузии кислород из легких проникает в кровь человека, а из крови — в ткани.
2. В начале XIX-го века английский ботаник Броун, наблюдая в микроскоп частицы пыльцы, взвешенные в воде, заметил, что эти частицы пребывают в «вечной пляске». Причину так называемого «броуновского движения» поняли только через 50 лет после его открытия: отдельные удары молекул жидкости о частицу не компенсируют друг друга, если эта частица достаточно мала. С тех пор броуновское движение рассматривается как наглядное опытное подтверждение теплового движения молекул.
Докажем третье положение.
Поставим опыты.
1. Чтобы получить некоторое представление о величине сил взаимодействия между молекулами, попробуйте разорвать стальную или капроновую нить сечением 1 мм2. Немногие смогут это сделать, а ведь усилиям всего вашего тела «противостоят» силы притяжения молекул в малом сечении нити!
2. Если плотно прижать друг к другу свинцовые цилиндры с хорошо зачищенными торцами, они «сцепляются» настолько прочно, что к ним можно подвешивать килограммовую гирю (см. рисунок). Этот опыт также свидетельствует о наличии сил межмолекулярного притяжения.
Если бы молекулы не притягивались друг к другу, не было бы ни жидкостей, ни твердых тел — они просто рассыпались бы на отдельные молекулы. С другой стороны, если бы молекулы только притягивались, они «слипались» бы в чрезвычайно плотные сгустки, а молекулы газов при ударах о стенки сосуда «прилипали» бы к ним. Взаимодействие молекул имеет электрическую природу. Хотя молекулы, в целом, электрически нейтральны, распределение положительных и отрицательных электрических зарядов в них таково, что на больших расстояниях (по сравнению с размерами самих молекул) молекулы притягиваются, а на малых расстояниях — отталкиваются.
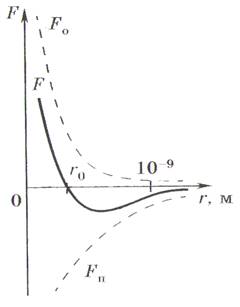 На рисунке приведена качественная
зависимость сил межмолекулярного взаимодействия от расстояния r между молекулами, где Fо и Fп — соответственно силы отталкивания и притяжения, F — их результирующая. Силы отталкивания считаются положительными, а силы взаимного
притяжения - отрицательными.
На рисунке приведена качественная
зависимость сил межмолекулярного взаимодействия от расстояния r между молекулами, где Fо и Fп — соответственно силы отталкивания и притяжения, F — их результирующая. Силы отталкивания считаются положительными, а силы взаимного
притяжения - отрицательными.
На расстоянии r = rо результирующая сила F = 0, т.е.силы притяжения и отталкивания уравновешивают друг Друга. Таким образом, расстояние г0 соответствует равновесному расстоянию между молекулами, на котором бы они находились а отсутствие теплового движения. При r < г0 преобладают силы отталкивания (F > 0), при r>r0 — силы притяжения (F < О). На расстояниях г > 10-9 м межмолекулярные силы взаимодействия практически отсутствуют (F →0).
Ярким примером различного взаимодействия молекул является то, что вещество может находиться в различных агрегатных состояниях. Например: лёд, вода и водяной пар.
Лёд, вода и водяной пар состоят из одних и тех же молекул. Различие заключается в скорости молекул, их взаимном расположении и силах взаимодействия между ними.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.