
6 тақырып. Физико-химиялық анализ және фазалық тепе-теңдік.
Термодинамикалық жүйелер гомогенді және гетерогенді болып бөлінеді. Гомогенді жүйе бір ғана фазадан, ал гетерогенді жүйе - екі немесе одан да көп фазалардан тұрады.
Фаза деп, құрамы, химиялық және физикалық қасиеттері бірдей, басқа бөліктерден бөлу беті арқылы бөлінген жүйенің біртекті бөлігін айтамыз.
Жүйені фаза санына байланысты бір фазалы, екі фазалы, үш фазалы, көп фазалы деп бөледі.
Жүйеден тыс жеке өмір сүре алатын оның негізгі құрамдас бөлігі болып келетін жеке химиялық затты компонент дейді.
Термодинамикалық жүйенің барлық фазаларын түзуге және кез–келген фазасының құрамын математикалық өрнектеуге қажетті жеке химиялық заттың ең аз санын компонент саны дейміз.
Компонент саны бойынша жүйені бір компоненті, екі компоненті және тағы әрі қарай бөледі.
Жүйе күйі еркіндік дәреже санымен сипаталады.
Жүйедегі тепе–теңдікті, яғни, фазалар санын бұзбай өзгертуге болатын термодинамикалық параметрлер санын еркіндік дәреже саны дейді. Оны с әрпімен белгідейді. Еркіндік дәреже саны бойынша жүйені инвариантты немесе вариантсыз (с=0), моновариантты (с=1), бивариантты (с=2).
Гиббстің фазалар ережесі. Клаузиус-Клапейрон теңдеуі
Жүйенің фазалық күйі фазалар санымен (ф), тәуелсіз компонент санымен (к), еркіндік дәреже санымен (с) және жүйеге әсер етуші сыртқы факторлар санымен (n) сипатталады. Тепе–теңдіктегі жүйенің осы сипаттамаларының арасындағы байланыс Гиббстің фазалар ережесімен анықталады:
с = к – ф + n ( 4.1 )
Тепе–теңдік күйдегі жүйеге сыртқы факторлардан температура мен қысым әсер етсе, еркіндік дәреже саны компоненттер санынан фазалар санын алып, оған екіні қосқанға тең болады:
с = к – ф + 2 ( 4.2 )
Егер сыртқы факторлардан жүйеге тек температура әсер етсе, ал қысым тұрақты (немесе керісінше), онда фазалар ережесі келесідей болады:
с = к – ф + 1 ( 4.3 )
Клаузиус-Клапейрон теңдеуі бір компонентті жүйенің фазалық күйіне қысым мен температураның әсерін көрсетеді:
![]() (4.4)
(4.4)
мұндағы ![]() – фазалық ауысу жылуы;
– фазалық ауысу жылуы;
Т – фазалық ауысу температурасы;
∆V – фазалық ауысу кезіндегі жүйенің молярлы көлемінің өзгерісі.
![]() туындысы булану
және возгонка процестері үшін қаныққан бу
қысымының температура бойынша өзгеруін көрсетеді.
туындысы булану
және возгонка процестері үшін қаныққан бу
қысымының температура бойынша өзгеруін көрсетеді.
∆ V = V2 – V1, егер V2 >> V1
![]() , онда
теңдеу келесідей:
, онда
теңдеу келесідей:
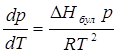 (
4.5)
(
4.5)
мұндағы
![]() – буланудың молярлы жылуы.
– буланудың молярлы жылуы.
Температура жоғарлаған сайын сұйықтық бетіндегі қаныққан бу қысымы әрқашанда артады. Балқу процесі үшін теңдеуді келесідей түрде жазуға болады:
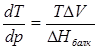 немесе
немесе 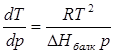 (4.6)
(4.6)
Клаузиус-Клапейрон теңдеуінің дифференциалды түрі келесідей болады:
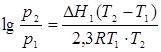 (
4.7)
(
4.7)
Бір компонентті гетерогенді жүйелер
Судың күй диаграммасы.
Бір компонентті жүйелер үшін фазалар ережесі:
с = 1 – ф + 2 = 3 – ф ( 4.8)
Қысымның температурадан немесе қысымның құрамнан және температураның құрамнан тәуелділігінің графикалық кескінін күй диаграммасы дейді.
Күй диаграммасын талдау фазалар санын, олардың болу (өмір сүру) шекарасын, ондағы компоненттердің әрекеттесу сипаттамасын, қайтадан түзілген қосылыстардың барын, олардың құрамын анықтауға мүмкіндік береді.
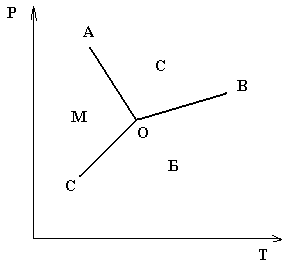
с = 1 – 1 + 2 = 2 (жүйе бивариантты).
Кез–келген қисыққа түсірілген нүктеде жүйе моновариантты с = 1. с = 1 – 2 + 2 = 1. Температураны немесе қысымды ғана өзгертуге болады.
Диаграммадағы О нүктесінде жүйе үш фазалы, (М, С, Б)
с= 1 – 3 + 2 = 0 (жүйе инвариантты)
О нүктесін судың үштік нүктесі дейді. Параметрлердің біреуінің өзгеруі тепе – теңдікті бұзып, бір немесе екі фазаның жоғалуына әкеледі.
Екі компоненті жүйенің күй диаграммасы
Екі компонентті жүйе үшін қысым тұрақты болғанда, Гиббстің фазалар ережесі келесі теңдеумен анықталады:
с = 2 – ф + 1 = 3 – ф (4.9)
Бұл кезде тепе – теңдіктегі фазалар саны үштен ф = 3 (с = 0), ал еркіндік дәрежесі екіден артық болмайды с = 2 (ф = 1).
Қатты фазалы екікомпоненті жүйенің күй диаграммасын балқу диаграммасы (термиялық талдау) дейді.
Балқу диаграммасы жүйе күйінің қоспалардың балқу температурасы мен құрамынан тәуелділігін көрсетеді.
Термиялық талдау температураның уақыт бойынша өзгеру сипаттамасы бойынша жүйенің салқындау кезіндегі өзгерісі туралы қортынды айтады. Салқындау қисықтары бойынша екі компоненті жүйенің күй диаграммасын тұрғызады.
Негізгі күй диаграмма түрлеріне: эвтетикалық диаграмма, конгруэнтті және инконгруэнтті балқитын химиялық қосылыстар, қатты және сұйық фазада ерігіштігі шектелген және шектелмеген жатады.
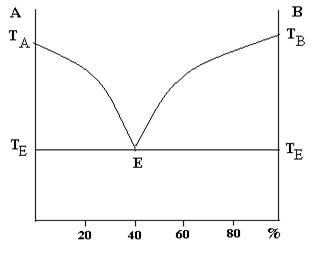
Сурет 4.2. Қатты күйінде ерімейтін А және В компоненттерінің балқу диаграммасы.
ТА, ТВ – таза А және В заттарының балқу температурасы. ТАЕ жәнеТВЕ қисықтары ликвидус сызығы деп аталады. Ликвидус сызығынан жоғарда жүйе сұйық күйде ( 1 – фаза ).
с = 2 – 1 + 1 = 2 (жүйе бивариантты)
ТАЕ және ТВЕ қисықтары екі фазалы жүйеге сәйкес келеді ( таза А және В компоненттерінің кристалдары және балқыма).
с = 2 – 2 + 1 = 1 (жүйе моновариантты)
Е нүктесін эвтетика нүктесі дейді. Екі компонент бірдей уақытта кристалданатын, кез–келген құрамдағы балқыма үшін бірдей ең төменгі тұрақты температураны эвтетикалық температура ТЕ деп атайды. ТЕ Е ТЕ сызығын эвтетикалы қисық немесе солидус сызығы дейді. Солидус қисығынан төмен балқыма болмайды. Е нүктесіне балқыма және А мен В кристалдарының екі қатты фазалар жүйе құрамы сәйекс келеді (ф = 3).
с = 2 – 3 + 1 = 0 (жүйе инвариантты)
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.