галогендер және оның қосылыстарына тоқталу, жетінші топтың элементтеріне жеке тоқталып,химиялық қасиеттерін, алынуын, физикалық қасиеттеріне тоқталу.NaCl – тамақ өнеркәсібінде қолданылады.
KCl – маңызды минералды тыңайтқыш
ZnCl2 – ерітіндісін теміржол шпалдарына сіңіріп, шіруден сақтау үшін, сондай – ақ дәнекерлеу кезінде қолданылады.
CaCl2 – суытқыш қоспа дайындауға қажет.галогендер және оның қосылыстарына тоқталу, жетінші топтың элементтеріне жеке тоқталып,химиялық қасиеттерін, алынуын, физикалық қасиеттеріне тоқталу.NaCl – тамақ өнеркәсібінде қолданылады.
KCl – маңызды минералды тыңайтқыш
ZnCl2 – ерітіндісін теміржол шпалдарына сіңіріп, шіруден сақтау үшін, сондай – ақ дәнекерлеу кезінде қолданылады.
CaCl2 – суытқыш қоспа дайындауға қажет.
Төлқұжаты
Атырау облысы
Атырау қаласы
Атырау мұнай және газ технологиялық колледжі
Химия пәнінің оқытушысы
Далеуова Алмагуль Асауовна
Тақырыбы : “Галогендер және оның
КИПиА11
қосылыстары”
Топқа бөліну
• Қайраткер, еңбекшіл форма, ұйымшыл, дәл,
қатаң тәртіпті, ережені ұстану, аналитикалық
ойлау қабілеті, фактіге жүгіну, жазба сөйлеуге
құштарлық, ұқыптылық, тазалық, сақтық,
үнемшілдік, тұрақтылық, талапшыл,
шешімінен қайтпау, шыдамдылық,
еңбекқорлық.
• Бұл лидерліктің символы, мақсатына
бағытталу, дегеніне жету,лидер, билікке
ұмтылыс, қайткен күнде жеңіске жету,
проблеманың өзегіне үңілу, өзіне деген
еңбекқорлық, тапқырлық
сенімділік, шешімге тез келе алу, батылдық,
өте белсенділік,тәуекелшілдік, жоғары
• Адамдар жақсы қарымқатынас орнату,
қарымқатынасты қажетсінуі өте
жоғары, ұжымды біріктіргіш, ашық,
өзгелерге қамқоршы, өзгені түсіну,
байсалдылық, сенгіштік, әділетсіздікке
қарсы тұруда батылдық танытады,
қоғамдық жұмысқа бейімділік
Өткен тақырыпқа пысықтау
сұрақтары
Квадрат тобы
• Күкірттің химиялық таңбасы
• Мына қосылыстардың ішінен күкіртті
қосылыстардың формуласын тауып, атын
ата:
СаО, Н2S, NaOH , SO2, H 2O, HNO3, MgCI2 ,Fe2 (SO 4)3
• Күкірт қышқылының физикалық
қасиеттері қандай?
•
Үшбұрыш тобы
Күкірт қышқылының формуласы
• Күкірттің электрондық формуласы
• Мына реакция теңдеуін аяқта:
а) Mg+H2S O4→ ә) Zn O+ H2S O4
→
б) Na3 PO4 + H2S O4→
Шеңбер тобы
• Күкірттің мүмкін болатын валенттігі
• Күкірттің мүмкін болатын тотығу
дәрежесі
• Мына айналымды жүзеге асыр:
H→ 2 S O4
• S
SO→
2
SO→
3
K→ 2
S O4
Бақыт жолы біліммен табылады
Ахмед Югнаки
“ “ Галогендер ”
Галогендер ”
Гипермаркеті
Гипермаркеті
Периодтық
жүйедегі орны
Табиғатта таралуы
Қолданылуы
Биологиялық
маңызы
Физикалық қасиеті
Химиялық қасиеті
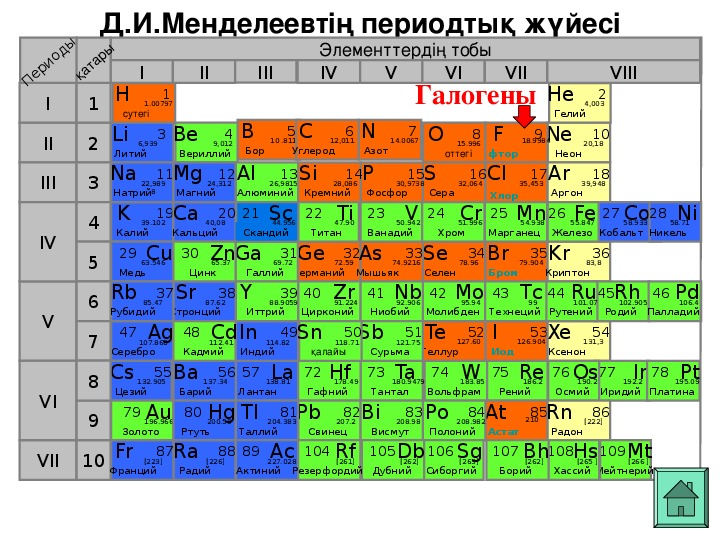
Д.И.Менделеевтің периодтық жүйесі
VIII
Элементтердің тобы
IV
VI
III
V
II
Периоды
I
II
III
IV
V
VI
VII
қатары
1
2
3
4
5
6
7
8
9
10
39.102
22,989
сутегі
Литий
Натрий
8
I
11.00797
36,939
11
H
Li
Na
K
19
Калий
Cu
29 63.546
Медь
Rb
37
85.47
Рубидий
Ag
47
Серебро
Cs
55
132.905
Цезий
Au
79 196.966
Золото
Fr
87
107.868
[223]
Франций
оттегі
Азот
Сера
Хром
Неон
Углерод
Гелий
612,011
714.0067
Co
VII
He
Галогены
24,003
C
N
O
F
Ne
815.996
1020,18
918.9984
фтор
Cl
Si
P
S
Ar
1428,086
1530,9738
1632,064
1839,948
1735,453
Кремний
Фосфор
Аргон
Хлор
27 58.933 Ni
Ti
V
24 51.996 Mn
Cr
Fe
22 47.90
23 50.942
25 54.938
26 55.847
28 58.71
Кобальт
Марганец
Ванадий
Титан
Железо
Никель
Br
Se
As
Kr
Ge
3683,8
3478.96
3374.9216
3579.904
3272.59
Бром
Селен
Криптон
Германий
Nb
Zr
Tс
Mo
Ru
41
40
42
43
45
44
95.94
99
101.07
91.224
Ниобий
Цирконий
Технеций
Молибден
Рутений
Родий
Sn
Te
I
Xe
Sb
50
51
52127.60
53126.904
54131,3
118.71
121.75
Иод
Сурьма
Теллур
Ксенон
қалайы
Hf
Ta
W
Re
Ir
Os
72
73
74
75
76
77
192.2
183.85
Гафний
Тантал
Вольфрам
Рений
Осмий
Иридий
82207.2 Bi
Pb
85210 Rn
At
Po
83208.98
84208.982
86[222]
Астат
Висмут
Радон
Полоний
Свинец
Rf
Db
Sg
Bh
Hs
106 [263]
107 [262]
108 [265 ]
104 [261]
105 [262]
Сиборгий
Борий
Хассий
Дубний
Резерфордий
Mt
109 [266 ]
Мейтнерий
46
106.4
Палладий
Pt
78
195.09
Платина
Rh
Pd
Мышьяк
180.9479
102.905
178.49
92.906
186.2
190.2
24,312
Магний
49,012
Вериллий
12
Be
Mg
Ca
2040,08
Кальций
Zn
30 65.37
Цинк
Sr
38
Cd
48
Кадмий
Ba
56
137.34
Барий
Hg
80 200.59
Ртуть
Ra
88
112.41
87.62
Стронций
[226]
69.72
Бор
Галлий
510 .811
В
Al
13
26,9815
Алюминий
Sс
21 44.956
Скандий
Ga
31
Y
Иттрий
In
49
114.82
Индий
La
57
Лантан
Tl
81204.383
Таллий
Ac
89 227.028
Актиний
39
88.9059
138.81
Радий
Периодтық жүйе
Группы элементов
IV
VI
I
II
III
V
Фтор/Fluorum (F)
VII
VIII
Жай заттың
сыртқы түрі
Ашық сары түсті
улы газ
Электрондық
құрылысы
Тотығу дәрежесі −1
тығыздығы
[He] 2s2 2p5
1,108 г/см ³
Балқу
температурасы
Қайнау
температурасы
53,53К
85,01 К
Периоды
I
II
III
IV
V
VI
VII
Ряды
1
2
3
4
5
6
7
8
9
10
Периодтық жүйе
I
II
III
Элементтің топтары
IV
VI
V
VIII
Хлор / Chlorum (Cl)
VII
Жай заттың
сыртқы түрі
Сары жасыл
түсті,өткір иісті.
[Ne] 3s2 3p5
Электрондық
құрылысы
Тотығу дәрежесі 7, 6, 5, 4, 3, 1, −1
Тығыздығы
1,56 г/см ³
Балқу
температурасы
Қайнау
температурасы
172.2 К
238.6 К
Периоды
I
II
III
IV
V
VI
VII
Ряды
1
2
3
4
5
6
7
8
9
10
V
VI
VIII
Бром / Bromum (Br)
VII
Жай заттардың
сыртқы түрі
Қою қызыл түсті
сұйықтық, өткір
иісті
[Ar] 3d10 4s2 4p5
Периодтық жүйе
Элементтердің топтары
I
II
III
IV
Электрондық
құрылысы
Тотығу дәрежесі 7, 5, 3, 1, 1
Тығыздығы
Балқу
температурасы
Қайнау
температурасы
3,12 г/см³
265,9 К
331,9 К
Периоды
I
II
III
IV
V
VI
VII
қатары
1
2
3
4
5
6
7
8
9
10
Периодтық жүйе
Элементтердің топтары
I
II
III
IV
V
Жай заттардың
сыртқы түрі
VII
VIII
VI
оо
И д / Iodum (I)
Металдық
жылтыры бар қара
күлгін түсті
кристалл
[Kr] 4d10 5s2 5p5
Электрондық
формуласы
Тотығу дәрежесі 7, 5, 3, 1, 1
Тығыздығы
4,93г/см³
Балқу
температурасы
Қайнау
температурасы
386,7 К
457,5 К
Периоды
I
II
III
IV
V
VI
VII
қатары
1
2
3
4
5
6
7
8
9
10
VIII
V
Аст т / Astatium (At)
VI
ао
VII
Жай заттардың
сыртқы түрі
Қара көк түсті
кристалды зат
Радиоактивті
элемент
[Xe] 4f14 5d10 6s2 6
p5
Периодтық жүйе
Элементтердің топтары
I
II
III
IV
Электрондық
формуласы
Тотығу дәрежесі 7, 5, 3, 1, −1
Балқу
температурасы
Қайнау
температурасы
582 К
517 К
Периоды
I
II
III
IV
V
VI
VII
қатары
1
2
3
4
5
6
7
8
9
10
Химиялық қасиеттері
Металдармен Күрделі заттармен Бейметалдармен
2Au + 3F = 2AuF 2F + 2H O =4HF +O H +F = 2HF
2Na +F = 2NaF Cl2 + 2KBr = 2KCl + Br 2 Xe + 2F = XeF
2Mg +I =2 MgI 2KI + Br = 2KBr +I 2P + 5F =
2PF
Фтор элементінің ашылуы
1886 жылы француз химигі А. Муассан
электролиз әдісімен фторсутектен фтор
газын бөліп алды.
Қолданылуы
Органикалық қосылыстар синтездеуде,
шыны өңдеуде, ағашты шіруден сақтауда
қолданылады.
Өсімдіктер мен жануарлар, адам өмірінде
де елеулі рөл атқарады. Тоңазытқыш сұйықтар
(фреондар) алуға жұмсалады.
Ауыз суда жетіспесе тістеріңіз
ауыратын болады.
Тіс пастасы құрамында кездеседі.
Анри
Муассан
(1852 – 1907)
Хлор элементінің ашылуы
1774жылы швед оқымыстысы К.
Шееле хлор газын алған.
1812 жылы ГейЛюссак газге хлор
деген ат берді.
Хлор ауадан 2,5 есе ауыр.
Қолданылуы
1 Пластмассалар, бояулар алуда
1 Пластмассалар, бояулар алуда
2. Мата мен қағаздарды ағарту.
2. Мата мен қағаздарды ағарту.
3. Ауыз суын зарарсыздандыруда
3. Ауыз суын зарарсыздандыруда
Карл
(1742 – 1786)
Вильгельм
Шееле
Бром элементінің ашылуы
1825 жылы француз химигі А.Ж.Балар
бром элементін ашты.
Қолданылуы
Өнеркәсіпте сурет, кино материалдарын жасауда,
медицинада дәрідәрмектер алуда, бензин сапасын
жақсартып, этилдеуде қолданылады.
Нерв жүйесін реттейді.
Антуан Жером
Балар
(1802 – 1876)
Йод элементінің ашылуы
1811 жылы француз химигі Бернар
Куртуа йод элементін ашты.
1813 жылы ГейЛюссак алынған
элементті йод деп атады.
Қолданылуы
Бернар Куртуа
(1777 – 1838 )
Теңіз орман жапырағы деп
аталатын ламинария балдырының
құрамында 0,10,6 %. Организмде йод
жетіспесе бақшаңкөз ауруына шалдығады,
сондықтан құрамында йоды бар асты пайдаланыңыздар.
Медицинада дәрілер даярлайды, тамақ өнеркәсібінде, фото,
кино ісінде, лабораториялық реактив ретінде де қолданылады.
Астат элементінің ашылуы
1869 жылы Д.И.Мендеелеев астат элементін,болашақта
алынатынын қарастырды.
Алғаш рет 1940 ж жасанды жолмен астат алынды
Қолданылуы
Радиоактивті элемент болғандықтан қолданылмайды.
Зертханада.
МnО2 + 4HCl = MnCl2 + Cl2
+2H↑
2 O
16HCl + 2KMnO4 = 2MnCl2 + 5Cl2
+↑ 8H2 O + 2KCl
AgNO3 + HCl = AgCl
+ HNO
NaOH + HCl = NaCl + H2 O
↓
3
Тұздарын хлоридтер деп атайды.
Қолданылуы
NaCl – тамақ өнеркәсібінде қолданылады.
KCl – маңызды минералды тыңайтқыш
ZnCl2 – ерітіндісін теміржол шпалдарына
сіңіріп, шіруден сақтау үшін, сондай – ақ
дәнекерлеу кезінде қолданылады.
CaCl2 – суытқыш қоспа дайындауға
қажет.
І кезең
Шығармашылық жұмыс
Фтор, йод, бромның
қолданылуы, пайдасы туралы
мәлімет.
Квадрат
Үшбұрыш
Шеңбер
ІІ кезең
Ойлан,тап
→
HCl
→
3
Cl→ 2
Айналуларды жүзеге асыр:
AgCl
NaCl
Төмендегі химиялық реакция теңдеулеріндегі қажетті
заттардың формуласын тауып, коэффициенттерін
қойыңдар
+ = ZnCl2 + H2 ↑
+ = MgCl2 + H2 O
+ = NaCl + H2 O
↓
+ = AgCl
Коэффициенттерін қойыңдар
HCl + KMnO4 = MnCl2 + Cl2
HCl + KClO3 = KCl + Cl2
NaCl + H2 O
+ Cl
+H↑ 2 O
↑
+H↑ 2 O + KCl
+ HNO
H→ 2
↑
+ NaOH
2
ІІІ кезең
«Сөзжұмбақтар»
Сөзжұмбақ «Химиктер»
Сөзжұмбақ «Металдар»
Сөзжұмбақ «Галогендер»
Сергіту сәті.
1.Екі буыннан тұратын химиялық элемент,
Бірінші буыны атау септігінің сұрағы,екінші
буыны сан есім, бұл қандай элемент?
2.Бірінші буыны тасқын су, екінші буыны мал
құлағындағы белгі.
3.Табылса бұрын тамтұмнан ,қазір көп әрбір
өлкеде.
Қымбат болды алтыннан ,қандай металл ертеде
4.Күмістей түсі жылтыр,өзі сұйық,
буланбас, қайнатсаң да отынды үйіп.
Көрсететін суықты,жылуды анық ,
қандай зат, құрал жасар соны құйып?
«Зерек болсаң, шешіп көр!»
V кезең
Есептер
Калий иодидінен массасы 25,4 грамм йод
алу үшін хлордың (қ.ж) қандай көлемі
жұмсалады?
VІ кезең
Тест жұмысы
«Галогендер және олардың
қосылыстары»
Бағалау. 1315 ұпай «5»
1012 ұпай «4»
79 ұпай «3»
Үйге тапсырма
«Бүгін сабақта...» эссе жазу
.
( шығармашылық жұмыс)
