
Клименко Т.А. МКОУ
СОШ пгт.Пластун
Лекция
Все методы анализа основаны на использовании
зависимости физико-химического свойства вещества, называемого аналитическим
сигналом или просто сигналом, от природы вещества и его содержания в
анализируемой пробе. В классических методах химического анализа в качестве
такого свойства используется или масса осадка (гравиметрический метод), или
объем реактива, израсходованный на реакцию (титриметрический анализ). Однако
химические методы анализа не в состоянии удовлетворять многообразные запросы
практики, особенно возросшие в результате научно-технического прогресса и
развития новых отраслей науки, техники и народного хозяйства в целом. Наряду с
черной и цветной металлургией, машиностроением, энергетикой, химической
промышленностью и другими традиционными отраслями большое значение для
промышленно-энергетического потенциала страны стали иметь освоение атомной
энергии в мирных целях, развитие ракетостроения и освоения космоса, прогресс
полупроводниковой промышленности, электроники и ЭВМ, широкое применение чистых
и сверхчистых веществ в технике. Развитие этих и других отраслей поставило
перед аналитической химией задачу снизить предел обнаружения до ![]() %. Только при содержании так
называемых «запрещенных» примесей не выше
%. Только при содержании так
называемых «запрещенных» примесей не выше ![]() жаропрочные сплавы сохраняют свои
свойства. Примерно такое же содержание примеси гафния допускается в цирконии
при использовании его в качестве конструкционного материала ядерной техники. Еще
меньшее содержание загрязнений (до
жаропрочные сплавы сохраняют свои
свойства. Примерно такое же содержание примеси гафния допускается в цирконии
при использовании его в качестве конструкционного материала ядерной техники. Еще
меньшее содержание загрязнений (до ![]() ) допускается в материалах
полупроводниковой промышленности (кремний, германии и др.). Существенно
изменяются свойства металлов, содержание примесей которых находится на уровне
) допускается в материалах
полупроводниковой промышленности (кремний, германии и др.). Существенно
изменяются свойства металлов, содержание примесей которых находится на уровне ![]() и меньше. Например,
хром и бериллий становятся ковкими и тягучими, вольфрам и цирконий становятся
пластичными, а не хрупкими. Определение столь малых содержаний гравиметрическим
и титриметрическим методом практически невозможно, и только применений
физико-химических методов анализа, обладающих гораздо более низким пределом
обнаружения, позволяет решать аналитические задачи такого рода.
и меньше. Например,
хром и бериллий становятся ковкими и тягучими, вольфрам и цирконий становятся
пластичными, а не хрупкими. Определение столь малых содержаний гравиметрическим
и титриметрическим методом практически невозможно, и только применений
физико-химических методов анализа, обладающих гораздо более низким пределом
обнаружения, позволяет решать аналитические задачи такого рода.
Другой важной особенностью физико-химических методов анализа является их экспрессность, высокий темп получения результатов. Современные автоматические квантомеры позволяют получать результаты буквально через несколько минут после поступления пробы в лабораторию. Современная информация о составе сырья, о степени химического предела и т. д. дает возможность технологу активно вмешиваться в ход технологического процесса и вводить необходимые коррективы. Весьма существенное значение имеет экспрессность анализа и в металлургическом производстве, где корректировать состав стали можно по ходу плавки в зависимости от результатов анализа. Сокращение времени плавки, нередко зависящее от быстроты анализа, дает большой экономический эффект, снижая энергетические и другие затраты.
Физико-химические методы позволяют проводить анализ на расстоянии. Яркими примерами являются анализ лунного грунта, выполненный рентгенфлуоресцентным устройством непосредственно на луноходе, определение состава атмосферы, окружающей планету Венера, и т. д. Важное практическое значение имеет дистанционный анализ в земных условиях, например, когда анализируются препараты высокой радиоактивности, токсичности, а также при анализе морских вод на больших глубинах и решении других аналогичных аналитических задач.
Многие приборы, используемые в физико-химических методах анализа, позволяют автоматизировать сам процесс анализа или некоторые его стадии. Автоматические газоанализаторы контролируют состав воздуха в шахтах. В металлургической промышленности широко применяют автоматизированные оптические и рентгеновские квантомеры. В значительной степени автоматизирован газовый хроматографический анализ в нефтехимической, коксохимической и других отраслях промышленности. Нередко приборы физико-химических методов анализа используют непосредственно в производстве в качестве датчиков соответствующих сигналов, например при регулировании рН растворов или корректировке концентрации компонентов.
Анализ с помощью некоторых физико-химических методов может быть выполнен без разрушения анализируемого образца (недеструктивный), что имеет большое значение для некоторых отраслей промышленности, а также для криминалистики, медицины и т.д. Недеструктивный анализ может быть выполнен рентгенфлуоресцентным, радиоактивационным и некоторыми другими методами. Часто практический интерес представляет не общее содержание какого-либо элемента в пробе, а его распределение по поверхности – так называемый локальный анализ – определение элемента в данной точке образца. Этот анализ имеет значение в металловедении и других областях, где состав отдельных включений определяет качество материала, а также в минералогии, криминалистике, археологии и т.д. Выполняется локальный анализ рентгеноспектральным методом. Электроны собирают в очень тонкий пучок диаметром 1мкм и меньше (электронный зонд) и направляют его в интересующую точку образца. По характеристикам возникающего рентгеновского излучения судят о содержании элементов в «точке». Для целей локального анализа используется также техника лазерной микроспектроскопии. Перспективным является использование ЭВМ в аналитической химии не только для расчета результатов анализа и статистической обработки, но и для решения других аналитических задач. С помощью ЭВМ можно более надежно выделять аналитический сигнал, проводить более четкое разрешение перекрывающихся сигналов. ЭВМ, встроенные в спектрофотометр и другие аналитические приборы, значительно расширяют возможности этих приборов.
Погрешность анализа физико-химическими методами
составляет в среднем 2…5%,что превышает погрешность классических методов
анализа. Однако такое сравнение погрешностей не вполне корректно, так как
относится к разным концентрационным областям. При небольшом содержании
определяемого компонента (порядка ![]() и менее) классические химические методы
анализа вообще непригодны, при больших концентрациях физико-химические методы
успешно соперничают с химическими, а такие методы анализа, как кулонометрия,
даже превышают их по точности.
и менее) классические химические методы
анализа вообще непригодны, при больших концентрациях физико-химические методы
успешно соперничают с химическими, а такие методы анализа, как кулонометрия,
даже превышают их по точности.
Однако химические методы анализы своего значения не потеряли. Они незаменимы там, где при высоком содержании требуется высокая точность и нет серьезных ограничений по времени (например, анализ готовой продукции, арбитражный анализ, изготовление эталонов).
Основными характеристиками инструментальных методов анализа являются чувствительность, предел обнаружения, воспроизводимость и правильность.
Чувствительность – это параметр, характеризующий изменение измеряемого сигнала y при изменении концентрации с. Для количественной оценки чувствительности S:
![]() или
или
![]()
Таким образом, S – это первая
производная функции ![]() . На практике удобно использовать линейную
зависимость y от c:
. На практике удобно использовать линейную
зависимость y от c:
y = ac + b,
где, а –
коэффициент чувствительности, b – значение параметра y в отсутствии
определяемого компонента (с=0), т.е. значение у холостой пробы. Очевидно, что а
– тангенс угла наклона прямой ![]() , отсекающей отрезок b – по оси y (рис.1). Эту
прямую называют градуировочным графиком.
, отсекающей отрезок b – по оси y (рис.1). Эту
прямую называют градуировочным графиком.
Коэффициенты а и b можно вычислить методом регрессионного анализа. Если проведено n измерений параметра y при различных значениях с, то по методу наименьших квадратов
![]() ,
,
![]() .
.
Если зависимость между у и с нелинейна, то стараются превратить ее в линейную. Например, функцию типа y = kcn можно привести к линейному виду логарифмированием:
![]()
Воспроизводимость – параметр,
отражающий случайные ошибки изменения и показывающий степень разброса повторных
(паралелльных) измерений. Критериями воспроизводимости служат отклонение d от среднего
результата серии измерений ![]() и размах выборки w (т.е. разность
между максимальным и минимальным значениями). Если разброс значений у можно
описать нормальным (гауссовым) распределением, то для оценки воспроизводимости
обычно рассчитывают дисперсию V, стандартное отклонение s или относительное
стандартное отклонение sr:
и размах выборки w (т.е. разность
между максимальным и минимальным значениями). Если разброс значений у можно
описать нормальным (гауссовым) распределением, то для оценки воспроизводимости
обычно рассчитывают дисперсию V, стандартное отклонение s или относительное
стандартное отклонение sr:
![]() ,
,![]() ,
, ![]() .
.
Существуют специальные приемы для установления типа распределения. Результаты измерения аналитического сигнала, как правило, подчиняются закону нормального распределения. Для расчета критериев воспроизводимости существуют стандартные программы.
Предел обнаружения смин, Р – наименьшая концентрация, которую можно обнаружить с доверительной вероятностью Р:
![]() ,
,
где
![]() –
предельное значение аналитического сигнала, которое еще можно измерить на
данной пробе;
–
предельное значение аналитического сигнала, которое еще можно измерить на
данной пробе; ![]() –
среднее значение этого параметра в холостом опыте; S – коэффициент
чувствительности.
–
среднее значение этого параметра в холостом опыте; S – коэффициент
чувствительности.
Для
оценки ![]() используют
статистические критерии – k (коэффициент, характеризующий доверительную
вероятность) и sхол (стандартное
отклонение холостого опыта):
используют
статистические критерии – k (коэффициент, характеризующий доверительную
вероятность) и sхол (стандартное
отклонение холостого опыта):
![]() .
.
Коэффициент k принимают равным 2, 3 и выше (обычно 3). Чем больше значение k, тем выше предел надежного обнаружения сигнала.
Итак, для оценки предела обнаружения нужно найти стандартное отклонение холостого опыта (желательно провести не менее 12 измерений) и коэффициент чувствительности измерения:
![]() .
.
При большом числе измерений (n>20) s → σ, поэтому говорят о двух-, трех- или шестисигмовом критерии оценки предела обнаружения.
Разницу в пределах обнаружения меньше чем в 2 раза не следует считать значимой. Следует иметь в виду, что реально определяемые концентрации элементов на один-два порядка выше предела обнаружения. Поэтому важной характеристикой метода является диапазон определяемых концентраций, т.е. интервал содержаний компонента, в котором возможно определение данным методом. Наименьшее значение, ограничивающее этот диапазон, называют нижним пределом определяемых содержаний (концентраций), сн, наибольшее значение – верхним пределом, св.
Правильность – параметр, характеризующий близость полученного и истинного значений измеряемой величины правильность характеризуется систематической погрешностью, которая связана с работой прибора (например, если шкала смещена на какую-то величину, то во все измерения будет входить одна и та же погрешность), с индивидуальными особенностями аналитика, с ошибками расчета (например, неправомочным округлением чисел) и главным образом с методическими погрешностями. Источником методических погрешностей может быть неоднородность анализируемого материала, неадекватное применение метода анализа (например, применение методики определения фосфора в листьях растений для определения фосфора в природной воде с большим содержанием кремния), влияние примесей или основы анализируемого объекта, а также примесей в реагентах и растворителях. Опасность систематической погрешности особенно велика при анализе сложных объектов, таких, как почва, руды, минералы.
Существуют определенные приемы выявления систематической погрешности, из них наиболее известны:
1. использование стандартных образцов – специально подготовленных материалов, состав и свойства которых достаточно установлены и официально удостоверены;
2. варьирование массы навески;
3. метод добавок (метод «введено-найдено»);
4. сравнение результатов анализа независимыми методами.
Если известно истинное значение μ, то
правильность – это разность между ним и полученным результатом (![]() ).
Обычно μ неизвестно, в лучшем случае знают действительное значение,
максимально приближающиеся к истинному.
).
Обычно μ неизвестно, в лучшем случае знают действительное значение,
максимально приближающиеся к истинному.
Если выявлены и устранены или учтены систематические погрешности, то результат определения представляют в виде среднего значения с указанием доверительного интервала, в который попадает результат с заданной вероятностью Р:
![]() ,
,
где
![]() –
среднее значение; s – стандартное отклонение; n – число
определений; tP – коэффициент Стьюдента.
–
среднее значение; s – стандартное отклонение; n – число
определений; tP – коэффициент Стьюдента.
Для более правильного расчета концентрации определяемого компонента используют холостую пробу, для учета посторонних мешающих сигналов.
Физико-химические методы анализа – это большая группа аналитических методов, в которых используются физические приборы.
Эти методы называются еще инструментальными. В настоящее время инструментальные методы бурно развиваются, являются востребованными при выполнении аналитических исследований.
Общее число физико-химических методов анализа очень велико – оно составляет несколько десятков. Наибольшее практическое значение среди них имеют следующие (рис. 1)
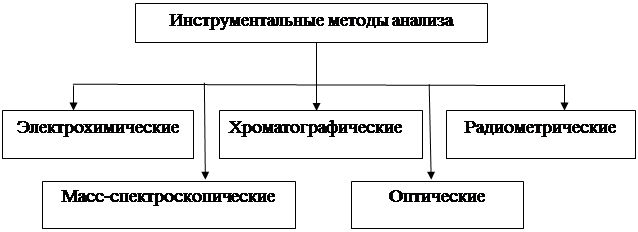
Рис.1. Классификация физико-химических методов
Методы анализа, основанные на взаимодействии электромагнитного излучения атомов и молекул вещества, носят название оптические методы анализа. Классификация оптических методов представлена на рис. 2.
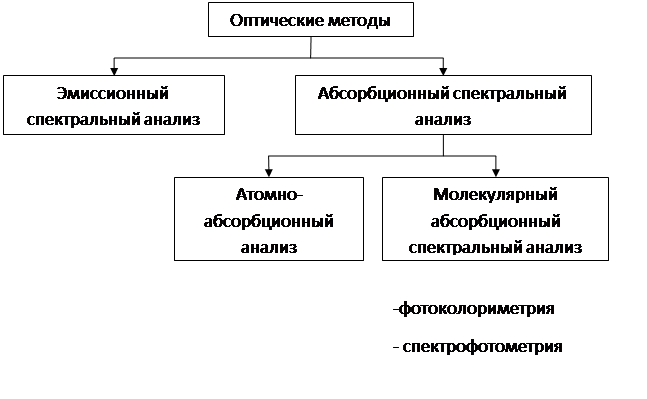
Рис. 2. Оптические методы анализа
Оптические методы включают в себя абсорбционные методы, использующие спектры поглощения молекул (ионов) и атомов в видимой, УФ - и ИК-областях, и эмиссионные методы, использующие спектры излучения (эмиссии) атомов и ионов в видимой и УФ-областях.
Оптические абсорбционные методы — это методы анализа, основанные на поглощении электромагнитного излучения анализируемыми веществами. Именно оптические абсорбционные методы получили широкое распространение в научно-исследовательских и сертификационных лабораториях. При поглощении света атомы и молекулы поглощающих веществ переходят в новое возбужденное состояние. В зависимости от вида поглощающих веществ и способа трансформирования поглощенной энергии различают атомно-абсорбционный, молекулярно-абсорбционный анализ, нефелометрию и люминесцентный анализ.
Атомно-абсорбционный анализ основан на поглощении световой энергии атомами анализируемых веществ. Обязательным условием является атомизация, а затем возбуждение.
Молекулярный абсорбционный анализ основан на поглощении света молекулами анализируемого вещества и сложными ионами в ультрафиолетовой, видимой и инфракрасной областях спектра (спектрофотометрия, фотоколориметрия, ИК-спектроскопия). Основной вклад в изменение энергии молекулы вносит электронный переход, но у молекулы чисто электронный переход не осуществим – он сопровождается изменением колебательной и вращательной энергий. Поэтому молекулярный спектр поглощения состоит из множества спектральных линий. Линии с близкой энергией сливаются в одну полоску поглощения. Возвращаясь в исходное состояние, молекула чаще теряет поглощенную энергию в виде теплоты, реже – в виде излучения. Поскольку возбуждаемых молекул по сравнению с общим числом мало, выделившаяся теплота не влияет на состояние излучаемой системы.
Фотоколориметрия и спектрофотометрия основаны на взаимодействии излучения с однородными
системами, их обычно объединяют в одну группу фотометрических методов анализа.
Метод абсорбционной спектроскопии имеет высокую чувствительность (низкий предел
обнаружения), они избирательны и точны. Методы могут быть применены для анализа
больших и малых содержаний, но особенно ценной их особенностью является
возможность определения примесей (до ![]() ). Важное
значение имеет избирательность многих фотометрических методов, позволяющая
проводить определения элементов в сложных пробах без химического разделения
компонентов. Погрешность фотометрических методов обычно составляет 3…5 %,
уменьшаясь в благоприятных случаях до 1…2 % и нередко до 0,5…1.0 %. Методы
абсорбционной спектроскопии используются химической, металлургической,
металлообрабатывающей и других отраслях промышленности, горном деле, сельском
хозяйстве, медицине. Простые, быстрые и точные фотометрические методы анализа
применяются для контроля производства, определения примесей и решения многих
других важных вопросов в заводских и научно-исследовательских лабораториях.
Большое значение имеют эти методы для исследования различных реакций,
установления состава и устойчивости образующихся соединений. Успехи химии
координационных соединений и достижения приборостроения дают все основания
ожидать дальнейшего повышения точности и чувствительности этих методов.
). Важное
значение имеет избирательность многих фотометрических методов, позволяющая
проводить определения элементов в сложных пробах без химического разделения
компонентов. Погрешность фотометрических методов обычно составляет 3…5 %,
уменьшаясь в благоприятных случаях до 1…2 % и нередко до 0,5…1.0 %. Методы
абсорбционной спектроскопии используются химической, металлургической,
металлообрабатывающей и других отраслях промышленности, горном деле, сельском
хозяйстве, медицине. Простые, быстрые и точные фотометрические методы анализа
применяются для контроля производства, определения примесей и решения многих
других важных вопросов в заводских и научно-исследовательских лабораториях.
Большое значение имеют эти методы для исследования различных реакций,
установления состава и устойчивости образующихся соединений. Успехи химии
координационных соединений и достижения приборостроения дают все основания
ожидать дальнейшего повышения точности и чувствительности этих методов.
Эмиссионная спектроскопия. Эмиссия – это излучение, т.е. методы основаны на излучении
электромагнитной энергии, в результате возникает атомный спектр, это метод
качественного анализа и полуколичественного, т.к. количественная оценка
определяется интенсивностью спектральных линий. При общей оценке методов
эмиссионной спектроскопии необходимо, прежде всего, отметить их низкий предел
обнаружения, точность, быстроту выполнения анализов и универсальность. Средний
предел обнаружения методами эмиссионной спектроскопии составляет ![]() , а при использовании приемов
обогащения он снижается до
, а при использовании приемов
обогащения он снижается до ![]() Погрешность
определения характеризуется в среднем величиной 1 …2 %. В связи с
экспрессностью, точностью и другими достоинствами эмиссионный спектральный
анализ широко используется в практике. Значительная часть определений в
металлургической и машиностроительной промышленности выполняется с помощью
спектрального анализа. Многочисленные применения нашел спектральный анализ и в
других отраслях народного хозяйства и техники (геологии, химической
промышленности, сельском хозяйстве).
Погрешность
определения характеризуется в среднем величиной 1 …2 %. В связи с
экспрессностью, точностью и другими достоинствами эмиссионный спектральный
анализ широко используется в практике. Значительная часть определений в
металлургической и машиностроительной промышленности выполняется с помощью
спектрального анализа. Многочисленные применения нашел спектральный анализ и в
других отраслях народного хозяйства и техники (геологии, химической
промышленности, сельском хозяйстве).
Закон Бугера – Ламберта – Бера (основной закон светопоглощения)
Атом, ион или молекула, поглощающая квант света, переходит в более высокое энергетическое состояние. Обычно это бывает переход с основного, невозбужденного уровня на один из более высоких, чаще всего на первый возбужденный уровень. Вследствие поглощения излучения при прохождении его через слой вещества интенсивность излучения уменьшается и тем больше, чем выше концентрация светопоглощающего вещества.
Закон Бугера – Ламберта – Бера связывает уменьшение интенсивности света, прошедшего через слой светопоглощающего вещества, с концентрацией вещества и толщиной слоя. Чтобы учесть потери света на отражение и рассеяние, сравнивают интенсивность света, прошедшего через исследуемый раствор и растворитель. При одинаковой толщине слоя в кюветах из одинакового материала, содержащих один и тот же растворитель, потери на отражение и рассеяние света будут примерно одинаковы у обоих пучков, и уменьшение интенсивности света будет зависеть от концентрации вещества.
Уменьшение интенсивности света, прошедшего через раствор характеризуется коэффициентом пропускания (пропусканием) Т:
![]()
где
![]() и
и ![]() -
соответственно интенсивность света, прошедшего через раствор и растворитель.
-
соответственно интенсивность света, прошедшего через раствор и растворитель.
Взятый с обратным знаком логарифм Т называется оптической плотностью А:
![]()
Уменьшение интенсивности света при прохождении его через раствор подчиняется закону Бугера – Ламберта – Бера:
![]()
или
![]()
или
![]()
где
ε – молярный коэффициент поглощения, ![]() - толщина светопоглощающего слоя, с – концентрация
раствора.
- толщина светопоглощающего слоя, с – концентрация
раствора.
Физический
смысл ε; если принято ![]() и с
= 1 моль/л, тогда А = ε. Следовательно, молярный коэффициент поглощения
равен оптической плотности одномолярного раствора при толщине слоя 1
см.
и с
= 1 моль/л, тогда А = ε. Следовательно, молярный коэффициент поглощения
равен оптической плотности одномолярного раствора при толщине слоя 1
см.
Отклонение от закона Бугера – Ламберта – Бера
Поведение поглощающих свет систем подчиняются закону Бугера – Ламберта – Бера лишь при монохроматичности светового потока, отсутствии химических измерений в поглощающей свет систем подчиняются закону системе и постоянстве коэффициента преломления. При нарушении этих условий молярный коэффициент поглощения изменяет и график зависимости А и С искревляется. Если ε уменьшается, наблюдаются отрицательные отклонения от закона, если увеличивается – положительные.
Причины отклонения от основного закона светопоглощения может быть обусловлены немонохроматичностью светового потока, рассеянием света, случайным излучениями. Может быть вызваны химическими взаимодействиями. Истинные причины связаны с изменением коэффициента преломления.
Немонохроматичность светового потока обусловлена несовершенством оптических приборов: каждый прибор имеет определенную разрешающую силу, и выходная щель пропускает излучение в каком-то интервале дли волн.
Химические взаимодействия поглощающего вещества в растворе также являются причиной отклонения от закона Бугера — Ламберта — Бера. Исследуемое вещество может взаимодействовать (протонирование или депротонирование, ассоциация или диссоциация и др.) с растворителем или другими компонентами раствора. В результате появляются поглощающие частицы с другими оптическими свойствами. Отсюда возможны положительные и отрицательные отклонения от основного закона поглощения.
Истинные ограничения закона светопоглощения связаны с изменением коэффициента преломления среды n, а, следовательно, с изменением скорости света и длины волны. При малых концентрациях изменением n пренебрегают. При необходимости вводят поправку, умножая значение А или ε на отношение n/(n2 + 2)2.
Следует заметить, что зависимость оптической плотности от толщины поглощающего слоя всегда прямолинейна.
Все отклонения от основного закона светопоглощения приводят к тому, что молярный коэффициент поглощения, рассчитанный по экспериментально найденным значениям оптической плотности, отличается от истинного молярного коэффициента, не зависящего от условий измерения А. Молярный коэффициент поглощения, рассчитанный в конкретных условиях, называют наблюдаемым (средним).
Закон аддитивности
Оптическая плотность – экстенсивное свойство вещества. Поэтому оптическая плотность смеси веществ равна сумме оптических плотностей каждого из них. Это справедливо при условии подчинения каждого вещества закону Бугера – Ламберта – Бера и в отсутствии химических взаимодействий между ними. Итак, для смеси m веществ при одной и той же длине волны имеем
![]()
где ε – молярный коэффициент поглощения; c – концентрация раствора; l = толщина поглощающего слоя, см.
Принцип аддитивности (суммирования) оптических плотностей широко используется в аналитической химии.
Все аналитические методы основаны на получении и измерении аналитического сигнала, т.е. любого проявления химических и физических свойств вещества, которое можно использовать для установления качественного состава анализируемого объекта или для количественной оценки содержащихся в нем компонентов. Для перехода от аналитического сигнала к определению концентрации или состава анализируемого образца используется подходы: калибровочного графика, метода стандартных серий, метод добавок. Все подходы используют стандартные образцы (эталоны).
Метод градуировочного графика. Готовят серию из 4-6 растворов определяемого вещества с известной концентрацией, измеряют их оптическую плотность при одних и тех же длине волны и длине кюветы, строят график зависимости оптической плотности А от концентрации с. Если получается прямая линия (т. е. растворы подчиняются закону Бугера — Ламберта — Бера), можно описать ее уравнением
у = ах + b,
где х—концентрация раствора с; у— его оптическая плотность А; а—угловой коэффициент, равный коэффициенту поглощения (если использована молярная концентрация, то a = ε); b — отрезок на оси оптической плотности, отсекаемый прямой, т. е. значение оптической плотности холостого раствора Ахол. Следовательно, уравнение градуировочного графика при фотометрических измерениях имеет вид
А = εс + Ахол
Значение ε рассчитывают для каждого стандартного раствора серии и берут среднее. Зная ε, рассчитывают концентрацию исследуемого раствора по его оптической плотности:
![]()
Более точно значения ε и Ахол находят методом наименьших квадратов, который дает возможность оценить погрешности измерений (стандартные отклонения) этих величин и, следовательно, погрешность определения неизвестной концентрации. Тогда уравнение прямой будет иметь вид
![]()
Метод добавок. Метод заключается в том, что сначала измеряют оптическую плотность Ах раствора с неизвестной концентрацией (сх), а затем в тех же условиях оптическую плотность Ах того же раствора с добавкой некоторого известного количества определяемого вещества с1. Таким образом, во втором растворе концентрация определяемого вещества равна cx+c1, а оптическая плотность этого раствора Ах складывается из Ах и оптической плотности добавки, равной εс1l:
A1 = Ax + εc1l
После математических преобразований полученного выражения имеем
![]()
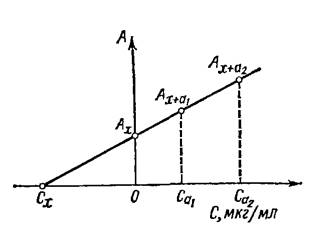
Рис. 3. Определение концентрации методом добавок
Метод добавок можно использовать в графическом варианте (рис. 3.). В этом случае по оси концентраций откладывают добавленное количество стандартного раствора. Значения A1, и Ах, при которых добавка равна 0, откладывают по оси ординат. Соединяют обе точки и продолжают до пересечения с осью концентраций. Отсекаемый отрезок является определяемой концентрацией сх. Через две точки прямую обычно не проводят во избежание большой ошибки. Поэтому готовят еще один раствор, содержащий добавку с2, измеряют его оптическую плотность А2 и проводят прямую через три точки.
Важно правильно выбрать количество добавки. Погрешность будет наименьшей, если первая добавка близка к определяемому количеству, а вторая — в 2 раза больше первой. Такие добавки должны обеспечить угол наклона прямой, близкий к 45°.
Метод добавок особенно употребим при определении веществ в присутствии примесей, которые могут повлиять на поглощение исследуемого компонента. Именно такие случаи часто встречаются при анализе реальных объектов, в частности почв. При измерении методом добавок все растворы содержат одинаковое количество примесей.
Условие применимости метода — подчинение растворов закону Бугера — Ламберта — Бера.
Метод сравнения.. Готовится раствор исследуемого компонента, измеряется его оптическая
плотность Ax = εlcx. Затем готовится стандартный раствор определяемого
иона с концентрацией ccт и
измеряется его оптическая плотность Aст. концентрация стандартного раствора сст
подбирается таким образом, чтобы Аст было близко
по значению к Ах. При работе с двумя стандартными
растворами концентрации стандартных растворов подбираются по условию: сcm1 ‹ cx ‹ ccm2 .
Измеряются оптические плотности, которые также должны быть в соотношении Аст’<Ax<Aст’’. Тогда ![]() при
работе с одним стандартным раствором. При двух точках сравнения
при
работе с одним стандартным раствором. При двух точках сравнения ![]() .
.
Блок схема спектрофотометра
Все оптические приборы ряда спектрофотометров имеют следующую блок схему
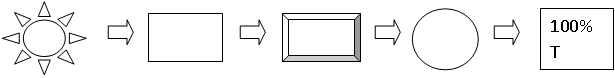
1 – Источник света 2 – Монохроматор 3 – Кюветное отделение 4 – Детектор 5 - Дисплей
Прежде чем приступить к выполнению практических работ, необходимо ознакомиться со следующими рекомендациями:
1. Внимательно прочитать все, что касается предложенной задачи по данному описанию;
2. Строго следовать методике приготовления растворов (исходный объем, порядок приготовления реагентов, их количество, кислотность раствора);
3. Конечный объем всех эталонных растворов, контрольных растворов должны быть строго одинаковы, так как только в этом случае можно проводить сравнения растворов (готовят растворы в мерных колбах);
4. Объем стандартного раствора следует отмерять с максимальной точностью (пипеткой или бюреткой);
5. Кюветы должны быть тщательно очищены, их моют концентрированной HCl, тщательно промывают водой, ополаскивают дистиллированной водой и насухо вытирают снаружи. Изнутри сушат кюветы только при работе с органическими растворителями, несмешивающимися с водой. Перед работой кюветы ополаскивают небольшой порцией испытуемого раствора во избежании его разбавления;
6. Кювету заполняют до такого уровня, чтобы поток излучения проходил целиком через слой раствора;
7. Ознакомиться с описанием и порядком измерений на приборе (см. соответствующие инструкции);
8. Перед работой включить прибор для прогрева на время, указанное в инструкции по эксплуатации;
9. Кюветы устанавливают в кюветное отделение всегда строго в определенном положении;
10. Отсчет по шкале прибора сделать несколько раз, повторив весь порядок измерений;
11. По окончании работы необходимо выключить прибор, вымыть кюветы, рабочее место привести в порядок;
12. При записях в рабочих журналах рекомендуется следующий порядок:
a. Название выполняемой работы;
b. Сущность и уравнение фотометрической реакции, используемой в данной работе;
c. Краткая методика работы;
d. Запись результатов измерений вести по форме, прилагаемой к работе;
13. Оптимизация условий фотометрических определений предполагает: выбор длины волны (спектрального диапазона), выбор толщины кюветы, нахождение области линейности определяемых концентраций.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.