
Химические свойства неорганических соединений.
Взаимодействие неметаллов с растворами щелочей
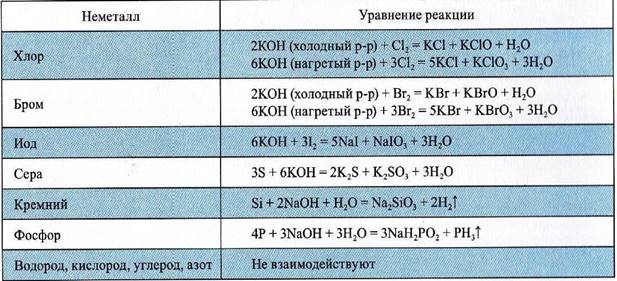
Реакции металлов и неметаллов
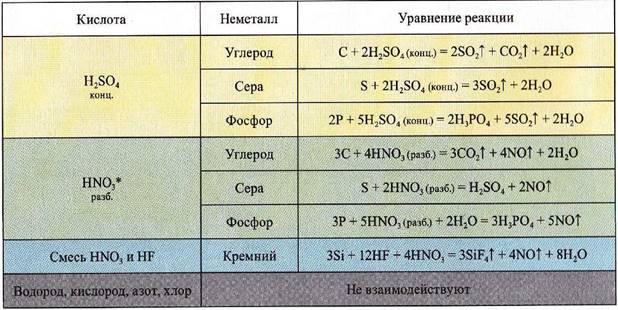
Взаимодействие неметаллов с кислотами-окислителями
•Металл+неметалл→ оксид, соль, бинарное соединение или не реагируют 4Al+3O2→ 2Al2O3
2Na+Cl2→ 2NaCl
3Mg+N2→ Mg3N2
Fe+N2→
![]()
Неметалл+неметалл t° оксид, кислота, бинарное соединение или не реагируют
![]()
S+O2 t° SO2
![]()
H2+Cl2→ 2HCl
N2+H2 t° 2NH3
![]()
N2+С→
![]()
•Металл+кислота→ соль+H2↑
Условие: металл должен стоять в электрохимическом ряду левее H2.
Fe+2HCl→ FeCl2+H2↑
Cu+HCl→
![]()
•Галогены вытесняют менее активные галогены, а также серу из растворов солей
Br2+K2S→ 2KBr+S
Реакции основных, кислотных и амфотерных оксидов.
•Основный оксид+H2O→ основание
Условие: реакция проходит, если основание растворимо.
CaO+H2O→ Ca(OH)2
FeO+H2O→
![]()
•Кислотный оксид+H2O→ кислота
Условие: реакция проходит, если кислота растворима.
SO3+H2O→ H2SO4
SiO2+H2O→
•Основный оксид+кислотный оксид→ соль
3Na2O+P2O5→ 2Na3PO4
•Основный оксид+кислота→ соль+H2O
Na2O+2HNO3→ 2NaNO3+H2O
•Кислотный оксид+основание→ соль+H2O CO2+Ca(OH)2→ CaCO3↓+H2O
•Кислотный оксид+соль→ соль+летучий кислотный оксид SiO2+CaCO3→ CaSiO3+CO2↑
•Амфотерный оксид+соль→ соль+летучий кислотный оксид Al2O3+Na2CO3→ 2NaAlO2+CO2↑
•Амфотерный оксид+основный оксид→ соль
Al2O3+Na2O→ 2NaAlO2
•Амфотерный оксид+кислотный оксид→ соль
t°
Al2O3+3SiO2→ Al2(SiO3)3
•Амфотерный оксид+кислота→ соль+H2O ZnO+2HNO3→ Zn(NO3)2+H2O
•Амфотерный оксид+основание+ H2O→ комплексная соль ZnO+2NaOH+H2O→ Na2[Zn(OH)4]
t°
•Амфотерный оксид+основание→ соль+ H2O
t°
ZnO+2NaOH→ Na2ZnO2+H2O
Оксиды вступают в окислительно-восстановительные реакции:
•Невысшие оксиды могут реагировать с кислородом
t°
CO+O2→ CO2
•Оксиды могут разлагаться при нагревании
t°
2HgO→2Hg+O2
•Оксиды могут восстанавливаться до простых веществ
t°
CuO+H2→t° Cu+H2O
Cr2O3+Al→ Al2O3+Cr
NO2+2H2→ N2+2H2O
•Другие окислительно-восстановительные реакции MnO2+4HCl→MnCl2+Cl2+2H2O
SO2+2H2S →3S+H2O
Реакции оснований
•Основание+кислотный (амфотерный) оксид→ соль+H2O 6NaOH+P2O5→ 2Na3PO4+3H2O
•Основание+кислота→ соль+H2O
2NaOH+H2SO4→ Na2SO4+2H2O
NaOH+H2SO4→ NaHSO4+H2O
Mg(OH)2+HCl→Mg(OH)Cl+2H2O
•Основание+кислая соль→ соль+H2O NaOH+NaHCO3→ Na2CO3+H2O
•Основание+амфотерный оксид+ H2O→ комплексная соль
2NaOH+ZnO+H2O→ Na2[Zn(OH)4]
•Основание+амфотерный оксид → соль+ H2O
2NaOH+ZnO→ Na2ZnO2+H2O
•Основание+амфотерный гидроксид→ комплексная соль
2NaOH+Zn(OH)2→ Na2[Zn(OH)4]
•Основание+амфотерный гидроксид → соль+ H2O
2NaOH+Zn(OH)2 → Na2ZnO2+H2O
•Основание+соль → соль+ основание 2NaOH+CuSO4→ Na2SO4+Cu(OH)2
•Нерастворимое основание → основный оксид+H2O
Реакции амфотерных гидроксидов
•Амфотерный гидроксид+кислотный оксид→ соль+H2O 2Al(OH)3+3SO3→ Al2(SO4)3+3H2O
•Амфотерный гидроксид+основный оксид→ соль+H2O 2Al(OH)3+Na2O→ 2NaAlO2+3H2O
•Амфотерный гидроксид+кислота→ соль+H2O
Zn(OH)2+H2SO4→ ZnSO4+2H2O
•Амфотерный гидроксид+основание→ комплексная соль 2NaOH+Zn(OH)2→ Na2[Zn(OH)4]
t°
•Амфотерный гидроксид+основание → соль+ H2O
t°
2NaOH+Zn(OH)2 → Na2ZnO2+H2O
t°
•Амфотерный гидроксид→ амфотерный оксид+H2O
Zn(OH)2→t° ZnO+H2O
Реакции кислот
•Кислота+основание (амфотерный гидроксид)→ соль+H2O
H2SO4+2NaOH→ Na2SO4+2H2O
H2SO4+NaOH→ NaHSO4+H2O
HCl+Mg(OH)2→Mg(OH)Cl+2H2O
•2HCl+Zn(OH)2→ZnCl2+2H2O
•Кислота+основная соль→ соль+H2O
HCl+Mg(OH)Cl→MgCl2+H2O
•Кислота+основный (амфотерный) оксид→ соль+H2O
2HCl+Na2O→ 2NaCl+H2O
•2HCl+ZnO→ ZnCl2+H2O
•Кислота+металл→ соль+H2↑ (Исключение реакции с H2SO4(конц) и с HNO3)
Условие: металл должен стоять в электрохимическом ряду левее H2. Fe+2HCl→ FeCl2+H2↑
•Кислота+соль → соль+ кислота
H2SO4+CaCO3→ CaSO4+H2O+CO2
Взаимодействие неметаллов с кислотами-окислителями
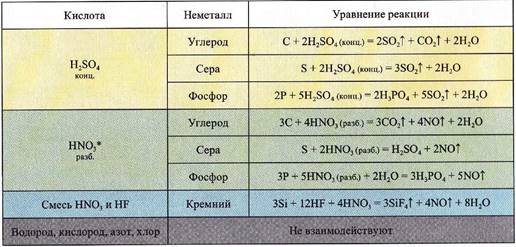
* HNO3(конц) всегда восстанавливается до NO2
Реакции солей
Реакции ионного обмена
Условия:
1. Реагенты должны быть растворимы (исключение: осадки можно растворять в сильных кислотах).
2. В продуктах реакции должны быть нерастворимое вещество (осадок), газ или
H2O.
•Соль+кислота→ соль+кислота
BaCl2+H2SO4→ BaSO4↓+2HCl
•Соль+основание→ соль+основание
CuCl2+NaOH→ Cu(OH)2↓+2NaCl
•Соль+соль→ соль+соль
BaCl2+Na2SO4→ BaSO4↓+2NaCl
•Галогены вытесняют менее активные галогены, а также серу из растворов солей
Br2+K2S→ 2KBr+S
•Металл+соль→ металл↓+соль
Условие: каждый металл, начиная с Mg, может вытеснить менее активный металл
из его растворимой соли.
Fe+CuSO4→FeSO4+Cu↓
Ag+CuSO4→
•Основная соль+кислота→ соль+H2O
Mg(OH)Cl+HCl→MgCl2+H2O
•Кислая соль+основание→ соль+H2O
NaHCO3+NaOH→ Na2CO3+H2O
•Соли вступают в различные окислительно-восстановительные реакции
5KClO3+6P →3P2O5+5KCl
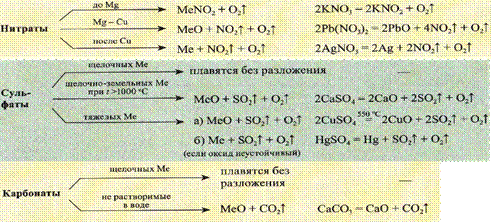
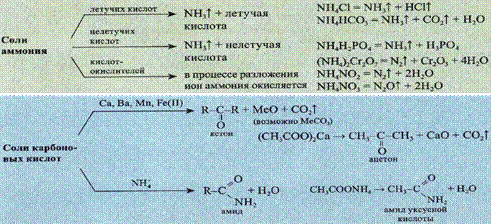
Термические превращения солей
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.