
Интегрированный урок по математике и химии в 11 классе.
Тема урока: «Задачи на смеси и сплавы».
Цели урока:
1. Подготовка к ЕГЭ по математике (задача В13) и химии (задача В9) .
2. Обобщение и закрепление знаний учащихся по теме «Задачи на смеси и сплавы».
3. Формирование умений переноса знаний с одного предмета на другой.
4. Развивать познавательный интерес, реализуя межпредметные связи курсов химии и
математики.
Задачи урока :
1. Рассмотреть в сравнении химический и математический способ решения задач с
использованием понятия концентрация.
2. Применить способы решения задач на практических опытах.
3. Вывести новый метод решения задач на смеси и сплавы , рассматривать его
применение на уроках математики и химии.
Оборудование: экран, проектор, презентация, раздаточный материал, аптечные весы ,
дистиллированная вода, кристаллизатор, фенолфталеин, металлический натрий,
этиловый спирт, кристаллический йод, хлорид натрия, физиологический раствор.
Ход урока.
Учитель математики: Сегодня у нас необычный урок, это интегрированный урок математики и химии и вести его будут два учителя. На этом уроке мы посмотрим с вами на задачи с двух точек зрения – с химической и математической, и выясним: как математика помогает в решении химических задач и как химия решает некоторые математические задачи.
Тема урока «Задачи на смеси и сплавы». (Слайд № )
Задачи урока
(Слайд № )
В задачах на смеси и сплавы ключевым понятием является
понятие концентрации. Как найти концентрацию
вещества в растворе или сплаве? ( Отношение массы (или объема) чистого
вещества к общей массе (или объему). Концентрация может быть выражена дробью k = ![]() или в процентах, тогда эта дробь умножается на 100%. (Слайд
№ ). Во многих текстовых
задачах понятие «концентрация» может быть заменено на:
или в процентах, тогда эта дробь умножается на 100%. (Слайд
№ ). Во многих текстовых
задачах понятие «концентрация» может быть заменено на:
«жирность» (масло, творог, молоко), «крепость» (уксус), «проба» (золото). ( Слайд № ). Как понимать, что жирность молока равна 3,2%, крепость уксуса 9%, проба золота 583 ?
Используя формулу для вычисления концентрации, решим устно задачи:
v К 1 части сахара добавили 4 части воды. Какова процентная концентрация полученного раствора? ( 20%)
v 1 кг соли растворили в 9 литрах воды. Какова процентная концентрация полученного раствора? (10%)
v Смешали 3 литра 14% раствора соли с 3 литрами воды. Какова процентная концентрация полученного раствора? (7%)
v Сколько граммов сахара содержится в 2 кг 10% сахарного сиропа? (200 г)
Учитель химии:
Задача 1. Смешали 150 г раствора нитрата калия с массовой долей 12% и 300 г раствора этой же соли с массовой долей 7%. Какой стала массовая доля соли в полученном растворе? (9%)
Решение:
m1 (в-ва)=m(р-ра) ∙w(в-ва)
m1(в-ва)= 150 ∙ 0,12=18 г
m2(в-ва)=300∙ 0,07= 21 г
W3(в-ва) = 18+21/150+300= 0,09 ( 9%)
Учитель математики: А вот как прозвучала бы эта задача на уроке математики.
Смешали 150 г 12% водного раствора некоторого вещества с 300 г 7% раствора этого же вещества. Сколько процентов составляет концентрация получившегося раствора? (Результат округлить до единиц)
Решим эту задачу с помощью таблицы. (Таблица заполняется постепенно)
|
k |
чист |
общ |
|||||
|
1раствор |
12%=0,12 |
150∙0,12=18 |
150г |
||||
|
2 раствор |
7%=0,07 |
300∙0,07=21 |
300г |
||||
|
смесь |
39:450∙100≈9% |
39г |
450г |
Учитель химии:
Задания для практической работы
1. Приготовить 55,5 г физиологического раствора, содержащего 0,9% по массе поваренной соли.
Решение:
m(в-ва)= 55,5 ∙ 0,009=0,5 г
m(H2O)= 55,5 – 0,5 = 55 г
2. Приготовить 30 г 5% раствора йодной настойки.
m(в-ва)= 30∙ 0,05=1,5 г
m(H2O)=30- 1,5= 28,5 г
Учитель математики:
Задача 2.
Один раствор содержит 30% по объему HNO3 , а второй 55% HNO3 .Сколько нужно взять первого и второго раствора, что бы получить 100 литров 50% раствора HNO3?
|
k |
чист |
общ |
|||||
|
1раствор |
30%=0,3 |
0,3х |
х |
||||
|
2 раствор |
55%=0,55 |
0,55∙(100-х) |
100 - х |
||||
|
смесь |
50%=0,5 |
0,5∙100=50 |
100л |
Получаем уравнение: 0,3х + 0,55(100 – х) = 50;
0,3х + 55 – 0,55х = 50;
х = 20.
Значит, первого раствора надо взять 20 литров, а второго 80 литров.
Учитель химии: Проверим решение практических задач( у доски учащиеся рассказывают решение практических задач.
Задача 3 .
Определить массу воды, которую надо добавить к 20 г раствора уксусной кислоты с массовой долей 70% для получения раствора уксусной кислоты с массовой долей 5%.
Решение: ( учащиеся выполняют у доски).
m 1(в-ва)= 20∙ 0,7= 14 г
0,05= 14/ 20+х
х=260 г
Учитель математики:
Решим задачу в общем виде.
Задача 4.
Смешали два водных раствора некоторого вещества с концентрацией k1 % и k2 %. Получили раствор с концентрацией k %. В каком отношении нужно взять массы этих растворов? Рассмотрим случай, когда k1 < k < k2
Если мы обозначим массы растворов т1
и т2, то надо выразить ![]() через k1, k2 и k.
через k1, k2 и k.
|
k |
чист |
общ |
|||||
|
1раствор |
k1% = |
т1 |
|||||
|
2 раствор |
k2% = |
т2 |
|||||
|
смесь |
k% = |
Получаем уравнение: k(m1 + m2 ) = k 1m1 + k 2m2
![]() =
= ![]()
k2 -k
kk1 k k2 -k
kk1
![]()
![]()
![]()

![]()
![]()
![]()
![]()
Для того, чтобы легче было запомнить и пользоваться этой
формулой, воспользуемся старинным способом решения. Запишем концентрации
растворов следующим образом:
k1 k1 k2 k1 k k k1 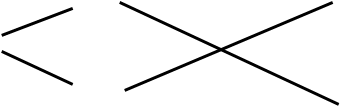
![]()
![]()
![]()





![]()
![]()
![]()
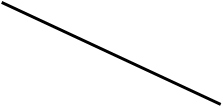
![]()
 |
|||
|
|||
Эта схема похожа на рыбку, поэтому такой способ решения задач называется способ «рыбки». Этот способ справедлив не только, когда выполняется условие k1 < k < k2, просто надо из большего вычитать меньшее. Впервые в России такой способ решения задач был описан в арифметике 18 века, автором которой был Леонтий Филиппович Магницкий (1669-1739) . эта арифметика так и называется «Арифметика Магницкого». Этот учебник М. В. Ломоносов назвал «вратами учености».
Решим этим способом задачу.
Задача 5
К 15 г 10% раствора соли добавили 5% раствор соли и получили 8% раствор. Сколько добавили граммов 5% раствора соли?
|
|||||
|
|||||
|
|||||
2 5%
![]() , х =
10
, х =
10
Решим таким же способом задачу 3. Будем считать, что вода имеет концентрацию равную 0.

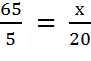 ; х = 260.
; х = 260.
Задача 4
Имеется два сплава с разным содержанием меди: в первом содержится 70%, а во втором – 40% меди. В каком отношении надо взять первый и второй сплавы, чтобы получить из них новый сплав, содержащий 50% меди?
Учащиеся
решают самостоятельно. Ответ: ![]() .
.
Учитель химии: Демонстрационный опыт( показывает учитель): в кристаллизатор с
водой опускаем кусочек металлического натрия. Что за газ выделяется? Почему вода
изменила окраску на малиновую?
Согласно поставленному опыту нам надо решить следующую задачу:
Задача 5
10 г Na провзаимодействовали со 100 г воды. Найти массовую долю гидроксида натрия в растворе.
Решение:
2Na + 2НОН =2NaOH +H2
n (Na)= 10:23=0,43 моль
n (HOH)=100 : 18= 5,56 моль ( избыток)
n (NaOH) = 0,43 моль
m (NaOH)= 40∙ 0,43= 17,2 г
n (H2) = 0,43:2= 0,215 моль
m (H2)=0,215 ∙2=0,43г
w (NaOH)= 17,2/ 10+100- 0,43=0,157( 15,7%)
Итог урока:Сегодня мы на уроке повторили химические и математические способы решения задач, а так же рассмотрели новый способ , который подойдет для решения задач как по математике так и по химии с использованием понятия концентрация ( массовая и объемная доля вещества).Все это поможет на ЕГЭ.
Урок окончен. Успехов вам на экзамене.
Литература:
1. А. В. Шевкин ,,Текстовые задачи по математике,, Москва, Илекса,2011 г.
http://schoolmathematics.ru/prakticheskie-rekomendacii-zadanie-v13-chast-3.
2. А.А.Кушнарев ,,Учимся решать задачи по химии,, Москва , Школа- пресс, 1996г.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.