
Виды химических Электродов и их назначение
Садкова Анастасия Игоревна
студентка, Череповецкого химико-технологического колледжа,
Россия, г.Череповец
Электроды различают по назначению и принципу действия.
В
зависимости от назначения бывают электроды - вспомогательные и измерительные,
по принципу действия – металлические (электронно-обменные), ионоселективные
(мембранные) ![]() .
.
Электроды подразделяющиеся по
назначению:
1. Индикаторный электрод- это электрод (измерительный) потенциал
которого зависит от активности им концентрации определяющих ионов.
Индикаторные электроды подразделяются на хингидронный и стеклянный.
Хингидронный
электрод, представляет собой платиновую проволоку, опущенную в сосуд с
исследуемым раствором, в который предварительно помещают избыточное количество
хингидрона![]() – соединения хинона
– соединения хинона![]() и гидрохинона
и гидрохинона![]() , способных к взаимопревращению в равновесном
окислительно-восстановительном процессе, в котором участвуют ионы водорода.
, способных к взаимопревращению в равновесном
окислительно-восстановительном процессе, в котором участвуют ионы водорода.
Стеклянный электрод, являющийся наиболее используемым индикаторным электродом, относится к ионоселективным или мембранным электродам. В основе работы таких электродов лежат ионообменные реакции, протекающие на границах мембран с растворами электролитов.
Стеклянные электроды чувствительны к ионам водорода и его мембрана
изготавливается из специального сорта стекла![]() .
.
При погружении электрода в раствор сначала ионы щелочных металлов из стекла обмениваются ионами водорода и из раствора металлами:
![]() (1)
(1)
где: ![]() - ионы металла в стекле;
- ионы металла в стекле;
![]() - ионы водорода в растворе;
- ионы водорода в растворе;
![]() - ионы металла в растворе;
- ионы металла в растворе;
![]() - ионы водорода в стекле.
- ионы водорода в стекле.
Затем на внутренней и внешней поверхности мембраны устанавливается равновесие:
![]() (2)
(2)
Хингидронный и стеклянный электрод представлены на Рисунке-1.
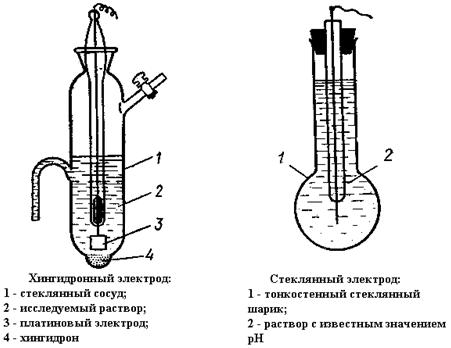
Рисунок-1. Хингидронный и стеклянный электрод
2. Электрод сравнения – (хлорсеребряный ) электрод, потенциал которого постоянен и не зависит от концентрации ионов в растворе.
Потенциал
между серебряной проволокой и внутренним раствором определяется уравнением
Нернста и соответствует произведению растворимости при условии, что
коэффициент активности близок к 1![]() .
.
Устройство хлорсеребряного электрода представлено на Рисунке-2.
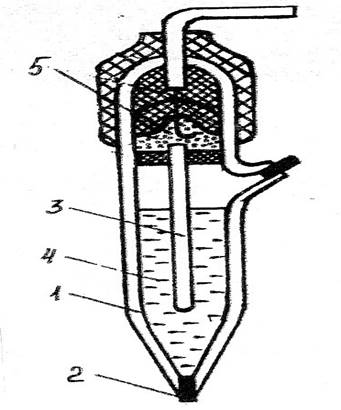
Рисунок-2. Устройство хлорсеребряного электрода.
1- корпус:
2- нить асбестовая; 3- контактный полуэлемент; 4- насыщенный раствор ![]() ;
5-электролитический ключ.
;
5-электролитический ключ.
По принципу действия электроды подразделяются на:
Металлические. При опускании металлической пластинки в воду на её поверхности возникает отрицательный электрический заряд. Механизм его появления состоит в следующем. В узлах кристаллической решетки металлов находятся положительно заряженные ионы, между которыми двигаются свободные электроны. В водной среде катионы, расположенные на поверхности кристаллической решетки, гидратируются полярными молекулами воды и переходят в жидкую фазу, заряжая её положительно. Металл, в котором появился избыток электронов приобретает отрицательный заряд. Отрицательный заряд металлической пластинки препятствует переходу ионов металла в раствор и вызывает обратный процесс – переход его катионов из раствора на металл. При равенстве скоростей этих противоположно направленных процессов в системе устанавливается динамическое равновесие, в ходе которого пластинка и прилегающий к ней водный слой приобретают постоянный электрический заряд, одинаковый по величине, но противоположный по знаку.
Величина этого заряда в
данном случае будет зависеть от природы металла и от температуры. Двойной
электрический слой, возникающий на границе раздела между металлом и жидкостью
имеет не плоское, а диффузионное строение. Электростатическому притяжению
катионов со стороны пластинки противодействуют силы взаимного отталкивания
между ионами металла их тепловое движение. По мере удаления от поверхности
металла, концентрация его катионов в водном слое убывает. Если металлическую
пластинку опустить не в воду, а в раствор соли этого металла, то величина
заряда, возникающего на пластинке при установлении равновесия, будет
определяться ещё и концентрацией ионов металла в исходном растворе![]() .
.
Металлические электроды подразделяются на электроды первого и второго рода:
· Электроды первого рода– это электроды, состоящие из металлической пластинки, опущенной в раствор собственной соли. Величина электродного потенциала для них зависит только от активности катионов соли.
·
Электроды
второго родасостоят
из малоактивного металла, покрытого слоем труднорастворимой собственной соли и
погруженного в раствор какой-либо легкорастворимой соли, содержащей те же
анионы, что и у нерастворимой соли. Потенциал такого электрода зависит как от
активности ионов металла в растворе, так и от активности общего для двух солей
аниона![]() .
.
Ионоселективные
электроды. В потенциометрических методах анализа часто применяют ионоселективные
электроды (ИСЭ). Использование ионоселективных электродов расширяет область
применения потенциометрии. Ионоселективными (мембранными, ионообменными)
электродами называют электроды, на межфазных границах которых протекают
ионообменные процессы. Работа ионообменных электродов определяется равновесным
обменом ионов между мембраной и раствором, разностью потенциалов, возникающей
на границе раздела фаз, а не электрохимической реакцией с переносом электронов. Важнейшей составной
частью ионообменных электродов является полупроницаемая мембрана, которая
представляет собой тонкую пленку, отделяющую внутреннюю часть электрода от
анализируемого раствора. Мембрана называется полупроницаемой, потому что
обеспечивает прохождение через неё ионов одного знака (катионов или
анионов), и, преимущественно, ионов одного сорта в присутствии других ионов с
тем же знаком заряда. Это обеспечивает достаточно
высокую селективность мембраны![]() .
.
Ионоселективные электроды подразделяются на:
Электроды с твердой
мембраной.
Электроды содержат мембрану из малорастворимого кристаллического вещества с
ионным характером проводимости. Перенос заряда происходит за счет дефектов
кристаллической решетки (ионных вакансий, «дырок»). Селективность твердых
кристаллических мембранных электродов обусловлена вакансионным механизмом
переноса заряда. Вакансии заполняются только определенными подвижными ионами в
соответствии с их характеристиками (форма, размер, распределение заряда
вакансии)![]() .
.
Жидкостные мембранные
электроды. Жидкая
мембрана - это слой жидкого органического вещества, которое не должно
растворяться в исследуемом растворе. Устойчивость мембраны повышается, если
органическая жидкость обладает ещё и высокой вязкостью.Общее свойство всех этих
органических веществ - способность селективно связывать некоторые ионы
небольшого размера. При этом образуются нейтральные ионогенные группы с ионами
противоположного знака заряда (в жидком ионообменнике) или заряженные комплексы
с нейтральными группами органической природы. Селективность электрода зависит
от избирательности этого ионного процесса. К электродам с жидкими мембранами
относятся электроды на основе жидких катионитов и жидких анионитов![]() .
.
Список литературы
1. Ионоселективные электроды. Н. В. Шведене
2. https://ru.wikipedia.org/wiki/Электрод
3. http://www.xumuk.ru/encyklopedia/2/5297.html
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.