
|
Раздел долгосрочного плана: 7.3С Относительная атомная масса. Простейшие формулы
|
Школа: ХБН г.Караганда |
||||||||||||
|
Дата: |
ФИО учителя: Т.Бектемирова |
||||||||||||
|
Класс: 7 |
Количество присутствующих: |
отсутствующих: |
|||||||||||
|
Тема урока |
Относительная атомная масса
|
||||||||||||
|
Цели обучения, которые достигаются на данном уроке |
7.1.2.8 понимать, что большинство элементов на Земле встречаются в виде смеси изотопов, образовавшихся при формировании планет; 7.1.2.9 понимать, что атомные массы химических элементов, имеющие природные изотопы, являются дробными числами; 7.1.2.10 –знать определение относительной атомной массы химических элементов. |
||||||||||||
|
Цели урока |
- сформировать понимание того, что большинство элементов на Земле встречаются в виде смеси изотопов, образовавшихся при формировании планет; - понимать, что атомные массы химических элементов, имеющие природные изотопы, являются дробными числами; - уметь рассчитывать значение относительной атомной массы по известным процентным соотношениям природных изотопов; - знать определение относительной атомной массы химических элементов. |
||||||||||||
|
Критерии оценивания |
- формулирует определение относительной атомной массы; - рассчитывает значение относительной атомной массы элемента по содержанию изотопов в природе, - объясняет, почему величина относительной атомной массы имеет дробное значение. |
||||||||||||
|
Языковые цели
|
Формулирует определение «относительная атомная масса». Лексика и терминология, специфичная для предмета: Атом, изотоп, процент, химический элемент. Полезные выражения для диалогов и письма: Смесь изотопов химического элемента, массовая доля. |
||||||||||||
|
Привитие ценностей |
Уважение и сотрудничество – диалоговое обучение; академическая честность – правильное поведение во время проведения любых форм оцениваемых работ. |
||||||||||||
|
Межпредметные связи |
Математика – процент, доля, математические вычисления. |
||||||||||||
|
Предварительные знания
|
Учащиеся: - знают, что атомы одного химического элемента представлены изотопами в природе; - понимают отличие в составе изотопов одного химического элемента; - знают понятие массовое число; - умеют записывать состав в атома в отношении протонов, нейтронов, электронов. |
||||||||||||
|
Ход урока |
|||||||||||||
|
Запланированные этапы урока |
Запланированная деятельность на уроке |
Ресурсы |
|||||||||||
|
Начало урока
1-2 минуты
3-8 минуты |
I. Организационный момент: постановка целей урока и формулирование ожидаемых результатов обучения. Учащиеся могут участвовать в определении целей урока и способов достижения поставленных целей, осуществлять самоконтроль, коррекцию и рефлексию деятельности. Совместное обсуждение целей обучения может способствовать повышению мотивации деятельности учащихся на уроке. II. Актуализация знаний, цель: 7.1.2.7- знать понятие «изотоп». Техника проведения: фронтально устно. |
Приложение 1. |
|||||||||||
|
Середина урока
9 - 17 минуты
18-22 минуты
23-25 минуты
23-36 минуты
|
I. Знакомство с понятием относительная атомная масса. II. Вопрос учащимся: обсудите в парах и сформулируйте ответ на вопрос: i. Массовое число атома определяется числом нуклидов. Масса протона численно равна массе нейтрона = 1. Как объяснить тот факт, что в таблице значения относительной атомной массы записаны как дробные числа.
Например, бром
Ответ: учащиеся могут предположить, что зависит от суммы всех частиц в атоме (т.к масса электронов условно принимается за «0», но реально = 9.10938356 × 10-31 килограмма. Масса нейтрона больше массы протона:
ii. Учитель корректирует ответы учащихся и вводит понятие «относительная атомная масса» и способ её расчета. Относительная атомная масса химического элемента рассчитывается как средняя масса изотопов химического элемента с учётом их распространённости в природе.
Для расчета относительной атомной массы элемента, представленного в природе в виде смеси изотопов, необходимо умножить процент каждого изотопа на его атомную массу и сложить их вместе. III. Демонстрация способа решения задачи для расчета относительной атомной массы брома. IV. Деление на пары. Учащимся предлагаются карточки с описанием состава изотопов, учащиеся выбирают карточки и формируют группы для работы в классе. V. Закрепление Организация работы учащихся в группах. На этом этапе урока учащиеся выполняют дифференцированные задания, оказывают поддержку менее способным учащимся. Организуйте самопроверку работ учащихся по образцу или взаимопроверку по критериям. Самооценивание/взаимооценивание по критериям позволяет учащимся соотнести ожидаемые результаты с уровнем достижения целей обучения и ставить ближайшие цели в самообразовании (развитии навыка составления уравнений реакций |
Приложение 2.
Приложение 3.
Приложение 4. |
|||||||||||
|
Конец урока 37-40 минут |
В конце урока учащиеся проводят рефлексию. Техника проведения: закончить одно предложение:
учащиеся выборочно зачитывают свои записи, анализ информации позволяет оценить уровень достижения ЦО, эмоционального состояния и прогресса учащихся. Домашнее задание. Предлагаемые задания направлены на отработку навыка решения задач на определение относительной атомной массы и развития представлений об изотопах. |
Приложение 5. |
|||||||||||
|
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися? |
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися? |
Здоровье и соблюдение техники
безопасности |
|||||||||||
|
Дифференциация выражена в подборе заданий, в оказании индивидуальной поддержки учащемуся при работе в паре со стороны более способного ученика - консультанта (учителя), в подборе ресурсов. |
Оценивание знаний учащихся проводится на всех этапах уроках, форма контроля знаний: фронтально, индивидуально; контроль учителя, взаимоконтроль. |
Правила техники безопасности на данном уроке поддержка здоровью учащихся в смене деятельности, создании психологически – комфортном взаимообучении учащихся через диалоговое обучение.
|
|||||||||||
Приложение 1.
ЦО: 7.1.2.7- знать понятие «изотоп»
|
Критерии оценивания |
Дескриптор Учащийся: |
|
Формулирует определение понятия “изотопы” |
объясняет, в чём заключается различие между изотопами; |
|
объясняет, в чём заключается сходство между изотопами; |
|
|
формулирует определение понятия«изотопы»; |
|
|
приводит пример изотопного состава одного химического элемента; |
|
|
По изображению выбирает изотопы |
Выбирает изотопы гелия на основании состава атомов |
Вариант 1.
Задание:
На рисунке показаны природные изотопы углерода:
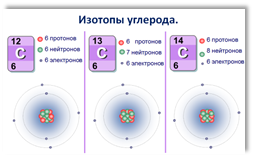 (а) В чём
заключается различие между изотопами углерода?
(а) В чём
заключается различие между изотопами углерода?
(b) В чём заключается сходство между изотопами углерода?
(с) Сформулируйте определение понятия «изотопы»
(d) Приведите пример изотопного состава другого химического элемента.
2. Гелий имеет два изотопа 32He и 42He.
Какие две диаграммы показывают расположение частиц в этих двух изотопах?
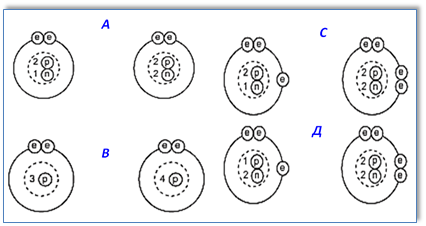
Приложение 2.
Образец:
Бром в природе встречается в виде двух изотопов: бром-79 (55%) и бром-81 (45%).
Задание:
(i) Рассчитайте относительную атомную массу брома.
Аr (Br) = (55%/100%) ![]() 79+ (45%/100%
79+ (45%/100% ![]() 81) = (0.55
81) = (0.55 ![]() 79) + (0.45
79) + (0.45 ![]() 81) = 43.45 +
36.45
81) = 43.45 +
36.45
 = 79.9
= 79.9
Ответ: Аr (Br) =79.9
(ii) Предложить учащимся сравнить с табличным значением
Приложение 3.
Деление на группы.
Задание: выберите карточку и сформируйте группы изотопов химических элементов.
Цели обучения: - знать понятие изотоп;
- знать строение атома (p, n, e) и состав атомного ядра для первых 20 элементов.
Критерий оценивания: Учащийся
ü выбирает по описанию состава атома изотопы;
ü устанавливает состав атомного ядра первых 20 элементов
|
24Mg |
14 нейтронов |
12 протонов |
26 Mg |
|
Натрий |
11 протонов |
11 электронов |
23 нуклона |
|
Водород |
1Н |
2Н |
1 протон |
|
Хлор |
35Cl |
37Cl |
17 электронов |
Приложение 4.
Работа в группах.
|
Критерии оценивания |
ü Объясняет дробное значение атомной массы химических элементов и рассчитывает относительную атомную массу для заданного элемента. ü Составляет формулы бинарных химических соединений, используя названия элементов и их атомные соотношения в соединениях. ü Вычисляет относительную молекулярную массу химического соединения. |
Задание 1.
Вариант 1.
Природный хлор имеет два природных изотопа:
a. хлор-35 (77,35%=0,7735)
b. хлор-37 (22,65%=0,2265). Рассчитайте относительную атомную массу хлора.
Решение:
Аr (Cl) = = (0.7735 ![]() 35) + (0.2265
35) + (0.2265 ![]() 37) = 27.0725 +
8.3805= 35. 453
37) = 27.0725 +
8.3805= 35. 453
Вариант 2.
Неон имеет три изотопа. Их процентное соотношение составляет 90,92% - 20Ne, 0,26% - 21Ne и 8,82% - 22Ne.Рассчитайте относительную атомную массу неона.
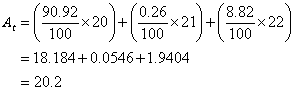 Решение:
Решение:
Задание 2.
В природе встречается два изотопа лития 6Li и 7Li. Сравните табличное значение величины относительной атомной массы лития с массовыми числами изотопов и установите какой из изотопов 6Li или 7Li представлен в природе в большем процентом содержании. Объясните свой ответ.
Задание 3*.
На приведенной ниже диаграмме представлено природное соотношение изотопов элемента 2 группы периодической таблицы. Каждый пик в диаграмме представляет собой изотоп этого элемента.
Изучите диаграмму и ответьте на вопросы ниже:
(i) Что означает термин изотоп?

(ii) На основании вышеприведенного соотношения массовых значений изотопов, определите, сколько изотопов у этого элемента присутствует в образце______________?
(iii) Какова масса изотопа с наибольшим относительным содержанием__________?
(iv) Рассчитайте величину относительной атомной массы элемента, используя данные графика.
(v) Назовите элемент 2 группы__________________________________.
Задание 4**.
Если относительная атомная масса меди составляет 63,54, а в природе встречается два изотопа меди: 63Cu и 65Cu, то предложите способ как вычислить процентное соотношение изотопов меди в природе.
Решение:
1-й изотоп 63Cu
2-й изотоп 65 Cu
Пусть доля 63Cu x, а 65 Cu y=(100-х).
Относительная атомная
масса меди ( Ar) = (x
/ 100 ![]() 63)
+ (y / 100
63)
+ (y / 100 ![]() 65)
= 63,54
65)
= 63,54
63,54 = 0,63x
+ 0,65y ............. (2)
из уравнения (1); y = 100 - x
заменить y
в уравнении (2) выше 63,54 = 0,63x
+ 0,65 (100 - x)
63,54 = 0,63x
+ 65 - 0,65x
1,46 = 0,02x
x = 0,73 (= 73%)
напомнить; y
= 100 - x
y = 100% - 73%
y = 27%
Приложение 5.
Домашнее задание:
1. В природных соединениях рубидий представлен двумя изотопами: 85Rb и 87Rb; в соотношении 77% и 23% соответственно. Вычислите среднюю относительную атомную массу рубидия.
Ответ запишите с точностью до второго знака после запятой.
2. Элемент углерод имеет три изотопа: углерод-12, углерод-13 и углерод-14.
Заполните таблицу, чтобы показать количество протонов и нейтронов в каждом изотопе углерод.
|
Изотоп углерода |
Массовое число |
Количество протонов |
Количество нейтронов |
|
12С |
12 |
6 |
6 |
|
13С |
13 |
|
|
|
14С |
14 |
|
|
(i) Укажите, что значит термин «относительная атомная масса», Ar.
(ii) Образец углерода содержал 98,90% углерода-12 (12С) и 1,10% углерода-13 ( 13С).
Используйте эту информацию для расчета относительной атомной массы углерода в образце. Запишите ответ до двух знаков после запятой.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.