Контрольная работа содержит задания на строение атомов металлов и неметаллов, о химических свойствах веществ, типах химических реакций, типах кристаллических решеток веществ, умения составлять уравнения реакций ОВР и ионных полных и сокращенных, определять атом по электронному строению решать задачи на определение массы, объема, количества вещества..
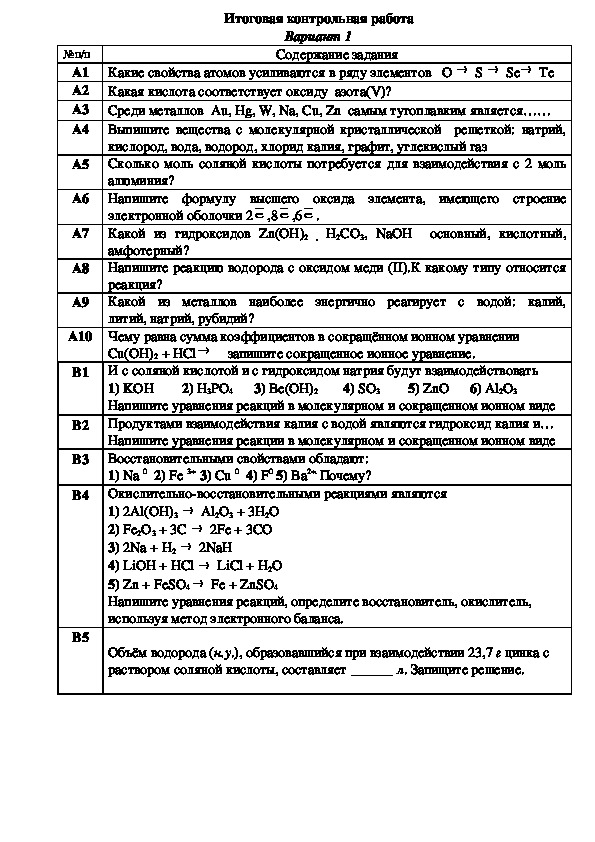
Итоговая контрольная работа
Вариант 1
Содержание задания
№п/п
А1 Какие свойства атомов усиливаются в ряду элементов О S Sе Те
А2 Какая кислота соответствует оксиду азота(V)?
А3
А4
Среди металлов Au, Hg, W, Na, Cu, Zn самым тугоплавким является……
Выпишите вещества с молекулярной кристаллической решеткой: натрий,
кислород, вода, водород, хлорид калия, графит, углекислый газ
Сколько моль соляной кислоты потребуется для взаимодействия с 2 моль
алюминия?
А5
А6 Напишите формулу высшего оксида элемента, имеющего строение
электронной оболочки 2 е ,8 е ,6 е .
А7 Какой из гидроксидов Zn(OH)2 , Н2СО3, NaOH
амфотерный?
основный, кислотный,
А8 Напишите реакцию водорода с оксидом меди (II).К какому типу относится
реакция?
А9 Какой из металлов наиболее энергично реагирует с водой: калий,
литий, натрий, рубидий?
А10 Чему равна сумма коэффициентов в сокращённом ионном уравнении
Cu(OH)2 + HCl запишите сокращенное ионное уравнение.
В1 И с соляной кислотой и с гидроксидом натрия будут взаимодействовать
1) KOH 2) H3PO4 3) Be(OH)2 4) SO3 5) ZnO 6) Al2O3
Напишите уравнения реакций в молекулярном и сокращенном ионном виде
В2 Продуктами взаимодействия калия с водой являются гидроксид калия и…
Напишите уравнения реакции в молекулярном и сокращенном ионном виде
Восстановительными свойствами обладают:
1) Na 0 2) Fe 3+ 3) Cu 0 4) F0 5) Ba2+. Почему?
В3
В4 Окислительновосстановительными реакциями являются
1) 2Al(OH)3 Al2O3 + 3H2O
2) Fe2O3 + 3C 2Fе + 3CO
3) 2Na + H2 2NaH
4) LiOH + HCl LiCl + H2O
5) Zn + FeSO4 Fe + ZnSO4
Напишите уравнения реакций, определите восстановитель, окислитель,
используя метод электронного баланса.
В5
Объём водорода (н.у.), образовавшийся при взаимодействии 23,7 г цинка с
раствором соляной кислоты, составляет ______ л. Запищите решение.Итоговая контрольная работа
Вариант 2
Содержание задания
№п/п
А1 Какие свойства атомов усиливаются в ряду элементов Si P S Cl?
А2 Какая кислота соответствует оксиду S(IV) ?
А3
А4
Среди металлов Au, Hg, W, Na, Cu, Zn очень мягкий, режется ножом?
Выпишите вещества с металлической кристаллической решёткой: кремний,
теллур, галлий, хлор, литий, азот, кальций, золото.
Сколько моль водорода образуется при взаимодействии 3 моль цинка с
серной кислотой?
А5
А6 Напишите формулу высшего оксида элемента, имеющего строение
электронной оболочки 2 е ,8 е ,7 е .
А7 Какой из гидроксидов Ве(ОH)2, Ba(OH)2, H3PO4: основный, амфотерный,
кислотный?
А8 Напишите реакцию гидроксида калия м хлоридом меди (II).К какому типу
А9
относится реакция?
С разбавленной серной кислотой НЕ взаимодействует: ртуть, алюминий
цинк,железо.
А10 Чему равна сумма коэффициентов в сокращённом ионном уравнении
Fe(OH)3 + HNO3
В1 И с серной кислотой и с гидроксидом калия будут взаимодействовать
1) NaOH 2)Al(OH)3 3) HNO3 4) FeCl2 5) BeO 6) Zn(OH)2
Напишите уравнения реакций в молекулярном и сокращенном ионном виде
Дополните предложение. Продуктами взаимодействия натрия с водой
являются водород и ______ натрия. Напишите уравнения реакции в
молекулярном и сокращенном ионном виде
Восстановительными свойствами обладают
1) Na + 2) Сu 0 3) Al 0 4) Ca0 5) Fe3+. Почему?
В2
В3
В5 Окислительновосстановительными реакциями являются
1) 4Li + O2 2Li2O
2) 2Fe(OH)3 Fe2O3 + 3H2O
3) Mg + CuCl2 MgCl2 + Cu
4) ZnO + C Zn + CO
5) Ca(OH)2 + 2HNO3 Ca(NO3)2 + 2H2O
Напишите уравнения реакций, определите восстановитель, окислитель,
используя метод электронного баланса.
В8 Объём кислорода (н.у.), необходимый для окисления 51,6 г меди, составляет
______ л.
Запищите решение