
Дата:
Класс: 9
Учитель:
Предмет: Химия
Тема: Контрольная работа №4 по теме «Важнейшие металлы и их соединения»
Контролируемые элементы содержания
Химические свойства щелочных и щелочноземельных металлов, алюминия и железа.
Контролируемые умения
Овладение основами химической грамотности: способностью анализировать и объективно оценивать жизненные ситуации, связанные с химией, навыками безопасного обращения с веществами, используемыми в повседневной жизни; умением анализировать и планировать экологически безопасное поведение в целях сохранения здоровья и окружающей среды.
Формирование первоначальных систематизированных представлений о веществах, их превращениях и практическом применении.
Проверяемые элементы содержания
Общая характеристика химических элементов-металлов на основании их положения в Периодической системе химических элементов Д.И. Менделеева и строения атомов.
Предметные умения
Выделять в тексте ключевые слова (химические понятия, названия веществ, признаки протекания реакций и др.), владеть приёмами преобразования информации из одной формы в другую (таблицу, рисунок и уравнение реакции в текст, а текст – в указанные формы).
Личностные результаты
Овладение языковой и читательской культурой как средством познания мира
Функциональная грамотность
Овладение языковой и читательской культурой как средством познания мира
Тип урока: контроль знаний
Библиотека ЦОК:
БЛОЧНО-МОДУЛЬНОЕ ОПИСАНИЕ УРОКА:
1. Вхождение в тему урока и создание условий для осознанного восприятия нового материала
Контрольная работа № 2 по теме « Металлы и их соединения ».
Цель: проверить умения учащихся характеризовать общие свойства металлов и их соединений на основе положения их в электрохимическом ряду напряжения металлов и ПСХЭ Д.И. Менделеева; - вычислять массовую долю выхода продукта реакции от теоретически возможного
1. Составьте уравнения реакций характеризующих химические свойства: ( 2-3 реакции)
![]()
2. Осуществите превращения:
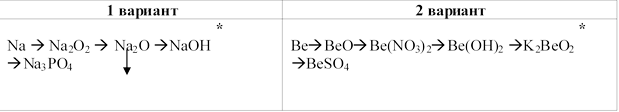 Для реакций обозначенных звездочкой (*) напишите полное
и сокращенное ионные уравнения.
Для реакций обозначенных звездочкой (*) напишите полное
и сокращенное ионные уравнения.
3. Решите задачу:
|
1 вариант |
2 вариант |
|
Рассчитайте объем водорода полученный при взаимодействии 5,4 г алюминия содержащего 5 % примесей с соляной кислотой, если выход водорода составляет 90 % от теоретически возможного. |
Рассчитайте объем водорода полученный при взаимодействии 5 г кальция содержащего 10 % примесей с водой, если выход водорода составляет 95 % от теоретически возможного. |
Ответы:
Составьте уравнения реакций характеризующих химические свойства:
1 вариант ( железо)

2 вариант (алюминий)
С кислородом
4Al + 3O2 → 2Al2O3
С неметаллом
– 2Al + 3S → Al2S3;
С галогенами
– 2Al + 3Cl2 → 2AlCl3;
С кислотами
Реагирует с разбавленными кислотами при обычных условиях, с концентрированными – при нагревании
– Al + 6HNO3(конц.) → Al(NO3)3 + 3NO2 + 3H2O
Со щелочами
– 2Al + 6KOH → 2KAlO2 + 2K2O + 3H2
С оксидами
2Al + Fe2O3 → 2Fe + Al2O3
Задание 2
Вариант 1
1) Перекись натрия образуется при сгорании натрия в кислороде:
2Na + O —>Na2O2 - реакция соединения
2) Прокаливание перекиси натрия с избытком натрия поможет получить оксид натрия:
Na2O2 + 2Na —> 2Na2O - реакция соединения
3) Взаимодействуя с водой, оксид натрия образует щелочь - гидроксид натрия:
Na2O + H2O —> 2NaOH - реакция соединения
4) Взаимодействуя с кислотой гидроксид натрия образует ортофосфат натрия:
3NaOH + H3PO4 —> Na3PO4 + 3H2O - реакция обмена
Вариант 2
1) 2Be + O2 -t-> 2BeO
2) BeO + 2HNO3 --> Be(NO3)2 + H2O
3) Be(NO3)2 + 2NaOH (разб. ) --> Be(OH)2↓ + 2NaNO3
4) Be(OH)2 + 2KOH -t-> K2BeO2 + 2H2O
5) K2BeO2 + 2H2SO4 --> BeSO4 + K2SO4 + 2H2O
Задание 3
Вариант 1
2Al + 6HCl =
2AlCl3 + 3H2↑
Необходимо отнять примеси из массы алюминия
m(примеси) = 5,4 * 0,05 = 0,27 г.
m(Al) = 5,4 - 0,27 = 5,13 г.
Теперь нужно найти количество алюминия, а потом через него количество водорода
n(Al) = 5,13 / 26 = 0,2 моль
n(H2) = ![]() = 0,3 моль
= 0,3 моль
Находим объём водорода
V(H2) = 22,4 * 0,3 = 6,72 л.
Ответ: 6,72 л.
Вариант 2
Дано:
m(Ca) = 5 г
M(Ca) = 40 г/моль
Найти: V(H2) -?
Решение:
Ca+2H2O → Ca(OH)2+H2
n(Ca) = m/M = 5/40=0,125 (моль)
n(H2) = n(Ca) = 0,125 (моль)
Vтеор(H2)=0,125*22,4=2,8 (л)
Vпрак(H2)=0,9*2,8 л=2,52 (л)
Ответ: Vтеор(H2) = 2,8 л Vпрак(H2) = 2,52 л
4. Подведение итогов, домашнее задание
5.1 Рефлексия

5.2 Домашнее задание.
Повторить пройденный материал.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.