
Тема урока: Диссоциация электролитов в водных растворах.
Ионные уравнения реакций.
Диссоциация – распад электролита на ионы.
Электролиты – вещества, растворы и расплавы которых проводят электрический ток (растворимые в воде кислоты, соли, основания).
Неэлектролиты - вещества, растворы и расплавы которых не проводят электрический ток (нерастворимые кислоты, основания, соли, все ОКСИДЫ, органические вещества, простые вещества).
Примеры диссоциации веществ.
Кислоты:
![]()
![]() HNO3 H+ + NO3-
HNO3 H+ + NO3-
В составе серной кислоты H2SO4 два атома водорода. При диссоциации одной молекулы образуется 2 ионы водорода и 1 сульфат-ион.
![]()
![]() H2SO4 2
H+ + SO42- (правильная
запись)
H2SO4 2
H+ + SO42- (правильная
запись)
![]()
![]() H2SO4 H2+ + SO42- (неправильная
запись)
H2SO4 H2+ + SO42- (неправильная
запись)
Основания:
![]()
![]() NaOH Na+ + OH-
NaOH Na+ + OH-
Если в составе основания две группы ОН, то индекс 2 после ОН переносится вперед и превращается в коэффициент.
![]()
![]() Ca(OH)2
Ca2+ + 2 OH- (правильная
запись)
Ca(OH)2
Ca2+ + 2 OH- (правильная
запись)
![]()
![]() Ca(OH)2
Ca2+ + (OH- )2 (неправильная
запись)
Ca(OH)2
Ca2+ + (OH- )2 (неправильная
запись)
Соли:
![]()
![]() KCl K+ + Cl-
KCl K+ + Cl-
![]()
![]() BaBr2 Ba2+ + 2 Br- (правильная
запись)
BaBr2 Ba2+ + 2 Br- (правильная
запись)
![]()
![]() BaBr2 Ba2+ + Br2- (неправильная
запись)
BaBr2 Ba2+ + Br2- (неправильная
запись)
![]()
![]() Al2(SO4)3
2 Al3+ + 3 SO43- (правильная запись)
Al2(SO4)3
2 Al3+ + 3 SO43- (правильная запись)
![]()
![]() Al2(SO4)3
Al2
3+ + (SO4 2-)3 (неправильная
запись)
Al2(SO4)3
Al2
3+ + (SO4 2-)3 (неправильная
запись)
Реакция ионного обмена имеет смысл (идет до конца), если образуются газ, осадок или вода.
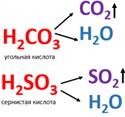
Пример составления ионных уравнений реакций:
Na2CO3 + CaCl2 = CaCO3↓ + 2 NaCl (МОЛЕКУЛЯРНОЕ УРАВНЕНИЕ РЕАКЦИИ)
2 Na+ + CO32- + Ca2+ + 2 Cl- = CaCO3 + 2 Na+ + 2 Cl- (ПОЛНОЕ ИОННОЕ УРАВНЕНИЕ)
Ca2+ + CO32- = CaCO3 (СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ)
Задание на урок:
1) Расставьте коэффициенты в уравнениях реакций. Укажите, какое вещество выпадает в осадок. Составьте полное и сокращенное ионные уравнения.
Ba(NO3)2 + H2SO4 = BaSO4 + HNO3
AgNO3 + NaCl = AgCl + NaNO3
CuSO4 + KOH = Cu(OH)2 + K2SO4
2) Допишите уравнение реакции, расставьте коэффициенты, составьте ионные уравнения.
AlCl3 + NaOH =
Ca(NO3)2 + K3PO4 =
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.