
Характеристика химического элемента по его положению в Периодической системе
Химические и физические свойства простых и сложных веществ, содержащих те или иные химические элементы, находятся в периодической зависимости от расположения данного элемента в Периодической системе.
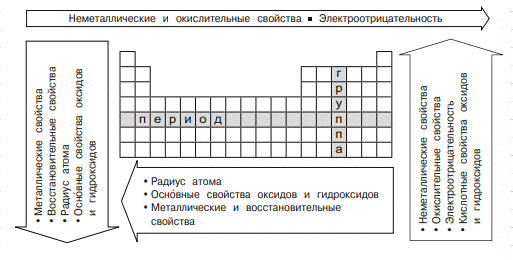
Закономерности
изменения свойств элементов и их соединений по периодам
и группам (стрелки показывают увеличение / усиление свойств)
Радиус атома
Радиус атома — расстояние от ядра атома до электрона, находящегося на внешнем слое электронной оболочки атома. Количество электронных слоёв равно номеру периода, соответственно,
вниз по группе число электронных слоёв увеличивается, а значит, радиус атома возрастает. Вправо по периоду (среди элементов главных групп) количество электронов на внешнем уровне увеличивается, но общее число уровней остаётся без изменений.
Отрицательно заряженные электроны притягиваются к положительно заряженному ядру, и чем больше их в пределах одного уровня, тем больше сила этого притяжения — атом немного сжимается. Вправо по периоду (среди элементов главных групп) радиус атома уменьшается.
Электроотрицательность
Электроотрицательность — это способность атома притягивать к себе валентные электроны других атомов. Элементы VIIIА груп пы — благородные газы — имеют завершённый внешний уровень, поэтому обладают нулевой электроотрицательностью. Самым электроотрицательным элементом является фтор F, второй по электроотрицательности — кислород O, третий — хлор Cl. Чем ближе элемент к фтору в Периодической системе, тем выше его электроотрицательность. Металлы обладают небольшой электроотрицательностью и, наоборот, склонны отдавать свои электроны. Электроотрицательность увеличивается вправо по периоду и вверх по подгруппе.
Металлические и неметаллические свойства
Металлические свойства — совокупность физико-химических свойств, характерных для элементов и их простых веществ, которым соответствуют простые вещества — металлы. Металлы — простые вещества, обладающие характерным металлическим блеском, высокой электро- и теплопроводностью, пластичностью, ковкостью.
Металлические свойства усиливаются вниз по подгруппе и влево
по периоду.
Неметаллические свойства являются противоположностью металличе- ским и, соответственно, усиливаются вверх по подгруппе и вправо по периоду.
При переходе от главных подгрупп к побочным металлические свойства резко ослабевают.
Кислотные и основные свойства
Кислотные свойства — совокупность свойств, которые определяют поведение кислот в химических реакциях, например взаимодействие с основными ми
оксидами и основаниями.
Основные свойства являются противоположностью кислотным и показывают поведение оснований в химических реакциях.
Основными являются оксиды металлов, а кислотными — оксиды неметаллов (или металлов в высокой степени окисления). Соответственно, кислотные свойства оксидов и гидроксидов изменяются по Периодической системе подобно неметаллическим свойствам простых веществ, основные свойства, наоборот, изменяются подобно металлическим свойствам.
Кислотные свойства оксидов и гидроксидов усиливаются вправо по периоду и вверх по подгруппе.
Основные свойства оксидов и гидроксидов усиливаются влево по периоду и вниз по подгруппе.
Кислотные и основные свойства водородных соединений изменяются иначе.
Кислотные свойства водородных соединений усиливаются вправо по периоду и вниз по подгруппе. Основные свойства водородных соединений усиливаются влево по периоду и вверх по подгруппе.
Окислительные и восстановительные свойства
Окислительные свойства — способность атома или иона принимать электроны, понижая свою степень окисления.
Восстановительные свойства — способность атома или иона отдавать электроны, повышая свою степень окисления.
Окислительные свойства усиливаются вправо по периоду и вверх по подгруппе, восстановительные — влево по периоду и вниз по подгруппе.
В правом верхнем углу Периодической системы находится самый активный окислитель — фтор F, в левом нижнем углу располагается самый активный восстановитель — цезий Cs.
Существуют частицы, которые могут проявлять только окислительные
свойства (например, Na+1, Fe–1, S+6) — степень окисления атома максимальная. Некоторые частицы проявляют только восстановительные
свойства (например, S–2, K0, F–) — степень окисления атома мини-
мальная. Но есть частицы, которые способны проявлять как окисли-
тельные, так и восстановительные свойства, атомы в них находятся
в промежуточной степени окисления (например, N+3, S+4, Fe+2).
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.