
Методическая разработка урока химии в 9-м классе по теме
"Водород"
Cоставитель:
Ибрагимова Фатимат Мурадагаевна
учитель химии и биологии
2019г
Тема урока: "Водород"
Цель: Создать условия для формирования знаний о водороде.
Задачи:
Образовательные: сформировать знания о простом веществе – водороде.
Развивающие:
продолжать развивать общеучебные умения – охарактеризовать свойства вещества на основе его положения в ПСХЭ;
умения составлять уравнения реакций (ОВР) на примере химических свойств водорода.;
интеллектуальные умения – устанавливать причинно-следственные связи, строить рассуждения, делать выводы по теме, систематизировать материал;
речевые умения – строить связные высказывания в учебно-научном стиле при работе в группах;
коммуникативные умения – высказывать свою точку зрения, выслушивать мнение своего товарища.
Воспитывающие: способствовать воспитанию определенных черт личности: усидчивости, умение работать в группе.
Оборудование: учебник Химия 9 О.С.Габриелян. ЦОРы, компьютер, проектор.
Химические реактивы и оборудование: цинк, соляная кислота, аппарат Киппа, металлический штатив, пробирка, спички, вата.
Тип урока: урок изучения и первичного закрепления новых знаний.
План урока:
1. Организационный момент
2. Этап подготовки учащихся к активному сознательному усвоению знаний
3.Этап усвоения новых знаний
4. Этап закрепления новых знаний
5. Этап информации учащихся о домашнем задании и инструкции по его выполнению.
ХОД УРОКА
1. Организационный момент (1 мин.)
Приветствие учителя и учащихся
Определение отсутствующих
2. Этап подготовки учащихся к активному сознательному усвоению знаний (3 мин.)
Формулировка темы и цели урока учащимися:
Отгадайте загадку о чем идет речь?
Я, газ, легчайший и бесцветный,
Неядовитый и безвредный,
Соединяясь с кислородом,
Я для питья даю вам воду!
(Учащиеся формулируют цели и задачи урока, демонстрируются слайды 1-3)
3. Актуализация знаний
Историческая справка (сообщения учащихся).
В трудах химиков 16 и 17 веков неоднократно упоминалось о выделении горючего газа при действии кислот на металлы. В 1766 году Г. Кавендиш собрал и исследовал выделяющийся газ, назвав его "горючий воздух". Будучи сторонником теории флогистона, Кавендиш полагал, что этот газ и есть чистый флогистон. В 1783 году А. Лавуазье путем анализа и синтеза воды доказал сложность ее состава, а в 1787 определил "горючий воздух" как новый химический элемент (Водород) и дал ему современное название hydrogene (от греч. hydor – вода и gennao – рождаю), что означает "рождающий воду"; этот корень употребляется в названиях соединений Водорода и процессов с его участием (например, гидриды, гидрогенизация). Современное русское наименование "Водород" было предложено М. Ф. Соловьевым в 1824 году.
Применение Водорода. В промышленном масштабе Водород стали получать в конце 18 века для наполнения воздушных шаров. В настоящее время Водород широко применяют в химической промышленности, главным образом для производства аммиака. Крупным потребителем Водорода является также производство метилового и других спиртов, синтетического бензина и других продуктов, получаемых синтезом из Водорода и оксида углерода (II). Водород применяют для гидрогенизации твердого и тяжелого жидкого топлив, жиров и других, для синтеза HCl, для гидроочистки нефтепродуктов, в сварке и резке металлов кислородо-водородным пламенем (температура до 2800°С) и в атомно-водородной сварке (до 4000°С). Очень важное применение в атомной энергетике нашли изотопы Водорода – дейтерий и тритий. Говоря о применении водорода, стоит рассказать о его использовании в синтезе НСl и NH3, а также резке, сварке и получении металлов, в переработке нефти и жиров.
4. Этап усвоения новых знаний (20 мин.)
1) Нахождение в природе (слайды 6-10).
Учащиеся разгадывают тайнопись и характеризуют нахождение водорода в природе. Заполняют схему в инструктивной карте (прил. 1).
|
Что означают эти цифры?
70% 8%
1% 50% |
2) Положение водорода в периодической системе.
Давайте с вами разберемся почему водород занимает двойственное положение в ПСХЭ.
3) Строение атома водорода – визитка химического элемента
Индивидуальная работа
(1 ученик работает у доски – составляет схему строения атома водорода, остальные пишут в тетради, демонстрируется слайд 11-12)
Характеризуя водород по положению в периодической системе химических элементов Д. И. Менделеева, следует обратить внимание на особенности строения атома водорода – самого простейшего из химических элементов.
• Символ – Н;
• Порядковый номер – 1
• Группа – IА,(VIIА)
• Период – 1
• Относителная ат. масса – 1
• Степени окисления: +1,0,-1
• Число е, p+, n0 – 1,1,0
• Электронная формула – 1S2
Молекула водорода двухатомная, связь ковалентная неполярная (Н:Н или Н-Н).
Вывод: строение обусловливает разнообразие свойств водорода, его двойственное положение в системе Д. И. Менделеева – в I и VII группах (слайд 13).
4) Физические свойства водорода (слайд 14).
Учащимся предлагается разгадать ребус и предсказать физические свойства водорода.
Водород – газ без цвета, вкуса и запаха, плохо растворим в воде, в 14,5 раз легче воздуха, температура кипения - 253 0С
Демонстрация видеофрагмента «Мыльные пузыри с водородом».
Интересный факт из жизни ученых (сообщение учащихся).
Как-то ученый Пилатр де Розьер решил проверить, что будет, если вдохнуть водород; до него никто такого эксперимента не проводил. Не заметив никакого эффекта, ученый решил убедиться, проник ли водород в легкие. Он еще раз глубоко вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако водород в легких экспериментатора смешался с воздухом, и произошел сильный взрыв.
5) Получение водорода (слайд 15-18).
1. Демонстрация видеофрагмента « Получение водорода в лаборатории».
2. Лабораторный опыт.
Работают в группах пользуясь инструктивными карточками (выполняют опыт)
• Получить водород из цинка и соляной кислоты.
• Собрать водород в пробирку методом вытеснения воздуха.
• Проверить наличие водорода с помощью реакции горения (над пламенем спиртовки).
• Записать уравнение реакции.
3. Записывают способы получения водорода в лаборатории и в промышленности (с помощью учителя)
1) В лаборатории:
Zn + 2HCl = ZnCl2 + H2
2К+2H2O=2KOH+H2
2) В промышленности:
С + Н2О = СО + Н2
СН4 + Н2О = СО + 3Н2
2Н2О = 2Н2 + О2
Не шутите с Водородом!
Он горит, рождая воду,
В смеси с Кислородом-братом
Он взрывается, ребята!
Вам скажу на всякий случай –
Эту смесь зовут « гремучей».
Демонстрация видеофрагмента «Взрыв гремучего газа»
6) Химические свойства водорода (слайд 22-23).
Учитель организует фронтальную работу по изучению химических свойств водорода и подводит к выводу об ОВ свойствах водорода
Учащиеся по очереди выходят к доске и записывают уравнения реакций, отражающих основные химические свойства водорода.
• 2Н2 + О2 = 2Н2О
• 3H2 + N2 = 2NH3
• H2 + 2Na = 2NaH
• H2 + Ca = CaH2
• CuO + H2 = Cu + H2O
7) Применение водорода (слайд 24-27).
Учитель организует дискуссию, а учащиеся отвечают на вопросы:
• Какие свойства водорода находят применение в современном мире и в прошлые столетия?
• Чем опасен водород?
8) Этап закрепления новых знаний (10 мин.)
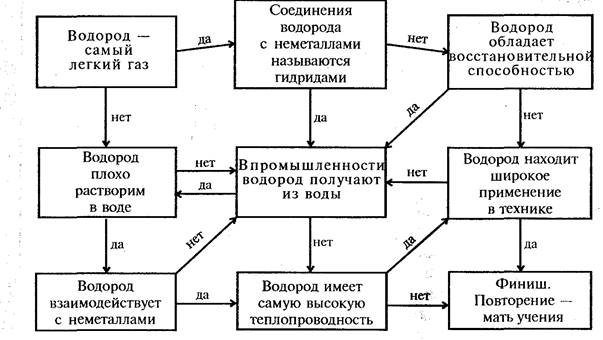
Задание 1(слайд 28): Найдите путь, который приведет вас к финишу. Начните прохождение лабиринта с верхней левой клетки. Если суждение, вписанное в эту клетку, правильно, то продолжаете путь по стрелке с обозначением «да». Если данное суждение ошибочно, то вам следует продолжить путь по стрелке с обозначением «нет». Для полного усвоения сведений, приведенных в лабиринте, выбирайте в качестве исходных разные клетки лабиринта.
Задание 2 (слайд 29-30): Как называются вещества: H2O, NH3, H2S ? В каком из предложенных веществ
массовая доля водорода наибольшая?
ω (Н) = 2*1/ 18 = 0,11 = 11% в H2O
ω (Н) = 3*1/ 17 = 0,18 = 18% в NH3
ω (Н) = 2*1/ 34 = 0,06 = 6% в H2S
Массовая доля водорода наибольшая в NH3
Задание 3(слайд 31-32): «Телеграмма»
Напишите пропавшие вещества и расставьте коэффициенты (выполняется самостоятельно по вариантам).
1 вариант
Мg + ……… = MgH2
….. + H2 = H2S
Al + HCI = ……….
Fe3O4 + H2 = Fe +…..
2 вариант
…….. + H2 = KH
H2 + …….. = H2 O
Zn + H2 SO4 = ……..
WO3 + H2 = W + ….
Котрольный тест.
Задание. Необходимо выбрать правильные утверждения. В рабочей тетради в столбик проставьте цифры с 1 по 12. Если вы согласны с утверждением, ставьте напротив цифры плюс, если нет, то минус.
Учитель зачитывает утверждения.
1. Водород – самый распространённый элемент во Вселенной.
2. Водород - самый распространённый газ на Земле.
3. Основным соединением водорода на нашей планете является вода.
4. Благодаря водороду есть жизнь на Земле.
5. Степень окисления водорода равна +2.
6. Формула простого вещества водорода Н2.
7. Газ водород обладает наименьшей среди всех веществ молекулярной массой.
8. Газообразный водород хорошо растворим в воде.
9. Водород в смеси с кислородом взрывоопасен.
10. Чтобы собрать водород, пробирку надо держать отверстием вверх.
11. Водород можно собрать методом вытеснения воды.
12.Водород помогает получать металлы
Учитель зачитывает ответы, учащиеся проверяют и оценивают: без единой ошибки – «5», 1 ошибка – «4», 2 ошибки – «3», 3 и более ошибок - неудовлетворительно.
9) Рефлексия (4 мин.)
Учитель создаёт условия для заключительной рефлексии:
Выберите подходящее словосочетание, чтобы определить ваше отношение к сегодняшнему уроку (слайд 35): .
Важная тема Урок понравился
Есть вопросы Ничего не понятно
Здорово Мне было интересно
Было скучно Легкая тема
Ничего особенного Оценка урока - хорошо
Оценка урока – отлично Доволен оценкой
Я молодец!
10) Информация о домашнем задании – слайд 34(1 мин.)
• Конспект (читать)
• Запишите уравнения химических реакций, осуществив следующие превращения:
H2 → CaH2 → H2 → H2S
↓
Ca (OH)2
• Рассчитайте объем водорода (н.у.), который потребуется для восстановления оксида меди (II) массой 127 кг, содержащего 8% посторонних примесей.
• Подготовить сообщения по темам (по желанию)
«Водород во Вселенной»,
«Старинные способы получения водорода»,
«Из истории развития воздухоплавания».
Оценка «5» - если выполнены 1-3 задание, оценка «4» - 1,2 задание, оценка «3» - 1 задание.
Литература
1. Кузьменко Н.Е., Еремин В.В. Химия. Пособие для 8-11 классов средней школы. – М.: Экзамен, 2002. – 448с.
2. Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. Настольная книга учителя. Химия. 9 класс. – М.: Дрофа, 2003. – 400с.
3. Габриелян О.С., Смирнова Т.В. Изучаем химию в 9 классе: дидактическое пособие к учебнику О.С. Габриеляна «Химия-9» для учащихся и учителей. – М.: БЛИК и К, 2004. – 224с.
4. Шукайло А.Д. Тематические игры по химии. 8 класс. Методическое пособие для учителя. – М.: ТЦ Сфера, 2004. – 96с.
Приложение 1
Инструктивная карта
Опорный конспект
|
Открытие простого вещества
|
||||||||||||||||
|
В природе: - Водород составляет % массы солнца - На Земле – % - В свободном виде – в газах нефтяных скважин, в верхних слоях атмосферы. -В воде. -В органических соединениях, в белках, жирах, углеводах - %. - Из водорода состоят межзвездный газ и газовые туманности (во вселенной - %). |
Строение атома атом Н: Порядковый номер – Группа – Период – z = , p+ = , n0= e = , Ar =
Электронная формула:
Металл (неметалл) |
|||||||||||||||
|
Изотопы водорода:
|
Водород – простое вещество – H2 Степень окисления = Связь - Электронная формула – Структурная формула - Перекрываются две
s – s связи |
|||||||||||||||
|
||||||||||||||||
|
Получение водорода |
|||
|
В лаборатории |
В промышленности |
||
|
|
|
||
|
Способы собирания |
|
|
В) А) Б)
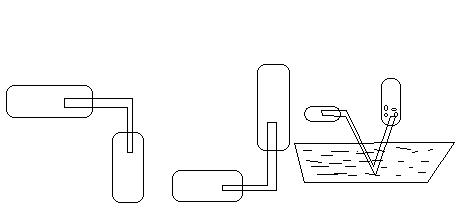
|
Вытеснением воздуха |
Вытеснением Воды (над водой) |
Химические свойства
|
Взаимодействие с веществами |
Уравнения реакций |
Продукт реакции |
|
С металлами |
|
|
|
С кислородом |
|
|
|
С галогенами (с фтором взрывается, с хлором и бромом реагирует при освещении или нагревании, в йодом – только при нагревании |
|
|
|
С азотом (при нагревании и давлении) |
|
|
|
С серой (при нагревании) |
|
|
|
С углеродом |
|
|
|
С оксидами металлов |
|
|
Применение водорода
|
Свойства водорода |
Применение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Домашнее задание
1) Конспект (читать)
2) Запишите уравнения химических реакций, осуществив следующие превращения:
H2 → CaH2 → H2 → H2S
↓
Ca (OH)2
3) Рассчитайте объем водорода (н.у.), который потребуется для восстановления оксида меди (II) массой 127 кг, содержащего 8% посторонних примесей.
4) Подготовить сообщения по темам (по желанию)
«Водород во Вселенной»,
«Старинные способы получения водорода»,
«Из истории развития воздухоплавания».
Оценка «5» - если выполнены 1-3 задание, оценка «4» - 1,2 задание, оценка «3» - 1 задание.
“Кроссворд”
Работайте в парах.
Ключевым словом является название ближайшей к Земле звезды, на которой преобладает химический элемент водород. Каждое предложенное химическое явление подтвердите соответствующими уравнениями химических реакций.
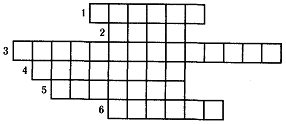
1. Сложные вещества, при взаимодействии которых с водородом получают металлы.
2. Вещество, которое образуется при горении водорода в кислороде.
3. Кислоты, состоящие из атомов водорода и другого химического элемента.
4. Кислота, которая легко разлагается на оксид углерода (IV) и воду.
5. Металл, непосредственно взаимодействующий с водородом.
6. Кислота, по уровню производства которой можно судить о мощности химической промышленности страны.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.