
Спецификация контрольной работы для промежуточной аттестации
(I полугодие) за курс 8 класса по предмету «Химия»
Материалы предназначены для проведения промежуточной аттестации обучающихся, осваивающих основные образовательные программы основного общего образования в форме семейного образования, по предмету
«Химия» за курс 8-го класса.( I полугодие)
Содержание и основные характеристики КИМ для промежуточной аттестации по химии разработаны на основе следующих документов:
· Федеральный государственный образовательный стандарт основного общего образования (приказ Минобрнауки России от 17.12.2010 № 1897).
· Примерная основная образовательная программа основного общего образования, одобренная решением федерального учебно-методического объединения по общему образованию (протокол от 08.04.2015 № 1/15); реестр примерных программ: http://fgosreestr.ru.
· О сертификации качества педагогических тестовых материалов (приказ Минобразования России от 17.04.2000 № 1122).
При проведении контрольной работы предусматривается строгое соблюдение порядка организации и проведения диагностики.
К каждому варианту проверочных работ должны прилагаться следующие материалы:
· периодическая система химических элементов Д.И. Менделеева;
· таблица растворимости солей, кислот и оснований в воде;
· электрохимический ряд напряжений металлов.
Во время выполнения работы разрешается использовать непрограммируемый калькулятор.
На выполнение работы отводится 40-45 минут, включая пятиминутный перерыв для разминки глаз (на рабочем месте).
Проверочные материалы включают в себя две проверочные работы.
Проверочные работы сконструированы таким образом, чтобы обеспечить проверку всех содержательных тем курса химии 8-го класса.
· Контрольная работа включает темы раздела «Первоначальные химические понятия».
В работах используются задания с выбором ответа, в которых необходимо указать верный ответ, и задания с кратким ответом, в которых ответ необходимо записать в виде числа или набора цифр.
В контрольной работе контролируются следующие умения:
· владение понятийным аппаратом курса химии 8-го класса;
· объяснение химических явлений с использованием имеющихся теоретических знаний;
· решение расчётных задач.
Задание с выбором ответа или с кратким ответом считается выполненным, если выбранный учащимся номер ответа совпадает с эталоном За правильное выполнение задания ставится 1 балл.
Часть заданий с кратким ответом оцениваются в 0, 1 или 2 балла. Эти задания оцениваются в 2 балла, если верно указаны все элементы ответа, в 1 балл, если одна цифра в указанной последовательности записана неверно, и в 0 баллов в других случаях.
Максимальный балл за выполнение контрольной работы – 25,
Шкала перевода первичного балла за выполнении контрольной работы в отметку по 5-ной шкале
|
Отметка по 5-ной шкале |
2 |
3 |
4 |
5 |
|
Первичный балл |
0-11 |
12-16 |
17-21 |
22-25 |
Используются следующие условные обозначения:
Тип задания: ВО – задания с выбором ответа, КО – задания с кратким ответом.
|
№ |
Контролируемые элементы содержания |
Контролируемые требования к уровню подготовки обучающихся |
Тип задания |
Макс. балл |
|
Проверочная работа 1. Первоначальные химические понятия и теоретические представления |
||||
|
1 |
Атомы и молекулы. Химический элемент |
Знать характерные признаки важнейших химических понятий |
КО |
2 |
|
2 |
Простые и сложные вещества |
Определять состав веществ по их формулам |
ВО |
1 |
|
3 |
Простые и сложные вещества |
Классифицировать состав веществ по их формулам |
КО |
2 |
|
4 |
Чистые вещества и смеси |
Определять/классифицировать состав веществ по их формулам |
КО |
2 |
|
5 |
Разделение смесей и очистка веществ |
Обращаться с химической посудой и лабораторным оборудованием |
КО |
2 |
|
6 |
Валентность химических элементов |
Определять валентность элемента в соединении |
ВО |
1 |
|
7 |
Химическая реакция. Условия и признаки протекания химических реакций |
Определять/классифицировать типы химических реакций |
ВО |
1 |
|
8 |
Химические уравнения |
Составлять уравнения химических реакций |
ВО |
1 |
|
9 |
Сохранение массы веществ при химических реакциях |
Знать смысл основных законов и теорий химии: закон сохранения массы веществ |
ВО |
1 |
|
10 |
Классификация химических реакций по различным признакам: числу и составу исходных и полученных веществ |
Определять/классифицировать типы химических реакций |
ВО |
1 |
|
11 |
Классификация химических реакций по различным признакам: поглощению и выделению энергии |
Определять/классифицировать типы химических реакций |
КО |
2 |
|
12 |
Проведение расчётов на основе формул и уравнений реакций |
Знать/понимать важнейшие химические понятия: относительные атомная и молекулярная массы, моль, молярная масса, молярный объём |
КО |
1 |
|
13 |
Проведение расчётов на основе формул и уравнений реакций |
Знать/понимать важнейшие химические понятия: относительные атомная и молекулярная массы, моль, молярная масса, молярный объём |
КО |
1 |
|
14 |
Приготовление растворов |
Обращаться с химической посудой и лабораторным оборудованием |
КО |
2 |
|
15 |
Правила безопасной работы в школьной лаборатории |
Обращаться с химической посудой и лабораторным оборудованием |
КО |
2 |
|
16 |
Лабораторная посуда и оборудование |
Обращаться с химической посудой и лабораторным оборудованием |
КО |
2 |
|
17 |
Вычисление массовой доли растворённого вещества в растворе |
Вычислять массовую долю вещества в растворе |
КО |
1 |
![]() Установите соответствие между описанием модели и обозначением: для каждой позиции,
обозначенной буквой, выберите соответствующую позицию, обозначенную цифрой.
Установите соответствие между описанием модели и обозначением: для каждой позиции,
обозначенной буквой, выберите соответствующую позицию, обозначенную цифрой.
|
|
ОПИСАНИЕ МОДЕЛИ |
|
ОБОЗНАЧЕНИЕ |
|
А) |
3 атома водорода |
1) |
H2 |
|
Б) |
3 молекулы водорода |
2) |
3H |
|
В) |
молекула водорода |
3) |
3H2 |
|
|
|
4) |
H |
Запишите в таблицу номера выбранных ответов под соответствующими буквами.
|
|
А |
Б |
В |
|
Ответ: |
|
|
|
![]() Определите утверждение, в котором
речь идёт о железе как простом
веществе.
Определите утверждение, в котором
речь идёт о железе как простом
веществе.
|
1) |
Железо входит в состав гемоглобина крови. |
|
2) |
Массовая доля железа в земной коре равна 4 %. |
|
3) |
Порядковый номер железа равен 26. |
|
4) |
Железо обладает магнитными свойствами. |
![]() Из предложенного перечня
веществ выберите три, которые являются сложными.
Из предложенного перечня
веществ выберите три, которые являются сложными.
|
1) |
CO |
2) |
N2 |
3) |
H2O |
4) |
CO2 |
5) |
O3 |
![]() Укажите два
верных ответа.
Укажите два
верных ответа.
Что из перечисленного ниже не является смесью?
|
1) |
молоко |
|
2) |
воздух |
|
3) |
аммиак |
|
4) |
родниковая вода |
|
5) |
железо |
![]() Выберите три действия, которые производятся при разделении смеси поваренной соли с мелом,
и установите их последовательность.
Выберите три действия, которые производятся при разделении смеси поваренной соли с мелом,
и установите их последовательность.
|
1) |
перегонка |
|
2) |
выпаривание |
|
3) |
отстаивание |
|
4) |
растворение в воде |
|
5) |
фильтрование |
Запишите в ответе соответствующую последовательность трёх цифр. Ответ: .
![]() Валентность кремния в соединении SiH 4
Валентность кремния в соединении SiH 4
такая же, как у серы в соединении:
|
1) |
Na 2S |
2) |
H 2S |
3) |
SO 2 |
4) |
SO3 |
![]() К химическим явлениям относится процесс:
К химическим явлениям относится процесс:
|
1) |
образования инея на ветках деревьев |
|
2) |
появления света при электрическом разряде |
|
3) |
появления удушливого газа при сжигании серы |
|
4) |
размягчения стекла при нагревании |
![]() Левой части
уравнения реакции CaO + 2HCl = … соответствует правая часть:
Левой части
уравнения реакции CaO + 2HCl = … соответствует правая часть:
|
1) |
… CaCl2 + H2 |
|
2) |
… CaH2 + ClO2↑ |
|
3) |
… CaCl2 + H2O |
|
4) |
… Ca(OH)2 + Cl2 |
![]() Расставьте коэффициенты в уравнении реакции,
схема которой
Расставьте коэффициенты в уравнении реакции,
схема которой
Fe + O2 ® Fe2O3
Коэффициент перед кислородом равен:
|
1) |
1 |
2) |
2 |
3) |
3 |
4) |
4 |
![]() Реакцией соединения является:
Реакцией соединения является:
|
1) |
4P + 5O2 = 2P2O5 |
|
2) |
СаCO3 = СаO + CO2 |
|
3) |
CН4 = С + 2H2 |
|
4) |
Cu(OH)2 = CuO + H2O |
![]() Установите соответствие между уравнением и типом реакции: для каждой позиции, обозначенной буквой,
выберите соответствующую позицию,
обозначенную цифрой.
Установите соответствие между уравнением и типом реакции: для каждой позиции, обозначенной буквой,
выберите соответствующую позицию,
обозначенную цифрой.
|
|
УРАВНЕНИЕ |
ТИП РЕАКЦИИ 1) экзотермическая реакция 2) эндотермическая реакция |
|
А) |
2Н2 + О2 = 2Н2О |
|
|
Б) |
С + О2 = СО2 |
|
|
В) |
2Н2О = 2Н2 +О2 |
|
|
Г) |
СН4 + 2О2 = СО2 + 2Н2О |
|
Запишите в таблицу номера выбранных ответов под соответствующими буквами.
|
|
А |
Б |
В |
Г |
|
Ответ: |
|
|
|
|
![]() Сколько моль вещества
содержится в 10 граммах водорода (H2)? Ответ запишите в виде целого числа.
Сколько моль вещества
содержится в 10 граммах водорода (H2)? Ответ запишите в виде целого числа.
Ответ: моль.
![]() Сколько граммов углерода
потребуется сжечь для получения 2,24 л (н.у.)
углекислого газа?
Сколько граммов углерода
потребуется сжечь для получения 2,24 л (н.у.)
углекислого газа?
В ответе запишите число с точностью до десятых. Ответ: г.
![]() Укажите два
верных ответа.
Укажите два
верных ответа.
Какое оборудование потребуется для приготовления раствора поваренной соли?
|
1) |
бумажный фильтр |
|
2) |
мерный цилиндр |
|
3) |
спиртовка |
|
4) |
стеклянный стакан |
|
5) |
делительная воронка |
![]() Среди перечисленных правил работы в лаборатории выберите
два, которые являются неверными.
Среди перечисленных правил работы в лаборатории выберите
два, которые являются неверными.
|
1) |
Горючие жидкости нельзя нагревать пламенем спиртовки. |
|
2) |
Любые вещества можно пробовать на вкус. |
|
3) |
При нагревании жидкости в колбе её не следует закрывать пробкой. |
|
4) |
Опыты по получению хлора можно не проводить в вытяжном шкафу. |
|
5) |
В лаборатории нельзя принимать пищу. |
![]() Установите соответствие
между названием лабораторного оборудования и его назначением: для каждой позиции, обозначенной буквой, выберите соответствующую позицию, обозначенную цифрой.
Установите соответствие
между названием лабораторного оборудования и его назначением: для каждой позиции, обозначенной буквой, выберите соответствующую позицию, обозначенную цифрой.
|
ОБОРУДОВАНИЕ |
|
НАЗНАЧЕНИЕ |
|
А) делительная воронка Б) спиртовка В) мерный цилиндр |
1) |
хранение легко воспламеняемых жидкостей |
|
2) |
хранение растворов |
|
|
|
3) |
нагревание |
|
|
4) |
разделение несмешивающихся жидкостей |
|
|
5) |
измерение объёма жидкости |
Запишите в таблицу номера выбранных ответов под соответствующими буквами.
|
|
А |
Б |
В |
|
Ответ: |
|
|
|
![]() В 120 г воды растворили 30 г
соли. Чему равна массовая доля соли в этом растворе? Ответ запишите в виде целого числа.
В 120 г воды растворили 30 г
соли. Чему равна массовая доля соли в этом растворе? Ответ запишите в виде целого числа.
Ответ: %.
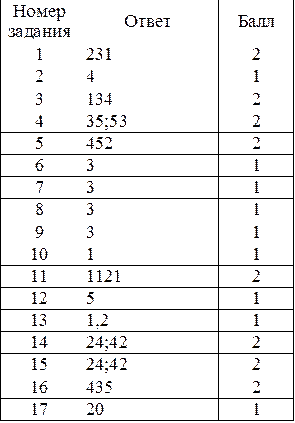 |
 |
||
Задания 1, 3–5, 11, 14–16 контрольной работы оцениваются в 2 балла, если верно указаны все элементы ответа, в 1 балл, если одна цифра в указанной последовательности записана неверно, и в 0 баллов в других случаях.
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.