
|
|
ДЕПАРТАМЕНТ ОБРАЗОВАНИЯ И НАУКИ Государственное бюджетное профессиональное образовательное учреждение «Брянский строительный колледж имени профессора Н.Е. Жуковского»
|
КОНТРОЛЬНО - ИЗМЕРИТЕЛЬНЫЕ МАТЕРИАЛЫ
Учебной дисциплины
ХИМИЯ
по профессиям:
|
|
54.01.20 Графический дизайнер.
08.01.24 Мастер столярно-плотничных, паркетных и стекольных работ
08.01.26 Мастер по ремонту и обслуживанию инженерных систем жилищно-коммунального хозяйства
15.01.05 Сварщик (ручной и частично механизированной сварки (наплавки )
23.01.08 Слесарь по ремонту строительных машин
Брянск
2020
|
РАССМОТРЕНО на заседании ПЦК Математических и естественнонаучных дисциплин Протокол №____ от «__»_____202__г. Председатель ПЦК _______ О.В.Симакова (подпись)
|
УТВЕРЖДАЮ И.о.заместителя директора по учебной работе ГБПОУ «Брянский строительный колледж имени профессора Н.Е. Жуковского» _______________С.А.Наумченко (подпись) «__»_________________202_г
|
Контрольно-измерительные материалы учебной дисциплины Химия /Сост. Евсеева Н.Л.– Брянск: ГБПОУ «Брянский строительный колледж имени профессора Н.Е. Жуковского», 2020.- 189 стр.
Контрольно-измерительные материалы (КИМы) по учебной дисциплине «Химия» разработаны на основе Федерального государственного образовательного стандарта среднего общего образования, Федерального государственного стандарта среднего профессионального образования
Разработчик:
Евсеева Н.Л. преподаватель ГБПОУ «Брянский строительный колледж имени профессора Н. Е. Жуковского»
Рецензент:
Жорова Татьяна Алексеевна, старший методист, преподаватель первой квалификационной категории ГБПОУ «Брянский строительный колледж имени профессора Н. Е. Жуковского»
© Евсеева Н.Л , 2020
© ГБПОУ «Брянский строительный колледж
имени профессора Н.Е.Жуковского», 2020.
«__»______________2020г
Пояснительная записка
Контрольно-измерительных материалов (КИМов) для выявления знаний и умений, уровня подготовки студентов учебной дисциплины «Химия» разработан на основе Федеральных государственных образовательных стандартов среднего профессионального образования для профессий:
54.01.20 Графический дизайнер.
08.01.24 Мастер столярно-плотничных, паркетных и стекольных работ
08.01.26 Мастер по ремонту и обслуживанию инженерных систем жилищно-коммунального хозяйства
15.01.05 Сварщик (ручной и частично механизированной сварки (наплавки )
23.01.08 Слесарь по ремонту строительных машин
формирование у обучающихся умения оценивать значимость химического знания для каждого человека;
формирование у обучающихся целостного представления о мире и роли химии в создании современной естественно-научной картины мира; умения объяснять объекты и процессы окружающей действительности: природной, социальной, культурной, технической среды, — используя для этого химические знания;
развитие у обучающихся умений различать факты и оценки, сравнивать оценочные выводы, видеть их связь с критериями оценок и связь критериев с определенной системой ценностей, формулировать и обосновывать собственную позицию;
приобретение обучающимися опыта разнообразной деятельности, познания и самопознания; ключевых навыков, имеющих универсальное значение для различных видов деятельности (навыков решения проблем, принятия решений, поиска, анализа и обработки информации, коммуникативных навыков, навыков измерений, сотрудничества, безопасного обращения с веществами в повседневной жизни).
Освоение содержания учебной дисциплины «Химия», обеспечивает достижение студентами следующих результатов:
личностных:
чувство гордости и уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами;
готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом;
умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности;
метапредметных:
использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов.
• предметных:
сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач
владение основополагающими химическими понятиями теориями,законами и закономерностями; уверенное пользование химической терминологией и символикой;
владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач;
сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям;
владение правилами техники безопасности при использовании химических веществ; сформированность собственной позиции по отношению к химической информации, получаемой из разных источников.
2. Модель контроля
Учебная дисциплина: Химия
на 1-2-3 й семестр.
Фонд учебного времени: 114 часов
|
Наименование разделов и тем. |
Виды контроля |
Формы контроля |
|
Тема 1.1.1.Основные понятия и законы химии |
ТК |
Устный опрос Пракическая раб. №1 Решение задач№1
|
|
Тема1.2.1.. Периодический закон Д.И.Менделеева |
ТК |
Тест№1 Практическая работа №2 |
|
Тема1.2.2.Строение атома. |
ТК |
Практическая работа №3 |
|
Тема1.3.1Химическая связь. |
ТК |
Тест№2 |
|
Тема 1.4.2. Теория электролитической диссоциации |
ТК |
Решение задач№2, письменная работа№1 |
|
Тема 1.5.4.Соли и их свойства |
РК |
Зачет №1 Лабораторная работа№1 |
|
Тема 1.6.1.Классификация химических реакций |
ТК |
Тест№4 |
|
Тема 1.6.2.Окислительно-восстановительные реакции |
ТК |
Практическаяработа№6 Письменная работа №4 (дидакт.карточки) Лабораторная работа №2
|
|
Тема 1.6.3.Скорость химических реакций |
ТК |
Письменная работа №5 Практическая работа |
|
Тема 1.7.1.Металлы |
ТК |
Лаб. работа №3 Тест №5 Практическая работа |
|
Тема 1.8.Контроль и обобщение |
РК |
Контрольная работа №1. |
|
Тема 2.2.1.Алканы |
ТК |
Практическая раб№5. Письменная работа№6 (задачи,номенклатура)
|
|
Тема 2.2.2.Алкены, алкины |
ТК |
Письменная работа№7 (номенклатура, св-ва) Практическая работа |
|
Тема 2.2.5. Природные источники углеводородов |
РК |
Зачет№2 |
|
Тема 2.3.1.Спирты |
ТК |
Письменная работа№8 |
|
Тема2.3.2. Альдегиды и карбоновые кислоты |
ТК |
Тест№6. Лабор.раб.№4 |
|
Тема 2.3.3.Сложные эфиры и жиры |
ТК |
Лаб.раб.№5 Тест№7 |
|
Тема 2.3.4.Контроль и обобщение знаний |
РК |
Контрольная работа№2 |
|
Тема2.3.5.Углеводы |
ТК |
Тест№8 Лабораторная работа |
|
Тема 2.4.1.Амины. Аминокислоты. Белки. |
ТК |
Лабораторная работа №6 Тест№8 |
|
Тема2.4.2.Итоговая аттестация |
РК |
Дифференцированный зачет |
3. Кодификатор содержания заданий учебной дисциплины
«Химия»
(для всех профессий)
|
№п/п |
Наименование дидактических единиц по учебной дисциплине (из ФГОС знать и уметь) |
Формы контроля |
Номер заданий |
|
1. 1.1. |
Знать/понимать: важнейшие химические понятия
|
Решение задач№1 Письменная раб.№1 |
№1 |
|
1.2. |
основные законы и теории химии |
Тест№1 |
№1-12 |
|
1.3. |
важнейшие вещества и материалы. |
Тест №6-8 |
|
|
2. |
Уметь: |
|
|
|
2.1. |
называть изученные вещества по тривиальной или международной номенклатуре; |
Практич. раб.№4
|
№1-4 |
|
2.2. |
определять/классифицировать: валентность, степень окисления химических элементов, заряды ионов; вид химических связей в соединениях и тип кристаллической решетки; характер среды водных растворов веществ; окислитель и восстановитель; принадлежность веществ к различным классам неорганических и органических соединений; гомологи и изомеры; химические реакции в неорганической и органической химии (по всем известным классификационным признакам); |
Практ.раб.№3 Тест№4 Письменная раб.№3 Тест№2 Практическая раб№5. Письменная работа№6 (задачи,номенклатура) Письменная работа№7 (номенклатура,св-ва) |
№1-15
№1 |
|
2.3. |
характеризовать: |
Письменная работа№8 Тест№6. Лабор.раб.№4 Лаб.раб.№5 Тест№7 |
№1-5 |
|
2.4. |
объяснять: зависимость свойств химических элементов и их соединений от положения элемента в Периодической системе Д.И. Менделеева; природу химической связи (ионной, ковалентной, металлической, водородной); зависимость свойств неорганических и органических веществ от их состава и строения; сущность изученных видов химических реакций (электролитической диссоциации, ионного обмена, окислительно-восстановительных) и составлять их уравнения; влияние различных факторов на скорость химической реакции и на смещение химического равновесия; |
Тест№1 Тест№2 Прак. раб.№2 Решение задач№2, письменная работа№1 Тест№4 Письменная работа №5 Тест №5 |
№1-10 |
|
2.5. |
планировать/проводить: эксперимент по получению и распознаванию важнейших неорганических и органических соединений, с учетом приобретенных знаний о правилах безопасной работы с веществами в лаборатории и в быту; вычисления по химическим формулам и уравнениям |
Лаб. работы№ 1-8 Практ. работы№1,3
|
№1-4 №1-6 |
Критерии оценки различных форм контроля.
1. Оценка устного ответа.
Отметка «5»:- ответ полный и правильный на основании изученных теорий;
-материал изложен в определенной логической последовательности, литературным языком;
-ответ самостоятельный.
Ответ «4»:- ответ полный и правильный на сновании изученных теорий;
- материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «З»:- ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2»:- при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя, отсутствие ответа.
Отметка «1»: - отсутствие ответа
2. Оценка лабораторных работ.
- Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу.
Отметка «5»:- работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
- эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
- проявлены организационно - трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы).
Отметка «4»:- работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:- работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:- допущены две (и более) существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя;
Отметка «1»: работа не выполнена, у учащегося отсутствует экспериментальные умения.
3. Оценка умений решать расчетные задачи.
Отметка «5»:- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:- в логическом рассуждении и решения нет существенных ошибок, но задача решена нерациональным способом, или допущено не более двух несущественных ошибок.
Отметка «3»:- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:- имеется существенные ошибки в логическом рассуждении и в решении.
- отсутствие ответа на задание.
Отметка «1»: - не приступил к решению задачи
4. Оценка письменных самостоятельных работ.
Отметка «5»:- ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:- ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:- работа выполнена не менее чем наполовину, допущена одна существенная ошибка и при этом две-три несущественные.
Отметка «2»:- работа выполнена меньше чем наполовину или содержит несколько существенных ошибок.
Отметка «1»: - работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
5. Оценка тестовых работ.
Тесты, состоящие из пяти вопросов можно использовать после изучения каждого материала (урока). Тест из 10—15 вопросов используется для текущего контроля. Тест из 20—30 вопросов необходимо использовать для итогового контроля.
При оценивании используется следующая шкала: для теста из пяти вопросов
• нет ошибок — оценка «5»;
• одна ошибка - оценка «4»;
• две ошибки — оценка «З»;
• три ошибки — оценка «2».
Для теста из 30 вопросов:
• 25—З0 правильных ответов — оценка «5»;
• 19—24 правильных ответов — оценка «4»;
• 13—18 правильных ответов — оценка «З»;
• меньше 12 правильных ответов — оценка «2».
6.Оценка контрольной работы.
Часть А.Задание с выбором ответа считается выполненным верно, если учащийся указал код правильного ответа. Во всех остальных случаях задание считается невыполненным. Каждый правильный ответ оценивается 1 баллом.
Часть ВЗадание с кратким свободным ответом считается выполненным верно, еслиправильно указана последовательность цифр (число). За полный правильный ответ на задания В1-В4 ставятся 2 балла, за правильный неполный — 1 балл.
ЧастьС оценивается 3 баллами.
Обработка результатов контрольной работы.
Каждый вариант контрольной работы оценивается максимально 19
баллами. Примерная шкала перевода в пятибалльную систему оценки:
Оцеика «5»--17- 19 баллов (90-100%), оценка «4»-10-166баллов (66-90%) 7 -9
баллов (33- 65%) - «3», менее 6 баллов (до 32%) - «2».
Оценка реферата.
Реферат оценивается по следующим критериям:• соблюдение требований к его оформлению;
• необходимость и достаточность для раскрытия темы приведенной в тексте реферата информации;• умение обучающегося свободно излагать основные идеи, отраженные в реферате;
• способность обучающегося понять суть задаваемых членами аттестационной комиссии вопросов и сформулировать точные ответы.
Практическая работа №1
Тема: «Основные законы и понятия химии. Расчеты
по химическим формулам и уравнениям.
(время выполнения-1 час)
Задания для самостоятельной работы.
1.Определите массу:
а) молекулярного кислорода количеством вещества 2 моль.
Б) атомарного азота количеством вещества 0,01моль.
В) молекулярного хлора количеством вещества 3 моль.
Г) молекулярного фтора количеством вещества 2 моль.
2.Рассчитайте количество вещества:
а) фосфора массой 31гр.
б) железа массой 112гр. в) кальция массой 40 гр
г) калия массой 39гр.
3.Сколько молекул содержится:
а) в 98 граммах серной кислоты
б) в 4,9 граммах гидроксида меди
в) в 106 граммах карбоната натрия
г) в 72 граммах магния.
4.Определить:
а) плотность кислорода по воздуху (молекулярная масса воздуха-29)
б)плотность углекислого газа по воздуху.
В) плотность кислорода по водороду (молекулярная масса водорода-2)
г) плотность азота по водороду.
Решение задач по теме
«Основные законы и понятия химии. Расчеты
по химическим формулам и уравнениям.»
(Время выполнения—20 минут)
Вариант№1.
1.Определить массу молекулярного кислорода количеством вещества 4 моль.
2.Рассчитайте количество вещества натрия массой 69 гр.
3.Сколько молекул содержится в 54 граммах алюминия.
Вариант№2.
1.Определить массу молекулярного азота количеством вещества 2 моль.
2.Рассчитайте количество вещества фосфора массой 62гр.
3.Сколько молекул содержится в 38граммах фтора.
Вариант№3.
1.Определить массу молекулярного хлора количеством вещества 2 моль.
2.Рассчитайте количество вещества кальция массой 80 гр.
3.Сколько молекул содержится в 56 граммах кремния.
Вариант№4
1.Определить массу молекулярного азота количеством вещества 4 моль.
2.Рассчитайте количество вещества калия массой 78гр.
3.Сколько молекул содержится в 72 граммах магния.
Вариант№5
1.Определить массу молекулярного фтора количеством вещества 2 моль.
2.Рассчитайте количество вещества цинка массой 65гр.
3.Сколько молекул содержится в 27 граммах бер.иллия
Вариант№6
1.Определить массу молекулярного водорода количеством вещества 2 моль.
2.Рассчитайте количество вещества меди массой 128г.
3.Сколько молекул содержится в 96 граммах серы.
Вариант№7
1.Определить массу молекулярного кислорода количеством вещества 3 моль.
2.Рассчитайте количество вещества алюминия массой 54 гр.
3.Сколько молекул содержится в 69 граммах натрия.
Вариант№8
1.Определить массу молекулярного хлора количеством вещества 2 моль.
2.Рассчитайте количество вещества фосфора массой 62гр.
3.Сколько молекул содержится в 48граммах магния.
Вариант№9
1.Определить массу молекулярного азота количеством вещества 3моль.
2.Рассчитайте количество вещества стронция массой 88 гр.
3.Сколько молекул содержится в 112граммахжелеза.
Вариант№10
1.Определить массу молекулярного фтора количеством вещества 3 моль.
2.Рассчитайте количество вещества хрома массой 104гр.
3.Сколько молекул содержится в 62 граммах фосфора.
Критерии оценки умений решать расчетные задачи.
Отметка «5»:- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:- допущено не более двух несущественных ошибок или решено правильно две задачи из трех.
Отметка «3»:- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах, правильно решена только одна задача из трех.
Отметка «2»: -не решена ни одна задача из задач.
Практическая работа №2
Тема: «Периодический закон Д.И.Менделеева в свете теории строения атома.
Составление электронных формул атомов.»
Задания для самостоятельной работы.
1.Определите период, ряд , группу, в которых находятся элементы с порядковыми номерами
14, 24, 52, 63, 76, 101.
2.Элемент побочной подгруппы имеет высший оксид RO3. Образует ли этот элемент газообразное соединение с водородом?
3.У какого из элементов седьмой группы, у хлора или иода, сильнее выражены неметаллические свойства? Почему?
4.У какого из элементов первой группы, у калия или цезия ,сильнее выражены металлические свойства?Почему?
5.Пользуясь периодической системой Д.И.Менделеева,укажите формулы высших оксидов элементов: марганца,ванадия, германия.
6.Назовите элемент по следующим данным:
А) элемент четвертого периода, высший оксид R2 O7 , с водородом образует газообразное соединение HR.
Б) элемент пятого периода, высший оксид RO2 , с водородом газообразное соединение не образует.
В) элемент четвертого периода, высший оксид RO, с водородом дает солеобразное соединение RH2.
7.Найдите в периодической таблице элемент, расположенный в четвертом периоде,в пятом ряду, проявляющий высшую валентность по кислороду равную шести. Какова его валентность по водороду?
8.Какой гидроксид является более сильным основанием:Ca(OH)2 или Ba(OH)2; Na(OH) или K(OH)Более сильной кислотой:H2 SO4 или H2 TeO4; H3 AsO4 или H3 PO4?
9.По формулам высших соединений определите номер группы элемента:
RO2 , R2 O7 , R2 O5 , RH3, HR.
10.Определить число протонов, электронов, нейтронов атомов: стронция, олова, марганца, мышьяка, титана.
11.Cреди приведенных ниже конфигураций укажите возможные и невозможные:а)1р2 б)4s2в)5f14г)3d3д)4p5
№12.Составьте электронные и графические формулы элементов, расположенных
А) в шестой группе,3периода
б)в четвертой группе,пятом ряду 4 периода
в)в седьмой группе 2 периода
№13.Найти элементы в таблице:
а)…3s23р3
б)…4s1
в)…3d14s2
г)…4s24p
д)…5s2
№14. Выберите d- элемент:
Ca , Al, Si , Ti , Mg
№15Найти элемент, стоящий в 4 группе главной подгруппе:
а)…3s2 3p6
б)…4s2
в)…2s22p5
г)…4s24p2
д)…3d24s2
№16.Выберите элемент, образующий оксид R2O5
а)…3s2
б)…3s23p3
в)…4s24p2
Тесты по теме: «Периодический закон в свете строения атома»
(Время выполнения-30 минут)
Вариант №1
Выберите один правильный ответ.
1.Сколько протонов, нейтронов и электронов имеет атом селена?
А – число протонов=79, число нейтронов=79, число электронов=34
В – число протонов=34, число нейтронов=34, число электронов=45
С – число протонов=45, число нейтронов=79, число электронов=45
D – число протонов=34 число нейтронов=45, число электронов=34
2. Сколько нейтронов имеет изотоп водорода, дейтерий?
А) –0 В) – 2 С) – 3 D) – 1
3 Какую конфигурацию внешнего электронного уровня имеет атом мышьяка?
А –3S2 3P2
В – 4S2 4p2
С – 4S2 4p3
D – 4S2 4p5
.
4 Какой элемент имеет следующую электронною конфигурацию 6S26P2
А) – Pd В) – Pb С) – Po D) – Br
5. Какой элемент имеет следующую формулу оксида R2 O7
А) Ca В) – Sr С) – Br D) – As
6. Какой из атомов в основном состоянии имеет два неспаренных электрона на внешнем уровне?
А – бор
В – магний
С – углерод
D – цинк
7.Выберете p—элемент 4 группы
А) – 4S2 4P5 В) – 3d5 4S2 С) – 3S2 3P3 D) 4S2 4P2
8. Металлические свойства в периоде слева направо…..
А – увеличиваются
В – уменьшаются
С – не меняются
D –уменьшаются, начиная с 4-ого
9. Металлические свойства в группе сверху вниз…..
А – увеличиваются
В – уменьшаются
С – не меняются
D –уменьшаются только в главных подгруппах
10 Какова максимальная положительная степень окисления германия?
А) – +6 В) – 0 С) – +2 D) – +4
11. Радиус какого атома больше Al или Cl?
А – Al
В – Cl
С – равны
D – нельзя сравнить
12.Назовите элемент по следующим данным:
3 период, высший оксид R2 O5, с водородом образует газообразное соединение RH3
Вариант №2
Выберите один правильный ответ.
1.Сколько протонов, нейтронов и электронов имеет атом брома?
А – число протонов=79, число нейтронов=79, число электронов=34
В – число протонов=35, число нейтронов=45, число электронов=35
С – число протонов=45, число нейтронов=79, число электронов=45
D – число протонов=79, число нейтронов=45, число электронов=34
2. Сколько нейтронов имеет изотоп кислорода—17?
А) –6 В)—7 С) – 8 D)—9
3 Какую конфигурацию внешнего электронного уровня имеет атом алюминия
А –3S2 3P3
В –3S2 3P5
C—3S2 3P1
D – 4s24p5
.
4 Какой элемент имеет следующую электронною конфигурацию 5S25P3
А) – Pd В) – Sb С) – Po D) – Br
5. Какой элемент имеет следующую формулу оксида R O2
А) – Mn В) – Sr С) – Br D) Ge
6 Какой из атомов в основном состоянии имеет три неспаренных электрона на внешнем уровне?
А – бор
В – магний
С –азот
D – цинк
7. Выберете S—элемент 5 периода
А) – 5S1 В) – 5S2 5P4 С) – 4d3 5S2 D) – 4S1
8. Металлические свойства в периоде справа налево…
А – увеличиваются
В – уменьшаются
С – не меняются
D –уменьшаются, начиная с 4-ого периода
9. Металлические свойства в группе снизу вверх….
А – увеличиваются
В – уменьшаются
С – не меняются
D –уменьшаются только в главных подгруппах
10 Какова максимальная положительная степень окисления селена?
А) – +6 В) – 0 С) – +2 D) – +4
11. Радиус какого атома больше Be или F?
А—Be
В – F
С – равны
D – нельзя сравнить
12.Назовите элемент по следующим данным:
5 период, высший оксид RO, с водородом образует твердое соединение –гидрид.
Вариант №3
Выберите один правильный ответ.
1. Сколько протонов, нейтронов и электронов имеет атом олова?
А – число протонов=50, число нейтронов=69, число электронов=50
В – число протонов=119, число нейтронов=50, число электронов=50
С – число протонов=69, число нейтронов=69, число электронов=119
D – число протонов=50, число нейтронов=50, число электронов=69
2. Сколько нейтронов имеет изотоп цезия—137?
А –75 В—82 С – 80 D—55
3 Какую конфигурацию внешнего электронного уровня имеет атом брома?
А –3S2 3P3
В –3S2 3P5
C—3S2 3P1
D – 4S2 4p5
.
4 Какой элемент имеет следующую электронною конфигурацию 6S2 6P4
А) – Pd В) – Sb С) – Po D) – Сr
5. Какой элемент имеет следующую формулу оксида R2 O3
А) Al В) – Sr С) – Br D) Ge
6 Какой из атомов в основном состоянии имеет семь электронов на внешнем уровне?
А – фосфор
В – иод
С –скандий
D – олово
7.Выберете p-элемент 3 периода
А) – 5S2 В) – 3S2 3P3 С) – 2S2 2P5 D) – 7S1
8. Неметаллические свойства в периоде справа налево…
А – увеличиваются
В – уменьшаются
С – не меняются
D –уменьшаются, начиная с 4-ого периода
9. Неметаллические свойства в группе снизу вверх….
А – увеличиваются
В – уменьшаются
С – не меняются
D –уменьшаются только в главных подгруппах
10 Какова максимальная положительная степень окисления магния?
А) – +6 В) – 0 С) – +2 D) – +4
11. Радиус какого атома больше P или As?
А—As
В – P
С – равны
D – нельзя сравнить
12.Назовите элемент по следующим данным:
3 период, 4группа, с водородом образует газообразное соединение RH4
Вариант №4
Выберите один правильный ответ.
1. Сколько протонов, нейтронов и электронов имеет атом мышьяка?
А – число протонов=33, число нейтронов=42 число электронов=33
В – число протонов=119, число нейтронов=50, число электронов=50
С – число протонов=69, число нейтронов=69, число электронов=119
D – число протонов=33, число нейтронов=42, число электронов=69
2. Сколько нейтронов имеет изотоп стронция-90?
А –38 В—40 С – 50 D—52
3 Какую конфигурацию внешнего электронного уровня имеет атом фосфора?
А –3S2 3P3
В –3S2 3P5
C—3S2 3P1
D – 4S2 4p5
.
4 Какой элемент имеет следующую электронною конфигурацию 3S2 3P4
А) – S В) – Sb С) – Po D) – Сr
5. Какой элемент имеет следующую формулу оксида R O3
А) – Mn В) – Sr С) – Se D) Ge
6 Какой из атомов в основном состоянии имеет пять электронов на внешнем уровне?
А – бор
В – магний
С –азот
D – цинк
7. Выберете d-элемент 4 группы
А) – 3S2 3P4 В) – 4S2 4P1 С) – 3d5 4S2 D) – 4d2 5S2
8. Неметаллические свойства в периоде слева направо…
А – увеличиваются
В – уменьшаются
С – не меняются
D –уменьшаются, начиная с 4-ого периода
9. Неметаллические свойства в группе сверху вниз
А – увеличиваются
В – уменьшаются
С – не меняются
D –уменьшаются только в главных подгруппах
10 Какова максимальная положительная степень окисления скандия?
А) – +6 В) – 0 С) – +2 D) – +3
11. Радиус какого атома меньше O или S?
А—S
В – O
С – равны
D – нельзя сравнить
12. Назовите элемент по следующим данным:
5 период, 6 группа, с водородом газообразного соединения не образуе
Ключ к тесту по теме «Периодический закон Д.И.Менделеева»
|
№вопроса |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
1вариант |
D |
D |
C |
B |
C |
C |
D |
B |
A |
D |
A |
P |
|
2вариант |
B |
D |
C |
B |
D |
C |
A |
A |
B |
A |
A |
Sr |
|
3вариант |
A |
B |
D |
C |
A |
B |
B |
B |
A |
C |
A |
Si |
|
4вариант |
A |
D |
A |
A |
C |
C |
D |
A |
B |
D |
A |
Mo |
Система оценки:
За каждый правильный ответ-1балл.
Максимальное число баллов-12
10-12 баллов (80-100%)- оценка «5
7-9 баллов(60-75%)-оценка «4»
6 баллов(50%)-оценка «3»
Тест по теме «Химическая связь»
Время выполнения-30 мину
Выберите правильный ответ
1.С помощью ковалентной неполярной связи образованы все вещества ряда:
а)О3, N2, Н2, О2
б) 02, 03, СО, NH3
в) NH3, СО, С02, Н20
г) Н20, 02, N2, Н2
2.Ковалентная полярная связь и степени окисления атомов химических элементов +1 и -2 характерны для:
а) оксида калия
б) аммиака
в)сероводорода
г)хлороводорода
3.Вещества, формулы которых RbF, HF, F2, образованы с помощью химических связей соответственно
а) ковалентной неполярной, ковалентной полярной, ионной
б) ионной, ковалентной неполярной, ковалентной полярной
в) ионной, ковалентной полярной, ковалентной неполярной
г) ковалентной полярной, ионной, ковалентной неполярной
4.Химическая связь в хлориде цезия CsCl
а)металлическая
б)ковалентная неполярная
в)ионная
г)ковалентная полярная
5..Химическая связь в веществах, образованных из атомов, электроотрицательность которыхотличаетсянезначительно, является
а) ионной
б) ковалентной полярной
в) водородной
г) ковалентной неполярной
6.Формула соединений с ионной связью
а) С12 б) NH3 в) NaCl г) Вг2
7.Установите соответствие между видом связи и формулой вещества.
Вид связи:
А)Ионная
Б) Металлическая
В)Ковалентная полярная
Г) Ковалентная неполярная
Формула вещества:
1)Н20 2) ВаС12 3)С12 4) Fe
8.Установите , какое вещество имеет набольшую длину связи:
А) H2
Б) О2
В) N2
9.Установите соответствие между видом связи и формулой вещества.
Вид связи
А)Ионная
Б)Металлическая
В) Ковалентная полярная
Г) Ковалентная неполярная
Формула вещества:
1).02 2) СН4 3) KF 4) К
10. В молекуле какого вещества самая прочная связь:
А) HCL
Б) O2
В) СL2
Г) H2
Вариант 2
Выберите правильный ответ:
1.Формулы веществ только с ковалентной полярной связью записаны в ряду:
а) Cl2, N2, Н2 в) H2S, H20, S8
б) HBr, N0, Вг2 г) HI, Н20, РН3
2.Химический элемент, в атоме которого распределение электронов по слоям отражает последовательность чисел2, 8, 5, образует с водородом химическую связь:
а)ковалентную полярную
б ковалентную неполярную
в)ионную
г)металлическую
3.Ковалентную полярную и ковалентную неполярную связь имеют соответственно:
а)бромид калия и азот
б)вода и сероводород
в)аммиак и водород
г)кислород и метан
4.Молекулярная кристаллическая решетка свойственна веществам с химической связью:
а) ионной и ковалентной неполярной
б) ковалентной полярной и ковалентной неполярной
в) только ковалентной полярной
г) только ковалентной неполярной
5.В веществах, образованных из одинаковых злементов, химическая связь:
а) ионная
б) ковалентная полярная
в) водородная
г) ковалентная неполярная
6.Формула соединения с ковалентной полярной связью:
а) 02 б) H2S в) NaCl г) РЬ
7.Установите соответствие между видом связи в веществе и формулой химического соединения.
Вид связи:
А) Ионная
Б) Металлическая
В) Ковалентная полярная
Г) Ковалентная неполярная
Формула соединения:
Н2 2) Ва 3) НС1 4) BaF2
8. Установите , какое вещество имеет наименьшую длину связи:
А) CL2
Б) N2
В) H2 O
9. Установите соответствие между видом связи и формулой вещества.
Вид связи:
А) Ионная
Б) Металлическая
В) Ковалентная полярная
Г) Ковалентная неполярная
Формула вещества:
1.NH3 2) NaCl 3) N2 4) Na
10. В молекуле какого вещества самая прочная связь:
А) H2
Б) F2
В) N2
Вариант№3
Выберите правильный ответ.
1.С помощью ионной связи образованы все вещества ряда:
а)О3, N2, Н2 Mg
б) 02, 03, СО, NH3
в) NaH, СaО,K2С03, Li20
г) Н20, 02, N2, Н2
2.Ковалентная полярная связь и степени окисления атомов химических элементов +1 и -3 характерны для:
а) оксида калия
б) аммиака
в)сероводорода
г)хлороводорода
3.Вещества, формулы которых CaCl2, H2S, N2, образованы с помощью химических связей соответственно
а) ковалентной неполярной, ковалентной полярной, ионной
б) ионной, ковалентной неполярной, ковалентной полярной
в) ионной, ковалентной полярной, ковалентной неполярной
г) ковалентной полярной, ионной, ковалентной неполярной
4Химическая связь в хлориде магнияMgsCl
а)металлическая
б) ковалентная неполярная
в) ионная
г) ковалентная полярная
5..Химическая связь в веществах, образованных из атомов, электроотрицательность которых сильно отличается, является
а) ионной
б) ковалентной полярной
в) водородной
г) ковалентной неполярной
6.Формула соединений с ионной связью
а) С12 б) H2O в)KNO3 г) P
7.Установите соответствие между видом связи и формулой вещества.
Вид связи:
A)Ионная
Б) Металлическая
В)Ковалентная полярная
Г) Ковалентная неполярная
Формула вещества:
1)Br2 2) NH3 3)K2S 4) Ca
8.Установите , какое вещество имеет набольшую длину связи:
А) H2
Б) О2
В) N2
9.Установите соответствие между видом связи и формулой вещества.
Вид связи
А)Ионная
Б)Металлическая
В) Ковалентная полярная
Г) Ковалентная неполярная
Формула вещества:
1Na 2) NaBr 3) CO2 4) N2
10. В молекуле какого вещества самая прочная связь:
А) Br2
Б) O3
В) N2
Вариант 4
Выберите правильный ответ:
1.Формулы веществ только с ковалентной полярной связью записаны в ряду:
а) HCl, NH3, Н2SO4 в) H2S, H20, S8
б) HBr, N0, Вг2 г) HI, Н2, РН3
2.Химический элемент, в атоме которого распределение электронов по слоям отражает последовательность чисел2, 8, 6, образует с водородом химическую связь:
а) ковалентную полярную
б) ковалентную неполярную
в) ионную
г) металлическую
3.Ковалентную полярную и ковалентную неполярную связь имеют соответственно:
а) аммиак и азот
б) вода и сероводород
в)кислород и водород
г) кислород и метан
4.Молекулярная кристаллическая решетка свойственна веществам с химической связью:
а) ионной и ковалентной неполярной
б) ковалентной полярной
в) ковалентной полярной и ковалентной неполярной
г) только ковалентной неполярной
5.В веществах, образованных из одинаковых злементов, химическая связь:
а) ионная
б) ковалентная неполярная
в) водородная
г) ковалентная полярная
6.Формула соединения с ионной связью:
а) 02 б) H2S в) NaCl г) РЬ
7.Установите соответствие между видом связи в веществе и формулой химического соединения.
Вид связи:
А) Ионная
Б) Металлическая
В) Ковалентная полярная
Г) Ковалентная неполярная
Формула соединения:
1)Н2S 2) Ва 3) С12 4) BaF2
8.Установите , какое вещество имеет наименьшую длину связи:
А) H2
Б) О2
В) H2 O
9. Установите соответствие между видом связи и формулой вещества.
Вид связи:
А) Ионная
Б) Металлическая
В) Ковалентная полярная
Г) Ковалентная неполярная
Формула вещества:
1.H3PO4 2) Na(NO3)3) Na 4) O2
10. В молекуле какого вещества самая прочная связь:
А)N2
Б) CL2
В) HBr
Ответы к тесту:
|
Вариант |
Задание |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
1 |
a |
в |
в |
В |
б |
в |
2413 |
1321 |
3421 |
3121 |
|
2 |
г |
а |
в |
б |
г |
б |
4231 |
3211 |
2413 |
3123 |
|
3 |
в |
б |
в |
в |
а |
в |
34 21 |
12 31 |
21 34 |
31 21 |
|
4 |
а |
а |
а |
в |
б |
в |
4213 |
2113 |
2314 |
21 23 |
Система оценки:
За каждый правильный ответ-1балл.
Максимальное число баллов-10
10баллов (100%)- оценка «5
9-7 баллов(90-70%)-оценка «4»
6-5 баллов(60-50%)-оценка «3»
Практическая работа №3.
Тема: Решение задач на определение массовой доли вещества в растворе.
Цель:Формирование навыков решения задач; закрепление понятий: масса раствора,массовая доля вещества,масса растворенного вещества
Выражение состава смеси
Массовая доля компонента в смеси:
![]()
Массовая доля растворенного вещества в растворе:
![]() ; m(раствора)=m(в-ва)+m(воды)
; m(раствора)=m(в-ва)+m(воды)
Объемная доля газа в газовой смеси:
![]()
1. Вычислите массовую долю меди в образце латуни, полученной при сплавлении 17,5 г цинка и 32,5 г меди.
2. Вычислите массовую долю олова в образце бронзы, полученной при сплавлении 30 г олова с 170 г меди.
3. В 100 г воды растворили 12 г гидроксида натрия и 13 г гидроксида калия. Вычислите массовые доли NaOH и KOH в растворе.
4. Сколько граммов воды и сахара нужно взять для приготовления 100 г раствора сахара с массовой долей 10%?
5. Сколько граммов воды и поваренной соли NaCl нужно взять для приготовления раствора массой 50 г с массовой долей соли 3%.
6. Сосуд заполнили 25 мл кислорода О2 и 125 мл N2. Вычислите объемные доли кислорода и азота в этой смеси.
7. Сколько литров кислорода можно получить из воздуха, объемом 100 м3, если объемная доля кислорода в нем 21%?
8. Рассчитайте количество вещества (моль) спирта С2Н6О, который содержится в 500 г водки (40%-ный раствор спирта).
9. В 180 г 15%-го раствора гидроксида калия растворили 5 г щелочи. Рассчитайте массовую долю щелочи в полученном растворе.
Решение задач на определение массовой доли вещества в растворе
(время выполнения-25 минут)
Вариант№1
1.Сколько граммов йода и спирта нужно взять для приготовления 60 г. 15% раствора йодной настойки.
2.Слили два раствора гидроксида натрия: 240г. 20% и 200г. 10%. Рассчитайте массовую долю гидроксида натрия в полученном рас творе
Вариант№2
1.Определить количество вещества золота и серебра, которое содержится в обручальном кольце массой 4,25г. и пробой 5850 (58,5% Au).
2.К 240 г. 30% раствора серной кислоты(H2SO4) добавили еще 20г. кислоты. Рассчитайте массовую долю кислоты в полученном растворе.
Вариант№3
1.Рассчитате количество вещества спирта(C2H5OH) ,который содержится в 200г. сухого виноградного вина с 9% содержанием спирта.
2.Для приготовления маринадов для консервирования обычно растворяют три столовые ложки поваренной соли (NaCl) (это 90 граммов) в 3 литрах воды. Какова массовая доля соли в полученном растворе
Вариант№4
1.Сколько граммов воды необходимо добавить к 200г 25%раствора серной кислоты,чтобы получить раствор с массовой долей 5%?
2.Рассчитайте количество вещества гидроксида натрия, который содержится в растворе массой 250г. с массовой долей 20%
Вариант№5
1.К300мл раствора гидроксида калия (плотность 1,2) с массовой долей 20% прибавили 40 гр. вещества гидроксида калия (KOH). Определить массовую долю KOH в полученном растворе.
2.Рассчитайте количество вещества спирта C2H5OH, который содержится в 300гр. водки (40% раствор спирта в воде)
Вариант№6
1.В 180гр. 15% раствора гидроксида бария растворили еще 40г. вещества гидроксида бария .Рассчитайте массовую долю гидроксида бария в полученном растворе.
2.В воде объемом 300мл растворили 20 г. поваренной соли (NaCl).Определить массовую долю соли в полученном растворе.
Вариант№7
1.Сколько воды необходимо добавить к раствору массой 3 кг с массовой долей соли 20%, чтобы получить раствор с массовой долей 15%.
2.Определить массовую долю вещества серной кислоты в растворе, если в растворе массой 245гр. растворено 0,5 моль H2SO4
Вариант№8
1.Сколько граммов хлорида меди содержится в растворе массой 300гр. с массовой долей 25%.
2.Рассчитайте количество вещества воды,которое потребуется для разбавления 500г уксусной кислоты с массовой долей 70%,чтобы получить раствор с массовой долей 9%
Вариант№9
1.В воде объемом 100 мл растворили 30 г соды. Определить массовую долю соды в растворе.
2.Смешали два раствора серной кислоты: 250г 20% раствора и 100г 30% раствора. Определить массовую долю вещества серной кислоты в образовавшемся растворе.
Вариант№10
1.В растворе гидроксида натрия массой 120г растворено 0,5 моль вещества гидроксида натрия. Определить массовую долю гидроксида натрия в данном растворе.
2.Сколько граммов вещества сульфата меди содержится в растворе массой 196г с массовой долей 20%
Вариант№11
1.Определить количество вещества нитрата меди, которое содержится в растворе массой 300г с массовой долей 45%.
2.К 120г раствора азотной кислоты с массовой долей 15% добавили еще 30г.Опеделить массовую долю кислоты в полученном растворе.
Оценка умений решать расчетные задачи.
Отметка «5»:
- в логическом рассуждении и решении нет ошибок, задачи решены рациональным способом;
Отметка «4»:
- в логическом рассуждении и решении нет существенных ошибок, но задачи решены нерациональным способом, или допущено не более двух несущественных ошибок.
Отметка «3»:
- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах, решена только одна задача.
Отметка «2»:
- имеется существенные ошибки в логическом рассуждении и в решении.
- отсутствие ответа на задание.
Отметка «1»:
- не приступил к решению задачи
Лабораторная работа №1
Тема: Испытание растворов солей индикатором.Гидролиз солей.
Реакция обмена между растворами электролитов
Цель: Опытным путем установить среду растворов солей. Сделать вывод: все ли соли подвергаются гидролизу.
Опыт №1. Испытание растворов солей индикаторами.
Оборудование и реактивы: штатив с пробирками; растворы- универсального индикатора лакмуса ,хлорида железа , сульфата железа, сульфата меди, хлорида бария, карбоната натрия.
Выполнение опыта.1.Налить в пробирку 5-6 капель раствора хлорида железа и добавить 2 капли индикатора лакмусаНаблюдать изменение окраски раствора.
2.Тоже самое проделать с растворами остальных солей.
3. Результаты занести в таблицу.
Примечание: среду раствора в таблице отмечать знаком +
4.Написать уравнения реакций гидролиза солей , растворы которых имели кислую или щелочную реакцию .Уравнения реакций записать в молекулярной и ионной формах.Указать, какие ионы определяют среду.
5.Сделать вывод: все ли соли подвергаются гидролизу.
Опыт №2. Реакции ионного обмена.
Цель:Опытным путем установить, при каких условиях реакции ионного обмена идут до конца.
Оборудование и реактивы: штатив с пробирками; растворы- универсального индикатора лакмуса ,хлорида железа , сульфата железа, сульфата меди, хлорида бария, карбоната натрия.
А)Получение гидроксида железа (3)
Выполнение опыта: Налить в пробирку 3-4 капли раствора хлорида железа (3) и прилить такое же количество раствора гидроксида натрия. Что наблюдаете?
Б). Получение гидроксида меди (2)
Выполнение опыта: Налить в пробирку 3-4 капли раствора сульфата меди (2) и прилить такое же количество гидроксида натрия. Что наблюдаете?
В). Получение сульфата бария
Выполнение опыта: Налить в пробирку 3-4 капли раствора хлорида бария (2) и прилить 1-2 капли раствора серной кислоты. Что наблюдаете?
Г)Получение слабодиссоциирующего вещества - воды
Выполнение опыта: Налить в пробирку 5-6 капель раствора гидроксида натрия и прилить 1-2 капли лакмуса. Что наблюдаете? К полученному раствору по каплям приливаем серную кислоту до изменения окраски. Почему окраска раствора изменилась?
Д)Получение углекислого газа – СО2.
Выполнение опыта: Налить в пробирку 5-6 капель раствора карбоната натрия и прилить 3-4 капли соляной кислоты. Взболтайте. Что наблюдаете?
Выполнение опыта внесите в таблицу:
Сделайте вывод, при каких условиях реакции ионного обмена идут до конца.
Письменно ответьте на вопросы:
1.Какой процесс называют гидролизом?
2.Чем определяется кислотность среды?
3.Чем определяется основность среды?
4.Что такое электролитическая диссоциация,
5.Что такое катионы?
6.Что такое анионы ?
2. Оценка лабораторных работ.
- Оценка ставится на основании наблюдения за учащимися и письменного отчета за работу.
Отметка «5»:- работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
- эксперимент осуществлен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
- проявлены организационно - трудовые умения, поддерживаются чистота рабочего места и порядок (на столе, экономно используются реактивы).
Отметка «4»:- работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:- работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента в объяснении, в оформлении работы, в соблюдении правил техники безопасности на работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:- допущены две (и более) существенные ошибки в ходе: эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя;
Отметка «1»: работа не выполнена, у учащегося отсутствует экспериментальные умения.
Задания к зачету по теме:
«Важнейшие классы неорганических соединений, способы их
получения и химические свойства ».(время выполнения-30 минут)
Вариант 1
1. Из данного перечня веществ выпишите формулы оксидов:
HBr, Na2SO4, CuO, Fe(OH)2, NO2, HNO3, NaOH, MgSO4, SO2, H3PO4, MgO, HCI, LiOH, Ca3(PO4)2, H2S, CaCI2, HNO2, AI(OH)3, P2O5, H2CO3, FeS, H3PO4.
2. Закончите уравнения возможных реакций:
а) Na + H2O =
б) KOH + HNO3 =
в) Сu + HCI =
г) SO2 + H2O =
3. Напишите уравнения реакций, при помощи которых можно осуществить превращения:
K ---- K2O ---- KOH ---- K3PO4 ---- H3PO4
4. Вычислите массу серной кислоты, необходимой для нейтрализации 250 граммов раствора, содержащей 15% гидроксида калия.
Вариант 2
1. Из данного перечня веществ выпишите формулы оснований:
HBr, Na2SO4, CuO, Fe(OH)2, NO2, HNO3, NaOH, MgSO4, SO2, H3PO4, MgO, HCI, LiOH, Ca3(PO4)2, H2S, CaCI2, HNO2, AI(OH)3, P2O5, H2CO3, FeS, H3PO4.
2. Закончите уравнения возможных реакций:
а) Mg + HCI =
б) AI + O2 =
в) Ag + H2O =
г) Fe(OH)3 + HNO3 =
3. Напишите уравнения реакций, при помощи которых можно осуществить превращения:
AI2O3 ---- AI2(SO4)3 ---- AI(OH)3 ---- AI2O3 ---- AI(NO3)3
4. Определите массу гидроксида кальция, необходимого для нейтрализации 150г раствора с массовой долей азотной кислоты 63%.
Вариант 3
1. Из данного перечня веществ выпишите формулы кислот:
HBr, Na2SO4, CuO, Fe(OH)2, NO2, HNO3, NaOH, MgSO4, SO2, H3PO4, MgO, HCI, LiOH, Ca3(PO4)2, H2S, CaCI2, HNO2, AI(OH)3, P2O5, H2CO3, FeS, H3PO4.
2. Закончите уравнения возможных реакций:
а) NaCI + HCI =
б) H2 + CI2 =
в) Ag + HCI =
г) P2O5 + H2O =
3. Напишите уравнения реакций, при помощи которых можно осуществить превращения:
C ---- CO2 ---- Na2CO3 ---- CO2 ---- CaCO3 ---- CaCI2
4. Рассчитайте объем раствора с массовой долей серной кислоты 10% (р = 1,07г/см3), которой потребуется для нейтрализации раствора, содержащего 32г гидроксида калия.
Вариант 4
1. Из данного перечня веществ выпишите формулы солей:
HBr, Na2SO4, CuO, Fe(OH)2, NO2, HNO3, NaOH, MgSO4, SO2, H3PO4, MgO, HCI, LiOH, Ca3(PO4)2, H2S, CaCI2, HNO2, AI(OH)3, P2O5, H2CO3, FeS, H3PO4.
2. Закончите уравнения возможных реакций:
а) P2O5 + CO2 =
б) H2SiO3 =
в) AgNO3 + HCI =
г) Fe + H2SO4 =
3. Напишите уравнения реакций, при помощи которых можно осуществить превращения:
Ca --- CaO ---- Ca(OH)2 ---- CaCO3 ---- Ca(NO3)2
4. Рассчитайте массу алюминия, необходимого для полного выделения меди из 400г раствора с массовой долей сульфата меди (II) 8%.
Вариант 5
1. Из данного перечня веществ выпишите формулы солей:
BaO, H2SO3, KOH, NaI, Ca(NO3)2, P2O5, HF, AgCI, Ba(OH)2, NO, H3PO4, C O,
HBr, Zn(OH)2, Na2S, MgO, K3PO4, HCI, ZnO, Cu(NO3)2, CuO, Pb(OH)2, H2CO3.
2. Закончите уравнения возможных реакций:
а) Zn + HNO3 =
б) Р2O5 + H2O =
в) NaCI + HNO3 =
г) AICI3 + NaOH =
3. Напишите уравнения реакций, при помощи которых можно осуществить превращения:
P ---- P2O5 ---- H3PO4 ----Ca3(PO4)2 ---- CaCI2 ---- Ca(OH)2
4.Железо массой 7 г вступило в реакцию с хлором. Полученный хлорид железа (III) растворили в воде массой 200г. Вычислите массовую долю соли в полученном растворе.
Вариант 6
1. Из данного перечня веществ выпишите формулы оксидов:
BaO, H2SO3, KOH, NaI, Ca(NO3)2, P2O5, HF, AgCI, Ba(OH)2, NO, H3PO4, C O,
HBr, Zn(OH)2, Na2S, MgO, K3PO4, HCI, ZnO, Cu(NO3)2, CuO, Pb(OH)2, H2CO3.
2. Закончите уравнения возможных реакций
а) NaOH + ZnO =
б) Ca(OH)2 + H2SO4 =
в) ZnO + HCI =
г) H3PO4 + HNO3 =
3. Напишите уравнения реакций, при помощи которых можно осуществить превращения:
Fe ---- FeO ---- FeSO4 ---- Fe(OH)2 ---- FeO ---- FeCI2
4. Вычислите массу соли, которая образуется при взаимодействии 100г раствора с массовой долей сульфата меди (II) 20% с магнием.
Вариант 7
1. Из данного перечня веществ выпишите формулы оснований:
BaO, H2SO3, KOH, NaI, Ca(NO3)2, P2O5, HF, AgCI, Ba(OH)2, NO, H3PO4, C O,
HBr, Zn(OH)2, Na2S, MgO, K3PO4, HCI, ZnO, Cu(NO3)2, CuO, Pb(OH)2, H2CO3.
2. Закончите уравнения возможных реакций:
а) K + H2O =
б) Zn(OH)2 + HNO3 =
в)AgNO3 + Zn =
г) СО2 + СаО =
3. Напишите уравнения реакций, при помощи которых можно осуществить превращения:
SO3 --- H2SO4 ---- ZnSO4 ---- Zn(OH)2 --- ZnO ---- Na2ZnO2
4. При взаимодействии цинка с серной кислотой выделился газ, содержащей
6 . 1022 молекул, определите массу полученной соли.
Вариант 8
1. Из данного перечня веществ выпишите формулы кислот:
BaO, H2SO3, KOH, NaI, Ca(NO3)2, P2O5, HF, AgCI, Ba(OH)2, NO, H3PO4, C O,
HBr, Zn(OH)2, Na2S, MgO, K3PO4, HCI, ZnO, Cu(NO3)2, CuO, Pb(OH)2, H2CO3.
2. Закончите уравнения возможных реакций:
а) NaOH + H3PO4 =
б) PbCI2 + KOH =
в) NaOH + KOH =
г) ZnCI2 + Cu =
3. Напишите уравнения реакций, при помощи которых можно осуществить превращения:
Ba ---- BaO ---- Ba(OH)2 ----- Ba(NO3)2 --- BaSO4
4. Вычислите, какой объем раствора с массовой долей серной кислоты 10% (р = 1,07г/см3) потребуется для нейтрализации раствора, содержащего 52г гидроксида лития.
Оценка письменной работы.
Отметка «5»:- ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:- ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:- работа выполнена не менее чем наполовину, допущена одна существенная ошибка и при этом две-три несущественные.
Отметка «2»:- работа выполнена меньше чем наполовину или содержит несколько существенных ошибок.
Отметка «1»: - работа не выполнена.
Тест по теме « Типы химических реакций»
(на выполнение работы предусмтрено 20 минут).
ВАРИАНТ № 1
А.
1. (2 балла) Физическое явление – это:
а) ржавление железа
б) горение древесины
в) плавление свинца
2. (2 балла) Уравнение реакции обмена:
а) CaO + SiO2 = CaSiO3
б) FeS + 2 HCl = FeCl2 + H2S
в) 2 KClO3 = 2 KCl + 3O2
3. (3 балла) По данной левой части уравнения CuO + H2SO4 =
… восстановите его правую часть.
а) CuSO4 + H2O
б) CuSO4 + 2 H2O
в) CuSO4 + H2
4. (2 балла) Из нескольких простых или сложных веществ образуется одно более
сложное вещество в реакции:
а) замещения
б) обмена
в) разложения
г) соединени
Б.
5. (6 баллов) Расставьте коэффициенты в схемах и укажите типы
химических реакций:
а) Li + O2 Li2O
б) Fe2O3 + Al Al2O3 +
Fe
6. (7 баллов) Восстановите пропущенную запись и укажите тип
химической реакции:
а) ? + 2 HCl = FeCl2 + H2
б) 2 Al + ? = 2 AlCl3
^ ВАРИАНТ № 2
А.
1. (2 балла) Химическое явление – это:
а) горение свечи
б) испарение бензина
в) плавление льда.
2. (2 балла) Уравнение реакции разложения:
а) CaO + SiO2 = CaSiO3
б) FeS + 2 HCl = FeCl2 + H2S
в) 2 KNO3 = 2 KNO2 + O2
3.(3 балла) По данной правой части уравнения … = CuCl2 + 2 H2O
восстановите его левую часть.
а) Cu + 2 HCl
б) Cu(OH)2 + 2 HCl
в) CuO + 2 HCl
4. (2 балла) Из одного сложного вещества образуется два или более новых веществ
в реакции:
а) замещения
б) обмена
в) разложения
г) соединения
Б.
5. (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических
реакций:
а) CuO + HCl CuCl2 + H2O
б) NH3 N2 + H2
6. (7 баллов) Восстановите пропущенную запись, укажите тип химической реакции:
а) Fe2O3 + 3 H2 = ? + 3 H2O
б) Zn + ? = ZnCl2 + H2
^
ВАРИАНТ № 3
А.
1. (2 балла) Физическое явление – это:
а) испарение воды
б) горение керосина
в) скисание молока.
2. (2 балла) Уравнение реакции замещения:
а) BaO + H2O = Ba(OH)2
б) CuO + H2 = Cu + H2O
в) 3 KOH + H3PO4 = K3PO4 +
3 H2O
3. (3 балла) По данной левой части уравнения ZnO + 2 HCl =… восстановите его
правую часть.
а) ZnCl2 + H2O
б) ZnCl2 + 2 H2O
в) ZnCl2 + H2
4. (2 балла) Из одного сложного вещества образуется два или более новых веществ
в реакции:
а) замещения
б) обмена
в) разложения
г) соединения
Б.
5. (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических
реакций:
а) Fe2O3 + HCl FeCl3 +
H2O
б) NO + O2 NO2
6. (7 баллов) Восстановите пропущенную запись, укажите тип химической реакции:
а) ? + H2SO4 = ZnSO4 + H2
б) 4 Al + ? = 2 Al2O3
^
ВАРИАНТ № 4
А.
1. (2 балла) Химическое явление – это:
а) плавление олова
б) горение магния
в) замерзание воды..
2. (2 балла) Уравнение реакции соединения:
а) N2 + O2 = 2 NO
б) CaCO3 = CaO + CO2
в) CH4 + 2 O2 = CO2 + 2 H2O
3. (3 балла) По данной левой части уравнения Zn(OH)2 + 2 HCl =
… восстановите его правую часть.
а) ZnCl2 + H2
б) ZnCl2 + H2O
в) ZnCl2 + 2 H2O
4. (2 балла) Из двух сложных веществ образуется два новых сложных вещества в
реакции
а) замещения
б) обмена
в) разложения
г) соединения
Б.
5 (6 баллов) Расставьте коэффициенты в схемах и укажите типы химических
реакций:
а) Al2O3 + H2SO4 Al2(SO4)3 + H2O
б) H2 + Cl2 HCl
6. (7 баллов) Восстановите пропущенную запись, укажите тип химической реакции:
а) Mg + 2 HCl = ? + H2
б) 2 Na + ? = 2 NaCl
Ответы к тесту «Типы химических реакций».
Вариант1.
А: 1-в 2-б 3-а 4-г
Б: 4Li +O2=2Li2O –р.соединения
Fe2O3+2Al=Al2O3+2Fe-р.замещения
Fe+2HCL=FeCL2+H2-р.замещения
2Al+3CL2=2AlCl3 –р.соединения
Вариант2.
А:1-а 2-в 3-б 4-в
Б: CuO+2HCl=CuCl2+H2O-реакция обмена
2NH3=N2+3H2 –реакция разложения
Fe2O3 +3H2=2Fe+3H2O-реакция замещения
Zn+2HCL=ZnCL2+H2 –реакция замещения
Вариант3.
А:1-а 2-б 3-а 4-в
Б: Fe2O3+6HCL=2FeCL3+3H2O –реакция обмена
2NO+O2=2NO2 –реакция соединения
Zn+H2SO4=ZnSO4+H2 –реакция замещения
4Al+3O2=2Al2O3 –реакция соединения
Вариант4.
А:1-б 2-а 3-в 4-б
Б: AL2O3+3H2SO4=AL2(SO4)3+3H2O-реакция обмена
H2+CL2=2HCL –реакция соединения
Mg +2HCL=MgCL2+H2 -реакция замещения
2Na +CL2=2NaCL-реакция соединения
Практическая работа №4
Тема: «Окислительно-восстановительные реакции.Решение ОВР
методом электронного баланса».
Задания для самостоятельной работы:
Составить электронный баланс и расставить коэффициенты в следующих уравнениях:
1.Pb + HNO3 = Pb(NO3)2 + NO2 + H2O
2. P2O5 +C = P + CO
3. Mg +HNO3 = Mg(NO3)2 + NH4NO3 + H2O
4.C + HNO3 = CO2 + NO + H2O
5 SO2 +HNO3 +H2O = H2SO4 + NO
6 FeSO4 +H2SO4 =Fe2(SO4)3 +SO2 +H2O
7 H2S + HNO3 = S + NO2 +H2O
8 K + H2SO4 = K2SO4 + S + H2O
9 Na + HNO3 = NaNO3 + NH4NO3 + H2O
10 NH3 + O2 = NO +H2O
11 KNO2 + KCLO3 = KCL + KNO3
12 K2SO3 + KMnO4 + H2SO4 = MnSO4 + K2SO4 +H2O
13 KCLO3 + S = KCL + SO2
14 HBr +H2SO4 = Br2 + SO2 + H2O
15 K2SO3 + KMnO4 + KOH = K2MnO4 + K2SO4 + H2O
16 Mg + HNO3 = Mg(NO3)2 +NO + H2O
17 Cu + HNO3 = Cu(NO3)2 + NO2 + H2O
18 K2SO3 + KMnO4 + H2O = MnO2 + K2SO4 + KOH
19 Ag + HNO3 = Ag(NO3) + NO + H2O
20 Na + HNO3 = NaNO3 + NH4NO3 + H2O
21 FeSO4 + KMnO4 + H2SO4 = Fe2(SO4)3 + K2SO4 +MnSO4 +Н2О
Задания для письменной работы по теме
« Окислительно-восстановительные реакции»
(для выполнения работы предусмотрено 20 минут).
Вариант№1
1. Реакции выражаются схемами:
P + HIO3 + H2O ![]() H3PO4 + HI
H3PO4 + HI
H2S + Cl2 + H2O ![]() H2SO4 + HCl
H2SO4 + HCl
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций.
Для каждой реакции укажите какое вещество является окислителем, какое -
восстановителем; какое вещество окисляется, какое - восстанавливается.
Вариант№2
1. Реакции выражаются схемами:
HNO3 + Ca ![]() NH4NO3 + Ca(NO3)2 + H2O
NH4NO3 + Ca(NO3)2 + H2O
K2S + KMnO4 + H2SO4 ![]() S + K2SO4 + MnSO4 + H2O
S + K2SO4 + MnSO4 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций.
Для каждой реакции укажите какое вещество является окислителем, какое -
восстановителем; какое вещество окисляется, какое - восстанавливается.
Вариант№3
1. Реакции выражаются схемами:
P + HNO3 + H2O ![]() H3PO4 + NO
H3PO4 + NO
KMnO4 + Na2SO3 + KOH ![]() K2MnO4 + Na2SO4 +
H2O
K2MnO4 + Na2SO4 +
H2O
Составьте электронные уравнения. Расставьте коэффициенты в
уравнениях реакций. Для каждой реакции укажите какое вещество является
окислителем, какое - восстановителем; какое вещество окисляется, какое -
восстанавливается.
Вариант№4
1. Реакции выражаются схемами:
H2S + Cl2 + H2O ![]() H2SO4 + HCl
H2SO4 + HCl
K2Cr2O7 + H2S + H2SO4 ![]() S + Cr2(SO4)3 + K2SO4 +
H2O
S + Cr2(SO4)3 + K2SO4 +
H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций.
Для каждой реакции укажите какое вещество является окислителем, какое -
восстановителем; какое вещество окисляется, какое - восстанавливается.
Вариант№5
1. Реакции выражаются схемами:
KClO3 + Na2SO3 ![]() KCl + Na2SO4
KCl + Na2SO4
KMnO4 + HBr ![]() Br2 + KBr + MnBr2 + H2O
Br2 + KBr + MnBr2 + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций.
Для каждой реакции укажите какое вещество является окислителем, какое -
восстановителем; какое вещество окисляется, какое - восстанавливается.
Вариант№6
1. Реакции выражаются схемами:
P + HCIO3 + H2O ![]() H3PO4 + HCI
H3PO4 + HCI
H3AsO3 + KMnO4 + H2SO4 ![]() H3AsO4 + MnSO4 + K2SO4 +
H2O
H3AsO4 + MnSO4 + K2SO4 +
H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций.
Для каждой реакции укажите какое вещество является окислителем, какое -
восстановителем; какое вещество окисляется, какое - восстанавливается.
Вариант№7
1. Реакции выражаются схемами:
NaCrO2 + Br2 + NaOH ![]() Na2CrO4 + NaBr + H2O
Na2CrO4 + NaBr + H2O
FeS + HNO3 ![]() Fe(NO3)2 + S + NO + H2O
Fe(NO3)2 + S + NO + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций.
Для каждой реакции укажите какое вещество является окислителем, какое -
восстановителем; какое вещество окисляется, какое - восстанавливается.
Вариант№8
1. Реакции выражаются схемами:
HNO3 + Zn ![]() N2O + Zn(NO3)2 + H2O
N2O + Zn(NO3)2 + H2O
FeSO4 + KClO3 + H2SO4 ![]() Fe2(SO4)3 + KCl + H2O
Fe2(SO4)3 + KCl + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций.
Для каждой реакции укажите какое вещество является окислителем, какое -
восстановителем; какое вещество окисляется, какое - восстанавливается.
Вариант№9
1. Реакции выражаются схемами:
K2Cr2O7 + HCl ![]() Cl2 + CrCl3 + KCl + H2O
Cl2 + CrCl3 + KCl + H2O
Au + HNO3 + HCl ![]() AuCl3 + NO + H2O
AuCl3 + NO + H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое - восстанавливается.
Вариант№10
1. Реакции выражаются схемами:
HCl + CrO3 ![]() Cl2 + CrCl3 + H2O
Cl2 + CrCl3 + H2O
Cd + KMnO4 + H2SO4 ![]() CdSO4 + K2SO4 + MnSO4 +
H2O
CdSO4 + K2SO4 + MnSO4 +
H2O
Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для
каждой реакции укажите какое вещество является окислителем, какое -
восстановителем; какое вещество окисляется, какое - восстанавливается.
Система оценки :
Отметка «5»:- задания работы выполнены в полном объеме: правильно определены степени окисления, составлен электронный баланс, расставлены коэффициенты, указаны окислитель, восстановитель, процесс восстановления, окисления.Выполнены два уравнения.
Отметка «4»:-задания выполнены не в полном объеме, допущена одна ошибка, выполнены два уравнения.
Отметка «3»:- работа выполнена не менее чем наполовину, допущена одна существенная ошибка и при этом две-три несущественные, выполнено одно уравнение.
Отметка «2»:- работа выполнена меньше чем наполовину или содержит несколько существенных ошибок.
Тест по теме «. Скорость химических реакций. Химическое равновесие».
(на выполнение теста предусмотрено 30 минут)
ВАРИАНТ 1. Скорость химических реакций. Химическое равновесие
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1. (2 балла). Фактор, не влияющий на скорость химической реакции:
A. Давление. Б. Катализатор.
B. Концентрации реагирующих веществ. Г. Форма сосуда, в котором протекает реакция.
2. (2 балла). Фактор, влияющий на смещение химического равновесия:
А. Вид химической связи. Б. Катализатор.
B. Природа реагирующих веществ. Г. Температура
.
3. (2 балла). С увеличением концентрации азота в 2 раза скорость прямой химической реакции, уравнение которой N2 + О2 ↔ 2NO:
A. Не изменится. Б. Увеличится в 2 раза.
B. Увеличится в 4 раза Г. Уменьшится в 4 раза.
4. (2 балла). С увеличением давления в 5 раз скорость прямой химической реакции, уравнение которой 2NO + О2 ↔ 2NO2, увеличится:
А. В 5 раз Б. В 75 раз В. В 25 раз Г. В 125 раз
5. (2 балла). При повышении температуры на 10 °С (температурный коэффициент γ = 2) скорость химической реакции увеличится:
А. В 2 раза . Б. В 8 раз В. В 4 раза. Г. В 16 раз.
6. (2 балла). С увеличением давления равновесие обратимой химической реакции, уравнение которой С2Н4(Г) + Н2О(Г) ↔ С2Н5ОН(Г):
A. Не изменится. Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.
7. (2 балла). Для смещения химического равновесия обратимой реакции, уравнение которой 2SO2 + О2 ↔ 2SO3 + Q, в сторону исходных веществ необходимо:
A. Увеличить давление. Б. Повысить температуру.
B. Понизить температуру. Г. Применить катализатор.
8. (2 балла). Максимальная скорость химической реакции при взаимодействии веществ, формулы которых:
A. Zn(гран.) и НС1. Б. РЬ и НС1. В. Zn(пыль) и НС1. Г. Fe и НС1.
9. (2 балла). Повышение температуры смещает химическое равновесие вправо в обратимой реакции, уравнение которой:
A. 2Н2 + О2↔2Н2О + Q. Б. SO2 + Н2О↔H2SO3 + Q.
B. 2NO + О2↔2NO2 + Q. Г.C4H10↔C4H8 + H2-Q.
10. (2 балла). Скорость химической реакции, уравнение которой Mg + 2HCl = MgCl2 + H2↑, при уменьшении концентрации кислоты за каждые 10 с на 0,04 моль/л равна:
А. 0,00004 моль/л•с). Б. 0,004 моль/(л•с). В. 0,0004 моль/л•с). Г. 0,04 моль/л•с).
11. (8 баллов). Установите соответствие.
Уравнение реакции: 1. С + О2= СО2. 2. С + СО2 = 2СО.
Формула для определения скорости реакции:
A. v = k·C(О2). B. v = k-C(O2)·C(С). Б. v = k·C(С).С(СО2). Г. v = k·C(CО2).
ЧАСТЬ Б. Задания со свободным ответом
12. (6 баллов). В какую сторону сместится химическое равновесие в реакции, уравнение которой С2Н4 + Н2 ↔ C2H6 + Q, в случае:
а) повышения давления; б) уменьшения температуры; в) увеличения концентрации С2Н4; г) применения катализатора? Дайте обоснованный ответ.
13. (6 баллов). Запишите схему химической реакции, скорость которой можно рассчитать по формуле v = k • СА • СВ.
14. (4 балла). Почему, если смешать твердый нитрат свинца (II) и иодид калия, признаки реакции можно наблюдать через несколько часов, а если слить растворы этих солей, признаки реакции появятся сразу? Напишите уравнение реакции в молекулярном и ионном видах.
15. (6 баллов). Составьте термохимическое уравнение реакции разложения карбоната кальция, если для разложения 25 г карбоната кальция потребовалось 44,5 кДж теплоты
.
ВАРИАНТ 2 Скорость химических реакций. Химическое равновесие
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1. Фактор, не влияющий на скорость химической реакции:
A. Давление. Б. Катализатор. B. Способ получения реагентов. Г. Температура.
(2 балла).
2. Фактор, не влияющий на смещение химического равновесия:
A. Давление. Б. Концентрация реагирующих веществ.
B. Температура. Г. Природа реагирующих веществ. (2 балла).
3. С увеличением концентрации хлора в 2 раза скорость химической реакции, уравнение которой СО + С12 = СС12О:
A. Не изменится. Б. Увеличится в 2 раза.
B. Увеличится в 4 раза. Г. Уменьшится в 4 раза. (2 балла).
4. С уменьшением давления в 3 раза скорость прямой химической реакции, уравнение которой N2 + О2 <=> 2NO, уменьшится:
А. В 3 раза. Б. В 27 раз. В. В 9 раз. Г. В 81 раз. (2 балла).
5. Для увеличения скорости химической реакции в 32 раза (температурный коэффициент у = 2) надо повысить температуру:
А. На 30 °С. Б. На 50 °С. В. На 40 °С. Г. На 60 °С.
(2 балла).
6. С увеличением концентрации SO2 равновесие обратимой химической реакции, уравнение которой 2SO2 + О2 ↔2SO3 + Q:
A. Не изменится. Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ. (2 балла).
7. Для смещения химического равновесия обратимой реакции, уравнение которой N2 + ЗН2 ↔ 2NH3 + Q, в сторону продуктов реакции необходимо:
A. Увеличить концентрацию NH3. Б. Повысить температуру.
B. Повысить давление. Г. Применить катализатор. (2 балла).
8. Скорость химической реакции максимальна при взаимодействии веществ, формулы которых:
A. С2Н5ОН(Ж) и О2. Б. С2Н5ОН(Г) и О2. B. N2 и О2. Г. СuО и H2SO4.
(2 балла).
9. Понижение давления смещает химическое равновесие вправо в реакции, уравнение которой:
A. СН4 + Н2О ↔ ЗН2 + СО. Б. СО2 + Н2О ↔ Н2СО3.
B. ЗН2 + N2 ↔2NH3. Г. 2СО + О2 ↔ 2СО2. (2 балла).
10. Скорость химической реакции, уравнение которой CuO + H2SO4 = CuSO4 + Н2О, при уменьшении концентрации кислоты за каждые 10 с на 0,03 моль/л равна:
А. 0,1 моль/(л•с). Б. 0,002 моль/(л•с). В. 0,001 моль/(л•с). Г. 0,003 моль/(л•с).
(2 балла).
11(8 баллов). Установите соответствие.
Уравнение реакции: 1. Н2О + СО2 ↔ Н2СО3. 2. 2СО + О2 ↔2СО2.
Формула для определения скорости обратной реакции:
A. υ = k·C(H2О)·C(CO2). Б. υ= k·C2(CO2). В. υ = k·С2(CО)·С(О2). Г. υ= k·C(Н2CO3).
ЧАСТЬ Б. Задания со свободным ответом
12(6 баллов). В какую сторону сместится химическое равновесие реакции, уравнение которой 4НС1(Г) + О2 (Г)↔ 2Н2О(Г) + 2С12(Г) + Q, в случае:
а) повышения температуры; б) уменьшения давления; в) увеличения концентрации О2;
г) применения катализатора? Дайте обоснованный ответ.
13(6 баллов). Запишите схему химической реакции, скорость которой можно рассчитать по формуле v = k • С2А • СВ
14(4 балла). Приведите примеры химических реакций, иллюстрирующих влияние катализатора на направление химического процесса: а) для неорганических веществ; б) для органических соединений. Запишите уравнения этих реакций.
15(6 баллов). Составьте термохимическое уравнение реакции разложения нитрата калия, если для образования 5,6 л кислорода потребовалось 63,7 к Дж теплоты.
ВАРИАНТ 3. Скорость химических реакций. Химическое равновесии
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1. (2 балла). Фактор, не влияющий на скорость химической реакции:
A. Место проведения реакции. Б. Концентрация реагирующих веществ.
B. Природа реагирующих веществ. Г. Температура.
2. (2 балла). Фактор, влияющий на смещение химического равновесия:
A. Катализатор. Б. Концентрация реагирующих веществ.
B. Природа реагирующих веществ.
Г. Тип кристаллической решётки реагирующих веществ.
3. (2 балла). С увеличением концентрации кислорода в 2 раза скорость химической реакции, уравнение которой СН4 + 2О2 = СО2 + 2Н2О:
A. Не изменится. Б. Увеличится в 2 раза. B. Увеличится в 4 раза. Г. Уменьшится в 4 раза.
4. (2 балла). С увеличением давления в 4 раза скорость прямой химической реакции, уравнение которой 2СО + О2 ↔ 2СО2, увеличится:
А. В 4 раза. Б. В 16 раз В. В 64 раза. Г. В 128 раз.
5. (2 балла). При повышении температуры на 20 °С (температурный коэффициент γ= 3) скорость химической реакции увеличится:
А. В 3 раза. Б. В 9 раз. В. В 27 раз. Г. В 81 раз
.
6. (2 балла). С увеличением температуры равновесие обратимой химической реакции, уравнение которой CO2(г) + C(т)↔ 2CO(г)-Q:
A. Не изменится. Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.
7. (2 балла). Для смещения химического равновесия обратимой реакции, уравнение которой 2NO + О2 <=> 2NO2 + Q, в сторону исходных веществ необходимо:
A. Увеличить концентрацию NO2. Б. Повысить давление.
B. Понизить температуру. Г. Применить катализатор.
8. (2 балла). Скорость химической реакции максимальна при взаимодействии веществ, формулы которых:
А. ВаС12(т) и H2SO4. Б. ВаС12(р.р) и H2SO4 В. ВаО и H2SO4. Г. СаСО3 и H2SO4.
9. (2 балла). Понижение температуры смещает химическое равновесие вправо в реакции, уравнение которой:
A. 2NO + О2 ↔2NO2 + Q. Б. C2H6 ↔ 2С + ЗН2 -Q.
B. 2НВr ↔ Н2 + Br2 - Q. Г. 2HI ↔Н2 + I2 - Q.
10. (2 балла). Скорость химической реакции, уравнение которой СаСО3 + 2НС1 = СаС12 + СО2↑ + Н2О, при уменьшении концентрации кислоты за каждые 20 с на 0,05 моль/л равна:
А. 2,5 моль/(л•с). Б. 0,25 моль/(л•с). В. 0,025 моль/(л•с). Г. 0,0025 моль/(л•с).
11. (8 баллов). Установите соответствие.
Уравнение реакции: l. S + O2 = SO2. 2. N2 + О2 ↔ 2NО.
Формула для определения скорости необратимой (1) или прямой (2) реакции:
A. v = k·C(S)·C(О2). Б. v = k·С(О2). B. v = k·C(N2)∙ C(O2). Г. v = k· С2(NO).
ЧАСТЬ Б. Задания со свободным ответом
12. (6 баллов). В какую сторону сместится химическое равновесие в реакции, уравнение которой 2СО + О2 ↔ 2СО2 + Q, в случае:
а) повышения температуры; б) повышения давления; в) увеличения концентрации О2;
г) применения катализатора? Дайте обоснованный ответ.
13. (6 баллов). Запишите схему химической реакции, скорость которой можно рассчитать по формуле v = k • С2А.
14. (4 балла). Почему реакция между кислотой и гладкой гранулой цинка идет медленнее, чем с этой же кислотой и шероховатой гранулой?
15. (6 баллов). Составьте термохимическое уравнение реакции синтеза аммиака, если в реакцию вступило 44,8 л водорода и при этом выделилось 60 кДж теплоты.
ВАРИАНТ 4. Скорость химических реакций. Химическое равновесие
ЧАСТЬ А. Тестовые задания с выбором ответа и на соотнесение
1. (2 балла). Фактор, не влияющий на скорость химической реакции:
А. Катализатор. Б. Концентрация реагирующих веществ.
B. Природа реагирующих веществ. Г. Размер пробирки.
2. (2 балла). Фактор, не влияющий на смещение химического равновесия:
А. Давление. Б. Ингибитор. B. Концентрация реагирующих веществ. Г. Температура.
3. (2 балла). С увеличением концентрации оксида углерода (II) в 2 раза скорость химической реакции, уравнение которой 2СО + О2 = 2СО2:
А. Не изменится. Б. Увеличится в 2 раза. B. Увеличится в 4 раза. Г. Уменьшится в 4 раза.
4. (2 балла). С уменьшением давления в 2 раза скорость прямой реакции, уравнение которой N2 + 3H2 <=> 2NH3, уменьшится:
А. В 2 раза. Б. В 8 раз. В. В 16 раз. Г. В 32 раза.
5. (2 балла). Для увеличения скорости химической реакции в 27 раз (температурный коэффициент γ=3) надо повысить температуру:
А. На 30 °С. Б. На 40 °С. В. На 50 °С Г. На 60 °С.
6. (2 балла). С увеличением давления равновесие обратимой химической реакции, уравнение которой CO(г)+2H2(г)↔CH3OH(г) + Q:
А. Не изменится. Б. Сместится в сторону продуктов реакции.
B. Сместится в сторону исходных веществ.
7. (2 балла). Для смещения химического равновесия обратимой реакции, уравнение которой СН3СООН + С2Н5ОН ↔ СН3СООС2Н5 + Н2О, в сторону продуктов реакции необходимо:
А. Добавить H2SO4. Б. Добавить щелочь. B. Добавить воду. Г. Применить катализатор.
8. (2 балла). Скорость химической реакции максимальна при взаимодействии веществ, формулы которых:
А. Н2 и О2. В. N2 и О2. Б. S и О2. Г. С5Н12 и О2.
9. (2 балла). Повышение давления смещает химическое равновесие реакции вправо в системе, уравнение которой:
A. 2NO2 ↔ N2O4. Б. N2 + О2 ↔2NO. B. СаСО3 ↔ СаО + СО2. Г. СН4 ↔ С + 2Н2.
10. (2 балла). Скорость реакции, уравнение которой Zn + 2HCl = ZnCl2 + H2↑,
при уменьшении концентрации кислоты за каждые 30 с на 0,06 моль/л равна:
А. 0,001 моль/(л • с). Б. 0,002 моль/(л • с). В. 0,004 моль/(л • с). Г. 0,02 моль/(л • с).
11. (8 баллов). Установите соответствие.
Уравнение реакции: 1. СаО + СО2 = СаСО3. 2. Н2 + С12 = 2НС1.
Формула для определения скорости реакции:
A.v = k·C(СаО)·C(СО2). Б. v = k·С(Н2)·С(Сl2) B.v = k· C(СO2). Г. v = k· С2(HCl).
ЧАСТЬ Б. Задания со свободным ответом
12. (6 баллов). В какую сторону сместится химическое равновесие реакции, уравнение которой С2Н4(Г) + Н2О(Г) ↔ С2Н5ОН(Г) + Q, в случае:
а) повышения температуры; б) повышения давления; в) увеличения концентрации С2Н4;
г) применения катализатора? Дайте обоснованный ответ.
13. (6 баллов). Запишите схему химической реакции, скорость которой можно рассчитать по формуле v = к· СА • СB.
14. (4 балла). Почему в местах хранения порожних цистерн, в которых перевозили концентрированную серную кислоту, нельзя зажигать огонь, опасно даже пламя спички?
15. (6 баллов). Составьте термохимическое уравнение реакции горения оксида углерода (II), если при сгорании 0,4 моль его выделилось 113,76 кДж теплоты.
Лабораторная работа №2
Тема :Изучение свойств металлов на примере железа. Качественные реакции на Fe+2и Fe+3.
Цель:Изучить свойства соединений железа.
Познакомиться с качественными реакциями
наFe+2и Fe+3.
Оборудование и реактивы: штатив с пробирками; растворы:,хлорида железа
сульфата железа(II),гидроксида натрия, серной кислоты, соляной кислоты, перманганата калия(KMnO4),гексациано(3)феррата калия-K3(Fe(CN)6), гексациано(2)феррата калия-K4(Fe(CN)6).
Опыт №1.Получение гидроксида железа(II) и превращение его в гидроксид железа(III).
Выполнение опыта:А).Взять чистую пробирку .Налить в нее 5-6 капель сульфата железа (II)-FeSO4 и добавить несколько капель гидроксида натрия(NaOH) до образования зеленого осадка. Какое вещество образовалось в пробирке? Напишите уравнение произошедшей реакции в молекулярной и ионной формах.
Б)Полученный в предыдущем опыте осадок разделите на две пробирки.Одну из них оставьте для следующего опыта, а другую энергично встряхивайте в течение 5-7минут до образования бурого осадка.Внимание: при встряхивании пробирки не закрывайте горлышко пробирки пальцем! . Какое вещество образовалось в пробирке? Напишите уравнение произошедшей реакции окисления гидроксида железа (II) на воздухе в присутствии паров воды. Внимание:данная реакция является
ОВР,при записи составьте электроный баланс.
Опыт№2.Изучение основных свойств гидроксида железа (II).
Выполнение опыта: К полученному в предыдущем опыте осадку зеленого цвета (Fe(OH)2) прилейте несколько капель соляной кислоты (HCL). Что наблюдаете? Напишите уравнение произошедшей реакции в молекулярной и ионной формах.
Опыт №3.Получение гидроксида железа(III).
Выполнение опыта: Взять чистую пробирку .Налить в нее 5-6 капель хлорида железа (III)-FeCL3 и добавить несколько капель гидроксида натрия(NaOH) до образования бурого осадка. Какое вещество образовалось в пробирке? Напишите уравнение произошедшей реакции в молекулярной и ионной формах.
Опыт№4.Изучение основных свойств гидроксида железа (III).
Выполнение опыта: К полученному в предыдущем опыте осадку бурого цвета (Fe(OH)3) прилейте несколько капель серной кислоты (H2SO4)). Что наблюдаете? Напишите уравнение произошедшей реакции в молекулярной и ионной формах.
Опыт№5.Окисление сульфата железа(II)) перманганатом калия(KMnO4)
Выполнение опыта:Взять чистую пробирку .Налить в нее 5-6 капель раствора перманганата калия(KMnO4) (обратите внимание на цвет раствора!), добавить2-3 капли серной кислоты (H2SO4),4-5 капель раствора сульфата железа (II)-(FeSO4).Наблюдайте изменения окраски раствора .Запишите наблюдения.
Напишите уравнение произошедшей реакции окисления сульфата железа (II) перманганатом калия(KMnO4) в кислой среде. Внимание: данная реакция являетсяОВР, при записи составьте электроный баланс.
Опыт№6.Качественные реакции на соли железа(II) и железа(III).
А)Образование осадка берлинской лазури.
Выполнение опыта:Взять чистую пробирку .Налить в нее 2-3 капли хлорида железа (III)-FeCL3 и добавить такое же количество желтой кровяной соли-K4(Fe(CN)6)-гексациано(2) феррат калия. Наблюдайте изменения окраски раствора .Запишите наблюдения.
Б) Образование осадка турнбулевой сини.
Выполнение опыта: Взять чистую пробирку .Налить в нее 2-3 капли раствора сульфата железа (II)-(FeSO4) и добавить такое же количество красной кровяной соли-K3(Fe(CN)6)-гексациано(3)) феррат калия. Наблюдайте изменения окраски раствора .Запишите наблюдения.
Письменно ответьте на вопросы:
1.Какую кристаллическую решетку имеет железо?
2.Что такое металлическая связь?
3.Какими физическими свойствами обладают металлы?
4.Какие степени окисления имеет железо?
5.Что такое ржавчина?
6.При каких условиях происходит ржавление железа?
Тест по теме «Металлы»
Вариант 1
1. Определите какая из электронных формул отражает строение атома натрия:
А) 1s2 2s2 2p6 3s2 3p6 4s2
Б) 1s2 2s2 2p6 3s1
В) 1s2 2s2 2p6 3s2 3p6 3d5 4s1
Г) 1s2 2s1
2. Определите в каких парах обе реакции практически осуществимы:
А) Cu + Zn2+ → ; Fe3+ + K→
Б) Mg + Cu2+ → ; Cr + H+ →
В) Ca2+ + Zn → ; Al3+ + Na →
Г) Ca + H+ → ; Pb2+ + Cu →
3. В какой из групп все металлы растворяются в кислотах:
А) Al, Fe, Cu Б) Ag, K, Ba
В) Ca, Zn, Fe Г) Au, Mg, Na
4. В 4 пробирки налиты растворы солей. В каждой из них – кусочек цинка. В какой из пробирок будет идти реакция с раствором:
А) CaCl2 Б) CuSO4
В) Mg(NO3)2 Г) FeCl3
Тест по теме «Металлы»
Вариант 2
1. Какой из металлов, электронные формулы которых записаны ниже, наиболее химически активен:
А) 1s2 2s2 2p6 3s1
Б) 1s2 2s2 2p6 3s2 3p6 3d10 4s2
В) 1s2 2s2 2p6 3s2 3p6 4s1
Г) 1s2 2s1
2. Проанализируйте, в каких группах все три металла могут вытеснять медь из раствора хлорида меди. Выберите правильный ответ:
А) Al, Zn, Na Б) Fe, Hg, Sr
В) Zn, Fe, Ca Г) Ag, Pb, Zn
3. Какие реакции практически осуществимы:
А) Cu + HCl → Б) Cu + AgCl →
В) Ca + H2O → Г) Zn + Pb(NO3)2 →
4. Какое из свойств наиболее характерно для всех металлов:
А) твердость Б) восстановительная активность
В) взаимодействие с водой Г) сильные окислительные свойства
Тест по теме «Металлы»
Вариант 3
1. Определите, какая из электронных формул отражает строение атома железа:
А) 1s2 2s2 2p6 3s2 3p6 3d5 4s1 Б) 1s2 2s2 2p6 3s2 3p6 4s2
В) 1s2 2s2 2p6 3s2 3p6 3d6 4s2 Г) 1s2 2s2 2p6 3s2 3p6 4s1
2. Укажите, в каких случаях железо и его соединения являются окислителями:
А) Fe0 → Fe2+ Б) Fe3+ → Fe2+
В) Fe2+ → Fe0 Г) Fe2+ → Fe3+
3. Определите, какие группы реакций показывают процессы, при которых медную пластинку можно превратить в черный порошок, а затем в голубой раствор:
А) Cu + H2O → ; CuCl2 + NaOH →
Б) Cu + O2 → ; CuO + HCl →
В) Cu + Cl2 → ; Cu + HgCl2 →
Г) Cu + O2 → ; CuO + H2O →
4. Чем объяснить, что металлы хорошо проводят электрический ток:
А) электропроводность металлов обусловлена свободным перемещением валентных электронов в кристаллической решетке
Б) не все металлы проводят электрический ток
В) металлы хорошо проводят электрический ток благодаря наличию s- электронов
Г) электропроводность металлов обусловлена низкой энергией отрыва валентных электронов
Тест по теме «Металлы»
Вариант 4
1. Какой из металлов, электронная формула которого записана ниже, относится к d-элементам:
А) 1s2 2s2 2p6 3s2
Б) 1s2 2s2 2p6 3s2 3p6 3d1 4s1
В) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p1
Г) 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d2 5s2
2. Определите в каких группах обе реакции практически осуществимы:
А) Cu + Hg2+ → ; H+ + K→ Б) Mg + Pb2+ → ; Al + H+ →
В) Ca2+ + Zn → ; Fe2+ + Cu → Г) Na + Cu2+ → ; Na+ + Fe →
3. В какой из групп все металлы растворяются в кислотах:
А) Mg, Al, Cu Б) Au, K, Fe
В) Zn, Ca, Cr Г) Ag, Sn, Pb
4. В какой группе ПСХЭ находятся самые активные металлы:
А) седьмой группе, побочной подгруппе
Б) первой группе, главной подгруппе
В) второй группе, побочной подгруппе
Г) пятой группе, главной подгруппе
Контрольная работа №1
По теме: «Неорганическая химия»
Вариант___1____
Часть A
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-8) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
А-1 Выберите формулу,соответствующую атому фосфора
1.1s22s22p63s23p1
2 1s22s22p63s23p5
3.1s22s22p63s23p3
А-2 Укажите число электронов в атоме кальция:
1.40
2.20
3.19
А-3 Неметаллические свойства в группах сверху вниз:
1.Ослабевают
2.Не изменяются
3.Усиливаются
А-4.Выберите ряд веществ с ионной связью:
1. HCl H2O Cl2O7 PH3
2. KCl H2O2 Cl2O5 NH3
3. BaCl2 Mg(NO3)2 Na3PO4 CuO
А-5.Степень окисления серы в соли K2SO4 равна:
1.+2
2.+4
3.+6
А-6. Щелочная реакция среды образуется при гидролизе:
1. K3PO4
2. `CuCl2
3. ZnSO4
A-7.В 60 граммах воды растворили 40грамм вещества. Концентрация полученного раствора равна:
1.20%
2.40%
3.60%
А-8. При взаимодействии хлорида железа(II) с гидроксидом натрия
образуется осадок. Это:
1. Fe(OH)3
2. Fe(OH)2
3. NaCl
Часть В
Ответом к заданиям этой части (В1-В4) является набор цифр. В заданиях В1-В4, на установление соответствия, запишите в таблицу цифры выбранных вами ответов под соответствующими буквами.
В-1Установите соответствие между формулой вещества и классом
неорганических веществ, к которому данное вещество принадлежит
Формула вещества: Класс веществ:
А)Bi(OH)3 1.Оксиды
B)HCl 2.Кислоты
C)BaHPO4 3.Соли
4.Основания
В-2 Установите соответствие между уравнением реакции и типом химической реакции.
Уравнение реакции: Тип реакции :
А) CuO+H2=Cu +H2O 1.Соединения
B)BaO + 2HNO3= Ba(NO3)2 + H2O 2.Замещения
C)2K +Cl2=2KCl 3.Обмена
4.Разложения
В-3 Установите соответствие между молярными массами веществ и их формулами.
Формула вещества: Молярная масса:
А) K2O 1.150
В) HMnO4 2. 120
C)CsOH 3.94
4. 90
В-4 Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества: Продукты реакции:
А)ZnSO4+2NaOH 1.ZnCl2 +2H2O
B)ZnO +2HCl 2.NaCl +H2O
C)Zn(OH)2+2HCl 3.ZnCl2 + H2O
4.Zn(OH)2 +Na2SO4
ЧастьС
Для записи ответов к заданиям этой части (C1 – C2) используйте бланк ответов № 2. Запишите сначала номер задания (С1 и т. д.),а затем полное решение. Ответы записывайте четко и разборчиво.
С-1 Осуществить превращения:
![]()
![]()
![]()
![]()
![]() Ca
Ca(OH)2
CaCO3
Ca(HCO3)2
CaCO3
CaO
Ca
Ca(OH)2
CaCO3
Ca(HCO3)2
CaCO3
CaO
С-2 Решить задачу.
Реакция между оксидом азота и хлором протекает по
уравнению: 2NO + Cl2 <==> 2NOCl. Как изменится
скорость прямой реакции при увеличении концентрации
оксида азота в два раза.
Вариант №_2_
Часть A
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-8) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
А-1 Выберите формулу,соответствующую атому кальция
1. 1s22s22p63s23p64s2
2. 1s22s22p63s23p63d24s2
3. 1s22s22p63s23p63d04s1
А-2 Укажите число нейтронов в атоме натрия:
1.12
2.11
3.23
А-3. Неметалические свойства в периоде слева направо:
1.Ослабевают
2.Не изменяются
3.Усиливаются
А-4.Вещество, молекула которого обладает ковалентной неполярной
связью:
1.Вода жидкая
2.Кислород
3.Серная кислота
А-5.Степень окисления марганца в соли KMnO4 равна:
1.+6
2.+7
3.+4
А-6.
При гидролизе соли CuCl2
среда раствора будет:
1.Щелочная
2.Кислая
3.Нейтральная
A-7.В90 граммах воды растворили 10 грамм вещества. Концентрация полученного раствора равна:
1.20%
2.30%
3.10%
А-8 При взаимодействии гидроксида железа(III) с раствором серной кислоты бурый осадок растворяется, при этом образуется вещество:
1.FeSO4
2 Fe(OH)2
3 Fe2(SO4)3
Часть В
Ответом к заданиям этой части (В1-В4) является набор цифр. В заданиях В1-В4, на установление соответствия, запишите в таблицу цифры выбранных вами ответов под соответствующими буквами.
В-1Установите соответствие между формулой вещества и классом
неорганических веществ, к которому данное вещество принадлежит
Формула вещества: Класс веществ:
А)Mg(OH)NO3 1.Оксиды
B) NO2 2.Кислоты
C)H2SO4 3.Соли
4.Основания
В-2 Установите соответствие между уравнением реакции и типом химической реакции.
Уравнение реакции: Тип реакции :
А)CO2 +H2O =H2CO3 1.Обмена
B)2Na+H2SO4=Na2SO4+H2 2Замещения
C)BaCl2+H2SO4=BaSO4+2HCl 3.Соединения
4.Разложения
В-3 Установите соответствие между молярными массами веществ и их формулами.
Молярная масса: Формула вещества:
А) 56 1.Mg(NO3)2
В) 98 2.Na2CO3
С) 148 3. KOH
4.H2SO4
В-4 Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества: Продукты реакции:
А)FeSO4+2NaOH 1Fe3O4+H2
B) FeCl3+3NaOH 2Fe(OH)3+3NaCl
C) Fe +H2O 3 Fe(OH)2 +NaCl
4Fe(OH)2+Na2SO4
ЧастьС
Для записи ответов к заданиям этой части (C1 – C2) используйте бланк ответов № 2. Запишите сначала номер задания (С1 и т. д.),а затем полное решение. Ответы записывайте четко и разборчиво.
С-1 Осуществить превращения:
![]()
![]()
![]()
![]()
![]() Fe
FeCl2
Fe(OH)2
Fe(OH)3
FeCl3
FeOHCl2
Fe
FeCl2
Fe(OH)2
Fe(OH)3
FeCl3
FeOHCl2
С-2 Решить задачу.
Температурный коэффициент реакции равен 2.Определите во сколько раз увеличится скорость реакции при повышении температуры от 20 до 50оС?
Вариант №_3__
Часть A
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-8) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
А-1 Выберите формулу,соответствующую атому магния:
1.1s22s22p63s23p3
2 1s22s22p63s2
3.1s22s22p63s23p1
А-2 Укажите заряд ядра атома натрия:
1.+12
2.+23
3.+11
А-3 Неметаллические свойства в группах сверху вниз:
1.Ослабевают
2.Не изменяются
3.Усиливаются
А-4.Выберите ряд веществ с ковалентной неполярной связью:
1.Na2O NaOH BaCl2 Mg(NO3)2
2. Cl2 H2 Br2 N2
3. HCl H2O Cl2O7 PH3
А-5.Степень окисления азота в соли KNO2 равна:
1.+3
2.+4
3.+5
А-6. Кислая реакция среды образуется при гидролизе:
1. K3PO4
2. Na2CO3
3. FeSO4
A-7.В 70 граммах воды растворили 30 грамм вещества. Концентрация полученного раствора равна:
1.20%
2.25%
3.30%
А-8. При взаимодействии кальция с водой выделяется газ:
1.Кислород
2.Водород
3.Азот
Часть В
Ответом к заданиям этой части (В1-В4) является набор цифр. В заданиях В1-В4, на установление соответствия, запишите в таблицу цифры выбранных вами ответов под соответствующими буквами.
В-1Установите соответствие между формулой вещества и классом
неорганических веществ, к которому данное вещество принадлежит
Формула вещества: Класс веществ:
А)Cu(OH)2 1.Оксиды
B)K3PO4 2.Кислоты
C)Ca(OH)CL 3.Соли
4.Основания
В-2 Установите соответствие между уравнением реакции и типом химической реакции.
Уравнение реакции: Тип реакции :
А)CaCO3 + HCl= CaCL2 +H2O+CO2 1.Соединения
B)CaO + 2HNO3= Ca(NO3)2 + H2O 2.Замещения
C)3Mg +N2 = Mg3N2 3.Обмена
4.Разложения
В-3 Установите соответствие между молярными массами веществ и их формулами.
Молярная масса: Формула вещества:
А) 40 1.CuSO4
В) 160 2.Na2CO3
С) 36,5 3MgO
4.HCl
В-4 Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества: Продукты реакции:
А) Na2CO3 + H2SO4 1.Na2SO4+2H2O
B) NaOH +H2SO4 2NaCl +H2SO4
C) Na +HCl 3NaCl +H2
4Na2SO4+CO2+H2O
ЧастьС
Для записи ответов к заданиям этой части (C1 – C2) используйте бланк ответов № 2. Запишите сначала номер задания (С1 и т. д.),а затем полное решение. Ответы записывайте четко и разборчиво.
С-1 Осуществить превращения:
![]()
![]()
![]()
![]()
![]()
![]() Mg
MgO Mg(OH)2
MgCl2
Mg(OH)2
MgSO4
Mg
MgO Mg(OH)2
MgCl2
Mg(OH)2
MgSO4
MgOHCl
С-2 Решить задачу.
Вычислить, во сколько раз увеличится скорость
реакции при повышении
температуры от 400 до 600 С, если температурный
коэффициент реакции равен 3.
Вариант №__4_
Часть A
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-8) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
А-1 Выберите формулу,соответствующую атому алюминия:
1.1s22s22p63s23p1
2 1s22s22p63s23p5
3.1s22s22p63s23p3
А-2 Укажите общее число протонов в атоме серы:
1.32
2.15
3.16
А-3 Неметаллические свойства в периоде слева направо:
1.Ослабевают
2.Не изменяются
3.Усиливаются
А-4. Вещество, молекула которого обладает ковалентной неполярной связью:
1.Вода
2.Хлор
3.Поваренная соль
А-5 Процессу окисления соответствует схема:
1.Cu+0 -2e =Cu+2
2 S+6 +2e =S+4
3 Mn+7 +5e =Mn+2
-6. При гидролизе соли Na2CO3 среда раствора будет:
1.Кислая
2.Щелочная
3.Нейтральная
A-7.В 90 граммах воды растворили 10 грамм вещества. Концентрация полученного раствора равна:
1.10%
2.15%
3.20%
А-8. При взаимодействии гидроксида железа (II) с кислородом воздуха и парами воды образуется:
1.Fe(OH)3
2 Fe(OH)2
3 Na2SO4 Часть В
Ответом к заданиям этой части (В1-В4) является набор цифр. В заданиях В1-В4, на установление соответствия, запишите в таблицу цифры выбранных вами ответов под соответствующими буквами.
В-1Установите соответствие между формулой вещества и классом
неорганических веществ, к которому данное вещество принадлежит
Формула вещества: Класс веществ:
А)LiCL 1.Оксиды
B)P2O5 2.Кислоты
C)H2CO3 3.Соли
4.Основания
В-2 Установите соответствие между уравнением реакции и типом химической реакции.
Уравнение реакции: Тип реакции :
А) Mg+ H2SO4 = MgSO4 +H2 1.Соединения
B) NaOH +HCl =NaCl+H2O 2.Замещения
C) H2+O2 = H2O 3.Обмена
4.Разложения
В-3 Установите соответствие между молярными массами веществ и их формулами.
Молярная масса: Формула вещества:
А)78 1.P2O5
В)158 2.K2SO3
С)142 3. Al(OH)3
4.KMnO4
В-4 Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества: Продукты реакции:
А) CaCl2 + 2NaOH 1 CaCl2 +H2O
B) CaO +2HCl 2 Ca(OH)2 +KCl
C) Ca(OH)2+ H2SO4 3 CaSO4 +2H2O
4 Ca(OH)2+2NaCl
ЧастьС
Для записи ответов к заданиям этой части (C1 – C2) используйте бланк ответов № 2. Запишите сначала номер задания (С1 и т. д.),а затем полное решение. Ответы записывайте четко и разборчиво.
С-1 Осуществить превращения:
![]()
![]()
![]()
![]()
![]()
![]() Cu
CuO Cu(NO3)2
Cu(OH)2
CuCl2
CuOHCl
Cu
CuO Cu(NO3)2
Cu(OH)2
CuCl2
CuOHCl
CuSO4
С-2 Решить задачу.
Реакция между оксидом серы и кислородом протекает по
уравнению:
2SО2 +O2 = 2S О3 (г). Как изменится скорость
реакции при увеличении концентрации SO2 в два раза
Вариант №__5_
Часть A
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-8) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
А-1 Выберите формулу,соответствующую атому фосфора:
1.1s22s22p63s23p1
2 1s22s22p63s2
3.1s22s22p63s23p3
А-2 Укажите общее число нейтронов в атоме углерода:
1.12
2. 6.
3.16
А-3 Металлические свойства в группе снизу вверх:
1.Ослабевают
2.Не изменяются
3.Усиливаются
А-4.Ионная связь осуществляется в молекулах веществ:
1.HCl и H2SO4
2 LiCl и Na2S
3 NH4Cl и PH3
А-5.
Только щелочи расположены в ряду:
1.KOH Cu(OH)2
Zn(OH)2
2 NaOH Ca(OH)2 KOH
3 Al(OH)3 Fe(OH)2 Pb(OH)2
А-6.
Гидролизу не подвергается соль:
1.K2CO3
2.NaNO3
3.CaCL2
A-7.В170 граммах воды растворили 30 грамм вещества. Концентрация полученного раствора равна:
1.20%
2.15%
3.10%
А-8.
Водный раствор гидроксида натрия(NaOH)
не реагирует с каждым из веществ:
1.KOH и KCl
2 Ca(OH)2 и Mg(OH)2
3 FeSO4 и FeCl3
Часть В
Ответом к заданиям этой части (В1-В4) является набор цифр. В заданиях В1-В4, на установление соответствия, запишите в таблицу цифры выбранных вами ответов под соответствующими буквами.
В-1Установите соответствие между формулой вещества и классом
неорганических веществ, к которому данное вещество принадлежит
Формула вещества: Класс веществ:
А)Al(OH)3 1.Оксиды
B)H3BO3 2.Кислоты
C)Cr2O3 3.Соли
4.Основания
В-2 Установите соответствие между уравнением реакции и типом химической реакции.
Уравнение реакции: Тип реакции :
А)K2SO4+Pb(OH)2=PbSO4+2KOH 1.Соединения
B)Na2O+CO2=Na2CO3 2.Замещения
C)2Fe(OH)3=Fe2O3+3H2O 3.Обмена
4.Разложения
В-3 Установите соответствие между молярными массами веществ и их формулами.
Формула вещества: Молярная масса:
А) Cr2O3 1.144
В) NaHCO3 2.152
С) Cu2O 3. 100
4.84
В-4 Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества: Продукты реакции:
А) MgSO4 + NaOH 1 MgCl2 +H2O
B) MgO +2HCl 2MgOHCl+HCl
C) Mg(NO3)2 +KOH 3Mg(OH)2 +Na2SO4
4Mg(OH)2 +2KNO3
ЧастьС
Для записи ответов к заданиям этой части (C1 – C2) используйте бланк ответов № 2. Запишите сначала номер задания (С1 и т. д.),а затем полное решение. Ответы записывайте четко и разборчиво.
С-1 Осуществить превращения:
![]()
![]()
![]()
![]()
![]() Zn
ZnO ZnCl2
Zn(OH)2
ZnCl2
ZnOHCl
Zn
ZnO ZnCl2
Zn(OH)2
ZnCl2
ZnOHCl
С-2 Решить задачу.
. Вычислите, во сколькоувеличится скорость
реакции при повышении
температуры от 300С до 700С, если температурный
коэффициент реакции равен 2.
Вариант №__6_
Часть A
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-8) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
А-1 Химический элемент с электронной конфигурацией
1s22s22p63s23p2 образует оксид:
1.ЭО
2.ЭО2
3.ЭО3
А-2 Укажите общее число нейтронов в изотопе кислорода-16
1.8
2. 9
3.10
А-3 Уменьшение металлических свойств простых веществ происходит в ряду:
1.Ca-Ba-Be
2 Ba –Ca-Be
3 Be-Ca-Ba
А-4.Ионная связь осуществляется в молекулах веществ:
1.HCl и H2SO4
2 LiCl и Na2S
3 NH4Cl и PH3
А-5.
Только соли расположены в ряду:
1HCl Na2SO4
H2SO4
2 Na2CO3 KNO3 K2SO3
3 H3PO4 H2S H2SO4
А-6. Степень окисления -2 и +6 имеет сера в соединениях:
1.K2S и K2SO4
2 Na2SO4 и K2SO3
3 FeSO4 и Fe2(SO4)3
A-7.В 150 граммах воды растворили 50 грамм вещества. Концентрация полученного раствора равна:
1.25%
2.10%
3.15%
А-8. С разбавленной cоляной кислотой не может реагировать:
1. Na
2 Cu
3 Zn Часть В
Ответом к заданиям этой части (В1-В4) является набор цифр. В заданиях В1-В4, на установление соответствия, запишите в таблицу цифры выбранных вами ответов под соответствующими буквами.
В-1Установите соответствие между формулой вещества и классом
неорганических веществ, к которому данное вещество принадлежит
Формула вещества: Класс веществ:
А)SiO2 1.Оксиды
B)MnCL2 2.Кислоты
C) H2S 3.Соли
4.Основания
В-2 Установите соответствие между уравнением реакции и типом химической реакции.
Уравнение реакции: Тип реакции :
А)CaCO3=CaO+CO2 1.Соединения
B)CaO + P2O5= Ca3(PO4)2 2.Замещения
C)6K+2H3PO4=2K3PO4+3H2 3.Обмена
4.Разложения
В-3 Установите соответствие между молярными массами веществ и их формулами.
Формула вещества: Молярная масса:
А) ZnO 1.62
В) Al(OH)3 2.78
С) H3BO3 3. 80
4.82
В-4 Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества: Продукты реакции:
A)SO2 + 2NaOH 1 NaHSO3 +NaOH
B)2NaOH + H2SO4 2Na2SO3 + H2O
C)Na2SO3 +H2O 3Na2SO4+H2O
4Na2SO3+ H2O
ЧастьС
Для записи ответов к заданиям этой части (C1 – C2) используйте бланк ответов № 2. Запишите сначала номер задания (С1 и т. д.),а затем полное решение. Ответы записывайте четко и разборчиво.
С-1 Осуществить превращения:
![]()
![]()
![]()
![]()
![]()
![]() Cr
Cr2O3
Cr2(SO4)3
Cr(OH)3
CrCl3
CrOHCl2
Cr
Cr2O3
Cr2(SO4)3
Cr(OH)3
CrCl3
CrOHCl2
K[Cr(OH)4]
С-2 Решить задачу.
Рассчитать, как изменится скорость прямой реакции
2NO + O2=2 NO2., если концентрацию NO и O2
увеличить в 4 раза.
Вариант №_7__
Часть A
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-8) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
А-1 Масса веществ, вступивших в реакцию всегда:
1.Равна массе образующихся веществ
2.Больше массы образующихся веществ
3.Меньше массы образующихся веществ
А-2 Укажите общее число протонов в атоме кремния:
1.14
2. 7
3.10
А-3 Уменьшение неметаллических свойств простых веществ происходит в ряду:
1.F-Cl-Br
2Cl-Br-F
3 Br-Cl-F
А-4.При гидролизе соли CuCL2 среда раствора будет:
1. Кислой
2. Щелочной
3. Нейтральной
А-5. Степень окисления марганца +7 и +6 будет в соединениях:
1.KMnO4 и MnO2
2 K2MnO4 и MnO2
3 KMnO4 и K2MnO4
А-6 Ковалентная полярная связь осуществляется в молекулах веществ:
1.Na2O NaOH BaCl2 Mg(NO3)2
2. Cl2 H2 Br2 N2
3. HCl H2O Cl2O7 PH3
A-7. .В 120 граммах воды растворили 30 грамм вещества. Концентрация полученного раствора равна:
1.15%
2.20%
3.25%
А-8. При взаимодействии кальция с водой образуются вещества:
1.CaO и H2
2Ca(OH)2 и H2O
3 2Ca(OH)2 и H2
Часть В
Ответом к заданиям этой части (В1-В4) является набор цифр. В заданиях В1-В4, на установление соответствия, запишите в таблицу цифры выбранных вами ответов под соответствующими буквами.
В-1Установите соответствие между формулой вещества и классом
неорганических веществ, к которому данное вещество принадлежит
Формула вещества: Класс веществ:
А)MgCl2 1.Оксиды
B)H2SO3 2.Кислоты
C)KClO4 3.Соли
4.Основания
В-2 Установите соответствие между уравнением реакции и типом химической реакции.
Уравнение реакции: Тип реакции :
А)2 NaOH + FeSO4= Na2SO4+Fe(OH)2 1.Соединения
B)Cu(OH)2 =CuO + H2O 2.Замещения
C) Ca +2H2O=Ca(OH)2+H2 3.Обмена
4.Разложения
В-3 Установите соответствие между молярными массами веществ и их формулами.
Формула вещества: Молярная масса:
А) CuOHNO3 1.143
В) H2CO3 2.60
С)Cl2O7 3. 62
4.183
В-4 Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества: Продукты реакции:
А)CO2 +Ca(OH)2 1CaCO3
B)Ca(OH)2+Ca(HCO3)2 2CaCO3+NaHCO3
C)CO2+CaO 3CaCO3+H2O
4CaCO3 +2H2O
ЧастьС
Для записи ответов к заданиям этой части (C1 – C2) используйте бланк ответов № 2. Запишите сначала номер задания (С1 и т. д.),а затем полное решение. Ответы записывайте четко и разборчиво.
С-1 Осуществить превращения:
![]()
![]()
![]()
![]()
![]()
![]() S
SO2
SO3
H2SO4
MgSO4
Mg(OH)2
S
SO2
SO3
H2SO4
MgSO4
Mg(OH)2
(MgOH)2SO4
C-2 Решить задачу
Температурный коэффициент реакции равен 3.Определите во сколько раз увеличится скорость реакции при повышении температуры от 300С до 70оС.
Вариант___8______
Часть A
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-8) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
А-1 Свойства простых веществ, а также их соединений ,находятся в периодической зависимости от:
1.Количества протонов
2.Количества электронов
3.Заряда ядра их атомов
А-2 Укажите общее число электронов в атоме фтора:
1.7
2.8
3.9
А-3 Химический элемент с электронной конфигурацией
1s22s22p63s2 образует оксид:
1.ЭО
2.ЭО2
3.ЭО3
А-4. . Вещество, молекула которого обладает ковалентной полярной связью:
1.Вода
2.Железо
3.Поваренная соль
А-5. Степень окисления азота +2 и +3 будет в соединениях:
1.HNO3 и KNO3
2 NO2 и NH3
3 KNO2 и NO
А-6 При гидролизе Mg(NO3)2 образуются вещества:
1. Mg(OH)2 и HNO3
2 MgOHNO3 и HNO3
3 HNO3 и H2O
A-7. .В 96 граммах воды растворили 24 грамма вещества. Концентрация полученного раствора равна:
1.15%
2.20%
3.25%
А-8. Реакция ионного обмена идет до конца,если образуются:
1.NaNO3 и K2SO4
2 H2SO4 и NaOH
3 Na2SO4 и H2O
Часть В
Ответом к заданиям этой части (В1-В4) является набор цифр. В заданиях В1-В4, на установление соответствия, запишите в таблицу цифры выбранных вами ответов под соответствующими буквами.
В-1Установите соответствие между формулой вещества и классом
неорганических веществ, к которому данное вещество принадлежит
Формула вещества: Класс веществ:
А)Pb(OH)2 1.Оксиды
B)Ca(HCO3)2 2.Кислоты
C)SO3 3.Соли
4.Основания
В-2 Установите соответствие между уравнением реакции и типом химической реакции.
Уравнение реакции: Тип реакции :
А)MnO+SiO2=MnSiO3 1.Соединения
B)ZnO+FeSO4=FeO+ZnSO4 2.Обмена
C)2NaHCO3=Na2CO3+CO2+H2O 3.Замещения
4.Разложения
В-3 Установите соответствие между молярными массами веществ и их формулами.
Формула вещества: Молярная масса:
А) SO3 1.98
В) H3PO4 2.111
С) CaCl2 3. 112
4.80
В-4 Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества: Продукты реакции:
А)AlCl3+3NaOH 1.Al2(SO4)3 +3H2
B)AlCl3+ H2O 2. Al2(SO4)3+3H2O
C)Al2O3+ 3H2SO4 3.Al(OH)3 +3NaCl
4. AlOHCl2 +HCl
ЧастьС
Для записи ответов к заданиям этой части (C1 – C2) используйте бланк ответов № 2. Запишите сначала номер задания (С1 и т. д.),а затем полное решение. Ответы записывайте четко и разборчиво.
С-1 Осуществить превращения:
![]()
![]()
![]()
![]()
![]() P
P2O5 H3PO4 Na3PO4
NaH2PO4
P
P2O5 H3PO4 Na3PO4
NaH2PO4
PH3
С-2 Решить задачу
Во сколько раз увеличится скорость
реакции 2А + 3В → А2 В3, если увеличить концентрацию
вещества А в 3 раза?
Вариант №_9__
Часть A
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-8) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
А-1 Cколько протонов,нейтронов и электронов имеет атом мышьяка:
1.Протонов-33,нейтронов-42,электронов-33
2. Протонов-33,нейтронов-42,электронов-75
3. Протонов-35,нейтронов-42,электронов-75
А-2 Укажите заряд ядра атома магния:
1. +28
2 +14
3 + 12
А-3 Металлические свойства увеличиваются в ряду:
1.Rb-Cs-Fr
2 Cs-Fr-Rb
3 Fr-Cs-Rb
А-4. Вещества с ковалентной неполярной связью расположены в ряду:
1.Na2O NaOH BaCl2 Mg(NO3)2
2.Cl2 H2 Br2 N2
3. HCl H2O Cl2O7 PH3
А-5. Только основания расположены в ряду:
1.HCl K2SO4 Na2S
2 Li OH KOH Mg(OH)2
3 NaNO3 Ca SO4 PbCl2
А-6 Степень окисления железа +2 и+3 будет в соединениях:
1.FeSO4 Fe(OH)2
2Fe(OH)2 Fe2(SO4)3
3Fe2(SO4)3 Fe(OH)3
A-7. .В 360граммах воды растворили 40 грамм вещества. Концентрация полученного раствора равна:
1.10%
2.20%
3.25%
А-8. При взаимодействии магния с соляной кислотой выделяется газ:
1.H2
2 CO2
3 O2 Часть В
Ответом к заданиям этой части (В1-В4) является набор цифр. В заданиях В1-В4, на установление соответствия, запишите в таблицу цифры выбранных вами ответов под соответствующими буквами.
В-1Установите соответствие между формулой вещества и классом
неорганических веществ, к которому данное вещество принадлежит
Формула вещества: Класс веществ:
А)Fe(NO3)2 1.Оксиды
B)Al(OH)3 2.Кислоты
C)H2SO3 3.Соли
4.Основания
В-2 Установите соответствие между уравнением реакции и типом химической реакции.
Уравнение реакции: Тип реакции :
А)2 NaOH +SiO2= Na2SiO3 1.Соединения
B)2Fe+6HCl=2FeCl3=3H2 2.Замещения
C)4Al+3O2=2Al2O3 3.Обмена
4.Разложения
В-3 Установите соответствие между молярными массами веществ и их формулами.
Формула вещества: Молярная масса:
А) MgO 1.56
В) H2SiO3 2.60
С) KOH 3. 78
4.40
В-4 Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества: Продукты реакции:
А)BaSO4+2NaOH 1.BaCl2 +2H2O
B)BaO +2HCl 2.NaCl +H2O
C)Ba(OH)2+2HCl 3.BaCl2 + H2O
4.Ba(OH)2 +Na2SO4
ЧастьС
Для записи ответов к заданиям этой части (C1 – C2) используйте бланк ответов № 2. Запишите сначала номер задания (С1 и т. д.),а затем полное решение. Ответы записывайте четко и разборчиво.
С-1 Осуществить превращения:
![]()
![]()
![]()
![]()
![]() N2
NO NO2
HNO3
NaNO3
N2
NO NO2
HNO3
NaNO3
![]()
NH3
С-2 Решить задачу
Рассчитать, как изменится скорость прямой реакции
3 H2+N2=2NH3, если концентрацию N2
увеличить в 4 раза
Вариант №__10
Часть A
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-8) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
А-1 Выберитеформулу,соответствующую атому хлора:
1.1s22s22p63s23p3
2 1s22s22p63s23p6
3.1s22s22p63s23p5
А-2 Укажите общее число нейтронов в изотопе стронция-90
1.38
2.50
3.52
А-3 Неметаллические свойства уменьшаются в ряду:
1.Cl-S-P
2 P-S-Cl
3 P-Cl-S
А-4. Ковалентная неполярная связь осуществляется в молекулах веществ:
1.Na2O NaOH BaCl2 Mg(NO3)2
2. Cl2 H2 Br2 N2
3. HCl H2O Cl2O7 PH3
А-5. Не подвергается гидролизу соль:
1.CuCl2
2 Na2S
3 BaSO4
А-6 Cтепень окисления серы в соединении Na2SO4 равна:
1. +6
2. +4
3.+2
A-7. .В 200граммах воды растворили 50 грамм вещества. Концентрация полученного раствора равна:
1.15%
2.20%
3.25%
А-8. При взаимодействии хлорида меди с гидроксидом натрия выпадает осадок:
1.NaCL
2 Cu(OH)2
3 CuOHCL
Часть В
Ответом к заданиям этой части (В1-В4) является набор цифр. В заданиях В1-В4, на установление соответствия, запишите в таблицу цифры выбранных вами ответов под соответствующими буквами.
В-1Установите соответствие между формулой вещества и классом
неорганических веществ, к которому данное вещество принадлежит
Формула вещества: Класс веществ:
А)Bi(OH)3 1.Оксиды
B)HCl 2.Кислоты
C)BaHPO4 3.Соли
4.Основания
В-2 Установите соответствие между уравнением реакции и типом химической реакции.
Уравнение реакции: Тип реакции :
А) CuO+H2=Cu +H2O 1.Соединения
B)BaO + 2HNO3= Ba(NO3)2 + H2O 2.Замещения
C)2K +Cl2=2KCl 3.Обмена
4.Разложения
В-3 Установите соответствие между молярными массами веществ и их формулами.
Формула вещества: Молярная масса:
А) K2O 1.150
В) HMnO4 2. 104
C)CsOH 3.94
4. 90
В-4 Установите соответствие между исходными веществами и продуктами реакции.
Исходные вещества: Продукты реакции:
А)ZnSO4+2NaOH 1.ZnCl2 +2H2O
B)ZnO +2HCl 2.NaCl +H2O
C)Zn(OH)2+2HCl 3.ZnCl2 + H2O
4.Zn(OH)2 +Na2SO4
ЧастьС
Для записи ответов к заданиям этой части (C1 – C2) используйте бланк ответов № 2. Запишите сначала номер задания (С1 и т. д.),а затем полное решение. Ответы записывайте четко и разборчиво.
С-1 Осуществить превращения:
![]()
![]()
![]()
![]()
![]()
![]() Al
Al2O3 Al2(SO4)3
Al(OH)3 AlCl3 AlOHCl2
Al
Al2O3 Al2(SO4)3
Al(OH)3 AlCl3 AlOHCl2
Al(OH)3
С-2 Решить задачу
Температурный коэффициент реакции равен 3.Определите во сколько раз увеличится скорость реакции при повышении температуры от 30 до 50оС?
Оценка контрольной работы.
Часть А.
Задание с выбором ответа считается выполненным верно, если учащийся
указал код правильного ответа. Во всех остальных случаях задание счи
тается невыполненным. Каждый правильный ответ оценивается 1 баллом.
Часть В
Задание с кратким свободным ответом считается выполненным верно, если
правильно указана последовательность цифр (число). За полный правильный
ответ на задания В1-В4 ставятся 2 балла, за правильный неполный — 1 балл.
ЧастьС оценивается 3 баллами.
Обработка результатов контрольной работы.
Каждый вариант контрольной работы оценивается максимально 19
баллами. Примерная шкала перевода в пятибалльную систему оценки:
Оцеика «5»--17- 19 баллов (90-100%), оценка «4»-10-166баллов (66-90%) 7 -9
баллов (33- 65%) - «3», менее 6 баллов (до 32%) - «2».
Ответы к контрольной работе:
Часть А
|
В-1 |
В-2 |
В-3 |
В-4 |
В-5 |
В-6 |
В-7 |
В-8 |
В-9 |
В-10 |
|
А-1-3 |
А-1-1 |
А-1 -2 |
А-1-1 |
А-1-3 |
А-1-2 |
А-1-1 |
А-1-3 |
А-1-1 |
А-1-3 |
|
А-2-2 |
А-2-1 |
А-2-2 |
А-2-3 |
А-2-2 |
А-2-1 |
А-2-1 |
А-2-3 |
А-2-3 |
А-2-3 |
|
А-3-1 |
А-3-3 |
А-3-3 |
А-3-3 |
А-3-3 |
А-3-2 |
А-3-1 |
А-3-1 |
А-3-1 |
А-3-1 |
|
А-4-3 |
А-4-2 |
А-4-2 |
А-4-2 |
А-4-2 |
А-4-2 |
А-4-1 |
А-4-1 |
А-4-2 |
А-4-2 |
|
А-5-3 |
А-5-2 |
А-5-1 |
А-5-1 |
А-5-2 |
А-5-2 |
А-5-3 |
А-5-3 |
А-5-2 |
А-5-3 |
|
А-6-1 |
А-6-2 |
А-6-3 |
А-6-2 |
А-6-2 |
А-6-1 |
А-6-3 |
А-6-2 |
А-6-2 |
А-6-1 |
|
А-7-2 |
А-7-3 |
А-7-3 |
А-7-1 |
А-7-2 |
А-7-1 |
А-7-2 |
А-7-2 |
А-7-1 |
А-7-2 |
|
А-8-2 |
А-8-3 |
А-8-2 |
А-8-1 |
А-8-2 |
А-8-2 |
А-8-3 |
А-8-3 |
А-8-1 |
А-8-2 |
Часть В
|
Вариант |
В-1 |
В-2 |
В-3 |
В-4 |
|
№1 |
4 2 3 |
2 3 1 |
3 2 1 |
4 3 1 |
|
№2 |
3 1 2 |
3 2 1 |
3 4 1 |
4 2 1 |
|
№3 |
4 3 3 |
3 3 1 |
3 1 4 |
4 1 3 |
|
№4 |
3 1 2 |
2 3 1 |
3 2 1 |
4 1 3 |
|
№5 |
4 2 1 |
3 1 4 |
2 4 1 |
3 1 4 |
|
№6 |
1 3 2 |
4 1 2 |
3 2 1 |
4 3 1 |
|
№7 |
3 2 3 |
3 4 2 |
1 3 4 |
3 4 1 |
|
№8 |
4 3 1 |
1 2 4 |
4 1 2 |
3 4 2 |
|
№9 |
3 4 2 |
1 2 1 |
4 3 1 |
4 3 1 |
|
№10 |
4 2 3 |
2 3 1 |
3 2 1 |
4 3 1 |
Часть С
В-1: Ca+ 2 H2 O=Ca(OH)2 +H2; Ca(OH)2+CO2 = CaCO3 +H2O; CaCO3 +H2CO3 =Ca(HCO3)2;
Ca(HCO3)2= CaCO3 +CO2 +H2О; CaCO3 = CaO +CO2
В-2: Fe + CL2 = FeCL2; FeCL2 +2 NaOH =Fe(OH)2 +2NaCL; 4Fe(OH)2 +O2 +2H2O =4 Fe(OH)3;
Fe(OH)3 +3HCL =FeCL3 +3H2О; FeCL3 + H2O =FeOHCL2 +HCL
В-3: 2 Mg + O2 = 2MgO; MgO + H2O =Mg(OH)2; Mg(OH)2 +2HCL =MgCL2 +2H2O;
MgCL2 +H2O =MgOHCL +HCL; MgCL2 + 2NaOH =Mg(OH)2 + 2NaCL
В-4: 2 Cu +O2 = 2 CuO; CuO + 2HNO3 =Cu(NO3)2 +H2O; Cu(NO3)2 +2NaOH =Cu(OH)2
+2NaNO3
Cu(OH)2 +2 HCL = CuCL2 +2H2O ; CuCL2 + 2NaOH = CuOHCL + NaCL;
Cu(OH)2 +H2SO4 =CuSO4 +2 H2O
В-5: 2 Zn +O2 = 2ZnO; ZnO +2 HCL =ZnCL2 +H2O; ZnCL2 + 2NaOH = Zn(OH)2 + 2NaCL
Zn(OH)2 + 2HCL = ZnCL2 + 2H2О; ZnCL2 + H2O = ZnOHCL + HCL
В-6: 4 Сr + 3 O2 = 2Cr2O3; Cr2O3 + 3H2SO4 = Cr2(SO4)3 +3 H2O;
Cr2(SO4)3 + 6NaOH = 2Cr(OH)3 + 3Na2SO4 ; Cr(OH)3 + KOH = K(Cr(OH)4);
Cr(OH)3 +3HCL = CrCL3 +3H2O; CrCL3 + NaOH =CrOHCL +NaCL
В-7: S + O2=SO2; 2 SO2 + O2 =2SO3 ; SO3 + H2O =H2SO4;
Mg + H2SO4 = MgSO4 + H2 ; MgSO4 + NaOH =( MgOH)2SO4;
MgSO4 + NaOH =Mg(OH)2 +Na2SO4
В-8: 2P + 5O2 = 2 P2O5; P2O5 + 3 H2O= 2H3PO4; H3PO4 + 3NaOH = Na3PO4 + 3H2O;
2 P + 3H2 = 2PH3; Na3PO4 + H2O= NaH2PO4
В-9: N2 +O2 =2NO; 2 NO +O2 = 2NO; 2 NO2 + H2O = 2HNO3;
N2 + 3H2 = 2NH3; 4 NH3 +5O2 = 4NO + 6H2O; HNO3 +NaOH = NaNO3 + H2O
В-10:
4Al + 3O2 = 2Al2O3
2 Al + 6 H2O = 2Al(OH)3 +3 H2 Al2O3
+3 H2![]() SO4 =Al2(SO4)3
+ 3H2O
SO4 =Al2(SO4)3
+ 3H2O
Al2(SO4)3 +6 NaOH =2 Al(OH)3 + 3Na2SO4 Al(OH)3 +3HCL =AlCl3 +3 H2O
AlCl3 + NaOH = Al(OH)Cl2 +NaCl
Практическая работа №5.
Тема: «Решение задач на вывод молекулярной формулы
вещества.Номенклатура алканов.»
![]()
![]()
![]() - относительная плотность вещества Х относительно
вещества Y
- относительная плотность вещества Х относительно
вещества Y
M(X), M(Y) – молярные массы веществ X и Y
M(воздуха) = 29 г/моль
M(Н2) = 2*1 г/моль = 2 г/моль
M(О2) = 2*16 г/моль = 32 г/моль
M(N2) = 2*14 г/моль = 28 г/моль
Задача1. Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 83,3%. Относительная плотность паров этого вещества по водороду равна 36.
Задача2. Найдите молекулярную формулу органического вещества, если известно, что массовая доля углерода в нем составляет 51,89%, водорода 9,73% и хлора 38,38%. Относительная плотность паров этого вещества по воздуху равна 3,19.
Задача3. Найдите молекулярную формулу углеводорода, массовая доля водорода в котором составляет 15,79%. Относительная плотность паров этого вещества по воздуху равна 3,93.
Задача4Найдите молекулярную формулу углеводорода, массовая доля углерода в котором составляет 81,8%. Относительная плотность вещества по азоту N2 равна 1,57.
Зачетная работа по теме «Углеводороды»
Вариант 1
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1.Укажите общую формулу аренов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
2.Укажите к какому классу относится УВ с формулой СН3 – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3.Укажите название вещества, формула которого СН2 = СН – СН2 – СН3
1) 2 метилбутен 2 2) бутен 1 3) бутан 4) бутин 1
4.Укажите название гомолога для пентадиена 1,3
1) бутадиен 1,2 2) бутадиен 1,3 3) пропадиен 1,2 4) пентадиен 1,2
5.Укажите название вещества, для которого характерна реакция замещения
1) бутан 2) бутен 1 3) бутин 4) бутадиен 1,3
6.Укажите название вещества, для которого характерна реакция
гидрирования(присоединение водорода)
1) пропен 2) пропан 3) этан 4) бутан
7.Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н4 и СН4 2) С3Н8 и Н2 3) С6Н6 и Н2О 4) С2Н4 и Н2
8.Определите, сколько молей углекислого газа образуется при полном сгорании метана
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
Часть Б. Задания со свободным ответом
9.Перечислите области применения алкенов. 2 балла
10Напишите уравнения химических реакций для следующих превращений: 6 баллов
CH4 → CH3Cl → C2H6 → C2H5NO2
Дайте названия продуктам реакции
Часть С. Задача
11. Выведите молекулярную формулу УВ, массовая доля углерода в котором составляет 83,3%. Относительная плотность паров этого вещества по водороду составляет 29. 4 балла
Зачетная работа по теме «Углеводороды»
Вариант 2
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкенов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
2. Укажите к какому классу относится УВ с формулой СН3 – С = СН2
|
СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название вещества, формула которого СН3 - СН = СН – СН3
1) пентин 2 2) бутан 3) бутен 2 4) бутин 1
4. Укажите название гомолога для бутана
1) бутен 2) бутин 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен 1 3) гексин 1 4) гексадиен 1,3
6. Укажите название вещества, для которого характерна реакция гидрирования
(присоединение водорода)
1) метан 2) пропан 3) пропен 4) этан
7.Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С3Н8 и О2 2) С2Н4 и СН4 3) С4Н10 и НCl 4) С2Н6 и Н2О
8.Определите, сколько молей углекислого газа образуется при полном сгорании этана
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
Часть Б. Задания со свободным ответом
9. Перечислите области применения алканов. 2 балла
10. Напишите уравнения химических реакций для следующих превращений: 6 баллов
CаС2 → C2Н2 → C6H6 → C6H5NO2 Дайте названия продуктам реакции
Часть С. Задача
1. Выведите молекулярную формулу УВ, массовая доля углерода и водорода в котором составляют 81,82% и 18,18% . Относительная плотность паров этого вещества по водороду составляет 2. 4 балла
» Зачетная работа по теме «Углеводороды
Вариант 3
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алкинов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
2. Укажите к какому классу относится УВ с формулой С6Н5 – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3.Укажите название вещества, формула которого СН3 – СН - СН2 – СН3
|
СН3
1) бутан 2) 2 метилпропан 3) 3 метилпентан 4) пентан
4. Укажите название гомолога для бутина 1
1) бутин 2 2) пентин 2 3) пентин 1 4) гексин 2
5. Укажите название вещества, для которого характерна реакция замещения
1) гексан 2) гексен 1 3) гексин 1 4) гексадиен 1,3
6. Укажите название вещества, для которого характерна реакция полимеризации
1) бутадиен 1,3 2) бутан 3) бензол 4) циклогексан
7. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) С2Н6 и HCl 2) С2Н4 и Сl2 3) С2Н16 и Н2O 4) С6Н6 и Н2О
8. Определите, сколько молей углекислого газа образуется при полном сгорании этена
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
Часть Б. Задания со свободным ответом
9. Перечислите области применения алкинов. 2 балла
10. Напишите уравнения химических реакций для следующих превращений: 6 баллов
СН4 → C2Н2 → C6H6 → C6H5Cl
Дайте названия продуктам реакции
Часть С. Задача
11 Выведите молекулярную формулу УВ, массовая доля углерода и водорода в котором составляют 92,31% и 7,69% . Относительная плотность паров этого вещества по водороду составляет 13. 4 балла
Зачетная работа по теме «Углеводороды»
Вариант 4
Часть А. Тестовые задания с выбором ответа. За задание 1 балл
1. Укажите общую формулу алканов
1) CnH2n +2 2) CnH2n 3) CnH2n—2 4) CnH2n -6
2.Укажите к какому классу относится УВ с формулой СН = С – СН3
1) алканов 2) алкенов 3) алкинов 4) аренов
3. Укажите название вещества, формула которого СН2 = СН - СН = СН2
1) бутадиен 1,3 2) бутин 1 3) бутен 1 4) бутан
4. Укажите название гомолога для 2 метилпропана
1) 2 метилбутан 2) 2 метилбутен 1 3) пропан 4) пропен
5. Укажите название вещества, для которого характерна реакция гидратации
(присоединение воды)
1) ацетилен 2) бутан 3) полиэтилен 4) циклобутан
6. Укажите название вещества, для которого характерна реакция присоединения
1) метан 2) пропан 3) пропен 4) этан
7. Укажите формулы веществ, которые вступают в реакцию друг с другом
1) СН4 и Н2 2) С6Н6 и Н2О 3) С2Н2 и Н2О 4) С2Н6 и Н2О
8 Определите, сколько молей углекислого газа образуется при полном сгорании этина
1) 1 моль 2) 2 моль 3) 3 моль 4) 4 моль
Часть Б. Задания со свободным ответом
9. Перечислите области применения аренов. 2 балла
10. Напишите уравнения химических реакций для следующих превращений: 6 баллов
С2Н5ОН → C2Н4 → C2H5Cl → C4H10
Дайте названия продуктам реакции
Часть С. Задача
11. Выведите молекулярную формулу УВ, массовая доля углерода и водорода в котором составляют 85,7% и 14,3% . Относительная плотность паров этого вещества по водороду составляет 28. 4 балла
Эталоны ответов
|
№ п/п |
1 вариант |
2 вариант |
3 вариант |
4 вариант |
|
1 |
4 |
2 |
3 |
1 |
|
2 |
1 |
2 |
4 |
3 |
|
3 |
2 |
4 |
4 |
2 |
|
4 |
2 |
3 |
3 |
1 |
|
5 |
1 |
1 |
1 |
1 |
|
6 |
1 |
3 |
1 |
3 |
|
7 |
4 |
1 |
2 |
3 |
|
8 |
2 |
4 |
2 |
4 |
|
9 |
Производство полимеров, растворителей, уксусной кислоты, этанола, созревания плодов |
Производство сажи, резины, типографской краски, органических соединений, фреонов, метанола, ацетилена |
Производство растворителей, ацетона, уксусной кислоты, этанола, клея, резки и сварки металлов |
Производство растворителей, анилина, фенола, пестицидов, лекарственных препаратов, феноформальдегидных смол |
|
10 |
1) CH4 + Cl2 → CH3Cl + HCl хлорметан р. замещения (галогенирование) 2)2 CH3Cl + 2Na → C2H6 + 2NaCl этан р. Вюрца 3) C2H6+HNO3 →C2H5NO2 +H2O нитроэтан р. замещения (нитрование) |
1) СаC2 + 2Н2О → C2Н2 + Са(ОН)2 ацетилен р. получения ацетилена 2) 3C2Н2 → C6H6 бензол р. тримеризации 3) C6H6+HNO3 →C6H5NO2 +H2O нитробензол р. замещения (нитрование) |
1) 2CH4 → C2Н2 + 3H2 ацетилен р. разложения 2) 3C2Н2 → C6H6 бензол р. тримеризации 3) C6H6+ Cl2 →C6H5Cl +HCl хлорбензол р. замещения (галогенирование) |
1) C2H5ОН → C2H4 + H2О этилен р. разложения (дегидратация) 2) C2H4 + HCl → C2H5Cl хлорэтан р. присоединения (гидрогалогенирование) 3) 2C2H5Cl+2Nа →C4H10 +2NaCl р. Вюрца бутан |
|
11 |
1) М(СхНу)=29 ·2=58г/моль 2) υ(C)=(0,833·58)/12=4моль 3) υ(Н)= 0,167·58/1 = 8моль Ответ: С4Н8
|
1) М(СхНу)=2 · 2= 4г/моль 2) υ(C)=(0,8182· 4) /12 =2моль 3) υ(Н)=(0,1818 · 4)/1 =6моль Ответ: С2Н6
|
1) МСхНу)=13 · 2 =26г/моль 2) υ(C)=(0,9213 · 26) /12 =2моль 3) υ(Н)=(0,0769 · 26)/1 = 2моль Ответ: С2Н2
|
1) МСхНу)=28 · 2 =56г/моль 2) υ(C)=(0,857 · 56) /12 =4моль 3) υ(Н)=(0,143 · 56)/1 = 8моль Ответ: С4Н8
|
Критерии оценок
«5» - 17 – 23 баллов (76 - 100%)
«4» - 11 – 22 баллов (47 – 75%)
«3» - 8 – 10 баллов (34 – 46%)
«2» менее 8 баллов
Лабораторная работа №3
Тема :Изучение свойств спиртов.
Цель:Исследовать растворимость глицерина в воде.Познакомиться
с качественной реакцией на глицерин. Доказать кислотные свойства фенола.
Оборудование и реактивы: штатив с пробирками; растворы: гидроксида натрия, сульфата меди, хлорида железа(III), серной кислоты, соляной кислоты, этилового спирта,эмульсии фенола,глицерина. Медная проволока,спиртовка, держатель.
Опыт№1. Растворение глицерина в воде .Качественная реакция на глицерин.
Выполнение опыта: А)Возьмите пробирку, в которой находится глицерин. Внимательно рассмотрите его:обратите внимание на прозрачность, вязкость. Наклоните пробирку, обратите внимание, как стекает глицерин со стенок пробирки. Наблюдения запишите в тетрадь. Возьмите чистую пробирку,налейте в нее 1 мл воды и добавьте 2-3 капли глицерина, взболтайте. Обратите внимание на растворимость глицерина в воде. Раствор глицерина сохраните для следующего опыта.
Б) Возьмите чистую пробирку .Поместите в нее 2-3 капли раствора сульфата меди(II)(CuSO4) и прилейте 5-6капель раствора гидроксида натрия(NaOH). Наблюдайте образование голубого осадка. Какое вещество образовалось в ходе реакции? Напишите уравнение данной реакции в молекулярной и ионной формах. К полученному осадку прилейте раствор глицерина, хорошо взболтайте. Что наблюдаете? Наблюдения запишите в тетрадь. Напишите уравнение реакции взаимодействия
глицерина с гидроксидом меди(II)(CuSO4), используя структурную формулу глицерина. Назовите полученное вещество.
Опыт№2. Свойства фенола.
Внимание! С фенолом обращаться очень осторожно!
Выполнение опыта:1) Возьмите пробирку, в которой находится фенол( С6H5OH). Внимательно рассмотрите его: обратите внимание, в каком агрегатном состоянии находится фенол. Осторожно откройте пробку и очень аккуратно понюхайте фенол .Внимание! Не наклоняйтесь над пробиркой! Добавьте к кристалликам фенола 6-8 капель воды, хорошо взболтайте.(При взбалтывании пробирка должна быть закрыта пробкой во избежание ожогов!) Обратите внимание на образование мутной жидкости. Это эмульсия фенола. Сохраните ее для следующих опытов.
2)Возьмите чистую пробирку. Отлейте в нее половину эмульсии фенола и добавьте 3-4 капли гидроксида натрия(NaOH) до исчезновения мути ,хорошо взболтайте.Что наблюдаете? Наблюдения запишите в тетрадь. Напишите уравнение реакции взаимодействия ф енола с гидроксидом натрия(NaOH).
Назовите полученное вещество.
3)К полученному в предыдущем опыте прозрачному раствору добавить 2-3 капли соляной кислоты(HCL) до помутнения раствора. Какое вещество образовалось? . Напишите уравнение реакции взаимодействия фенолята натрия(C6H5ON a) с соляной кислотой. Назовите полученное вещество.
4)К оставшейся в первом опыте эмульсии фенола добавьте по каплям бромную воду(Br2). Наблюдайте образование белого осадка с характерным запахом . Напишите уравнение реакции взаимодействия фенола(C6H5OH) с бромной водой, используя структурную формулу фенола. Назовите полученное вещество.
Опыт№3.Окисление спирта в альдегид.
Выполнение опыта:1)Возьмите медную проволоку в руки. Обратите внимание на цвет меди(Cu). Держа проволоку в руках, поместите спирально закрученный конец проволоки в пламя спиртовки, хорошо прокалите. Выньте проволоку из пламени, как изменился цвет проволоки? Напишите уравнение реакции окисления меди. Вновь поместите проволоку в пламя спиртовки, хорошо прокалите и быстро опустите раскаленную проволоку в пробирку с этиловым спиртом(C2H5OH). Что наблюдаете? Обратите внимание на запах альдегида. Наблюдения запишите в тетрадь. Напишите уравнение реакции окисления этилового спирта оксидом меди. Назовите полученные вещества.
Письменно ответьте на вопросы:
1.Какая функциональная группа характерна для спиртов?Напишите общую формулу спиртов.
2.На какие группы делятся спирты.
3.К какой группе спиртов относится глицерин?Почему?
4.Назовите качественную реакцию на глицерин.
5. К какой группе спиртов относится фенол?
6.Какие свойства проявляет фенол?
Письменная работа по теме «Сирты»
(время выполнения -20 минут)
Вариант №1
1.Дайте полный развернутый ответ на вопрос «Одноатомные спирты».
2.Постройте структурную формулу спирта: 2,3-диметил-фенол.
3.Дайте название веществу:
СН3 – СН – СН2 – СН2ОН
І
СН3
4..Осуществить превращения:
C H4 → C2H4 → СН2 – СН2 → СН2 – СН2 → СН2 – СН2
І І І І І І
Cl Cl ОН ОН ОNa ОNa
Письменная работа по теме «Сирты»
Вариант №2
1.Дайте полный развернутый ответ на вопрос «Многоатомные спирты».
2.Постройте структурную формулу спирта: 1,2-дибром-бутанол-2
![]() 3.Дайте название веществу:
3.Дайте название веществу:
С-OH
C-CH3
4..Осуществить превращения:
СН4 → С2Н2 → С6Н6 → С6Н5Cl → С6Н5ОН → 2,4,6, - трибромфенол
Письменная работа по теме «Сирты»
Вариант №3
1.Дайте полный развернутый ответ на вопрос «Фенол».
2.Постройте структурную формулу спирта: 3,3-диметил-пентанол-2
3.Дайте название веществу:
СН2 – СН – СН3
І І І
ОН ОН ОН
4..Осуществить превращения:
СН4 → С2Н6 → С2Н5Cl → С2Н5ОН → С2Н4 → СН2 – СН2 OH
ТЕСТ по теме « Спирты»
( на выполнение теста -20минут)
Вариант№1
Часть А (задания с выбором ответа)
А1. Общая формула одноатомных спиртов
1) R-OH 2) R-COH 3) R-COOH 4) R-NH2
A2. Укажите название спирта С4Н9-OH
1) метиловый 2) пропиловый 3) бутиловый 4) этиловый
А3. Спирт, содержащий две гидроксильные группы, называется
1) двухатомным 2) вторичным 3) двухосновным 4) двухкислотным
А4. Формула глицерина
1) СН3 – СН2 – СН2ОН 2) СН2ОН – СНОН – СН2ОН
3) СН3 – СН2 – ОН 4) СН2ОН – СН2ОН
А5. При окислении этанола на воздухе в присутствии меди при нагревании образуется
1) этилен 2) этиленгликоль 3) уксусная кислота 4) уксусный альдегид
А6. Многоатомные спирты образуют ярко-синий раствор с веществом, формула которого
1) CuO 2) Cu(OH)2 3) Al(OH)3 4) NaOH
А7. Функциональная группа альдегидов (карбонильная группа) - это
1) -OH 2) -COOH 3) -COH 4) -NH2
А8. Этиловый спирт массой 92 г полностью окислился при нагревании кислородом воздуха в присутствии медного катализатора до уксусного альдегида. Определите массу образовавшегося альдегида
1) 88 г 2) 90 г 3) 94 г 4) 96 г
Часть В (задания с кратким ответом)
В1. Установите соответствие между названием предельного одноатомного спирта и его формулой. Ответ дайте в виде последовательности букв и цифр.
НАЗВАНИЕ СПИРТА ФОРМУЛА СПИРТА
A) пропанол 1) СН3-OH
Б) бутанол 2) С3Н7-OH
В) метанол 3) С2Н5-OH
Г) этанол 4) С4Н9-OH
В2. Установите соответствие между схемой превращений и веществом Х в этой схеме. Ответ дайте в виде последовательности букв и цифр.
СХЕМЫ ПРЕВРАЩЕНИЙ ВЕЩЕСТВО Х
A) этан → Х → этанол 1) этан
Б) этилен → Х → уксусный альдегид 2) этиленгликоль
В) этанол → Х → этан 3) этилен
Г) глюкоза → Х → углекислый газ 4) этанол
ТЕСТ по теме « Спирты»
Вариант №2
Часть А (задания с выбором ответа)
A1
Гидроксильная группа - это
1) -NH2 2) -COOH 3) -COH 4) -OH
А2. Укажите, какое из суждений является правильным:
А) спирты – это органические вещества, в которых углеводородный радикал связан с гидроксильной группой
Б) функциональная группа – это группа атомов, определяющая наиболее характерные свойства классов органических соединений
1) верно только А 2) верно только Б
3) верны оба суждения 4) оба суждения неверны
А3. Укажите формулу пропилового спирта
1) СН3-OH 2) С3Н7-OH 3) С2Н5-OH 4) С4Н9-OH
А4. Формула этиленгликоля
1) СН3 – СН2 – ОН 2) СН2ОН – СНОН – СН2ОН
3) СН3 – СН2 – СН2ОН 4) СН2ОН – СН2ОН
А-5. Спирты,содержащие бензольное кольцо, называются:
2) двухатомные 2) вторичные 3) многоатомные 4) ароматические
А6. При дегидратации этанола концентрированной серной кислотой при нагревании
образуется
1) этан 2) пропилен 3) этилен 4) этиленгликоль
А7. Функциональная группа альдегидов (карбонильная группа) - это
2) -OH 2) -COOH 3) -COH 4) -NH2
А8. Реакция спиртового брожения глюкозы С6Н12О6 идет в присутствии ферментов – дрожжей с выходом 85% по уравнению С6Н12О6 → 2 С2Н5-OH + 2 СО2↑. Определите массу 94%-ного раствора этилового спирта, который можно получить из 1 кг глюкозы
1) 511 г 2) 434 г 3) 408 г 4) 462 г
Часть В (задания с кратким ответом)
В1. Установите соответствие между формулами спиртов и их названиями. Ответ дайте в виде последовательности букв и цифр.
ФОРМУЛА СПИРТА НАЗВАНИЕ СПИРТА
A) СН2ОН – СН2ОН 1) этиловый
Б) СН3 – СН2 – СН2ОН 2) пропиловый
В) СН3 – СН2ОН 3) глицерин
Г) СН2ОН – СНОН – СН2ОН 4) этиленгликоль
В2. Установите соответствие между свойством и применением спирта и его названием. Ответ дайте в виде последовательности букв и цифр.
СВОЙСТВО И ПРИМЕНЕНИЕ СПИРТА НАЗВАНИЕ СПИРТА
A) ядовитая жидкость, используемая в качестве антифриза 1) метанол
Б) жидкость, используемая для смягчения кожи рук и лица 2) этанол
В) ядовитая жидкость, используемая в качестве растворителя
3)этиленгликоль (небольшое количество приводит к слепоте) 4) глицерин
Г) жидкость, используемая для получения каучука
Ответы к тесту «Спирты»
|
|
А-1 |
А-2 |
А-3 |
А-4 |
А-5 |
А-6 |
А-7 |
А-8 |
|
В-1 |
1 |
3 |
1 |
2 |
4 |
2 |
3 |
1 |
|
В-2 |
2 |
4 |
4 |
2 |
4 |
3 |
3 |
2 |
Задания части В
Вариант №1
|
В-1 |
А-2 |
Б-4 |
В-1 |
Г-3 |
|
В-2 |
А-3 |
Б-4 |
В-2 |
Г-4 |
Вариант №2
|
В-1 |
А-4 |
Б-2 |
В-1 |
Г-3 |
|
В-2 |
А-3 |
Б-1 |
В-1 |
Г-2 |
Система оценки:
9-10 ответов-100%-«5»-отлично
8-7ответов-80-70%-«4»-хорошо
6-5 ответов-60-50%-«3»-удовлетворительно
Менее 6-«2»-неудовлетворительно
Лабораторная работа №4
Тема: Изучение свойств альдегидов и кислот.
Цель: Изучить качественные реакции на альдегиды.Опытным путем доказать,что
уксусная кислота проявляет типичные свойства кислот.
Оборудование и реактивы: штатив с пробирками; растворы:
гидроксида натрия, сульфата меди, серной кислоты,формалина,этилового спирта,уксусной кислоты,аммиачного раствора серебра,универсального индикатора лакмуса.Медная проволока,спиртовка,порошок магния,держатель.
Опыт№1.Окисление спирта в альдегид.
Выполнение опыта:1)Возьмите медную проволоку в руки. Обратите внимание на цвет меди(Cu). Держа проволоку в руках, поместите спирально закрученный конец проволоки в пламя спиртовки, хорошо прокалите. Выньте проволоку из пламени, как изменился цвет проволоки? Напишите уравнение реакции окисления меди. Вновь поместите проволоку в пламя спиртовки, хорошо прокалите и быстро опустите раскаленную проволоку в пробирку с этиловым спиртом(C2H5OH). Что наблюдаете? Обратите внимание на запах альдегида. Наблюдения запишите в тетрадь. Напишите уравнение реакции окисления этилового спирта оксидом меди. Назовите полученные вещества.
Опыт№2 .Окисление альдегида.
А) Реакция «серебряного зеркала».
Выполнение опыта:В чистую пробирку налить ¼ объема аммиачного раствора оксида серебра, прибавить 5-10 капель формалина. Взболтать и осторожно нагреть смесь, вращая пробирку вокруг пламени спиртовки. Что наблюдаете? Напишите уравнение реакции взаимодействия муравьиного альдегида(формалина) с оксидом серебра,используя структурную формулу. Назовите полученные вещества. Почему эта реакция называется реакцией «серебряного зеркала».
Б) Окисление гидроксидом меди.
Выполнение опыта:. Возьмите чистую пробирку .Поместите в нее 2-3 капли раствора сульфата меди(II)(CuSO4) и прилейте 5-6капель раствора гидроксида натрия(NaOH). Наблюдайте образование голубого осадка. Какое вещество образовалось в ходе реакции? Напишите уравнение данной реакции в молекулярной и ионной формах. К полученному осадку прилейте 5-10 капель формалина. Взболтать и осторожно нагреть смесь, вращая пробирку вокруг пламени спиртовки. Что наблюдаете? Наблюдения запишите в тетрадь. Напишите уравнение реакции взаимодействия муравьиного альдегида(формалина) с гидроксидом меди(II)(Cu(OH)2), используя структурную формулу. Назовите полученные вещества.
Опыт№3. Свойства уксусной кислоты.
Выполнение опыта:. Возьмите пробирку с уксусной кислотой. Обратите внимание на запах уксусной кислоты! Разделите кислоту на две пробирки.
А) В одну пробирку с кислотой прилейте раствор лакмуса. Обратите внимание на цвет раствора. О чем говорит изменившаяся окраска индикатора? Наблюдения запишите в тетрадь. Напишите уравнение реакции диссоциации уксусной кислоты.
Б) Во вторую пробирку с кислотой осторожно всыпьте стружку магния и быстро закройте горлышко пробирки большим пальцем. Внимание! Реакция экзотермическая, пробирка разогревается.Соберите выделяющийся газ и подожгите его, поднеся к горлышку пробирки зажженную спичку. Выделяющийся газ сгорает с характерным хлопком. Наблюдения запишите в тетрадь. Напишите уравнение реакции взаимодействия уксусной кислоты с магнием. Какой газ выделяется в ходе реакции?
Письменно ответьте на вопросы:
1.Какая функциональная группа характерна для альдегидов? Какая функциональная группа характерна для карбоновых кислот? Напишите общую формулу альдегидов, карбоновых кислот.
2.Напишите уравнение реакции взаимодействия этаналя с водородом.
3.Напишите формулы масляной и валерьяновой кислот.
|
|
![]() 4.Напишите
уравнения реакций взаимодействия уксусной кислоты с гидроксидом натрия, с
карбонатом натрия.
4.Напишите
уравнения реакций взаимодействия уксусной кислоты с гидроксидом натрия, с
карбонатом натрия.
Тест по теме «Химические свойства альдегидов и карбоновых кислот»
Вариант №1
1. Верны ли следующие суждения о химических свойствах альдегидов?
А Химические свойства альдегидов обусловлены наличием в составе их молекул поляризованной карбонильной группы.
Б. За счет разрыва π-связи в карбонильной группе происходят реакции присоединения водорода.
1) Верно только А; 3) верны оба суждения;
2) верно только Б; 4) оба суждения неверны.
2. Уравнение химической реакции, по которой можно судить о том, что альдегиды легко окисляются по месту химической связи С—Н в альдегидной группе:
1) СН3СНО + С12 →С1СН2СНО;
2) СН3СНО + Ag2О(aм р.р) →СН3СООН + 2Ag↓;
3) 2СН3СНО + 5О2→ 4СО2 + Н2О;
4) СН3СНО + Н2 → СН3СН2ОН.
.
3.
Химическая реакция, уравнение которой ![]()
относится к реакциям:
1) соединения; 3) обмена;
2) замещения; 4) гидрирования.
4.Формальдегид реагирует с каждым из веществ, формулы которых:
1) Cu(OH)2, Ag2O(aм, p.p), Н2;
2) CuO, C2H5OH, HCOOH;
3) С6Н5ОН, СН3ОН, О2;
4) Н2О, CuO, HCOOH.
5. При гидратации этина в присутствии сульфата ртути (II) образуется:
1) этанол; 3) этановая кислота;
2) этаналь; 4) диэтиловый эфир.
6.Реакция «серебряного зеркала» характерна для вещества, формула которого:
1) CH3COOH; 3) C2H5OH;
2)CH3CHO 4) СН3СООС4Н9.
7. Установите соответствие между реагирующими веществами и продуктами их
взаимодействия.

8. С каждым из веществ, формулы которых Сu(ОН)2, Ag2О(aм р.р), Сl2, будет реагировать:
1) фенол; 3) этанол;
2) глицерин; 4) этаналь.
.
9.В химических реакциях муравьиная кислота проявляет свойства:
1) спирта и альдегида;
2) спирта и карбоновой кислоты;
3) альдегида и карбоновой кислоты;
4) алкена и альдегида.
10. Верны ли следующие суждения о химических свойствах карбоновых кислот?
А. Карбоновые кислоты —электролиты.
Б. По углеводородному радикалу карбоновые кислоты реагируют с галогенами.
1) верно только А; 3) верны оба суждения;
2) верно только Б; 4) оба суждения неверны
3) .
11. Уравнение химической реакции, по которой можно судить о том, что у карбоновых
кислот может вступать в реакцию углеводородный радикал:
1) 2СН3СООН + Са → (СН3СОО)2Са + Н2↑;
2) СН3СООН + КОН → СН3СООК + Н2О;
3) СН3СООН + Вг2 → ВгСН2СООН + НВг;
4) НСООН + С3Н7ОН → НСООС3Н7 + Н2О.
12. В схеме превращений ![]() веществами
«X1» и «Х2»
являются соответственно:
веществами
«X1» и «Х2»
являются соответственно:
1) СН3СООН и СН3СООК;
2) НСООН и К2СО3;
3)СО и К2СО3;
4)СН3СНО и К2О
13.Уксусная кислота взаимодействует с каждым из двух веществ:
1) гидроксидом меди (II) и метаном;
2) метанолом и серебром;
3) метанолом и магнием;
4) гидроксидом меди (II) и серебром.
Тест по теме «Химические свойства альдегидов и карбоновых кислот»
Вариант №2
1. Химическая реакция, уравнение которой СН3-СНО + Ag2О(aм р.р) → СНз-СООН + 2Ag↓,
относится к реакциям:
1).окисления; 3) обмена;
2 ).замещения; 4) разложения.
2. С каждым из веществ, формулы которых Сu(ОН)2, Ag2О(aм р.р), Сl2, будет реагировать:
1) фенол; 3) этанол;
2) глицерин; 4) этаналь.
3. В схеме превращений ![]() веществами
«X1» и «Х2»
могут быть соответственно:
веществами
«X1» и «Х2»
могут быть соответственно:
1) гидроксид меди (II) и бромоводород;
2) бром и оксид меди (II);
3) водород и бромоводород;
4) кислород и бром.
4. Пропаналь может взаимодействовать с каждым из двух веществ, формулы которых:
1) СuО и Н2О; 3) Вг2 и Ag2О{aм p.p);
2) Н2 и КОН; 4) НВг и С12.
5.При гидрировании ацетальдегида образуется:
1) ацетилен; 3) этиленгликоль;
2) этанол; 4) уксусная кислота.
6.Химическая реакция, уравнение которой
nН2С=O —> (-Н2С-O-O-)n, относится к реакциям:
1) полимеризации; 3) изомеризации;
2) поликонденсации; 4) этерификации.
3) этаналь; 4) диэтиловый эфир.
7. Установите соответствие между реагирующими веществами и продуктами их взаимодействия.
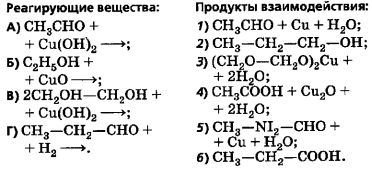
8.В отличие от этаналя, уксусная кислота взаимодействует с веществом, формула которого:
1) Са; 2) Сu(ОН)2; 3) Н2; 4) О2.
9. По углеводородному радикалу у карбоновых кислот происходит взаимодействие:
1) с солями; 3) с основаниями;
2) со спиртами; 4) с галогенами.
10. С образованием воды идет реакция между:
1) масляной кислотой и хлором;
2) уксусной кислотой и магнием;
3) муравьиной кислотой и глицерином;
4) олеиновой кислотой и водородом.
11. Масляная кислота будет реагировать с каждым из веществ, формулы которых:
1) С4Н9ОН, К2О, Вг2;
2) Mg3(PО4)2, ZnO, CH3OH;
3) Си, CuSО4, Cu(OH)2;
4) С3Н7ОН, НСl, Na2COs.
12. В
схеме превращений![]() веществами «Х4» и «Х2»
являются соответственно:
веществами «Х4» и «Х2»
являются соответственно:
1) уксусная кислота и этилацетат;
2) этанол и метилэтиловый эфир;
3) уксусная кислота и метилацетат;
4) метилацетат и уксусная кислота.
13.Муравьиная кислота не вступает в реакцию с веществом, формула которого:
1) Mg; 3) NaCl;
2) NaOH; 4) BaO.
Тест по теме «Химические свойства альдегидов и карбоновых кислот»
Вариант №3
1. Этаналь взаимодействует с каждым из двух неорганических веществ:
1) натрий и вода;
2) водород и гидроксид меди (II);
3) водород и оксид меди (II);
4) азотная кислота и бром.
.
2. Окислением ацетальдегида можно получить:
1) этанол; 3) пропанол-1;
2) уксусную кислоту; 4) муравьиную кислоту.
1) .
3.Верны ли следующие суждения о химических свойствах альдегидов?
А. В альдегидах атомы водорода углеводородного радикала могут замещаться атомами галогенов.
Б. При взаимодействии альдегидов с одноатомными спиртами в присутствии кислот образуются ацетали.
1) Верно только А; 3) верны оба суждения;
2) верно только Б; 4) оба суждения неверны.
4.В схеме превращений С2Н2 → Х1 → Х2 → C2H5ONa веществами «X1» и «Х2» могут быть:
1) этаналь и этанол; *
2) водород и этаналь;
3) этан и этаналь;
4) этаналь и уксусная кислота.
5. При окислении пропанола-1 образуется:
1) пропилен; 3) пропаналь;
2) пропанон; 4) пропан.
6. С аммиачным раствором оксида серебра (I) может взаимодействовать:
1) ацетилен;
2)этанол;
3) этиленгликоль;
4) 3-метилбутаналь;
5)ацетон;
6) этаналь.
Ответом к заданию 7 является последовательность цифр.
7. Установите соответствие
между реагирующими веществами и продуктами их взаимодействия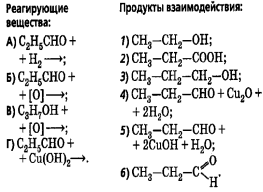
8. Формальдегид в присутствии катализатора реагирует с фенолом по типу реакции:
1) полимеризации; 3) изомеризации;
2) поликонденсации; 4) этерификации.
9.Уравнение реакции, в которой в реакцию вступает вся гидроксильная группа:
1) 2СН3СООН + Mg → (CH3COO)2Mg + H2↑;
2) СН3СООН + Cl2 → СlСН2-СООН + НСl;
3) СН3СООН + NaOH → CH3COONa + Н2О;
4) СН3СООН + С2Н5ОН → СН3СООС2Н5 + Н2О.
10.Пропионовая кислота может взаимодействовать с каждым из веществ в группе:
1)этанол, гидроксид натрия, хлор;
2)сульфат кальция, кислород, метанол;
3)бромоводород, бром, оксид натрия;
4)бутанол-2, хлор, оксид кремния(IV).
11. С каждым из веществ, формулы которых С3Н7ОН, Вг2, КОН, может реагировать:
1) ацетальдегид; 3) этанол;
2) уксусная кислота; 4) этиленгликоль.
12.Для осуществления превращений по схеме
СН4 → СН3ОН → НСНО → НСООН
можно использовать вещества, формулы которых:
1) Cl2, H2О, СuО, Сu(ОН)2;
2) НС1, Н20, Сu(ОН)2, СuО;
3) О2,H2О,Ag2О(ам.р-р), О2;
4) Н2О, Cl2, О2, Ag2О(aм р.р).
13.Уксусная кислота не реагирует с веществом, формула которого:
1) K2CО3; 2) NH3; 3) Cl2; 4) Na2SО4.
Тест по теме «Химические свойства альдегидов и карбоновых кислот»
Вариант №4
1. Этаналь взаимодействует с каждым из двух неорганических веществ:
1)натрий и вода;
2)водород и гидроксид меди (II);
3)водород и оксид меди (II);
4)азотная кислота и бром.
2. При окислении этанола оксидом меди (II) образуется:
1) этаналь; 3) диэтиловый эфир;
2) метаналь; 4) муравьиная кислота.
3. Верны ли следующие суждения о химических свойствах альдегидов?
А. Альдегиды очень легко окисляются по месту химической связи С—Н в альдегидной группе.
Б. Формальдегид не вступает в реакцию полимеризации.
1)верно только А; 3) верны оба суждения;
2) верно только Б; 4) оба суждения неверны.
4. Уравнение химической реакции, по которой можно судить о том, что у альдегидов по месту двойной связи могут происходить реакции присоединения:
1) СН3СНО + Ag2О →СН3СООН + 2Ag↓
2) СН3СНО + 2Cu(OH)2 → СН3СООН + Cu2О + 2Н2О;
3) СН3СНО + Н2 → СН3СН2ОН;
4) 2СН3СНО + О2 → 2СН3СООН.
5.Блестящий налет серебра на стенках пробирки появляется в результате реакции аммиачного раствора оксида серебра с веществами, формулы которых:
1)CH3CH2CHO
2) НОСН2—СН2ОН;
3) НСООН;
4) С3Н7ОН;
5) СН3СООН.
6. В уравнении реакции горения бутаналя коэффициент перед формулой кислорода равен:
1)12; 2)4; 3) 8; 4) 11.
Ответом к заданию 7является последовательность цифр.
7. Альдегиды характеризуются:
1) присутствием в молекуле
карбонильной группы ![]()
2) связью карбонильной группы с двумя радикалами;
3) образованием водородной связи между молекулами;
4) способностью к реакциям полимеризации;
5) реакциями окисления с Ag2О(aм p.p);
6) реакциями хлорирования по углеводородному радикалу.
8. Сложный эфир можно получить при взаимодействии пропановой кислоты:
1) с этанолом; 3) с этаналем;
2) с этаном; 4) с пропеном-1.
9. Химическая реакция, уравнение которой C17H35COONa + Н2О <=> С17Н35СООН + NaOH,
относится к реакциям:
1) соединения; 3) гидратации;
2) гидролиза; 4) замещения.
10. Верны ли следующие суждения:
А. В реакции этерификации образуется вода.
Б. При образовании сложных эфиров от кислоты отщепляется атом водорода, а от спирта — ОН-группа.
1) верно
только А;
2) верно только Б;
3) верны оба суждения;
4) оба суждения неверны.
11. В схеме превращений![]() веществами
«Х1» и «Х2» являются соответственно:
веществами
«Х1» и «Х2» являются соответственно:
1) СН3СООН и СН3СНО;
2) С2Н5ОН и СО2;
3) НСНО и СН3ОН;
4) СН3СНО и СН3СООН.
12. Отличить уксусную кислоту от этанола можно с помощью вещества, формула которого:
1) Na 3) KMnО4;
2) К2СО3; 4) НВг.
13. С каждым из веществ, формулы которых Mg, Na2SО3, CH3OH, Br2, может реагировать:
1) этиленгликоль; 3) пропаналь;
2) пропановая кислота; 4) пропанон.
Ответы к тесту «Альдегиды и карбоновые кислоты»
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
|
В-1 |
4 |
2 |
2 |
1 |
2 |
2 |
А-2 Б-4В-1 Г-5 |
3 |
3 |
3 |
3 |
2 |
2 |
|
В-2 |
1 |
4 |
3 |
3 |
2 |
1 |
А-4 Б-1 В-3 Г-6 |
1 |
4 |
3 |
2 |
3 |
3 |
|
В-3 |
2 |
2 |
1 |
1 |
3 |
4,6 |
А-3 Б-2 В-6 Г-4 |
2 |
4 |
1 |
2 |
1 |
2 |
|
В-4 |
2 |
1 |
1 |
3 |
1 |
4 |
1, 5 |
1 |
2 |
1 |
4 |
2 |
2 |
Система оценки.
«5»-выполнено 100%-90% (13-11ответов)
«4»-выполнено 80%-70% (8-10 ответов)
«3»-выполнено 60%-50% (6-9 ответов)
«2»-выполнено менее 50% (менее 6ответов)
Лабораторная работа №5
Тема: Изучение свойств мыла. Получение уксусно-этилового эфира.
Цель: Изучить свойства мыла.Опытным путем установить, при каких условиях протекает реакция синтеза уксусно-этилового эфира.
Оборудование и реактивы: штатив с пробирками; растворы:
гидроксида натрия, серной кислоты ,этилового спирта,уксусной кислоты, раствор мыла, фенолфталеин, серная кислота(концентр.),хлорид кальция, насыщенный раствор поваренной соли, спиртовка, колба плоскодонная,держатель.
Опыт №1.Получение уксусно-этилового эфира.
Выполнение опыта:1) Возьмите чистую пробирку.Налейте в нее 0,5мл концентрированной уксусной кислоты и добавьте столько же этилового спирта. Закрепите пробирку держателе и нагрейте в пламени спиртовки, не доводя смесь до кипения.Осторожно понюхайте. Запах эфира не обнаруживается.
2)После этого осторожно добавьте к смеси 0,5-1л концентрированной серной кислоты.Пробирку со смесью поместите в колбу с небольшим количеством воды (водяная баня) и нагревайте 5-7минут,пока не почувствуете запах эфира.Вылейте смесь в неширокий стаканчик с насыщенным раствором поваренной соли. На поверхности появляются капли эфира. Наблюдения запишите в тетрадь. Напишите уравнение реакции взаимодействия уксусной кислоты с этиловым спиртом в присутсвии серной кислоты, используя структурные формулы. Какова роль серной кислоты в этой реакции?
Опыт №2. Изучение свойств мыла.
Выполнение опыта: Взять пробирку, в которой находится стружка мыла.Прилить в нее около 3мл воды и нагревать до полного растворения. Полученный мыльный раствор разделить на три пробирки:1)в первую пробирку добавить 2-3 капли фенолфталеина.Наблюдать изменение окраски раствора.О чем говорит цвет раствора?Наблюдения запишите в тетрадь. . Напишите уравнение реакции гидролиза мыла (стеарата натрия) в молекулярной и ионной формах.
2)во вторую пробирку добавьте 1мл серной кислоты. Наблюдайте образование белого осадка.Какое вещество выпало в осадок? Напишите уравнение реакции взаимодействия мыла (стеарата натрия) с серной кислотой в молекулярной и ионной формах. Назвать вещество,выпавшее в осадок.
3) в третью пробирку добавьте 1 мл хлорида кальция. Наблюдайте образование белого осадка.Какое вещество выпало в осадок? Напишите уравнение реакции взаимодействия мыла (стеарата натрия) с хлоридом кальция в молекулярной и ионной формах. Назвать вещество,выпавшее в осадок.
Письменно ответьте на вопросы:
1.Какая функциональная группа характерна для сложных эфиров?
2.Напишите уравнение реакции получения муравьино-бутилового эфира.
3.Напишите уравнение гидролиза муравьино-бутилового эфира.
4.Что такое мыло?Дайте определение.
5.Почему мыло плохо мылится в жесткой воде?
Письменная работа по теме «Сложные эфиры. Жиры»
Вариант 1
1. Напишите уравнения реакций получения: а) бутилового эфира пропионовой кислоты;
б) этилового эфира масляной кислоты.
2. Составьте схему получения уксусноэтилового эфира из этана и напишите уравнения всех реакций.
3. Каковы области применения сложных эфиров? Где они встречаются в природе?
Вариант 2
1. Напишите уравнения реакций получения: а) пропилового эфира муравьиной кислоты;
б) метилового эфира валериановой кислоты.
2. Какой объем этанола (р=0,8 г/мл) требуется для получения 120 г этилового эфира масляной кислоты. Ответ: 59,5 мл
3. Укажите различие в составе твердых и жидких жиров. Какие из них легче окисляется и почему?
Вариант 3
1. Напишите уравнения реакций получения: а) метилового эфира уксусной кислоты;
б) бутилового эфира муравьиной кислоты.
2. Составьте уравнения реакций, при помощи которых можно осуществить следующие превращения:
СН4 → А → СНзОН → В → Н-СООН → этилформиат. Укажите названия веществ А и В.
3. Что такое мыла? Укажите различие в составе твердых и жидких мыл. Какие из них обладают более сильным моющим действием? Почему?
Вариант 4
1. Напишите уравнения реакций получения: а) метилового эфира масляной кислоты;
б) пропилового эфира уксусной кислоты.
2. Какую массу метилацетата можно получить из метанола массой 16 г и уксусной кислоты массой 27 г?
Ответ: 33,3 г
3. Каковы области применения жиров? Где они встречаются в природе?
Вариант 5.
1. Напишите уравнение реакции синтеза жира на основе олеиновой кислоты.
2. Напишите уравнение реакции гидролиза этилового эфира пропионовой кислоты в присутствии гидроксида натрия.
3. Укажите, какое вещество используется для доказательства того, что глюкоза является альдегидом. Составьте уравнение реакции.
Вариант 6.
1. Напишите уравнение реакции гидролиза жира, образованного стеариновой кислотой в присутствии карбоната калия.
2. Напишите уравнение реакции синтеза метилового эфира уксусной кислоты и укажите условия ее смещения.
3. Определите, какое вещество используется для превращения жидкого жира в твердый. Составьте уравнение реакции.
Вариант 7.
1. Напишите уравнение реакции синтеза жира на основе пальмитиновой кислоты.
2. Напишите уравнение реакции гидролиза амилового эфира уксусной кислоты в присутствии гидроксида калия.
3. Укажите, какое вещество используется для доказательства того, что глюкоза является многоатомным спиртом. Составьте уравнение реакции.
.Вариант 8.
1. Напишите уравнение реакции гидролиза жира, образованного масляной кислотой в присутствии карбоната натрия.
2. Напишите уравнение реакции синтеза пропионового эфира муравьиной кислоты и укажите условия ее смещения.
3. Как можно определить раствор мыла? Составьте уравнение реакции.
.
![]() Контрольная
работа№2
Контрольная
работа№2
По теме: «Основные классы органических соединений»
Вариант №_1__
Часть 1
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
![]() А-1
Укажите формулу 3 – метил – пентанол – 2
А-1
Укажите формулу 3 – метил – пентанол – 2
1. СН3 – СН – СН – СН3
І І
ОН СН3
2. СН3 – СН2 – СН – СН – СН3
І І
СН3 ОН
3. СН3 – СН – СН2 – СН2 – СН3
І
![]() ОН
ОН
А-2 Среди перечисленных ниже веществ, выберите вещество, относящиеся к классу аренов:
1. СН3 – СН = СН – СН2 – СН3
![]() 2. СН3
2. СН3
НС СH
CH CH
СН
3. СН3 – С ≡ С – СН – СН3
І
СН3
![]() А-3
Свойства веществ зависят от:
А-3
Свойства веществ зависят от:
1. Условий протекания реакции.
2. Способа получения.
![]() 3. Строения веществ.
3. Строения веществ.
А-4 При добавлении Cu(ОН)2 к веществу, голубой осадок растворяется. Это качественная реакция на:
1. Этанол
2. Глицерин
![]() 3. Уксусную кислоту
3. Уксусную кислоту
А-5 Уравнение
СН ≡ СН + НСl → СН2 = СН
І
Сl
выражает реакцию:
1.Присоединения
2.Замещения
3.Горения
А-6 Расставьте коэффициенты в уравнении реакции
С2Н6 + О2 → СО2 + Н2О
Укажите сумму всех коэффициентов
1. 10
2. 19
3. 22
Часть 2
![]()
В-1 Установите соответствие между формулой вещества и классом (группой) органических веществ, к которому данное вещество принадлежит.
А) СН3СООН 1. Сложные эфиры
![]() О 2.
Простые эфиры
О 2.
Простые эфиры
В) СН3 – С
Н 3. Карбоновые кислоты
![]() О 4.
Спирты
О 4.
Спирты
С) СН3 – С
О – СН3 5. Альдегиды
![]()
В-2 Установите соответствие между молярными массами веществ и их формулами
А) 88 1. С4Н10
В) 46 2. С5Н11ОН
С) 26 3. С2Н5ОН
4. С2Н2
![]() О
О
5. СН3 – С
О – С2Н5
![]() О
О
6. СН3 – СН2 – С
О – СН3
Часть 3
![]() В
бланке ответов запишите подробное решение заданий
В
бланке ответов запишите подробное решение заданий
С-1 Осуществите превращения:
![]()
![]()
![]() О
О О
О
О О
![]()
![]()
![]() СН4
→ С2Н4 → С2Н5ОН →
СН3 – С → СН3 – С → СН3 –
С
СН4
→ С2Н4 → С2Н5ОН →
СН3 – С → СН3 – С → СН3 –
С
Н ОН О – СН3
![]()
С-2 Решите задачу:
Сколько литров ацетилена потребуется для получения 88г. Этаналя в ходе реакции Кучерова?
Контрольная работа
По теме: «Основные классы органических соединений»
Вариант 2
Часть 1
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
![]() А-1
Укажите формулу 2,3,4 – триметил – гексановая кислота
А-1
Укажите формулу 2,3,4 – триметил – гексановая кислота
![]() O
O
1. СН3 – СН – СН – СН2 – СН2 – С
І І Н
СН3 СН3
![]() О
О
2. СН3 – СН2 – СН – СН – СН – С
І І І ОН
СН3 СН3 СН3
![]() О
О
3. СН3 – СН2 – СН – СН – СН – СН2 – С
І І І ОН
СН3 СН3 СН3
![]() А-2 Среди перечисленных ниже
веществ, выберите вещество, относящиеся к классу спиртов:
А-2 Среди перечисленных ниже
веществ, выберите вещество, относящиеся к классу спиртов:
1. СН3 – СН – СН2 – СН3
І
СН3
![]() О
О
2. СН3 – СН2 – СН – С
І Н
СН3
3. СН3 – СН – СН2 – СН2ОН
І
СН3
![]() А-3
σ (сигма) связь:
А-3
σ (сигма) связь:
1. Прочнее π (пи) связи.
2. Слабее π (пи) связи.
3. Одинаковая.
![]()
А-4 При взаимодействии карбида кальция с водой выделяется газ:
1. Водород
2. Этилен
3. Ацетилен
![]()
А-5 Уравнение
С15Н31СООNa + Н2О → С15Н31СООН + NaОН
выражает реакцию:
1Окисления
2 Замещения
3Гидролиза
![]() А-6 Расставьте коэффициенты в уравнении реакции
А-6 Расставьте коэффициенты в уравнении реакции
С2Н2 + О2 → СО2 + Н2О
Укажите сумму всех коэффициентов
1. 10
2. 13
3. 15
Часть 2
![]()
В-1 Установите соответствие между формулой вещества и классом (группой) органических веществ, к которому данное вещество принадлежит.
А) С5Н11ОН 1. Сложные эфиры
В) С6Н14 2. Простые эфиры
![]() О 3. Спирты
О 3. Спирты
С) СН3 – СН2 - С
О – С2Н5 4. Алкены
5. Алканы
![]()
В-2 Установите соответствие между молярными массами веществ и их формулами
![]() О
О
А) 68 1. СН3 – С
Н
В) 60 2. С3Н7ОН
![]() О
О
С) 74 3. СН3 – СН2 - С
О – СН3
![]() О
О
4. СН3 – СН2 – С
ОН
5. С6Н14
6. С5Н8
Часть 3
В бланке ответов запишите подробное решение заданий
![]()
С-1 Осуществите превращения:
СН4 → С2Н2 → С6Н6 → С6Н5Cl → С6Н5ОН → 2,4,6, - трибромфенол
![]()
С-2 Решите задачу:
Сколько литров ацетилена можно получить из 128 граммов карбида кальция?
Контрольная
работа
По теме: «Основные классы органических соединений»
Вариант №_3__
Часть 1
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
![]()
А-1 Укажите формулу: 2 – метил – 3 – этил – пентаналь
O
1. СН3 – СН – СН2 – СН – С
І І Н
СН3 СН3
![]() О
О
2. СН3 – СН – СН – СН2 – С
І І Н
СН3 С2Н5
![]() О
О
3. СН3 – СН2 – СН – СН – С
І І Н
С2Н5 СН3
![]()
А-2 Среди перечисленных ниже веществ, выберите вещество, относящиеся к классу многоатомных спиртов:
1. СН3 – СН – СН – СН3
І І
ОН СН3
2. СН2 – СН – СН2
І І І
ОН ОН ОН
3. СН3 – СН – СН – СН2ОН
І І
СН3 СН3
![]() А-3
Атомы в молекулах органических веществ располагаются:
А-3
Атомы в молекулах органических веществ располагаются:
1. По порядку.
2. Хаотично.
![]() 3. Согласно их валентности.
3. Согласно их валентности.
А-4 Щелочной гидролиз жиров приводит к образованию:
1. Смеси алканов и алкенов.
2. Глицерина и солей карбоновых кислот.
![]() 3. Карбоновых кислот и спиртов.
3. Карбоновых кислот и спиртов.
А-5 Уравнение
2СН3СООН + 2Nа → 2СН3СООNа + Н2 выражает реакцию:
1. Присоединения
2 Обмена
3 Замещения
![]() А-6
Расставьте коэффициенты в уравнении реакции
А-6
Расставьте коэффициенты в уравнении реакции
С2Н4 + О2 → СО2 + Н2О
Укажите сумму всех коэффициентов
4 10
5 8
6 12
Часть 2
![]()
В-1 Установите соответствие между молекулярной массой вещества и формулой
А) 46 1. С5Н12
В) 72 2. С2Н5ОН
![]() О
О
С) 94 3. С4Н9 – С
Н
4. С3Н7СООН
5. С6Н5ОН
![]()
В-2 Установите соответствие между типом гибридизации и углом в молекуле
А) sp3 1. 1300
В) sp 2. 1800
С) sp2 3. 1200
4. 1130
5. 109028'
Часть 3
В бланке ответов запишите подробное решение заданий
![]() С-1
Осуществите превращения:
С-1
Осуществите превращения:
СН4 → С2Н6 → С2Н5Cl → С2Н5ОН → С2Н4 → СН2 – СН2
І І
С-2 Решить задачу: CL CL
Сколько литров водорода выделится при взаимодействии магния с уксусной кислотой массой 120 г?
Контрольная работа
По теме: «Основные классы органических соединений»
Вариант №_4__
Часть 1
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
![]() А-1
Укажите формулу 3 – метил – 4 – этил – гексин – 1
А-1
Укажите формулу 3 – метил – 4 – этил – гексин – 1
1. СН ≡ С – СН – СН – СН3
І І
СН3 СН3
2. СН ≡ С – СН – СН – СН2 – СН3
І І
СН3 С2Н5
3. СН2 = СН – СН – СН – СН2 – СН3
І І
СН3 С2Н5
![]()
![]() А-2 Среди перечисленных ниже
веществ, выберите вещество, относящиеся к классу алканалей:
O
А-2 Среди перечисленных ниже
веществ, выберите вещество, относящиеся к классу алканалей:
O
1.СН3 – СН – СН2 – С
І Н
СН3
![]() О
О
1. СН3 – СН – СН2 – С
І ОН
СН3
![]() О
О
3. СН3 – СН – СН2 – С
І О – СН3
СН3
![]()
А-3 π (пи) связь:
1. Прочнее σ (сигма) связи.
2. Одинаковая.
![]() 3. Слабее σ (сигма) связи.
3. Слабее σ (сигма) связи.
А-4 При внесении прокаленной медной проволоки в раствор этанола образуется:
1.Этановая кислота.
2. Этилат меди.
3. Этаналь.
![]() А-5 Уравнение
А-5 Уравнение
![]() О
О
СН3 – С + Н2 → СН3 – СН2ОН
Н
выражает реакцию:
1.Замещения
2Присоединения
3. Обмена
![]() А-6 Расставьте коэффициенты в
уравнении реакции
А-6 Расставьте коэффициенты в
уравнении реакции
С3Н4 + О2 → СО2 + Н2О
Укажите сумму всех коэффициентов
1. 15
2. 12
3. 10
Часть 2
![]()
В-1 Установите соответствие между молекулярной массой вещества и формулой
А) 60 1. С4Н8
В) 30 2. С3Н7ОН
![]() О
О
С) 56 3. СН3 – С
О – СН3
4. С15Н31СООNa
![]() 5. С2Н5Сl O
5. С2Н5Сl O
6. Н – С
Н
![]() В-2 Установите соответствие
между видом спирта и формулой:
В-2 Установите соответствие
между видом спирта и формулой:
А) Одноатомный 1. СН2 – СН2
І І
В) Многоатомный ОН ОН
![]() О
О
С) Ароматический 2. СН3 – СН2 – С
Н
3. С6Н5ОН
4. С6Н5Cl
5. СН3 – СН – СН3
І
ОН
Часть 3
В бланке ответов запишите подробное решение заданий
![]()
С-1 Осуществите превращения:
СН4 → С2Н6 → С2Н4 → СН2 – СН2 → СН2 – СН2 → СН2 – СН2
І І І І І І
![]() Cl Cl ОН ОН ОNa ОNa
Cl Cl ОН ОН ОNa ОNa
Решите задачу:
Сколько литров этилена потребуется для получения 132г. этилового спирта в ходе реакции гидратации?
Контрольная работа
По теме: «Основные классы органических соединений»
Вариант №__5_
Часть 1
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
![]() А-1
Укажите формулу 3,3 – диметил – пентаналь
А-1
Укажите формулу 3,3 – диметил – пентаналь
![]() О
О
1. СН3 – СН2 – СН – СН2 – С
І Н
СН3
СН3
![]() І
О
І
О
2. СН3 – СН2 – СН2 – С – С
І ОН
СН3
СН3
![]() І О
І О
3. СН3 – СН2 – С – СН2 – С
І Н
СН3
![]()
А-2 Среди перечисленных ниже веществ, выберите вещество, относящиеся к классу алкенов:
1. СН ≡ С – СН – СН3
І
СН3
2. СН3 – СН = С – СН2 – СН3
І
СН3
3. СН3 – СН2 – СН – СН2 – СН3
І
СН3
![]() А-3
Тройная связь состоит из:
А-3
Тройная связь состоит из:
1. Трех σ (сигма) связей.
2. Одной σ (сигма) и двух π (пи) связей.
![]() 3. Одной π (пи) и двух σ (сигма)
связей.
3. Одной π (пи) и двух σ (сигма)
связей.
А-4 Продуктами гидролиза уксусно-этилового эфира являются:
1. СН3 – СН2ОН и СН3СООН
![]() О
О
2. СН3 – СН2ОН и СН3С
Н
3. СН3 – СН2ОН и СН3 – СН2ОН
![]() А-5 Уравнение
А-5 Уравнение
![]() О
О
С2Н5ОН + CuO → СН3 – С + Cu + Н2О
Н
выражает реакцию:
1. Гидролиза
2. Окисления
3. Нейтрализации
![]() А-6 Расставьте коэффициенты в
уравнении реакции
А-6 Расставьте коэффициенты в
уравнении реакции
С6Н6 + О2 → СО2 + Н2О
Укажите сумму всех коэффициентов
1. 20
2. 30
3. 35
Часть 2
![]() В-1 Установите соответствие
между молекулярной массой вещества и формулой
В-1 Установите соответствие
между молекулярной массой вещества и формулой
А) 42 1. С5Н8
В) 30 2. С4Н9ОН
![]() О
О
С) 74 3. Н – С
Н
4. С2Н5СООН
5. С3Н6
![]() О
О
6. Н – С
О – СН3
![]()
В-2 Установите соответствие между функциональной группой и классом веществ:
![]() О 1. Алканолы
О 1. Алканолы
А) - С
Н 2. Сложные эфиры
В) - ОН 3. Альдегиды
![]() О 4. Арены
О 4. Арены
С) -С
ОН 5. Алкановые кислоты
6. Алкены
Часть 3
В бланке ответов запишите подробное решение заданий
![]()
С-1 Осуществите превращения:
СН4 → С2Н4 → С2Н2
![]()
![]() ↓ ↓ О О
↓ ↓ О О
С2Н5ОН СН3 – С → СН3 – С
Н ОН
С-2 Решите задачу:
Сколько литров хлора потребуется для полного хлорирования 1 моль метана?
Контрольная работа
По теме: «Основные классы органических соединений»
Вариант №_6__
Часть 1
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
![]() А-1
Укажите формулу 3 – метил – 4 – этил – гексановая кислота
А-1
Укажите формулу 3 – метил – 4 – этил – гексановая кислота
![]() О
О
1. СН3 – СН – СН – СН2 – С
І І Н
СН3 СН3
![]() О
О
2. СН3 – СН2 – СН – СН – СН2 – С
І І ОН
С2Н5 СН3
![]() О
О
3. СН3 – СН2 – СН – СН2 – СН2 – С
І H
С2Н5
![]()
А-2 Среди перечисленных ниже веществ, выберите вещество, относящиеся к классу многоатомных спиртов:
1. СН3 – О – С2Н5
2. СН3 – СН – СН – СН3
І І
ОН СН3
3. СН2 – СН – СН3
І І І
ОН ОН ОН
![]() А-3
Изомеры – это вещества:
А-3
Изомеры – это вещества:
1. Одинаковые по строению и свойствам.
2. Одинаковые по строению, но имеющие разные свойства.
3. Одинаковые по составу, но разные по строению и свойствам.
![]() А-4 При взаимодействии
уксусной кислоты с магнием выделяется газ:
А-4 При взаимодействии
уксусной кислоты с магнием выделяется газ:
1. Кислород.
2. Углекислый газ.
3. Водород.
![]() А-5 Уравнение
А-5 Уравнение
С2Н6 + Cl2 → С6Н5Cl + НCl
выражает реакцию:
1. Присоединения
2.Горения
3. Замещения
![]() А-6 Расставьте коэффициенты в
уравнении реакции
А-6 Расставьте коэффициенты в
уравнении реакции
С2Н5ОН + Na → С2Н5ОNa + Н2
Укажите сумму всех коэффициентов
1. 7
2. 10
3. 13
Часть 2
![]() В-1 Установите соответствие
между молекулярной массой вещества и формулой:
В-1 Установите соответствие
между молекулярной массой вещества и формулой:
А) 54 1. С3Н4
В) 74 2. С6Н5Br
С) 72 3. C3Н7ОNa
4. СН3 – ОNa
5. СН3 – СН2 – СН – СН3
І
СН3
![]() В-2 Установите соответствие
между классом веществ и формулой:
В-2 Установите соответствие
между классом веществ и формулой:
А) Алкены 1. СН3 – СН2 – СН – СН3
І
СН3
![]() В) Алканоли О
В) Алканоли О
2. СН3 – С
О – СН3
С) Сложные эфиры 3. С4Н9ОН
![]() О
О
4. СН3 – СН2 – С
ОН
5. СН2 = СН – СН3
6. С4Н6
Часть 3
В бланке ответов запишите подробное решение заданий
![]() С-1
Осуществите превращения:
С-1
Осуществите превращения:
![]()
![]() О О
О О
СН3 – С → СН3ОН → Н – С → СН3ОН → СН3Сl → С2Н6
![]() О – СН3 Н
О – СН3 Н
С-2 Решите задачу:
Сколько граммов уксусно-этилового эфира можно получить в результате реакции этерификации из 120 г. уксусной кислоты ?
Контрольная работа
По теме: «Основные классы органических соединений»
Вариант №_7__
Часть 1
![]() При
выполнении этой части в бланке ответов под номером
выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер
которой соответствует номеру выбранного вами ответа
При
выполнении этой части в бланке ответов под номером
выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер
которой соответствует номеру выбранного вами ответа
А-1 Укажите формулу 2,4,6 – трибром – фенол
1. СН3 – СН – СН – СН – СН2 – СН2
І І І І
Br Br Br ОН
СН
![]() 2. Br-С С-Br
2. Br-С С-Br
НС СН
С
І
Br
![]() С-ОН
С-ОН
3 Br-С С--Br
HС C CH
CH
І
![]() Br
Br
А-2 Среди перечисленных ниже веществ, выберите вещество, относящиеся к классу сложных эфиров:
1. СН3 – О – СН3
2. СН3 – СН2 – ОН
![]() О
О
3. СН3 – С
О – СН3
![]() А-3
Двойная связь состоит из:
А-3
Двойная связь состоит из:
1. Двух σ (сигма) связей.
2. Двух π (пи) связей.
3. Одной σ (сигма) и одной π (пи) связей.
![]() А-4 При добавлении бромной воды
к веществу выпадает осадок. Это качественная реакция на:
А-4 При добавлении бромной воды
к веществу выпадает осадок. Это качественная реакция на:
1. Бензол.
2. Ацетилен.
3. Фенол.
![]() А-5 Уравнение
А-5 Уравнение
С2Н5ОН + 3О2 → 2СО2 + 3Н2О
выражает реакцию:
1.Замещения
2.Горения
![]() 3. Обмена
3. Обмена
А-6 Расставьте коэффициенты в уравнении реакции
С3Н7ОН + Na → С3Н7ОNa + Н2
Укажите сумму всех коэффициентов
1. 9
2. 7
3. 13
![]() Часть
2
Часть
2
В-1 Установите соответствие между молекулярной массой вещества и формулой
А) 72 1. С3Н7ОН
![]() 2. С5Н12
О
2. С5Н12
О
В) 82 3. C2Н5 – С
ОН
С) 74 4. С6Н10
![]() О
О
5. Н – С
О – СН3
6. C2Н5Сl
![]() В-2 Установите соответствие между классом
органических веществ и формулой:
В-2 Установите соответствие между классом
органических веществ и формулой:
А) Многоатомные спирты 1. СН3 – СН2 – СН – СН2ОН
І
СН3
![]() В) Алканоли
О
В) Алканоли
О
2. СН3 – СН2 – СН – С
І Н
С) Сложные эфиры СН3
![]() О
О
3. СН3 – СН2 – С
ОН
4. СН2 – СН2
І І
![]() ОН ОН О
ОН ОН О
5. СН3 – СН2 – С
О – СН3
6. СН3 – О – С2Н5
Часть 3
В бланке ответов запишите подробное решение заданий
![]() С-1
Осуществите превращения:
С-1
Осуществите превращения:
![]()
![]()
![]() О О
О
О О
О
С2Н5ОН → СН3 – С → СН3 – С → СН3СООNa → СН4 →Н – С
Н ОН Н
![]()
С-2 Решите задачу:
Сколько литров ацетилена (этина) можно получить из 4 моль метана?
Контрольная работа
По теме: «Основные классы органических соединений»
Вариант №_8__
Часть 1
![]() При
выполнении этой части в бланке ответов под номером
выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер
которой соответствует номеру выбранного вами ответа
При
выполнении этой части в бланке ответов под номером
выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер
которой соответствует номеру выбранного вами ответа
А-1 Укажите формулу 2 – метил – 4 – этил – гексаналь
![]() О
О
1. СН3 – СН – СН2 – СН – СН2 – С
І І Н
СН3 С2Н5
![]() О
О
2. СН3 – СН2 – СН – СН – С
І І ОН
СН3 СН3
![]() О
О
3. СН3 – СН2 – СН – СН2 – СН – С
І І Н
С2Н5 СН3
![]() А-2 Среди перечисленных ниже
веществ, выберите вещество, относящиеся к классу алкинов:
А-2 Среди перечисленных ниже
веществ, выберите вещество, относящиеся к классу алкинов:
1. СН3 – СН2 – СН – СН2ОН
І
СН3
2. СН2 = СН – СН2 – СН – СН3
І
СН3
3. СН3 – С ≡ С – СН – СН3
І
СН3
![]() А-3
Определите тип гибридизации у алкенов:
А-3
Определите тип гибридизации у алкенов:
1. sp2.
2. sp3.
![]() 3. sp.
3. sp.
А-4 Взаимодействуют между собой:
1. Глицерин и этанол.
2. Глицерин и фенол.
![]() 3. Глицерин и гидроксид меди.
3. Глицерин и гидроксид меди.
А-5 Уравнение
С2Н4 + 3О2 → 2СО2 + 2Н2О
выражает реакцию:
1. Замещения
2. Горения
3. Обмена
![]() А-6
Расставьте коэффициенты в уравнении реакции
А-6
Расставьте коэффициенты в уравнении реакции
С6Н5ОН + Na → С6Н5ОNa + Н2
Укажите сумму всех коэффициентов
1. 7
2. 5
3. 3
Часть 2
![]() В-1 Установите соответствие между молекулярной массой и формулой
вещества.
В-1 Установите соответствие между молекулярной массой и формулой
вещества.
А) 30 1. С6Н5ОН
2. С4Н8
В) 62 3. CН2– СН2
І І
С) 56 ОН ОН
![]() О
О
4. Н – С
Н
![]() О
О
5. CН3 – С
О – СН3
![]()
В-2 Установите соответствие между классом веществ и формулой:
![]() О
О
А) Сложные эфиры 1. СН3 – С
Н
В) Алкены 2. С4Н10
![]() О
О
3. Н – С
С) Алканали ОН
![]() О
О
4. Н – С
О – СН3
5. С4Н8
6. С4Н6
Часть 3
В бланке ответов запишите подробное решение заданий
![]()
С-1 Осуществите превращения:
![]()
![]()
![]() О О
О
О О
О
С2Н4 → С2Н5ОН → СН3 – С → СН3 – С → СН3 – С → СН4
О – С2Н5 ОН ОNа
![]()
С-2 Решите задачу:
Сколько граммов 2,4,6 – трибромфенола образуется при взаимодействии 156 г. фенола
с бромной водой?
Контрольная работа
По теме: «Основные классы органических соединений»
Вариант9
Часть 1
![]() При
выполнении этой части в бланке ответов под номером
выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер
которой соответствует номеру выбранного вами ответа
При
выполнении этой части в бланке ответов под номером
выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер
которой соответствует номеру выбранного вами ответа
А-1 Укажите формулу 2,3 – диметил – бутановая кислота
1. СН2 = СН – СН – СН – СН3
І І
СН3 СН3
![]() O
O
СН3 – СН – СН – C
І І ОН
СН3 СН3
![]() О
О
3. СН3 – СН – СН – С H
І І
![]() СН3
СН3
СН3
СН3
А-2 Среди перечисленных ниже веществ, выберите вещество, относящиеся к классу спиртов:
![]() O
O
1. .СН3 – СН2 – СН – С
І Н
СН3
2.СН3 – СН2 – СН – СН3
І
ОН
3. СН3 – СН2 – СН – СН = СН2
І
СH3
А-3. Определите тип гибридизации у алканов:
1. sp2.
2. sp3.
![]() 3. sp.
3. sp.
А-4 Образование «серебряного зеркала» при добавлении к веществу аммиачного раствора оксида серебра и нагревании является качественной реакцией на:
1. Этанол.
2. Глицерин
3.Этаналь
А-5 Уравнение:
С2Н6 + Cl2 → С2Н5Cl + НCl
выражает реакцию:
1.Реакцию присоединения
![]() 2Реакцию окисления
2Реакцию окисления
3Реакцию замещения
А-6. Расставьте коэффициенты в уравнении реакции
СН3СООН + Na → СН3СООNa + Н2
Укажите сумму всех коэффициентов
1. 9
2. 11
3. 7
Часть 2
![]() В-1 Установите соответствие между молекулярной массой и формулой
вещества.
В-1 Установите соответствие между молекулярной массой и формулой
вещества.
А) 54 1. С5Н12
2. С4Н9ОН
![]() В) 72 O
В) 72 O
3. C2Н5 – С
Н
С) 58 4. С4Н6
5. С5Н11ОН
6. С2Н2
![]() В-2 Установите соответствие
между веществами, вступившими в реакцию и продуктами реакции:
В-2 Установите соответствие
между веществами, вступившими в реакцию и продуктами реакции:
А) С2Н4 + Br2 → 1. С3Н7Br + НBr
В) С2Н2 + Br2 → 2. СН2 – СН2
І І
Br Br
С) С2Н6 + Br2 → 3. СН = СН
І І
Br Br
4. СН2 = СН
І
Br
5. С2Н5 Br + НBr
Часть 3
В бланке ответов запишите подробное решение заданий
![]() С-1
Осуществите превращения:
С-1
Осуществите превращения:
СН4 → С2Н4 → СН2 – СН2 → СН2 – СН2 → СН2 – СН2
↓ І І І І І І
Cl Cl ОН ОН ОNa ОNa
![]() С-2 Решите задачу:
С-2 Решите задачу:
Сколько граммов уксусной кислоты можно получить из 132г. этаналя в ходе реакции «серебряного зеркала»?
Контрольная работа
По теме: «Основные классы органических соединений»
Вариант 10
Часть 1
При выполнении этой части в бланке ответов под номером выполняемого вами задания (А-1 – А-6) поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа
![]() А-1
Укажите формулу 1,2 – дибром – бутанол – 2
А-1
Укажите формулу 1,2 – дибром – бутанол – 2
Br
І
1. СН2 – СН – СН2 – СН3
І
Br
2. СН2 – СН2 – СН – СН2
І І І
ОН Br Br
ОН
І
3. СН2 – С – СН2 – СН3
І І
Br Br
А-2 Среди перечисленных ниже веществ, выберите вещество, относящиеся к классу алканалей:
![]() O
O
1. СН3 – СН – СН – С
І І Н
СН3 СН3
![]() О
О
2. СН3 – СН – СН2 – С
І ОН
СН3
3. С6Н5ОН
А-3 В образовании σ (сигма) связи участвуют:
1. Два гибридных электрона, вращающиеся по двум неправильным восьмеркам.
2. Два р-электрона, вращающиеся по двум правильным восьмеркам
3. Шесть р-электронов, вращающиеся по правильным восьмеркам.
А-4 Взаимодействуют между собой:
1. Метан и этан.
2. Этанол и оксид меди.
3. Этанол и фенол.
![]() А-5 Уравнение
А-5 Уравнение
![]()
![]() О Н2SO4(k) О
О Н2SO4(k) О
![]() СН3 – С + Н2О
СН3 – С + СН3OH
СН3 – С + Н2О
СН3 – С + СН3OH
О – СН3 ОН
выражает реакцию:
1.Реакцию присоединения
2Реакцию окисления
3Реакцию гидролиза
![]() А-6 Расставьте коэффициенты в
уравнении реакции
А-6 Расставьте коэффициенты в
уравнении реакции
С3Н8 + О2 → СО2 + Н2О
Укажите сумму всех коэффициентов
1. 10
2.
13![]()
3. 9
Часть 2
В-1 Установите соответствие между молекулярной массой и формулой вещества.
А) 58 1. С3Н8
В) 88
3. C3Н7ОН
С) 60 4. СН2 = СН – СН – СН3
І
СН3
5. С3Н7СООН
В-2 Установите соответствие между агрегатным состоянием вещества и
формулой вещества:
А) Газ 1. С2Н4
В) Твердое вещество 2. С5Н12
С) Жидкое вещество 3. С2Н2
4. С6Н5ОН
5. С2Н5ОН
6. С15Н31СООNа
Часть 3
![]() В
бланке ответов запишите подробное решение заданий
В
бланке ответов запишите подробное решение заданий
С-1 Осуществите превращения:
![]()
![]()
![]() О О
О
О О
О
СН4 → С2Н2 → СН3 – С → СН3 – С → СН3 – С → С2Н5ОН
Н ОН О – С2Н5
![]() С-2 Решите задачу:
С-2 Решите задачу:
Сколько граммов бензола можно получить из 172г. гексана в результате реакции дегидрирования?
Лабораторная работа №6
Тема: Изучение свойств углеводов и белков.
Цель: Опытным путем доказать,что глюкоза проявляет свойства альдегидоспирта,
изучить свойства крахмала.Познакомиться с характерными реакциями на белки.
Оборудование и реактивы: штатив с пробирками; растворы:
гидроксида
натрия, серной кислоты(концентр.),глюкозы,сульфата меди, иодной воды, азотной
кислоты,аммиака;крахмал,спиртовка,держатель,![]() раствор белка.
раствор белка.
Опыт№1.Взаимодействие глюкозы с гидроксидом меди.
Напишите уравнение реакции глюкозы с гидроксидом меди,используя структурные формулы.
Опыт№2.Свойства кахмала.
А)Приготовление крахмального клейстера.
Выполнение опыта:Возьмите пробирку с 0,5 г хорошо растертого крахмала и прилейте ¼ холодной воды. Хорошо взболтайте. Обратите внимание на растворимость крахмала в холодной воде. Нагрейте пробирку со смесью ,постоянно вращая ее в пламени спиртовки. Что произошло с крахмалом?
Полученный крахмальный клейстер разделите на две пробирки. В одну пробирку добавить 1-2 капли йодной воды.Что набдюдаете? Наблюдения запишите в тетрадь.Нагрейте пробирку. Почему исчезло синее окрашивание?
Б) Гидролиз крахмала.
Выполнение опыта:Возьмите вторую пробирку с крахмальным клейстером и добавьте 1-2капли концентрированной серной кислоты(H2SO4). В течение 2-3 минут кипятите раствор,следите за тем, чтобы смесь во время кипения не выхлестывала из пробирки. Что происходит с раствором? Наблюдения запишите в тетрадь. Напишите уравнение реакции гидролиза крахмала. Какое вещество образовалось в ходе реакции? К полученному раствору добавить йодной воды, синее окрашивание не должно появляться.
Опыт№3.Свойства белков: свертывание, цветные реакции.
1)Свертывание белка.
Выполнение опыта:Налейте в пробирку 1/4 водного раствора белка и нагрейте в пламени
спиртовки.Обратите внимание на образование белых хлопьев.
2) Биуретовая реакция.
Выполнение опыта: Налейте в пробирку четверть ее объема раствора яичного белка,прибавьте 1мл
гидроксида натрия и 2 капли сульфата меди. Хорошо взболтайте.Жидкость окрашивается в
фиолетовый цвет.
3)Ксантопротеиновая реакция.
Выполнение опыта: : Налейте в пробирку четверть ее объема раствора яичного белка,прибавьте 2 капли концентрированной азотной кислоты (HNO3).Образуется белый осадок.
Нагрейте содержимое пробирки. Наблюдайте переход окрашивания осадка от белого до желтого.
Охладите смесь и осторожно добавьте несколько капель концентрированного раствора аммиака (NH4OH) до образования оранжевой окраски.
Этим способом может быть обнаружен белок в молоке, мясе,твороге.
![]()
Тест по теме «Химические свойства белков, углеводов».
Вариант №1
1. Верны ли следующие суждения об углеводах?
А. Крахмал и клетчатка относятся к полисахаридам.
Б. Молекула глюкозы содержит ОН-группы.
1) Верно только А; 3) верны оба суждения;
2) верно только Б; 4) оба суждения неверны.
2. К моносахаридам относится каждое из веществ:
1) фруктоза и целлюлоза;
2) глюкоза и сахароза;
3) крахмал и сахароза;
4) глюкоза и фруктоза.
3. Глюкоза, как многоатомный спирт и как альдегид, может реагировать с веществом, формула которого:
1) NaOH; 3) Ag2О(aм р.р)
2) Н2; 4) Cu(OH)2.
4. Конечный продукт гидролиза крахмала:
1) глюкоза; 3) фруктоза;
2) мальтоза; 4) декстрины.
5. Для осуществления превращений по схеме: сахароза → глюкоза → глюконовая кислота необходимо использовать вещества, формулы которых:
1) Ag2О(aм р.р) и Н2О;
2) Са(ОН)2 и Н2О;
3) Н2О и Сu(ОН)2;
4) Сu(ОН)2 и Н2О.
6. К реакциям этерификации относится реакция, уравнение которой:
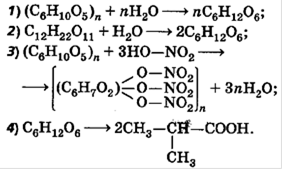
7. Верны ли следующие суждения о химических свойствах белков?
А. Белки состоят из аминокислот.
Б.Вторичная структура белка представляет собой спираль.
1) Верно только А; 3) верны оба суждения;
2) верно только В; 4) оба суждения неверны.
8. Амфотерные свойства проявляют каждое из двух веществ:
1) уксусная кислота и глюкоза;
2) аминоуксусная кислота и белок;
3) муравьиная кислота и глицерин;
4) белок и бутан-1.
9. Верны ли следующие суждения о белках?
A. Наиболее часто в составе белков встречаются 20 аминокислот, имеющих кроме карбоксильных и аминогрупп функциональные группы -ОН, -SH.
B. Последовательность соединения аминокислотных звеньев в полипептидной цепи называется первичной структурой молекулы белка.
1) Верно только А; 3) верны оба суждения;
2) верно только Б; 4) оба суждения неверны.
Ответом к заданию 10является последовательность цифр.
10. В отличие от глюкозы, сахароза:
1)является дисахаридом;
2) реагирует с аммиачным раствором оксида серебра; .
3) подвергается гидролизу;
4) реагирует с гидроксидом меди (II);
5) реагирует с гидроксидом кальция;
6) способна гореть.
Тест по теме «Химические свойства белков, углеводов».
Вариант№2
1. Верны ли следующие суждения о химических свойствах глюкозы?
А. Химические свойства глюкозы обусловлены наличием функциональных групп.
Б. Глюкоза не вступает в реакцию с гидроксидом меди (II).
1) Верно только А; 3) верны оба суждения;
2) верно только Б; 4) оба суждения неверны.
2. О наличии альдегидной группы в молекуле глюкозы можно судить по ее взаимодействию:
1) с уксусной кислотой;
2) с оксидом серебра (ам. р-р);
3) с бромной водой;
4) с метиловым спиртом.
3. Глюкоза, как многоатомный спирт, реагирует с веществом, формула которого:
1) Н2 (в присутствии катализатора); 2) Ag2О(aм р.р)
3) Cu(OH)2 (без нагревания); 4) О2.
4. Конечный продукт гидролиза крахмала:
3) глюкоза; 3) фруктоза;
4) мальтоза; 4) декстрины.
5. В результате маслянокислого брожения глюкозы, кроме масляной кислоты, образуется вещество, формула которого:
1) H2; 2) СО2 и Н2; 3) СО2; 4) СО2 и О2.
6. Верны ли следующие суждения о химических свойствах углеводов?
А. Глюкоза взаимодействует с гидроксидом кальция.
Б. Целлюлоза с азотной кислотой образует сложный эфир.
1) Верно только А; 3) верны оба суждения;
2) верно только В; 4) оба суждения неверны.
7. Осуществить следующие превращения (С6Н10О5)n → С6Н12O6 → С2Н5ОН →
→ СН3СООС2Н5 можно с помощью реакций:
1) гидролиза, гидрирования, этерификации;
2) гидратации, окисления, этерификации;
3) гидратации, изомеризации, этерификации;
4) гидролиза, брожения, этерификации.
8. Процессу фотосинтеза соответствует уравнение:
1) (СбН10О5) n + 6 nО2 —> 6nСО2 + 6nН2О;
2) СбН12О6 —> 2С2Н5ОН + 2СО2↑;
3) 6nCО2 + 6nH2О —> (С6Н10О5)n + 6nО2↑,
4) (C6H10O5)n + nН2О —> nС6Н12Об.
9. Верны ли следующие суждения о белках?
А. Все белки имеют полипептидную цепь, которая состоит из аминокислотных звеньев и имеет линейное строение.
Б. Большинство белков обладает амфотерными свойствами.
1) Верно только А; 3) верны оба суждения;
2) верно только Б; 4) оба суждения неверны.
10. Белки можно обнаружить с помощью веществ, формулы которых:
1) NH3∙H2О; 4)FeCl3;
2) HNО3(KOHЦ); 5) CuSО4 + NaОH(ИЗБ);
3) CuSО4; 6) C6H5OH(p.p).
Тестирование за курс органической химии
Часть А. (1 вариант)
а) алканы б) алкены в) алкины г) арены
2. Какая общая формула соответствует классу алканов?
а) СпН2п+2 б) СпН2п в) СпН2п-2 г) СпН2п-6
3. Реакции какого типа характерны для алканов?
а) присоединения б) замещения в) полимеризации г) гидратации
![]() 4. Какое название
соответствует веществу СН3 – СН – СН2 – СН3
4. Какое название
соответствует веществу СН3 – СН – СН2 – СН3
СН3
а) бутан б) 2-метилбутан в) 2-метилпропан г) 3-метилбутан
5. Какой газ составляет основу природного газа?
а) метан б) этан в) пропан г) бутан
6. Сколько σ -связей в молекуле этена?
а) 2 б) 3 в) 4 г) 5
7. Сколько π-связей в молекуле бутадиена-1,3
а) 1 б) 2 в) 3 г) 4
8. Гомологами являются
а) пентен и 2-метилбутан б) хлорэтен и дихлорэтан
в) пропанол и пропаналь г) 2,2-диметилпропан и 2,2-диметилбутан
9. Тип реакции взаимодействия этена с бромом
а) присоединения б) замещения в) гидрирования г) гидратации
10. Только σ – связи имеются в молекуле
а) этанола б) этаналя в) этена г) этина
![]() 11. Вещество СН3 –
СН – СН = СН2 называется
11. Вещество СН3 –
СН – СН = СН2 называется
СН3
а)2-метилбутан б) 3-метилбутен-2
в) 3-метилбутин-1 г) 3-метилбутен-1
12. Несколько функциональных групп -ОН содержат молекулы
а) глицерина и глюкозы б) фенола и пропанола
в) сахарозы и формальдегида г) фенола и формальдегида
13. Следующие признаки: sp-гибридизация, длина С-С связи 0,120 нм,
угол 1800 характерны для молекулы
а) бензола б) этана в) этина г) этена
14. Функциональная группа -ОН характерна для класса
а) альдегидов б) аминов в) карбоновых кислот г) спиртов
15. Карбоксильная группа содержится в молекуле
а) метанола б) ацетальдегида в) уксусной кислоты г) глицерина
16. Реактивом для распознавания многоатомных спиртов является
а) бромная вода б) оксид меди (+2)
в) гидроксид меди (+2) г) хлорид железа (+3)
17. Продуктами окисления предельных одноатомных спиртов являются
а) альдегиды б) кетоны в) простые эфиры г) сложные эфиры
18. Сложный эфир можно получить реакцией
а) гидрирования б) гидратации в) этерификации г) дегидратации
19. В реакцию «серебряного зеркала» вступают
а) альдегиды б) фенолы в) спирты г) одноатомные спирты
20. Из остатков молекул α – глюкозы состоят молекулы
а) фруктозы б) крахмала в) сахарозы г) целлюлозы
21. Установите тип реакции: n C6H12O6 → (C6H10O5)n + n H2O
а) полимеризация б) присоединения
в) поликонденсации г) изомеризации
22. Для аминов характерны свойства
а) кислот б) оснований в) амфотерных соединений
![]() 23. Какое название у
вещества СН3 – СН – СН2 – СООН
23. Какое название у
вещества СН3 – СН – СН2 – СООН
NH2
а) 3-аминобутановая кислота б) 2-аминобутановая кислота
в) α-аминомасляная кислота в) 4- аминомасляная кислота
24. В состав белков входят остатки
а) α-аминокислот б) β-аминокислот
в) γ-аминокислот г) δ-аминокислот
25. Химическая связь, образующая первичную структуру белков:
а) водородная б) ионная в) пептидная г) ковалентная неполярная
часть Б.
Н – 15,6%, N – 31,1% и относительная плотность по водороду 22,5
2.Напишите уравнения для осуществления превращений:
СаС2 → С2Н2 → С6Н6 → С6Н5NO2 Укажите условия реакций, назовите продукты.
3Выберите, с какими из перечисленных веществ может взаимодействовать этанол, и напишите соответствующие уравнения реакций:
натрий, гидроксид натрия, хлорид натрия, хлороводород, уксусная кислота
4При полном сгорании 3 г. углеводорода получилось 4,48 л. (н.у.) углекислого газа и 5,4 г. воды. Относительная плотность по воздуху равна 1,03. Выведите формулу углеводорода.
Тестирование за курс органической химии
Часть А. ( 2 вариант)
1. К какому гомологическому ряду относится вещество состава С5Н8 ?
а) алканы б) алкены в) алкины г) арены
2. Какая общая формула соответствует классу алкенов?
а) СпН2п+2 б) СпН2п в) СпН2п-2 г) СпН2п-6
3. Реакции какого типа характерны для алканов?
а) полимеризации б) гидратации в) замещения г) присоединения
![]() 4. Какое название
соответствует веществу СН3 – СН – СН = СН2
4. Какое название
соответствует веществу СН3 – СН – СН = СН2
СН3
а) бутан б) 2-метилбутен-3 в) 3-метилбутен-1 г) 3-метилбутан
5. Какое вещество является природным полимером?
а) глюкоза б) фруктоза в) сахароза г) целлюлоза
6. Сколько σ -связей в молекуле этина?
а) 2 б) 3 в) 4 г) 5
7. Сколько π-связей в молекуле бутена-1
а) 1 б) 2 в) 3 г) 4
8. Гомологами являются
а) пентен-2 и бутен-2 б) хлорэтан и дихлорэтен
в) пропанол и пропаналь г) 2-метилпропан и 2-метилбутен
9. Тип реакции взаимодействия этена с бромоводородом
а) присоединения б) замещения в) гидрирования г) изомеризации
10. Только σ – связи имеются в молекуле
а) этаналя б) этанола в) бензола г) уксусной кислоты
![]() 11. Вещество СН3 –
СН2 – С = СН2 называется
11. Вещество СН3 –
СН2 – С = СН2 называется
СН3
а)2-метилбутен-1 б) 2-метилбутен-2
в) 3-метилбутин-1 г) 3-метилбутен-1
12. Несколько функциональных групп -ОН содержат молекулы
а) этанола и глюкозы б) фенола и формальдегида
в) сахарозы и формальдегида г) глюкозы и глицерина
13. Следующие признаки: sp2-гибридизация, длина С-С связи 0,134 нм,
угол 1200 характерны для молекулы
а) циклобутана б) этана в) этина г) этена
14. Функциональная группа -СООН характерна для класса
а) альдегидов б) аминов в) карбоновых кислот г) спиртов
15. Карбонильная группа содержится в молекуле
а) метанола б) ацетальдегида в) фенола г) глицерина
16. Реактивом для распознавания фенолов является
а) бромная вода б) оксид меди (+2)
в) гидроксид меди (+2) г) хлорид железа (+3)
17. Продуктами межмолекулярной дегидратации предельных
одноатомных спиртов являются
а) альдегиды б) кетоны в) простые эфиры г) сложные эфиры
18. Жир можно получить реакцией
а) гидрирования б) гидратации в) этерификации г) дегидратации
19. В реакцию «серебряного зеркала» вступают
а) спирты б) фенолы в) альдегиды г) одноатомные спирты
20. Из остатков молекул β– глюкозы состоят молекулы
а) глюкозы б) крахмала в) сахарозы г) целлюлозы
21. Установите тип реакции: n CH2 = CH2 → ( - CH2 - CH2-)n
а) полимеризация б) замещения
в) поликонденсации г) изомеризации
22. Для аминокислот характерны свойства
а) кислот б) оснований в) амфотерных соединений
![]() 23. Какое название у
вещества СН3 – СН – СН2 – СООН
23. Какое название у
вещества СН3 – СН – СН2 – СООН
NH2
а) 3-аминопропановая кислота б) 2-аминобутановая кислота
в) α-аминомасляная кислота г) β- аминомасляная кислота
24. В состав белков входят остатки
а) δ-аминокислот б) β-аминокислот
в) γ-аминокислот г) α- аминокислот
25. Химическая связь, образующая вторичную структуру белков:
а) водородная б) ионная в) пептидная г) ковалентная неполярная
часть Б.
Н – 13,04%, О – 34,78% и относительная плотность по водороду 23
2.Напишите уравнения для осуществления превращений:
С2Н5ОН → С2Н4 → С2Н5Сl → С4Н10 Укажите условия реакций, назовите продукты.
3. Выберите, с какими из перечисленных веществ может взаимодействовать этановая кислота, и напишите соответствующие уравнения реакций:
магний, гидроксид натрия, хлорид натрия, хлороводород, этанол
4.При полном сгорании 4,4 г. углеводорода получилось 6,72 л. (н.у.) углекислого газа и 7,2 г. воды. Относительная плотность по воздуху равна 1,517. Выведите формулу углеводорода.
Инструкция по выполнению работы.
Тест состоит из частей А и Б. На его выполнение отводится 120 минут. Задания рекомендуется выполнять по порядку. Часть А содержит тестовые задания с выбором одного правильного ответа. Ответы на вопросы части А вносятся вами в таблицу бланка ответов.
Часть Б содержит задания со свободным ответом, предусматривающие произведение расчётов, написание уравнений реакций, составление структурных формул веществ.
Каждое задание части А оценивается в 1 балл, задание Б1 – 3 балла, Б2 – 5 баллов, Б3 -3 балла, Б4 – 3 балла, Б5 – 5 баллов. Общее количество баллов равно 44.
Шкала перевода баллов в отметки:
0 -15 баллов - «2» ( 0-34 %)
16 – 26 баллов - «3» (35-60%)
27 – 37 баллов -«4» (61-85 %)
38 – 44 балла - «5» (86-100%)
Ответы на задания 1 варианта. Часть А
|
1 |
2 |
3 |
4 |
5 |
|
г |
а |
б |
б |
а |
|
6 |
7 |
8 |
9 |
10 |
|
г |
б |
г |
а |
а |
|
11 |
12 |
13 |
14 |
15 |
|
г |
а |
в |
г |
в |
|
16 |
17 |
18 |
19 |
20 |
|
в |
а |
в |
а |
б |
|
21 |
22 |
23 |
24 |
25 |
|
в |
б |
а |
а |
в |
Б1 ответ С2Н7N
Б2 СаС2+2Н2О → Са(ОН)2+С2Н2 (этин и гидроксид кальция)
3 С2Н2 → С6Н6 С активир., t ̊ (бензол)
С6Н6 + НNO3 → С6Н5NO2 + Н2О Н2SO4 конц. (нитробензол)
Б3 2С2Н5ОН + 2Na → 2С2Н5ОNa + H2
С2Н5ОН + HCl → С2Н5Cl + Н2О
С2Н5ОН + СН3COОН → СН3COО С2Н5 + Н2О
Б4ответ С2Н6
Ответы на задания 2 варианта. Часть А
|
1 |
2 |
3 |
4 |
5 |
|
в |
б |
в |
в |
г |
|
6 |
7 |
8 |
9 |
10 |
|
б |
а |
а |
а |
б |
|
11 |
12 |
13 |
14 |
15 |
|
а |
г |
г |
в |
б |
|
16 |
17 |
18 |
19 |
20 |
|
г |
в |
в |
в |
г |
|
21 |
22 |
23 |
24 |
25 |
|
а |
в |
г |
г |
а |
Б1 ответ С2Н6О
Б2С2Н5ОН → С2Н4 + Н2О t ̊> 140 ̊, Н2SO4 конц. (этен и вода)
С2Н4 + НСl → С2Н5Сl (хлорэтан)
2 С2Н5Сl + 2Na → С4Н10 + 2NaСl (бутан и хлорид натрия)
Б3 СН3COОН + С2Н5ОН → СН3COОС2Н5 + Н2О
2 СН3COОН + Мg → (СН3COО)2Mg + Н2
2 СН3COОН + 2Na →2 СН3COОNa + Н2
Б4 ответ С3Н8
Лист регистрации изменений и дополнений в контрольно-измерительных материалах учебной дисциплины «Химия»
для специальностей:
08.02.01 Строительство и эксплуатация зданий и сооружений
08.02.09 Монтаж, наладка и эксплуатация электрооборудования промышленных и гражданских зданий
23.02.04 Техническая эксплуатация подъемно-транспортных, строительных, дорожных машин и оборудования (по отраслям)
07.02.01 Архитектура
09.02.01 Компьютерные системы и комплексы
|
№ изменения |
Номера изменённых |
№ протокола /подпись ПЦК |
Дата ввода изменений |
|
|
страниц |
пунктов |
|||
|
|
|
|
|
|
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.