
Министерство образования и молодежной политики Владимирской области Государственное бюджетное
профессиональное образовательное учреждение Владимирской области
«Суздальский индустриально-гуманитарный колледж»
___________
КОНТРОЛЬНО-ОЦЕНОЧНЫЕ СРЕДСТВА
по учебной дисциплине «Химия»
для студентов
специальностей 38.02.01 «Экономика и бухгалтерский учёт (по отраслям)»,
43.02.14 «Гостиничное дело», 43.02.16 «Туризм и гостеприимство», 35.02.16
«Эксплуатация и ремонт сельскохозяйственной техники и оборудования»,
23.02.07 «Техническое обслуживание автотранспортных средств», профессий 35.01.13 «Тракторист-машинист сельскохозяйственного производства»,
35.01.26 «Мастер растениеводства», 35.01.27 «Мастер сельскохозяйственного производства», 43.01.01 «Официант, бармен», 43.01.09 «Повар, кондитер»
Преподаватель: О.В.Петрова
Рассмотрены на заседании ЦК социально-экономических дисциплин Протокол № ____ от ___________2024 г.
Председатель_______
Суздаль, 2024
СОДЕРЖАНИЕ
Стр.
1. ПАСПОРТ КОМПЛЕКТА КОНТРОЛЬНО - ОЦЕНОЧНЫХ 3
СРЕДСТВ
2. РЕЗУЛЬТАТЫ ОСВОЕНИЯ УЧЕБНОЙ ДИСЦИПЛИНЫ, 3
ПОДЛЕЖАЩИЕ ПРОВЕРКЕ
3. ОЦЕНКА ОСВОЕНИЯ УЧЕБНОЙ ДИСЦИПЛИНЫ 12
4. КОНТРОЛЬНО-ОЦЕНОЧНЫЕ СРЕДСТВА ДЛЯ 15 ИТОГОВОЙ АТТЕСТАЦИИ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ
5. ПЕРЕЧЕНЬ РЕКОМЕНДУЕМЫХ УЧЕБНЫХ ИЗДАНИЙ, 35 ДОПОЛНИТЕЛЬНОЙ ЛИТЕРАТУРЫ
Представленный комплект оценочных средств (КОС) по дисциплине «Химия» соответствует требованиям ФГОС СПО. Комплект оценочных средств предназначен для контроля и оценки образовательных достижений обучающихся, освоивших программу учебной дисциплины «Химия».
КОС включает контрольно-оценочные материалы (КОМ) для проведения входного, текущего контроля и промежуточной аттестации, разработан в соответствии с:
-Федеральным государственным образовательным стандартом среднего профессионального образования
-основной профессиональной образовательной программой (ОПОП) и учебным планом;
-программой учебной дисциплины;
- образовательными технологиями, используемыми в преподавании данной дисциплины.
Предлагаемые преподавателем формы и средства текущего и рубежного контроля адекватны целям и задачам реализации основной образовательной программы, а также цели и задачам рабочей программы реализуемой учебной дисциплины, которая входит в цикл базовых общеобразовательных дисциплин.
Оценочные средства для промежуточной аттестации по итогам освоения дисциплины представлены в полном объеме.
Виды оценочных средств, включенных в представленный комплект, отвечают основным принципам формирования оценочных средств.
Разработанный и представленный для экспертизы комплект оценочных средств рекомендуется к использованию в процессе подготовки по указанным специальностям.
ПОДЛЕЖАЩИЕ ПРОВЕРКЕ
|
Код и наименование формируемых компетенций |
Планируемые результаты освоения дисциплины |
|
|
Общие |
Дисциплинарные |
|
|
ОК 01. Выбирать способы решения задач профессионал ьной деятельности применитель но к различным контекстам |
В части трудового воспитания: - готовность к труду, осознание ценности мастерства, трудолюбие; - готовность к активной деятельности технологической и социальной направленности, способность инициировать, планировать и самостоятельно выполнять такую деятельность; - интерес к различным сферам профессиональной деятельности, Овладение универсальными учебными познавательными действиями: а) базовые логические действия: - самостоятельно формулировать и актуализировать проблему, |
- владеть системой химических знаний, которая включает: основополагающие понятия (химический элемент, атом, электронная оболочка атома, s-, р-, dэлектронные орбитали атомов, ион, молекула, валентность, электроотрицательность, степень окисления, химическая связь, моль, молярная масса, молярный объем, углеродный скелет, функциональная группа, радикал, изомерия, изомеры, гомологический ряд, гомологи, углеводороды, кислород- и азотсодержащие соединения, биологически активные вещества (углеводы, жиры, белки), мономер, полимер, структурное звено, высокомолекулярные соединения, кристаллическая решетка, типы |
|
|
рассматривать ее всесторонне; - устанавливать существенный признак или основания для сравнения, классификации и обобщения; - определять цели деятельности, задавать параметры и критерии их достижения; - выявлять закономерности и противоречия в рассматриваемых явлениях; - вносить коррективы в деятельность, оценивать соответствие результатов целям, оценивать риски последствий деятельности; - развивать креативное мышление при решении жизненных проблем б) базовые исследовательские действия: - владеть навыками учебноисследовательской и проектной деятельности, навыками разрешения проблем; - выявлять причинноследственные связи и актуализировать задачу, выдвигать гипотезу ее решения, находить аргументы для доказательства своих утверждений, задавать параметры и критерии решения; - анализировать полученные в ходе решения задачи результаты, критически оценивать их достоверность, прогнозировать изменение в новых условиях; - уметь переносить знания в познавательную и практическую области жизнедеятельности; - уметь интегрировать знания из разных предметных областей; - выдвигать новые идеи, предлагать оригинальные подходы и решения; - способность их использования в познавательной и социальной практике |
химических реакций (окислительно- восстановительные, экзо-и эндотермические, реакции ионного обмена), раствор, электролиты, неэлектролиты, электролитическая диссоциация, окислитель, восстановитель, скорость химической реакции, химическое равновесие), теории и законы (теория химического строения органических веществ A.M. Бутлерова, теория электролитической диссоциации, периодический закон Д.И. Менделеева, закон сохранения массы), закономерности, символический язык химии, фактологические сведения о свойствах, составе, получении и безопасном использовании важнейших неорганических и органических веществ в быту и практической деятельности человека; - уметь выявлять характерные признаки и взаимосвязь изученных понятий, применять соответствующие понятия при описании строения и свойств неорганических и органических веществ и их превращений; выявлять взаимосвязь химических знаний с понятиями и представлениями других естественнонаучных предметов; - уметь использовать наименования химических соединений международного союза теоретической и прикладной химии и тривиальные названия важнейших веществ (этилен, ацетилен, глицерин, фенол, формальдегид, уксусная кислота, глицин, угарный газ, углекислый газ, аммиак, гашеная известь, негашеная известь, питьевая сода и других), составлять формулы неорганических и органических веществ, уравнения химических реакций, объяснять их смысл; подтверждать характерные химические свойства веществ соответствующими экспериментами и записями уравнений химических реакций; - уметь устанавливать принадлежность изученных неорганических и органических веществ к определенным классам и группам соединений, характеризовать их состав и важнейшие свойства; определять виды химических |
|
|
|
связей (ковалентная, ионная, металлическая, водородная), типы кристаллических решеток веществ; классифицировать химические реакции; - сформировать представления: о химической составляющей естественнонаучной картины мира, роли химии в познании явлений природы, в формировании мышления и культуры личности, ее функциональной грамотности, необходимой для решения практических задач и экологически обоснованного отношения к своему здоровью и природной среде; - уметь проводить расчеты по химическим формулам и уравнениям химических реакций с использованием физических величин, характеризующих вещества с количественной стороны: массы, объема (нормальные условия) газов, количества вещества; использовать системные химические знания для принятия решений в конкретных жизненных ситуациях, связанных с веществами и их применением |
|
ОК 02. Использовать современные средства поиска, анализа и интерпретаци и информации и информацион ные технологии для выполнения задач профессионал ьной деятельности |
В области ценности научного познания: - сформированность мировоззрения, соответствующего современному уровню развития науки и общественной практики, основанного на диалоге культур, способствующего осознанию своего места в поликультурном мире; - совершенствование языковой и читательской культуры как средства взаимодействия между людьми и познания мира; - осознание ценности научной деятельности, готовность осуществлять проектную и исследовательскую деятельность индивидуально и в группе; Овладение универсальными учебными познавательными действиями: в) работа с информацией: - владеть навыками получения информации из источников разных типов, самостоятельно |
- уметь планировать и выполнять химический эксперимент (превращения органических веществ при нагревании, получение этилена и изучение его свойств, качественные реакции на альдегиды, крахмал, уксусную кислоту; денатурация белков при нагревании, цветные реакции белков; проводить реакции ионного обмена, определять среду водных растворов, качественные реакции на сульфат-, карбонат- и хлориданионы, на катион аммония; решать экспериментальные задачи по темам "Металлы" и "Неметаллы") в соответствии с правилами техники безопасности при обращении с веществами и лабораторным оборудованием; представлять результаты химического эксперимента в форме записи уравнений соответствующих реакций и формулировать выводы на основе этих результатов; - уметь анализировать химическую информацию, получаемую из разных источников (средств массовой информации, сеть Интернет и другие); - владеть основными методами научного |
|
|
осуществлять поиск, анализ, систематизацию и интерпретацию информации различных видов и форм представления; - создавать тексты в различных форматах с учетом назначения информации и целевой аудитории, выбирая оптимальную форму представления и визуализации; - оценивать достоверность, легитимность информации, ее соответствие правовым и морально-этическим нормам; - использовать средства информационных и коммуникационных технологий в решении когнитивных, коммуникативных и организационных задач с соблюдением требований эргономики, техники безопасности, гигиены, ресурсосбережения, правовых и этических норм, норм информационной безопасности; - владеть навыками распознавания и защиты информации, информационной безопасности личности; |
познания веществ и химических явлений (наблюдение, измерение, эксперимент, моделирование); - уметь проводить расчеты по химическим формулам и уравнениям химических реакций с использованием физических величин, характеризующих вещества с количественной стороны: массы, объема (нормальные условия) газов, количества вещества; использовать системные химические знания для принятия решений в конкретных жизненных ситуациях, связанных с веществами и их применением |
|
|
ОК 04. Эффективно взаимодейств овать и работать в коллективе и команде |
- готовность к саморазвитию, самостоятельности и самоопределению; -овладение навыками учебноисследовательской, проектной и социальной деятельности; Овладение универсальными коммуникативными действиями: б) совместная деятельность: - понимать и использовать преимущества командной и индивидуальной работы; - принимать цели совместной деятельности, организовывать и координировать действия по ее достижению: составлять план действий, распределять роли с учетом мнений участников обсуждать результаты совместной работы; |
- уметь планировать и выполнять химический эксперимент (превращения органических веществ при нагревании, получение этилена и изучение его свойств, качественные реакции на альдегиды, крахмал, уксусную кислоту; денатурация белков при нагревании, цветные реакции белков; проводить реакции ионного обмена, определять среду водных растворов, качественные реакции на сульфат-, карбонат- и хлориданионы, на катион аммония; решать экспериментальные задачи по темам "Металлы" и "Неметаллы") в соответствии с правилами техники безопасности при обращении с веществами и лабораторным оборудованием; представлять результаты химического эксперимента в форме записи уравнений соответствующих реакций и формулировать выводы на |
|
|
|
- координировать и выполнять работу в условиях реального, виртуального и комбинированного взаимодействия; - осуществлять позитивное стратегическое поведение в различных ситуациях, проявлять творчество и воображение, быть инициативным Овладение универсальными регулятивными действиями: г) принятие себя и других людей: - принимать мотивы и аргументы других людей при анализе результатов деятельности; - признавать свое право и право других людей на ошибки; - развивать способность понимать мир с позиции другого человека; |
основе этих результатов. |
|
|
ОК 07. Содействоват ь сохранению окружающей среды, ресурсосбере жению, применять знания об изменении климата, принципы бережливого производства, эффективно действовать в чрезвычайны х ситуациях |
В области экологического воспитания: - сформированность экологической культуры, понимание влияния социальноэкономических процессов на состояние природной и социальной среды, осознание глобального характера экологических проблем; - планирование и осуществление действий в окружающей среде на основе знания целей устойчивого развития человечества; активное неприятие действий, приносящих вред окружающей среде; - умение прогнозировать неблагоприятные экологические последствия предпринимаемых действий, предотвращать их; - расширение опыта деятельности экологической направленности; - овладение навыками учебноисследовательской, проектной и социальной деятельности; |
- сформировать представления: о химической составляющей естественнонаучной картины мира, роли химии в познании явлений природы, в формировании мышления и культуры личности, ее функциональной грамотности, необходимой для решения практических задач и экологически обоснованного отношения к своему здоровью и природной среде; - уметь соблюдать правила экологически целесообразного поведения в быту и трудовой деятельности в целях сохранения своего здоровья и окружающей природной среды; учитывать опасность воздействия на живые организмы определенных веществ, понимая смысл показателя предельной допустимой концентрации |
|
Предметом оценки служат знания и умения, предусмотренные ФГОС СПО по дисциплине Химия, и направленные на формирование общих и профессиональных компетенций.
«Входной контроль» проводится в начале учебного года.
Задачи проведения диагностической работы:
– определить уровень усвоения содержания образования по учебному предмету
«Химия»;
– предоставить подросткам возможность самореализации в учебной деятельности;
– определить пути совершенствования преподавания курса «Химия» на уровне среднего профессионального образования.
Диагностическая работа состоит из 12 заданий, из них 10 с записью краткого ответа и 2 задания с развернутым ответом. В работе содержатся задания базового и повышенного уровней сложности. На выполнение работы отводится 30 мин. Для выполнения заданий дополнительного оборудования не требуется. Выполнение задания в зависимости от типа и трудности оценивается разным количеством баллов. Максимальный балл за выполнение всей работы – 15 баллов.
Габриелян О.С. Химия для профессий и специальностей технического профиля :
учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г.Остроумов.
— 4-е изд., стер. — М. : Издательский центр «Академия», 2022. — 272 с.
Тестовые задания могут быть использованы не только для входного или итогового контроля, но и для проверки усвоения текущего материала, а также для закрепления информации. Тестовые форматы позволяют быстро осуществить проверку знаний, а также могут быть использованы для взаимопроверки.
Другим видом заданий являются задания-задачи. Данный тип заданий носит ярко выраженный практико-ориентированный характер. В задачах рассматривается ситуация и ставится проблема, которую предстоит решить, опираясь на предметные знания и проявляя функциональную грамотность. В ходе проверки выполнения заданий преподавателю важно дифференцировать различные уровни освоения обучающимися необходимых для выполнения заданий компетенций, и с этой целью фиксировать, у кого полностью выполнено задание, у кого задание выполнено частично, у кого задание не выполнено.
Особенностью проектных заданий является наличие конкретного проектного продукта, который возможно создать в ходе занятия как индивидуально, так и в группе: памятки, рекомендации, руководства, плакаты, мини-сценарии и пр. В каждом случае критерии оценивания формулируются, исходя из конкретного проектного выхода.
Работа со схемами, таблицами, диаграммами, инфографикой также является неотьемлемой частью курса. Данный формат работы позволяет оценить уровень овладения знаниями и метапредметными умениями. Задания могут быть направлены на выявление, анализ, оценку информации, представленной в форме схемы, таблицы, диаграммы или инфографики. Выполнение заданий может проходить как письменно, так и устно.
Работа с документами, содержащими социальную информацию позволяет, в первую очередь, проверить уровень овладения метапредметными умениями. Задания могут быть направлены на выявление, анализ, оценку информации, представленной в тексте.
Устный опрос (собеседование) представляет собой ряд вопросов, с помощью которых представляется возможным провести текущую проверку усвоения материала.
Проблемное обсуждение включает вопросы, на которые трудно дать однозначные ответы, а требуется рассмотреть проблему с разных сторон или позиций. Задания могут выполняться устно (фронтально или в групповой форме), а также в письменном виде индивидуально.
Самооценка является своеобразной заявкой на ту или иную отметку, позволяет обучающемуся самостоятельно без участия преподавателя определить объем своих знаний и уровень владения конкретными умениями.
Оформление самооценки может быть представлено либо на отдельном листе, либо самооценка своих учебных результатов может фиксироваться обучающимся непосредственно на листе, где выполнена самостоятельная (практическая) работа. Так, преподаватель до фактической проверки работы сможет ознакомиться с информацией, как обучающиеся оценили свои результаты, и составить представление о сложности для них темы и заданий, которое позже подтвердит или опровергнет проверка.
|
Объем выполнения (в %) |
Вариант самооценки |
Возможный комментарий обучающегося |
|
|
Менее 35 |
Не знаю и не понимаю материал |
Не понял(а) тему, не справился(ась) с большей частью заданий |
- не владею базовым материалом (не читал(а) материал), - не понимаю сути (особенностей) задания, которое необходимо выполнить Итог: - изучить материал в учебнике, - составить конспект основных элементов содержания темы, - решать типовые задания, - обратиться за консультацией к преподавателю |
|
От 35 до 65 |
Знаю, но не понимаю, как применить |
Остались вопросы по теме, в части заданий допущены ошибки |
- не отработал(а) материал на типичных заданиях Итог: - ознакомиться с содержанием темы повторно, - составить краткую схему содержания темы, - решать типовые задания, - обратиться за консультацией к преподавателю |
|
От 65-85 |
Знаю и понимаю, как |
Хорошо понял(а) тему, с |
- не отработал(а) материал на заданиях повышенного уровня |
|
|
применить |
большинством заданий справился(ась) |
сложности Итог: - ознакомиться с дополнительной литературой, - решать задания повышенного уровня сложности, - обратиться за консультацией к преподавателю |
|
От 85-100 |
Понимаю, как применять |
Владею материалом темы в свободной форме, заинтересован в выполнении заданий высокого уровня сложности |
- есть заинтересованность в изучении темы на углубленном уровне - есть заинтересованность в заданиях высокого уровня сложности Итог: - изучить дополнительную литературу, раскрывающую материал на углубленном уровне, - выполнять задания высокого уровня сложности, - принять участие в олимпиаде, - выполнить проект по теме |
Актуальным вариантом самооценки для обучающихся СПО является возможность соотнести задание с имеющимися знаниями и умениями и прогнозировать успех его выполнения.
|
Задание |
Необходимые знания |
Необходимые умения |
Прогнозирование результата |
|
Указывает задание |
Указывает тему, тезисно раскрывает теоретический материал |
- поиск нужной информации в задании, - описание, - сравнение, - анализ, синтез, - выдвижение гипотезы, - формулирование вывода, аргументации и пр. |
Низкий: - не справлюсь (не имею необходимых знаний и умений); Средний: - затрудняюсь (не владею всем объемом знаний и умений); Достаточный: - справлюсь (имею необходимые знания и умения, сомневаюсь в ряде заданий); Высокий: - уверен в успехе (имею необходимые знания и умения, владею |
|
|
|
|
материалом на высоком уровне) |
Важным элементом формирования критического мышления и коммуникации становится взаимооценка достигнутых образовательных результатов обучающимися. Взаимооценка проводится в форматах и по критериям, показанным в модельных примерах ФОС для текущего контроля.
Промежуточная аттестация (дифференцированный зачет) проводится по окончании изучения общеобразовательной дисциплины «Химия». Преподаватель профессиональной образовательной организации проводит проверочную работу (дифференцированный зачет), которая предназначена для промежуточной аттестации, итоговой оценки учебной подготовки студентов, завершивших освоение общеобразовательной дисциплины «Химия».
Задачей проведения проверочной работы (дифференцированного зачета) является определение уровня усвоения содержания образования по общеобразовательной дисциплине «Химия».
Проверочная работа состоит из двух частей. Первая часть включает 13 заданий, проверяющих усвоение обучающимися знаний по курсу. Вторая часть включает 4 задания, проверяющих умение обучающегося применять полученные знания в профессиональной деятельности. В работе содержатся задания базового и повышенного уровней сложности. На выполнение работы отводится 90 минут (2 академических часа). Для выполнения заданий дополнительного оборудования не требуется. При выполнении работы не разрешается пользоваться учебниками, рабочими тетрадями и другими справочными материалами. Выполнение задания в зависимости от типа и трудности оценивается разным количеством баллов. Максимальный балл за выполнение всей работы
– 31 балл.
Текущий контроль результатов обучения можно осуществлять различными методами и с помощью различных оценочных средств. По дисциплине «Химия» в качестве средств текущего контроля применяются вопросы для организации устного и письменного опроса, системы заданий в тестовой форме, задачи и упражнения, практико-ориентированные задания (теоретические, расчетные, ситуационные), лабораторные работы и другие оценочные мероприятия. Ниже приведем примеры некоторых из них.
Система заданий в тестовой форме – это содержательная система, охватывающая взаимосвязанные элементы знаний. В отличие от тестов, в системах заданий вероятность правильного ответа на последующее задание может зависеть от вероятности правильного ответа на предыдущие задания.
Для того чтобы на одном содержательном материале можно было составить несколько вариантов теста, конструируют базу заданий в тестовой форме. Если есть компьютерные программы генерации тестов, то в программу создания теста вводится база, включающая в себя параллельные по содержанию и трудности варианты одного и того же задания. Это означает, что проверка знания признаков, свойств, состава, функций однотипных объектов может быть организована на базе одного и того же задания, меняющего в своем тексте только название этих объектов. Эти задания называют фасетными, т.е. имеющими переменные элементы.
Приведем пример системы заданий в тестовой форме, включающей фасетные задания (фасеты в задании заключены в фигурные скобки).
|
Название темы |
Тема 1.1 «Строение атомов химических элементов и природа химической связи» |
|
Результат обучения |
Составлять химические формулы соединений в соответствии со степенью окисления химических элементов, исходя из валентности и электроотрицательности |
|
Общие компетенции |
ОК 01 |
Выберите один правильный ответ:
1. Атомы C и Si имеют одинаковое число:
А) нейтронов в ядре
Б) энергетических уровней
В) электронов на внешнем энергетическом уровне
Г) электронов
2. В ряду химических элементов Li–Be–B–C металлические свойства:
А) усиливаются
Б) ослабевают
В) не меняются
Г) изменяются периодически
3. К s-элементам относится:
А) К
Б) S
В) Fe Г) Br
4. Путем соединения атомов под номером 11 и 17 образуется вещество с химической связью:
А) ионной
Б) ковалентной полярной
В) ковалентной неполярной
Г) металлической
5. {количество электронов в атоме; количество энергетических уровней; количество электронов на последнем энергетическом уровне; количество протонов в ядре атома} соответствует
А) номеру периода
Б) номеру группы
В) порядковому номеру
6.{хлориду бария, алмазу, аммиаку, серной кислоте}соответствует
А) ионная химическая связь
Б) ковалентная полярная химическая связь
В) ковалентная неполярная химическая связь
7. {связь, образованная за счет образования общих электронных пар; связь, образованная за счет обобществления валентных электронов; связь, образованная за счет электростатических сил притяжения} называется А) ионной
Б) металлической
В) ковалентной
8. {в порядке возрастания металлических свойств; в порядке убывания радиуса атомов; в порядке возрастания кислотных свойств летучих водородных соединений}элементы расположены в ряду
А) К, Са, Sc
Б) Al, Mg, Na В) F, Cl, I
9. Какое из суждений верно для элементов {VА группы , IVА группы, IА группы}
А) общая формула летучего водородного соединения RH4
Б) не образуют летучих водородных соединений
В) до завершения энергетического уровня не хватает трёх электронов
10. Среди веществ, указанных в ряду {NH3, O2, HCl, SO2; CaO, HNO3, Cl2,
CO2; H2SO4, HI, CuCl2, CH4, NH3}количество соединений с ковалентной полярной связью равно
А) трем
Б) двум
В) четырем
11. Химическая связь в молекулах {озона и хлорида кальция; серной кислоты и хлорида аммония; серной кислоты и озона} соответственно
А) ковалентная полярная и ионная
Б) ковалентная полярная и ковалентная неполярная
В) ковалентная неполярная и ионная
Как видно из приведенного примера, каждое фасетное задание может быть преобразовано в несколько различных вариантов одного задания тестовой системы. При организации автоматизированного текущего контроля появляется возможность генерации большого количества вариантов теста, при этом задания, полученные из фасета, будут параллельны по содержанию и трудности.
Практические задания и задачи, часто используемые в качестве дидактических средств в естественнонаучных дисциплинах, также могут быть фасетными. Возможно применение задач с вариантами ответа для удобства организации автоматизированного контроля.
Практические задания и задачи представлены в разделах:
1. Основы строения вещества – задачи на составление химических формул двухатомных соединений (оксидов, сульфидов, гидридов и т.п.).
2.1. Задачи на составление уравнений реакций: соединения, замещения, разложения, обмена и реакций с участием комплексных соединений (на примере гидроксокомплексов алюминия и цинка); окислительно-
восстановительных реакций с использованием метода электронного баланса; с участием комплексных соединений (на примере гидроксокомплексов цинка и алюминия).
2.2. Задачи на расчет количественных характеристик продукта реакции соединения; массовой или объемной доли выхода продукта реакции соединения от теоретически возможного; объемных отношений газов; количественных характеристик исходных веществ и продуктов реакции; массы (объем, количество вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества.
2.3. Задания на составление молекулярных и ионных реакций с участием оксидов, кислот, оснований и солей, ионных реакций гидролиза солей, установление изменения кислотности среды.
3.1 Задачи на расчет массовой доли (массы) химического элемента (соединения) в молекуле (смеси).
3.2. Практические задания по классификации, номенклатуре и химическим формулам неорганических веществ различных классов.
3.3. Практические задания на определение химической активности веществ в зависимости вида химической связи и типа кристаллической решетки.
3.4. Задания на составление уравнений химических реакций с участием простых и сложных неорганических веществ: оксидов металлов, неметаллов и амфотерных элементов; неорганических кислот, оснований и амфотерных гидроксидов, неорганических солей, характеризующих их свойства и способы получения.
4.1. Задания на составление названий органических соединений по тривиальной или международной систематической номенклатуре;
4.2. Задания на составление полных и сокращенных структурных формул органических веществ отдельных классов.
4.3. Задачи на определение простейшей формулы органической молекулы, исходя из элементного состава (в %).
4.5. Задания на составление уравнений химических реакций с участием органических веществ на основании их состава и строения.
4.6. Задания на составление уравнений химических реакций, иллюстрирующих химические свойства с учетом механизмов протекания данных реакций и генетической связи органических веществ разных классов. 4.7. Расчетные задачи по уравнениям реакций с участием органических веществ.
5.1 Практические задания на оценку изменения скорости химической реакции и направления смещения равновесия с использованием принципа Ле-Шателье.
5.2 Задачи на расчеты тепловых эффектов химических реакций и определение типа реакции (по тепловому эффекту: экзо- и эндотермические).
6. Дисперсные системы
6.1. Задачи на приготовление растворов.
7.1. Практические задания на составление уравнений реакций обнаружения катионов I–VI групп и анионов, в т.ч. в молекулярной и ионной формах.
7.2. Практические задания на составление качественных реакций обнаружения органических соединений.
1. Типовые расчеты по тематике эксперимента.
2. Задачи на вычисление среднего значения экспериментальных данных, погрешности.
3. Задание «Химический состав воды, тип воды и способы ее применения» (с использованием нормативных документов).
4. Задание «Взаимосвязь состава почвы, тип почвы и ее назначения». 9.2. Исследование и химический анализ объектов техносферы
1. Типовые расчеты по тематике эксперимента.
2. Задачи на вычисление среднего значения экспериментальных данных, погрешности.
3. Задачи на определение металлов, неорганических анионов и органических веществ в технической воде разного назначения.
4. Задание «Химический состав технической воды, тип воды и способы ее применения» (с использованием нормативных документов).
1. В реакцию, термохимическое уравнение которой S + O2 = SO2 + 297 кДж, вступила сера массой 1 г. Количество теплоты, выделившееся при этом, равно:
А) 9,28 кДж
Б) 74,25 кДж
В) 29,7 кДж
2. Укажите соль, водный раствор которой имеет щелочную среду
А) сульфат калия
Б) хлорид алюминия
В) карбонат калия
3. Определите название вещества, главная цепь которого состоит из четырех атомов углерода, содержит карбоксильную группу и одну двойную связь, а также радикалы метил и этил.
А) 3-метил-3-этилбутен-3-овая кислота
Б) 3-метил-2-этилбутен-3-овая кислота
В) 2-метил-3-этилбутен-3-овая кислота
4. Составьте химические формулы двухатомных соединений: {силицид кальция, гидрид бария, сульфид железа (III), оксид азота (II), оксид алюминия, хлорид железа (II), нитрид бария, оксид ртути (I), оксид сурьмы (V); оксид меди (I), хлорид ртути (II), нитрид калия, силицид магния, гидрид алюминия, сульфид свинца (II), бромид цинка, оксид углерода (II), оксид хлора (V); нитрид натрия, иодид меди (I), оксид хрома (II), оксид азота (V), гидрид натрия, хлорид хрома (III), оксид калия, оксид мышьяка (III), сульфид цинка}.
5. При взаимодействии {40; 20; 35} г смеси {серебра и цинка; цинка и меди; меди и железа} с соляной кислотой выделилось {6,72; 2,24; 5,6} л газа (н.у.). Определите массовую долю (в %) {цинка; меди; железа} в смеси.
6.Уравняйте окислительно-восстановительную реакцию {MnO2 + H2SO4 = MnSO4 + O2 + H2O;
Zn + K2Cr2O7 + H2SO4 = ZnSO4 + Cr2(SO4)3 + K2SO4 + H2O;
KClO3 + S = KCl + SO2} методом электронного баланса; определите окислитель и восстановитель.
7. Определите молекулярную формулу углеводорода, содержащего {80%; 85,7%; 75%} углерода. Относительная плотность паров вещества по {водороду; воздуху; кислороду} равна {15; 1,931; 0,5}.
А) C4H8
Б) C2H6
В) CH4
Вопросительные формулировки:
8. Какая масса уксусной кислоты потребуется для синтеза этилацетата массой 140,8 г. Выход эфира примите равным 80% от теоретически возможного.
9. Каким реактивом можно отличить глицерин от глюкозы? Составьте уравнение качественной реакции для обнаружения многоатомных спиртов на примере глицерина.
10. С помощью какого реактива можно распознать галогенид-ионы (Cl-, Br-, I-)? Составьте уравнения качественных реакций в молекулярной и ионной формах. Укажите признаки реакций.
Задачи, как и другие дидактические задания, могут выполнять обучающую и контролирующую функции. Решение задач может осуществляться на различных типах и этапах занятий.
Практико-ориентированные задания (как теоретические, так и расчетные), направлены на развитие результатов обучения основного модуля (разделы: «Основы строения вещества», «Строение и свойства неорганических / органических веществ», «Кинетические и термодинамические закономерности протекания химических реакций», «Дисперсные системы») и выявление химической сущности объектов природы, производства и быта, с которыми человек взаимодействует в процессе практической деятельности (прикладной модуль).
Практико-ориентированные задания можно определить как педагогически переработанный фрагмент профессиональной деятельности специалиста. Они разрабатываются для проверки знаний и умений обучающихся действовать в практических, нетипичных, экстремальных и других ситуациях. При изучении дисциплины «Химия» практикоориентированные задания применяются для активизации учебнопознавательной деятельности обучающихся путем «погружения» их в проблемы химических исследований, возникавших в истории развития науки, или имеющих практическое значение для человека.
Приведем примеры практико-ориентированных заданий по разделам «Строение и свойства неорганических веществ», «Строение и свойства органических веществ».
|
Название темы |
Тема 3.3. «Производство неорганических веществ. Значение и применение в быту и на производстве» |
|
Результат обучения |
Обосновывать значение и применение неорганических веществ в бытовой и производственной деятельности человека их физико-химическими свойствами |
|
Общие компетенции |
ОК 01, ОК 02 |
А знакомо ли вам понятие «карбокситерапия»? В терапевтических целях используют газообразное вещество. По этой причине подобную методику называют «газовыми уколами». Эта методика используется для лечения сердечно-сосудистых заболеваний, повышения эластичности кожи. Повышение содержания этого газа в крови говорит о некачественной функции крови. Самое удивительное, что оно используется в твёрдом виде в пищевой промышленности для хранения и перевозки продуктов: рыбы, мяса, мороженого.
Выберите один правильный ответ:
1. О каком веществе идёт речь?
А) углекислый газ
Б) кислород
В) аммиак
2. Какими химическими свойствами обладает это вещество?
А) кислотными
Б) основными
В) амфотерными
3. С чем может вступать во взаимодействие?
А) с водой, основными оксидами, щелочами, некоторыми солями
Б) с водой, кислотными оксидами, щелочами, некоторыми солями В) с водой, кислотными оксидами, кислотами, некоторыми солями
4. С помощью какого вещества его можно обнаружить?
А) фенолфталеина
Б) бромной воды
В) известковой воды
5. Приведите факты, которые доказывают отрицательное влияние этого газа на желудочно-кишечный тракт человека.
|
Название темы |
Тема 3.3. «Производство неорганических веществ. Значение и применение в быту и на производстве» |
|
Результат обучения |
Обосновывать значение и применение неорганических веществ в бытовой и производственной деятельности человека их физико-химическими свойствами |
|
Общие компетенции |
ОК 01, ОК 02 |
Известно, что в мире добывается примерно 100 миллионов тонн поваренной соли в год. На пищевые нужды расходуется около одной четвертой части этого количества. Куда же идет остальная соль?
Поваренная соль совершенно необходима при производстве мясных и рыбных консервов, она используется в металлургической отрасли промышленности, при обработке мехов и различных кож, в процессе приготовления мыла, идет для получения кальцинированной соды, применяется в медицине. Основной потребитель соли – химическая отрасль промышленности. В этой области используется не только сама соль, но и элементы, составляющие ее. В процессе электролиза ее раствора получают хлор, водород и едкий натр. Из раствора едкого натра получают твердую щелочь – каустик. Соединяя водород с хлором, получают соляную кислоту.
|
Название темы |
Тема 3.3. «Производство неорганических веществ. Значение и применение в быту и на производстве» |
|
Результат обучения |
Обосновывать значение и применение неорганических веществ в бытовой и производственной деятельности человека их физико-химическими свойствами |
|
Общие компетенции |
ОК 01, ОК 02 |
Одним из самых распространенных способов сварки плавлением является газовая сварка, которая производится с образованием газового пламени в каналах сварочной горелки. Образование газосварочного пламени невозможно без газа ацетилена. Технический ацетилен получают из карбида кальция.
1. Объясните, какой физический показатель позволяет использовать ацетилен для сварочных работ;
2. Составьте уравнение реакции получения ацетилена;
3. Составьте уравнение реакции горения ацетилена;
4. Вычислите объём ацетилена полученного из карбида кальция массой 128 г, содержащего 5% примесей, если выход ацетилена составляет 80% от теоретически возможного.
Название темы Тема 4.3. «Органические вещества в жизнедеятельности человека. Производство и применение органических веществ в промышленности»
 Результат
обучения Обосновывать значение и применение органических веществ
в бытовой и производственной деятельности человека их
физико-химическими свойствами
Результат
обучения Обосновывать значение и применение органических веществ
в бытовой и производственной деятельности человека их
физико-химическими свойствами
Общие компетенции ОК 01, ОК 02
Промежуточным продуктом обмена у теплокровных животных является молочная кислота. Запах этой кислоты кровососущие насекомые улавливают на значительном расстоянии.
1. Почему насекомые (комары) быстро находят свою жертву?
2. Установите формулу молочной кислоты, которая помогает насекомым находить теплокровных животных, если массовые доли элементов в ней составляют: углерода – 40,00%, водорода – 6,67%, кислорода – 53,33%.
3. Составьте структурную формулу молочной кислоты. Назовите кислоту по номенклатуре ИЮПАК.
4. На основании строения молочной кислоты сделайте вывод о ее химических свойствах.
5. Найдите в интернете или других источниках информацию о применении молочной кислоты.
Лабораторные работы являются важной частью учебного процесса по дисциплине и способствуют формированию у обучающихся умений исследовать химические процессы и явления (планировать и проводить химические эксперименты, исследовать вещества и проверять гипотезы, обрабатывать и интерпретировать результаты экспериментов). Лабораторные работы по химии предусмотрены в каждом разделе основного и прикладного модулей (табл. 2).
Таблица 2. Лабораторные работы по химии
|
Раздел |
Лабораторная работа |
|
Раздел 2. Химические реакции |
Лабораторная работа 1. «Реакции гидролиза» |
|
Раздел 3. Строение и свойства неорганических веществ |
Лабораторная работа 2. «Свойства металлов и неметаллов» |
|
Раздел 4. Строение и свойства органических веществ |
Лабораторная работа 3. «Получение этилена и изучение его свойств» |
|
Раздел 5. Кинетические и термодинамические закономерности протекания химических реакций |
Лабораторная работа 4 (на выбор) «Определение зависимости скорости реакции от концентрации реагирующих веществ» или «Определение зависимости скорости реакции от температуры» Лабораторная работа 5. «Изучение влияния различных факторов на смещение химического равновесия» |
|
Раздел 6. Дисперсные системы |
Лабораторная работа 6 (на выбор) «Приготовление растворов» или «Исследование дисперсных систем» |
|
Раздел 7. Качественные реакции обнаружения органических и неорганических веществ |
Лабораторная работа 7 (на выбор) «Аналитические реакции катионов I–VI групп» или «Аналитические реакции анионов» Лабораторная работа 8 (на выбор) «Качественные реакции на отдельные классы органических веществ» или «Качественный анализ органических соединений по функциональным группам» |
|
Раздел 9.1. Исследование и химический анализ объектов биосферы |
Лабораторная работа 9. «Основы лабораторной практики» Лабораторная работа 10 (на выбор) «Очистка воды от загрязнений» «Определение рН воды и ее кислотности» |
|
|
«Определение жесткости воды и способы ее устранения» Лабораторная работа 11 (на выбор) «Обнаружение нитратов в продуктах питания» «Исследование продуктов питания на наличие углеводов (мука, творог, молоко, йогурт) на наличие углеводов (крахмал, глюкоза, сахароза)» Лабораторная работа 12 (на выбор) «Обнаружение неорганических примесей в пробах почвы» «Определение рН водной вытяжки почвы, ее кислотности и щелочности» |
|
Раздел 9.2. Исследование и химический анализ объектов техносферы |
Лабораторная работа 9. «Основы лабораторной практики» Лабораторная работа 10 (на выбор) «Определение хлоридов методом титрования в технической воде» «Определение жесткости технической воды методом титрования» Лабораторная работа 11. «Определение содержания углекислого газа в воздухе помещения экспресс-методом» Лабораторная работа 12 (на выбор) «Изготовление красок (подбор пигментов и связывающих веществ)» «Исследование свойств вяжущих веществ на примере гипса» |
Оборудование лаборатории и рабочих мест лаборатории: мензурки, пипетки-капельницы, термометры, микроскоп, лупы, предметные и покровные стекла, планшеты для капельных реакций, фильтровальная бумага, промывалки, стеклянные пробирки, резиновые пробки, фонарики, набор реактивов, стеклянные палочки, штативы для пробирок; мерные цилиндры, воронки стеклянные, воронки делительные цилиндрические (50– 100 мл), ступки с пестиком, фарфоровые чашки, пинцеты, фильтры бумажные, вата, марля, часовые стекла, электроплитки, лабораторные штативы, спиртовые горелки, спички, прибор для получения газов (или пробирка с газоотводной трубкой), держатели для пробирок, склянки для хранения реактивов, раздаточные лотки; химические стаканы (50, 100 и 200 мл); шпатели; пинцеты; тигельные щипцы; секундомеры (таймеры), мерные пробирки (на 10–20 мл) и мерные колбы (25, 50, 100 и 200 мл), водяная баня (или термостат), стеклянные палочки; конические колбы для титрования (50 и 100 мл); индикаторные полоски для определения рН и стандартная индикаторная шкала; универсальный индикатор; пипетки на 1, 10, 50 мл (или дозаторы на 1, 5 и 10 мл), бюретки для титрования, медицинские шприцы на 100–150 мл, лабораторные и/или аналитические весы, рН-метры, сушильный шкаф, и др. лабораторное оборудование.
Приведем примеры лабораторных работ по разделу 2 «Химические реакции» и разделу 4 «Строение и свойства органических веществ».
|
Название темы |
Тема 2.2. «Электролитическая диссоциация и ионный обмен» |
|
Результат обучения |
Составлять уравнения химических реакции ионного обмена с участием неорганических веществ |
|
Общие компетенции |
ОК 01, ОК 02 |
а) сформулируйте цель планируемого эксперимента;
б) объясните, какой процесс называют гидролизом, какой он бывает;
в) объясните, какие существуют способы доказательства существования
гидролиза неорганических и органических веществ;
г) объясните, как составляется уравнение гидролиза;
д) объясните, что такое рН? Как зависит данный показатель от
кислотности или основности среды раствора;
е) объясните ход выполнения эксперимента по решению качественных
задач;
ж) перечислите основные аспекты соблюдения техники безопасности
при работе с агрессивными реагентами (гидроксид натрия).
|
Оборудование и посуда |
Реактивы |
|
|
1. Стеклянные пробирки |
1. |
Раствор NaOH |
|
2. Штатив для пробирок |
2. |
Раствор Na2SO4 |
|
|
3. |
Раствор AlCl3 |
|
|
4. |
Раствор Na2CO3 |
|
|
5. |
Раствор Cu(OH)2 |
|
|
6. |
Кислотно-основный индикатор |
|
Алгоритм проведения опыта № 1 |
Вопросы и задания |
|
Задание № 1. В трех пробирках под номерами находятся растворы трех солей: хлорида алюминия, сульфата натрия, карбоната натрия. Не пользуясь другими реактивами, определите состав каждой пробирки. |
1. Дать объяснение проведенным опытам. 2. Составить уравнения реакций, протекающих в пробирке в молекулярном и ионном видах. |
|
Алгоритм проведения опыта № 2 |
Вопросы и задания |
|
Задание № 2. Что произойдет, если охладить раствор карбоната натрия или добавить к нему гидроксид натрия? 1.1. Налить в пробирку 1–2 мл раствора карбоната натрия. 1.2. Опустить пробирку в стакан с очень холодной водой или снегом. 1.3. Проверить среду раствора при помощи кислотно-основного индикатора. 1.4. Добавить к раствору карбоната |
1.Какой индикатор лучше использовать для определения среды раствора? 2. Составить соответствующие уравнения химических реакций, в молекулярном и ионном видах. |
|
натрия гидроксид натрия. |
|
|
Алгоритм проведения опыта № 3 |
Вопросы и задания |
|
Задание № 3. Проблемный опыт. 1.1. В одну пробирку с раствором сульфата меди (II) прилить раствор гидроксида натрия. 1.2. Во вторую пробирку с раствором сульфата меди (II) прилить раствор карбоната натрия. 1.3. Сравнить цвет образующихся осадков. 1.4. Обратить внимание на выделение газа в одной из пробирок. 1.5. Определить, откуда может выделяться этот газ? 1.6. Проверить качественный состав газа горящей лучинкой. 1.7. Объяснить происходящее явление. |
1. Составить соответствующие уравнения химических реакций, в молекулярном и ионном видах. |
|
Алгоритм проведения опыта № 4 |
Вопросы и задания |
|
Задание № 4. Проблемный опыт. 1.1. К раствору хлорида алюминия прилить раствор карбоната натрия. |
1. Объяснить происходящее явление. 2. Составить соответствующие уравнения химических реакций, в молекулярном и ионном видах. 3. Ответить на вопросы. Для чего в медицинской практике используют раствор питьевой соды для полоскания при воспалительных заболеваниях горла? Какова роль гидролиза в природе? Почему раствор мыла пенится в воде? |
1. Проанализировать соответствие полученных результатов типам гидролиза. Сделать соответствующие выводы.
2. Сформулировать выводы о зависимости типа гидролиза и кислотности среды раствора.
 1. Вопросы для допуска к
лабораторной работе
1. Вопросы для допуска к
лабораторной работе а) сформулируйте цель планируемого эксперимента;
б) объясните, к какому классу органических веществ относится этилен;
в) объясните, какими химическими свойствами обладают вещества данного класса, какие качественные реакции для их обнаружения используются;
г) объясните, как можно получить вещества данного класса соединений
в лабораторных условиях;
д) объясните, из чего состоит прибор для получения газов;
е) перечислите основные аспекты соблюдения техники безопасности при работе с ЛВЖ (этиловый спирт), агрессивными реагентами
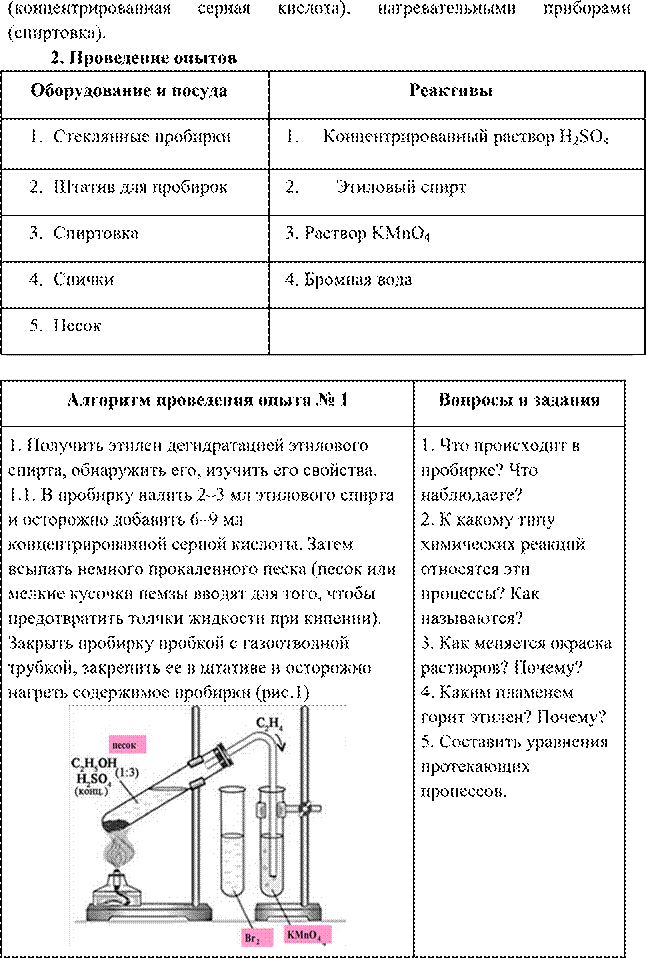
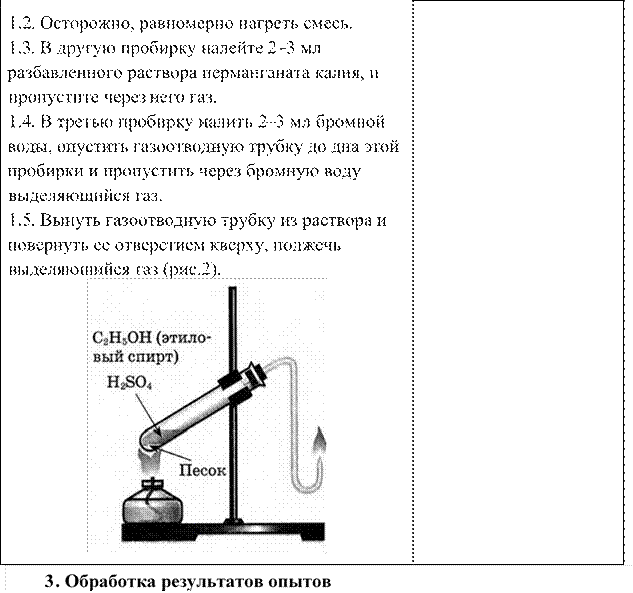
1. Проанализировать соответствие полученных результатов способам получения непредельных углеводородов ряда этилена (алкенов). Сделать соответствующий вывод.
2. Сформулировать вывод о физико-химических свойствах этилена.
3. Сформулировать вывод о способах обнаружения этилена.
Рубежный (тематический) контроль по дисциплине «Химия» проводится в форме контрольных работ по разделам основного модуля на отдельных занятиях, кейсов и учебно-исследовательских проектов.
Контрольные работы по химии как оценочные средства рубежного контроля завершают изучение 1 или 2 тематических разделов основного модуля.
Контрольная работа содержит четыре вида заданий:
1. Задачи на составление химических формул двухатомных соединений по их названию.
2. Задачи на составление уравнений реакций: соединения, замещения, разложения, обмена и реакций с участием комплексных соединений; окислительно-восстановительных реакций.
3. Задания на составление молекулярных и ионных реакций гидролиза солей, установление изменения кислотности среды.
4. Задачи на расчет количественных характеристик по уравнениям химических реакций: массовой или объемной доли выхода продукта реакции соединения от теоретически возможного; объемных отношений газов; количественных характеристик исходных веществ и продуктов реакции; массы (объем, количество вещества) продукта реакции, если одно из веществ дано в виде раствора с определенной массовой долей растворенного вещества.
Раздел 3. Строение и свойства неорганических веществ.
Контрольная работа «Свойства неорганических веществ» Контрольная работа содержит три вида заданий:
1. Задачи на расчет массовой доли (массы) химического элемента (соединения) в молекуле (смеси).
2. Практические задания по классификации, номенклатуре и химическим формулам неорганических веществ различных классов: определение класса неорганических веществ, называть неорганические соединения по международной и тривиальной номенклатуре по химическим формулам.
3. Задания на составление уравнений химических реакций с участием простых и сложных неорганических веществ: оксидов металлов, неметаллов и амфотерных элементов; неорганических кислот, оснований и амфотерных гидроксидов, неорганических солей, характеризующих их свойства и способы получения.
Раздел 4. Строение и свойства органических веществ. Контрольная работа «Строение и свойства органических веществ» Контрольная работа состоит из пяти видов заданий:
1. Задания на составление названий органических соединений по химическим формулам (в т.ч. структурным) с использованием тривиальной или международной систематической номенклатуры.
2. Задания на составление полных и сокращенных структурных формул органических веществ отдельных классов по их названиям в соответствии с международной номенклатурой.
3. Задачи на определение простейшей формулы органической молекулы, исходя из элементного состава (в %).
4. Задания на составление уравнений химических реакций, иллюстрирующих химические свойства с учетом механизмов протекания данных реакций и генетической связи органических веществ разных классов, в т.ч. цепочки превращений.
5. Расчетные задачи по уравнениям реакций с участием органических веществ.
Контрольная работа состоит из трех видов заданий:
1. Расчетные задачи на изменение скорости химических в зависимости от концентрации реагирующих веществ и температуры.
2. Задачи на расчеты тепловых эффектов химических реакций и определение типа реакции (по тепловому эффекту: экзо- и эндотермические).
3. Задания на применение принципа Ле-Шателье для нахождения направления смещения равновесия химической реакции и анализ факторов, влияющих на смещение химического равновесия.
Раздел 6. Дисперсные системы. Контрольная работа по теме
Контрольная работа состоит из двух частей:
1. Задачи на приготовление и расчет концентрации растворов (3 задачи на растворение, разбавление, смешивание растворов).
2. Задания на дисперсные системы, используемые в бытовой и производственной деятельности человека (в виде тестовых заданий).
Приведем примеры заданий контрольной работы по теме «Строение и свойства органических веществ», которая проводится после изучения обучающимися раздела 4.
По итогам изучения раздела 4 «Строение и свойства органических веществ» обучающиеся будут способны:
–определять принадлежность веществ к различным классам органических соединений; гомологи и изомеры;
–называть изученные вещества по «тривиальной» или международной номенклатуре;
–характеризовать строение и химические свойства изученных органических соединений;
–объяснять зависимость свойств органических веществ от их состава и строения;
–проводить вычисления по химическим формулам и уравнениям.
Тематический контроль осуществляется методом тестирования (I) или в форме письменной работы, включающей практические задания и задачи (II).
(I).
1. Вещество, состав которого выражен молекулярной формулой С3Н8, относится к классу:
1) арены 2) алканы
3) алкены
4) алкины
2. Название вещества, формула которого: СН3-СН(СН3)-СН2-СН2-ОН
1) бутанол-2
2) пентанол-2
3) 2-метилбутанол-4
4) 3-метилбутанол-1
3. Вещество, имеющее формулу СН2=СН2 называется:
1) толуол
2) этилен
3) глицерин
4) пропанол
4. Вещество, название которого пропионовая кислота, имеет формулу:
1) C2H5OH
2) (CH3)2NH
3) CH3-CH2-COOH
4) C3H9OH
5. Для алканов характерна реакция:
1) присоединения Н2
2) хлорирования на свету
3) обесцвечивания раствора KMnO4
4) полимеризации
6. Метанол реагирует с: 1) натрием
2) водой
3) водородом
4) метаном
7. Уксусная кислота вступает в реакцию с:
1) AgNO3
2) NaCl
3) Na2CO3 4) H2O
8. Верны ли утверждения:
А. Амины проявляют основные свойства
Б. Аминокислоты проявляют только основные свойства
1) верно только А
2) верно только Б
3) верны оба утверждения
4) неверно ни одно из утверждений
9. Уравнение химической реакции С2Н6+Cl2→C2H5Cl+HCl является:
1) реакцией замещения, протекающей по радикальному механизму
2) реакцией присоединения, протекающей по радикальному механизму
3) реакцией замещения, протекающей по ионному механизму
4) реакцией присоединения, протекающей по ионному механизму
10. В реакцию «серебряного зеркала» (с аммиачным раствором оксида серебра) вступает:
1) этанол 2) глюкоза
3) глицерин
4) крахмал
11. Установите соответствие между названием вещества и классом (группой) органических соединений, к которому(-ой) оно принадлежит. Название вещества
А) СН3СООН
Б) СН3-СН2-СН3
В) СН2=СН-СН2-СН3
Г) СН3-СН2-ОН
Класс органических соединений
1) одноатомные спирты
2) углеводы
3) карбоновые кислоты
4) ароматические углеводороды
5) непредельные углеводороды
6) предельные углеводороды
12. В схеме превращений
15000С Сакт +Br2
СН4 → Х1 → бензол → X2 веществами Х1 и X2 соответственно являются:
1) ацетилен
2) этилен
3) бромбензол
4) хлорбензол
5) фенол
6) циклогексан
13. Определите молекулярную формулу вещества, содержащего 37,5% углерода, 50% кислорода и 12,5% водорода. Относительная плотность паров этого вещества по водороду равна 16.
1) CH3OH
2) C2H5OH
3) HCOOH
4) C6H5OH
14. Сколько литров водорода потребуется для образования 10,2 г этилового спирта из ацетальдегида, если выход продукта реакции составляет 80%?
1) 6,2 л
2) 3,1 л
3) 12,75 л 4) 11,2 л Приведем пример заданий для письменной контрольной работы (II).
1. Дайте названия органическим соединениям по химическим формулам с использованием тривиальной или международной систематической номенклатуры:
а) C2H5OH
б) (CH3)2NH
в) CH3-CH(NH2)-COOH
г) C3H9N
д) CH3CH2HC=O
е) C6H5CH2OH
2. Составьте полные и сокращенные структурные формулы органических веществ отдельных классов по их названиям в соответствии с международной номенклатурой:
а) метилбензол
б) анилин
в) 3-метилбутаналь
г) циклогексен
д) бутадиен-1,2
е) 2-метилпропанол-1
ж) бутин-1
з) аминоуксусная кислота
3. Составьте уравнения химических реакций согласно схеме превращений:
15000С Сакт +Br2
СН4 → Х1 → Х2 → X3
Укажите тип и механизм реакции, назовите образовавшиеся вещества.
4. Определите молекулярную формулу вещества, содержащего 37,5% углерода, 50% кислорода и 12,5% водорода. Относительная плотность паров этого вещества по водороду равна 16.
5. Сколько литров водорода потребуется для образования 10,2 г этилового спирта из ацетальдегида, если выход продукта реакции составляет 80%?
Кейсы используются в качестве оценочного средства в разделе 8 прикладного модуля, их содержание определяется с учетом профессиональной направленности образовательной программы СПО. Примеры возможных тем кейсов:
1. Потепление климата и высвобождение газовых гидратов со дна океана.
2. Будущие материалы для авиа-, машино- и приборостроения.
3. Новые материалы для солнечных батарей.
4. Лекарства на основе растительных препаратов.
5. Химические элементы в жизни человека.
6. Водородная энергетика.
Приведем примеры кейсов по химии (автор Голубева Инна Борисовна, учитель химии, https://urok.1sept.ru/articles/636947).
В Японии объединенными силами Национального института здоровья и Префектурного университета Сидзуоки было проведено исследование. Ученые выяснили, что естественные органические вещества вступают в реакцию с хлорированной водой из-под крана, образуя опасные соединения, которые могут служить причиной рака. Такие соединения называются МХ, то есть «Мутаген икс» или «Неизвестный мутаген».
Задания:
1. Предложите способы уменьшения ядовитого влияния хлора в питьевой воде на организм человека.
2. Исходя из своей жизненной практики, приблизительно рассчитайте, сколько хлорированной воды вы используете в течение дня и для каких целей?
3. Какие органы человека больше всего страдают от воздействия хлора?
4. Как влияет хлорированная вода на человека при купании?
5. Найдите дополнительную информацию о замене хлора при обеззараживании воды.
6. Исследуйте различные товары бытовой химии в своём доме. Составьте список хлорсодержащих соединений, укажите меры безопасности при работе с ними.
Автомобили Honda FCX Clarity на водородных топливных элементах ездят по дорогам Европы с 2009 года. В 2011 году Honda присоединилась к европейскому партнерству экологичной энергии (Clean Energy Partnership), после чего вывела на первый план производство экологически чистых автомобилей. А на Пятом Московском Международном автосалоне ВАЗ представил свою новинку «Лада-Антэл» с баллонами водорода и кислорода.
Задания:
1. Почему многие автомобильные компании разрабатывают автомобили, работающие на водородном топливе?
2. Как выхлопные газы автомобилей, работающих на углеводородном топливе, влияют на здоровье человека?
3. Какие «+» и «–» вы видите у водородомобилей?
4. Найдите дополнительную информацию об их устройстве.
5. Если в вашей семье или у ваших знакомых есть автомобили, подсчитайте, сколько приблизительно литров бензина, газа и какой марки используете ежедневно.
6. Какие вещества и в каком количестве могут находиться в выхлопных газах ваших автомобилей?
Учебно-исследовательский проект является основным способом оценки результатов обучения, сформированных у обучающихся в ходе освоения прикладного модуля химии в разделах 9.1. и 9.2. Исследование и химический анализ объектов биосферы/техносферы (с учетом будущей профессиональной деятельности).
Приведем пример проектного задания, работа над которым начинается с начала раздела, а детальное выполнение заданий в группах и оформление результатов проектной деятельности производится в конце изучения раздела.
Общая тема проекта, приведенная ниже, в дальнейшем декомпозируется по фасетному принципу в зависимости от получаемой обучающимися специальности (профессии), а также каждая группа может рассмотреть более углубленно один из обязательных содержательных компонентов (подтем) проекта.
Название проекта: составление проекта цветника/сада/огородам в зависимости от состава проанализированных почв.
Проблема исследования: определение возможности разбивки цветника в соответствии с дизайнерским запросом и необходимости адаптации дизайнерского проекта к почвенным и климатическим условиям на основании исследования химического состава почв предложенного участка.
Цель проекта: определить влияние химического состава почв на предложенном участке на ассортимент растений, рекомендованных к посадке для реализации выбранного дизайнерского проекта.
Задачи проекта:
1) исследовать химический состав, структуру, кислотность почвы на предложенном участке;
2) исследовать инсоляцию отведенного для цветника участка;
3) предложить меры по улучшению качества почвы путем внесения различных удобрений и добавок на предложенном участке в случае необходимости;
4) определить ассортимент растений в соответствии с выявленными особенностями исследованного участка и дизайнерским запросом;
5) составить посадочную ведомость;
6) подготовить и публично представить презентацию по теме проекта в команде. Результаты обучения:
–определять перечень необходимых исследований химического состава почв и участка для составления или адаптации ранее разработанного проекта цветника;
–описывать зависимость ассортимента растений от качества предложенной почвы для обустройства цветника;
–способность использовать современные средства поиска, анализа и интерпретации информации, и информационные технологии для выполнения задач профессиональной деятельности (ОК–2);
–способность эффективно взаимодействовать и работать в коллективе и команде (ОК–4). Результат проектной работы обучающегося:
–макет / видеоматериал / печатные средства / 3D-модели космической технологии; презентация результатов исследования на профессиональных конкурсах. Форма представления результатов проектной работы:
–защита проекта с использованием средств визуализации и
демонстрации продукта ( / макета / видеоматериала / печатных средств / 3Dмодели (при наличии).
Возможные варианты тем проектов:
1. Исследование состава минеральной воды и рекомендации по ее использованию.
2. Исследование разрушающего действия природной воды на строительные материалы.
3. Составление проекта цветника/огорода/сада в зависимости от состава проанализированных почв в соответствии с дизайнерским запросом (монохромный цветник, цветник однолетников, многолетников, декоративный огород и др.).
4. Составление сбалансированного меню на день (неделю) в зависимости от содержания химических макро и микроэлементов в продуктах питания.
5. Исследование качества питьевой воды.
6. Исследование проб водопроводной воды на предмет устранения жесткости.
7. Устранение жесткости воды в сельскохозяйственной деятельности.
8. Контроль качества технической воды разных видов в соответствии с методиками по ГОСТ.
9. Создание декоративной штукатурки.
10. Пигменты в изделиях из стекла.
11. Исследование разрушающего действия воды на строительные материалы.
12. Оценка состояния воздуха рабочей зоны специалиста (технолога, строителя и т.п., с учетом области профессиональной деятельности) в соответствии с нормативными документами
Промежуточная аттестация по дисциплине «Химия» проводится в форме экзамена. Каждый экзаменационный билет состоит из трех заданий: 1) теоретическое задание в виде вопроса из теоретического содержания основного и прикладного модулей; 2) практическое задание (составление уравнений химических реакций с участием неорганических или органических веществ, в т.ч. цепочек превращений и качественных реакций обнаружения; химических формул неорганических и органических веществ, в т.ч. структурных; задания по номенклатуре неорганических и органических веществ; оценка изменения скорости химической реакции и направления смещения равновесия с использованием принципа Ле-Шателье; оценка химического состава и обоснование применимости объекта био- или техносферы и т.п.); 3) расчетная задача (расчеты по уравнению химических реакций, расчет массовой доли (массы) химического элемента (соединения) в молекуле (смеси); определение простейшей формулы органической молекулы, исходя из элементного состава (в %); расчеты тепловых эффектов химических реакций; расчеты зависимости скорости химической реакции от концентрации и температуры и т.п.).
Приведем пример экзаменационного билета.
Задание 1.
Какой раствор используют для качественной рекции определения хлоридов, бромидов, йодидов? Напишите уравнения реакций и обоснуйте ответ.
Задание 2.
Дана схема превращений.
C2H5OH Al2O3, 400°→ X1 KMnO4, H2O, 0-20°→ X2 HBr (изб.), t→ X3 t→ этин →
→C2H4O
Пропишите все реакции и определить вещества Х1, Х2, Х3.
Задание 3.
Определите массовые доли химических элементов в оксиде алюминия Al2O3 и выразите их в процентах.
Основные печатные издания
1. Блинов, Л. Н. Химия : учебник для среднего профессионального образования / Л.
Н. Блинов, И. Л. Перфилова, Т. В. Соколова. — 2-е изд., стер. — Санкт-Петербург : Лань, 2021. — 260 с.
2. Егоров, В. В. Общая химия : учебник для среднего профессионального образования / В. В. Егоров. — Санкт-Петербург : Лань, 2022. — 192 с.
3. Пресс, И. А. Общая химия : учебное пособие для среднего профессионального образования / И. А. Пресс. — Санкт-Петербург : Лань, 2021. — 496 с.
4. Щеголихина Н. А. Общая химия. Учебник. СПО / Н.А. Щеголихина — СанктПетербург : Лань, 2021. — 164 с. 5. Пузаков, С. А. Химия. 11 класс : учеб. для общеобразоват.
организаций : углубл. Уровень / С. А. Пузаков, Н. В. Машнина, В.А. Попков. – 2е изд. – М. : Просвещение, 2020. – 320 с.
6. Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С.Габриелян, И.Г. Остроумов. – М., 2016.- 256 с. 7. Габриелян О.С. Химия для профессий и специальностей технического профиля : учебник для студ. учреждений сред. проф. образования / О.С.Габриелян, И.Г.Остроумов. — 4-е изд., стер. — М. : Издательский центр «Академия», 2017. — 272 с.
Электронные издания (ресурсы)
1. hemi.wallst.ru - «Химия. Образовательный сайт для школьников»
2. www.alhimikov.net - Образовательный сайт для школьников
3. chem.msu.su - Электронная библиотека по химии
4. www.enauki.ru - Интернет-издание для учителей «Естественные науки»
5. 1september.ru - Методическая газета "Первое сентября"
6. hvsh.ru - Журнал «Химия в школе»
7. www.hij.ru/ - Журнал «Химия и жизнь»
8. chemistry-chemists.com/index.html - Электронный журнал «Химики и химия».
9. https://foxford.ru/wiki/himiya - Фоксфорд. Учебник по химии
Дополнительные источники
1. Леонова, Г. Г. Химия : учебное пособие / Г. Г. Леонова. — СанктПетербург : Лань, 2022. — 208 с.
2. Габриелян, О. С., Лысова, Г. Г. Химия: книга для преподавателя: учеб.-метод. пособие. — М. Академия, 2012. - 332 с.
3. Никольский, А. Б. Химия : учебник и практикум для среднего профессионального образования / А. Б. Никольский, А. В. Суворов. — 2-е изд., перераб. и доп. — Москва :
Издательство Юрайт, 2020. — 507 с. — (Профессиональное образование). — ISBN 978-5-
534-01209-5. — URL : https://urait.ru/bcode/452591
4. Аналитическая химия: учебное пособие для среднего профессионального образования / А. И. Апарнев, Г. К. Лупенко, Т. П. Александрова, А. А. Казакова. — 2-е изд., испр. и доп. — Москва : Издательство
Юрайт, 2020. — 107 с. — (Профессиональное образование). — ISBN 978-5-53407838-1. — URL : https://urait.ru/bcode/453609
5. Богомолова, И. В. Неорганическая химия: учебное пособие / И.В.
Богомолова. - Москва : ИНФРА-М, 2020. - 336 с. : ил. - (ПРОФИль). - ISBN 978-598281187-5. - Текст : электронный. - URL: https://znanium.com/catalog/product/1061490
6. Александрова, Э. А. Неорганическая химия. Теоретические основы и лабораторный практикум: учебник / Э. А. Александрова. — 3-е изд., стер. — Санкт-Петербург: Лань, 2020. — 396 с. — ISBN 978-5-8114-3473-2. — Текст : электронный // Лань : электроннобиблиотечная система. — URL: https://e.lanbook.com/book/130569 7. Черникова Н. Ю., Мещерякова Е. В. Решаем задачи по химии самостоятельно: учебное пособие / Н. Ю. Черникова, Е. В. Мещерякова — Санкт-Петербург : Лань, 2022. — 328 с.
8. Резников В. А. Сборник упражнений и задач по органической химии: учебное пособие / В.А. Резников — Санкт-Петербург: Лань, 2021. — 226 с.
9. Капустина А. А., Хальченко И. Г., Либанов В. В. Общая и неорганическая химия.
Практикум / А. А. Капустина, И. Г. Хальченко, В. В. .Либанов — Санкт-Петербург : Лань, 2020. — 152 с.
10. Гончаров Е. Г., Кондрашин В. Ю., Ховив А. М. Основы общей химии: учебное пособие / Е. Г. Гончаров и др. под ред. Н.В. Столярова — СанктПетербург : Лань, 2020. — 464 с.
11. Алексинский, В. Н. Занимательные опыты по химии. - М.: Академия, 2010 - 215 с.
12. Ахметов, Н. С. Актуальные вопросы неорганической химии. -М.: Академия, 2010 -
156 с.
13. Дайнеко, В. И. Как научить школьников решать задачи по органической химии - М.: Просвещение, 2011 - 230 с.
14. Зуева, М. В. Обучение учащихся применению знаний по химии - М.: Просвещение,
2011 - 210 с.
15. Линсон, И. А. Почему и как идут химические реакции- М.: МИРОС, 2010 -110 с.
16. Сорокин, В. В., Золотников, Э. Г. Химии в тестах. - СПб.: Химия, 2012
- 95 с.
17. Третьяков, Ю. Д. Справочные материалы по химии. - М.: Просвещение, 2010 - 320 с.
18. Шакикова, Д. М. Творчество на практических занятиях по химии. - М.: Академия, 2010 - 84 с.
РЕЦЕНЗИЯ
на контрольно-оценочные средства по дисциплине
(по отраслям)», 43.02.14 «Гостиничное дело», 43.02.16 «Туризм и гостеприимство», 35.02.16 «Эксплуатация и ремонт
сельскохозяйственной техники и оборудования», 23.02.07 «Техническое обслуживание автотранспортных средств», профессий 35.01.13
«Мастер растениеводства», 35.01.27 «Мастер сельскохозяйственного производства», 43.01.01 «Официант, бармен», 43.01.09 «Повар, кондитер»
Автор – Петрова О.В., преподаватель первой квалификационной категории
ГБПОУ ВО «СИГК»
Контрольно-оценочные средства по дисциплине «Химия» разработаны в соответствии с рабочей программой учебной дисциплины «Химия» для специальностей 38.02.01 «Экономика и бухгалтерский учёт (по отраслям)», 43.02.14 «Гостиничное дело», 43.02.16 «Туризм и гостеприимство», 35.02.16 «Эксплуатация и ремонт сельскохозяйственной техники и оборудования»,
23.02.07 «Техническое обслуживание автотранспортных средств», профессий
35.01.13 «Тракторист-машинист сельскохозяйственного производства», 35.01.26 «Мастер растениеводства», 35.01.27 «Мастер сельскохозяйственного производства», 43.01.01 «Официант, бармен», 43.01.09 «Повар, кондитер».
Контрольно-оценочные средства составлены в соответствии с «Положением о контрольно-оценочных средствах» и предусматривают проверку теоретических знаний в рамках дисциплины, проверку знаний, умений и навыков практического характера в рамках данной дисциплины.
Представленные материалы позволяют объективно оценить уровень знаний, умений, помогают сформировать общие компетенции обучающихся в соответствии с требованиями ФГОС СПО.
Контрольно-оценочные средства разработаны на основе актуальной литературы, используемой в рамках курса, содержат адекватные критерии оценивания знаний, умений и навыков обучающихся.
Заключение: Контрольно-оценочные средства по дисциплине «Химия» могут использоваться для проведения промежуточного контроля и итоговой аттестации по дисциплине «Химия».
Контрольно-оценочные средства могут быть рекомендованы к использованию в учебном процессе для указанных специальностей.
Рецензент –
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.