
ТЕМА 1. Состав вещества. Основные понятия и законы химии.
Современная химия – одна из естественных наук и представляет собой систему отдельных научных дисциплин: общей и неорганической, аналитической, органической, физической и коллоидной, геохимии, космохимии и т.д. Химия изучает материальный мир во всем многообразии форм его существования и превращений.
Все вещества состоят из атомов, следовательно, из электронов, протонов и нейтронов. Химия изучает первую форму существования материи – вещество. Химия – это наука, изучающая свойства и превращения веществ, сопровождающиеся изменением состава и строения (наука о веществах и их превращениях).
Химия тесно связана с другими естественными науками – физикой, биологией, математикой, геологией. На границе между геологией и химией возникла геохимия, изучающая распространенность и миграцию химических элементов на Земле. На стыке химии, биологии и геологии возникла биогеохимия, изучающая геохимические процессы с участием живых организмов.
Основные понятия химии
Основными в химии являются такие понятия, как атом, молекула, элемент, вещество, аллотропия и др.
У истока основных понятий химии стоит атомно-молекулярное учение, которое дает определение молекулы и атома:
Молекула - это наименьшая частица определенного вещества, которая обладает его химическими свойствами. Состав и химическое строение молекулы определяют ее химические свойства. Все вещества состоят из молекул, а молекулы из атомов.
Атом - это наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ, это электронейтральная частица, которая состоит из положительно заряженного ядра атома и отрицательно заряженных электронов, вращающихся вокруг ядра.
Молекулы и атомы находятся в постоянном движении.
В настоящее время известно 118 элементов, 89 из которых найдены в природе, остальные получены искусственно (см. Интересные факты о химических элементах). Что же такое Химический элемент? Это такой вид атомов, который имеет определенный заряд ядра и строение электронных оболочек.
Теперь рассмотрим строение атомного ядра и следующее основное понятие химии.
Атомное ядро состоит из протонов (Z) и нейтронов (N), имеет положительный заряд, равный по величине количеству протонов (или электронов в нейтральном атоме) и совпадает с порядковым номером элемента в периодической таблице. Суммарная масса протонов и нейтронов атомного ядра называется массовым числом
A = Z + N.
Существуют химические элементы (изотопы), имеющие одинаковый заряд ядер, но при этом различные массовые числами, что достигается за счет разного числа нейтронов в ядре.
Вещество – это некая совокупность атомов и молекул, их ассоциатов и агрегатов, которые могут находиться в любом из трех агрегатных состояний, образуют вещество.
Простые вещества состоят из атомов одного вида, а сложные вещества (химические соединения) состоят из атомов разного вида и образуются при химическом взаимодействии атомов разных химических элементов.
Аллотропия
Встречается явление, при котором один химический элемент может образовывать нескольких простых веществ, различных по свойствам и строению. Это явление называется Аллотропией. Аллотропные модификации характерны, например, для кислорода (O2 и O3), фосфора (белый, красный, черный фосфор), углерода (алмаз, графит), серы (моноклинная, ромбическая, пластическая), олова (белое, серое, ромбическое олово).
В 1814 г Й. Берцелиус предложил использовать химическую формулу — запись состава веществ с помощью химических знаков и индексов.
Химическое вещество характеризуется атомной массой, а молекулы — молекулярной массой.
Это отношение средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1/12 массы атома 12C.
Относительная молекулярная масса (Mr)
Это величина, показывающая, во сколько раз масса молекулы данного вещества больше 1/12 массы атома углерода 12C. Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов, составляющих химическое соединение, с учетом индексов. Моль вещества (n)
Это количество вещества, содержащее столько молекул, атомов, ионов, электронов или других структурных единиц, сколько содержится их в 12 г изотопа углерода 12C.
Число структурных единиц, содержащихся в 1 моле вещества равно
6,02 • 1023.Эточисло называется числом Авогадро (NA)
Молярная масса (M) показывает массу 1 моля вещества и равна отношению массы вещества к соответствующему количеству вещества.
M = m / n
Для более удобного сравнения способности различных элементов к соединению введено понятие химического эквивалента. Это одно из важнейших понятий химии, дадим ему определение:
Химическим эквивалентом вещества (Э) называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.
Масса 1 эквивалента вещества называется эквивалентной массой (mэкв). Масса одного моля эквивалента элемента — это молярная масса эквивалента MЭ(X).
Молярную массу эквивалента химического элемента, простых и сложных веществ (Mэкв(X)) рассчитывают по формуле: Мэкв(х) = M(X) / валентность где M(X) – молярная масса; вал – суммарная валентность.
Например, молярная масса эквивалента алюминия составляет Mэкв(Са) = 40/2 = 20 г/моль.
Молярные массы эквивалента кислорода и водорода постоянны и составляют:
Mэкв(О) = 16/2=8г/моль, МЭ(Н) = 1/1 = 1 г/моль.
Эквивалентную массу соединения можно определить по его химической формуле, например,
М экв(оксида) = М(оксида)/(число атомов кислорода ∙ 2);
М экв(основания) = М(основания)/число гидроксильных групп;
М экв(кислоты) = М(кислоты)/число протонов;
М экв(соли) = М(соли)/(число атомов металла ∙ валентность металла).
Пример, определим эквивалент (Э) и эквивалентную массу Мэкв (Х) фосфора, серы и брома в соединениях PHз, Н2S и HBr.
В PHз 1 моль атомов водорода соединяется с 1/3 моль фосфора, поэтому эквивалент фосфора равен Э(N) = 1/3 моль
В Н2S 1 моль атомов водорода соединяется с 1/2 моль серы, поэтому эквивалент серы равен Э(S) = 1/2 моль
В HBr 1 моль атомов водорода соединяется с 1 моль брома, поэтому эквивалент брома равен Э(Br) = 1 моль. Найдем эквивалентные массы:
Мэкв (Р) = 31/3 = 10,33 г/моль; Мэкв (S) = 32/2 = 16 г/моль; Мэкв (Br) = 80/1 = 80 г/моль.
Аналогично можно дать определение понятию эквивалентный объем.
Эквивалентный объем – это тот объем, который при данных условиях занимает 1 эквивалент вещества. Так как эквивалент водорода равен 1 моль, а в 22,4 л Н2 содержатся 2 эквивалента водорода; тогда эквивалентный объем водорода равен 22,4/2=11,2 л/моль, для О2 эквивалентный объем равен 5,6 л/моль.
Определить эквивалент вещества можно также по его соединению с другим веществом, эквивалент которого известен.
Определить молярную массу эквивалента (эквивалентную массу) можно исходя из закона эквивалентов, который рассмотрен немного ниже.
Основные законы химии
Нижеперечисленные законы принято считать основными законами химии.
Закон эквивалентов
В зависимости от класса веществ эквиваленты определяют по-разному.
Эквивалент простого вещества, вступающего в реакцию, – это такое его количество, которое приходится на единицу валентности соответствующего элемента.
Например, водород в своих соединениях одновалентен и его эквивалент равен 1 моль Н, или ½ моль Н2; кислород – двухвалентен, его эквивалент – ½ моль О, или ¼ моль О2; железо может быть двухвалентным, тогда его эквивалент – ½ моль Fe, или трехвалентным, тогда его эквивалент – ⅓ моль Fe.
Эквивалент кислоты – это такое ее количество, которое содержит 1 моль ионов водорода, замещающихся на катионы.
Например, эквивалент хлороводорода НСl 1 моль, фосфорноватистой Н3РО2 – 1 моль (одноосновная кислота); серной кислоты Н2SО4 – ½ моль.
Эквивалент двух- и многоосновных кислот может быть переменным в зависимости от реакции, в которой они участвуют. Например, в реакции NaOH + H2SO4 = NaHSO4 + H2O
эквивалент серной кислоты 1 моль, т. к. замещается 1 моль ионов
водорода, а в реакции
2NaOH + H2SO4 = Na2SO4 + 2H2O эквивалент ее ½ моль, т. к. замещаются 2 моль ионов водорода.
Эквивалент основания – это такое его количество, которое содержит 1 моль гидроксид-ионов, замещающихся на анионы.
Например, эквивалент гидроксида натрия NаОН – 1 моль; гидроксида железа (II) Fе(ОН)2 – ½ моль. Эквивалент двух- и многокислотных оснований также может быть переменным в зависимости от реакции, в которой они участвуют.
Например, в реакции
Cu(OH)2 + HNO3 = CuOHNO3 + H2O
эквивалент гидроксида меди (II) 1 моль, т. к. на нитрат-ионы
замещается 1 моль гидроксид-ионов, а в реакции Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O
эквивалент основания ½ моль, т. к. замещаются 2 моль гидроксид-
ионов.
Эквивалент соли – это такое ее количество, которое образовано количеством катиона, приходящимся на единицу его заряда.
Например, 1 моль хлорида натрия образован 1 моль ионов натрия Nа+ и 1 моль хлорид-ионов Сl–, на единицу заряда иона натрия приходится 1 моль Nа+, значит эквивалент NaCl – 1 моль; 1 моль хлорида кальция содержит 1 моль Са2+ и 2 моль Сl–, на единицу заряда иона кальция приходится ½ моль Са2+, значит эквивалент СаСl2 – ½ моль; 1 моль сульфата железа (III) содержит 2 моль Fе3+ и 3 моль SО42–, на единицу заряда иона железа (III) приходится ⅓ моль Fе3+, значит, эквивалент Fe2(SO4)3 – ⅙ моль.⅕
Окислительно-восстановительный (электрохимический) эквивалент – это такое количество окислителя (или восстановителя), которое в окислительно-восстановительной реакции принимает (или отдает) 1 моль электронов.
Масса одного эквивалента вещества (элемента) называется его эквивалентной массой Мэ (единица измерения г/моль).
Эквивалентные массы веществ можно рассчитать, используя следующие формулы:
МЭ(простого вещества) = М(простого вещества) / в(элемента), где М – молярная масса, в – валентность; МЭ(кислоты) = М(кислоты) / ν(Н+);
МЭ(основания) = М(основания) / (ОН–); МЭ(соли) = М(соли) / [(катиона)z], где z – заряд катиона;
Современная формулировка закона эквивалентов:
Вещества взаимодействуют друг с другом в количествах, пропорциональных их эквивалентам.
Исходя из этого закона, можно вывести формулу для расчетов:
![]() ,
,
где m1, МЭ,1 – масса и эквивалентная масса одного вещества, m2, МЭ,2 –
масса и эквивалентная масса другого вещества.
Пример 2.14. Определите эквивалент и эквивалентную массу элементов в следующих соединениях: хлороводород HCl, вода H2O, аммиак NH3 и метан СН4.
Решение. В указанных соединениях с 1 моль атомов водорода соединяется 1 моль атомов хлора, ½ моль атомов кислорода, ⅓ моль атомов азота и ¼ моль атомов углерода. Следовательно, согласно определению, эквиваленты хлора, кислорода, азота и углерода соответственно равны 1 моль, ½ моль, ⅓ моль и ¼ моль.
Исходя из молярных масс атомов этих элементов, находим их эквивалентные массы:
МЭ = Э ∙ М(Э);
МЭ(Cl) = 1 ∙ 35,5 = 35,5 (г/моль);
МЭ(О) = ½ ∙ 16 = 8 (г/моль);
МЭ(N) = ⅓ ∙ 14 = 4,67 (г/моль); МЭ(С) = ¼ 12 = 3 (г/моль).

Закон постоянства состава, сформулированный в 1808г. Ж.Прустом, гласит: Всякое чистое вещество, независимо от способов его получения, всегда имеет постоянный качественный и количественный состав. В качестве примера рассмотрим состав воды: качественный ее состав- она состоит из кислорода и водорода, количественный состав – 88,89% и
11,11%,соответственно. 12 Она имеет выше приведенный состав независимо от того, как она получена: синтезом из водорода и кислорода, реакцией нейтрализации или из кристаллогидратов. Оксид углерода (II) СО содержит
— 42,88% (масс) С
57,12% (масс)
О
Оксид углерода (IV) СО2 содержит — 27,29% (масс) С
72,71% (масс) О
Закон кратных отношений установлен 1803 году Джоном Дальтоном. Если два элемента образуют между собой несколько соединений, то массы атома одного элемента, приходящиеся на одну и ту же массу атома другого элемента, относятся между собой как небольшие целые числа. На примере оксидов серы:
Ar(S) = 32 Ar(O) = 16
1) SO2 m(S) : m(O) = 32 : 32 = 1 : 1
2) SO3 m(S) : m(O) = 32: 48 = 2 : 3
ТЕМА 2. Количество вещества и единицы измерения: моль, ммоль, нмоль. Число Авагадро. Молекулярная масса. Закон Авагадро и его следствия.
Отношение количества молекул N в данном теле к количеству атомов NA в 0,012 кг углерода называется количеством вещества:
v = N / NA; N = vNA.
Количество молекул воды в 1г равняется: N = m / m0 = 1 • 10-3 кг / 30 • 10-27 кг ≈ 3,3 • 1022.
Количество вещества измеряется в молях или киломолях. 1 кмоль = 103 моль.
Моль — это такое количество вещества, которое содержит столько же атомов, молекул или других структурных элементов вещества, сколько атомов содержится в 0,012 кг углерода.
Количество атомов или молекул в 1 моле вещества называют постоянной Авогадро NA. Она одинакова для всех веществ и является фундаментальной константой физики: NA = 6,022045 • 1023 моль-1.
1 моль кислорода содержится в 32 г кислорода, 1 моль воды — в 18 г воды.
Массу 1 моля вещества называют молярной массой. Согласно определению в СИ она измеряется в кг/моль и равняется произведению массы молекулы на постоянную Авогадро:
M = m0 • NA.
Молярная масса связана с относительной молекулярной массой простым соотношением:
М = Мr г /моль = Мr • 10-3 кг/моль.
Молярная масса воды равна 18 г/моль, или 18 • 10-3 кг/моль
Масса т произвольного количества вещества v определяется из соотношения:
m = m0 • N = v • m0 • NA = v • М.
На основании формулы v = N / NA и этого соотношения можно получить формулу для расчета общего количества молекул в теле:
N = NA • m / M.
Следовательно, для измерения количества вещества молекулярная физика использует величины, которые упрощают расчеты соответствующих величин,— постоянную Авогадро, молярную массу.
Закон Авогадро
|
T=const |
|
|
N) |
- |
Пусть температура постоянна (), давление не изменяется (p=const), объем постоянный (V=const): ( число частиц (молекул) любого идеального газа величина неизменная. Это утверждение называется законом Авогадро.
Закон Авогадро звучит следующим образом:
|
|
||
|
В равных объемах газов ( |
V |
) при одинаковых условиях |
|
(температуре Т и давлении Р) содержится одинаковое число молекул. |
||
Закон Авогадро был открыт в 1811 г Амедео Авогадро. Предпосылкой для этого стало правило кратных отношений: при одинаковых условиях объемы газов, вступающих в реакцию, находятся в простых соотношениях, как 1:1, 1:2, 1:3 и т. д.
Французский ученый Ж.Л. Гей-Люссак установил закон объемных отношений:
|
Объемы вступающих в реакцию газов при одинаковых условиях (температуре и давлении) относятся друг к другу как простые целые числа. |
|||||||||||
|
Например, |
1 л |
хлора соединяется с |
1 л |
водорода, образуя |
2 |
||||||
|
л |
хлороводорода; образуя |
|
оксида серы (IV) соединяются с
|
|
кислорода, |
||||||
|
оксида серы (VI). |
|
||||||||||
Реальные газы, как правило, являются смесью чистых газов — кислорода, водорода, азота, гелия и т. п. Например, воздух состоит из 77 % азота, 21 % кислорода, 1 % водорода, остальные — инертные и прочие газы. Каждый из них создает давление на стенки сосуда, в котором находится.
|
Давление, которое в смеси газов создает каждый газ в отдельности, как будто он один занимает весь объем, называется парциальным давлением (от лат. partialis — частичный) |
||||||
|
Нормальные условия: |
p = 760 мм рт. ст. |
или |
101 325 Па |
, |
t = 0 |
|
|
°С или 273 К. |
||||||
Следствия из закона Авогадро
Первое следствие :один моль любого газа при одинаковых условиях занимает одинаковый объем.
Второе следствие: молярный объём газов Vm — величина постоянная при неизменных температуре и давлении. Vμ=V/ν
где Vμ — молярный объем газа (размерность л/моль); V — объем
вещества системы; n — количество вещества системы. Пример записи:
|
|
Vμ |
газа (н.у.) = 22,4 л/моль - Это равенство для разных газов |
|
объясняется тем, что вещество количеством 1 моль всегда содержит 6,02 ∙ |
||
1023 частиц.
Следствие третье. Массы одинаковых объёмов двух газов при одинаковых условиях относятся как их молярные массы.
Покажем это на примере двух произвольных газов
одинакового объёма V при одних и тех же условиях. Известно, что ![]() Поскольку объёмы равны: V
Поскольку объёмы равны: V![]() .
Сократив обе части уравнения на Vm, получим:
.
Сократив обе части уравнения на Vm, получим:![]() .
.
Отношение ![]() называют относительной
плотностью первого газа по второму
называют относительной
плотностью первого газа по второму ![]() .
.
Знание относительной плотности одного газа Х по второму газу Y позволяет определить молярную массу одного из газов, если известна молярная масса другого газа: M(X) = M(Y) · DY(X).
Обычно относительную плотность газов веществ определяют по отношению к водороду или по отношению к воздуху.
Пример 1. Определите относительную плотность сернистого газа по водороду и по воздуху.
Решение. Так как молярная масса сернистого газа М(SO2) = 64 г/моль, то его относительная плотность по водороду:
![]()
относительная плотность по воздуху (M(возд.) = 29 г/моль):
![]() 𝑀(𝑆𝑂 ) 64г/
𝑀(𝑆𝑂 ) 64г/
.
Пример 2. Определите молярную массу газообразного углеводорода, если его относительная плотность по воздуху равна 2.
Решение. Исходя из определения относительной плотности газа, запишем:
![]()
Из этого соотношения следует: М(СхНу) = Dвозд. (СхНу)* Мвозд. =2*29г/моль =58 г/моль.
Относительная плотность газов D, в отличие от их плотностей ρ, является величиной, не зависящей от температуры и давления.
В химических реакциях соблюдается закон сохранения массы, но объём реакционной смеси может существенно изменяться, если химическая реакция протекает между газообразными веществами или газообразные вещества образуются в результате реакции. При этом объёмы газообразных реагентов и продуктов относятся между собой, как коэффициенты в уравнении соответствующей реакции. Поясним это на примере реакции окисления аммиака NH3 кислородом с образованием азота и воды:
 Уравнение
реакции
Уравнение
реакции
V(NH3) : V(O2) : V(N2) = (4 · 22,4 дм3) : (3 · 22,4 дм3) : (2 · 22,4 дм3) = 4 : 3 : 2.
Итак, отношение объёмов газообразных веществ равно отношению коэффициентов перед их формулами в уравнении реакции. Например, если объёмы вступающих в реакцию аммиака и кислорода равны соответственно 4 м3 и 3 м3, то в результате реакции образуется азот объёмом 2 м3.
Применим полученный вывод для решения расчётных задач.
Пример 3. Определите объём (н. у.) кислорода, который необходим для полного сгорания бутана объёмом 10 м3 (н. у.).
Дано:
V(C4H10) = 10 м3 V(O2) — ? Решение
Так как и бутан, и кислород — газообразные вещества (н. у.), то для нахождения объёма кислорода можно воспользоваться объёмными отношениями газов.
Это позволит решить задачу без пересчёта объёмов газов на количество вещества и не потребует перевода единиц измерения объёмов.
1. Составим уравнение реакции:
2C4H10(г) + 13O2(г) = 8CO2(г) + 10H2O(ж).
2. ![]() Определим
объёмные соотношения бутана и кислорода согласно уравнению реакции: на 2 моль
бутана необходимо 13 моль кислорода, то есть их объёмные соотношения 2 : 13: 3
Определим
объёмные соотношения бутана и кислорода согласно уравнению реакции: на 2 моль
бутана необходимо 13 моль кислорода, то есть их объёмные соотношения 2 : 13: 3
откуда находим:
![]()
Удобным является и привычный способ оформления решения:
2С4Н10(г) + 13О2(г)= 8 СО2(г)
+ 10Н2О(ж) ;
откуда:![]()
Ответ: V(O2) = 65 м3.
Пример 4. На полное сгорание 2 дм3 некоторого углеводорода потребовалось 9 дм3 кислорода. При этом образовалось 6 дм3 углекислого газа. Определите молекулярную формулу углеводорода. Измерения объёмов проводили при одинаковых условиях.
Дано:
V(CхHу) = 2 дм3
V(O2) = 9 дм3 V(СO2) = 6 дм3 CхHу — ? Решение
Условно представим формулу искомого углеводорода как CxHy.
Составим уравнение реакции горения углеводорода, расставив коэффициенты в соответствии с экспериментальными данными об объёмах газов:
2CxHy + 9O2 = 6CO2 + yH2O.
Коэффициенты в нём относятся как объёмы соответствующих газообразных реагентов. С учётом равенства числа атомов кислорода, вступивших в реакцию, числу атомов, входящих в продукты реакции, имеем:
9 ∙ 2 = 6 ∙ 2 + y ∙ 1, откуда y = 6. Запишем уравнение реакции со всеми коэффициентами:
2CxHy + 9O2 = 6CO2 + 6H2O. Анализ этого уравнения указывает на то, что х = 3, молекулярная формула углеводорода — C3H6. Ответ: C3H6.
ЗАДАЧА 1. Какое число молекул содержится в 2,5 моль кислорода?
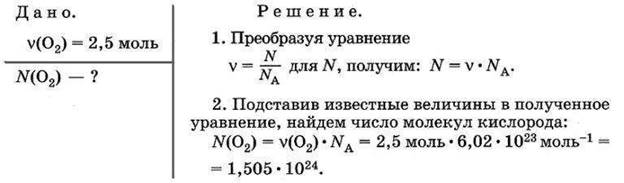
ЗАДАЧА 2. Какой объем при нормальных условиях занимают
27 .1021 молекул газа? Решение:
Согласно закону Авогадро в равных объёмах любых газов, взятых при одинаковых условиях, содержится одинаковое число молекул, Один моль любого газа занимает 22,4л, В которых содержится 6,02 . 1023 молекул. Отсюда находим какой объём при нормальных условиях занимают
27 .1021 молекул газа, составив пропорцию:
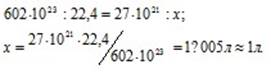
Ответ: V=1л.
ТЕМА 3. Определение атома. Атомное ядро. Электроны в атоме.
Все вещества состоят из молекул. У каждого вещества своя собственная и присущая только ему молекула. Следовательно, в мире огромное многообразие различных молекул. Установлено, что все молекулы состоят из мельчайших частиц, которые называются атомами (греч. аtomos – неделимый). Атомы способны объединяться и образовывать молекулы. Так, молекула кислорода состоит из двух атомов кислорода – О2.
Атомы имеют очень сложное строение и состоят из трех типов частиц.
С греческого языка «атом» переводиться как «неделелимый». Атом не разрушается при химических явлениях, элементы не превращаются друг в друга.
Поэтому мы можем дать такое определение: Атом - химические неделимая частица вещества.
1910 г Резерфорд предложил «планетарную модель» атома, согласно которой атом состоит из атомного ядра и электронов. Ядро, несущее почти всю массу атома, состоит из положительно заряженных протонов и незаряженных нейтронов, связанных между собой при помощи сильного взаимодействия.
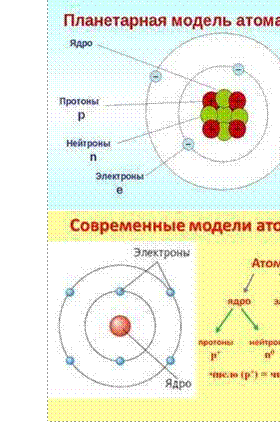
Атомы имеют сложное строение. В центре любого атома
находится ядро, вокруг которого хаотично двигаются электроны. Расстояние, на которое электроны удалены от ядра, очень велико и значительно превышает размеры ядра. Все электроны атома составляют его электронную оболочку. Ядро атомов состоит из протонов и нейтронов, которые имеют общее название нуклоны (от англ. nucleus – ядро).
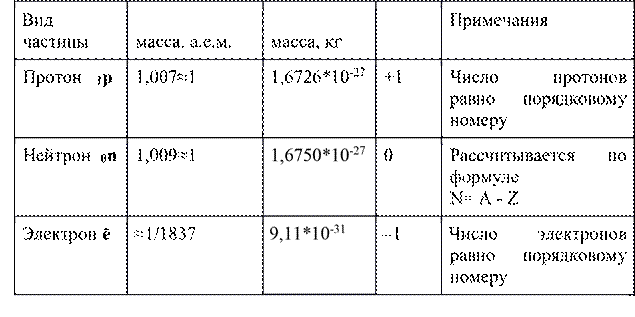
Протон - это частица, которая имеет положительный заряд. Заряд протона в условных единицах равен +1. Символ протона 1p.
Нейтрон – нейтральная частица, заряд нейтрона равен 0. Символ нейтрона – 0n.
Ядра атомов имеют положительный заряд, т.к. состоят из протонов с положительным зарядом и нейтральных нейтронов.
Вокруг ядра движутся электроны, которые имеют отрицательный заряд. Заряд электрона в условных единицах равен -1. Символ электрона – ē.
Протоны, нейтроны и электроны называются элементарными частицами.
Любой атом содержит равное число протонов и электронов, поэтому сумма положительных зарядов в атоме равна сумме отрицательных зарядов.
Следовательно, атомы являются электронейтральными частицами.
Ядра различных атомов содержат разное число протонов и нейтронов.
Главной характеристикой любого атома является заряд ядра, который обозначается буквой Z и равен число протонов.(Z=1p)
Вид атомов с одинаковым зарядом ядер называется химическим элементом.
Каждый элемент имеет свое название и свой символ (знак). В настоящее время известно более 100химических элементов.
В 1913 г. английский физик Г. Мозли установил, что положительный заряд ядра атома (в условных единицах) равен порядковому номеру элемента в периодической системе Д.И.Менделеева.
Каждый протон имеет заряд +1, поэтому заряд ядра равен числу протонов. Атом является электронейтральной частицей, поэтому число протонов равно числу электронов.
Порядковый Заряд Число Число номер = ядра = протонов = электронов
элемента атома в ядре в атоме
Пример: элемент железо Fe имеет порядковый номер 26. Следовательно, заряд ядра атома железа равен +26, т.е. ядро содержит 26 протонов, а вокруг ядра движутся 26 электронов.
Свойства протонов, нейтронов и электронов.
 Относительная Абсолютная
Заряд
Относительная Абсолютная
Заряд
Данные таблицы показывают, что масса протона, как и масса нейтрона, приблизительно в 1840 раз больше массы электрона. Протоны и нейтроны находятся в ядре, поэтому масса атома почти равна массе ядра. Масса ядра, как и масса атома, определяется суммой числа протонов и числа нейтронов. Эта сумма называется массовым числом атома (атомная масса). Атомная масса указана под символом элемента в ПСХЭ.
Массовое Число Число нейтронов число = протонов + (N) атома (A) (Z)
Пример: Определим число протонов, нейтронов, электронов, заряд ядра, массовое число в элементах Na, P, Au
 Ион - это атом, состоящий из
положительно заряженного ядра, в котором находятся протоны и нейтроны, и
отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд
может быть положительным и отрицательным из-за электронов, которые атом может
отдавать и принимать. Поэтому число протонов в атоме не меняется, а число
электронов в ионе может меняться.
Ион - это атом, состоящий из
положительно заряженного ядра, в котором находятся протоны и нейтроны, и
отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд
может быть положительным и отрицательным из-за электронов, которые атом может
отдавать и принимать. Поэтому число протонов в атоме не меняется, а число
электронов в ионе может меняться.
• Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
• Например, у N3- заряд -3, а у Ca2+ заряд +2.
• Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
ТЕМА 4.Валентные возможности атомов химических элементов.
Атомы химических элементов в основном состоянии на внешнем энергетическом уровне могут иметь электроны спаренные и неспаренные. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей.
Такие электроны называются валентными. В первую очередь валентность атома определяется числом неспаренных электронов, принимающих участие в образовании химической связи. Далее объяснение учителя сопровождается составлением таблицы.
У s- и p-элементов валентные электроны расположены на s- и рподуровнях внешнего энергетического уровня.
У d-элементов — на s-подуровне последнего энергетического уровня и d-подуровне предвнешнего энергетического уровня.
У f-элементов — на s-подуровне последнего энергетического уровня и d-подуровне предпоследнего энергетического уровня и f-подуровень, третьего с края энергетического уровня.
Вместе с учителем составляется таблица.
Расположение валентных электронов элементов разных семейств
|
Семейства элементов |
Подуровни, на которых располагаются валентные электроны |
Энергетические уровни |
|
|
|
s-элементы |
s-подуровень |
внешний уровень |
энергетический |
|
|
р-элементы |
s- и р-подуровни |
внешний уровень |
энергетический |
|
|
d-элементы |
s-подуровень d-подуровень |
внешнего энергетического уровня предвнешний энергетический уровень |
||
|
f-элементы |
s-подуровень d-подуровень f-подуровень |
внешний энергетический уровень предвнешний энергетический уровень третий с края энергетический уровень |
||
|
Все валентные электроны определяют основные свойства элементов. |
||||
Уровни, подуровни, на которых располагаются валентные электроны, называются валентными.
Учащиеся вместе с учителем составляют электронные и электроннографические формулы s-, р-, d-, f-элементов в основном состоянии.
Литий (Li): +3; 3е-, 1s22s1; s-элемент, атом имеет один неспаренный sэлектрон, валентность лития — 1.
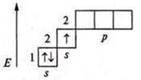
Фосфор (Р): +15; 15е-.
1s22s22p63s23p3; p-элемент.
Фосфор имеет пять валентных электронов — два спаренных sэлектрона и 3 неспаренных р-электрона.
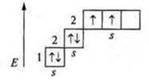
Марганец (Мn): +25; 25е-.
1s22s22p63s23p64s23d5; d-элемент.
Марганец имеет семь валентных электронов, два спаренных s- электрона и пять неспаренных d-электронов.
Однако следует помнить, что в первую очередь в реакцию вступают неспаренные электроны последнего энергетического уровня. В зависимости от заполнения последнего энергетического уровня химические элементы делятся на активные, если есть неспаренные электроны, и малоактивные, если есть парные — спаренные электроны. На основании строения атома в основном состоянии можно определить металличность и неметалличность элемента. Если на последнем энергетическом уровне электронов меньше, чем три — это металлический элемент; в нашем случае Li, Мn — металлические элементы; если электронов на последнем энергетическом уровне больше, чем четыре, это неметаллический элемент, в нашем случае это Р. Следовательно, все s-, d-, f-элементы — это металлические элементы; а p-элементы могут быть и металлические и неметаллические.
В ПСХЭ по диагонали от В к At все p-элементы выше диагонали — неметаллические, ниже — металлические. По строению атома элементы, у которых на внешнем энергетическом уровне три или четыре электрона, считаются переходными элементами; многие d-элементы — металлические с переходными свойствами.
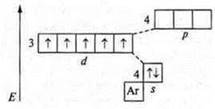
Таким образом, валентность элемента в первую очередь определяется количеством неспаренных электронов внешнего энергетического уровня. Однако: каким же образом атом углерода в основном состоянии С; +6; 6е-, 1s22s22p2, р-элемент, 2 неспаренных электрона (следовательно, его валентность — два) может проявить валентность четыре?
Известно, что если в атоме элемента имеются свободные орбитали, то в случае имеющейся энергии извне возможно распаривание парных
электронов и переход электрона на свободную орбиталь. Атом в таком
случае находится в возбужденном состоянии. В случае с атомом углерода на р-подуровне имеется свободная орбиталь. В возбужденном состоянии происходит переход одного s-электрона с 2s-подуровня на свободную
орбиталь 2р-подуровня. Затрата Е равна 400 кДж/моль. Она компенсируется при образовании двух моль С—Н связей, выделяется 720 кДж/моль. что превышает энергию перевода атома углерода в возбужденное состояние на 320 кДж/моль.
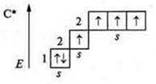
Вследствие чего в атоме углерода образуется четыре неспаренных углерода, валентность углерода равна четырем.
Вопрос: Чем же определяются валентные возможности атомов?
Ответ: Валентные возможности атомов определяются числом неспаренных электронов в основном и в возбужденном состоянии.
Однако валентные возможности атомов могут определяться и числом пустых орбиталей, и числом неподеленных электронных пар.
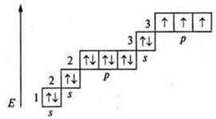
Атом элемента, предоставляющий неподеленную электронную пару, называется атом-донор, атом-акцептор имеет свободные орбитали и предоставляет их неподеленным парам электронов. Пример: Азот (N): +7, 7е-. 1s22s22p3; р-элемент.
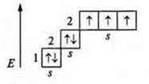
На внешнем энергетическом уровне в основном состоянии: пара спаренных s-элементов и три неспаренных p-электрона, валентность по количеству неспаренных электронов — три, а также атом азота — атомдонор, предоставляет неподеленную пару s-электронов. В основном состоянии атом азота проявляет валентность четыре.
Сделаем общий вывод о валентных возможностях атомов химических элементов.
Валентные возможности атомов определяются:
1) количеством неспаренных электронов в основном и в возбужденном состоянии;
2) наличием неподеленных пар электронов, и быть атомами-донорами; 3) числом пустых орбиталей, и быть атомами-акцепторами.
В качестве закрепления учащиеся выполняют задание: определить валентные возможности атомов а) фосфора; б) хлора в основном и в возбужденном состоянии.
Фосфор (Р): +15; 15е-.
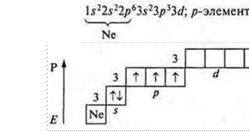
основном состоянии атом фосфора может проявить валентность:
— три — т. к. в атоме три неспаренных p-электрона;
— четыре — т. к. атом фосфора, атом-донор, может предоставить пару электронов для образования химической связи.
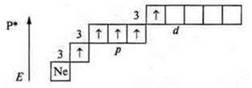
Если атом фосфора находится в возбужденном состоянии, то возможен переход s-электрона с подуровня 3s на подуровень 3d — на свободную орбиталь, вследствие чего в атоме появляются пять неспаренных электронов, что обеспечивает валентность атома фосфора — пять.
Хлор (Сl), +17, 17е-;
![]()
В основном состоянии валентность — один (один неспаренный pэлектрон), хлор — атом-донор и может предоставить пары спаренных электронов и проявлять в основном состоянии валентность, равную один, два, три, четыре.
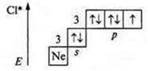
Первое возбужденное состояние — переход р-электрона (одного на 3dподуровень): три неспаренных электрона — валентность — три; атом-донор — валентность — четыре, пять.
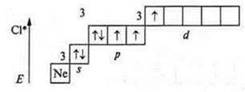
Второе возбужденное состояние — переход p-электрона (следующего с p-подуровня, на 3d-подуровень): пять неспаренных электронов — валентность — пять; атом-донор — валентность — шесть.

Третье возбужденное состояние — семь неспаренных электронов; валентность — семь.
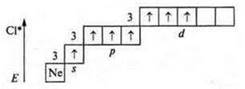
Максимальная валентность атомов химических элементов II периода всегда четыре, так как на II энергетическом уровне возможно открытие только четырех орбиталей: одной s- и трех р-; у элементов III периода возможно открытие 9 орбиталей — одной s-; трех р- и пяти d-. Они могут проявлять валентность до максимальной (9), однако известна только 8. (В дальнейшем мы узнаем конкретно, какие элементы и в каких соединениях имеют такую валентность.)
Как правило, валентность записывается римской цифрой у элемента в соединении.
Пример: ![]()
Однако у элементов в соединении определяется не только валентность, но и степень окисления. Одно ли это понятие?
Валентность атома — это количество общих электронных пар, которые данный атом образует с другими атомами в данном соединении, учитывая его валентные возможные, которые он проявил в данном соединении.
Степень окисления (С.О.) — условный заряд, который приобретает атом в соединении в случае смещения электронов от атома — положительный заряд и, наоборот, смещение электронов к атому — отрицательный заряд, если считать все связи в веществе ионными.
Если в соединении атом не проявляет валентность как донор, то степень окисления (С.О.) численно совпадает с валентностью.
Пример:

В образовании связи азот выступил как атом-донор. С.О. может быть минимальной (min), максимальной (шах) и промежуточной.
C.O.min определяется числом валентных мест в незавершенном энергетическом уровне для неметаллических элементов. У атома углерода C.O.mjn = -4, т. к. до устойчивости внешнего энергетического уровня атома углерода — до 8 электронов — число валентных мест четыре, у атома азота C.O.min = -3; кислорода C.O.min = -2.
Максимальная С.О. определяется числом электронов внешнего энергетического уровня s- и р-электронов (суммой), а также суммой s- и dэлектронов для d-элементов.
Пример: атом марганца — это d-элемент, металлический. У металлических элементов С.О. соответствует количеству электронов внешнего энергетического уровня.
Для металлических элементов s- либо +1, +2: s- и р- +3, +4 для dэлементов, Мn 4s23d5 минимальная, у марганца +2; максимальная сумма s- и d-электронов +7.
Промежуточные С.О. возможны от 0, +1, +2 +3 +4, +5, +6, +7. Однако устойчивыми считаются 0, +2, +4, +6, +7.
Далее необходимо объяснить учащимся определение С.О. элементов в соединениях.
а) бинарные соединения: ![]() — определить элемент более
электроотрицательный, к которому
— определить элемент более
электроотрицательный, к которому
смещаются электроны, и его минимальную С.О., в данном случае это сера; min = -2.
Молекула всегда электронейтральна, следовательно произведение С.О. электроотрицательного элемента на количество атомов по абсолютной величине равно произведению его электроположительного элемента на количество атомов.
2х = 6; х = 3. С.О. алюминия+3;
б) соединения более сложного
состава: ![]() — поставить С.О. известных элементов, в
данном случае это
— поставить С.О. известных элементов, в
данном случае это
кислород -2 и калий +1; неизвестный элемент — х. Далее так же, как и в бинарных соединениях. (+1) · 1 + x + (-2) · 4 = 0;
+ 1 + x — 8 = 0; 1 + х = 8; х = +7.
По абсолютной величине верно х = +7.
1 + х = 8; х = 7; х = +7; либо по схеме:
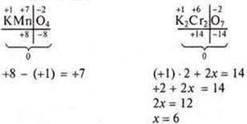
Если соединение с неполярной ковалентной связью — простое вещество, то С.О. равно 0.
![]()
В органических соединениях С.О. углерода определяется у каждого в отдельности, учитывая С.О. элементов, связанных с ним.
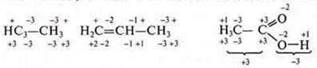
Углерод во всех соединениях четырехвалентен, однако С.О. имеет различные. Этот факт еще раз подтверждает то, что С.О. и валентность не одно и то же понятие.
ТЕМА 5. Периодический закон, система элементов Д.И.Менделеева и строения атома.
Периодический закон и Периодическая система химических элементов Д. И. Менделеева — величайшее открытие конца XIX в. в области химии, основа современной химии, динамичное и развивающееся учение. Оно отражает явления, реально существующие в природе, и поэтому никогда не потеряет своего значения.
Открытие Периодического закона и Периодической системы было подготовлено всем ходом истории развития химии, однако потребовалась гениальность Д. И. Менделеева, его дар научного предвидения, чтобы эти закономерности были сформулированы и графически представлены в виде таблицы.
Открытие Д. И. Менделеевым Периодического закона
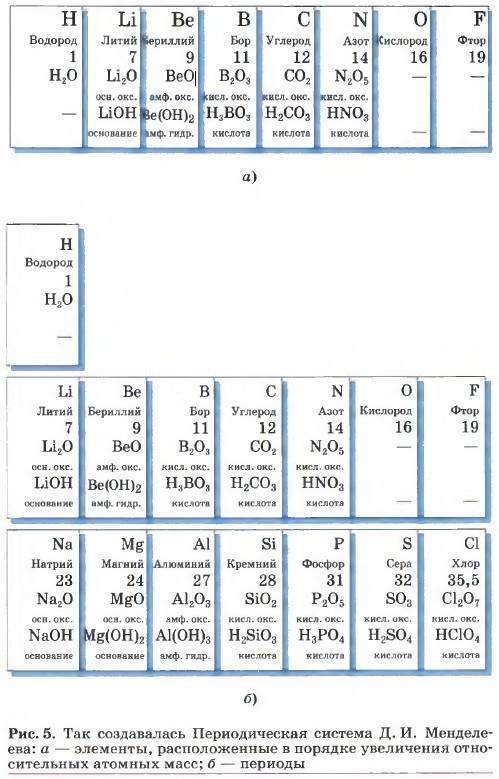
Д. И. Менделеев расположил все известные ко времени открытия Периодического закона химические элементы в ряд (рис. 5, а) по возрастанию их атомных масс (во времена Д. И. Менделеева эту величину называли атомным весом) и отметил в нём отрезки — периоды (рис. 5, б), в которых свойства элементов и образованных ими веществ изменялись сходным образом, а именно (в современных терминах):
1) металлические свойства ослабевали;
2) неметаллические свойства усиливались;
3) валентность элемента в высших оксидах увеличивалась с I до VII;
В своих трудах Д. И. Менделеев много внимания уделял развитию отечественной промышленности и химизации сельского хозяйства.
Д. И. Менделеев доказал необходимость создания химических производств соды, серной кислоты, минеральных удобрений. Обосновал идеи подземной газификации угля и применения кислорода в металлургической промышленности. Предложил способ непрерывной переработки нефти, а также оригинальную теорию её происхождения.
4) валентность элементов в гидридах (твёрдых солеподобных соединениях металлов с водородом) увеличивалась с I до III, а затем уменьшалась в летучих водородных соединениях с IV до I;
5) оксиды от основных через амфотерные сменялись кислотными;
6) гидроксиды от щелочей через амфотерные гидроксиды сменялись всё более сильными кислотами.
На основании этих наблюдений Д. И. Менделеев в 1869 г. сделал вывод
— сформулировал Периодический закон:

Ещё раз подчеркнём, что в настоящее время синонимом понятия
«атомный вес» является понятие «относительная атомная масса».
Периодический закон в свете учения о строении атома
![]() Формулировка
Периодического закона, данная Д. И. Менделеевым, отражала состояние науки на
тот период времени, когда о сложном строении атома учёные только догадывались.
Можно поражаться гениальности выдающегося русского химика, который на основании
величайшей научной интуиции предвидел причины открытых им закономерностей,
блестяще угадал порядок расположения элементов. Д. И. Менделеев создал таблицу
так, что она, будучи довольно простой, тем не менее максимально характеризует
строение атомов химических элементов и не претерпела никаких принципиальных
изменений уже на протяжении почти полутора столетий. Последующие открытия в
области физики и химии только дополняли и углубляли открытие Д. И. Менделеева.
Формулировка
Периодического закона, данная Д. И. Менделеевым, отражала состояние науки на
тот период времени, когда о сложном строении атома учёные только догадывались.
Можно поражаться гениальности выдающегося русского химика, который на основании
величайшей научной интуиции предвидел причины открытых им закономерностей,
блестяще угадал порядок расположения элементов. Д. И. Менделеев создал таблицу
так, что она, будучи довольно простой, тем не менее максимально характеризует
строение атомов химических элементов и не претерпела никаких принципиальных
изменений уже на протяжении почти полутора столетий. Последующие открытия в
области физики и химии только дополняли и углубляли открытие Д. И. Менделеева.
Как вы уже знаете, было доказано сложное строение атома, предложены модели, отражающие его строение, было открыто явление существования изотопов и доказано, что заряд ядра атома каждого химического элемента в таблице Менделеева возрастает на единицу по сравнению с зарядом ядра атома предыдущего химического элемента. Следовательно, заряд атомного ядра совпадает с порядковым номером элемента в таблице Менделеева. Таким образом, был вскрыт истинный принцип, по которому гениальный учёный интуитивно расположил элементы в предложенной им системе.
Эти открытия потребовали уточнить первую, менделеевскую, формулировку Периодического закона. В современной редакции этот закон звучит так:

Периодическая система Д. И. Менделеева в свете учения о строении атома
![]() Периодическая
система Д. И. Менделеева — это графическое выражение Периодического закона.
Периодическая
система Д. И. Менделеева — это графическое выражение Периодического закона.
Существует множество различных модификаций Периодической системы химических элементов Д. И. Менделеева, однако наиболее употребительны: в средней школе короткопериодный вариант (им мы и пользуемся в нашем учебнике), а в высшей — также и длиннопериодный (см. рис. 4).
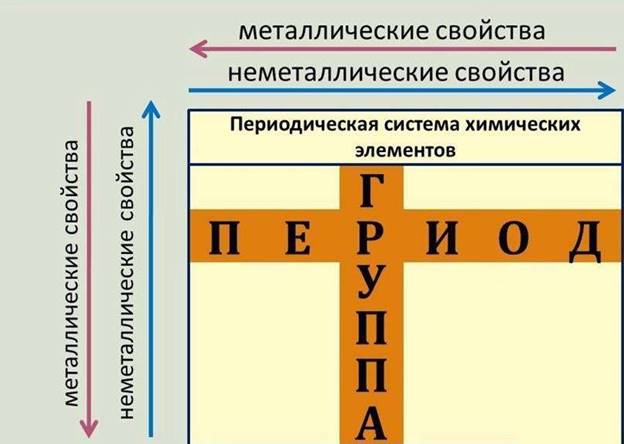
Порядковый номер элемента, номер периода и номер группы в Периодической системе Д. И. Менделеева отражают особенности или закономерности в строении атомов элементов.
Так, порядковый номер элемента, как вы знаете, соответствует заряду атомного ядра, т. е. числу протонов в нём, и числу электронов в электронной оболочке атома, так как он электронейтрален.
Число нейтронов для изотопов химического элемента находят по формуле: N = А - Z, где N — число нейтронов, А — массовое число, Z — порядковый номер элемента.
Номер периода соответствует числу энергетических уровней (электронных слоёв) в атоме.
Номер группы соответствует числу электронов на внешнем энергетическом уровне атомов для элементов главных подгрупп (А групп) или максимальному числу валентных электронов для элементов обеих подгрупп.

Для элементов главных подгрупп такими электронами являются электроны внешнего энергетического уровня, и их число равно номеру группы. Для элементов побочных подгрупп (В групп) валентными являются не только электроны внешнего, но также и предвнешнего энергетического уровня, однако и в этом случае максимальное их число определяется номером группы.
Особенности строения атома объясняют и закономерности изменения свойств элементов в периодах и группах.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются, так как:
а) увеличиваются заряды атомных ядер элементов;
б) увеличивается число электронов на внешнем энергетическом уровне
атомов;
в) число энергетических уровней в атомах элементов не изменяется;
г) радиус атомов уменьшается.
В пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают, так как:
а) увеличиваются заряды атомных ядер элементов;
б) число электронов на внешнем энергетическом уровне не изменяется;
в) увеличивается число энергетических уровней в атомах;
г) увеличивается радиус атомов.
В больших периодах (4—6) эти изменения происходят медленнее, так как у атомов элементов побочных подгрупп строится (до 18 электронов) не внешний, а предвнешний уровень, и только потом начинает достраиваться внешний уровень (с 2 до 8 электронов в соответствии с номером группы).
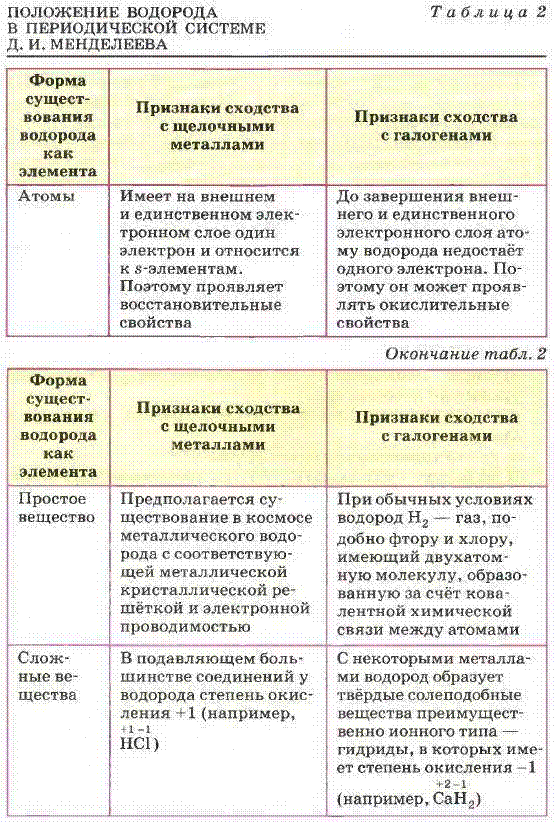
Положение водорода в Периодической системе Д. И. Менделеева
![]() Каждому элементу в
Периодической системе Д. И. Менделеева отведено место, строго определённое
зарядом атомного ядра. Единственный элемент, которому в таблице Менделеева
отведено два места, причём в резко противоположных группах (щелочных металлов и
галогенов), — это водород. Причины такого особенного положения водорода
отражены в таблице 2.
Каждому элементу в
Периодической системе Д. И. Менделеева отведено место, строго определённое
зарядом атомного ядра. Единственный элемент, которому в таблице Менделеева
отведено два места, причём в резко противоположных группах (щелочных металлов и
галогенов), — это водород. Причины такого особенного положения водорода
отражены в таблице 2.
Значение Периодического закона и Периодической системы Д. И. Менделеева
![]()
Периодический закон и Периодическая система Д. И. Менделеева являют собой триумф российской химической науки. Подумайте сами, ведь все учёные, которые занимались поиском естественной классификации химических элементов, находились в равных условиях, имели одни и те же научные предпосылки для обобщения. Почему же ни одному из них, кроме Д. И. Менделеева, не удалось открыть Периодический закон?
Очевидно, объективных предпосылок (накопленного фактологического материала, работ предшественников, участия в съезде химиков в г. Карлсруэ, на котором победили идеи атомистики) было мало. Потребовался субъективный, личностный фактор, который у каждого из учёных разный. Д. И. Менделеев имел энциклопедические знания, умел обобщать факты и выдвигать на их основе гипотезы. Очевидно, справедливы слова русского химика Л. А. Чугаева, сказанные им о Д. И. Менделееве: «Гениальный химик, первоклассный физик, плодотворный исследователь в области гидродинамики, метеорологии, геологии, в различных отделах химической технологии (взрывчатые вещества, нефть, учение о топливе) и других сопредельных с химией и физикой дисциплинах, глубокий знаток химической промышленности и промышленности вообще, особенно русской, оригинальный мыслитель в области учения о народном хозяйстве, государственный ум, которому, к сожалению, не суждено было стать государственным человеком, но который видел и понимал задачи и будущность России лучше представителей нашей официальной власти...
Он умел быть философом в химии, в физике и других отраслях естествознания, которых ему приходилось касаться, и естествоиспытателем в проблемах философии, политической экономии и социологии».
Поэтому остаётся только недоумевать, почему Нобелевский комитет, который в 1906 г. в Стокгольме из двух кандидатур — француза А. Муассана и русского Д. И. Менделеева — отдал предпочтение французскому химику. Очевидно, немалую роль в этом решении Нобелевского комитета сыграл тот факт, что кандидатуру А. Муассана выдвинула Французская академия наук, а Д. И. Менделеева — Академия наук Германии. Стыдно признать, что Д. И. Менделеев, будучи почётным членом почти всех европейских академий наук, так и не был избран членом Российской академии, хотя баллотировался в неё не раз.
Очевидно, закономерно и следующее нелогичное поведение Лондонского королевского общества, которое в 1882 г. присудило Д. И. Менделееву медаль Дэви (предшественник и аналог медали нобелевского лауреата) «За открытие периодических соотношений атомных весов», а пятью годами позже, в 1887 г., это же общество вручило такую же медаль своему соотечественнику Дж. Ньюлендсу «За открытие периодического закона химических элементов».
Как признание заслуг русского химика перед мировой наукой следует отметить следующий факт.
В 1955 г. группа американских химиков во главе с Г. Сиборгом получила новый, 101-й элемент, которому в честь величайшего русского химика Д. И. Менделеева единодушно присвоила название «менделевий».
Периодический закон и Периодическая система Д. И. Менделеева позволили:
1) установить взаимосвязь между элементами и объединить их по свойствам;
2) расположить элементы в естественной последовательности;
3) обнаружить периодичность, т. е. повторяемость, свойств элементов и их соединений и объяснить причину этого;
4) исправить и уточнить значения относительных атомных масс некоторых элементов;
5) исправить и уточнить степени окисления (валентность) некоторых элементов;
6) предсказать существование ещё не открытых элементов, описать их свойства, указать пути их открытия.
Триумфом Периодического закона и Периодической системы явилось открытие трёх предсказанных Д. И. Менделеевым элементов — галлия, скандия и германия. Это позволило одному из известных философов назвать открытие Д. И. Менделеевым Периодического закона научным подвигом, подобным подвигу астронома Леверье, предсказавшего орбиту ещё неизвестной планеты Нептун. Почему так эмоционально характеризуется предсказание русского химика? Это связано с открытием первого из предсказанных Д. И. Менделеевым элемента галлия, который был открыт французом П. Э. Лекоком де Буабодраном. Д. И. Менделеев, владевший французским языком, прочитал статью об открытии галлия, а затем написал письмо первооткрывателю этого элемента и указал не только на ошибку П. Э. Лекока де Буабодрана (тот определил неверно плотность галлия), но и назвал причину этой ошибки (образец галлия был недостаточно очищен).
Видный философ химии Б. М. Кедров писал: «Можно представить первоначальное изумление, а возможно, даже негодование любого строгого химика-аналитика, если бы он получил подобный совет. Как?! Он в Париже держит в руках новое, открытое им вещество, никому дотоле не известное, видит и осязает его, измеряет и определяет его свойства на аналитических весах, словом, является единственным в мире исследователем, имеющим дело с этим веществом как с реальным телом. И вдруг кто-то, находящийся в России, на расстоянии тысячи километров от его лаборатории, не видевший в глаза ни крупинки нового вещества, сомневается в том, хорошо ли оно очищено, и, не смущаясь, высказывает свои советы, как это сделать».
Д. И. Менделеев оказался прав. П. Э. Лекок де Буа- бодран внял его совету и сообщил научному миру: «Я думаю, что нет нужды настаивать на исключительной важности теоретических взглядов г. Менделеева относительно плотности нового элемента».
Шведский учёный Ф. Нильсон, открывший в 1879 г. скандий, предсказанный Д. И. Менделеевым как эка- бор, прислал ему в подарок новый металл, а немецкий учёный К. А. Винклер, открывший предсказанный Д. И. Менделеевым германий (экасилициум), писал: «...периодичность элементов тем самым уже не гипотеза, она стала фактом, и химическое исследование сделало новый, неисчислимо важный шаг в царство познания».
В заключение приведём слова Д. И. Менделеева из его статьи «Заметки по поводу открытия галлия», в которой он даёт советы П. Э. Лекоку де Буабодрану: «Эта статья показывает как мою научную смелость, так и мою уверенность в Периодическом законе. Всё оправдалось. Это моё имя».
ТЕМА 6. Причины изменения металлических и неметаллических свойств элементов в группах и подгруппах. Значение периодического закона и Периодической системы химических элементов.
Радиусом мы считаем расстояние от ядра до внешнего энергетического уровня. Несомненно, чем больше у атома слоев (уровней), тем больше его радиус.
Соответственно, вниз по периодической таблице радиус атома увеличивается.
Теперь разберемся, что происходит в рамках одного периода. Вспомним, если элементы стоят в одном периоде, значит у них одинаковое количество электронных уровней, а отличаются они лишь количеством электронов. Ядро заряжено положительно, электроны — отрицательно, чем электронов больше, тем сильнее они притягиваются к ядру. Чем сильнее электроны притягиваются к ядру, тем меньше радиус.
Соответственно, слева направо радиус атома уменьшается! Очень важно понять, почему так происходит, тогда не придется запоминать закономерности.
Металлические и неметаллические свойства
Закономерности изменения химических свойств элементов и их соединений по периодам и группам. Общая характеристика металлов IА–IIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов. Характеристика переходных элементов – меди, цинка, хрома, железа – по их положению в Периодической системе химических элементов Д.И. Менделеева и особенностям строения их атомов. Общая характеристика неметаллов IVА–VIIА групп в связи с их положением в Периодической системе химических элементов Д.И. Менделеева и особенностями строения их атомов
Таблица Менделеева состоит и 7 периодов и 8 групп. Каждый период начинается с щелочного металла (первый — с водорода) и заканчивается инертным газом. Первые три периода называют малыми, так как в них нет элементов побочных групп. Начиная с четвертого периоды называют большими. В шестой и седьмой период включены две группы по 14 элементов — лантаноиды (от Сe до Lu) и актиноиды (от Th до Lr), это элементы у которых последним заполняется f-орбиталь. Поскольку по свойствам они очень близки к La и Ac, соответственно, их принято помещать в клетку к этим элементам и делать сноску под основной периодической таблицей.
Элементы IA группы — щелочные металлы (Li, Na, K, Rb, Cs, Fr) и водород.
Элементы IIA группы — щелочно-земельные металлы (Ca, Sr, Ba, Ra), а также металл Mg и амфотерный Be.
Элементы IIIA группы — неметалл B, амфотерный Al, и металлы Ga, In, Tl и радиоактивный Nh.
Элементы IVА группы — неметаллы С,Si, а также металлы Ge, Sn,
Pb.
Элементы VA группы —пниктогены: неметаллы N, P, полуметалл As, металлы Sb, Bi.
Элементы VIA группы — халькогены: неметаллы O, S, Se, полуметалл Te и радиоактивный металл Po.
Элементы VIIА группы — галогены: неметаллы F, Cl, Br, I, и радиоактивный металл At.
Элементы VIIА группы — инертные благородные газы He, Ne, Ar, Kr, Xe.
Элементы IIIB группы — переходные металлы Sc, Y, La
(+лантаноиды), Ac (+актиноиды).
Элементы IVВ группы — переходные металлы Ti, Zr, Hf.
Элементы VВ группы — переходные металлы V, Nb, Ta.
Элементы VIВ группы — переходные металлы Cr, Mo, W.
Элементы VIIB группы — переходные металлы Mn, Tc, Re.
Элементы VIIIВ группы — три триады металлов — триада железа (Fe,Co,Ni), и две триады платиновых металлов (Ru,Rh, Pd, Os, Ir,Pt).
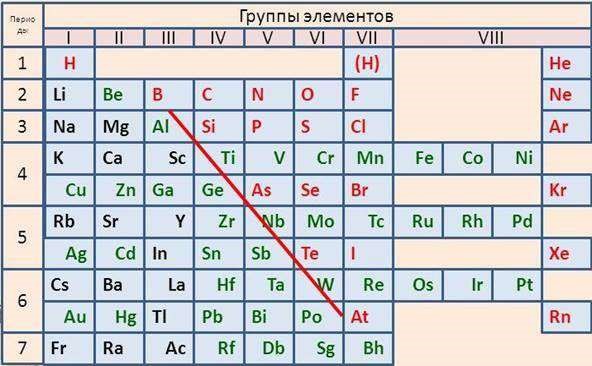
Если провести черту от B до At, то слева в останутся металлы, справа в главных подгруппах — неметаллы. В побочных подгруппах содержатся только металлы!
Можно заметить, что металлов в периодической таблице значительно больше, они содержатся во почти во всех главных подгруппах и полностью составляют побочные подгруппы.
Проявление металлических свойств определяется способностью атомов данного элемента отдавать электроны с внешнего электронного слоя. А неметаллические свойства — способность принимать электроны.
Чем меньше электронов на внешнем уровне тем легче атом их отдает, если же электронов больше 4, то атому легче принимать электроны.
У металлов главных групп на внешнем уровне от 1 до 3 электронов, у побочных групп ВНЕШНИЙ уровень содержит 2 электрона на s-подуровне. У неметаллов обычно на внешнем уровне содержится от 4 до 8 электронов.
Металлические свойства усиливаются вниз по главным подгруппам и уменьшаются слева направо по периоду. Неметаллические свойства противоположны металлическим:)
В побочных подгруппах – наоборот – верху вниз металлические свойства ослабевают, а слева направо увеличиваются!
Однако, металлы побочных групп значительно слабее металлов главных групп.
Электроотрицательность характеризует способность атомов химического элемента притягивать электроны от других атомов. При определении значений относительной электроотрицательности (ЭО) химических элементов по шкале Полинга за единицу принята электроотрицательность лития. Наиболее электроотрицательным химическим элементом является фтор (ЭО=4) Электроотрицательность элементов изменяется периодически: она возрастает в периоде слева направо и убывает в подгруппе сверху вниз. В периодах и главных подгруппах её изменение совпадает с изменением неметаллических свойств.
Металлические свойства характеризуются способностью атомов химического элемента отдавать электроны. Металлические свойства тем выше, чем меньше значение электроотрицательности химического элемента. Металлические свойства связаны также с восстановительной способностью атомов: чем сильнее выражены металлические свойства, тем выше восстановительная активность.
Атомы типичных металлов легко отдают валентные электроны и превращаются при этом в простые катионы, например:
Na…3s1 -e→ Na+ …..3s0
Ca…4s2 -2e→ Ca2+…..4s0
Al…3s23p1-3e→ Al3+…3s03p0
Zn…3s2 -2e→ Zn2+….3s0
Для характеристики металлических свойств используется также величина энергии ионизации . Энергия ионизации — это энергия, которая необходима для отрыва самого слабосвязанного электрона от атома. Энергия ионизации имеет минимальное значение для щелочных металлов, возрастает слева направо; уменьшается в группе сверху вниз.
Неметаллические свойства характеризуется способностью атомов химического элемента присоединять электроны. Неметаллические свойства тем выше, чем больше значение электроотрицательности химического элемента. Неметаллические свойства связаны также с окислительной способностью атомов: чем сильнее выражены неметаллические свойства, тем выше окислительная активность.
Атомы типичных неметаллов легко присоединяют электроны, завершая при этом внешний электронный уровень, и превращаются в простые анионы, например:
Cl…..3s23p5 + e→ Cl-…..3s23p6
S…..3s23p4 + 2e→S2-…..3s23p6
N…..3s23p3+ 3e→N3-…..3s23p6
ТЕМА 7. Типы химических связей. Ковалентная связь, виды, механизм образования. Электроотрицательность.
Типы кристаллических решеток.
Все системы стремятся к равновесию и к уменьшению свободной энергии — так гласит один из постулатов химической термодинамики. Атомы, взаимодействующие в молекуле вещества, тоже подчиняются этому закону. Они стремятся образовать устойчивую конфигурацию — 8электронную или 2-электронную внешнюю оболочку. Этот процесс взаимодействия называется химической связью, благодаря ему получаются молекулы и молекулярные соединения.
Химическая связь — это взаимодействие между атомами в молекуле вещества, в ходе которого два электрона (по одному от каждого атома) образуют общую электронную пару либо электрон переходит от одного атома к другому.
Как понятно из определения химической связи, при взаимодействии двух атомов один из них может притянуть к себе внешние электроны другого. Эта способность называется электроотрицательностью (ЭО). Атом с более высокой электроотрицательностью (ЭО) при образовании химической связи с другим атомом может вызвать смещение к себе общей электронной пары.
Механизм образования химической ковалентной связи Существует два механизма взаимодействия атомов:
обменный — предполагает выделение по одному внешнему электрону
от каждого атома и соединение их в общую пару; донорно-акцепторный — происходит, когда один атом (донор) выделяет два электрона, а второй атом (акцептор) принимает их на свою свободную орбиталь.
Независимо от механизма химическая связь между атомами сопровождается выделением энергии. Чем выше ЭО атомов, т. е. их способность притягивать электроны, тем сильнее и этот энергетический всплеск.
Энергией связи называют ту энергию, которая выделяется при взаимодействии атомов. Она определяет прочность химической связи и по величине равна усилию, необходимому для ее разрыва.
Также на прочность влияют следующие показатели:
Длина связи — расстояние между ядрами атомов. С уменьшением этого расстояния растет энергия связи и увеличивается ее прочность.
Кратность связи — количество электронных пар, появившихся при взаимодействии атомов. Чем больше это число, тем выше энергия и, соответственно, прочность связи.
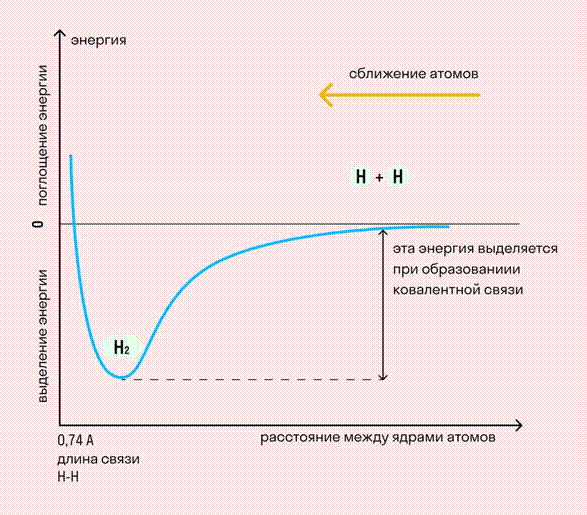
На примере химической связи в молекуле водорода посмотрим, как меняется энергия системы при сокращении расстояния между ядрами атомов. По мере сближения ядер электронные орбитали этих атомов начинают перекрывать друг друга, в итоге появляется общая молекулярная орбиталь. Неспаренные электроны через области перекрывания смещаются от одного атома в сторону другого, возникают общие электронные пары. Все это сопровождается нарастающим выделением энергии. Сближение происходит до тех пор, пока силу притяжения не компенсирует сила отталкивания одноименных зарядов.
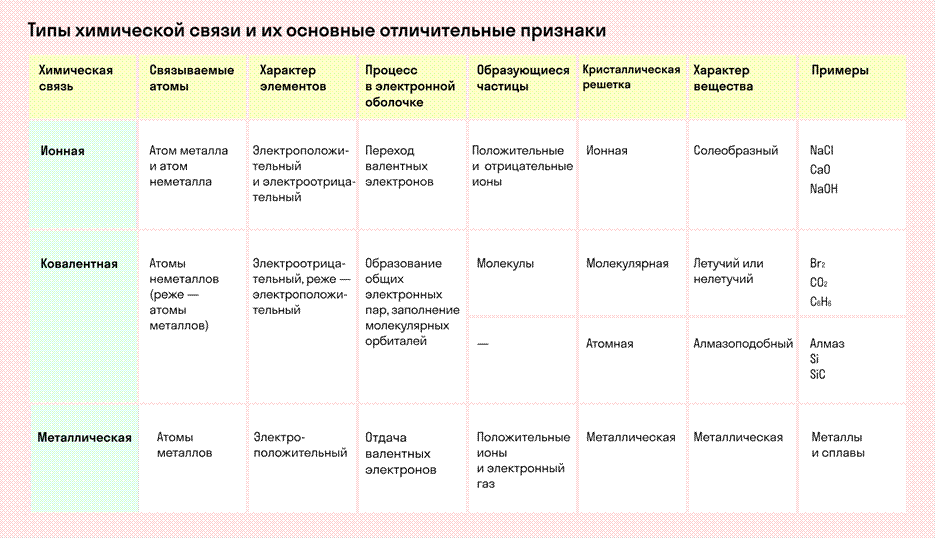
Различают четыре вида связей в химии: ковалентную, ионную, металлическую и водородную. Но в чистом виде они встречаются редко, обычно имеет место наложение нескольких типов химических связей. Например, в молекуле фосфата аммония (NH4)3PO4присутствует одновременно ионная связь между ионами и ковалентная связь внутри ионов.
Также отметим, что при образовании кристалла от типа связи между частицами зависит, какой будет кристаллическая решетка. Влияя на тип кристаллической решетки, химическая связь определяет и физические свойства вещества: твердость, летучесть, температуру плавления и т. д.
Основные характеристики химической связи:
насыщенность — ограничение по количеству образуемых связей из-за
конечного числа неспаренных электронов;
полярность — неравномерная электронная плотность между атомами и
смещение общей пары электронов к одному из них; направленность — ориентация связи в пространстве, расположение орбиталей атомов под определенным углом друг к другу.
Как уже говорилось выше, этот тип связи имеет два механизма образования: обменный и донорно-акцепторный. При обменном механизме объединяются в пару свободные электроны двух атомов, а при донорноакцепторном — пара электронов одного из атомов смещается к другому на его свободную орбиталь.
Ковалентная связь — это процесс взаимодействия между атомами с одинаковыми или близкими радиусами, при котором возникает общая электронная пара. Если эта пара принадлежит в равной мере обоим взаимодействующим атомам — это неполярная связь, а если она смещается к одному из них — это полярная связь.
Как вы помните, сила притяжения электронов определяется электроотрицательностью атома. Если у двух атомов она одинакова, между ними будет неполярная связь, а если один из атомов имеет большую ЭО — к нему сместится общая электронная пара и получится полярная химическая связь.
Ковалентная неполярная связь образуется в молекулах простых веществ, неметаллов с одинаковой ЭО: Cl2, O2, N2, F2 и других.
Посмотрим на схему образования этой химической связи. У атомов водорода есть по одному внешнему электрону, которые и образуют общую пару.
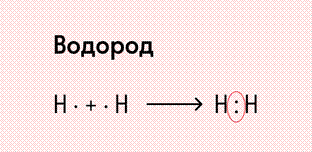
Ковалентная полярная связь характерна для неметаллов с разным уровнем ЭО: HCl, NH3,HBr, H2O, H2S и других.
Посмотрим схему такой связи в молекуле хлороводорода. У водорода имеется один свободный электрон, а у хлора — семь. Таким образом, всего есть два неспаренных электрона, которые соединяются в общую пару. Поскольку в данном случае ЭО выше у хлора, эта пара смещается к нему.
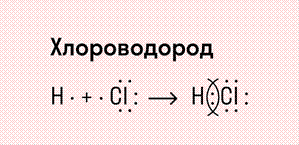
Другой пример — молекула сероводорода H2S. В данном случае мы видим, что каждый атом водорода имеет по одной химической связи, в то время как атом серы — две. Количество связей определяет валентность атома в конкретном соединении, поэтому валентность серы в сероводороде — II.
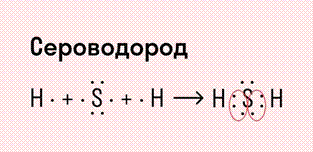
Число связей, которые могут быть у атома в молекуле вещества, называется валентностью.
Характеристики ковалентной связи: насыщена, направлена, имеет полярность.

Кристаллическая решетка — это внутренняя структура кристалла, порядок взаимного расположения атомов, ионов или молекул. Точки, в которых находятся эти частицы, называются узлами решетки.
Частицы удерживаются на своих местах благодаря химическим связям между ними. В зависимости от того, какой вид связи удерживает атомы или ионы данного вещества, в химии выделяют основные типы кристаллических решеток:
атомная (ковалентные связи),
молекулярная (ковалентные связи и притяжение между молекулами), металлическая (металлические связи), ионная (ионные связи).
Соединения с ковалентной связью имеют два типа кристаллических решеток: атомные и молекулярные.
Атомная кристаллическая решетка
Согласно своему названию, атомная кристаллическая решетка — это структура, в узлах которой расположены атомы. Они взаимодействуют с помощью ковалентных связей, то есть один атом отдает другому свободный электрон или же электроны из разных атомов образуют общую пару. В кристаллах с атомной решеткой частицы прочно связаны, что обуславливает ряд физических характеристик.
Свойства веществ с атомной решеткой:
прочность, твердость, неспособность к растворению в воде, высокая температура кипения и плавления.
К примеру, атомную кристаллическую решетку имеет алмаз — самый твердый минерал в мире.
Другие примеры: германий Ge, кремний Si, нитрид бора BN, карборунд SiC.

Молекулярная кристаллическая решетка
Как и в предыдущей группе, в этой находятся вещества с ковалентными связями между атомами. Но физические характеристики этих веществ совершенно иные — они легко плавятся, превращаются в жидкость, растворяются в воде. Почему так происходит? Все дело в том, что здесь кристаллы строятся не из атомов, а из молекул.
Молекулярная кристаллическая решетка — это структура, в узлах которой находятся не атомы, а молекулы.
Внутри молекул атомы имеют прочные ковалентные связи, но сами молекулы связаны между собой слабо. Поэтому кристаллы таких веществ непрочные и легко распадаются.
Молекулярная кристаллическая решетка характерна для воды. При комнатной температуре это жидкость, но стоит нагреть ее до температуры кипения (которая сравнительно низка), как она тут же начинает превращаться в пар, т. е. переходит в газообразное состояние.
Некоторые молекулярные вещества — например, сухой лед CO2, способны преобразоваться в газ сразу из твердого состояния, минуя жидкое (данный процесс называется возгонкой).
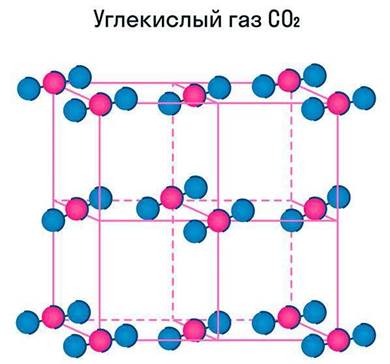
Свойства молекулярных веществ: небольшая твердость; низкая прочность; легкоплавкость; летучесть; у некоторых — наличие запаха.
Помимо воды к веществам с молекулярной кристаллической решеткой относятся аммиак NH3, гелий He, радон Rn, йод I, азот N2 и другие. Все благородные газы — молекулярные вещества. Также к этой группе принадлежит и большинство органических соединений (например, сахар).
ТЕМА 8. Ионная связь. Механизм образования, свойства связи. Кристаллические решетки.
• металлы, атомы которых содержат на внешнем слое 1—3 электрона, могут отдать их, чтобы сделать завершённый предвнешний слой внешним;
• неметаллы, атомы которых содержат на внешнем слое 4—7 электронов, могут принять недостающие чужие электроны для завершения этого слоя.
Однако эти процессы имеют далеко идущие последствия. Во–первых, атомы металлов, отдавая электроны (процесс называется окислением), превращаются в положительно заряженные ионы — катионы, а во–вторых, атомы неметаллов, принимая электроны на внешний слой (процесс называется восстановлением), превращаются в отрицательно заряженные ионы — анионы.
|
Согласно закону Кулона, между катионами и анионами возникают силы электростатического притяжения, которые удерживают эти частицы в ионном кристалле. |
|
|
Связь, образованная за счёт электростатического притяжения между катионами и анионами, в которые превращаются атомы или группы атомов в результате отдачи и присоединения электронов, называется ионной. |
|
|
Эта связь характерна для соединений, образованных наиболее активными металлами — щелочными и щёлочноземельными, и наиболее активными неметаллами — галогенами и кислородом. Следовательно, из бинарных, или двухэлементных соединений, к ионным относятся оксиды и галогениды металлов IA- и IIА-групп. Эти соединения построены простыми ионами. Схематично процесс образования ионной связи между атомами кальция и хлора можно отразить следующим образом: |
|
![]()
Два разноимённо заряженных иона, связанных силами взаимного притяжения, взаимодействуют с другими противоположно заряженными ионами, образуя таким образом кристаллические соединения. Что они собой представляют?
Ионы, как и другие частицы, в твёрдом кристалле занимают строго определённое положение в пространстве. Если их соединить воображаемыми линиями, получится совокупность ячеек правильной геометрической формы, называемая кристаллической решёткой. Точки, в которых расположены частицы вещества (в нашем случае ионы), называют узлами кристаллической решётки.
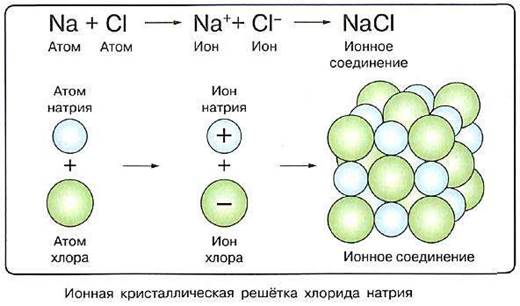
На рисунке представлена модель кристаллической решётки другого ионного соединения — хлорида натрия NaCl. В нём каждый катион натрия
|
окружён шестью хлорид-анионами. Те, в свою очередь, окружены каждый шестью катионами натрия. Ионы в узлах кристаллической решётки могут колебаться, но перемещаться им мешают другие ионы. Силы взаимного притяжения ионов достаточно велики, поэтому при обычных условиях вещества ионного строения имеют твёрдое агрегатное состояние, высокую температуру плавления, они нелетучие, а потому без запаха. Некоторые из таких веществ хорошо растворимы в воде (гидроксиды щелочных и щёлочноземельных металлов, соли). Ионные кристаллы хрупкие, поскольку при смещении слоёв одинаково заряженные ионы сближаются друг с другом, что приводит к их взаимному отталкиванию. При сильном нагревании колебание ионов увеличивается настолько, что порядок нарушается и кристалл плавится. Из каких частиц будет состоять полученная жидкость? Очевидно, из тех, которые были в узлах кристаллической решётки, т. е. из ионов.
На рисунке показана схема образования ионной связи в оксиде кальция СаО, хорошо известного под названием «негашёная известь». В определении ионной связи есть уточнение: ионы образуют не только отдельные атомы, но и группы атомов. Следовательно, существуют и сложные ионы, состоящие из нескольких химических элементов. Например, гидроксид-анион ОН–, анионы кислотных остатков кислородсодержащих кислот — сульфат–анион SO42–, нитрат анион NO3– и др. Логично сделать вывод, что ионными соединениями являются щёлочи и соли. Поскольку соединения с ионной связью относятся к веществам немолекулярного строения, более точным термином, отражающим их состав, является термин «формульная единица», а не «молекулярная формула». Однако в силу традиций последнее название часто употребляется и в отношении ионных соединений. |
|
Ионную связь можно рассматривать как крайнюю степень полярности ковалентных связей. Даже в тех соединениях, которые считаются абсолютно ионными, например в хлориде натрия, отсутствуют ионы с целочисленными значениями зарядов (+1 и –1). Действительный заряд на катионе натрия и хлорид–анионе соответственно равен +0,8 и –0,8. Не является абсолютно истинным и утверждение о том, что ионная связь возникает между элементами с противоположными свойствами — между активными металлами и неметаллами. Имеются ионные соединения, построенные только из неметаллов. К ним, например, можно отнести соли аммония (сульфат аммония, хлорид аммония и др.), а также соли органических оснований — аминов (хлорид метиаламмония, нитрат этиламмония и др.). Теорию ионной связи предложил немецкий учёный Вальтер Коссель. |
Ковалентная и ионная связь в целом похожи, и одну из них можно рассматривать, как крайнее выражение другой. Но все же между ними есть существенная разница.
Сравним эти виды химических связей в таблице.
|
Ковалентная связь |
Ионная связь |
|
Характеризуется появлением электронных пар, принадлежащих обоим атомам. |
Характеризуется появлением и взаимным притяжением ионов. |
|
Общая пара электронов испытывает притяжение со стороны обоих ядер атомов. |
Ионы с противоположными зарядами подвержены кулоновскому притяжению. |
|
Имеет направленность и насыщенность. |
Ненасыщенна и не имеет направленности. |
|
Количество связей, образуемых атомом, называется валентностью. |
Количество ближайших соседей атома называется координационным числом. |
|
Образуется между неметаллами с одинаковой или не сильно отличающейся ЭО. |
Образуется между металлами и неметаллами — веществами со значимо разной ЭО. |
ТЕМА 9. Металлическая химическая связь, водородная связь.
Механизм образования кристаллической решетки и свойства веществ.
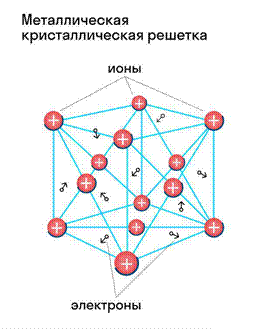
Отличительная особенность металлов в том, что их атомы имеют достаточно большие радиусы и легко отдают свои внешние электроны, превращаясь в положительно заряженные ионы (катионы). В итоге получается кристаллическая решетка, в узлах которой находятся ионы, а вокруг беспорядочно перемещаются электроны проводимости, образуя «электронное облако» или «электронный газ».
Свободные электроны мигрируют от одного иона к другому, временно соединяясь с ними и снова отрываясь в свободное плавание. Этот механизм по своей природе имеет сходство с ковалентной связью, но взаимодействие происходит не между отдельными атомами, а в веществе.
Металлическая связь — это взаимодействие положительных ионов металлов и отрицательно заряженных электронов, которые являются частью «электронного облака», рассеянного по всему объему вещества.
Наличие такого «электронного облака», которое может прийти в направленное движение, обусловливает электропроводность металлов. Другие их качества — пластичность и ковкость, объясняются тем, что ионы в кристаллической решетке легко смещаются. Поэтому металл при ударном воздействии способен растягиваться, но не разрушаться.
![]() Характеристики металлической связи:
Характеристики металлической связи:
ненаправленность, делокализованный характер, многоэлектронность.
Металлическая связь присуща как простым веществам — таким как Na, Ba, Ag, Cu, так и сложным сплавам — например, AlCr2, CuAl11Fe4, Ca2Cu и другим.
Схема металлической связи:
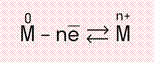
M — металл, n — число свободных внешних электронов.
К примеру, у железа в чистом виде на внешнем уровне есть два электрона, поэтому его схема металлической связи выглядит так:
![]()
Металлическая кристаллическая решетка
Для начала вспомним, как проходит металлическая химическая связь. В молекуле металла свободные отрицательно заряженные электроны перемещаются от одного иона к другому и соединяются с некоторыми из них, а после отрываются и мигрируют дальше. В результате получается кристалл, в котором ионы превращаются в атомы и наоборот.
Металлическая кристаллическая решетка — это структура, которая состоит из ионов и атомов металла, а между ними свободно передвигаются электроны. Как несложно догадаться, она характерна лишь для металлов и сплавов.
Свободные электроны, мигрирующие между узлами решетки, образуют электронное облако, которое под воздействием электротока приходит в направленное движение. Это объясняет такое свойство металлов, как электрическая проводимость.
В химии типичным примером вещества, которое имеет металлическую кристаллическую решетку, считается медь. Она очень ковкая, пластичная, имеет высокую тепло- и электропроводность. Впрочем, все металлы ярко демонстрируют эти характеристики, поэтому назвать физические свойства данной группы несложно.
Свойства веществ с металлической кристаллической решеткой: характерный блеск; хорошая ковкость; высокая теплопроводность; электропроводность.
При этом температура плавления веществ может существенно различаться. Например, у ртути это −38,9°С, а у бериллия целых +1287°С.
Подведем итог: о характеристиках разных типов кристаллических решеток расскажет таблица.
|
Тип решетки
|
Частицы в узлах решетки
|
Тип связи между частицами |
Примеры веществ
|
Физические свойства веществ
|
|
Атомная |
Атомы |
Ковалентная связь |
Твердые неметаллы: |
При обычных условиях прочные и |
|
|
|
|
графит, кремний, бор, германий и другие |
твердые, тугоплавкие, нерастворимые в воде, нелетучие |
|
Молекулярна я |
Молекул ы |
Силы притяжения между молекулами |
Вещества, образующие маленькие молекулы (CO2, Cl2, H2O), благородны е газы, органически е вещества. |
При обычные условиях — газы или жидкости. Легкоплавкие, летучие, некоторые способны к возгонке. |
|
Ионная |
Ионы |
Ионная связь |
Соли, большая часть органически х соединений, оксиды, щелочи. |
Твердые, тугоплавкие, хрупкие, нелетучие, растворимы в воде, способны проводить электроток. |
|
Металлическ ая |
Атомы и ионы |
Металлическ ая связь |
Все металлы и сплавы |
Твердые (кроме ртути), ковкие, имеют блеск, отличаются теплопроводностью, электропроводность ю. |
Обобщим все полученные знания. Таблица ниже описывает кратко химические связи и строение вещества.
45
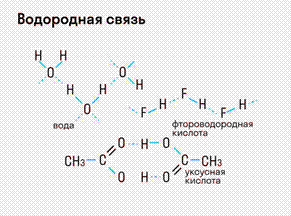
Данный тип связи в химии стоит отдельно, поскольку он может быть как внутри молекулы, так и между молекулами. Как правило, у неорганических веществ эта связь происходит между молекулами.
Водородная связь образуется между молекулами, содержащими водород. Точнее, между атомами водорода в этих молекулах и атомами с большей ЭО в других молекулах вещества.
Объясним подробнее механизм этого вида химической связи. Есть молекулы А и В, содержащие водород. При этом в молекуле А есть электроотрицательные атомы, а в молекуле В водород имеет ковалентную полярную связь с другими электроотрицательными атомами. В этом случае между атомом водорода в молекуле В и электроотрицательным атомом в молекуле А образуется водородная связь.
Графически водородная связь обозначается тремя точками. Ниже приведена схема такого взаимодействия на примере молекул воды.
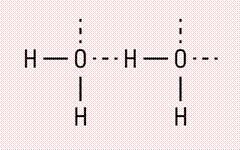
Важно!
В отдельных случаях водородная связь может образоваться внутри молекулы. Это характерно для органических веществ: многоатомных спиртов, углеводов, белковых соединений и т. д.
Характеристики водородной связи:
насыщенная, направленная.
Кратко о химических связях
Итак, самое главное. Химической связью называют взаимодействие атомов, причиной которого является стремление системы приобрести устойчивое состояние. Во время взаимодействия свободные внешние электроны атомов объединяются в пары либо внешний электрон одного атома переходит к другому.
Образование химической связи сопровождается выделением энергии. Эта энергия растет с увеличением количества образованных электронных пар и с сокращением расстояния между ядрами атомов.
Основные виды химических связей: ковалентная (полярная и неполярная), ионная, металлическая и водородная. В отличие от всех остальных водородная ближе к молекулярным связям, поскольку может быть как внутри молекулы, так и между разными молекулами.
Как определить тип химической связи:
Ковалентная полярная связь образуется в молекулах неметаллов между атомами со сходной ЭО.
Ковалентная неполярная связь имеет место между атомами с разной ЭО.
Ионная связь ведет к образованию и взаимному притяжению ионов. Она происходит между атомами металла и неметалла.
Металлическая связь бывает только между атомами металлов. Это взаимодействие положительных ионов в кристаллической решетке и свободных отрицательных электронов. Масса рассеянных по всему объему свободных электронов представляет собой «электронное облако».
Водородная связь появляется при условии, что есть атом с высокой ЭО и атом водорода, связанный с другой электроотрицательной частицей ковалентной связью.
Химическая связь и строение молекулы: типом химической связи определяется кристаллическая решетка вещества: ионная, металлическая, атомная или молекулярная.
ТЕМА 10. Органические полимеры, получение, особенности строения, свойства. Структуры полимеров.
Высокомолекулярные соединения (полимеры) существуют как в природе (белки, нуклеиновые кислоты, крахмал, целлюлоза, природный каучук), так и производится в больших масштабах синтетическим путём. Объёмы этих производств всё возрастают. Самыми известными полимерами являются полиэтилен, поливинилхлорид, полистирол, синтетический каучук.
Свойства:
1) химическая стойкость;
2) пластичность;
3) механическая прочность;
4) диэлектрические характеристики;
Полимеры – органические или неорганические соединения, молекулы которых состоят из десятков и сотен тысяч связанных между собой повторяющихся звеньев. Исходное вещество – мономер (низкомолекулярные вещества, способные к взаимодействию друг с другом) за счёт наличия кратных связей (этилен, стирол и т.д.) или существования функциональных групп (COOH и NH2).
Свойства полимеров определяются как химической природой мономеров, так и строением макромолекулярной цепи.
1) Цепи могут быть линейными (полиэтилен, каучук), разветвлёнными (крахмал) или пространственно структурированными (резина).
2) В зависимости от порядка соединения мономеров в макромолекуле полимеры могут иметь регулярное (2,3) и нерегулярное строение (1).
Вид структуры определяет физические свойства молекулы.
3) Химическая природа мономера определяет гибкость и термомеханические свойства материала.
Синтетические полимеры – уникальные материалы современности и будущего.
Высокомолекулярными соединениями (ВМС) или полимерами называются сложные вещества, молекулы которых состоят из большого числа повторяющихся группировок атомов, имеющих одинаковое строение и связанных между собой химическими связями.
Эти группировки атомов называются иначе элементарными звеньями. Молекулы полимеров имеют значительные размеры и большую молекулярную массу. В связи с этим их часто называют макромолекулами.
Число элементарных звеньев, содержащихся в такой макромолекуле, называется степенью полимеризации (СП) данного полимера и, как правило, обозначается в его химической формуле не числом, а буквенным индексом n. Это связано с тем, что молекулы одного и того же полимера, в отличие от низкомолекулярных соединений, не являются однородными. Одни из них имеют бóльшую молекулярную массу и значение СП, другие – мéньшую. Величина СП для высокомолекулярного соединения во многом зависит от условий его получения, строения элементарного звена и ряда других факторов. В связи с этим каждый полимер характеризуется своим молекулярно-массовым распределением (ММР), в котором указывается доля макромолекул с определенной массой и величиной СП среди общего числа его молекул.
Часто для характеристики полимера используют его среднюю молекулярную массу. Она рассчитывается по формуле: Mr (полимера) = n×Mr (элементарного звена), где n – средняя степень полимеризации.
Любой полимер можно синтезировать из соответствующих низкомолекулярных соединений, которые иначе называются мономерами. При этом выделяют 2 основных метода получения полимеров: полимеризацию и поликонденсацию.
Полимеризацией называется реакция образования ВМС из низкомолекулярных соединений в результате разрыва кратных связей (двойных или тройных) и не сопровождающаяся выделением побочных низкомолекулярных продуктов. Например:
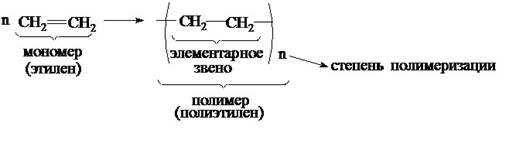
nCH2=CH2 [−CH2−CH2−]n полиэтилен n≤10000, n≤300000
nCH2=CH−CH=CH2 [−CH2−C=CH−CH2−]n
CH3 изопрен CH3 полиизопрен
Реакция полимеризации является реакцией присоединения и может протекать как по радикальному, так и по ионному механизму.
Поликонденсацией называется реакция образования ВМС из низкомолекулярных соединений путем взаимодействия между собой функциональных групп, содержащихся в их молекулах. При этом, кроме основного продукта, выделяются побочные низкомолекулярные вещества: H2O, NH3, HCl и т.д.
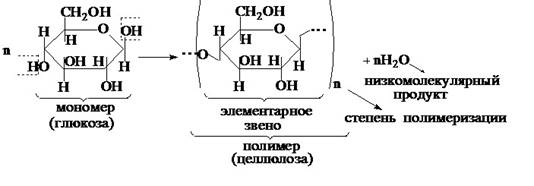
nH2N−(CH2)5−COOH −N−(CH2)5−C− n + nH2O
аминокапроновая кислота полимер «капрон»
В реакцию поликонденсации вступают мономеры, являющиеся поли- или гетерофункциональными соединениями.
Многие полимеры редко используются в «чистом» (индивидуальном) виде. Обычно их применяют в сочетании с другими веществами или материалами (наполнителями, красителями, пластификаторами, стабилизаторами и т.д.), которые придают им специфические свойства.
Такие композиции называют пластмассами или пластиками. Полимеры и композиции на их основе делятся на термопластические (термопласты) и термореактивные (реактопласты).
Термопласты размягчаются при нагревании и в горячем состоянии легко формуются в изделия, которые при охлаждении затвердевают и сохраняют заданную форму. При этом цикл нагревание – охлаждение с образованием новой формы изделия можно повторять многократно.
Реактопласты, сформованные в определенное изделие, в момент получения при повторном нагревании необратимо разлагаются без предварительного размягчения.
ТЕМА 11. Дисперсные системы. Классификация, свойства, значение.
Чистые вещества в природе встречаются очень редко. Кристаллы чистых веществ – сахара или поваренной соли, например, можно получить разного размера – крупные и мелкие. Каков бы ни был размер кристаллов, все они имеют одинаковую для данного вещество внутреннюю структуру – молекулярную или ионную кристаллическую решетку.
В природе чаще всего встречаются смеси различных веществ. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы. Такие системы мы будем называть дисперсными.
Дисперсной называется система, состоящая из двух или более веществ, причем одно из них в виде очень маленьких частиц равномерно распределено в объеме другого.
Вещество распадается на ионы, молекулы, атомы, значит “дробится” на мельчайшие частицы. “Дробление” > диспергирование, т.е. вещества диспергируют до разных размеров частиц видимых и невидимых.
Вещество, которое присутствует в меньшем количестве, диспергирует и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсной средой. Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называются гетерогенными (неоднородными).
И дисперсную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях – твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсной среды и дисперсной фазы можно выделить 9 видов таких систем. Таблица Примеры дисперсных систем
|
Дисперсионная среда |
Дисперсная фаза |
Примеры некоторых природных и бытовых дисперсных систем |
|
Газ |
Газ |
Всегда гомогенная смесь (воздух, природный газ) |
|
|
Жидкость |
Туман, попутный газ с капельками нефти, карбюраторная смесь в двигателях автомобилей (капельки бензина в воздухе), аэрозоли |
|
|
Твердое вещество |
Пыли в воздухе, дымы, смог, самумы (пыльные и песчаные бури), аэрозоли |
|
Жидкость |
Газ |
Шипучие напитки, пены |
|
Жидкость |
Эмульсии. Жидкие среды организма (плазма крови, лимфа, пищеварительные соки), жидкое содержимое клеток (цитоплазма, кариоплазма) |
|
|
Твердое вещество |
Золи, гели, пасты (кисели, студни, клеи). Речной и морской ил, взвешенные в воде; строительные растворы |
|
|
Твердое вещество |
Газ |
Снежный наст с пузырьками воздуха в нем, почва, текстильные ткани, кирпич и керамика, поролон, пористый шоколад, порошки |
|
Жидкость |
Влажная почва, медицинские и косметические средства (мази, тушь, помада и т. д.) |
|
|
Твердое вещество |
Горные породы, цветные стекла, некоторые сплавы |
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся на грубодисперсные (взвеси) с размерами частиц более 100 нм и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система – раствор. Она однородна, поверхности раздела между частицами и средой нет.
Дисперсные системы и растворы очень важны в повседневной жизни и в природе. Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета – наш общий дом – Земля; без клеток не было бы живых организмов и т.д.
Классификация дисперсных систем и растворов представлена на схеме
1.
Схема 1. Классификация дисперсных систем и растворов
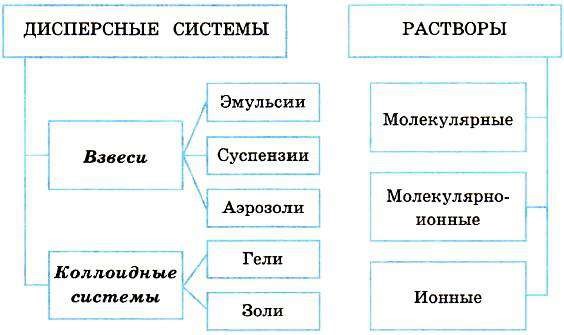
Взвеси – это дисперсные системы, в которых размер частицы фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсная среда легко разделяются отстаиванием, фильтрованием. Такие системы разделяются на:
1. Эмульсии (и среда, и фаза – нерастворимые друг в друге жидкости). Из воды и масла можно приготовить эмульсию длительным встряхиванием смеси. Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т.д.
2. Суспензии ( среда – жидкость, фаза – нерастворимое в ней твердое вещество).Чтобы приготовить суспензию , надо вещество измельчить до тонкого порошка, высыпать в жидкость и хорошо взболтать. Со временем частица выпадут на дно сосуда. Очевидно, чем меньше частицы, тем дольше будет сохраняться суспензия. Это строительные растворы, взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде – планктон, которым питаются гиганты – киты, и т.д.
3. Аэрозоли взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различаются пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний – взвесь капелек жидкости в газе. Например: туман, грозовые тучи – взвесь в воздухе капелек воды, дым – мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига – клинкера. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающих изо рта больного гриппом, также вредные аэролози. Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопление облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, лечение дыхательных путей (ингаляция) – примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли – туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.
Коллоидные системы (в переводе с греческого “колла” – клей, “еидос” вид клееподобные) – это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсная среда в таких системах отстаиванием разделяются с трудом.
Из курса общей биологии вам известно, что частицы такого размера можно обнаружить при помощи ультрамикроскопа, в котором используется принцип рассеивания света. Благодаря этому коллоидная частица в нем кажется яркой точкой на темном фоне.
Их подразделят на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок – кариоплазма, содержимое органоидов и вакуолей). И живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки и т.д.) Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия (“растворимого стекла”) с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (III) в горячей воде.
Характерное свойство коллоидных растворов – их прозрачность. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля. Более крупные, чем в истинном растворе, частицы дисперсной фазы золя отражают свет от своей поверхности, и наблюдатель видит в сосуде с коллоидным раствором светящийся конус. В истинном растворе он не образуется. Аналогичный эффект, но только для аэрозольного, а не жидкого коллоида, вы можете наблюдать в лесу и в кинотеатрах при прохождении луча света от киноаппарата через воздух кинозала.
Пропускание луча света через растворы;
а – истинный раствор хлорида натрия; б – коллоидный раствор гидроксида железа (III).
Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Это объясняется тем, что вещества в коллоидном, т.е., в мелкораздробленном, состоянии обладают большой поверхностью. На этой поверхности адсорбируются либо положительно, либо отрицательно заряженные ионы. Например, кремниевая кислота адсорбирует отрицательные ионы SiO32-, которых в растворе много вследствие диссоциации силиката натрия:
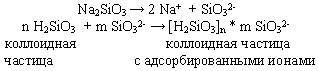
Частицы же с одноименными зарядами взаимно отталкиваются и поэтому не слипаются.
Но при определенных условиях может происходить процесс коагуляции. При кипячении некоторых коллоидных растворов происходит десорбция заряженных ионов, т.е. коллоидные частицы теряют заряд. Начинают укрупняться и оседают. Тоже самое наблюдается при приливании какого-либо электролита. В этом случае коллоидная частица притягивает к себе противоположно заряженный ион и ее заряд нейтрализуется.
Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок – наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. При этом раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (клей, яичный белок) или при изменении кислотно-щелочной среды раствора.
2. Гели или студни представляют собой студенистые осадки, образующиеся при коагуляции золей. К ним относят большое количество полимерных гелей, столь хорошо известные вам кондитерские, косметические и медицинские гели (желатин, холодец, мармелад, торт
“Птичье молоко”) и конечно же бесконечное множество природных гелей: минералы (опал), тела медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и т.д. Историю развития на Земле можно одновременно считать историей эволюции коллоидного состояния вещества. Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление называют синерезисом.
ТЕМА 12. Классификация химических реакций в органической и неорганической химии. Тепловой эффект химических реакций.
Процессы превращения одних веществ в другие, отличающиеся от исходных по составу или строению, а следовательно, и по свойствам,
|
называются химическими реакциями. |
|
|
Схема 1 Классификация химических реакций |
|
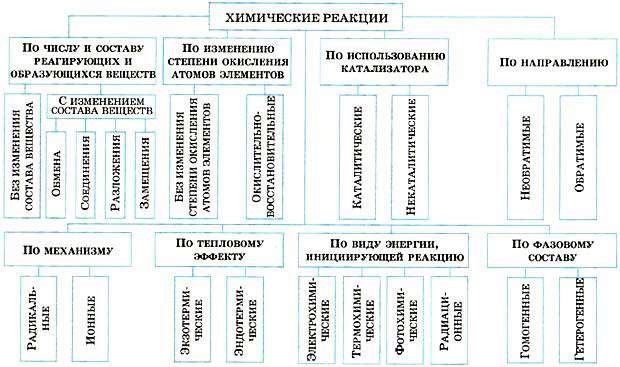
|
Химические реакции, протекающие без изменения состава веществ. Одно из положений теории химического строения утверждает, что свойства веществ зависят не только от их качественного и количественного состава, но и от строения. Следовательно, можно сделать вывод, что некоторые химические реакции могут сопровождаться изменением только качественного или только количественного состава исходных и образующихся веществ или же изменением их строения. Если качественный и количественный состав реагентов и продуктов реакций не меняется, то, очевидно, изменяется их строение. В курсе органической химии такие вещества называются изомерами, а процессы их взаимного перехода — реакциями изомеризации. Например, известно, что детонационную стойкость бензина характеризует октановая шкала, в которой устойчивость к детонации 2,2,4-триметилпентана (изооктана) принята за 100. А октановое число его изомера, углеводорода С8Н18 нормального строения, |
равно 20. Получить изооктан из н-октана можно с помощью реакции изомеризации:
![]() В
неорганической химии одинаковый качественный, но разный количественный состав
простых веществ иллюстрируют, например, аллотропные
видоизменения кислорода: этот элемент образует два простых вещества
— кислород и озон, которые связаны взаимопревращениями. Процесс образования
озона происходит при электрических разрядах:
В
неорганической химии одинаковый качественный, но разный количественный состав
простых веществ иллюстрируют, например, аллотропные
видоизменения кислорода: этот элемент образует два простых вещества
— кислород и озон, которые связаны взаимопревращениями. Процесс образования
озона происходит при электрических разрядах:
На примере кислорода и озона можно проиллюстрировать философский закон о переходе количественных отношений в качественные. Вспомните и сравните физические, химические и физиологические свойства кислорода и озона.
Влияние строения простых веществ, образованных одним химическим элементом на их свойства, иллюстрируют аллотропные модификации углерода.
Вспомните, какое строение имеют алмаз и графит. У обоих веществ — атомная кристаллическая решётка, только у алмаза она объёмная тетраэдрическая, а у графита — плоскостная. Поэтому алмаз — очень твёрдое вещество, а графит мягок. Алмаз прозрачен и обладает высоким светопреломлением, а графит непрозрачен, тёмно-серого цвета, в отличие от алмаза проводит электрический ток. Тем не менее обе модификации связаны взаимопревращениями:
![]()
|
Процесс получения искусственных алмазов моделирует природные экстремальные явления: проводится при очень высоких давлениях и температурах. В настоящее время искусственные алмазы получают из графита также при низких давлениях. Такие алмазы значительно уступают природным по ювелирным показателям, но сравнимы с природными по твёрдости, а потому применяются в технических целях. |
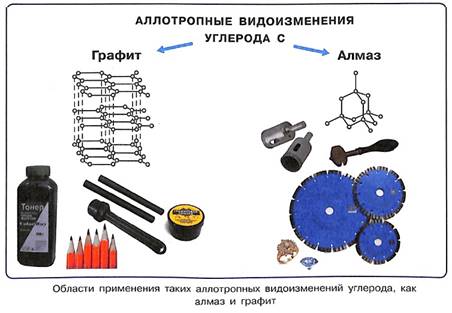
|
Первые сведения об аллотропии и аллотропных модификациях связаны с фосфором. В 1669 г. алхимик Хеннинг Брант, прокаливая сухой остаток мочи в попытке получить философский камень, получил белый фосфор (от греч. phos — свет и phoros — несущий), который затем превратился в красный. Химические реакции, протекающие с изменением состава веществ (по признаку числа и состава реагентов и продуктов реакции). Из курса химии основной школы вы знаете четыре типа реакций по этому признаку: соединения, разложения, замещения и обмена. |
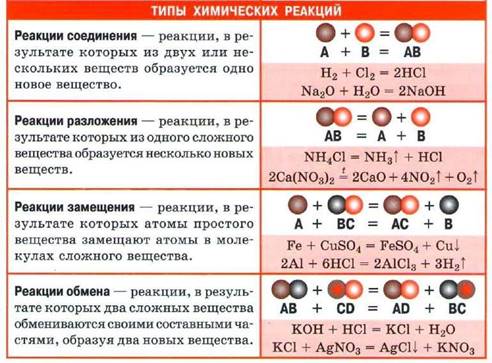
|
1. Реакции соединения (присоединения) |
|
||
|
Реакции, в результате которых из двух и более веществ образуется одно |
|
||
|
сложное вещество, называются реакциями соединения. |
||
|
В неорганической химии весь спектр разнообразных реакций можно проиллюстрировать примерами промышленных процессов: 1. Реакция горения фосфора — первая стадия получения чистой фосфорной кислоты: 4Р + 5O2 = 2Р2O5 В этом процессе участвуют два простых вещества и получается одно сложное. 2. Заключительная стадия получения фосфорной кислоты описывается уравнением Р2O5 + 3Н2O = 2Н3РO4 (сложное вещество образуется в результате взаимодействия двух сложных веществ). 3. На заключительной стадии получения азотной кислоты в реакцию вступают три вещества (одно простое и два сложных): 4NO2 + O2 + 2Н2O = 4HNO3 В органической химии реакции соединения называются реакциями присоединения, так как к основному веществу (субстрату) присоединяется дополнительное вещество (реагент). Такие реакции характерны для непредельных углеводородов и в зависимости от реагента носят видовые названия: • гидрирование — присоединение водорода; • галогенирование — присоединение галогенов; • гидрогалогенирование — присоединение галогеноводородов; гидратация — присоединение воды. Частным случаем реакции присоединения является реакция полимеризации — соединение множества одинаковых молекул мономера в макромолекулу полимера. 2. Реакции разложения (отщепления) |
||
|
Реакции, в результате которых из одного сложного вещества образуется два или несколько новых веществ, называются реакциями разложения. |
|
|
|
Рассмотрим реакции разложения на примере реакций получения кислорода лабораторными способами. 1. Электролиз воды: |
||
![]()
|
2. Термическим разложением оксида ртути(II) англичанин Джозеф Пристли получил кислород. 3. Разложение пероксида водорода: |
![]()
4. Разложение нитратов:
![]()
Последняя реакция используется не для получения кислорода, а в медицинских целях. Полученное при разложении серебро прижигает ранки
|
или удаляет бородавки, если используется особый ляписный (от лат. lapis infernalis — адский камень) карандаш. В органической химии реакции разложения называют реакциями отщепления. Так, для получения этилена используются реакции дегидратации этанола, деполимеризации полиэтилена, дегидрирования этана (запишите уравнения реакций). 3. Реакции замещения |
|
Реакции, в результате которых атомы простого вещества замещают атомы другого элемента в сложном веществе, называются реакциями замещения. |
|
Как видно из определения, эти реакции характеризуют свойства классов простых веществ. Например, такое важное свойство галогенов, как их способность вытеснять менее активные галогены из растворов галогеноводородных кислот или их солей: Сl2 > Вг2 > I2. Аналогично, этот тип реакций характеризует химические свойства металлов: 1. Щелочные и щёлочноземельные металлы активно взаимодействуют с водой: 2Na + 2Н2O = 2NaOH + Н2↑ 2. С растворами кислот взаимодействуют металлы, стоящие в ряду напряжений до водорода: Zn + 2НСl = ZnCl2 + H2↑ 3. Металлы, стоящие в ряду напряжений до металла соли, вытесняют его из раствора соли: Fe + CuSO4 = Сu + FeSO4 4. Более активные металлы вытесняют менее активные из их оксидов с выделением большого количества теплоты — металлотермия: 2Аl + Fe2O3 = Аl2O3 + 2Fe Реакции замещения характерны для предельных соединений, например галогенирование метана, согласно цепочке переходов: СН4 –> СН3Сl –> СН2Сl2 –> СНСl3 –> ССl4. Нитрование бензола относится к реакциям замещения, но протекает между двумя сложными веществами: С6Н6 + HNO3 —> C6H5NO2 + Н2O В органической химии продуктами реакций этого типа являются не простое и сложное вещества, а два сложных. Кроме этого, в реакцию замещения могут вступать и сложные вещества. 4. Реакции обмена |
|
Реакции, в результате которых два сложных вещества обмениваются своими составными частями, называются реакциями обмена. |
|
Для растворов электролитов такие реакции протекают в соответствии с правилом Бертолле (названным по имени предложившего его французского химика Клода Бертолле) и возможны в том случае, если образуется осадок, газ или малодиссоциирующее вещество (например, вода). Приведём примеры. 1. Золотисто–жёлтый осадок иодида свинца выпадает при взаимодействии растворов иодида натрия и нитрата свинца: |
|
2NaI + Pb(NO3)2 = Pbl2↓ + 2NaNO3 Pb2+ + 2I– = Pbl2↓ 2. Лабораторный способ получения аммиака: 2NH4Cl + Са(ОН)2 = СаСl2 + 2NH3↑ + 2Н2O NH4+ + ОН– = NH3↑ + Н2O 3. Частным случаем реакции обмена является реакция нейтрализации — она протекает между растворами кислот и щелочей: 4. NaOH + НСl = NaCl + Н2O OH– + H+ = H2O
Химические реакции, протекающие с тепловым эффектом. Важный классификационный признак реакций — выделение или поглощение теплоты. Как правило, реакции соединения сопровождаются выделением теплоты. Такие реакции называются экзотермическими. Если экзотермическая реакция сопровождается выделением света, то она называется реакцией горения: 2Mg + О2 = 2MgO + Q Эта реакция широко использовалась раньше при фотографировании. До сих пор можно встретить выражение: «Место происшествия освещали вспышки магния», — хотя сейчас вместо вспышки пламени горящего порошка магния используются электровспышки. Важным источником теплоты и энергии является горение углеводородов: СН4 + 2О2 –> СО2↑ + 2Н2О + Q Но нет правил без исключения: реакция взаимодействия азота с кислородом сопровождается поглощением теплоты: N2 + О2 <=> 2NO – Q Такие реакции называются эндотермическими. Схематично экзо- и эндотермические реакции отражает рисунок. Если реакции разложения протекают с поглощением теплоты, то в реакциях соединения теплота должна выделяться, и наоборот. Например, практическое значение имеет обжиг известняка: процесс получения ценного химического сырья и строительного материала — негашёной извести:
|
|
|
|
Количество теплоты, которое выделяется или поглощается в результате протекания химической реакции, называется тепловым эффектом реакции. |
|
Если в уравнении реакции указывается тепловой эффект, то уравнение называется термохимическим. Например: СН4 + 2О2 —> СO2 + 2Н2O + 800 кДж — реакция экзотермическая; СаСO3 = СаО + СO2 – 187 кДж — реакция эндотермическая.
Классификация реакций по другим критериям Классификация реакций — многоплановый процесс. Их можно классифицировать также: • по направлению (обратимые и необратимые реакции); • по использованию катализатора (каталитические и некаталитические реакции); • по агрегатному состоянию реагентов и продуктов реакции (гомогенные и гетерогенные реакции); • по изменению степеней окисления элементов, образующих реагенты и продукты реакции (окислительно–восстановительные и реакции, протекающие без изменения степеней окисления). |

ТЕМА 13. Скорость химической реакции. Энергия активации, факторы влияющие на скорость реакции. Катализаторы и катализ.
Скорость химической реакции зависит от многих факторов. Основными из них являются природа и концентрации реагирующих веществ, давление — если в реакции участвуют газообразные вещества, поверхность соприкосновения реагирующих веществ, температура, действие катализатора.
Нам необходимо рассмотреть влияние каждого из этих факторов на скорость химической реакции, подтвердив экспериментально.
Первый фактор — природа реагирующих веществ и энергия активации взаимосвязаны. Если Еа иона 40 кДж/моль, это означает то, что большинство столкновений частиц приводит к их быстрому взаимодействию. Реакции ионного обмена протекают мгновенно, скорость таких реакций очень большая, т. к. в реакциях участвуют анионы и катионы, у которых Еа очень мала.
Если Еа очень велика, > 120 кДж/моль, это означает то, что лишь малое число столкновений взаимодействующих частиц приводит к образованию новых веществ. Скорость такой реакции очень мала. Например, взаимодействие азота с водородом с образованием аммиака при обычных условиях невозможно. Если Еа имеет промежуточное значение 40 < Еа < 120, скорость таких реакций имеет среднее значение. Примеры таких реакций — взаимодействие металлов с кислотами, гидролиз сахарозы, взаимодействие натрия с водой, спиртом и т. д.
Таким образом, под природой реагирующих веществ следует понимать: а) Особенности строения атомов элементов металлов и неметаллов.
Пример. К активнее Na; Mg активнее Zn, т. к. радиусы атомов разные, восстановительная способность разная, отличаются Еа.
Сравнительный эксперимент взаимодействия К и Na с водой:
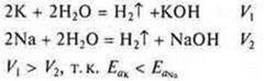
Взаимодействие Mg и Zn с соляной кислотой:
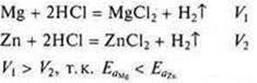
Второй фактор — концентрации реагирующих веществ. Чтобы осуществилось химическое взаимодействие между какими-то частицами, они должны эффективно столкнуться. Чем больше концентрация реагирующих веществ, тем больше столкновений и, соответственно, выше скорость реакции. На основании экспериментов, проведенных в 1867 г. норвежцами К. Гульдбергом и П. Вааге и независимо от них в 1865 г. русским ученым Н. И. Бекетовым, был сформирован основной закон химической кинетики и установлена зависимость скорости реакции от концентрации реагирующих веществ.
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
Этот закон также называют законом действующих масс (в конце XIX века термин «концентрация» еще не был введен, а химики вместо него использовали термин «действующие массы»).
Для реакции А + В = D, вычисляется
![]()
а скорость реакции А + 2В = D определяется как
![]()
где СА, СВ— концентрации реагирующих веществ, моль/л, k1, k2 —
константы скорости реакции.
Константа скорости зависит только от температуры и не зависит от концентрации веществ. Константа скорости при постоянной температуре численно равна скорости реакции, в которой концентрации реагирующих веществ равны 1 моль/л. Закон действующих масс не учитывает концентрации реагирующих веществ, находящихся в твердом состоянии, т. к.
они реагируют на поверхности и их концентрации являются постоянными.
Пример: ![]()
V = k · СO2, скорость реакции пропорциональна только концентрации кислорода. Таким образом, закон действующих масс учитывает лишь концентрации газообразных или растворенных веществ. Пример:
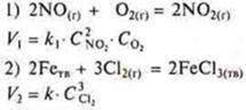
Изменение давления при участии в реакции газообразных веществ также приводит к изменению концентрации этих веществ. Так, при увеличении давления в 2, 3 и большее число раз уменьшается объем, а концентрация веществ на единицу объема увеличивается в это же число раз, и наоборот, при уменьшении давления объем увеличивается, а концентрация на единицу объема также будет уменьшаться. Пример:
![]()
а) — без изменения давления
б) давление увеличено в 3 раза,
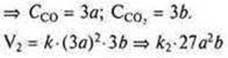
В целом скорость реакции возросла:
![]() -
в 27 раз;
-
в 27 раз;
в) давление уменьшили в 2 раза.
![]()
![]() - скорость реакции
уменьшается в 8 раз.
- скорость реакции
уменьшается в 8 раз.
Третий фактор — поверхность соприкосновения реагирующих веществ. Реакции идут на поверхности — это гетерогенные реакции.
![]()
Формула скорости чем меньше единица площади S, тем больше скорость реакции.
Твердые реагирующие вещества следует измельчать, растирать, т. е. нарушать структуру кристаллической решетки, т.к. частицы на микрокристалле реакционноспособнее, чем те же частицы на «гладкой поверхности».
Четвертый фактор — температура.
Чем выше температура, тем больше активных частиц, т. к. повышается Еа, а также увеличивается скорость их движения, что приводит к большому числу соударений при взаимодействии друг с другом. Наблюдается увеличение скорости реакции. Реакция между кислородом и водородом при t° = 20 °С за 54 млрд. лет протекает на 15%, при 500 °С — за 50 мин, при 700 °С — мгновенно.
В 1844 г. Я. Вант-Гофф установил, что при повышении температуры на каждые 10° скорость химической реакции увеличивается в 2—4 раза. Эту величину называют температурным коэффициентом реакции, обозначается у — гамма. Для каждой реакции числом от 2 до 4. При повышении
температуры с t°1 до t°2
реакция ускоряется в 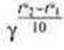 раз, т. е. скорость
раз, т. е. скорость
реакции при ![]()
Пятый фактор — катализатор, ингибитор. Катализаторы — вещества, уменьшающие механизм реакции и направление ее по энергии более выгодным путем, с меньшей энергией активации.
Катализаторы — вещества, участвующие в химической реакции и изменяющие ее скорость или направление, оставаясь на окончание реакции неизменными качественно и количественно. Если катализатор и реагенты находятся в одном агрегатном состоянии — это гомогенный катализ. Пример.
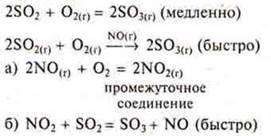
Если катализатор и реагенты находятся в разных агрегатных состояниях — это гетерогенный катализ.
![]()
В присутствии катализатора изменяется путь, по которому проходит суммарная реакция, поэтому изменяется ее скорость. Катализаторы положительные увеличивают скорость реакции.
Катализаторы отрицательные — ингибиторы — замедляют скорость химической реакции. Они реагируют с высокой скоростью с активными частицами и образуют малоактивные соединения. Скорость реакции замедляется, и химическая реакция прекращается. Ингибиторы стабилизируют кислоты при их перевозке в стальной таре, подавляют действие пероксида водорода, мономеры предотвращают преждевременную полимеризацию.
Очень эффективно работают катализаторы и ингибиторы в живом организме. Катализаторы в живом организме называются ферментами. Благодаря им в живом организме при невысокой температуре с большой скоростью протекает множество сложных реакций. Ферменты отличаются особой специфичностью, каждый из них ускоряет только одну химическую реакцию с выходом 100 %. Ингибиторы в живом организме подавляют различные вредные реакции окисления в клетках тканей, которые могут инициироваться радиоактивным излучением.
III. Решение расчетных задач
Задача 1. Написать математические выражения для скоростей реакций, протекающих по уравнениям:
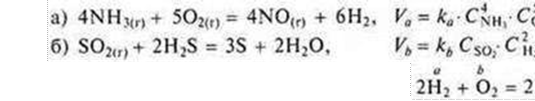 Задача 2. Как изменится скорость
реакции если концентрацию водорода увеличить в 2 раза?
Задача 2. Как изменится скорость
реакции если концентрацию водорода увеличить в 2 раза?
![]() — до увеличения
концентрации водорода.
— до увеличения
концентрации водорода.
— с увеличением концентрации водорода.
Скорость реакции (2) возросла в 4 раза.
Задача 3. Как изменится скорость реакции ![]() если
давление уменьшить в 100 раз?
если
давление уменьшить в 100 раз?
![]() При уменьшении давления в 100 раз
концентрации Н2 и
При уменьшении давления в 100 раз
концентрации Н2 и
Сl2 уменьшаются в 100 раз ![]()
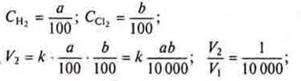
![]() скорость реакции
уменьшится в 10 000 раз.
скорость реакции
уменьшится в 10 000 раз.
Задача 4. Во сколько раз увеличится скорость реакции при повышении температуры от 50° до 100°С, если температурный коэффициент скорости равен 2?
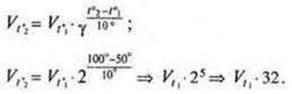
Скорость реакции возрастет в 32 раза.
Задача 5. Определить температурный коэффициент скорости реакции, если при повышении температуры от 10° до 50° скорость реакции увеличилась в 16 раз.
![]()
Ответ: γ = 2.
ТЕМА 14. Обратимость химических реакций. Химическое равновесие.
При изучении теории электролитической диссоциации вы установили отличие сильных электролитов от слабых. Сильные электролиты в растворах диссоциируют полностью, т. е. существуют только в виде ионов. Например:
![]() Слабые
электролиты диссоциируют частично, т. е. существуют в растворе как в виде
ионов, так и в виде молекул. Одни молекулы распадаются на ионы (диссоциация),
другие образуются из получившихся ионов (ассоциация). Например:
Слабые
электролиты диссоциируют частично, т. е. существуют в растворе как в виде
ионов, так и в виде молекул. Одни молекулы распадаются на ионы (диссоциация),
другие образуются из получившихся ионов (ассоциация). Например:
Сильные электролиты диссоциируют необратимо, а слабые — обратимо. Эту особенность отражают с помощью двух стрелок, направленных в противоположные стороны: стрелка, указывающая слева направо, отражает процесс диссоциации, обратная — ассоциации.
Из курса органической химии вы знаете, что ацетилен можно получить взаимодействием карбида кальция с водой:
![]() Если
вы попытаетесь из гидроксида кальция и ацетилена получить карбид кальция, т. е.
провести обратную реакцию, у вас ничего не выйдет. Гидролиз карбида кальция
относится к необратимым химическим реакциям.
Если
вы попытаетесь из гидроксида кальция и ацетилена получить карбид кальция, т. е.
провести обратную реакцию, у вас ничего не выйдет. Гидролиз карбида кальция
относится к необратимым химическим реакциям.
Химические реакции, протекающие в одном направлении, называются необратимыми.
Взаимодействие карбоновой кислоты со спиртом называют, как вы знаете, реакцией этерификации. Катализаторами таких реакций являются сильные кислоты, например серная:
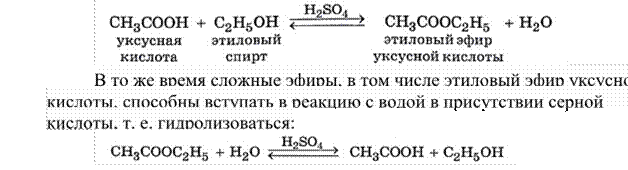
Нетрудно заметить, что реакции этерификации и гидролиза сложного эфира — зеркальное отражение друг друга, два взаимно противоположных процесса.
Химические реакции, которые протекают в двух взаимно противоположных направлениях, называются обратимыми.
![]() В
обратимых реакциях вместо знака равенства часто изображают две противоположно
направленные стрелки — стрелки обратимости:
В
обратимых реакциях вместо знака равенства часто изображают две противоположно
направленные стрелки — стрелки обратимости:
Условно реакцию, которая записана слева направо, называют прямой, а противоположную ей — обратной.
Обратимой, например, является реакция синтеза аммиака. Смесь азота с водородом пропускают через нагретый железный катализатор. Начинается химическая реакция:
Однако часть образующегося аммиака в тех же самых условиях (температура, катализатор) распадается:
Общее уравнение этого обратимого процесса можно записать так:
![]() В
реакции синтеза аммиака, как и в любой обратимой реакции, наступает такой
момент времени, когда скорость прямой реакции становится равной скорости
обратной.
В
реакции синтеза аммиака, как и в любой обратимой реакции, наступает такой
момент времени, когда скорость прямой реакции становится равной скорости
обратной.
Состояние обратимой химической реакции, при котором скорости прямой и обратной реакций равны, называется химическим
|
равновесием. |
|
|
При химическом равновесии концентрации участников реакции перестают изменяться, хотя ни прямая, ни обратная реакции не прекращаются. Сколько продуктов реакции образовалось за единицу времени, столько и разложилось с образованием исходных веществ. Если условия реакции не изменяются, химическое равновесие может существовать сколь угодно долго. Стоит реакцию «потревожить», и равновесие смещается либо в сторону исходных веществ, либо в сторону продуктов реакции. Через некоторое время устанавливается новое равновесие. Такое явление называют смещением химического равновесия. |
|
Какие факторы оказывают влияние на химическое равновесие? В общем случае таких факторов три: изменение температуры реакции, давления и концентрации реагирующих веществ.
Общий принцип смещения химического равновесия сформулировал в 1884 г. французский химик Анри Ле Шателье.
Если на обратимую реакцию, находящуюся в состоянии химического равновесия, оказывать воздействие (изменять температуру, давление или концентрацию веществ), то равновесие смещается в направлении, ослабляющем это воздействие.
Проиллюстрируем этот принцип на примере реакции синтеза аммиака.
1. На состояние равновесия оказывает влияние температура.
![]() Реакция
соединения водорода и азота сопровождается выделением теплоты, т. е. является
экзотермической. Естественно, что разложение аммиака — эндотермический процесс:
Реакция
соединения водорода и азота сопровождается выделением теплоты, т. е. является
экзотермической. Естественно, что разложение аммиака — эндотермический процесс:
|
Если в состоянии равновесия увеличить температуру реакционной смеси, то это вызовет ускоренное разложение аммиака, т. е. смещение равновесия влево. Это реакция эндотермическая, идёт с поглощением теплоты, и, следовательно, система препятствует повышению температуры. Можно запомнить частное правило: увеличение температуры смещает равновесие в сторону эндотермической реакции. 2. Если хотя бы один из участников обратимой реакции является газом, на состояние равновесия оказывает влияние давление. Синтез аммиака сопровождается понижением давления, так как из четырёх объёмов исходных газов получается два объёма газообразного продукта (в соответствии с коэффициентами в уравнении реакции). Если в состоянии равновесия увеличить давление в системе, то равновесие сместится вправо, при этом объём смеси уменьшится и давление также станет меньше. Получается, что увеличение давления смещает равновесие в сторону реакции, которая сопровождается уменьшением суммарного объёма газообразных веществ. 3. На состояние равновесия можно повлиять изменением концентрации реагирующих веществ. Допустим, в равновесную смесь азота, водорода и аммиака добавили дополнительное количество азота, т. е. увеличили его концентрацию. Равновесие в системе будет смещаться таким образом, чтобы азота стало меньше, т. е. в сторону образования аммиака. Сделаем общий вывод: добиться большего выхода продукта в реакции синтеза аммиака можно уменьшением температуры, повышением давления, увеличением концентрации азота или водорода и уменьшением концентрации аммиака. |
||
|
|
А как влияет катализатор на смещение равновесия? Синтез аммиака — |
|
|
это каталитический процесс, но катализатор в одинаковой степени |
||
|
увеличивает скорость как прямой, так и обратной реакции. Поэтому наличие |
||
|
катализатора на смещение равновесия никак не влияет, он только сокращает |
||
|
время установления равновесия. |
|
|
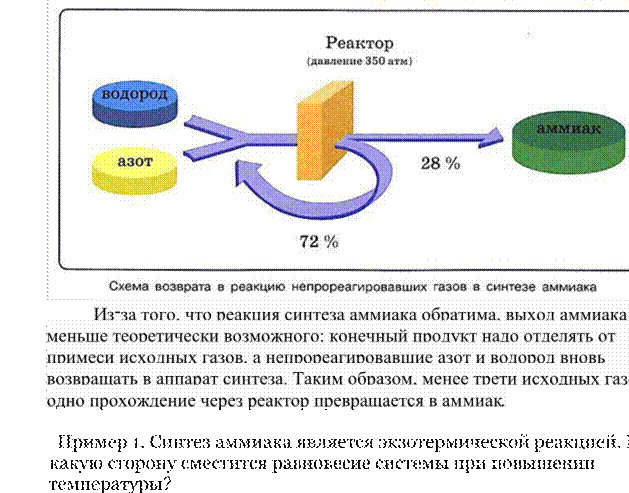
N2+3H2 ↔ 2NH3+92,4 кДж Решение задачи:
При повышении температуры равновесие в системе H2-N2NH3 свдигается в сторону разложения аммиака (влево), поскольку этот процесс идет с поглощением теплоты.
![]()
Пример 2. Синтез оксида азота (II) является эндотермической реакцией. В какую сторону сместится равновесие системы при повышении температуры?
N2+O2 ↔ 2NO-108,5 кДж Решение задачи:
При повышении температуры равновесие в системе N2-O2-2NO свдигается в сторону образования оксида азота (вправо), поскольку этот процесс идет с выделением теплоты.
![]()
Пример 3. Куда будет смещаться равновесие системы с увеличением температуры?
N2+O2 ↔ 2NO-108,5 кДж
N2+3H2 ↔ 2NH3+88 кДж
Решение задачи:
В первой системе протекает эндотермическая реакция, поэтому, при повышении температуры равновесие будет смещаться в сторону прямой реакции (вправо); во второй системе - все с точностью, до наборот - поскольку реакция экзотермическая, то увеличение температуры приведет к смещению равновесия в сторону обратной реакции (влево).
![]()
Пример 4. Какие реакции идут с повышением давления, а какие - с понижением?
2SO2+O2 ↔ 2SO2
2NO2 ↔ 2NO+O2
H2+I2 ↔ 2HI Решение задачи:
Чтобы решить задачу, надо определить кол-во молей в левой и правой частях схемы реакции:
• В первой реакции из 3 молекул образуется 2 молекулы - реакция идет с понижением давления;
• Во второй реакции из 2 молекул образуется 3 молекулы - реакция идет с повышением давления;
• В третьей реакции из 2 молекул получаются 2 молекулы - реакция идет без изменения давления.
![]()
Пример 5. Как будет меняться равновесие в системах с изменением давления?
N2+3H2 ↔ 2NH3
2HBr ↔ H2+Br2
N2O4 ↔ 2NO2 Решение задачи:
• В первой реакции из 4 молекул получается 2 - прямая реакция идет с уменьшением давления, обратная - с увеличением давления, поэтому, увеличение давления сместит равновесие системы в сторону прямой реакции, а уменьшение - в сторону обратной;
• Во второй реакции из 2 молекул получается 2 молекулы - прямая и обратная реакции идут без изменения давления, поэтому, изменение давления не вызовет смещения реакции ни в какую сторону;
• В третьей реакции из 1 молекулы получает 2 - прямая реакция идет с увеличением давления, обратная - с уменьшением, поэтому, увеличение давления сместит равновесие системы в сторону обратной реакции, а уменьшение - в сторону прямой.
![]()
Пример 6. Составить выражение константы равновесия и вычислить ее значение для следующей реакции (равновесные концентрации равны):
2SO2(г)+O2(г) ↔ 2SO3(г)
[SO2]=0,12 моль/л [O2]=0,06 моль/л
[SO3]=0,04 моль/л Решение задачи:
Kp=[SO3]2:([SO2]2·[O2]) Kp=0,042:(0,122·0,06) = 1,85
ТЕМА 16. Понятие о растворах. Физико-химическая природа растворения. Растворимость веществ. Способы выражения концентраций растворов.
Растворы – это однородные гомогенные системы, состоящие из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Растворенное вещество равномерно распределено в растворителе. Раствор может состоять из двух и более компонентов.
Растворы бывают жидкие, твердые и газообразные.
Растворитель – это то вещество, которое не изменяет агрегатное состояние при растворении. В случае смешения веществ с одинаковым агрегатным состоянием (жидкость-жидкость, газ-газ, твердое-твердое) растворителем считается тот компонент, содержание которого больше.
Образование раствора зависит от характера взаимодействия частиц растворителя и растворенного вещества, и их природы.
В школьном курсе рассматриваются преимущественно растворы электролитов. В курсе ВУЗов рассматриваются также истинные и коллоидные растворы, золи и другие системы.
По способности растворяться вещества условно делят на:
• малорастворимые (от 0,001 до 1 грамма растворенного вещества на 100 грамм растворителя);
• растворимые (больше 1 г растворенного вещества на 100 г
растворителя);
• нерастворимые (менее 0,001 г растворенного вещества на 100 г растворителя).
Обратите внимание!
При попадании в воду вещество может:
• раствориться в воде, то есть перемешаться с ней на атомномолекулярном уровне;
• химически прореагировать с водой;
• не раствориться в воде и химически не прореагировать.
Коэффициент растворимости – отношение массы растворенного вещества к массе растворителя (например, 10 г соли на 100 г воды).
По концентрации растворенного вещества растворы делят на:
Ненасыщенные растворы – это растворы, в которых концентрация растворенного вещества меньше, чем в соответствующем насыщенном растворе, и в котором при данных условиях можно растворить еще некоторое количества растворенного вещества.
Насыщенные растворы – это растворы, в которых достигнута максимальная концентрация растворенного вещества при данных условиях. Насыщенный раствор можно приготовить даже в бытовых условиях – например, раствор поваренной соли в воде. Если в стакан воды постепенно добавлять соль, рано или поздно соль перестанет растворяться. Это и будет насыщенный раствор.
Пересыщенный раствор – это раствор, в котором концентрация растворенного вещества больше, чем в насыщенном. Избыток растворенного вещества легко выпадает в осадок. Приготовить пересыщенный раствор можно, например, с помощью охлаждения насыщенного раствора поваренной соли. При понижении температуры растворимость поваренной соли уменьшается, и раствор становится пересыщенным.
По концентрации растворенного вещества растворы также разделяют на концентрированные и разбавленные:
Концентрированные растворы – это растворы с относительно высоким содержанием растворенного вещества.
Разбавленные растворы – это растворы с относительно низким содержанием растворенного вещества.
Это деление очень условно, и не связано с делением раствора по насыщенности. Разбавленный раствор может быть насыщенным, а концентрированный раствор не всегда может оказаться насыщенным.
Физические величины, характеризующие состав раствора – это массовая доля, массовый процент, молярность (молярная концентрация), мольная доля, мольный процент, мольное соотношение, растворимость (для насыщенных растворов), объемная доля, объемный процент и некоторые другие величины, которые проходятся в курсе ВУЗов (нормальность или нормальная концентрация, моляльность, титр).
Остановимся подробнее на каждой из них:
1. Массовая доля, масс. доли — это отношение массы растворенного вещества mр.в. к массе раствора mр-ра, выраженное в долях от единицы. Долю можно также выразить в процентах, умножив на 100, тогда мы получим массовый процент, масс. %.
ω = mр.в. / mр-ра
Задачи на материальный баланс с использованием массовой доли — обязательный компонент экзаменов по химии (и не только!) разных уровней. Научиться решать задачи на массовую долю и материальный баланс (смешение, разбавление, концентрирование и приготовление растворов) можно здесь!
2. Молярная концентрация (молярность), моль/л, М – это отношение количества растворенного вещества ν, моль к объему всего раствора Vр-ра, л. Концентрация 1 моль растворенного вещества на 1 литр раствора также обозначается так: 1 М. Такой раствор называют «одномолярный». Двухмолярный раствор — 2 М соответствует концентрации 2 моль растворенного вещества на 1 литр раствора и т.д.
Cm = νр.в. / Vр-ра
Задачи на молярную концентрацию, как правило, встречаются в курсе ВУЗов, в химических олимпиадах и вступительных экзаменах в ВУЗы. Научиться решать задачи на молярную концентрацию можно здесь.
3. Мольная доля, мольн. дол. – это отношение количества растворенного вещества νр.в., моль к общему количеству вещества всех компонентов в растворе νр-ра, моль:
φ = νр.в. / νр-ра
Мольная доля также может быть выражена в мольных процентах (% мольн.), если умножить долю на 100%. Задачи на мольную долю встречаются в курсе ВУЗов, олимпиадах и вступительных экзаменах. Научиться решать задачи на мольную долю можно здесь.
4. Объемная доля, объемн. дол. – это отношение объема растворенного вещества Vр.в., л к общему объему раствора или смеси
Vр-ра, л:
φ = Vр.в./ Vр-ра
Объемная доля также может быть выражена в объемных процентах (% объемн.), если умножить долю на 100%. Задачи на объемную долю, как правило, сводятся к решению задач на мольную долю, т.к. для газовых смесей объемные и мольные доли компонентов в смеси равны.
5. Мольное соотношение – это отношение количества растворенного вещества к количеству вещества растворителя. Также может использоваться массовое соотношение и объемное соотношение.
6. Растворимость – это отношение массы растворенного вещества к массе растворителя (применяется, как правило, для насыщенных растворов).
7. Титр, г/мл – это отношение массы растворенного вещества mр.в., г к объему раствора, выраженному в миллилитрах Vр-ра, мл:
T = mр.в. / Vр-ра
8. Моляльность.
9. Нормальная концентрация (нормальность)
По механизму растворения растворы делят на физические и химические.
Физическое растворение — это растворение, при котором происходит разрыв и образование только межмолекулярных связей (включая водородные). Физически растворяются только некоторые вещества с молекулярной кристаллической решеткой. Например, растворение нафталина в спирте и воде — опыт.
Химическое растворение — это растворение, при котором разрушаются химические связи в веществе. Химическое растворение, как правило, сопровождается электролитической диссоциацией растворяемого вещества. Подробнее про электролитическую диссоциацию и химическое растворение здесь.
Важно! Подобное хорошо растворяется в подобном. Неполярные растворители хорошо растворяют неполярные вещества. Полярные растворители хорошо растворяют полярные вещества. Понимание механизмов растворения, природы растворяемого вещества и растворителя позволяет легко определить растворимость одного вещества в другом. ТЕМА 17. Теория электролитической диссоциации веществ с различными типами связи.
Как известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий.
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя).
Механизм электролитической диссоциации обусловлен как особенностями строения молекул растворителя, так и типом химической связи в молекулах растворенных веществ (электролитов). Известно, что молекулы воды являются полярными молекулами, под действием которых связь внутри молекул с ионной связью ослабевает, образуются противоположно заряженные ионы, окруженные определенным количеством молекул воды. Рассмотренный механизм электролитической диссоциации действителен не только для соединений с ионной связью, но и для веществ, образованных полярной ковалентной связью. Такие соединения (например НСl) до растворения в воде ионов не содержат. Однако под действием полярных молекул воды связь в НСl ослабляется, становится еще более полярной и переходит в ионную. При этом общая электронная пара целиком смещается к атому хлора, который в результате превращается в гидратированный ион Сl –.
Если в качестве растворителя взять неводный растворитель с малым значением диэлектрической проницаемости, то процесс электролитической диссоциации будет сильно затруднен. Например, HCl хорошо диссоциирует в воде и практически не диссоциирует в бензоле.
Схема
электролитической диссоциации: KA ![]() K+ (катион) + A-
(анион).
K+ (катион) + A-
(анион).
Уравнение диссоциации на примере хлорида натрия: NaCl ![]() Na+ + Cl-. Механизм электролитической
диссоциации
Na+ + Cl-. Механизм электролитической
диссоциации
При контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается.
Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na+ и анионами хлора Cl-, которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы.
Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным. Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором. Вещество диссоциирует на ионы.
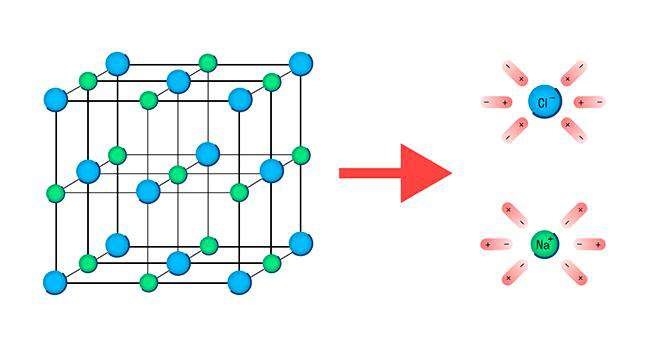
После распада хлорида натрия образовавшиеся ионы Na+ и Cl- окружают молекулы воды, создавая гидратную оболочку. Ионы с такой оболочкой называют гидратированными.
Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными.
Сущность процесса электролитической диссоциации передает схема:
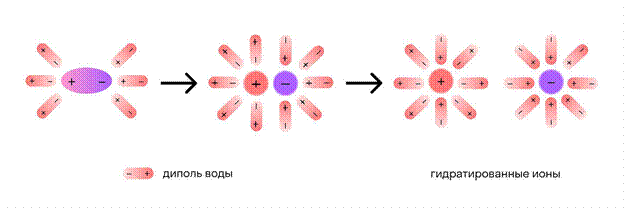
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
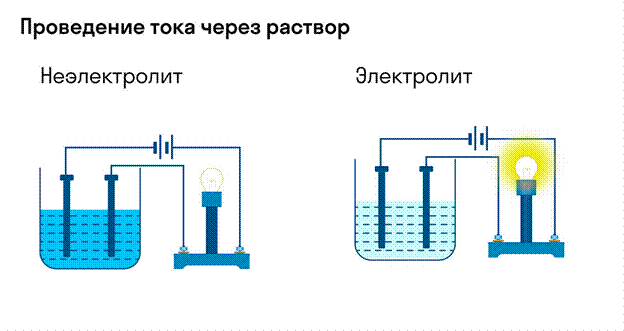
В отдельных случаях вещества расщепляются на ионы в несколько этапов или ступеней. Например, такая реакция характерна для основных и кислых солей, многоосновных кислот. Ступенчатая диссоциация может включать два этапа и более, при этом на первой ступени концентрация ионов всегда больше, чем на последующих.
Пример 1
Ортофосфорная кислота диссоциирует в 3 ступени. На первой из них наблюдается максимальная концентрация дигидрофосфат-ионов, а на последней остается минимальное количество фосфат-ионов (диссоциация почти не идет). Данная кислота не относится к сильным электролитам, поэтому реакция обратима.
H3PO4 ![]() H+ + H2PO4-
H2PO4-
H+ + H2PO4-
H2PO4- ![]() H+ + HPO42-
H+ + HPO42-
HPO42- ![]() H+ + PO43-
H+ + PO43-
Суммарное уравнение: H3PO4
![]() 3H+ + PO43-.
3H+ + PO43-.
Пример 2
Кислая соль Ca(HCO3)2 диссоциирует в 3 ступени. Поскольку это сильный электролит, на первом этапе реакция необратима. На втором этапе распадается на ионы слабый кислотный остаток HCO3- и слабый электролит, поэтому реакция обратима.
Ca(HCO3)2 = Ca2+ + 2HCO3-
HCO3- ![]() H+ + CO32-
H+ + CO32-
H+ + H2O = H3O+
Суммарное уравнение: Ca(HCO3)2 + 2H2O = Ca2+ + 2H3O+ + 2CO32-.
Как диссоциируют разные группы веществ
Диссоциация кислот
Приводит к образованию катионов водорода H+ и отрицательно заряженных кислотных остатков:
HCl = H+ + Cl-
H2SO4 = 2H+ + SO42-
HNO2 ![]() H+ + NO2-
H+ + NO2-
Многоосновные кислоты диссоциируют ступенчато:
AlOHCl2 = AlOH2+ + 2Cl- AlOH2+
![]() Al3+ + OH-
Al3+ + OH-
Диссоциация оснований
Происходит с образованием гидроксильных групп OH- и положительно заряженных ионов металла. Сильные электролиты в растворах диссоциируют полностью, а слабые — ступенчато и обратимо.
Сильные основания: NaOH = Na+ + OH- Слабые основания:
Cu(OН)2 ![]() CuOH+ + OH-
CuOH+
CuOH+ + OH-
CuOH+ ![]() Cu2+ + OH- Диссоциация
солей
Cu2+ + OH- Диссоциация
солей
Ведет к образованию катионов металлов (или катиона аммония) и отрицательно заряженных кислотных остатков.
Средние соли в растворах полностью распадаются в одну ступень. Na3PO4 = 3Na+ + PO43-
Кислые соли распадаются ступенчато. На первом этапе отделяются катионы металла, а на втором — катионы водорода.
KHSO4 = K+ + HSO4-
HSO4- ![]() H+ + SO42-
H+ + SO42-
Основные соли также диссоциируют в две ступени. На первой отделяются кислотные остатки, а за ними — гидроксильные группы OH-.
MgOHBr = MgOH+ + Br-
MgOH+ ![]() Mg2+ + OH-
Mg2+ + OH-
Молекулярное, полное и сокращенное ионные уравнения
С помощью молекулярных уравнений можно показать состав вещества с разложением его на молекулы. Полные ионные уравнения отражают реакцию диссоциации, т. е. расщепление молекул на ионы. Но в таком виде расписывают только сильные электролиты. Не раскладывают на ионы:
слабые электролиты;
осадки; газы.
Рассмотрим это на примере взаимодействия между нитратом свинца и серной кислотой.
Молекулярное уравнение: Pb(NO3)2 + H2SO4 → 2HNO3 + PbSO4↓
Сульфат свинца PbSO4 мы не будем раскладывать на ионы, поскольку это слабый электролит.
Полное ионное уравнение: Pb2+ + 2NO3- + 2H+ + SO42- → 2H+ + 2NO3- + PbSO4↓
Сократить это выражение очень просто — нужно убрать из обеих частей одинаковые ионы, которые не изменились в ходе реакции.
Сокращенное ионное уравнение: Pb2+ + SO42- → PbSO4↓
Как составить уравнение диссоциации
В левой части пишем молекулярную формулу вещества, а в правой — формулы образовавшихся катионов и анионов. Между ними ставим знак =, если это сильный электролит, или знак ⇄ — если средний или слабый. После этого нужно проставить коэффициенты перед ионами и проверить сумму катионов и анионов (она всегда равна 0).

Итак, мы разобрались, что такое диссоциация в химии, а сейчас повторим ключевые моменты:
1. При взаимодействии с водой или другими растворителями в электролитах разрывается химическая связь между частицами и они распадаются на ионы — происходит электролитическая диссоциация.
2. Под действием электротока катионы перемещаются к положительно заряженному электроду, анионы — к отрицательно заряженному. Раствор электролита обладает проводимостью.
3. Степень диссоциации зависит от типа электролита и от внешних условий. Для сильных электролитов она необратима, для слабых — это обратимая реакция.
4. Химические свойства электролитов соответствуют свойствам ионов, которые образовались при диссоциации.
ТЕМА 18. Степень диссоциации. Сильные и слабые электролиты. Диссоциация воды. Водородный показатель. Среда водных электролитов.
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
![]()
Например, если растворяли 50 молекул вещества, из них растворилось
40 молекул, причем продиссоциировало 10 молекул, то 0,25 ( 25%) 40 10 или
.
![]()
Если в растворе на ионы распадаются все 100% электролита, α=1 .
По силе электролиты делятся на следующие группы: слабые — α<30% ; средние — 30%<α<70% ; сильные — α>70% .
Различают сильные и слабые электролиты. Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы, к ним относятся:
• почти вcе растворимые соли;
• многие неорганические кислоты, например, H2SO4, HCl, HNO3;
• гидроксиды щелочных и щелочно-земельных металлов. Слабые электролиты при растворении в воде лишь частично диссоциируют на ионы.
К слабым электролитам относятся:
• большинство органических кислот, например СН3СООН;
• многие неорганические кислоты, например, H2CO3, H2S, HNO2, HClO, H3BO3, HCN;
• вcе гидроксиды металлов за исключением гидроксидов щелочных и щелочно-земельных металлов;
• некоторые органические соединения, например, фенолы и амины.

Электролиты
Электролиты - вещества, способные диссоциировать на ионы в водных растворах и расплавах.
Сильные электролиты:
• кислоты: H2SO4, HCl, HNO3, HClO4, HBr, HI, HCSN, HMnO4
• основания: LiOH, KOH, NaOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2,
Сильные кислоты и сильные основания диссоциируют в растворах на ионы полностью.
HCl = Н+ + Сl - KOH = K+ + OH - HNO3 = Н+ + NO3- NaOH = Na+ + OH -
Слабые электролиты:
• кислоты: H2SO3, H2СO3, HF, HNO2, HClO, H2S, CH3COOH, HCN.
• основания: NH4OH и все, кроме гидроксидов щелочных и щелочноземельных металлов.
Cлабые основания обычно не растворимы. NH4OH
исключение - слабое, неустойчивое: NH4OH ![]() NH3+H2O.
NH3+H2O.
ИОННОЕ ПРОИЗВЕДЕНИЕ ВОДЫ. ВОДОРОДНЫЙ
Очищенная от примесей вода обладает определенной незначительной электрической проводимостью, которая объясняется небольшой диссоциацией ее на ионы водорода и гидроксид-иона, т.е. Н2О является слабым электролитом. Процесс диссоциации воды часто записывают в простом виде: Н2О↔ Н + + ОН– .
Константа равновесия диссоциации воды может быть вычислена по уравнению
![]() , перепишем это
уравнение следующим образом:
, перепишем это
уравнение следующим образом:
[Н+] ∗ [ОН−] = Кв ∗ [Н2О].
Поскольку степень диссоциации воды мала, то концентрация недиссоциированных молекул Н2О равна общей концентрации воды
 (опытные данные).
(опытные данные).
Следовательно, [Н + ] ∙ [ОН– ] =1,8∙10-16 ∙ 55,56 = 10–14 .
Таким образом, ионное произведение воды Кв = [Н + ] ∙ [ОН– ] =10–14 .
Это постоянная величина при to =25oC не только для чистой воды, но и для разбавленных растворов электролитов.
При to =25oC в нейтральных растворах концентрация как ионов водорода, так и гидроксид-ионов равна 10-7 моль/л.
В кислых растворах больше концентрация ионов водорода, в щелочных – концентрация гидроксид-ионов.
Степень кислотности или щелочности раствора можно количественно охарактеризовать концентрацией ионов водорода:
нейтральный раствор [Н+ ]= 10-7 моль/л, кислый раствор [Н+ ]> 10-7 моль/л, щелочной раствор [Н+ ]< 10-7 моль/л.
Концентрацию ионов водорода удобнее выражать в логарифмической форме. Отрицательный десятичный логарифм концентрации ионов водорода называется водородным показателем и обозначается символом рН:
рН= - lg[Н+ ].
С помощью рН реакция растворов характеризуется так: нейтральная рН=7; кислая рН>7; щелочная рН<7. рН + рОН =14
Методы определения водородного показателя раствора
Характер среды (кислый, нейтральный или щелочной) определяют с помощью индикатора.
Индикаторы — вещества, которые изменяют окраску раствора при различных значениях pH.
Чтобы определить характер среды, в исследуемый раствор достаточно добавить несколько капель водно-спиртового раствора индикатора — и окраска последнего изменится.
На практике наиболее распространены несколько индикаторов:
метилоранж, лакмус и фенолфталеин. Окраска этих индикаторов в кислой, нейтральной и щелочной среде представлена в таблице:
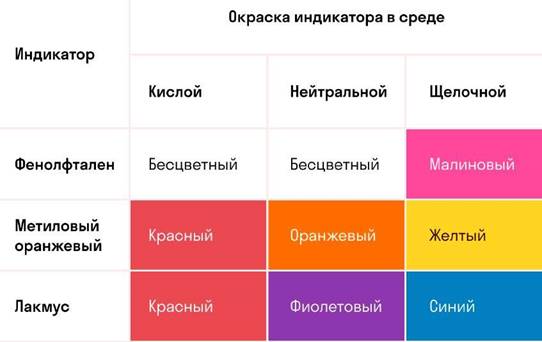
Определение pH среды с помощью индикатора — быстрый и наглядный метод, но для определения более точного значения pH используют универсальный индикатор.
Универсальный индикатор представляет собой смесь высушенных веществ, нанесенных на бумагу. С его помощью можно определить характер среды в широком диапазоне pH — от 1 до 14.
Для измерения водородного показателя pH на бумажную полоску наносят исследуемый раствор, а затем сравнивают цвет индикатора с эталонной шкалой.
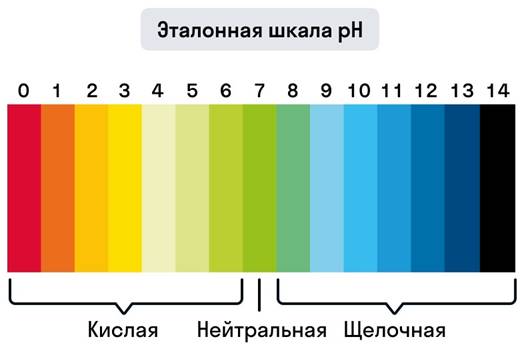
Задачи. №1.
Каково значение pH раствора,
концентрация ионов ![]() которого
которого
![]() равна
равна
Откуда
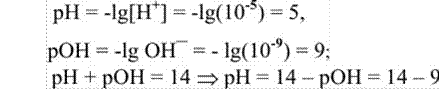
ТЕМА 19. Реакции обмена в водных растворах электролитов. Реакции обмена в водных растворах электролитов могут быть:
1) практически необратимыми, т. е. протекать до конца;
2) обратимыми, т. е. протекать одновременно в двух противоположных направлениях.
1) Реакции обмена между сильными электролитами в растворах протекают до конца, или практически необратимы, когда ионы соединяются друг с другом и образуют:
а) малорастворимые вещества;
б) малодиссоциирующие вещества — слабые электролиты;
в) газообразные или летучие вещества.
Рассмотрим эти случаи.
а) Реакции с образованием малорастворимых веществ, выпадающих в осадок (↓).
Составим молекулярное и ионное уравнения реакции между нитратом серебра (I) AgNO3 и хлоридом натрия NaCl:
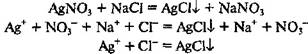
Эта реакция обмена необратима, потому что один из продуктов уходит из сферы реакции в виде нерастворимого вещества.
б) Реакции, идущие с образованием малодиссоциирующих веществ (слабых электролитов).
Составим молекулярное и ионное уравнения реакции нейтрализации между растворами гидроксида натрия NaOH и серной кислоты H2SO4:
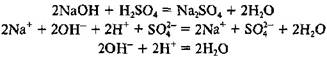
или, сокращая коэффициенты, получим: ОН— + Н+ = Н2О.
В результате реакции нейтрализации ионы водорода Н+ и гидроксидионы ОН— образуют малодиссоциирующие молекулы воды. Процесс нейтрализации идет до конца, т. е. эта реакция необратима.
в) Реакции, протекающие с образованием газообразных веществ.
Составим молекулярное и ионное уравнения реакции между растворами гидроксида кальция и хлорида аммония NH4Cl:
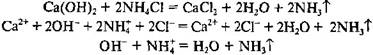
Эта реакция обмена необратима, потому что образуются газ аммиак NH3 и малодиссоциирующее вещество вода.
2) Если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, то такие реакции являются обратимыми, т. е. до конца не протекают. Например:
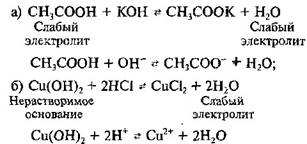
Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают. При смешивании их растворов образуется смесь ионов, которые не соединяются друг с другом. Например:
Если исходными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают. При смешивании их растворов образуется смесь ионов, которые не соединяются друг с другом. Например:
![]()
Уравнения таких реакций обмена не пишут.
Пример 1. Напишите уравнения реакций между растворами хлорида алюминия и гидроксидом калия в молекулярной и ионной формах.
Пример 2. Напишите уравнения реакций между растворами карбоната калия и соляной кислоты в молекулярной и ионной формах.
Пример 3. Выполните предложенные реакции. Пользуясь алгоритмом составления ионных уравнений реакций запиши молекулярное, полное и сокращенное ионное уравнение реакций между:
а) гидроксидом калия и азотной кислотой;
б) сульфатом меди и гидроксидом лития;
в) карбонатом калия и серной кислотой;
г) между нитратом бария и хлоридом кальция.
В каком случае реакция не идет до конца?
ТЕМА 20.Гидролиз солей. Гидролиз органических веществ (белков, жиров, углеводов).
Процесс растворения веществ в воде сопровождается химическим взаимодействием их молекул с молекулами воды.
Гидролизом называется взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды. В практике наиболее широко используется гидролиз солей.
Гидролиз солей – реакция ионного обмена между солью и водой с образованием соответствующих данной соли слабого основания либо слабой кислоты, в результате которой реакция среды раствора может отличаться от нейтральной.
В реакции гидролиза вступают соли, образованные:
1) сильной кислотой и сильным основанием (NaCl, KNO3);
2) сильным основанием и слабой кислотой (Na2CO3, K2S); 3) слабым основанием и сильной кислотой (ZnCl2, MgSO4); 4) слабым основанием и слабой кислотой ((NH4)2S, Pb(NO3)2.
1. Растворимые соли образованные сильным основанием и сильной кислотой в воде не гидролизуются. Их растворы имеют нейтральную реакцию среды (рН =7).
NaCl + Н2О = NaОН + НCl
Na++ Cl- + Н2О = Na++ Cl- + Н++ ОН-
Н2О = Н++ ОН-.
2. Растворимые соли образованные сильным основанием и слабой кислотой в водных растворах гидролизуются по аниону и их растворы имеют щелочную реакцию среды (рН <7).
KNO2+ Н2О = HNO2+ KOH
K+ + NO2- +Н2О = HNO2 + K+ + OH- NO2- +Н2О = HNO2 + OH-
В процессе реакции постепенно накапливаются ионы ОН-. Это приводит к образованию щелочной среды, рН<7.
Еще пример
Na2S + Н2О = H2S + NaOH
2Na+ + S2-+ Н2О =HS- + H+ + Na+ + OH-
HS- + Н2О = H2S + OH-
3. Растворимые соли, образованные слабым основанием и сильной кислотой, в водных растворах гидролизуются по каьиону. Их растворы имеют, кислую реакцию среды (рН >7).
NH4Cl + Н2О = NH4OH + HCl
NH4- + Cl-+ Н2О = NH4OH + H+ + Cl- NH4--+ Н2О = NH4OH + H+ + Cl-
Другой пример
Zn(NO3)2 + Н2О = Zn(OH)2 + 2HNO3
Zn(NO3)2 + Н2О = Zn(OH)2 + 2HNO3
Zn2+ + 2NO3-+ Н2О = ZnOH+ + H+ + NO3- ZnOH++ Н2О = Zn(OH)2 +H+
4. Гидролиз в растворах солей образованных слабой кислотой и слабым основанием, происходит в большей степени и по аниону и по катиону. При этом образуется слабые малорастворимые основания и слабые кислоты харатер среды в этом случае определяется относительной силой образовавшейся кислот и основания.
Соли образованных слабым нерастворимым или летучим основанием и слабой нерастворимой или летучей кислотой гидролизуются полностью и необратимо.
Продуктами гидролиза являются соответсвующие основание и соответствующая кислота.
Пример:
Al2S3 + 3H2O = 2 Al(OH)3↓ + 3H2S
Среди всего многообразия органических веществ способны гидролизоваться: галогенпроизводные алканов, сложные эфиры, алкоголяты, углеводы, белки жиры и нуклеиновые кислоты.
Высокомолекулярные вещества разлагаются водой до составляющих их мономеров, в более простых – происходит разрыв связей углерода с кислородом, галогенами, азотом, серой и другими заместителями.
Зачастую, органические соединения гидролизуются в присутствии кислот, щелочей или ферментов – кислотный, щелочной и ферментативный гидролиз.
Галогеналканы подвергаются гидролизу в щелочной среде, при этом происходит образование спиртов. Рассмотрим на примере хлорпентана и хлорфенола:
C5H11Cl + H2O (NaOH) → C5H11OH; C6H5Cl + H2O (NaOH) → C6H5OH.
Сложные эфиры гидролизуются до образующих их карбоновых кислот и спиртов. Рассмотрим на примере метилового эфира уксусной кислоты (метилацетата):
CH3COOCH3 + H2O ↔ CH3COOH + CH3OH
Алкоголяты – производные спиртов, пригидролизераспадаютсянасоответствующийспиртищелочь. Рассмотрим на примере алкоголята натрия:
C2H5ONa + H2O ↔ C2H5OH + NaOH
Углеводы гидролизуются начиная с дисахаридов. Рассмотрим на примере сахарозы:
C12H22O11 + H2O → C6H12O6 (глюкоза) + C6H12O6 (фруктоза)
Белки и полипептиды частично подвергаются гидролизу, в ходе которого образуются аминокислоты:
CH2(NH2)-CO-NH-CH2-COOH + H2O ↔ 2CH2(NH2)-COOH
При гидролизе жиров можно получить смесь высших карбоновых кислот и глицерин:
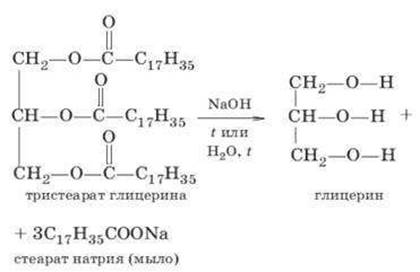
Нуклеиновые кислоты гидролизуются в несколько этапов. Сначала получаются нуклеотиды, затем нуклеозиды, а после этого пуриновые или пиримидиновые основания, ортофосфорная кислота и моносахарид (рибоза или дезоксирибоза).
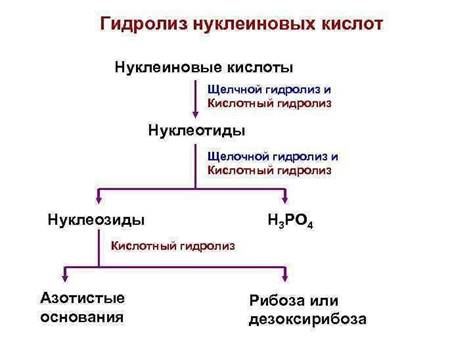
ТЕМА 21. Окислительно-восстановительные реакции, основные понятия, типы реакций, составление уравнений.
Все химические реакции можно разделить на два типа. К первому из них относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ. Например:
H+N+5O3-2+ Na+O-2H+ = Na+ N+5O3-2+ H+ O-2H+
Как видно. Степень окисления каждого из атомов до и после реакции осталась без изменения.
Ко второму типу относятся реакции с изменением степени окисления атомов реагирующих веществ. Например:
2K+Cl+5O3-1 = 2K+1 Cl-1 + 3O20
2K+Br-1 + Cl20 = Br20 + 2K+1Cl-1
Здесь в первой реакции атомы хлора и кислорода, а во второй – атомы брома и хлора изменяют степень окисления.
Реакции протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ, называются окислительновосстановительными.
Изменение степени окисления связано с оттягиванием или перемещением электронов.
Рассмотрим основные положения теории окислительновосстановительных реакций.
1. Окислением называется процесс отдачи электронов атомов, молекулой или ионом. Например:
Al -3e = Al3+ Fe2+ - e = Fe3+ H2 -2e = 2H+ 2Cl- -2e = Cl2
При окислении степень окисления повышается.
2. Восстановлением называется процесс присоединени электронов атомов, молекулой или ионом. Например:
S +2e = S2- Cl2 + 2e = 2Cl- Fe3+ + e = Fe2+
При восстановлении степень окисления понижается.
3. Атомы, молекулы и ионы, отдающие электроны, называются восстановителями. Во время реакции они окисляются. Атомы, молекулы и ионы, присоединяющие электроны, называются окислителями. вовремя реакции они восстанавливаются. Так, как атомы, молекулы и ионы входят в состав определенных веществ, то и эти вещества соответственно называются восстановителями или окислителями.
4. Окисление всегда сопровождается восстановлением, и наоборот, восстановление всегда связано с окислением, что можно выразить уравнениями:
Восстановитель – е ↔ Окислитель
Окислитель + е ↔ Восстановитель
Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположенных процессов – окисления и восстановления.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Восстановители и окислители могут быть как простыми веществами,
т.е. состоящими из одного элемента и сложными.
В соответствии с их местом в периодической системе элементов атомы большинства металлов содержат на внешнем энергетическом уровне 1-2 электрона. Поэтому в химических реакциях они отдают валентные электроны, т.е. окисляются. Металлы обладают восстановительными свойствами.
В периодах с повышением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные возрастают и становятся максимальными у галогенов. Так, например, в восьмом периоде натрий – самый активный в периоде восстановитель, а хлор – самый активный в периоде окислитель.
У элементов главных подгрупп с повышением порядкового номера усиливаются восстановительные свойства и ослабевают окислительные.
Лучшие восстановители – щелочные металлы, а наиболее активные из них франций (Fr) и цезий (Cs). Лучшие окислители – галогены. Элементы главных подгрупп IV – VII групп (неметаллы) могут отдавать, так и принимать электроны и проявлять восстановительные и окислительные свойства. Исключение составляет фтор. Он проявляет только окислительные свойства, т.к. обладает набольшей относительной электроотрицательностью.
Элементы побочных подгрупп (четные ряды больших периодов) имеют металлический характер, т.к. на внешнем уровне их атомов содержится 12электрона. Поэтому их простые вещества являются восстановителями. Т.о. в отличие от простых веществ металлов, выступающих в роли восстановителей, простые вещества – неметаллы проявляют себя и как окислители, и как восстановители.
Окислительные или восстановительные свойства сложных веществ зависят от степени окисления атома данного элемента. Например, KMn+7O4, Mn+4O2, Mn+2SO4. В первом соединении марганец имеет максимальную степень окисления и не может ее больше повышать. Он может только принимать электроны, а значит, KMnO4 может быть только окислителем. В третьем соединении у марганца низшая степень окисления – оно может быть только восстановителем. Во втором соединении марганец с промежуточной степенью окисления (+4), а поэтому оно может быть и восстановителем и окислителем; все зависит от условий протекания реакции и веществ, с которыми будут взаимодействовать MnO2.
Сложные анионы, содержащие атомы с высокой степенью окисления, также являются окислителями. Например, N+5O3, Mn+7O4-, Cr2+6O7-2, Cl+5O3-,
Cl+7O4- и др. Окислительные свойства обуславдивает не атом с высокой степенью окисления, а весь анион, например, не Mn+7, а весь анион MnO4-.
Элементарные анионы проявляют только восстановительные свойства.
Например, F-, Cl-, Br-, I-, S2- и др.
Важнейшие восстановители и окислители.
|
Восстановители |
Окислители |
|
Металлы, водород, уголь |
Галогены |
|
Оксид углерода (II) СО |
Перманганат калия KMnO4, манганат калия K2MnO4, оксид марганца (IV) MnO2 |
|
Сероводород Н2S, оксид серы (IV) SO2, сернистая кислота Н2SO3 и ее соли |
Дихромат калия K2Cr2O7, хромат калия K2CrO4 |
|
Иодоводородная кислота HI, бромоводородная кислота HBr, соляная кислота HCl |
Азотная кислота HNO3 |
|
Хлорид олова (II) SnCl2, сульфат железа (II) FeSO4,сульфат марганца (II) MnSO4, сульфат хрома (III) Cr2(SO4)3 |
Кислород О2, озон О3, пероксид водорода Н2О2 |
|
Азотистая кислота HNO2, аммиак NH3, гидразин N2H4, оксид азота (II) NO |
Серная кислота H2SO4 (конц.), селеновая кислота H2SeO4, |
|
Фосфористая кислота H3PO3 |
Оксид меди (II) CuO, оксид серебра(I) Ag2O, оксид свинца (IV) PbO2 |
|
Альдегиды, спирты, муравьиная и щавелевая кислоты, глюкоза |
Ионы благородны металлов (Ag+, Au3+ и др.) |
|
Катод при электролизе |
Хлорид железа (III) FeCl3 |
|
|
Гипохлориды, хлораты и перхлораты |
|
|
Царская водка, смесь концентрированных азотной и плавиковой кислот |
|
|
Анод при электролизе |
Составление уравнений окислительно-восстановительных реакций.
Применяются два метода составления уравнений окислительновосстановительных реакций – метод электронного баланса и метод полуреакций.
Метод электронного баланса. В этом методе сравнивают степени окисления атомов в исходных и конечных еществах, руководствуясь правилом: число электронов, отданных восстановителем, должно равняться числу электронов, присоединенных окислителем. Для составления уравнения надо знать формулы реагирующих веществ и продуктов реакции. Последние определяются либо опытным путем, либо на основ известных свойств элементов. Рассмотрим применение этого метода на примерах:
Пример 1. Составление уравнения реакции меди с раствором нитрата палладия (II). Запишем формулы исходных веществ и конечных веществ реакции и покажем изменения степеней окисления.
Cu0 + Pd+2(NO3)2 = Cu+2(NO3)2 + Pd0
Медь образует ион меди, отдает два электрона, ее степень окисления повышается от 0 до +2. Медь – восстановитель. Ион палладия, присоединяя два электрона, изменяет степень окисления от +2 до 0. Нитрат палладия (II) – окислитель. Эти изменения можно выразить электронными уравнениями
Cu0 - 2е = Cu+2│1 -восстановитель, окисление
Pd+2 + 2е = Pd0│1- окислитель, восстановление
Из которых следует, что при восстановителе и окислителе коэффициенты равны 1. Окончательное уравнение:
Cu + Pd(NO3)2 = Cu(NO3)2 + Pd Как видно, в суммарном уравнении реакции электроны не фигурируют.
Чтобы проверить правильность составленного уравнения, подсчитываем число атомов каждого элемента в ео правой и левой частях. Например, в правой части 6 атомов кислорода, в левой также 6 атомов; палладия 1 и 1; меди тоже 1 и 1. Значит, уравнение составлено правильно.
Переписываем это уравнение в ионной форме:
Cu + Pd+2 +2NO3- = Cu+2 + NO3- + Pd
И после сокращения одинаковых ионов получим
Cu + Pd+2 = Cu+2 + Pd
Пример 2. Составление уравнения реакции взаимодействия оксида марганца (IV) с концентрированной соляной кислотой (с помощью этой реакции в лабораторных условиях получают хлор).
Запишем формулы исходных и конечных веществ реакции: НCl + MnO2→ Cl2 + MnCl2 + H2O
Покажем изменение степеней окисления атомов до и после реакации: НCl-1 +Mn+4O2→ Cl20 + Mn+2Cl2 + H2O
Эта реакция окислительно-восстановительная, т.к. изменяются степени окисления атомов хлора и марганца. НCl – восстановитель, MnO2 – окислитель. Составляем электронное уравнение:
2 Cl-1 -2е = Cl2 │1- восстановитель, окисление
Mn+4 +2е = Mn+2│1- окислитель, восстановление
и находим коэффициенты при восстановителе и окислителе. Они соответственно равны 2 и 1. Коэффициент 2 (а не 1) становится потому, что 2 атома хлора со степенью окисления -1 отдают 2 электрона. Этот коэффициент уже стоит в электронном уравнении:
2НCl +MnO2→ Cl2 + MnCl2 + H2O
Находим коэффициенты для других реагирующих веществ. Из электронных уравнений видно, что на 2 моль НCl приходится 1 моль MnO2. Однако учитывая, что для связывания образующегося двухзарядного иона марганца нужно еще 2 моль кислоты, перед восстановлением следует поставить коэффициент 4. Тогда воды получается 2 моль. Окончательное уравнение имеет вид:
4НCl +MnO2→ Cl2 + MnCl2 + 2H2O
Проверка правильности написания уравнения можно ограничить подсчетом числа атомов одного какого-либо элемента, например хлора: в левой части 4 и в правой 2+2=4.
Перепишем составленное уравнения получим:
4Н+ +4Cl- +MnO2→ Cl2 + Mn2+ + 2Cl- + 2H2O
4Н+ +2Cl- +MnO2→ Cl2 + Mn2+ + 2H2O
Пример 3. Составление уравнения реакции взаимодействия сероводорода с подкисленным раствором перманганата калия.
Напишем схему реакции – формулы исходных и полученных веществ: H2S-2 + KMn+7O4 + H2SO4 → S0 + Mn+2SO4 + K2SO4 + H2O
Изменяются степени окисления у атомов серы и марганца (H2S – восстановитель, KMnO4 - окислитель). Составляем электронные уравнения, т.е. изображаем процессы отдачи и присоединения электронов:
S-2 – 2e = S │5- восстановитель, окисление
Mn+7 + 5е = │2 - окислитель, восстановление
И наконец находим коэффициенты при окислителе и восстановителе, а затем при других реагирующих веществах. Из электронных уравнений видно, что надо взять 5 моль H2S и 2 моль KMnO4, тогда получим 5 моль атомов S и 2 моль MnSO4. Кроме того, из сопоставления атомов в левой и правой частях уравнения, найдем, что образуется также 1 моль K2SO4 и 8 моль воды. Окончательное уравнение реакции будет иметь вид
5H2S + 2KMnO4 + 3H2SO4 → 5S + 2MnSO4 + K2SO4 + 8H2O
Правильность написания уравнения подтверждается подсчетом атомов одного элемента, например кислорода; в левой части их 2*4+ 3*4=20 и в правой части 2*4+4+8=20.
Переписываем уравнение в ионной форме:
5H2S + 2MnO4- + 6H+ → 5S + 2Mn2+ + 8H2O Метод полуреакций, или ионно-электронный метод. Как показывает само название, этот метод основ на составлении ионных уравнений для процесса окисления и процесса восстановления с последующим суммированием их в общее уравнение. В качестве примера составим уравнение той же реакции, которую использовали при объяснении метода электронного баланса (см. пр.3). при пропускании сероводорода H2S через подкисленный раствор перманганата калия KMnO4 малиновая окраска исчезает и раствор мутнеет. Опыт показывает, что помутнее раствора происходит в результате образования элементарной серы, т.е. протекания процесса:
H2S→ S + 2Н+
Эта схема уравнения по числу атомов. Для уравнения по числу зарядов надо от левой части схемы отнять два электрона, после чего можно стрелку заменить на знак равенство:
H2S – 2е = S + 2Н+- восстановитель, окисление
Это первая полуреакция – процесс окисления восстановителя H2S.
Обесцвечивание раствора связано с переходом иона MnO4- (он имеет малиновую окраску в ион ) Mn2+ (практически бесцветный и лишь при большой концентрации имеет слабо-розовую окраску), что можно выразить схемой
MnO4-→ Mn2+
В кислом растворе кислород, входящий в состав ионов MnO4-, вместе с ионами водорода в конечном итоге образует воду. Поэтому процесс перехода записываем так:
MnO4- + 8Н+→ Mn2+ + 4H2O
Чтобы стрелку заменить на знак равенства, надо уравнять и заряды. Поскольку исходные вещества имеют семь положительных зарядов (+7), а конечные – два положительных (2+), то для выполнения условий сохранения зарядов надо к левой части схемы прибавить пять электронов:
MnO4- + 8Н++ 5е = Mn2+ + 4H2O- окислитель, восстановление
Это вторая полуреакция – процесс восстановления окислителя, т.е. перманганат – иона MnO4-.
Для составления общего уравнения реакции надо уравнения полуреакций почленно сложить, предварительно уравняв числа отданных и полученных электронов. В этом случае по правилам нахождения наименьшего кратного определяют соответствующие множители, на которые умножаются уравнения полуреакций. Сокращенно запись проводится именно так:
H2S – 2е = S + 2Н+ │5 - восстановитель, окисление
MnO4- + 8Н++ 5е = Mn2+ + 4H2O │2- окислитель, восстановление
5H2S + 2 MnO4- + 16Н+ = 5S +10Н++ 2Mn2+ + 8H2O
И сократив на 10Н+, окончательно получим
5H2S + 2 MnO4- + 6Н+ = 5S + 2Mn2+ + 8H2O Проверяем правильность составленного в ионной форме уравнения:
Число атомов кислорода в левой части 8; число зарядов: в левой части (2-) + (6+) = 4+, в правой 2(2+)=4+. Уравнение составлено правильно, так как атомы т заряды уравнены.
Методом полуреакций составляется уравнение реакции в ионной форме. Чтобы от него перейти к уравнению в молекулярной форме, поступаем так: в левой части ионного уравнения к каждому аниону подбираем соответствующий катион, а к каждому катиону – анион. Затем те же ионы в таком же числе записываем в правую часть уравнения, после чего ионы объединяем в молекулы:
5H2S + 2 MnO4- + 6Н+ = 5S + 2Mn2+ + 8H2O 2К++3SO42-=2К++SO42____________________________________
5H2S + 2 КMnO4-+ 3НSO4 = 5S + 2MnSO4 + КSO4 + 8H2O
Таким образом, составление уравнений окислительно-
восстановительных реакций с помощью метода полуреакций приводит к тому результату, что и метод электронного баланса. Влияние среды на характер протекания реакций. Реакции окисления – восстановления могут протекать в различных средах: в кислой (избыток Н+- ионов), нейтральной (Н2О) и щелочной (збыток гидроксид-ионов ОН-). В зависимости от среды может изменятьс характер протекания реакций между одними теми же веществами. Среда влияет на изменение степеней окисления атомов. Так, например, ион MnO4- в кислой средетвосстанавливается до Mn2+, а нейтральной – до MnO2, а в щелочной – до MnO4-.
Руководствуясь приведенной схемой, составим методом полуреакций уравнения реакции взаимодействия сульфита натрия Na2SO3
(восстановитель) с перманганатом калия КMnO4- (окислитель)в различных средах
Схема
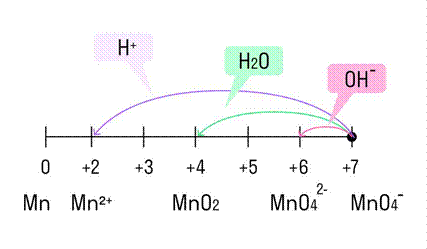
Пример1. В кислой среде.
Na2SO3 + КMnO4 + Н2SO4 = Na2SO4 +MnSO4 + К2SO4 + Н2О
SO32- + Н2О -2е = SO42- + 2Н+ │5- восстановитель, окисление
MnO4- + 8 Н+ +5е → Mn2+ + 4Н2О │2 - окислитель, восстановление
3SO32- +2 MnO4- + 6Н+ = 5SO42- + 2 Mn2+ + 3Н2О или
5Na2SO3 + 2КMnO4 + 3Н2SO4 = 5Na2SO4 +2MnSO4 + 3Н2О
Пример2. В нейтральной или слабощелочной среде
Na2SO3 + КMnO4 + Н2О = Na2SO4 +MnO2 + К2SO4 + КОН
SO32- +Н2О – 2е = SO42- + 2Н+ │3- восстановитель, окисление
MnO4- + 2 Н2О + 3е = MnO2 + 4ОН-│2- окислитель, восстановление
3SO32- +2 MnO4- + Н2О = 3SO42- + 2 MnO2 + 2ОН- или
2Na2SO3 + 2КMnO4 + Н2О = 2Na2SO4 +2MnO2 + 2КОН
Пример3. В сильнощелочной среде
Na2SO3 + КMnO4 + NaОН = Na2SO4 + К2MnO4 + Na2MnO4+ Н2О
SO32- + MnO4- + 2ОН- -2е = SO42- + Н2О│1- восстановитель, окисление
MnO4- + е = MnO42- │2- окислитель, восстановление
SO32- + 2MnO4- + 2ОН- = SO42- + MnO42-+ Н2О
Na2SO3 + 2КMnO4 + 2NaОН = Na2SO4 + К2MnO4 + Na2MnO4+ Н2О
Классификация окислительно-восстановительных реакций.
Обычно различают три типа окислительно-восстановительных реакций: межмолекулярные, внутримолекулярные и реакции диспропорционирования.
К межмолекулярным относятся реакции, в которых окислитель и влсстановитель находятся в разных веществах. Сюда относятся все предыдущие уравнения, следует и отнести также и реакции между разными веществами, в которых атомы одного и того же элемента имеют различные степени окисления:
H2S-2 + Н2S+4O4 = 2S0 + 3H2O2
5HCl + HCl+5O3 = 3Cl2 + 3H2O
К внутримолекулярным относятся такие вещества, в которых окислитель и восстановитель находятся в одном и том же веществе. В этом случае атом с более положительной степенью окисления окисляет атом с меньшей степенью окисления. Такими реакциями являются реакции термического разложения. Например.
2NaN+5O3-2 = 2NaN+3O2 + O20
2KCl+5O3-2 = 2KCl-1 + 3O20
(N-3H4)2Cr2+6O7 = N20 + Cr2+3O3 + 4H2O
Сюда же следует отнести и разложение веществ, в которых атомы одного и того же элемента имеют разные степени окисления:
N-3H4N+3O2 = N20 + 2H2O
N-3H4N+3O2 = N2+1O + 2H2O
Протекание реакций диспропорционирования сопровождается одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента. При этом исходное вещество образует соединения, одно из которых содержит атомы с более высокой , а другое с более низкой степенями с промежуточной степенью окисления. Примером может служить превращение манганата калия К2MnO4, в котором марганец имеет промежуточную степень окисления +6 (в примере между +7 и +4). Протекает реакция
3К2MnO4 + 2H2O = 2 КMnO4 + MnO2 + 4КОН
Mn+6 - 1e = Mn+7 │2- восстановитель, окисление
Mn+6 + 2e = Mn+4 │1- окислитель, восстановление
К реакциям диспропорционирования относятся и такие часто встречающиеся реакции, как
3HN+3O2 = 3HN+5O3 + 2N+2O + H2O Cl20 + H2O ↔ HCl+1O + HCl-1/
ТЕМА 22. Химические источники тока. Электролитические потенциалы. Ряд стандартных электродных потенциалов.
Рассмотрим знакомую нам окислительно-восстановительную реакцию. В раствор сульфата двухвалентной меди опустим цинковую пластинку. Со временем на поверхности цинка образуется красноватая пленка кристаллической меди. Синяя окраска раствора постепенно ослабевает. Это говорит о том, что протекает химическая реакция. CuSO4 + Zn = ZnSO4 + Cu
Cu2+ + Zn = Zn2+ + Cu
Молекулы воды отрывают ион цинка. Отдавая электроны, цинк является восстановителем. Ион меди – окислитель - принимает электроны.
Электроны передаются от цинка к меди в месте соприкосновения металлов.
Zn – 2e = Zn2+
Cu2+ + 2e = Cu
Давайте немного изменим условия проведения реакции. Цинковую пластинку опустим в сосуд с раствором сульфата цинка. Медную поместим в другой сосуд с раствором сульфата меди. Соединим пластинки с помощью металлического проводника. Теперь на цинковой пластинке идет окисление атомов цинка, а на медной восстанавливаются ионы меди. Электроны для их восстановления передаются теперь не напрямую, а по проводнику. Направленное движение электронов по этой внешней цепи и есть не что иное, как электрический ток.
Таким образом, произошло превращение энергии, полученной в результате химической реакции в электрическую. Устройство, в котором это осуществилось, получило название гальванический элемент.
Металлические пластинки или стержни называются электродами. Электроны перемещаются по внешней цепи от анода (цинка) к катоду (меди).
Образовавшиеся на аноде ионы цинка выходят в раствор и придают ему избыточный положительный заряд. В это же время у катода катионы меди восстанавливаются (принимают электроны), а оставшиеся в растворе анионы SO42- заряжают раствор отрицательно. Это препятствует дальнейшему течению процесса.
Чтобы не допустить этого, соединим сосуды стеклянной трубкой, которую заполним раствором хлорида калия с желатином. Теперь анионы будут двигаться в сторону цинка, а катионы – наоборот. Так будет поддерживаться электронейтральность растворов.
Гальванический элемент будет продолжать работу до полного растворения цинкового электрода или до восстановления всех ионов меди.
Впервые установку, в которой химическая реакция породила электрический ток, собрал Алессандро Вольта в 1800 году. Название «гальванический элемент» она получила позднее.
Теперь наука, которая изучает химические процессы, проходящие под действием электрического тока, а также процессы, в результате которых энергия химических реакций преобразуется в электрическую энергию, называется электрохимия.
Химические источники тока применяются очень широко. Знакомые нам «батарейки» - это разные варианты гальванических элементов. К сожалению, разрядившаяся батарейка уже не может быть восстановлена.
Этого недостатка лишены аккумуляторы, которые тоже представляют собой химические источники тока. Они устроены так, что израсходовав в процессе работы материалы электродов и электролит, способны вновь восстановить рабочие свойства после зарядки.
В свинцовом аккумуляторе чередуются решетчатые пластины, заполненные губчатым свинцом и диоксидом свинца. Электролитом служит серная кислота. Во время работы аккумулятора металлический свинец окисляется, а диоксид свинца восстанавливается.
Pb + SO42- - PbSO4 + 2e-
PbO2 + SO42- + 4H+ + 2e- = PbSO4 + 2H2O
Когда аккумулятор заряжают, то подключают его таким образом, чтобы ток шёл в направлении, противоположном тому, в котором двигались электроны во время работы. Благодаря этому, процессы окисления и восстановления на электродах поворачивают вспять. Теперь протекают обратные реакции, в результате которых снова появляются свинец, диоксид свинца и серная кислота.
разрядка
Pb + PbO2 + 2H2SO4 ![]() 2PbSO4 + 2H2O зарядка
2PbSO4 + 2H2O зарядка
Аккумулятор снова готов к работе.
Еще один источник преобразования химической энергии в электрическую – топливный элемент. Он подобен гальваническому элементу с той лишь разницей, что реагенты постоянно поступают в него извне. Поэтому он не разряжается и не требует электричества для повторной зарядки. Примером может служить водородный топливный элемент, перспективный для водородной энергетики.
Ряд стандартных электродных потенциалов
Вернемся к электродам и посмотрим поближе, что происходит там, где металл граничит с раствором.
Молекулы воды поляризованы и способны отрывать ионы металла. Удерживающиеся на поверхности электроны образуют отрицательно заряженный слой. К нему притягиваются из раствора катионы, образуя второй слой - положительный. Возникающую в двойном слое разность потенциалов называют электродным потенциалом, но определить его величину напрямую невозможно.
Однако есть такой электрод, которым пользуются для сравнения электродных потенциалов разных металлов. Он сделан из платины, но называется водородным, потому что водород пропускается через кислоту, в которой находится электрод. Благодаря платине, выступающей как катализатор, часть молекул водорода распадаются на атомы, которые окисляются на границе с кислотой. Одновременно идет и обратная реакция.
H2 ![]() 2H+ + 2e
2H+ + 2e
Разность потенциалов, возникающая в двойном электрическом слое водородного электрода, условно принимается за ноль.
Потенциал металла, измеренный относительно стандартного водородного электрода при концентрации ионов металла 1 моль/л и температуре раствора, равной 25 оС, называют стандартным электродным потенциалом металла.
Соберём гальванический элемент, соединив электрод из исследуемого металла со стандартным водородным электродом. Электролитом для металлического электрода послужит раствор соли этого металла, а для водородного, как всегда, кислота.
Зная, что электродвижущая сила вычисляется как разность потенциалов двух электродов, и, подставив ноль в случае водородного электрода, мы видим, что измеренная ЭДС и будет потенциалом исследуемого электрода.
Металлы, расположенные в порядке возрастания значений их стандартных потенциалов, составляют электрохимический ряд напряжений металлов или ряд стандартных электродных потенциалов. Еще одно название – ряд активности металлов.
Имея в своем распоряжении ряд напряжений, мы можем характеризовать химические свойства металлов:
1. Чем меньше значение электродного потенциала металла, тем больше его восстановительная способность;
2. Каждый металл, начиная с магния, вытесняет все следующие за ним металлы из растворов их солей (это касается металлов, не взаимодействующих с водой);
3. Металлы, стоящие в ряду напряжений до водорода, вытесняют его из разбавленных кислот (кроме азотной).
ПРИМЕРЫ И РАЗБОР РЕШЕНИЯ ЗАДАНИЙ
1. Решение задачи на использование электрохимического ряда напряжений металлов
Условие задачи: Учитель загадал металл и дал ученикам три подсказки:
• из соли ртути он вытеснит ртуть;
• но не вытеснит водород из растворов кислот;
• вам отгадать поможет вполне таблица, висящая на стене.
- Конечно, это ___, - засмеялись ученики, - только один металл подходит под ваше описание.
Вставьте в текст название металла.
Шаг первый: из таблиц выбираем «Электрохимический ряд напряжений металлов»
Шаг второй: находим металлы левее ртути, т.к. они вытесняют ртуть из растворов солей.
Шаг третий: из выбранных металлов находим те, что расположены правее водорода, т.к. они не вытесняют водород из растворов кислот. Этим условиям отвечает только один металл – медь. Ответ: Cu
2. Решение задачи на расчеты по уравнению реакции
Условие задачи: Мастер решил покрыть железную фигурку слоем меди и поместил её в сосуд с раствором медного купороса. Он знал, что на изготовление фигурки было использовано ровно 120 г железа. Когда мастер достал фигурку из раствора, её масса оказалась уже 121,56 г. Сколько граммов меди осело на фигурке?
Шаг первый: Запишем уравнение реакции CuSO4 + Fe = FeSO4 + Cu Шаг второй: Выразим массу железа через массу меди.
Из уравнения реакции следует, что количество вещества выделившейся меди равно количеству вещества прореагировавшего железа m(Fe)/M(Fe) = m(Cu)/M(Cu) m(Fe)/56 = m(Cu)/64, тогда m(Fe) = 56m(Cu)/64 Шаг третий: Рассчитаем массу меди.
Так как масса пластинки уменьшилась на величину массы прореагировавшего железа и увеличилась на величину массы выделившейся меди, можно записать равенство: 120 – m(Fe) + m(Cu) = 121,56 m(Cu) – m(Fe) = 1,56 m(Cu) - 56m(Cu)/64 = 1,56
0,125m(Cu) = 1,56
m(Cu) = 12,48 г
Ответ: 12,48 ТЕМА 23.Электролиз растворов и расплавов.
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды:
катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Виды электролиза Различают два вида электролиза:
Электролиз расплава.
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−)
Катион принимает электроны и восстанавливается:
Me+n + ne− → Me0 (восстановление).
Процесс на аноде A (+)
Анион отдает электроны и окисляется: неMe−n − ne− → неMe0 (окисление).
Процессы, протекающие при электролизе в общем случае: К− : Ме+n + ne− → Ме0;
А+ : неМе−n − ne− → неМе0.
Суммарное уравнение электролиза:
![]()
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К−: 2Na+ + 2e− = 2Na0
А+: 2Cl− − 2e− = Cl2
эл.ток
Суммарное уравнение электролиза: 2Na+ + 2Cl- → 2Na0 + Cl2
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
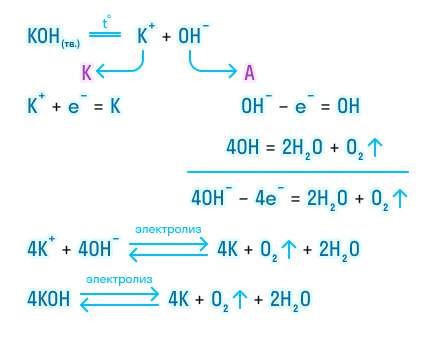
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H+ и OH- как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К−: 4H2O + 4e− = 2H20 + 4OH− А+: 2H2O − 4e− = O2 + 4H+
эл.ток
Суммарное уравнение электролиза: 2H2O →2H2↑ + O2↑
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза.
Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.

Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:

Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:
Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксидионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.

Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
ТЕМА 24. Классификация металлических соединений. Металлы положение в Периодической системе и особенности строения кристаллов и металлическая связь. Общие физические свойства металлов.
Металлы (от лат. metallum — шахта, рудник) — группа элементов, в виде простых веществ обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Из 118 химических элементов, открытых на данный момент (из них не все официально признаны), к металлам относят:
1) 6 элементов в группе щелочных металлов,
2) 6 в группе щёлочноземельных металлов,
3) 38 в группе переходных металлов,
4) 11 в группе лёгких металлов,
5) 7 в группе полуметаллов,
6) 14 в группе лантаноиды + лантан,
7) 14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний,
8) вне определённых групп бериллий и магний.
Таким образом, к металлам, возможно, относится 96 элементов из всех открытых.
Положение металлов в периодической системе
Если в таблице Д. И. Менделеева провести диагональ от бора к астату, то в главных подгруппах под диагональю окажутся атомы-металлы, а в побочных подгруппах все элементы ― металлы. Элементы, расположенные вблизи диагонали, обладают двойственными свойствами: в некоторых своих соединениях ведут себя как металлы; в некоторых ― как неметаллы.
В периодах и главных подгруппах действуют закономерности в изменении металлических свойств.
Атомы многих металлов имеют 1, 2 или 3 валентных электрона, например:
Na (+ 11): 1S2 2S22p6 3S1
Са (+ 20): 1S2 2S22p6 3S23p63d0 4S2
Щелочные металлы (1 группа, главная подгруппа): ...nS1.
Щелочно-земельные (2 группа, главная подгруппа): ...nS2.
Свойства атомов–металлов находятся в периодической зависимости от их местоположения в таблице Д. И. Менделеева.
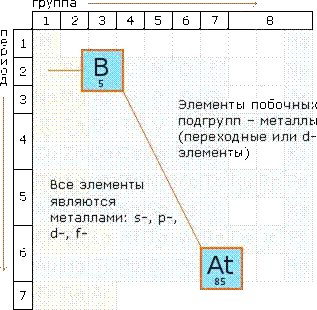
В ГЛАВНОЙ ПОДГРУППЕ:
• Число электронов на внешнем слое не изменяется.
• Радиус атома увеличивается Электроотрицательность уменьшается.
• Восстановительные свойства усиливаются.
• Металлические свойства усиливаются.
В ПЕРИОДЕ:
• Заряды ядер атомов увеличиваются.
• Радиусы атомов уменьшаются.
• Число электронов на внешнем слое увеличивается.
• Электроотрицательность увеличивается.
• Восстановительные свойства уменьшаются.
• Металлические свойства ослабевают.
Большинство твердых веществ существует в кристаллической форме:
их частицы расположены в строгом порядке, образуя регулярную пространственную структуру ― кристаллическую решетку.
Кристалл ― твердое тело, частицы которого (атомы, молекулы, ионы) расположены в определенном, периодически повторяющемся порядке (в узлах). При мысленном соединении узлов линиями образуется пространственный каркас ― кристаллическая решетка.
Кристаллические структуры металлов в виде шаровых упаковок

Атомы металлов стремятся отдать свои внешние электроны. В куске металла, слитке или металлическом изделии атомы металла отдают внешние электроны и посылают их в этот кусок, слиток или изделие, превращаясь при этом в ионы. «Оторвавшиеся» электроны перемещаются от одного иона к другому, временно снова соединяются с ними в атомы, снова отрываются, и этот процесс происходит непрерывно. Металлы имеют кристаллическую решетку, в узлах которой находятся атомы или ионы (+); между ними находятся свободные электроны (электронный газ). Схему связи в металле можно отобразить так: М0 ↔ nē + Мn+, атом ― ион
где n ― число внешних электронов, участвующих в связи (у Na ― 1 ē,
у Са ― 2 ē, у Al ― 3 ē).
Наблюдается этот тип связи в металлах ― простых веществахметаллах и в сплавах.
Металлическая связь ― это связь между положительно заряженными ионами металлов и свободными электронами в кристаллической решетке металлов.
Металлическая связь имеет некоторое сходство с ковалентной, но и некоторое отличие, поскольку металлическая связь основана на обобществлении электронов (сходство), в обобществлении этих электронов принимают участие все атомы (отличие). Именно поэтому кристаллы с металлический связью пластичны, электропроводны и имеют металлический блеск. Однако в парообразном состоянии атомы металлов связаны между собой ковалентной связью, пары металлов состоят из отдельных молекул (одноатомных и двухатомных).
|
Способность атомов отдавать электроны (окисляться) |
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au ← Возрастает |
||
|
Взаимодействие с кислородом воздуха |
Быстро окисляются при обычной температуре |
Медленно окисляются при обычной температуре или при нагревании |
Не окисляются |
|
|
Н2 из воды не вытесняют |
||
|
Взаимодействие с водой |
При обычной температуре выделяется Н2 и образуется гидроксид |
При нагревании выделяется Н2 |
|
![]() Взаимодействие
с Вытесняют Не вытесняют Н2 из разбавленных
Взаимодействие
с Вытесняют Не вытесняют Н2 из разбавленных
|
кислотами
|
|
кислот |
|
|
Реагируют с конц. и разб. HNO3 и с конц. H2SO4 при нагревании |
С кислотами не реагируют |
||
|
Нахождение в природе |
Только в соединениях |
В соединениях и в свободном виде |
Главным образом в свободном виде |
|
Способы получения |
Электролиз расплавов |
Восстановлением углем, оксидом углерода(2), алюмотермия, или электролиз водных растворов солей |
|
|
Способность ионов присоединять электроны (восстанавливаться) |
Li K Ca Na Mg Al Mn Zn Cr Fe Ni Sn Pb (H) Cu Hg Ag Pt Au |
||
|
Возрастает → |
|||
Общие физические свойства металлов
Общие физические свойства металлов определяются металлической связью и металлической кристаллической решеткой.
Ковкость, пластичность
Механическое воздействие на кристалл металла вызывает смещение слоев атомов. Так как электроны в металле перемещаются по всему кристаллу, то разрыва связей не происходит. Пластичность уменьшается в ряду Au, Ag, Cu, Sn, Pb, Zn, Fe. Золото, например, можно прокатывать в листы толщиной не более 0,001 мм, которые используют для позолоты различных предметов. Алюминиевая фольга появилась сравнительно недавно и раньше чай, шоколад поковали в фольгу из олова, которая так и называлась ― станиоль. Однако не обладают пластичностью Mn и Bi: это хрупкие металлы.
Металлический блеск
Металлический блеск, который в порошке теряют все металлы, кроме Al и Mg. Самые блестящие металлы ― это Hg (из нее изготовляли в средние века знаменитые «венецианские зеркала»), Ag (из него теперь с помощью реакции «серебряного зеркала» изготовляют современные зеркала). По цвету (условно) различают металлы черные и цветные. Среди последних выделим драгоценные ― Au, Ag, Pt. Золото ― металл ювелиров. Именно на его основе изготовляли замечательные пасхальные яйца Фаберже. Звон
Металлы звенят, и это свойство используется для изготовления колокольчиков (вспомните Царь-колокол в Московском Кремле). Самые звонкие металлы ― это Au, Ag, Cи. Медь звенит густым, гудящим звоном ― малиновым звоном. Это образное выражение не в честь ягоды-малины, а в честь голландского города Малина, где выплавлялись первые церковные колокола. В России потом русские мастера стали лить колокола даже лучшего качества, а жители городов и поселков жертвовали золотые и серебряные украшения, чтобы отливаемый для храмов колокол звучал лучше. В некоторых русских ломбардах определяли подлинность принимаемых на комиссию золотых колец по звону золотого обручального кольца, подвешенного на женском волосе (слышен очень долгий и чистый высокий звук).
При нормальных условиях все металлы, кроме ртути Hg, ― твердые вещества. Самый твердый из металлов ― хром Cr: он царапает стекло. Самые мягкие ― щелочные металлы, они режутся ножом. Щелочные металлы хранят с большими предосторожностями ― Na ― в керосине, а Li ― в вазелине из-за своей легкости, керосин ― в стеклянной баночке, баночка ― в асбестовой крошке, асбест ― в жестяной баночке.
Электропроводность
Хорошая электрическая проводимость металлов объясняется присутствием в них свободных электронов, которые под влиянием даже небольшой разности потенциалов приобретают направленное движение от отрицательного полюса к положительному. С повышением температуры усиливаются колебания атомов (ионов), что затрудняет направленное движение электронов и тем самым приводит к уменьшению электрической проводимости. При низких же температурах колебательное движение, наоборот, сильно уменьшается и электрическая проводимость резко возрастает. Вблизи абсолютного нуля металлы проявляют сверхпроводимость. Наибольшей электрической проводимостью обладают Ag, Cu, Au, Al, Fe; худшие проводники ― Hg, Pb, W.
Теплопроводность
При обычных условиях теплопроводность металлов изменяется в основном в такой же последовательности, как их электрическая проводимость. Теплопроводность обусловливается высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры в массе металла. Наибольшая теплопроводность ― у серебра и меди, наименьшая ― у висмута и ртути.
Плотность
Плотность металлов различна. Она тем меньше, чем меньше атомная масса элемента-металла и чем больше радиус его атома. Самый легкий из металлов ― литий (плотность 0,53 г/см3), самый тяжелый ― осмий (плотность 22,6 г/см3). Металлы с плотностью меньше 5 г/см3 называются легкими, остальные ― тяжелыми.
Разнообразны температуры плавления и кипения металлов. Самый легкоплавкий металл ― ртуть (tкип = -38,9°С), цезий и галлий ― плавятся соответственно при 29 и 29,8°С. Вольфрам ― самый тугоплавкий металл
(tкип = 3390°С).
Понятие аллотропии металлов на примере олова Некоторые металлы имеют аллотропные модификации.
Например, олово различают на:
• α-олово, или серое олово («оловянная чума» ― превращение обычного β-олова в α-олово при низких температурах стало причиной гибели экспедиции Р. Скотта к Южному полюсу, который потерял все горючее, так как оно хранилось в баках, запаянных оловом), устойчиво при t <14°С, серый порошок.
• β-олово, или белое олово (t = 14 ― 161°С) очень мягкий металл, но тверже свинца, поддается литью и пайке. Используется в сплавах, например, для изготовления белой жести (луженого железа).
Электрохимический ряд напряжений металлов и два его правила
Расположение атомов в ряд по их реакционной способности может быть представлен следующим образом:
Li,K,Ca,Na,Mg,Al, Mn,Zn,Fe,Ni,Sn,Pb, Н2, Сu,Hg,Ag,Pt,Au.
Положение элемента в электрохимическом ряду показывает, насколько легко он образует ионы в водном растворе, т. е. его реакционную способность. Реакционная способность элементов зависит от способности принимать или отдавать электроны, участвующие в образовании связи.
1-е правило ряда напряжений
Если металл стоит в этом ряду до водорода, он способен вытеснять его из растворов кислот, если после водорода, то нет.
Например, Zn, Mg, Al давали реакцию замещения с кислотами (они находятся в ряду напряжений до H), а Cu нет (она после H).
2-е правило ряда напряжений
Если металл стоит в ряду напряжений до металла соли, то он способен вытеснить этот металл из раствора его соли.
Например, CuSO4 + Fe = FeSO4 + Cu.
В таких случаях положение металла до или после водорода может не иметь значения, важно, чтобы вступающий в реакцию металл предшествовал металлу, образующему соль:
Cu + 2AgNO3 = 2Ag + Cu(NO3)2.
ТЕМА 24. Восстановительные свойства металлов. Оксиды и гидроксиды металлов. Зависимость свойств этих соединений от степени окисления металлов. Значение металлов в природе и жизни организмов.
Атомы металлов сравнительно легко отдают валентные электроны и переходят в положительно заряженные ионы, т. е. окисляются. В этом, как вам известно, заключается главное общее свойство и атомов, и простых веществ — металлов.
Металлы в химических реакциях всегда восстановители. Восстановительная способность атомов простых веществ — металлов, образованных химическими элементами одного периода или одной главной подгруппы Периодической системы Д. И. Менделеева, изменяется закономерно (см. рис. 1).
Восстановительную активность металла в химических реакциях, которые протекают в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов.

(Нижнюю строчку ряда следует рассматривать как продолжение предыдущей.)
Более точное название этого ряда — ряд стандартных электродных потенциалов металлов.
Что такое электродный потенциал? Каким образом составлен названный ряд? Как этим рядом пользоваться?
При погружении любого металла в раствор электролита на границе металл—раствор устанавливается равновесие:
![]()
В металле появляется избыток электронов, а раствор на границе заряжается положительно. Таким образом образуется двойной электрический слой и возникает разность потенциалов, называемая электродным потенциалом. Электродный потенциал каждого электрода зависит от природы металла, концентрации его ионов в растворе и температуры.
Абсолютное значение электродного потенциала непосредственно измерить нельзя. Вместе с тем не представляет труда измерение разности электродных потенциалов, которая возникает в системе, состоящей из двух пар металл—раствор. Условились определять электродные потенциалы металлов по отношению к стандартному водородному электроду, потенциал которого принят за нуль. Такой электрод состоит из специально приготовленной платиновой пластинки, которая погружена в раствор серной кислоты с концентрацией ионов водорода, равной 1 моль/л, и омывается струей газообразного водорода под давлением в 101,325 кПа при 25 °С.
Если пластинку любого металла, погруженного в раствор его соли с концентрацией ионов металла 1 моль/л, соединить со стандартным водородным электродом, то получится электрическая цепь (гальванический элемент), электродвижущую силу (ЭДС) которой легко измерить. Эту ЭДС и называют стандартным электродным потенциалом (Е°). Например:
Е°(К+/К) = -2,92 В, Е°(Аl3+/Аl) = -1,67 В, Е°(Fe2+/Fe) = -0,44 В, Е°(Cu2+/Cu) = +0,34 В, Е°(Ag+/Ag) = +0,80 В.
Металлы, расположенные в порядке возрастания алгебраических величин их стандартных электродных потенциалов, образуют хорошо известный вам электрохимический ряд напряжений металлов.
На основании этого ряда напряжений можно сделать следующие важные заключения о химической активности металлов в реакциях, протекающих в водных растворах при стандартных условиях (t = 25 °С, р = 1 атм):
1. Чем левее стоит металл в этом ряду, тем более сильным восстановителем он является.
2. Каждый металл способен вытеснять (восстанавливать) из солей в растворе те металлы, которые в ряду напряжений стоят после него (правее).
3. Металлы, находящиеся в ряду напряжений левее водорода, способны вытеснять его из кислот в растворе.
4. Металлы, являющиеся самыми сильными восстановителями (щелочные и щелочноземельные), в любых водных растворах взаимодействуют прежде всего с водой.
Восстановительная активность металла, определенная по электрохимическому ряду, не всегда соответствует положению его в Периодической системе. Это объясняется тем, что при определении положения металла в ряду напряжений учитывают не только энергию отрыва электронов от отдельных атомов, но и энергию, затрачиваемую на разрушение кристаллической решетки, а также энергию, выделяющуюся при гидратации ионов.
Например, литий более активен в водных растворах, чем натрий (хотя по положению в Периодической системе Na — более активный металл). Дело в том, что энергия гидратации ионов Li+ значительно больше, чем энергия гидратации ионов Na+, поэтому первый процесс является энергетически более выгодным.
Рассмотрев общие положения, характеризующие восстановительные свойства металлов, перейдем к конкретным химическим реакциям. Взаимодействие металлов с простыми веществами — неметаллами
1.
![]() С
кислородом большинство металлов образуют оксиды — основные и амфотерные.
Кислотные оксиды переходных металлов, например оксид хрома (VI) СrO3 или оксид марганца (VII)
Мп2O7, не образуются при прямом
окислении металла кислородом. Их получают косвенным путем.
С
кислородом большинство металлов образуют оксиды — основные и амфотерные.
Кислотные оксиды переходных металлов, например оксид хрома (VI) СrO3 или оксид марганца (VII)
Мп2O7, не образуются при прямом
окислении металла кислородом. Их получают косвенным путем.
Щелочные металлы натрий и калий активно реагируют с кислородом воздуха, образуя пероксиды, например:
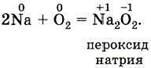
Оксид натрия получают косвенным путем, при прокаливании пероксидов с соответствующими металлами, например:
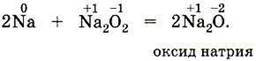
Литий и щелочноземельные металлы взаимодействуют с кислородом воздуха, образуя основные оксиды, например:
Другие металлы, кроме золота и платиновых металлов, которые не окисляются кислородом воздуха, взаимодействуют с ним менее активно или при нагревании:
2. С галогенами металлы образуют соли галогеноводородных кислот, например:
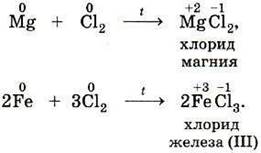
3. С водородом самые активные металлы образуют гидриды — ионные солеподобные вещества, в которых водород имеет степень окисления -1, например:
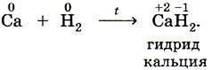
Многие переходные металлы образуют с водородом гидриды особого типа — происходит как бы растворение или внедрение водорода в кристаллическую решетку металлов между атомами и ионами, при этом металл сохраняет свой внешний вид, но увеличивается в объеме. Поглощенный водород находится в металле, по-видимому, в атомарном виде.
Существуют и гидриды металлов промежуточного характера.
4. С серой металлы образуют соли — сульфиды, например:
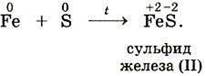
5. С азотом металлы реагируют несколько труднее, так как химическая связь в молекуле азота N2 очень прочна, при этом образуются нитриды. При обычной температуре взаимодействует с азотом только литий:

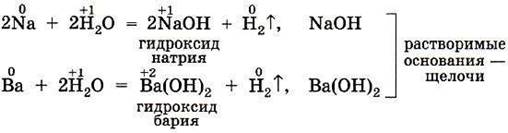
Другие металлы, стоящие в ряду напряжений до водорода, тоже могут при определенных условиях вытеснять водород из воды. Алюминий взаимодействует с водой, только если удалить с его поверхности оксидную пленку:
![]()
Магний взаимодействует с водой только при кипячении, при этом также выделяется водород:
![]()
Если горящий магний внести в воду, то горение продолжается, так как горит водород.
Железо взаимодействует с водой только в раскаленном виде:
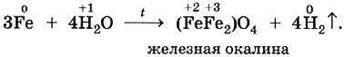
2. С кислотами в растворе (НСl, H2SO2(paзб), CH3COOH и др., кроме HNO3) с образованием соли и водорода взаимодействуют металлы, стоящие в ряду напряжений до водорода. Например:
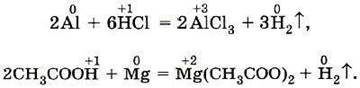
Свинец (и некоторые другие металлы), несмотря на его положение в ряду напряжений (слева от водорода), почти не растворяется в разбавленной серной кислоте, так как образующийся сульфат свинца (II) нерастворим и создает на поверхности металла защитную пленку.
3. С солями менее активных металлов в растворе. В результате такой реакции образуется соль более активного металла и выделяется менее активный металл в свободном виде. Например:
![]()
Нужно помнить, что реакция идет в тех случаях, когда образующаяся соль растворима. Вытеснение металлов из их соединений другими металлами впервые подробно изучал Н. Н. Бекетов — крупный русский физикохимик. Он расположил металлы по химической активности в «вытеснительный ряд», ставший прототипом ряда напряжений металлов.
4. С органическими веществами. Взаимодействие с органическими кислотами аналогично реакциям с минеральными кислотами. Спирты и фенолы могут проявлять слабые кислотные свойства при взаимодействии с щелочными металлами:
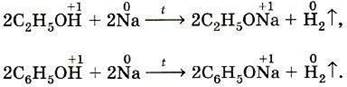
Металлы участвуют в реакциях с галогеналканами, которые используют для получения низших циклоалканов
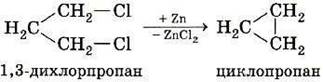
и для синтезов, в ходе которых происходит усложнение углеродного скелета молекулы (реакция А. Вюрца):
![]()
5. С щелочами в растворе взаимодействуют металлы, гидроксиды которых амфотерны. Например:
![]()
6. Металлы могут образовывать химические соединения друг с другом, которые получили общее название — интерметаллические соединения. В них чаще всего не проявляются степени окисления атомов, которые характерны для соединений металлов с неметаллами. Например: Cu3Au, LaNi5, Cu31Sn8, Na2Sb, Ca3Sb2 и др.
Интерметаллические соединения обычно не имеют постоянного состава, химическая связь в них в основном металлическая. Образование этих соединений более характерно для металлов побочных подгрупп.
![]() Оксиды,
образованные типичными металлами, относят к солеобразующим, основным по
характеру свойств. Как вы знаете, им соответствуют гидроксиды, являющиеся
основаниями, которые в случае щелочных и щелочноземельных металлов растворимы в
воде, являются сильными электролитами и называются щелочами. Например:
Оксиды,
образованные типичными металлами, относят к солеобразующим, основным по
характеру свойств. Как вы знаете, им соответствуют гидроксиды, являющиеся
основаниями, которые в случае щелочных и щелочноземельных металлов растворимы в
воде, являются сильными электролитами и называются щелочами. Например:
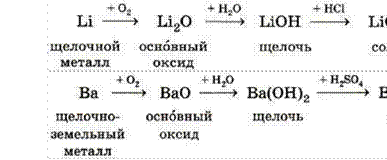
Оксиды и гидроксиды некоторых металлов (Be, Аl, Zn, Ge, Sn и др.) амфотерны, т. е. могут проявлять и основные, и кислотные свойства в зависимости от веществ, с которыми они взаимодействуют. Например:
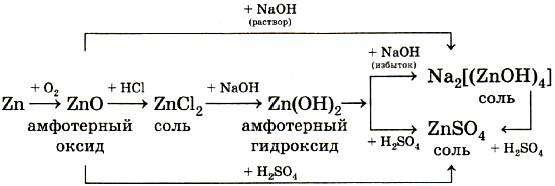
Многие металлы побочных подгрупп, имеющие в соединениях переменную степень окисления, могут образовывать несколько оксидов и гидроксидов, характер которых зависит от степени окисления металла.
Например, хром в соединениях проявляет три степени окисления: +2, +3, +6, поэтому он образует три ряда оксидов и гидроксидов, причем с увеличением степени окисления усиливается их кислотный характер и ослабляется основный.
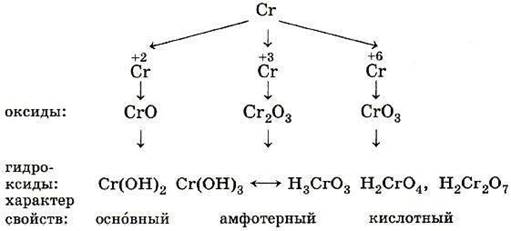
Обратите внимание на то, что металлы побочной подгруппы в своей высшей степени окисления образуют соединения, по форме и свойствам сходные с аналогичными соединениями элементов главных подгрупп. В нашем случае хром образует кислотный оксид и кислоту, подобно сере, элементу главной подгруппы VI группы: сравните
![]()
Значение металлов в жизни человека и природе
В современном мире роль металлов просто огромна: металлические изделия окружают нас везде. Даже находясь в своей комнате, Вы наверняка обнаружите хотя бы одно изделие из этого материала.
Еще в Средневековье алхимики утверждали, что поведение и характер человека зависят от того, какое количество металлов содержится в организме. Если в нем преобладает много свинца, то человек угрюмый и предпочитает темные тона в одежде. Если много железа, то он агрессивный и раздражается от красного цвета. А вот если в организме много меди, то человек дружелюбный и мягкий. Доля правды в этом конечно есть: в организме живых существ металлы оказывают влияние на все процессы жизнедеятельности. Например, открытие наличия железа в крови животных в XIX веке потрясло мир. Атомы железа являются составляющей частью гемоглобина, который занимается переносом кислорода, необходимого для протекания окислительно—восстановительных процессов в организме. Железо придает гемоглобину красный цвет, поэтому кровь животных и человека также красного цвета. Данный элемент в организм поступает вместе с продуктами питания – печенью, яблоками, творогами, сливами, дынями, тыквой, помидорами и абрикосами.
Также для организма полезны такие ферменты как марганец, цинк и медь. Недостаточное количество металлов вызывает серьезные последствия. Недостаток кальция приводит к замедлению роста скелета и возникновению кариеса. А вот нехватка магния приводит к судорогам мышц. Для пополнения запасов металлов, например, ставят автоматы с минеральной газированной водой, которая богата на микроэлементы.
Что уж говорить о важности металлургии. Нас просто окружают металлические изделия, которые делают нашу жизнь проще и комфортнее. Металлы широко используются практически во всех сферах промышленности. В природе в свободном состоянии встречаются неактивные металлы – платина, золото, медь и серебро. Чтобы добыть данные металлы, необходимо отделить их от примесей механическим путем. Те минеральные природные соединения, которые добываются в производственных условиях, называются рудами.
Атомы металла в организме животных играют схожую роль, что и в организме животных: атом металла находится в центре всех сложных соединений, которые связывают кислород. От количества металлов в почве зависит ее плодородие и богатство на органические соединения.
ТЕМА 25. Коррозия металлов химическая и электролитическая коррозия. Способы защиты от коррозии.
При взаимодействии металлов с веществами окружающей среды на их поверхности образуются соединения, обладающие совершенно иными свойствами, чем сами металлы. В обычной жизни мы часто употребляем слова «ржавчина», «ржавление», видя коричнево-рыжий налет на изделиях из железа и его сплавов. Ржавление – это частый случай коррозии.
Коррозия – это процесс самопроизвольного разрушения металлов и сплавов под влиянием внешней среды (от лат. corrosion - разъедание).
Однако разрушению подвергаются практически все металлы, в результате чего многие их свойства ухудшаются (или совсем теряются): уменьшаются прочность, пластичность, блеск, снижается электропроводимость, а так же возрастает трение между движущимися деталями машин, изменяются размеры деталей и т.д.
Коррозия металлов бывает сплошной и местной.
Первая не так опасна, как вторая. Ее проявления могут быть учтены при проектировании конструкций и аппаратов. Значительно опаснее местная коррозия, хотя потери металла здесь могут быть и небольшими. Один из наиболее опасных ее видов – точечная. Она заключается в образовании сквозных поражений, т.е. точечных полостей – питтингов, при этом снижается прочность отдельных участков. Уменьшается надежность конструкций, аппаратов, сооружений.
Коррозия металлов наносит большой экономический в результате. Человечество несет огромные материальные потери в результате разрушения трубопроводов, деталей машин, судов, мостов, различного оборудования.
Коррозия приводит к уменьшению надежности работы металлоконструкций. Учитывая возможное разрушение, приходится завышать прочность некоторых изделий (например, деталей самолетов, лопастей турбин), а значит, увеличить расход металла, а это требует дополнительных экономических затрат.
Коррозия приводит к простоям производства из-за замены вышедшего из строя оборудования, к потерям сырья и продукции в результате разрушения газо-, неф-те- и водопроводов. Нельзя не учитывать и ущерб природе, а значит, и здоровью человека, нанесенный в результате утечки нефтепродуктов и других химических веществ. Коррозия может приводить к загрязнению продукции, а следовательно, к снижению ее качества. Затраты на возмещение потерь, связанных с коррозией, колоссальны. Они составляют около 30% годового производства металлов во всем мире.
Из всего сказанного следует, что очень важной проблемой является изыскание способов защиты металлов и сплавов от коррозии.
Они весьма разнообразны. Но для их выбора необходимо знать и учитывать химическую сущность процессов коррозии.
По химической природе коррозия — это окислительновосстановительный процесс. В зависимости от среды, в которой он протекает, различают несколько видов коррозии.
Наиболее часто встречающиеся виды коррозии: химическая и электрохимическая.
I. Химическая коррозия происходит в не проводящей электрический ток среде. Такой вид коррозии проявляется в случае взаимодействия металлов с сухими газами или жидкостями — неэлектролитами (бензином, керосином и др.). Такому разрушению подвергаются детали и узлы двигателей, газовых турбин, ракетных установок. Химическая коррозия часто наблюдается в процессе обработки металлов при высоких температурах. Например:
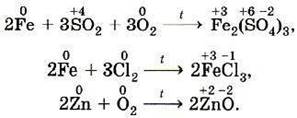
Большинство металлов окисляется кислородом воздуха, образуя на поверхности оксидные пленки. Если эта пленка прочная, плотная, хорошо связана с металлом, то она защищает металл от дальнейшего разрушения. Такие защитные пленки появляются у Zn, Aд, Cr, Ni, Sn, Pb, Nb, Та и др. У железа она рыхлая, пористая, легко отделяется от поверхности и потому не способна защитить металл от дальнейшего разрушения.
II. Электрохимическая коррозия происходит в токопроводящей среде (в электролите) с возникновением внутри системы электрического тока. Электрохимической коррозии подвергаются подводные части судов, паровые котлы, подземные трубопроводы, металлические конструкции, находящиеся во влажном воздухе. Как правило, металлы и сплавы неоднородны, содержат включения различных примесей. При контакте их с электролитами одни участки поверхности начинают выполнять роль анода (отдают электроны), а другие — роль катода (принимают электроны).
Рассмотрим разрушение железного образца в присутствии примеси олова.
На железе, как более активном металле, при соприкосновении с электролитом происходят процессы окисления (растворения) металла и перехода его катионов в электролит:
![]()
Таким образом, железо (его основная часть) служит анодом. Поток электронов перемещается к олову — металлу с меньшей активностью, на нем накапливается избыточное количество электронов. Таким образом, участки олова могут «поделиться» электронами, поэтому на них возможны процессы восстановления. Примесь олова выполняет роль катода.
В зависимости от среды электролита на катоде могут идти разные процессы (рис. 1).

Рис. 1. Процессы, протекающие на катоде при электрохимической коррозии
В одном случае будет наблюдаться выделение газа (Н2). В другом — образование ржавчины, состоящей из различных соединений железа (III) в общем виде Fe2O3 • nH2O.
Итак, электрохимическая коррозия — окислительно-восстановительная реакция, происходящая в средах, проводящих ток (в отличие от химической коррозии). Процесс происходит при соприкосновении двух металлов или на поверхности металла, содержащего включения, которые являются менее активными проводниками (это может быть и неметалл).
На аноде (более активном металле) идет окисление атомов металла с образованием катионов (растворение).
На катоде (менее активном проводнике) идет восстановление ионов водорода или молекул кислорода с образованием соответственно водорода Н2↑ или гидроксид-ионов ОН-.
Катионы водорода и растворенный кислород — важнейшие окислители, вызывающие электрохимическую коррозию.
Скорость коррозии тем больше, чем сильнее отличаются металлы (металл и примеси) по своей активности (для металлов — чем дальше друг от друга они расположены в ряду напряжений). Значительно усиливается коррозия при увеличении температуры.
Электролитом может служить морская вода, речная вода, конденсированная влага и конечно же хорошо известные всем электролиты — растворы солей, кислот, щелочей.
Вы, очевидно, помните, что зимой для удаления снега и льда с тротуаров используют техническую соль (хлорид натрия, иногда хлорид кальция и др.). Образующиеся растворы стекают в канализационные трубопроводы, создавая тем самым благоприятную среду для электрохимической коррозии подземных коммуникаций.
Для защиты металлических конструкций от коррозии применяют разные способы.
1. Шлифование поверхностей изделия, чтобы на них не задерживалась влага.
2. Применение легированных сплавов, содержащих специальные добавки: хром, никель, которые при высокой температуре на поверхности металла образуют устойчивый оксидный слой (например, Сr2O3). Общеизвестны легированные стали — «нержавейки», из которых изготавливают предметы домашнего обихода (ножи, вилки, ложки), детали машин, инструменты.
3. Нанесение защитных покрытий. Рассмотрим их виды.
• Неметаллические — неокисляющиеся масла, специальные лаки, краски, эмали, полимеры (рис. 2).

Рис. 2. Нанесение на корпус машины специального покрытия для защиты от коррозии
Правда, они недолговечны, но зато дешевы. Полимерные покрытия изготавливают из полиэтилена, полихлорвинила, полиамидных смол. Наносят их двумя способами: нагретое изделие помещают в порошок полимера, который плавится и приваривается к металлу, или поверхность металла обрабатывают раствором полимера в низко-кипящем растворителе, который быстро испаряется, а полимерная пленка остается на изделии.
• Химические — искусственно создаваемые поверхностные пленки: оксидные, нитридные, силицидные и др. Например, все стрелковое оружие и детали многих точных приборов подвергают воронению — это процесс получения тончайшей пленки оксидов железа на поверхности стального изделия. Получаемая искусственная оксидная пленка очень прочная и придает изделию красивый черный цвет и синий отлив.
• Металлические — это покрытия другими металлами, на поверхности которых под действием окислителей образуются устойчивые защитные пленки. Нанесение хрома на поверхность — хромирование, никеля — никелирование, цинка — цинкование, олова — лужение и т. д. Покрытием может служить и пассивный в химическом отношении металл — золото, серебро, медь.
4. Электрохимические методы защиты.
• Протекторная (анодная) — к защищаемой металлической конструкции присоединяют кусок более активного металла (протектор), который служит анодом и разрушается в присутствии электролита. В качестве протектора при защите корпусов судов, трубопроводов, кабелей и других стальных изделий используют магний, алюминий, цинк (рис. 3).
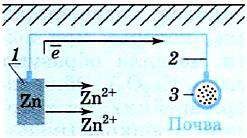
Рис. 3. Схема протекторной защиты: 1 — протектор (он разрушается); 2 — проводник тока; 3 — электрокабель (он защищен).
• Катодная — металлоконструкцию подсоединяют к катоду внешнего источника тока, что исключает возможность ее анодного разрушения (рис. 4).
Рис. 4. Схема катодной защиты
5. Специальная обработка электролита или другой среды, в которой находится защищаемая металлическая конструкция.
• Введение веществ-ингибиторов, замедляющих коррозию.
Известно, что дамасские мастера для снятия окалины и ржавчины пользовались растворами серной кислоты с добавлением пивных дрожжей, муки, крахмала. Эти примеси и были одними из первых ингибиторов. Они не позволяли кислоте действовать на оружейный металл, в результате растворялись лишь окалина и ржавчина.
Уральские оружейники применяли для этих целей «травильные супы» — растворы серной кислоты с добавкой мучных отрубей.
Примеры использования современных ингибиторов: соляная кислота при перевозке и хранении прекрасно «укрощается» производными бутиламина, а серная кислота — азотной кислотой; летучий диэтиламин впрыскивают в различные емкости. Отметим, что ингибиторы действуют только на металл, делая его пассивным по отношению к среде, например к раствору кислоты. Науке известно более 5 тыс. ингибиторов коррозии.
• Удаление растворенного в воде кислорода (деаэрация). Этот процесс используют при подготовке воды, поступающей в котельные установки.
ТЕМА 26. Положение неметаллов в Периодической системе, особенности строения, электроотрицательность. Из 118 известных на данный момент химических элементов 22 элемента образуют простые вещества, обладающие неметаллическими свойствами.
Неметаллы располагаются в III-VII группах. По физическим свойствам к неметаллам следует отнести также VIIIА группу, или группу благородных газов. Неметаллы образуют p-элементы, а также водород и гелий, являющиеся s-элементами. В длиннопериодной таблице p-элементы, образующие неметаллы, располагаются правее и выше условной границы B—At.
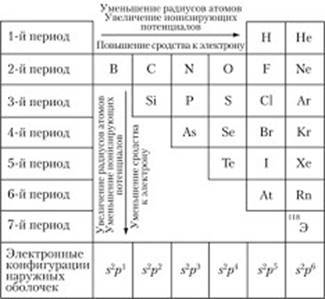
Неметаллы - это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя благодаря наличию, как правило, на внешнем электронном слое четырех и более электронов и малому радиусу атомов по сравнению с атомами металлов.
1. Особенности строения атомов неметаллов.
У большинства атомов неметаллов от четырех до восьми валентных электронов во внешнем слое, но у атома водорода - один, у атома гелия - два, а у атома бора - три валентных электрона, небольшой радиус атома (орбитальный радиус меньше 0,1 нм). Поэтому атомы неметаллов стремятся довести недостающие до 8е. Это свойство атомов характеризуется электроотрицательностью. Для атомов неметаллов характерны высокие значения электроотрицательности. Она изменяется в пределах от 2 до 4. В соответствии с ним неметаллы образуют особый ряд:
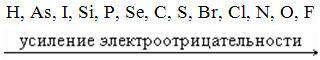
Фтор − самый сильный окислитель, его атомы в химических реакциях не способны отдавать электроны, то есть проявлять восстановительные свойства.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и подгруппах.
Неметаллы могут проявлять восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами: в периодах и подгруппах их восстановительная способность изменяется в обратном порядке по сравнению с окислительной.
Характеристики элементов неметаллов и их соединений закономерно изменяются в группах и периодах.
В периодах (с увеличением порядкового номера, т.е. слева и направо):
· увеличивается заряд ядра,
· увеличивается число внешних электронов,
· уменьшается радиус атомов,
· увеличивается прочность связи электронов с ядром (энергия ионизации),
· увеличивается электроотрицательность,
· усиливаются окислительные свойства простых веществ
("неметалличность") (кроме элементов VIIIA группы),
· ослабевают восстановительные свойства простых веществ ("металличность") (кроме элементов VIIIA группы),
· ослабевает основный характер гидроксидов и соответствующих оксидов,
· возрастает кислотный характер гидроксидов и соответствующих оксидов,
· валентность в соединении с кислородом возрастает от 3 до 7, высшая валентность равна номеру группы.
В группах (с увеличением порядкового номера, т.е. сверху вниз): · увеличивается заряд ядра,
· увеличивается радиус атомов (только в главных подгруппах),
· уменьшается прочность связи электронов с ядром (энергия ионизации; только в главных подгруппах),
· уменьшается электроотрицательность (только в главных подгруппах),
· ослабевают окислительные свойства простых веществ
("неметалличность"; только в главных подгруппах) (кроме элементов VIIIA группы),
· усиливаются восстановительные свойства простых веществ ("металличность"; только в главных подгруппах) (кроме элементов VIIIA группы),
· возрастает основный характер гидроксидов и соответствующих оксидов (только в главных подгруппах),
· ослабевает кислотный характер гидроксидов и соответствующих оксидов (только в главных подгруппах),
· снижается устойчивость водородных соединений (повышается их восстановительная активность; только в главных подгруппах), · валентность элементов не изменяется и равна номеру группы. Вида связи, характерные для неметаллов:
· ионная (КСI);
· ковалентная (неполярная − в простых веществах (С12) · полярная − в соединениях неметаллов (SCl2).
Однако следует особо остановиться на двойственном положении водорода в Периодической системе: в I и VII группах главных подгрупп. Это не случайно. С одной стороны, атом водорода, подобно атомам щелочных металлов, имеет на внешнем (и единственном для него) электронном слое один электрон (электронная конфигурация 1s1), который он способен отдавать, проявляя свойства восстановителя.
В большинстве своих соединений водород, как и щелочные металлы, проявляет степень окисления +1, Но отдача электрона атомом водорода происходит труднее, чем у атомов щелочных металлов. С другой стороны, атому водорода, как и атомам галогенов, для завершения внешнего электронного слоя недостает одного электрона, поэтому атом водорода может принимать один электрон, проявляя свойства окислителя и характерную для галогена степень окисления -1 в гидридах − соединениях с металлами, подобных соединениям металлов с галогенами − галогенидам. Но присоединение одного электрона к атому водорода происходит труднее, чем у галогенов.
При обычных условиях водород Н2 − газ. Его молекула, подобно галогенам, двухатомна.
Элементы VIII группы главной подгруппы − инертные или благородные газы, атомы которых имеют завершенный внешний электронный слой. Электронная конфигурация атомов этих элементов такова, что их нельзя отнести ни к металлам, ни к неметаллам. Они являются теми объектами, которые в естественной системе четко разделяют элементы на металлы и неметаллы, занимая между ними пограничное положение. Инертные или благородные газы («благородство» выражается в инертности) иногда относят к неметаллам, но чисто формально, по физическим признакам. Эти вещества сохраняют газообразное состояние вплоть до очень низких температур.
Инертность в химическом отношении у этих элементов относительна. Для ксенона и криптона известны соединения с фтором и кислородом. Несомненно, в образовании этих соединений инертные газы выступали в роли восстановителей.
2. Распространённость элементов-неметаллов.
Кислород и кремний являются наиболее распространенными элементами, на их долю приходится около 70% массы земной коры. К числу редких элементов относятся йод, селен, теллур и некоторые другие, на их долю приходятся тысячные доли процента массы земной коры. Многие соединения неметаллов являются обязательной составной частью растительных и животных организмов. К элементам-органогенам («рождающие» органические вещества: белки, жиры, углеводы, нуклеиновые кислоты) относятся: кислород О (на его долю приходится около 60% массы тела человека), С, Н, N, Р и S. В небольших количествах в организмах животных и растений содержатся F, О, I.
Два элемента-неметалла составляют 76% от массы земной коры. Это кислород (49%) и кремний (27%). В атмосфере содержится 0,03% от массы кислорода в земной коре. Неметаллы составляют 98,5% от массы растений, 97,6% от массы тела человека. В состав воздуха, которым мы дышим, входят простые и сложные вещества, также образованные элементами-неметаллами (кислород О2, азот, углекислый газ СО2, водяные пары Н2О и др.).
Водород − главный элемент Вселенной. Многие космические объекты (газовые облака, звезды, в том числе и Солнце) более чем наполовину состоят из водорода. На Земле его, включая атмосферу, гидросферу и литосферу, только 0,88%. Но это по массе, а атомная масса водорода очень мала. Поэтому небольшое содержание его только кажущееся, и из каждых 100 атомов на Земле 17 − атомы водорода.
3. Неметаллы − простые вещества. Строение.
В простых веществах атомы неметаллов связаны ковалентной неполярной связью; в благородных газах химических связей нет. Благодаря этому формируется более устойчивая электронная система, чем у изолированных атомов. При этом образуются одинарные (например, в молекулах водорода Н2, галогенов Cl2, Вг2), двойные (например, в молекулах кислорода) тройные (например, в молекулах азота) ковалентные связи.
Перейдем к рассмотрению строения молекул неметаллов. Неметаллы образуют как одноатомные, так и двухатомные молекулы.
К одноатомным неметаллам относятся инертные газы, практически не реагирующие даже с самыми активными веществами. Инертные газы расположены в VIII группе Периодической системы, а химические формулы соответствующих простых веществ следующие: He, Ne, Ar, Kr, Xe и Rn.
Некоторые неметаллы образуют двухатомные молекулы. Это галогены − F2, Cl2, Br2, I2 (элементы VII группы Периодической системы), а также H2, N2, O2. Атомы озона, фосфора, серы — из большего числа атомов (O3, Р4, S8), инертных газов – из одного атома (Не,Ne,Ar,Kr).
Для веществ неметаллов, находящихся в твердом состоянии, составить химическую формулу довольно сложно. Атомы углерода в графите соединены друг с другом различным образом. Выделить отдельную молекулу в приведенных структурах затруднительно. При написании химических формул таких веществ, как и в случае с металлами, вводится допущение, что такие вещества состоят только из атомов. Химические формулы, при этом, записываются без индексов - C, Si, S и т.д.
Самые типичные неметаллы имеют молекулярное строение, а менее типичные – немолекулярное. Этим и объясняется отличие их свойств.
1. Молекулярное строение. У этих неметаллов в твердом состоянии молекулярные кристаллические решетки. В этом случае в каждой молекуле атомы соединены достаточно прочно ковалентной связью, а вот отдельные молекулы друг с другом в кристаллах вещества связаны очень слабо. Поэтому при обычных условиях большинство таких веществ представляют собой газы или твердые вещества с низкими температурами плавления и лишь единственный бром (Вг2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи. В твердом состоянии они легкоплавки из-за слабого межмолекулярвого взаимодействия, удерживающего их молекулы в кристалле, и способны к возгонке.
Молекулярные неметаллы: H2, N2, P4 (белый фосфор), As4, O2, O3, S8, F2, Cl2, I2. К ним же можно отнести и благородные газы (He, Ne, Ar, Kr, Kx, Rn), атомы которых являются как бы "одноатомными молекулами".
2. Атомное строение. У этих неметаллов атомные кристаллические решетки, поэтому они обладают большой твердостью и очень высокими температурами плавления.Эти вещества образованы длинными цепями атомов. Из-за большой прочности ковалентных связей они, как правило, имеют высокую твердость, и любые изменения, связанные с разрушением ковалентной связи в их кристаллах (плавление, испарение), совершаются с большой затратой энергии. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала.
Немолекулярные неметаллы: B (несколько аллотропных модификаций), C(графит), C(алмаз), Si, Ge, P(красный), P(черный), As, Se, Te. Все они твердые вещества, кремний, германий, селен и некоторые другие обладают полупроводниковыми свойствами.
Причина большого разнообразия физических свойств неметаллов кроется в различном строении кристаллических решёток этих веществ.
Часть неметаллов имеет атомную кристаллическую решетку. Кристаллы таких веществ состоят из атомов, соединённых между собой прочными ковалентными связями. Такие неметаллы находятся в твёрдом агрегатном состоянии и являются нелетучими. Примерами таких веществ служат алмаз, графит, красный фосфор и кремний.
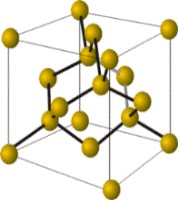
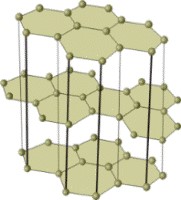
Модели кристаллических решёток алмаза (слева) и графита. Кристаллы этих аллотропных видоизменений состоят из атомов углерода, соединённых между собой ковалентными связями. Кристаллы графита, в отличие от кристаллов алмаза, сложены из отдельных слоёв, которые располагаются друг по отношению к другу подобно тому, как листы бумаги в книге.
Многие элементы-неметаллы образуют несколько простых веществ − аллотропных модификаций.
Аллотропия – это способность атомов одного химического элемента образовывать несколько простых веществ. а эти простые вещества – аллотропными видоизменениями или модификациями.
Аллотропия может быть связана и с разным составом молекул − различным числом атомов в молекуле (O2 и O3), и с разным строением кристаллов. Аллотропные видоизменения, образуемые одним и тем же химическим элементом, существенно отличаются между собой как по строению, так и по свойствам.
Агрегатное состояние
Неметаллы при обычных условиях могут быть газообразными, жидкими и твёрдыми веществами.
Кислород O2, озон O3, азот N2, водород H2, фтор F2, хлор Cl2, иод I2, белый фосфор P4, кристаллическая сера S8 и инертные газы (гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rn) — это всё газообразные вещества, кристаллы которых состоят из отдельных молекул (а в случае инертных газов — из отдельных атомов как бы выполняющих роль молекул).
При комнатной температуре бром – жидкость.
Остальные неметаллические химические элементы при обычных условиях находятся в твёрдом агрегатном состоянии. Твёрдыми являются все аллотропные модификации углерода C, кристаллическая сера S8, фосфор красный и фосфор белый P4, кристаллический иод I2, мышьяк As, кремний Si, бор B, кристаллическая сера S8, йод I2 и др.
![]()

Модель молекулы серы (слева) и кристалл серы. Кристалл серы состоит из отдельных молекул S8.
Цвет и блеск
Если для подавляющего большинства металлов характерен серебристосерый или серебристо-белый цвет, то окраска неметаллов очень разнообразна. Белый цвет имеет белый фосфор, красный − красный фосфор, жёлтый − сера и фтор, красно-бурый − жидкий бром, жёлтозелёный − хлор, фиолетовый цвет имеют пары иода, синий − жидкий кислород, серый − графит и кремний. Бесцветным является алмаз, окраски не имеют также инертные газы, азот, кислород и водород. Причем в подгруппах сверху вниз окраска усиливается: фтор − светло-зеленый газ, хлор − желто-зеленый газ, бром − красно-бурая жидкость, йод − темнофиолетовые кристаллы.

Большинство неметаллов не обладают металлическим блеском и не отражают свет. Блеском, несколько напоминающий блеск металлов, обладают активированный уголь, кристаллический йод и кремний и графит (т.е. это говорит об относительности деления элементов и простых веществ на металлы и неметаллы не только элементов, но и простых веществ). Запах
Некоторые неметаллы имеют запах. Например, резкий удушливый запах имеет озон O3, фтор F2 (при попадании в органы дыхания практически моментально разрушает ткани), хлор Cl2, бром Br2 и иод I2. Пластичность
Неметаллы в твёрдом агрегатном состоянии очень хрупкие, не обладают пластичностью и практически не присуще изгибание, ковкость и любые другие деформации − любая деформация вызывает разрушение ковалентных связей.
Все газообразные вещества, жидкий бром, а также Большинство твердых неметаллов (типичных ковалентных кристаллов) плохо проводят тепло и практически не проводят электрический ток (являются диэлектриками), так как все внешние электроны их атомов использованы для образования химических связей. Кремний и черный фосфор обладают полупроводниковыми свойствами, а графит − электро- и теплопроводностью.
в воде неметаллы нерастворимы или малорастворимы. Некоторые из них (галогены, сера) лучше растворяются в органических растворителях, белый фосфор − в сероуглероде. Фтор в воде растворять нельзя, так как он бурно реагирует с водой.
Кислород О2 – газ без цвета, вкуса и запаха, мало растворим в воде, поддерживает горение и дыхание. В атмосфере земли образуется в процессе фотосинтеза.
Озон – О3 – газ голубого цвета, с характерным запахом, очень реакционноспособен. Образуется во время грозы и в хвойных лесах. Основная масса О3 в атмосфере расположена в виде слоя − озоносферы — на высоте от 10 до 50 км с максимумом концентрации на высоте 20-25 км. Этот слой предохраняет живые организмы на Земле от вредного влияния коротковолновой ультрафиолетовой радиации Солнца. В промышленности О3 получают действием на воздух электрического разряда. Используют для обеззараживания воды и воздуха.
Кислород не обладает характерным запахом в отличие от озона (отсюда пришло и название озона – в переводе с греческого языка озон обозначает «пахнущий»). Подобный аромат, можно ощутить во время грозы, газ образуется в воздухе за счет электрических разрядов.
Кислород не обладает цветом в отличие от озона, который можно отличить по бледно-фиолетовому оттенку. Озон обладает бактерицидными свойствами. Он также используется для обеззараживания питьевой воды. Озон может препятствовать прохождению ультрафиолетовых лучей солнечного спектра, они губительны для всех живых организмов на Земле. Озоновый экран (слой), который находится на высоте 20-35 км, защищает все живое от губительных солнечных лучей.
Углерод известны еще с древних времен (древесный уголь).
Алмаз, минерал, кристаллическая модификация самородного углерода, по блеску, красоте и твердости превосходящий все минералы.
Размеры кристаллов варьируют от микроскопических до очень крупных, масса самого крупного алмаза «Куллинан», найденного в 1905 в Южной Африке 3106 кар (0,621 кг).
Алмаз − самое твердое из всех природных веществ. По шкале Мооса относительная твердость алмаза равна 10,
Графит, минерал, наиболее распространенная и устойчивая в земной коре модификация углерода. Структура слоистая. Темно-серые до черных чешуйчатые массы. Огнеупорен, электропроводен, химически стоек. Используется в производстве плавильных тиглей, в литейном деле, при изготовлении электродов, щелочных аккумуляторов, карандашей и т. д. Графит получают также искусственно − нагреванием антрацита без доступа воздуха. Блоки из чистого искусственного графита используют в ядерной технике, в качестве покрытия для сопел ракетных двигателей и т. д.
Углерод С, кремний Si, бор В имеют сходное строение и обладают некоторыми общими свойствами. Как простые вещества они встречаются в двух видоизменениях – в кристаллическом и аморфном. Кристаллические видоизменения этих элементов очень твердые, с высокими температурами плавления. Кристаллический кремний обладает полупроводниковыми свойствами.
Все эти элементы образуют соединения с металлами – карбиды, силициды и бориды (CaC2, Al4C3, Fe3C, Mg2Si, TiB, TiB2). Некоторые из них обладают большей твердостью, например Fe3C, TiB. Карбид кальция используется для получения ацетилена.
Кристаллический бор В (как и кристаллический кремний) обладает очень высокой температурой плавления (2075°С) и большой твердостью. Электрическая проводимость бора с повышением температуры сильно увеличивается, что дает возможность широко применять его в полупроводниковой технике. Добавка бора к стали и к сплавам алюминия, меди, никеля и др. улучшает их механические свойства.
Бориды (соединения бора с некоторыми металлами, например с титаном: TiB, TiB2) необходимы при изготовлении деталей реактивных двигателей, лопаток газовых турбин.
Аллотропные модификации олова представляет собой одна − металл, а другая − неметалл: белое олово − металл, серое олово проявляет свойства неметалла. При комнатной температуре обычно существует бета-олово. Это всем известное белое олово — металл, из которого раньше отливали оловянных солдатиков (вспомните знаменитую сказку Г. X. Андерсена "Стойкий оловянный солдатик") и которым покрывают изнутри консервные бамкн. При температуре ниже +13,2º С более устойчиво альфа олово — серый мелкокристаллический порошок, имеющий скорее свойства неметалла Процесс превращения белого олова в серое быстрее всего идет при температуре -33ºС. Это превращение получало образное название "оловянной чумы".
Элемент хлор (Сl2). При нормальных условиях хлор − это желтовато– зелёный газ с резким удушливым запахом. Хлор очень ядовит даже при такой малой концентрации как 0,001 мг на 1 дм3 воздуха. Этот газ в 2.5 раза тяжелее воздуха, поэтому всегда будет находится у самой земли в виде желтовато-зелёного тумана.
При содержании хлора в воздухе 0,9 мл/л смерть наступает в течение пяти минут. В небольших количествах (человек чувствует хлор уже при концентрации его в воздухе 0,003 мл/л), он сильно раздражает слизистые оболочки дыхательных путей и вызывает кашель.
Хлор содержится в земной коре по массе 0,017%. В некоторых горных районах он покрывает основание грунта и потому приводит к гибели насекомых, мелких грызунов и микроорганизмов. Температура кипения хлора равна (- 33,6°С), а температура плавления (-100,98°С).
Хлор имеет прекрасное дезенфицирующее свойство. Он уничтожает практически все живые организмы в сфере своего влияния, что делает его полезным в медицине и домашнем хозяйстве (порошки, хлорка – то же хлорная вода, соды с содержанием хлора). Сухой хлор такой способности не имеет. Раствор хлора в воде носит название «хлорной воды» которая имеет прекрасное свойство отбеливания материалов (тканей, дерева, бумаги и т.д.). Раствор хлора «уничтожает» краску на одежде, поэтому если не хотите, чтобы ваша кофточка или рубашка покрылась белыми пятнами - не используйте такую воду при стирке цветного белья. Достаточно просто поместить влажную крашенную ткань в струю хлора, как вскоре она потеряет свой цвет и превратится в чисто-белую.
Анионы хлора также играют важную биологическую роль для человека, так как принимают участие в активизации некоторых ферментов. С их помощью поддерживается благоприятная среда в желудке и поддерживается осмотическое давление. Хлор, как правило, попадает в организм человека, благодаря поваренной соли при приеме пищи.
Бром Br2 (бромос с древнегреческого языка переводится как
«зловонный») − легколетучая тяжелая жидкость тёмно-красного цвета (t пл 7 °С, t кип + 59 °С), с неприятным запахом, растворимая в воде (при 20°С растворяется 3,6 г бром (Вr2) в 100 мл воды) и органических растворителях. Пары брома сильно ядовиты. Ожоги бромом очень болезненны и долго не заживают. Если бром или бромная вода попала на кожу, надо немедленно промыть место ожога большим количеством воды, а затем раствором соды, которая нейтрализует бром. Бром получил широкое применение в синтезе полимерных материалов, а также для изготовления различных медицинских препаратов.
Йод (I2) (tпл=114°С, tкип=185°С) хорошо знаком каждому с детства: 5%-ный водно-спиртовой раствор йода используют для дезинфекции ран и порезов. Если вылить раствор йода в фарфоровую чашечку и оставить на несколько часов, то спирт испарится и выделится кристаллический йод в виде серых кристаллов с металлическим блеском, хорошо растворимых в органических растворителях. При небольшом нагревании кристаллический йод возгоняется, образуя пары фиолетового цвета.
Кристаллический йод имеет металлический блеск, в воде не растворяется, а в спирте растворяется хорошо. Спиртовой раствор йода имеет бурый цвет (он продаётся в аптеке в виде 5-10% раствора йода). Пары йода имеют тёмно-фиолетовый окрас.
Йод – прекрасное профилактическое средство против излучения. Его добавление к пище способствует укреплению щитовидной железы, которая больше всего подвержена радиоактивному влиянию. Для усвоения йода организмом в пищу используют йодированную соль (KI – йодид калия). Эту соль в виде добавок к пищевой соли (NaCl) можно приобрести в продуктовых магазинах.
Йод − один из очень важных элементов для организма человека. Нормальная доза для потребления его человеком исчисляется в микрограммах, но его отсутствие в организме - опасно для жизни человека. Йод принимает участие в синтезе гормонов щитовидной железы, которые в свою очередь отвечают за нормальный рост и развитие человеческого организма; йод очень необходим для правильной работы мозга!
Широкое применение получил йод в синтезе полимерных материалов, а также для изготовления различных медицинских препаратов. Водород
Такая разновидность неметаллов, как водород, широко применяется в химической промышленности. Его используют для синтеза аммиака, метанола, хлороводорода, а также для гидрогенизации жиров. Также, не обойтись без участия водорода, в качестве восстановителя и при производстве многих металлов и их соединений.
Широко применяется водород и в медицине. При обработке ран и для остановки мелких кровотечений используют трех процентный раствор перекиси водорода.
ТЕМА 27. Водородные соединения неметаллов. Физические свойства. Химические свойства.
Водородные соединения неметаллов представляют собой газообразные соединения, кроме воды. Они летучие и легкоподвижные, быстроиспаряемые.
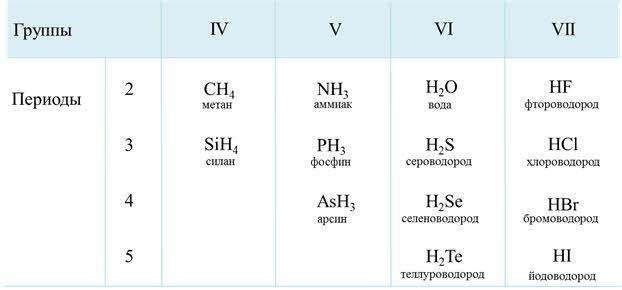
Электроотрицательность неметаллов больше электроотрицательности водорода, поэтому в водородных соединениях неметаллы проявляют минимальную отрицательную степень окисления: углерод — минус четыре, азот — минус три, фосфор — минус три и так далее.
Водородные соединения неметаллов проявляют основные, кислотные или амфотерные свойства. Водородные соединения неметаллов являются, как правило, сильными восстановителями.
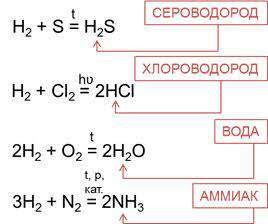
Так, углероду соответствует водородное соединение – метан, кремнию – силан, азоту – аммиак, фосфору – фосфин, мышьяку – арсин, кислороду – вода, сере – сероводород, селену – селеноводород, тэллуру – тэллуроводород, фтору – фтороводород, хлору – хлороводород, брому – бромоводород, йоду – йодоводород.
Водородные соединения неметаллов можно получить непосредственно взаимодействием неметалла с водородом. Сероводород можно получить реакцией водорода с серой, хлороводород – реакцией водорода с хлором, воду – реакцией водорода и кислорода, аммиак – реакцией водорода и азота.
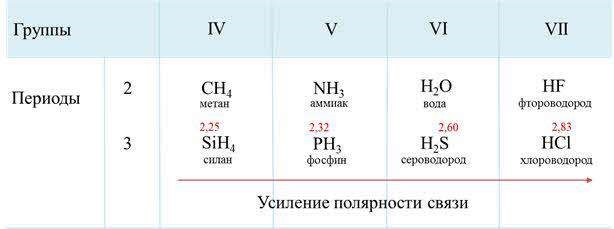
В водородных соединениях присутствует ковалентная полярная связь, они имеют молекулярную кристаллическую решётку.
Как известно, электроотрицательность усиливается по периоду слева направо, поэтому полярность связи в водородных соединениях возрастает, а в группах сверху вниз электроотрицательность уменьшается, поэтому и полярность связи будет уменьшаться.
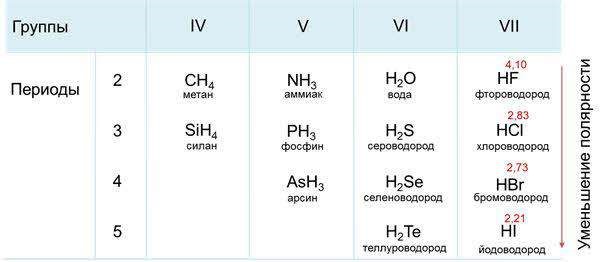
Если рассмотреть третий период, то от силена до хлороводорода будет наблюдаться усиление полярности связи из-за увеличения электроотрицательности неметаллов.
В седьмой A группе сверху вниз будет идти уменьшение полярности связи от фтороводорода к йодоводороду, потому что идёт уменьшение электрооотрицательности элемента-неметалла в водородном соединении.
Полярность связи влияет на растворимость водородного соединения в воде. Например, так как молекула воды сильно полярна, то возникает сильное межмолекулярное взаимодействие с образованием водородных связей.
![]() Если рассмотреть
водородные соединения неметаллов третьего периода, то здесь можно проследить
следующую закономерность: при растворении в воде силана не наблюдается
проявление кислотно-основного характера соединения, он сразу сгорает в
кислороде, фосфин в воде даёт слабую основную среду, сероводород – слабую
кислую среду, а хлороводород – сильнокислую среду. Это объясняется тем, что от силана до
хлороводорода радиус иона неметалла уменьшается, а заряд ядра увеличивается,
полярность связи в молекулах возрастает, поэтому усиливаются кислотные
свойства.
Если рассмотреть
водородные соединения неметаллов третьего периода, то здесь можно проследить
следующую закономерность: при растворении в воде силана не наблюдается
проявление кислотно-основного характера соединения, он сразу сгорает в
кислороде, фосфин в воде даёт слабую основную среду, сероводород – слабую
кислую среду, а хлороводород – сильнокислую среду. Это объясняется тем, что от силана до
хлороводорода радиус иона неметалла уменьшается, а заряд ядра увеличивается,
полярность связи в молекулах возрастает, поэтому усиливаются кислотные
свойства.
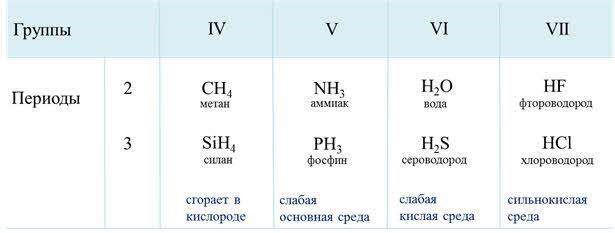
В группах сверху вниз кислотные свойства водородных соединений неметаллов усиливаются, так как прочность связи водород-элемент уменьшается, из-за увеличения длины связи.
Например, водородные соединения седьмой A группы: хлороводород, бромоводород, йодоводород в воде – это сильные кислоты, которые полностью диссоциируют. Из этих кислот самой слабой является фтороводородная. Это объясняется тем, что у фтора самый маленький радиус, кроме этого, в этой молекуле присутствуют межмолекулярные водородные связи.
Таким образом, в периодах и группах главных подгруппах с увеличением заряда ядер элементов-неметаллов усиливаются кислотные свойства, а ослабевают основные свойства.
![]() Например, водный
раствор хлороводорода – проявляет кислотные свойства, поэтому реагирует со
щелочами. Так, в реакции соляной кислоты с гидроксидом натрия образуется соль –
хлорид натрия и вода. Водный раствор аммиака проявляет основные свойства,
поэтому реагирует с кислотами. Так, в реакции аммиака с серной кислотой
образуется сульфат аммония и вода.
Например, водный
раствор хлороводорода – проявляет кислотные свойства, поэтому реагирует со
щелочами. Так, в реакции соляной кислоты с гидроксидом натрия образуется соль –
хлорид натрия и вода. Водный раствор аммиака проявляет основные свойства,
поэтому реагирует с кислотами. Так, в реакции аммиака с серной кислотой
образуется сульфат аммония и вода.
Как было сказано, водородные соединения неметаллов проявляют восстановительные свойства, так как элемент-неметалл здесь в минимальной степени окисления. Например, в реакции сероводорода с хлором сероводород является восстановителем, потому что сера повышает свою степень окисления с минус двух до нуля.
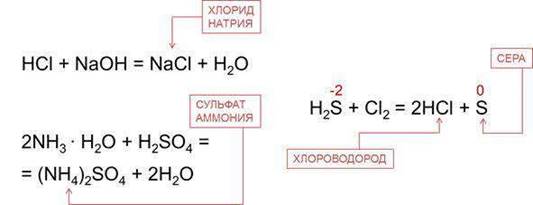
Таким образом, все солеобразующие оксиды, образованные неметаллами, обладают кислотными свойствами, а сила кислотного оксида зависит от степени окисления неметалла и радиуса иона. В периодах слева направо кислотный характер гидроксидов, образованных оксидами неметаллов усиливается, а в группах сверху вниз кислотный характер гидроксидов ослабевает. В периодах слева направо кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются. В группах сверху кислотные свойства водородных соединений увеличиваются. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
ТЕМА 28. Оксиды и ангидриды карбоновых кислот. Кислоты органические и неорганические. Общие свойства кислот.
Оксиды неметаллов и соответствующие им гидроксиды
![]() В
оксидах неметаллов связь между атомами ковалентная полярная.
В
оксидах неметаллов связь между атомами ковалентная полярная.
Среди оксидов молекулярного строения есть газообразные СO2, SO2, N2O, СО, NO и др., жидкие (летучие) SO3, N2O3, твердые (летучие) Р2O5, N2O5, SeO2. Твердый, очень тугоплавкий оксид SiO2 — вещество с атомной кристаллической решеткой.
Оксиды неметаллов делят на две группы: несолеобразующие и солеобразующие. К несолеобразующим оксидам относятся SiO, N2O, NO, NO2, CO. Все остальные оксиды неметаллов являются солеобразующими, кислотными. При растворении их в воде образуются гидраты оксидов — гидроксиды, по своему характеру являющиеся кислотами. Кислоты и кислотные оксиды в результате химических реакций образуют соли, в которых неметалл сохраняет степень окисления. Например:
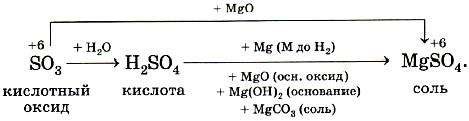
Кислотный оксид SiO2 нерастворим в воде, но ему также соответствует гидрат в виде кислоты H2SiO3 и соли:
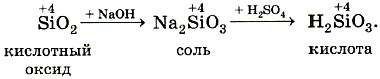
Оксиды и соответствующие им гидроксиды — кислоты, в которых неметалл проявляет степень окисления, равную номеру группы, т. е. высшее ее значение, называют высшими. Рассматривая Периодический закон, мы уже характеризовали их состав и свойства, например:
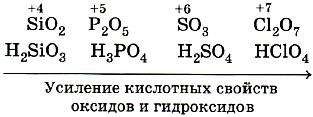
В пределах одной главной подгруппы, например VI группы, действует следующая закономерность изменения свойств высших оксидов и гидроксидов.
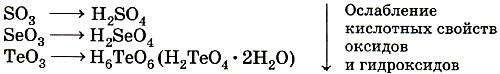
Если неметалл образует два или более кислотных оксидов, а значит, и соответствующих кислородсодержащих кислот, то их кислотные свойства усиливаются с увеличением степени окисления неметалла.
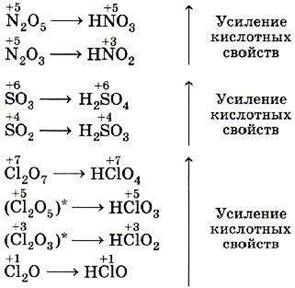
!!! Оксиды такого состава неизвестны; НСlO2 даже в водном растворе быстро разлагается.
Оксиды и кислоты, в которых неметалл имеет высшую степень окисления, могут проявлять только окислительные свойства.
Особенности сильнейших окислителей азотной кислоты HNO3 и концентрированной серной кислоты H2SO4 проявляются в реакциях с металлами, неметаллами, органическими веществами.
Оксиды и кислоты, где неметалл имеет промежуточную степень окисления, могут проявлять и окислительные, и восстановительные свойства.
Ангидридами называют производные карбоновых кислот, у которых атом водорода карбоксильной группы замещен на ацильную группу.
Химические свойства
1. Взаимодействие с водой (гидролиз)
При взаимодействии с водой ангидриды медленно гидролизуются с образованием соответствующих кислот:
2. Взаимодействие с аммиаком (аммонолиз)
При взаимодействии линейных ангидридов с аммиаком, первичными или вторичными аминами образуются амиды карбоновых кислот:
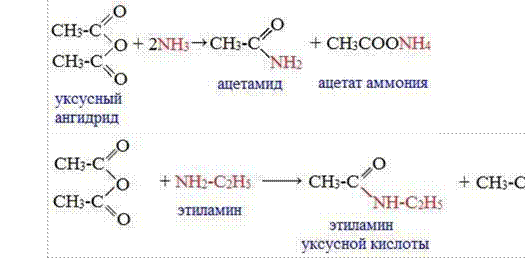
Циклические ангидриды реагируют с аммиаком и первичными аминами с образованием неполных амидов дикарбоновых кислот, которые при нагревании циклизуются в имиды:
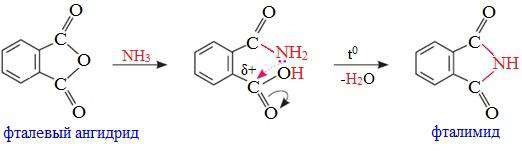
3. Взаимодействие со спиртами (алкоголиз)
При обработке линейных ангидридов спиртами образуются сложные эфиры:
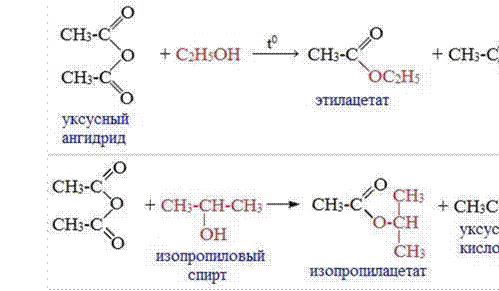
Циклические ангидриды реагируют со спиртами с образованием неполных (кислых) эфиров дикарбоновых кислот:
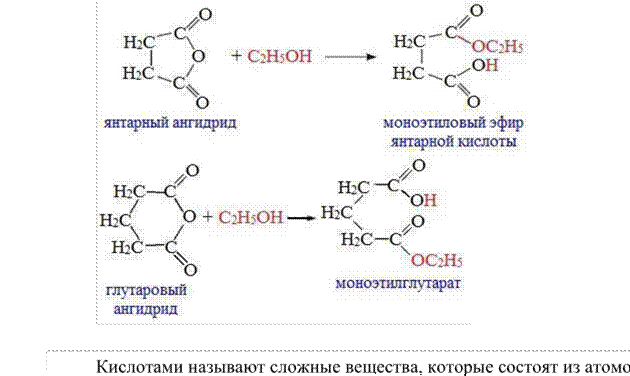 Кислоты
органические и неорганические
Кислоты
органические и неорганические
водорода, способных замещаться на металл, и кислотного остатка.
В свете теории электролитической диссоциации к кислотам относят электролиты, которые при диссоциации образуют катионы только одного типа — гидратированные ионы водорода.
Теория электролитической диссоциации объясняет кислотно-основные свойства водных растворов электролитов присутствием в них избытка ионов Н+ (точнее, Н3O+) или ОН-:
![]()
Наряду с этим известны реакции, в которых вещества взаимодействуют как кислота и основание при отсутствии в них ионов водорода и гидроксидионов. Вспомните, например, образование хлорида аммония при взаимодействии газообразных хлороводорода и аммиака, известное вам как «дым без огня»:
![]()
В 1923 г. появилась протолитическая теория кислот и оснований Брёнстеда—Лоури, которая расширила представления о кислотах и основаниях, объяснила поведение веществ в водных и неводных (спиртовых, эфирных, аммиачных) растворах. Согласно этой теории, кислоты — это молекулы или ионы, которые являются в данной
реакции донорами катионов водорода Н+, т. е. отдают их. Соответственно основания — это молекулы или ионы, которые принимают катионы Н+, т. е. являются акцепторами Н+.
В реакции получения хлорида аммония хлороводород отдает катион водорода Носнования — это молекулы или ионы, которые принимают катионы Н+, т. е. являются акцепторами Н+. аммиаку, следовательно, хлороводород НСl ведет себя как кислота, a NH3 — как основание.
Так как атом водорода состоит только из протона и электрона, то катион водорода Н+ представляет собой протон, поэтому кислоту иногда называют донором протонов, а основание — акцептором протонов.
Очевидно, вам теперь стала понятной и этимология названия теории — протолитическая (синтез терминов «протон» и «электролит»).
С точки зрения теории кислот и оснований Брёнстеда—Лоури распад электролита на ионы (1) и гидролиз по аниону (2) рассматривают как кислотно-основное взаимодействие электролитов и воды:
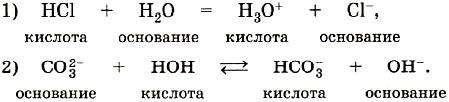
В реакции (1) Н2O ведет себя как основание — присоединяет протон (Н+) и образует ион оксония по донор-но-акцепторному механизму:
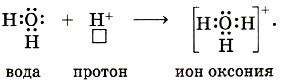
Ион оксония Н30+ и сам может играть роль кислоты — отдавать Н+ и превращаться в молекулу воды.
Теперь, когда вы познакомились с более широким взглядом на природу кислотно-основных свойств химических соединений, сделаем обобщение сведений о классе кислот, рассмотрев классификацию и свойства неорганических и органических кислот (табл. 1). Таблица 1 Классификация кислот
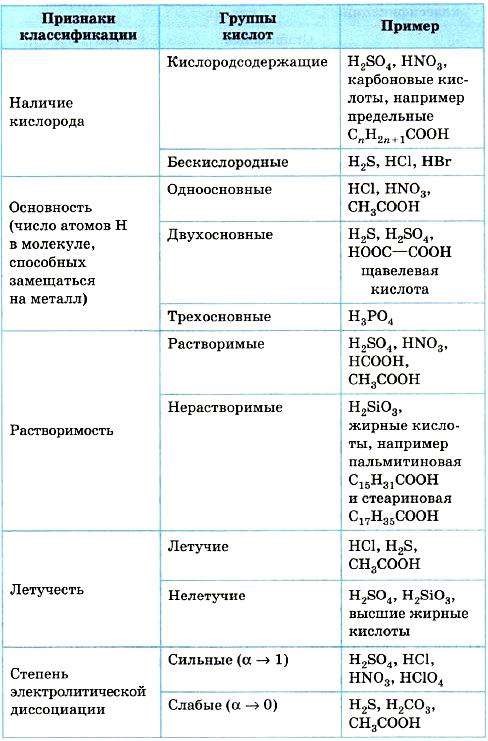
Свойства кислот
Кислый вкус, действие на индикаторы, электрическая проводимость, взаимодействие с металлами, основными и амфотерными оксидами, основаниями и солями, образование сложных эфиров со спиртами — эти свойства являются общими для неорганических и органических кислот.
![]()
1. В воде кислоты диссоциируют на катионы водорода и анионы кислотных остатков, например:
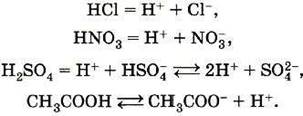
Растворы кислот изменяют цвет индикаторов: лакмуса — в красный, метилового оранжевого — в розовый, цвет фенолфталеина не изменяют.
2. Растворы кислот реагируют с металлами, стоящими в электрохимическом ряду напряжений левее водорода, при соблюдении ряда условий, важнейшим из которых является образование в результате реакции растворимой соли. Рассматривая это свойство неорганических и органических кислот, подчеркнем, что взаимодействие HNO3 и Н2SO4(конц.) с металлами (табл. 19) протекает иначе, но эти особенности указанных кислот будут объяснены несколько позднее.
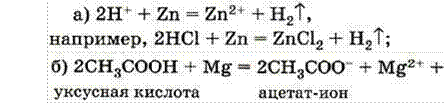
3. Неорганические и органические кислоты взаимодействуют с основными и амфотерными оксидами при условии, что образуется растворимая соль:
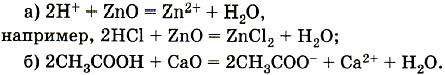
4. И те и другие кислоты вступают в реакцию с основаниями. Многоосновные кислоты могут образовать как средние, так и кислые соли (это реакции нейтрализации):
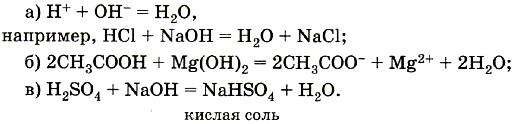
Таблица 19 Продукты взаимодействия простых веществ с азотной и серной кислотами
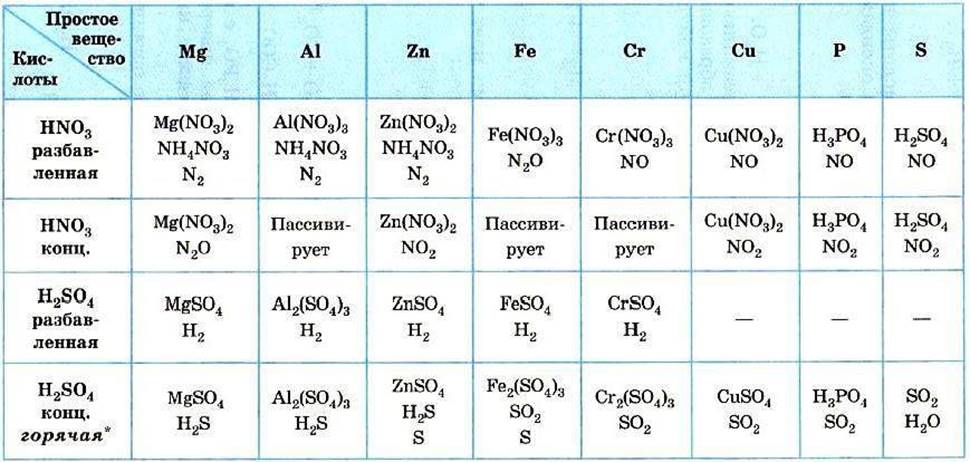
148
5. Реакция между кислотами и солями идет только в том случае, если образуется газ или осадок:
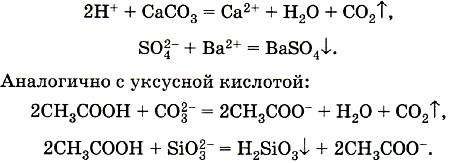
Взаимодействие фосфорной кислоты Н2РO4 с известняком прекратится из-за образования на поверхности последнего нерастворимого осадка фосфата кальция Са3(РO4)2.
6. Сложные эфиры образуют не только органические кислоты согласно общему уравнению:
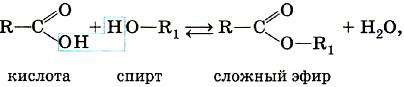
но и неорганические кислоты, например азотная и серная:
![]()
Аналогичная реакция с участием двух и трех гидроксогрупп целлюлозы при ее нитровании приводит к получению сложных эфиров: ди- и тринитроцеллюлозы — необходимых веществ для производства бездымного пороха.
Вместе с тем отдельные представители минеральных и органических кислот имеют и особые свойства.
Особенности свойств азотной HNO3 и концентрированной серной Н2SO4(конц.) кислот обусловлены тем, что при их взаимодействии с простыми веществами (металлами и неметаллами) окислителями будут выступать не катионы Н+, а нитрат- и сульфат-ионы. Логично ожидать, что в результате таких реакций образуется не водород Н2, а получаются другие вещества: обязательно соль и вода, а также один из продуктов восстановления нитрат- или сульфат-ионов в зависимости от концентрации кислот, положения металла в ряду напряжений и условий реакции (температуры, степени измельченности металла и т. д.).
Следует отметить, что третий продукт реакции металлов с этими кислотами часто образуется в «букете» — смеси с другими продуктами, но мы в таблице 19 указали преобладающие продукты.
Эти особенности химического поведения HNO3 и Н2SO4(конц.) наглядно иллюстрируют тезис теории химического строения о взаимном влиянии атомов в молекулах веществ. Его можно проследить и на примере свойств органических кислот, например уксусной и муравьиной.
Уксусная кислота СН3СООН, как и другие карбоновые кислоты, содержит в молекуле углеводородный радикал. В нем возможны реакции замещения атомов водорода атомами галогенов:
![]()
Под влиянием атомов галогена в молекуле кислоты ее степень диссоциации сильно повышается. Например, хлоруксусная кислота почти в 100 раз сильнее уксусной (почему?).
Муравьиная кислота НСООН, в отличие от уксусной, не имеет в молекуле углеводородного радикала. Вместо него она содержит атом водорода, а потому является веществом с двойственной функцией — альдегидокислотой и, в отличие от других карбоновых кислот, дает реакцию «серебряного зеркала»:
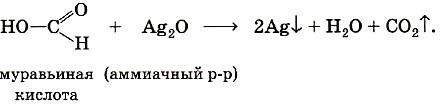
Образующаяся угольная кислота Н2СO3 распадается на воду и углекислый газ, который в избытке аммиака превращается в гидрокарбонат аммония.
ТЕМА 29. Основания органических и неорганических веществ в свете теории электролитической диссоциации. Классификация
оснований. Химические свойства щелочей и нерастворимых оснований.
Свойства бескислородных оснований: аммиака и аминов.
Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксогрупп (ОН-).
С точки зрения теории электролитической диссоциации, основания это электролиты (вещества, растворы или расплавы которых проводят электрический ток), диссоциирующие в водных растворах на катионы металлов и анионы только гидроксид - ионов ОН-.
Растворимые в воде основания называются щелочами. К ним относятся основания, которые образованы металлами 1-й группы главной подгруппы (LiOH, NaOH и другие) и щелочноземельными металлами (Са(ОН)2, Sr(ОН)2, Ва(ОН)2). Основания, образованные металлами других групп периодической системы в воде практически не растворяются. Щелочи в воде диссоциируют полностью:
NaOH → Na+ + OH-.
Многокислотные основания в воде диссоциируют ступенчато:
Ba(OH)2 → BaOH+ + OH-,
Ba(OH)+ → Ba2+ + OH-.
Cтупенчатой диссоциацией оснований объясняется образование основных солей.
Классификация оснований
1. По наличию кислорода: кислородосодержащие - KOH, Zn(ОН)2, бескислородные – NН3, амины.
2. По кислотности (по числу групп ОН— в молекуле
основания): однокислотные – NaOH, KOH, двухкислотные – Ca(OH)2, трехкислотные - Al(OH)3.
3. По растворимости: растворимые (щелочи) – LiOH, KOH, нерастворимые – Cu(OH)2, Al(OH)3. 4. По силе (по степени диссоциации):
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
б) слабые (α < 100 %) – все нерастворимые основания Cu(OH)2, Fe(OH)3 и растворимое NH4OH.
5. По химическим свойствам: основные –
Са(ОН)2, NaОН; амфотерные – Zn(ОН)2, Al(ОН)3.
6. По летучести: летучие - NН3, СН3NН2, нелетучие – щелочи, нерастворимые основания.
7. По стабильности: стабильные – NaOH. Ba(OH)2, нестабильные
NH4OH↔ NН3 + Н2О
Химические свойства
Свойства щелочей
1. Изменение цвета индикаторов: фенолфталеин – малиновый лакмус – синий
метиловый оранжевый – желтый
2. Водные растворы оснований (растворимых) диссоциируют, например:
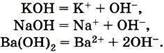
3. Взаимодействуют с кислотами, вступая с ними в реакцию обмена:
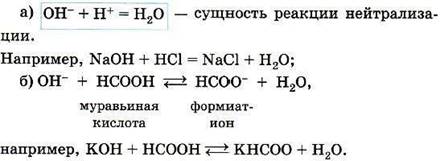
Многокислотные основания могут в таких реакциях давать как средние, так и основные соли:
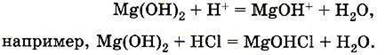
4. Взаимодействуют с кислотными оксидами, образуя средние и кислые соли в зависимости от основности кислоты, соответствующей этому оксиду:
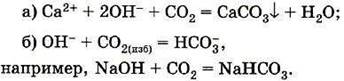
5. Взаимодействуют с амфотерными оксидами и гидроксидами:
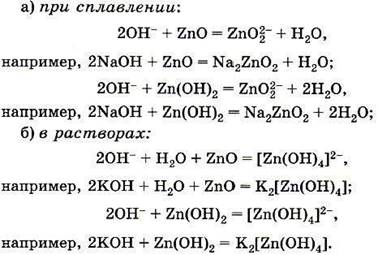
6. Взаимодействуют с растворимыми в воде солями, если образуется осадок или газ:
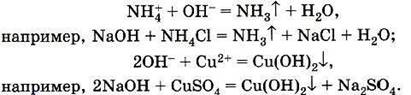
7. Вступают в реакции с некоторыми органическими веществами, например с фенолом — карболовой кислотой:
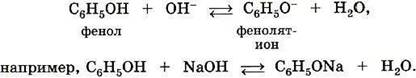
Нерастворимые основания, например Сr(ОН)2, Mn(OH)2, La(OH)3 и др., взаимодействуют с кислотами и разлагаются при нагревании на основный оксид и воду:
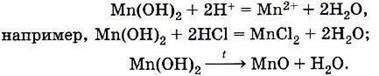
Свойства бескислородных оснований Рассмотрим их на примере аммиака и аминов.
1. Взаимодействуют с кислотами, образуя соли по донорноакцепторному механизму:
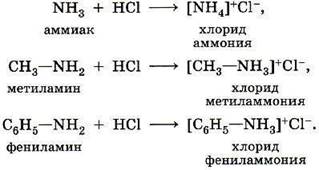
2. Взаимодействуют с водой, образуя гидроксиды — слабые и непрочные кислородсодержащие основания:
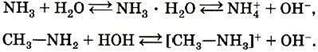
Основные свойства метиламина выражены более сильно, чем у аммиака, потому что положительный индукционный эффект метильного радикала —СН3 увеличивает электронную плотность на атоме азота, обеспечивая тем самым его большую способность к присоединению протона Н+.
Водные растворы аммиака и аминов имеют щелочную среду и окрашивают раствор фенолфталеина в малиновый цвет. Анилин такого действия не оказывает.
Ароматические амины плохо растворяются в воде. Их основные свойства ослаблены, поскольку неподеленная электронная пара атома азота аминогруппы вовлечена в ароматическое сопряжение бензольного кольца, вследствие чего затрудняется прием протонов Н+.
Аммиак, метиламин и анилин можно расположить в следующий ряд в порядке ослабления их основных свойств:
![]()
Этот пример (один из многих) красноречиво подтверждает универсальное проявление положения теории химического строения о взаимном влиянии атомов в молекулах веществ.
Влияние аминогруппы на бензольное ядро (радикал фенил) из-за наличия на атоме азота неподеленной электронной пары приводит к нарушению равномерности распределения замкнутой π-электронной системы в бензольном кольце, вследствие чего атомы водорода будут более подвижными в 2-, 4-, 6-положениях.
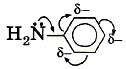
о этой причине реакции замещения в бензольном кольце будут
проходить в этих положениях.
Многие амины с низкой молекулярной массой имеют неприятный запах испорченной рыбы, ведь они и аммиак образуются при разложении мертвых организмов без доступа кислорода.
Некоторые лекарственные препараты (белый стрептоцид, норсульфазол, сульфидин, сульфодимезин) — производные ароматических аминов.
ТЕМА 29. Амфотерные органические и неорганические соединения (основания, оксиды, взаимодействие с кислотами и щелочами).
План
1. Амфотерные соединения
2. Химические свойства амфотерных соединений
3. Комплексные соединения
Химия – это всегда единство противоположностей.
Рассмотрим элементы периодической системы, соединения которых проявляют амфотерные (противоположные) свойства. Амфотерность – это способность некоторых простых веществ и соединений проявлять в зависимости от условий как кислотные, так и основные свойства. С каждым годом появляется все больше химических амфотерных соединений. Их называют материалами будущего.
В результате взаимодействия амфотерных гидроксидов со щелочами образуются комплексные соли, которые имеют огромное значение в жизнедеятельности живых организмов. Почти все ферменты и многие гормоны, гемоглобин крови, многие лекарства представляют собой комплексные соединения. В медицине они используются как противоядия, при лечении наследственных заболеваний, ревматоидного артрита. В медицинской практике при лечении многих заболеваний в качестве лекарственных препаратов используются соединения меди, серебра, цинка, кобальта, хрома, золота, платины, ртути.
Владение знаниями о свойствах амфотерных веществ и комплексных соединений позволит медицинскому работнику организовывать собственную деятельность для эффективного выполнения профессиональных задач, развивать навыки познавательной деятельности, способность и готовность к самостоятельному поиску методов решения практических задач, применению различных методов познания.
1. Амфотерные соединения
Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водорода и проявлять кислотные свойства, так и их акцепторами, т. е. проявлять основные свойства.
Амфотерны оксиды и гидроксиды многих элементов.
Схема 1
Амфотерные оксиды и гидроксиды
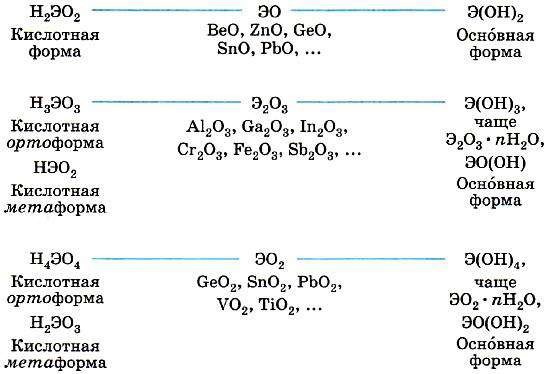
2. Химические свойства амфотерных соединений
1. Взаимодействуя с сильными кислотами, они обнаруживают основные свойства:
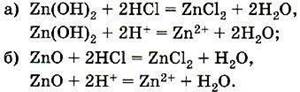
2. Взаимодействуя со щелочами — сильными основаниями, амфотерные гидроксиды и оксиды проявляют кислотные свойства:
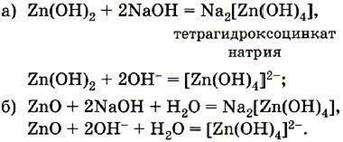
Взаимодействуя со щелочами, гидроксид алюминия также образует комплексные соли, состав которых может быть отражен формулой:
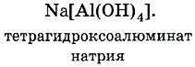
Теперь, когда мы познакомились со строением продуктов взаимодействия амфотерных гидроксидов с щелочами в растворе, вернемся к дальнейшему рассмотрению амфотерности. Типичное амфотерное соединение — вода, которая незначительно диссоциирует:
![]()
и в присутствии кислоты ведет себя как основание (принимает Н+), а в
присутствии основания — как кислота (отдает Н+).
В органической химии типичные амфотерные соединения — аминокислоты, общая формула которых для а-аминокислот такова:
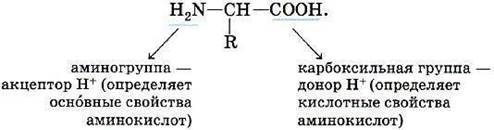
Именно амфотерность аминокислот обусловливает их наиболее характерные свойства.
Кислотные свойства аминокислот проявляются в их способности взаимодействовать, например, с основаниями или вступать в реакцию этерификации с образованием сложных эфиров:
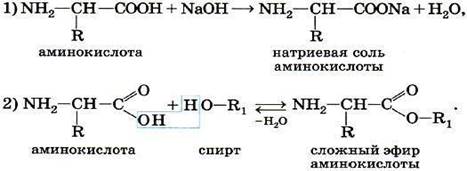
Основные свойства аминокислот проявляются в их способности взаимодействовать с кислотами, образуя комплексные ионы по донорноакцепторному механизму:
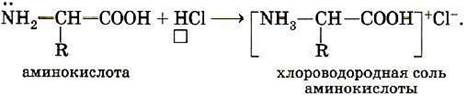
Амфотерность аминокислот проявляется в их способности в растворе образовывать в результате диссоциации диполярный ион — как бы внутреннюю соль:
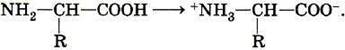
Аминокислоты могут вступать друг с другом в реакции поликонденсации, образуя полипептиды и белки:
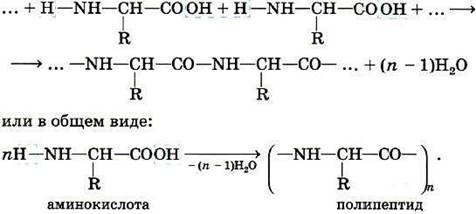
Эти процессы непрерывно протекают в клетках, обеспечивая в рибосомах биосинтез белков. Как вы уже знаете, именно порядок чередования в полученной полипептидной цепи исходных аминокислот обусловливает первичную структуру белковой молекулы.
В результате подобной реакции из аминокислот с концевым (почему?) расположением групп —NH2 и —СООН получают полиамиды, например:
![]()
Это соединения, в которых хотя бы одна ковалентная связь образовалась по донорно-акцепторному механизму.
В переводе с латинского complexus – «сочетание»
В 1863 г. Швейцарский химик Вернер разработал координационную теорию, в основу которой легли представления о пространственном строении веществ.
Строение комплексных соединений.
В центре находится атом или ион – комплексообразователь, а вокруг него – атомы, молекулы или ионы, образовавшие с ним ковалентные связи по донорно-акцепторному механизму – лиганды. Ими могут быть анионы кислот, некоторые молекулы небольшого размера (Н2О), имеющие атомы с неподелёнными электронными парами.
Общее число лигандов, связанных с центральным атомом, называется координационным числом. Известны комплексные соединения с координационным числом от 1 до 12 (чаще 4 и 6).
Лиганды вместе с центральным атомом образуют внутреннюю сферу. Внутреннюю сферу заключают в квадратные скобки.
Вокруг внутренней сферы образуется ещё и внешняя сфера – из ионов, не связанных непосредственно с комплексообразователем. Na2[Zn(OH)4] – тетрогидроксоцинкат натрия Значение комплексных соединений.
Комплексные соединения имеют важное значение для живых организмов, так гемоглобин крови образует комплекс с кислородом для доставки его к клеткам, хлорофилл находящийся в растениях является комплексом.
Широкое применение комплексные соединения получили в аналитической химии в качестве индикаторов.
Многие КС обладают каталитической активностью, поэтому их широко используют в неорганическом и органическом синтезах.
Таким образом, с использованием комплексных соединений связана возможность получения многообразных химических продуктов: лаков, красок, металлов, фотоматериалов, катализаторов, надёжных средств для переработки и консервирования пищи и т. д.
Комплексные соединения цианидов имеют важное значение в гальванопластике, так как из обычной соли бывает невозможно получить настолько прочное покрытие как при использовании комплексов.
ТЕМА 30. Соли, химические свойства. Особенности свойств солей органических и неорганических кислот. Генетическая связь между кислотами органических и неорганических соединений.
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия, NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями: CuSO4 — сульфат меди (II), CaCl2 — хлорид кальция.
Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксидионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности. Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования: KNaSO4 — сульфат калия-натрия, KAl(SO4)2 — сульфат калия-алюминия.
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями: CaClOCl — хлорид-гиполхорит кальция, PbFCl — фторид-хлорид свинца (II).
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Получение средних солей
Средние соли можно образовать в ходе следующих реакций: Металл + неметалл:
2Na + Cl2 = 2NaCl Fe + S =FeS Так получают только соли бескислородных кислот. Металл, стоящий левее H2 в ряду активности, с раствором кислоты: Mg + 2HCl = MgCl2 + H2 Металл с раствором соли менее активного металла: Fe + CuCl2 = FeCl2 + Cu
Основный оксид + кислотный оксид:
Na2O + CO2 = Na2CO3 Основный оксид и кислота:
CuO + H2SO4= CuSO4 + H2O Основание с кислотным оксидом: 2NaOH + SO3 = Na2SO4 + H2O
Основание с кислотой (реакция нейтрализации): Ca(OH)2 + 2HCl = CaCl2 + 2H2O Взаимодействие соли с кислотой:
MgCO3 + 2HCl = MgCl2 + H2O + CO2
BaCl2 + H2SO4 = BaSO4 + 2HCl
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ. Реакция раствора основания с раствором соли: 2NaOH + CuSO4 = Na2SO4 + Ba(OH)2
Взаимодействие растворов двух солей с образованием новых солей:
NaCl + AgNO3 = AgCl + NaNO3
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами: Zn + 2H2SO4 = H2 + Zn(HSO4)2
Кислот с оксидами металлов:
CaO + H3PO4 = CaHPO4 + H2O Гидроксидов металлов с кислотами: Ba(OH)2 + H3PO4 = BaHPO4 + 2H2O
Кислот с солями:
Ca3PO4 + 4H3PO4 = 3Ca(H2PO4)2
Аммиака с кислотами:
NH3 + H3PO4 = NH4H2PO4
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
KOH + CO2 = KHCO3
2SO2 + Ca(OH)2 = Ca(HSO3)2
Получение основных солей
Взаимодействие кислоты с избытком основания:
Fe(OH)3 + HCl = Fe(OH)2Cl + H2O
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Cu(NO3)2 + NaOH = CuOHNO3 + NaNO3
Взаимодействие солей слабых кислот со средними солями:
2MgCl2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaCl
Получение комплексных солей Реакции солей с лигандами:
AgCl + 2NH3 = [Ag(NH3)2]Cl
FeCl3 + 6KCN = K3[Fe(CN)6] + 3KCl
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Al2O3 + 2NaOH +3H2O = 2Na[Al(OH)4]
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Cr2(SO4)3 + K2SO4 + 24H2O = 2[KCr(SO4) 2 • 12H2O]
Химические свойства средних солей неорганических кислот Для средних солей характерны следующие химические свойства: 1. Реакции обмена
Средние соли способны вступать в реакции обмена с кислотами, щелочами, другими солями, если в результате реакции образуется осадок, газ или слабый электролит (например, вода).
– Взаимодействие с кислотами:
HCl + AgNO![]() = HNO
= HNO![]() + AgCl
+ AgCl
CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
– Взаимодействие с щелочами:
Fe(NO3)3 + 3NaOH → Fe(OH)3 + 3NaNO3 NH4Cl + KOH → KCl + NH3 + H2O
– Взаимодействие с другими солями:
Na2SiO3 + CaCl2 = 2NaCl + CaSiO3↓
2. Реакции замещения
Соли способны вступать в реакции замещения при взаимодействии с металлами.
В водном растворе соли взаимодействуют с металлами, стоящими в электрохимическом ряду напряжений левее, чем металл, входящий в состав соли, например:
CuSO4 + Fe = FeSO4 + Cu
Но сульфат цинка не взаимодействует с железом, так как железо менее активно, чем цинк (железо стоит в электрохимическом ряду напряжений после цинка):
FeSO4 + Cu ǂ
Однако активные металлы — щелочные и щёлочноземельные — в водных растворах солей будут вступать в реакцию не с солью, а с водой.
3. Термическое разложение (например, карбонатов, нитратов, солей аммония)
– Нерастворимые карбонаты и карбонат лития разлагаются на оксид металла и углекислый газ СО2:
CaCO3 ![]() CaO + CO2
CaO + CO2
Продуктами разложения карбоната аммония являются углекислый газ, аммиак и вода:
(NH4)2CO3 ![]() CO2
+ 2NH3 + H2O
CO2
+ 2NH3 + H2O
– Разложение нитратов металлов происходит в соответствии с положением металла в электрохимическом ряду напряжений:
Металл Левее Mg кроме Li От Mg до Cu (вкл.) Правее Cu
![]() Схема МеNO3→
МеNO2 МеNO3→ МехOу МеNO3→
Ме+NO2 +O2 нитрит +NO2 +O2 оксид
+O2 металл
Схема МеNO3→
МеNO2 МеNO3→ МехOу МеNO3→
Ме+NO2 +O2 нитрит +NO2 +O2 оксид
+O2 металл
металла
пример 2КNO3 = Cu(NO3)2 -> Cu + 2AgNO3 2A
2KNO2 + O2 2NO2 + O2. g + 2NO2 + O2
Нитрат аммония разлагается с образованием оксида азота(I) и воды: 2NH4NO3 2N2 + 4H2O + O2
– Термическое разложение солей аммония происходит с образованием аммиака NH3
NH4Cl = NH3↑+ HCl↑
Разложение солей аммония, в состав которых входит анион, проявляющий окислительные свойства, сопровождается выделением азота или оксида азота(I):
(NH4)2 Cr2O7 = Cr2O3 + N2 + 4H2O
2NH4NO 2N2 + 4H2O + O2
![]() NH4NO2
N2 + 2H2O
NH4NO2
N2 + 2H2O
– Хлорат калия в присутствии катализатора (например Mn2 ) разлагается с образованием хлорида калия и выделением кислорода:
2KClO3 ![]() 2KCl + 3O2
2KCl + 3O2
В отсутствие катализатора хлорат калия при нагревании диспропорционирует с образованием хлорида и перхлората калия:
4KClO3 ![]() KCl + 3KClO4
KCl + 3KClO4
4. Некоторые соли в водном растворе подвергаются гидролизу Генетическая связь
связь между веществами различных классов, основанная на их взаимопревращениях и отражающая единство их происхождения, т. е. генезис веществ.
приведем примеры генетической связи между классами органических и неорганических соединений, которые доказывают единство мира веществ, где нет деления на органические и неорганические вещества. Например, рассмотрим схему получения анилина — органического вещества из известняка — неорганического соединения:
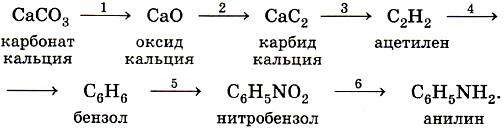
Воспользуемся возможностью повторить названия реакций, соответствующих предложенным переходам:
1. Обжиг известняка:
![]()
2. Восстановление оксида кальция в карбид:
![]()
3. Гидролиз карбида кальция:
![]()
4. Тримеризация ацетилена:
![]()
5. Нитрование бензола:
![]()
6. Восстановление нитробензола в анилин — реакция Н. Н. Зинина:
![]()
Задача 1.
Запишите уравнения реакций, иллюстрирующих следующие превращения:
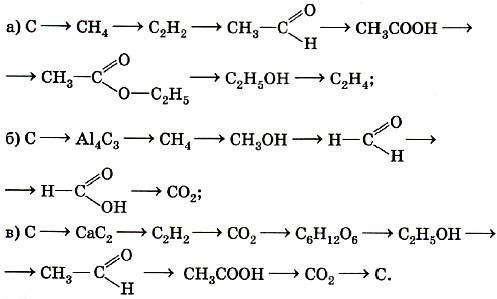
ТЕМА 31. Элементы IА-группы. Щелочные металлы. Общая характеристика. Природные соединения натрия и калия, их значение.
Элементы IIА-группы. Общая характеристика щелочно-земельных металлов. Кальций в природе, его биологическая роль.
Элементы IА-группы. Щелочные металлы. Общая характеристика.
Природные соединения натрия и калия, их значение.
В 1 группу(Ia группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 6 металлов: литий, натрий, калий, рубидий, цезий, франций (см. таблицу выше). Эти металлы принято называть щелочными, поскольку при взаимодействии с водой эти металлы (и их оксиды) образуют щелочи.
Самым распространенным из щелочных металлов в земной коре является натрий (2,3% по массе), далее идут калий (2,1%), рубидий (0,009%), литий (0,002%), цезий (0,0003%). Щелочные металлы по причине их высокой активности в природе в свободном виде не встречаются.
Природные соединения и минералы, богатые натрием и калием:
• NaCl - галит;
• KCl - сильвит; KCl·NaCl - сильвинит; K[AlSiO3O8] - ортоклаз.
Все атомы элементов 1(Ia) группы на внешнем энергетическом уровне имеют по одному валентному s-электрону (см. Электронная конфигурация атомов), с которым в химических соединениях достаточно легко "расстаются" с целью завершения внешнего энергетического уровня, который становится в таком случае устойчивым, по аналогии с завершенным энергетическим уровнем инертных газов.
Таким образом, отдавая "ненужный" электрон щелочные металлы в химических соединениях проявляют степень окисления +1.
Нетрудно заметить, что с ростом порядкового номера щелочного металла увеличивается не только общее кол-во электронов (энергетических уровней), но также и радиус атома, что в свою очередь, обуславливает уменьшение энергии ионизации (соответственно усиление металлических свойств элемента) в направлении от лития к францию (по мере увеличения радиуса атома щелочного элемента) - франций со своим s-электроном расстается гораздо легче, чем литий. Говоря другими словами, с ростом радиуса атома (номера элемента) возрастает реакционная
(восстановительная) способность щелочного металла.
Многие физические свойства щелочных металлов обусловлены металлическими связями, возникающими между атомами этих металлов по причине их низкой энергии ионизации:
• щелочные металлы имеют серебристо-белый цвет;
• низкую плотность;
• низкую температуру плавления (температуры плавления
уменьшаются в подгруппе сверху-вниз);
• обладают высокой пластичностью; высокой электро- и теплопроводностью.
Как уже было сказано выше, щелочные металлы очень легко вступают в химические реакции с другими элементами, отдавая при этом "ненужный" валентный электрон (см. Валентность) и превращаясь в положительно заряженный ион (катион).
Щелочные металлы легко реагируют со многими простыми веществами:
• с кислородом щелочные металлы образуют оксиды (Li), пероксиды (Na), суперпероксиды:
4Li + O2 = 2Li2O; 2Na + O2 = Na2O2; K + O2 = KO2;
• с серой образуют сульфиды: 2Na+S = Na2S
• с водородом образуют гидриды: 2Na+H2 = 2NaH взаимодействуют с галогенами (F, Cl, Br, I), образуя галогениды: 2Li + F2 = 2LiF;
• бурно реагируют с водой (активность возрастает с ростом атомного номера - натрий воспламеняется, а рубидий взрывается): 2Na + 2H2O = 2NaOH + H2;
• бурно реагируют с кислотами:
o с соляной и разбавленной серной реагируют с выделением
водорода: 2K + H2SO4(рзб) = K2SO4 + H2; o с концентрированной серной восстанавливают серу до степени
окисления -2: 8Na + 5H2SO4(кнц) = 4Na2SO4 + H2S + 4H2O; o с разбавленной азотной продуктом восстановления является нитрат аммония (ст. ок. -4) или аммиак:
8Na + 10HNO3(рзб) = 8NaNO3 + NH4NO3 + 3H2O; o с концентрированной азотной продуктом восстановления является оксид азота (I): 8Na + 10HNO3(кнц) = 8NaNO3 + N2O + 5H2O. Щелочные металлы окрашивают пламя в следующие цвета:
• Li - светло-красный;
• Na - желтый;
• K - сине-фиолетовый; Rb - темно-красный; Cs - бледно-голубой.
Промышленным способом щелочные металлы получают электролизом расплавов хлоридов (гидроксидов) этих металлов. NaCl → Na++Cl- (700°C)
Na++e- → Na0 (катод)
2Cl--2e- → Cl20 (анод)
2NaCl → 2Na+Cl2↑
Металлотермические методы получения щелочных металлов (рубидий и цезий получают в вакуумной среде):
• 3LiO + 2Al = Al2O3 + 3Li;
• Na + KCl = NaCl + K;
• 2RbCl + Ca = 2Rb + CaCl2;
• 2CsCl + Mg = 2Cs + MgCl2.
Применение щелочных металлов:
• Li:
o придает легкость сплавам, его применяют при производстве
медных, магниевых и алюминиевых сплавов; o в металлургии при помощи лития удаляют из металлических
расплавов шлаки, содержащие азот, кислород и серу; o в органическом синтезе.
Na:
o в качестве наполнителей газоразрядных ламп; o в качестве теплоносителя в ядерных реакторах; o в органическом и неорганическом синтезе; o в металлургии при производстве металлов и сплавов.
K:
o для получения металлов;
o в качестве теплоносителя в ядерных реакторах;
o в фотоэлементах в качестве преобразователя световой энергии в
электрическую. Rb, Cs:
o в источниках инфракрасного излучения; o в фотоэлементах.
Элементы IIА-группы. Общая характеристика щелочно-земельных металлов. Кальций в природе, его биологическая роль.
Во 2 группу (IIa группу по старой классификации) периодической таблицы химических элементов Д. И. Менделеева входят 6 металлов: бериллий, магний, кальций, стронций, барий, радий (см. таблицу выше). Последние четыре - Ca, Sr, Ba, Ra называют щелочноземельными металлами, поскольку гидроксиды этих металлов обладают щелочными свойствами, а их оксиды по своей тугоплавкости похожи на оксиды тяжелых металлов, называемых ранее "землями".
Самым распространенным в земной коре элементом 2(IIa) группы является кальций (4,1% по массе), далее идут: магний (2,3%), барий (0,05%), стронций (0,037%), бериллий (0,00026%), радий (6·10-11).
Наиболее важным элементом подгруппы берилия является кальций, который входит в состав костей всех животных и человека, определяя их прочность. Концентрация ионов кальция и магния в воде определяет ее жесткость.
Элементы 2(IIa) группы в свободном виде в природе не встречаются, но входят в состав многих соединений:
Be:
o 3BeO·Al2O3·SiO2 - минерал берилл; o берилл с примесью Cr2O3 - изумруд; o берилл с примесью Fe - аквамарин; o (BeAl2)O4 - хризоберилл; o (BeAl2)O4 с примесью Cr - александрит.
Mg:
o MgCO3·CaCO3 - доломит;
o MgCO3 - магнезит; o MgO·Al2O3 - шпинель; o 2MgO·SiO3 - оливин;
o магний содержится в морской воде, а также входит в состав
хлорофилла - важнейшей части фотосинтезирующего аппарата растений.
Ca:
o CaCO3 - кальцит; o CaSO4·2H2O - гипс; o CaF2 - флюорит; o Ca5(PO4)3F - фторапатит; o Ca3(PO4)2 - фосфат кальция.
• Sr и Ba встречаются в виде карбонатов и сульфатов.
Физические свойства:
• металлы II группы имеют серебристо-белый цвет;
• низкую плотность (плотность увеличивается в подгруппе сверху-
вниз);
• низкую температуру плавления (температуры плавления
уменьшаются в подгруппе сверху-вниз); обладают высокой пластичностью; высокой электро- и теплопроводностью.
Все атомы элементов 2(IIa) группы на внешнем энергетическом уровне имеют по два валентных s-электрона (см. Электронная конфигурация атомов), с которыми в химических соединениях достаточно легко "расстаются", завершая, таким образом, свой внешний энергетический уровень, который становится устойчивым, по аналогии с завершенным энергетическим уровнем инертных газов.
Таким образом, отдавая "ненужные" валентные электроны (см. Валентность), элементы 2(IIa) группы в химических соединениях проявляют степень окисления +2, являясь сильными восстановителями, проявляя при этом высокую реакционную способность.
С ростом порядкового номера химического элемента увеличивается не только общее кол-во электронов (энергетических уровней), но также и радиус атома, что в свою очередь, обуславливает уменьшение энергии ионизации (соответственно усиление металлических свойств элемента) в направлении от бериллия к радию. В этом ряду активность металлов и их восстановительные свойства возрастают.
Наибольшее значение из всех шести элементов 2(IIa) группы имеют магний и кальций - металлы серебристо-белого цвета, мягкие и очень легкие, о них и пойдет речь дальше.
• при нагревании выше 600°C магний сгорает на воздухе ослепительно ярким белым пламенем (при н. у. магний защищен оксидной пленкой), с образованием оксида и нитрида магния:
O2 + 2Mg = 2MgO; N2 + 3Mg = Mg3N2;
• кальций на влажном воздухе быстро реагирует с кислородом покрываясь рыхлой пленкой (смесь оксида и гидроксида кальция), при нагревании в кислороде воспламеняется: O2 + 2Ca = 2CaO; при н. у. легко реагируют с галогенами, образуя галогениды:
Ca + Cl2 = CaCl2; Mg + Cl2 = MgCl2;
• при нагревании реагируют с неметаллами, образуя гидриды, нитриды, сульфиды, карбиды: o H2 + Mg = MgH2; o N2 + 3Ca = Ca3N2; o S + Mg = MgS; o 2C + Ca = CaC2.
• при кипячении магний вытесняет из воды водород, образуя гидроксид магния (кальций реагирует с водой при н. у.):
2H2O + Mg = Mg(OH)2 + H2; 2H2O + Ca = Ca(OH)2 + H2; реагируют с соляной и разбавленной серной кислотой:
Ca + 2HCl = CaCl2 + H; Mg + H2SO4(рзб) = MgSO4 + H2;
• реагируют с разбавленной азотной кислотой, образуя нитрат аммония: 4Mg + 10HNO3(рзб) = 4Mg(NO3)2 + NH4NO3 + 3H2O;
• с концентрированной азотной кислотой (магний реагирует при нагревании): 4Mg + 10HNO3(кнц) = 4Mg(NO3)2 + N2O + 5H2O;
• с концентрированной серной кислотой:
4Mg + 5H2SO4(кнц) = 4CaSO4 + H2S + 4H2O;
• поскольку атомы элементов 2(IIa) группы являются сильными восстановителями, магний и кальций используются в реакциях восстановления металлов из их оксидов и галогенов, что находит широкое практическое применение в реакциях метллотермии, когда для получения редкоземельных металлов используют гораздо более распространенные щелочноземельные металлы:
o магнийтермия (в вакууме): 2RbCl + Ca = 2Rb + CaCl2; o кальцийтермия (в вакууме): 2CsCl + Mg = 2Cs + MgCl2.
Оксиды и гидроксиды магния и кальция... Получение магния и кальция
• электролизом расплавов солей: MgCl2 → Mg + Cl2;
• металлотермией (промышленный способ) при t>1200°C в электропечи в условиях вакуума, восстанавливая металлы из их соединений: 3CaO + 2Al = 3Ca + Al2O3;
• углетермией (восстановлением оксидов углем) в электропечи при t>2000°C: MgO + C = Mg + CO. Применение Be:
o в качестве легирующей добавки к сплавам, придавая им
твердость и прочность;
o как замедлитель и отражатель нейтронов в атомной промышленности.
Mg:
o широко используется в конструкционных сверхлегких сплавах в
автомобиле- и авиастроении;
o для получения редкоземельных металлов методом
металлотермии; o в органическом синтезе; o в фото- и пиротехнике.
Ca:
o в металлургии для удаления различных примесей при выплавке
сталей и других сплавов;
o для получения редкоземельных металлов методом
металлотермии; o для выделения из воздуха инертных газов.
Кальций в природе, его биологическая роль.
Кальций является структурным макроэлементом, содержание которого превышает по своему содержанию все остальные элементы в организме
(кроме элементов-органогенов).
Общее количество кальция у взрослого человека может составлять более одного килограмма.
Практически весь (99%) кальций в организме находится в зубах и костях скелета, и только около 1% - во всех остальных органах, тканях и биологических жидкостях.
Биологическая роль кальция
Прежде всего, кальций является важнейшим структурным компонентом костей и зубов.
Также кальций регулирует проницаемость клеточных мембран, а также инициирует ответы клеток на различные внешние стимулы. Присутствие кальция в клетки или во внеклеточной среде обуславливает дифференцировку клетки, а также сокращение мышц, секрецию и перистальтику. Кальций регулирует активность многих ферментов (включая ферменты систем свертывания крови). Кальций регулирует работу некоторых эндокринных желез, обладает десенсибилизирующим и противовоспалительным эффектом.
Основные функции кальция в организме:
• структурный компонент костей и зубов
• участвует в мышечных сокращениях
• регулирует проницаемость клеточных мембран
• участвует проводимости сигнала по нервным клеткам
• регулирует сердечную деятельность
• участвует в свертывании крови
Пищевые источники кальция
Во многих продуктах питания растительного происхождения кальций содержится в виде труднорастворимых соединений (фосфатов, карбонатов, оксалатов), что обуславливает его плохое усвоение из них. Наиболее важным источником кальция является молоко (120мг/100г) и молочные продукты (особенно следует выделить сыр – содержит около 1000мг/100г). За счет молочных продуктов удовлетворяется до 80% от физиологической потребности человека в кальции.
Среди растительных продуктов кальцием наиболее богаты ламинария, орехи и семена, как миндаль, лесной орех, кунжут, фисташки, фасоль, инжир, брюква, капуста брокколи, капуста, хрен, петрушка, лук, курага, яблоки и др.
Дополнительным существенным источником кальция являются специально обогащенные пищевые продукты (соки и мука).
Дефицит кальция
Основные факторы, приводящие к дефициту кальция в организме:
• гиповитаминоз по витамину D;
• нерациональное питание (дефицит кальция в поступающей
пище);
• нарушения всасывания Ca;
• избыточное поступление веществ, препятствующих усвоению кальция или способствующих его быстрому выведению (фосфор, щавелевая кислота, свинец, цинк, магний, кобальт, железо);
• болезни щитовидной железы и паращитовидных желез;
• некомпенсированная повышенная потребность в кальции (рост у детей, беременность и лактация, постменопауза);
• повышенное выведение кальция при использовании мочегонных и слабительных средств.
Последствия дефицита кальция:
• сниженная плотность костей, переломы, деформация позвонков, остеоартроз, остеопороз;
• повышенная утомляемость, общая слабость как реакция
организма на дефицит кальция;
• судороги, боли в мышцах;
• нарушения роста;
• болезнь Кашина-Бека, в списке основных причин, развития которой значится дефицит микроэлементов, поступающих в организм с продуктами и водой, в том числе и кальция;
• мочекаменная болезнь;
• нарушения свертываемости крови, кровоточивость. Избыток кальция Основные причины:
• избыточное поступление с пищевыми продуктами,
лекарственными средствами и БАД к пище
• нарушения обмена кальция, включая связанные с нарушением регуляции (нарушение функции паращитовидной и щитовидной железы, заболевания и травмы нервной системы)
• гипервитаминоз по витамину D
Последствия:
• снижение возбудимости скелетных мышц и нервных волокон
• снижение тонуса гладких мышц
• повышенная свертываемость крови
• повышение кислотности желудочного сока (гиперацидный
гастрит, язвы желудка)
• кальциноз, отложение кальция в органах и тканях
• брадикардия, стенокардия
• подагра
• увеличение выделения солей кальция с мочой, нефрокальциноз, почечно-каменная болезнь
• увеличение риска заболеваний щитовидной и паращитовидных желез, аутоиммунного тиреоидита
Суточная потребность в кальции: 1000 мг у мужчин и 1200 мг у женщин
ТЕМА 32. Алюминий, получение, физические и химические свойства.
Соединения алюминия, их свойства, применение. Особенности строения атомов d-элементов ( IB –VIIIB групп). Медь, цинк, хром, железо,
марганец, их простые вещества, их физические и химические свойства.
Соединения d-элементов в различной степени окисления, характер свойств.
Открыт Х.К.Эрстедом в 1825 г. Четвертый по распространённости элемент в земной коре.
Физические свойства
Серебристо-белый, пластичный, имеющий высокую тепло- и электропроводность, легкий металл с tпл.= 660ºC.
Нахождение в природе
В природе находится в виде бокситов – Al2O3 • H2O (с примесями SiO2, Fe2O3, CaCO3), нефелинов – KNa3[AlSiO4]4, алунитов - KAl(SO4)2 • 2Al(OH)3 и глинозема (смеси каолинов с песком SiO2, известняком CaCO3, агнезитом MgCO3).
Получение Получают электролизом расплава Al2O3 (в присутствии криолита
Na3[AlF6]):
2Al2O3 → 4Al + 3O2↑
Химические свойства
Al – покрыт тонкой и прочной оксидной пленкой (не реагирует с простыми веществами: с H2O (tºC); O2, HNO3 (без нагревания)).
Al – активный металл, восстановитель. Легко реагирует с простыми веществами:
• с кислородом: 4Al0 + 3O2 → 2Al+3 2O3;
• с галогенами: 2Al0 + 3Br2 0 → 2Al+3Br3;
• с другими неметаллами (азотом, серой, углеродом) реагирует при нагревании:
2Al0 + 3S – tºC→ Al2 +3S3 (сульфид алюминия);
2Al0 + N2 – tºC→ 2Al+3N (нитрид алюминия);
4Al0 + 3С – tºC→ Al4 +3С3(карбид алюминия)
Сульфид и карбид алюминия полностью гидролизуются:
Al2S3 + 6H2O → 2Al(OH)3↓+ 3H2S↑; Al4C3 + 12H2O → 4Al(OH)3↓+ 3CH4↑ Со сложными веществами:
• с водой (после удаления защитной оксидной пленки): 2Al0 + 6H2O → 2Al +3(OH)3 + 3H2↑;
• с растворами щелочей: 2Al0 + 2NaOH + 6H2O →2Na[Al+3(OH)4]
(тетрагидроксоалюминат натрия) + 3H2↑
• Легко растворяется в соляной и разбавленной серной киcлотах: 2Al +
6HCl → 2AlCl3 + 3H2↑;
2Al + 3H2SO4 (разб) → Al2(SO4)3 + 3H2↑
При нагревании растворяется в кислотах - окислителях:
2Al + 6H2SO4 (конц) → Al2(SO4)3 + 3SO2↑ + 6H2O;
Al + 6HNO3 (конц) → Al(NO3)3 + 3NO2↑ + 3H2O
• Восстанавливает металлы из их оксидов (алюминотермический метод):
8Al0 + 3Fe3O4 → 4Al2O3 + 9Fe;
2Al + Cr2O3 → Al2O3 + 2Cr
Применение
Al - основа легких и прочных сплавов. Раскислитель стали.
Используется для получения ряда металлов алюминотермическим методом. Оксид алюминия Al2O3
O=Al–O–Al=O
Глинозем, корунд, окрашенный – рубин (красный), сапфир (синий). 88 Твердое тугоплавкое (tºпл.=2050ºС) вещество; существует в нескольких кристаллических модификациях.
Получение Получают:
• Окислением металла: 4Al + 3O2 → 2Al2O3;
• Термическим разложением гидроксида: 2Al(OH)3 → Al2O3 + 3H2O
Амфотерный оксид с преобладанием основных свойств; не растворяется в воде.
• Реагирует с кислотами и растворами щелочей:
Как основной оксид: Al2O3 + 6HCl → 2AlCl3 + 3H2O;
Как кислотный оксид: Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]; Сплавляется со щелочами или карбонатами щелочных металлов:
Al2O3 + Na2CO3 → 2NaAlO2(алюминат натрия) + CO2↑;
Al2O3 + 2NaOH → 2NaAlO2 + H2O↑
Получение
• Осаждением из растворов солей щелочами или гидроксидом аммония:
AlCl3 + 3NaOH → Al(OH)3↓+ 3NaCl;
Al3+ + 3OH- → Al(OH)3↓белый
Al2(SO4)3 + 6NH4OH → 2Al(OH)3↓ + 3(NH4)2SO4;
Al3+ + 3NH4OH → Al(OH)3↓ + 3NH4; Слабым подкислением растворов алюминатов: Na[Al(OH)4] + CO2 → Al(OH)3↓ + NaHCO3 Амфотерный гидроксид:
• Как основание реагирует с кислотами:Al(OH)3 + 3HCl → AlCl3 + 3H2O;
• Как кислота взаимодействует с растворами щелочей: Al(OH)3 + NaOH → Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Алюминотермия (от алюминий и греч. thérme — теплота), алюминотермический процесс, получение металлов и сплавов восстановлением оксидов металлов алюминием. Шихта (из порошкообразных материалов) засыпается в плавильную шахту или тигель и поджигается с помощью запальной смеси. Если при восстановлении выделяется много теплоты, осуществляется внепечная алюминотермия, без подвода тепла извне, развивается высокая температура (1900 – 2400°С), процесс протекает с большой скоростью, образующиеся металл и шлак хорошо разделяются. Если теплоты выделяется недостаточно, в шихту вводят подогревающую добавку или проводят плавку в дуговых печах (электропечная алюминотермия). В Россиии электропечная алюминотермия широко распространена. Алюминотермию применяют для получения низкоуглеродистых легирующих сплавов трудновосстановимых металлов — титана, ниобия, циркония, бора, хрома и др., для сварки рельсов и деталей стального литья; для получения огнеупора – термиткорунда. Алюминотермический метод открыт русским учёным Н. Н. Бекетовым (1859), в промышленности внепечной процесс освоен немецким химиком Г.
Гольдшмидтом (1898).
В периодической системе d-элементы или переходные металлы расположены в побочных подгруппах (или В подгруппах) всех восьми групп.
Это элементы, которые при образовании соединений имеют незаполненную d-орбиталь.
Под определение не подпадают скандий (3d0 в соединениях) и цинк (3d10 в соединениях); медь же входит в группу указанных соединений, если имеет в них конфигурацию 3d9.
Принято, однако, относить эти металлы к d-металлам на основании химического сходства их соединений.
Общую электронную формулу валентного слоя d-элементов можно выразить формулой: ns2(n-1)d1-10
![]() В периоде слева
направо происходит некоторое уменьшение атомного радиуса элементов. Это
обусловлено эффектом «d-сжатия», вызванного постепенным увеличением заряда ядер
и усилением кулоновского притяжения электронов к ядру.
В периоде слева
направо происходит некоторое уменьшение атомного радиуса элементов. Это
обусловлено эффектом «d-сжатия», вызванного постепенным увеличением заряда ядер
и усилением кулоновского притяжения электронов к ядру.
В подгруппах сверху вниз (кроме IIIB группы) атомный радиус несколько уменьшается или остается практически неизменным за счет сокращения размеров внутренних f-орбиталей («лантаноидное сжатие»). При этом химическая активность металлов уменьшается, что отличает их от металлов главных подгрупп.
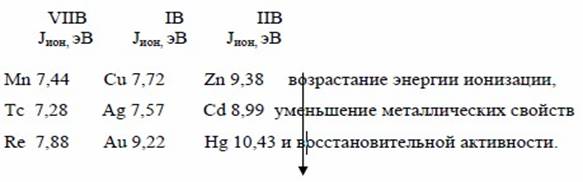
У элементов IIIВ группы атомные радиусы возрастают, химическая активность увеличивается, благодаря чему они проявляют большее сходство с элементами главных подгрупп, чем побочных. По реакционной способности элементы подгруппы скандия уступают лишь щелочным и щелочноземельным металлам.
В периодах слева направо металлические свойства уменьшаются.
Минимальные восстановительные свойства проявляют тяжелые металлы VIIIB и IB – групп. За свою инертность они названы благородными.
В химических реакциях электроны d-орбиталей участвуют после того, как оказываются использованными s-электроны внешнего энергетического уровня.
В образовании связей могут участвовать все или только часть dэлектронов предпоследнего энергетического уровня, поэтому образуются соединения с различной валентностью или степенью окисления (кроме dэлементов II и III групп).
Например, характерными для элементов VIIIВ группы являются следующие степени окисления (в скобках – наиболее устойчивые):
Fe Co Ni семейство железа
+2,(+3),+6 +2,(+3) +2,(+3)
Ru Rh Pd легкие платиновые металлы +3,(+4),+6,+8 (+3),+4 (+2),(+4)
Оs Ir Pt тяжелые платиновые металлы +4,(+6),+8 +3,(+4) +2,(+4),+6
Таким образом, особенностями электронного строения dэлементов обусловлены и их свойства:
а) большое разнообразие проявляемых валентностей и степеней
окисления;
б) способность образовывать различные комплексные соединения;
в) каталитическая активность.
Физические свойства d-металлов
Физические свойства переходных металлов зависят от электронного строения, от числа неспаренных d-электронов, которые могут участвовать в образовании связей.
• Металлы, у которых по 3–4 неспаренных d-электрона (VВ и VIВ группы), имеют максимальную температуру плавления и кипения.
• Переходные металлы, имеющие на внешнем s-подуровне один электрон, как правило, имеют более высокую электрическую проводимость (Cr, Мo и особенно Cu, Ag, Au).
• Элементы III-В группы, имеющие всего один d-электрон, по своим свойствам близки к соседним щелочноземельным металлом,
• а металлы II-В группы с полностью заполненным d-подуровнем близки по свойствам к соседним р-элементам.
Химические свойства d-металлов
Все d-элементы являются восстановителями. Восстановительная способность в растворах в пределах периода уменьшается.
Наиболее сильными восстановителями являются металлы IIIВ группы.
У большинства d-элементов образуются защитные оксидные пленки, вызывающие их пассивацию и предохраняющие их от коррозии. Наиболее склонны к пассивации металлы IVВ–VIВ групп.
Элементы IIIВ и IIВ групп (кроме ртути) легко взаимодействуют с разбавленными кислотами, а лантан взаимодействует и с водой.
Не взаимодействуют с разбавленными кислотами металлы IВ группы, ртуть и платиновые металлы (Ru, Rh, Pd, Os, Ir, Pt). Сравнение некоторых свойств металлов
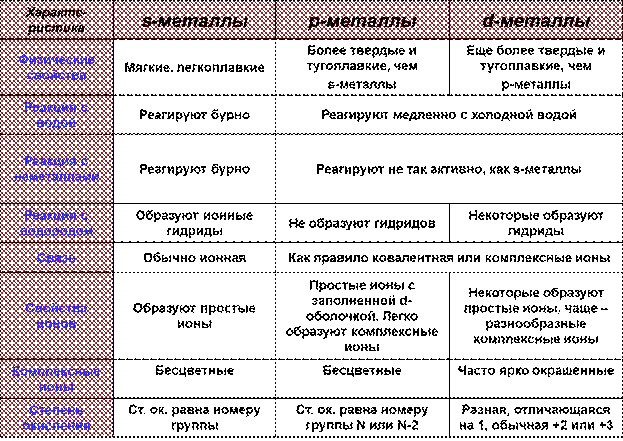
Строение и свойства соединений d-элементов зависят от степени окисления металла

Оксиды и гидроксиды d-элементов
Переходные металлы реагируют с кислородом, образуя оксиды (искл.
Ag, Au). Почти все они нерастворимы в воде, черного или иного цвета.
Обладают заметной ковалентностью связей.
|
Оксид железа (II) FeO, магнитный железняк (магнетит) Fe3O4 и красный железняк (гематит) Fe2O3 (в чашке).
|
Оксид хрома Сr2O3 |
Гидроксиды переходных металлов получают добавлением щелочей к растворам, содержащим соответствующие ионы металла. Цвет образующегося осадка часто используют для идентификации присутствующего металла. Все осадки гелеобразны вследствие гидратации и обладают основными свойствами. Некоторые амфотерны, а некоторые образуют растворимые комплексы с аммиаком:

С ростом степени окисления атома металла кислотные свойства соответствующих соединений усиливаются:
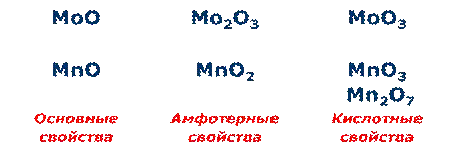
В пределах одной подгруппы для гидроксидов и оксидов d-элементов в одинаковой степени окисления характерно увеличение основных свойств:
В периоде кислотные свойства гидроксидов в высшей степени окисления металла усиливаются:
Ti(OH)4 – HVO3 – H2CrO4 – HMnO4 – H2FeO4
Медь находится в четвертом периоде, группе IБ. Ее электронная формула 29Cu 1s22s22p63s23p63d104s1, наиболее устойчивые степени окисления
+2 и +1. Медь в промышленности получают пирометаллургическим методом, что можно описать следующим уравнением:
![]()
Полученную медь называют черновой (содержание меди 95–98%). Затем медь подвергают электролитическому рафинированию для получения меди высокой чистоты. Металл малой активности, в ряду напряжений металлов медь расположена после водорода. Ее химические свойства:
Йодид меди (II) не существует. Попытки получить его реакциями обмена приводят к иодиду меди (I) и йоду, например:
В электрохимическом ряду напряжений металлов медь расположена после водорода, поэтому с разбавленной соляной кислотой она не реагирует. Однако с концентрированной соляной кислотой она взаимодействует с образованием дихлоркупрата (I) водорода:
![]()
Кроме того, медь способна взаимодействовать с соляной кислотой в присутствии кислорода воздуха:
![]()
Медь образует оксиды состава Cu2O, CuO. Первый проявляет основные, а второй амфотерные с преобладанием основных свойства. Оба оксида легко восстанавливаются до меди под действием различных восстановителей:
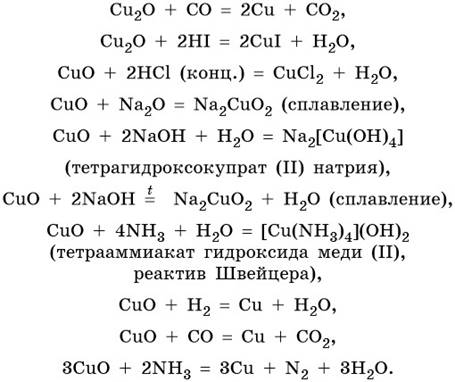
Гидроксид меди (II) Cu(OH)2 разлагается при нагревании, проявляет амфотерные свойства с преобладанием основных:
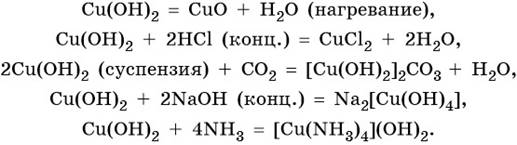
Цинк находится в четвертом периоде, группе IIБ. Его электронная формула 30Zn 1s22s22p63s23p63d104s2. В промышленности цинк получают либо электролизом водного раствора его сульфата, либо пирометаллургическим методом: сернистые руды подвергают обжигу с последующим восстановлением оксида цинка коксом:
![]()
Цинк относится к металлам средней активности, в своих соединениях проявляет единственную степень окисления +2. Характерные для цинка химические реакции:
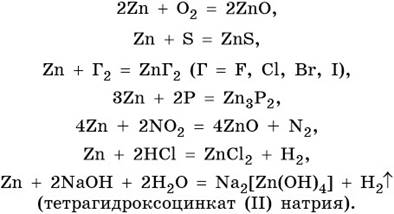
Особенностью цинка являются его реакции с серной и азотной кислотами различной концентрации. При этом в зависимости от концентрации кислот образуются различные продукты реакции:
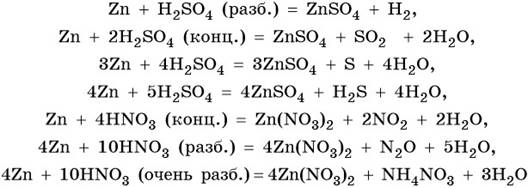
Оксид и гидроксид цинка являются амфотерными. Их характерные реакции:
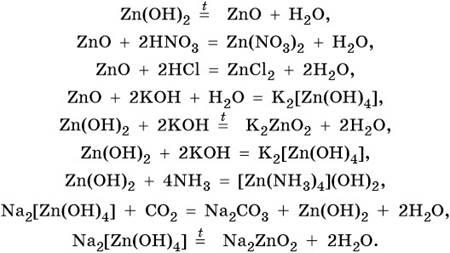
Хром расположен в четвертом периоде, группе VIБ. Его электронная формула 24Cr 1s22s22p63s23p63d54s1. Металл средней активности. В своих соединениях хром проявляет степени окисления +2, +3 и +6. В промышленности чистый хром получают восстановлением оксида хрома методом алюминотермии:
![]()
Его характерные химические реакции:
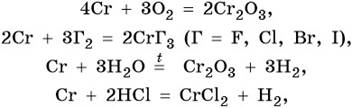
Хром образует ряд оксидов: CrO — основный оксид, Cr2O3 — амфотерный оксид, CrO3 — кислотный оксид, следовательно, рост степени окисления сопровождается усилением кислотных свойств. Все оксиды хрома вступают в окислительно-восстановительные реакции.
Ниже приведены характерные для этих соединений химические реакции:
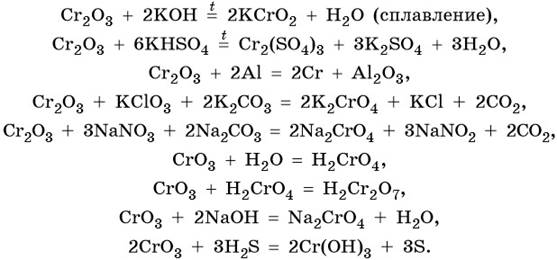
Гидроксид хрома (III) проявляет амфотерные свойства, вступает в окислительно-восстановительные реакции:
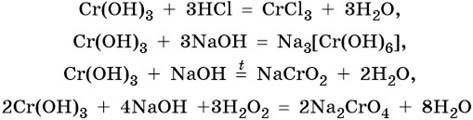
Марганец расположен в четвертом периоде, группе VIIБ, Периодической системы Д.И. Менделеева. Его электронная формула 1s22s22p63s23p63d54s2. Характерные степени окисления марганца +2, +4, +6 и +7. В чистом виде марганец получают термическим восстановлением оксидов или галогенидов водородом, натрием, магнием, алюминием, углеродом или кремнием (метод кремнийтермии):
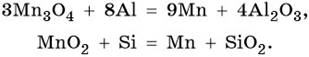
Особо чистый марганец получают электролизом водного раствора сульфата марганца (II).
Химические свойства марганца:
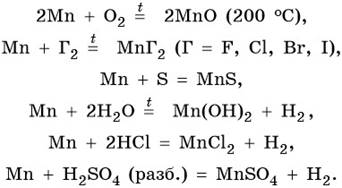
Марганец образует пять оксидов: MnO, Mn2O3, MnO2, MnO3, Mn2O7. MnO проявляет основные свойства. Mn2O3 при взаимодействии с разбавленными растворами кислот диспропорционирует, а при нагревании с концентрированными растворами кислот выделяет кислород:
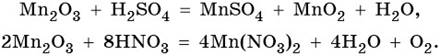
MnO2 не взаимодействует ни со щелочами, ни с разбавленными растворами кислот. С концентрированными кислотами при нагревании реагирует так же, как и Mn2O3:
![]()
Mn2O7 — единственный среди оксидов марганца, который является жидкостью при нормальных условиях. Кислотный оксид. Разлагается уже при температуре 55 °С, при ударе может взорваться.
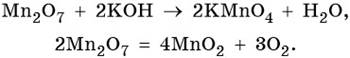
Железо находится в четвертом периоде, группе VIIIБ. Его электронная формула 26Fe 1s22s22p63s23p63d64s2. Металл средней активности, в своих соединениях проявляет степени окисления +2 и +3. Известны ряд соединений железа со степенью окисления +6. Они являются сильными окислителями. Химически чистое железо получают разложением его пентакарбонила:
![]()
Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом (сталь, чугун) и другими элементами. Эти сплавы получают в доменных печах. Упрощенно этот процесс можно описать уравнением:
![]()
Характерные для железа химические реакции:
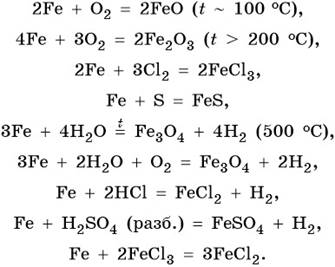
FeO проявляет основные, а Fe2O3 — амфотерные с преобладанием основных свойства. Оба оксида вступают в окислительно-восстановительные реакции:
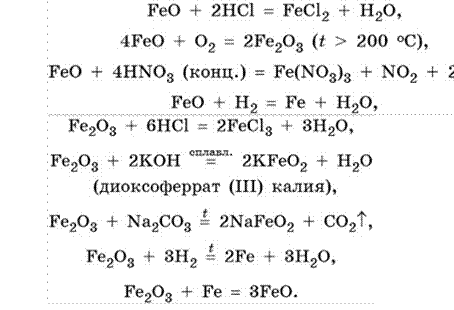
Для двойного оксида железа (II) — железа (III) Fe3O4 (магнетит) характерны в первую очередь окислительно-восстановительные реакции, а также реакции обмена, которые идут также, как и у входящих индивидуально в его состав оксидов:
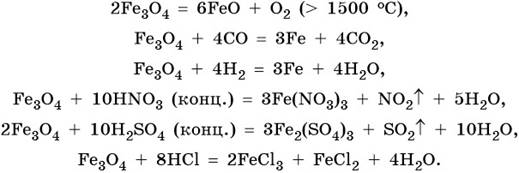
Гидроксид железа (II) практически проявляет только основные свойства, при нагревании разлагается, вступает в окислительновосстановительные реакции:
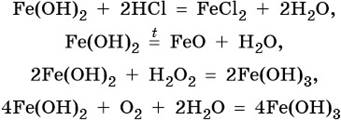
Гидроксид железа (III) проявляет амфотерные с преобладанием основных свойства, при нагревании разлагается, вступает в окислительновосстановительные реакции:
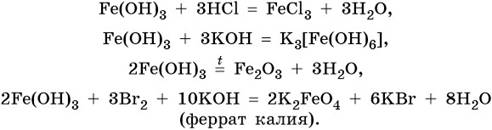
Йодид железа (III) не существует. Попытки получить его обменными реакциями приводят к йодиду железа (II) и йоду:
![]()
Тема 33. Углерод, кремний. Характерные оксиды и гидроксиды углерода и кремния, соли угольной и кремневой кислоты. Силикаты в промышленности. Элементы VА-группы. Общая характеристика
химические свойства. Водородные соединения элементов VА-группы, оксиды азота и фосфора, кислотные свойства, значение.
Биологическая роль азота и фосфора.
В IV A подгруппе к неметаллам относятся углерод и кремний. УГЛЕРОД
С – имеет 2s22p2 валентные электроны, высшая степень окисления углерода +4, низшая – 4. Формулы высшего оксида СО2. Имеет кислотный характер. Ему соответствует угольная кислота Н2СО3, которая является слабым электролитом.
Углерод имеет несколько аллотропных модификаций. Аллотропия – способность атомов одного и того же элемента образовывать несколько соединений, имеющих одинаковый состав, но различное строение и свойства.
Алмаз.Кристаллическое вещество, прозрачное, сильно преломляет лучи света, очень твёрдое, не проводит электрический ток, плохо проводит тепло, = 3,5 г/см3 ; tпл. = 3730C; tкип. = 4830C.
Атомы углерода находятся в sp3 - гибридизации и образуют атомную кристаллическую решётку с прочными ковалентными - связями. Алмаз можно получить из графита при p > 50 тыс. атм; t = 1200C.
Графит. Кристаллическое вещество, слоистое, непрозрачное, тёмносерое, обладает металлическим блеском, мягкое, проводит электрический ток; r = 2,5 г/см3 . В кристаллической решётке атомы углерода находятся в sp2 - гибридном состоянии и образуют слои из шестичленных колец; между слоями действуют межмолекулярные силы.
Карбин. Чёрный порошок; ρ = 2 г/см3 ; полупроводник. Состоит из линейных цепочек –C≡C–C≡C– и =С=С=С=С=; атомы углерода находятся в spгибридном состоянии. При нагревании переходит в графит. Химические свойства
Углерод - малоактивен, на холоде реагирует только с фтором; химическая активность проявляется при высоких температурах.
Восстановительные свойства: t
• взаимодействие с кислородом: C + O2 → CO2; - при недостатке кислорода наблюдается неполное сгорание:
t
2C 0 + O2 → 2C +2O (угарный газ);
• взаимодействие с фтором: С + 2F2 → CF4;
• взаимодействие с водяным паром: C 0 + H2O – 1200ºC→С +2O + H2 (водяной газ);
• взаимодействие с оксидами металлов: C 0 + 2CuO – tºC→ 2Cu + C +4O2; взаимодействие с кислотами – окислителями:
C 0 + 2H2SO4(конц.) → С +4O2 + 2SO2 + 2H2O; С 0 + 4HNO3(конц.) → С+4O2 + 4NO2 + 2H2O Окислительные свойства: с некоторыми металлами образует карбиды: 4Al + 3C 0 → Al4C3; Ca + 2C 0 → CaC2 -4 ;
• взаимодействие с водородом: C 0 + 2H2 → CH4 Оксид углерода (II) CO
Угарный газ; бесцветный, без запаха, малорастворим в воде, растворим в органических растворителях, ядовит, tкип = –192ºC; t пл. = –205ºC. Получение
• в промышленности (в газогенераторах):
C + O2 CO2; CO2 + C 2CO;
• в лаборатории - термическим разложением муравьиной или щавелевой кислоты в присутствии H2SO4(конц.):
HCOOH H2O + CO; H2C2O4 CO + CO2 + H2O
Химические свойства
При обычных условиях CO инертен; при нагревании – восстановитель; несолеобразующий оксид.
• с кислородом: 2C +2O + O2 → 2C +4O2;
• с оксидами металлов: C +2O + CuO → Сu + C +4O2;
• с хлором (на свету): CO + Cl2 – hν→ COCl2 (фосген);
• с переходными металлами образует карбонилы: 19 Ni + 4CO – tºC→ Ni(CO)4;
Fe + 5CO – tºC→ Fe(CO)5
Оксид углерода (IV) СO2
Углекислый газ, бесцветный, без запаха, растворимость в воде - в 1V H2O растворяется 0,9V CO2 (при нормальных условиях); тяжелее воздуха; t пл.= -78,5ºC (твёрдый CO2 называется "сухой лёд"); не поддерживает горение.
Структурная формула: O=C=O
Получение СO2:
• термическим разложением солей угольной кислоты (карбонатов).
Обжиг известняка: CaCO3 – tº→ CaO + CO2;
• действием сильных кислот на карбонаты и гидрокарбонаты:
CaCO3 + 2HCl → CaCl2 + H2O + CO2 ; NaHCO3 + HCl → NaCl + H2O + CO2;
Химические свойства
• СO2 - кислотный оксид: реагирует с основными оксидами и основаниями, образуя соли угольной кислоты: Na2O + CO2 → Na2CO3; 2NaOH + CO2 → Na2CO3 + H2O;
NaOH + CO2 → NaHCO3 ;
• при повышенной температуре может проявлять окислительные свойства: С +4O2 + 2Mg – tº→ 2Mg+2O + C 0
Угольная кислота и её соли
• кислота слабая, существует только в водном растворе:
CO2 + H2O ↔ H2CO3
Угольная кислота – двухосновная: H2CO3 ↔ H+ + HCO3 - ;
HCO3 - ↔ H+ + CO3 2-
Для нее характерны все свойства кислот.
Образует средние соли карбонаты (СO3 2- ) и кислые соли - гидрокарбонаты (HCO3 - ).
Карбонаты и гидрокарбонаты могут превращаться друг в друга:
2NaHCO3 – tº→ Na2CO3 + H2O + CO2; Na2CO3 + H2O + CO2 → 2NaHCO3.
Карбонаты металлов (кроме щелочных металлов) при нагревании разлагаются с образованием оксида: CuCO3 – tº→ CuO + CO2
Качественная реакция - "вскипание" при действии сильной кислоты:
Na2CO3 + 2HCl → 2NaCl + H2O + CO2 ↑; CO3 2- + 2H+ → H2O + CO2 ↑ КРЕМНИЙ
Открыт Ж. Гей-Люссаком и Л.Тенаром в 1811г. Второй по распространённости элемент в земной коре (27,6% по массе). Электронная формула: 1s22s22p63s23p2 . Степени окисления: + 4, - 4.
Аллотропия
Кристаллический – тёмно-серое вещество с металлическим блеском, большая твёрдость, хрупок, полупроводник; ρ = 2,33 г/см3 , t°пл. =1415°C; t°кип. = 2680°C. Имеет алмазоподобную структуру (sp3 - гибридизация атомов кремния) и образует прочные ковалентные s- связи. Инертен.
Аморфный - бурый порошок, гигроскопичен, алмазоподобная структура, r = 2 г/см3 , более реакционноспособен.
Получение:
• карботермическим способом: 2С + Si+4O2 – tº→ Si0 + 2CO;
• магнийтермическим способом: 2Mg + Si+4O2 – tº→ 2MgO + Si0 Химические свойства Типичный неметалл, инертен.
• Как восстановитель реагирует:
а) с кислородом: Si0 + O2 – tº→ Si+4O2;
б) с фтором (без нагревания): Si0 + 2F2 SiF4↑;
в) с углеродом: Si0 + C – tº→ Si+4C (SiC - карборунд – твёрдый;
используется для точки и шлифовки); с водородом не взаимодействует.
Силан (SiH4) получают разложением силицидов металлов кислотой: Mg2Si + 2H2SO4 SiH4↑ + 2MgSO4;
• с кислотами не реагирует. Растворяется только в смеси азотной и плавиковой кислот:
3Si + 4HNO3 + 18HF → 3H2 [SiF6] + 4NO + 8H2O;
• со щелочами (при нагревании): Si0 + 2NaOH + H2O – tº→ Na2Si+4O3+
2H2;
• как окислитель: с металлами (образуются силициды): Si0 + 2Mg – tº→ Mg2Si-4 .
Силан SiH4
Бесцветный газ, ядовит, t пл. = -185ºC, tкип. = -112ºC. Получение
Получают силан действием соляной кислоты на силицид магния:
Mg2Si + 4HCl → 2MgCl2 + SiH4
Химические свойства
• силан окисляется кислородом: SiH4 + 2O2 → SiO2 + 2H2O;
• разлагается: SiH4 → Si + 2H2
Оксид кремния (IV) (SiO2)n
SiO2 - кварц, горный хрусталь, аметист, агат, яшма, опал, кремнозём (основная часть песка).
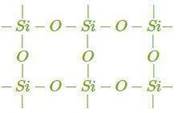
Al2O3 • 2SiO2 • 2H2O - каолинит (основная часть глины)
K2O • Al2O3 • 6SiO2 - ортоклаз (полевой шпат) Физические свойства
Твёрдое, тугоплавкое вещество, tпл.= 1728ºC, tкип.= 2590ºC.
SiO2 – Кислотный оксид
При сплавлении взаимодействует с основными оксидами, щелочами, а также с карбонатами щелочных и щелочноземельных металлов:
• с основными оксидами: SiO2 + CaO → CaSiO3 ;
• со щелочами: SiO2 + 2NaOH → Na2SiO3 + H2O;
• с солями: SiO2 + CaCO3 – tº→ CaSiO3 + CO2; SiO2 + K2CO3 – tº→ K2SiO3 + CO2;
• с плавиковой кислотой: SiO2 + 4HF → SiF4 + 2H2O;
SiO2 + 6HF → H2 [SiF6] (гексафторкремниевая кислота) + 2H2O (реакции лежат в основе процесса травления стекла).
Оксид кремния не растворяется в воде.
Кремниевые кислоты
x SiO2 * y H2O x = 1, y = 1 H2SiO3 - метакремниевая кислота ; x = 1, y = 2 H4SiO4 - ортокремниевая кислота и т.д
H2SiO3 - очень слабая (слабее угольной), непрочная, в воде малорастворима (образует коллоидный раствор), не имеет кислого вкуса. Получение
Так как оксид кремния нерастворим в воде, то кремниевую кислоту получают реакцией обмена: Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓ При нагревании она разлагается: H2SiO3 – tº→ H2O + SiO2.
Отмытый и высушенный гель кремниевой кислоты называется силикагелем. Соли кремниевой кислоты - силикаты.
Общая характеристика элементов главной подгруппы V группы
(подгруппы азота)
Таблица. Электронное строение и физические свойства
|
Поряд ковый |
Элемент |
Электронная конфигурация |
Атомный радиус, |
ЭО |
Степени окисления |
|
№ |
|
|
нм |
|
|
|
7 |
Азот (N) |
[He] 2s22p3 |
0,075 |
3,0 |
-3, -2, -1, +1, +2, +3, +4, +5 |
|
15 |
Фосфор (P) |
[Ne] 3s23p3 |
0,110 |
2,1 |
-3, +1, +3, +5 |
|
33 |
Мышьяк (As) |
[Ar] 3d104s24p3 |
0,121 |
2,0 |
-3, +3, +5 |
|
51 |
Сурьма (Sb) |
[Kr] 4d105s25p3 |
0,141 |
1,9 |
-3, +3, +4, +5 |
|
83 |
Висмут (Bi) |
[Xe] 4f145d106s26p3 |
0,152 |
1,9 |
+3, +5 |
В ряду –N – P – As – Sb – Bi увеличиваются размеры атомов, ослабляется притяжение валентных электронов к ядру, ослабляются неметаллические свойства, возрастают металлические свойства, ЭО уменьшается.
N, P - типичные неметаллы; As, Sb - проявляют неметаллические и металлические свойства ; Bi - типичный металл.
P, As и Bi существуют в твердом состоянии в нескольких модификациях.
Химические свойства
• Основный характер оксидов R2O5 увеличивается, а кислотный – ослабевает с увеличением порядкового номера;
• Гидроксиды всех элементов в пятивалентном состоянии имеют кислотный характер;
• Основный характер гидроксидов R(OH)3 увеличивается, а кислотный
– ослабевает с увеличением порядкового номера: RO3 3- + 3H+ ↔ R(OH)3 ↔ R 3+ + 3OH- (R – элемент) .
As, Sb, и Bi плохо растворимы в воде.
Восстановительные свойства водородных соединений RH3 усиливаются, а устойчивость уменьшается с увеличением порядкового номера.
:N≡N:
Открыт Д.Резерфордом в 1772 г. Основной компонент воздуха (78% по объему, 75,6% по массе). В молекуле имеются одна σ- и две π- связи. Получение
• Промышленный способ. Перегонка жидкого воздуха.
• Лабораторный способ. Разложение нитрита аммония: NH4NO2 – tº→
N2 + 2H2O
Химические свойства
Молекула N2 очень устойчива (три ковалентные связи), поэтому обладает низкой реакционной способностью, тем не менее азот при особых условиях может проявлять как восстановительные, так и окислительные свойства, так как находится в промежуточной степени окисления.
• Восстановитель:
Высокая температура (электрическая дуга, 3000ºС) N2 0 + O2 → 2N+2O
(в природе - во время грозы); Окислитель:
а) c водородом (500º С, катализатор, P): N2 0 + 3H2 ↔ 2N-3HЗ ;
б) с активными металлами (с щелочными и щелочно-земельными
металлами):
6Li + N2 0 → 2LiЗN-3 ; 3Mg + N2 0 – tº→ MgЗN2 -3
Строение
Молекула полярная, имеет форму треугольной пирамиды с атомом азота в вершине, ∟HNH = 107,3º. Атом азота находится в sp3 - гибридном состоянии; из четырех гибридных орбиталей азота три участвуют в образовании одинарных связей N–H, а четвертая связь занята неподеленной электронной парой.
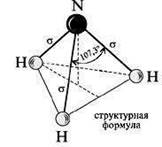
Химические свойства
Образование ковалентной связи по донорно-акцепторному механизму представлено на схеме:
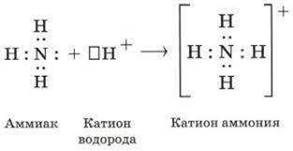
Аммиак - основание Льюиса. Его раствор в воде (аммиачная вода, нашатырный спирт) имеет щелочную реакцию (лакмус – синий; фенолфталеин – малиновый) из-за образования гидроксиды аммония: NH3 + Н2O ↔ NH4OH ↔ NH4 + + OH- . Аммиак реагирует с кислотами с образованием солей аммония: NH3 + HCl → NH4Cl ; NH3 + H2O + CO2 → NH4HCO3;
• Аммиак - восстановитель (окисляется до N2 +1O или N+2O);
• При нагревании разлагается: 2N-3H3 – tº→ N2 0 + 3H2;
• Горит в кислороде: a) без катализатора 4N-3H3 + 3O2 → 2N2 0 + 6Н2O; б) в присутствии катализатора Pt: 4N-3H3 + 5O2 → 4N+2O + 6Н2O;
• Восстанавливает оксиды некоторых металлов: 3Cu+2O + 2N-3H3 →
3Cu0 + N2 0 + 3Н2O
N2 +1O N+4O2
оксид азота (I) закись азота, оксид азота (IV) двуокись азота,
"веселящий газ" диоксид азота
N+2O N2 +5O5
оксид азота (II) окись азота оксид азота (V) азотный ангидрид
N2 +3O3 оксид азота (III) азотистый
ангидрид
HNO2 – Азотистая кислота H–O–N=O
Физические свойства Существует только в разбавленных водных растворах. Получение
Получают действием соляной кислоты на нитриты металлов:
AgNO2 + HCl → HNO2 + AgCl↓
Химические свойства Слабая кислота; ее соли (нитриты) – устойчивы:
HNO2 + NaOH → NaNO2 + H2O;
• Разлагается при нагревании: 3HNO2 → HNO3 + 2NO↑ + H2O;
• Слабый окислитель (окислительные свойства проявляет только в реакциях с сильными восстановителями):
2KNO2 + 2KI + 2H2SO4 → 2K2SO4 + I2 + 2NO + 2H2O
2I- - 2ē → I2 0 │1
NO2 - + 2H+ + 1ē → NO + H2O │ 2
2I- + 2NO2 - + 4H+ → I2 0 + 2NO + 2H2O
Сильный восстановитель: HNO2 + Cl2 + H2O → HNO3 + 2HCl
HNO3 – Азотная кислота
![]()
или
Физические свойства
Бесцветная жидкость, неограниченно растворимая в воде; tпл.= - 41ºC; Tкип = 82,6ºС, ρ = 1,52 г/см3.
Получение
• Лабораторный способ: KNO3 + H2SO4(конц) – tº→ KHSO4 + HNO3↑;
• Промышленный способ. Осуществляется в три этапа:
a) Окисление аммиака на платиновом катализаторе до NO:
4NH3 + 5O2 – 500ºC, Pt→ 4NO + 6H2O;
б) Окисление кислородом воздуха NO до NO2:
2NO + O2 → 2NO2; c
в) Поглощение NO2 водой в присутствии избытка кислорода:
4NO2 + О2 + 2H2O ↔ 4HNO3
Химические свойства
Азотная кислота является очень сильным электролитом. Диссоциирует в водном растворе практически нацело: HNO3 → H+ + NO3 - .
Реагирует:
• с основными оксидами: CuO + 2HNO3 → Cu(NO3)2 + H2O;
CuO + 2H+ → Cu2+ + H2O;
• с основаниями: HNO3 + NaOH → NaNO3 + H2O; H+ + OH- → H2O;
• вытесняет слабые кислоты из их солей:
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2↑
2H+ + СO3 2- → H2O + CO2↑
Азотная кислота - сильный окислитель Разлагается на свету и при нагревании: 4HNO3 – tºC, hν→ 2H2O + 4NO2↑ + O2↑ :
• Окрашивает белки в оранжево-желтый цвет (при попадании на кожу рук - "ксантопротеиновая реакция"); При взаимодействии с металлами никогда не выделяется водород :
металл + HNO3 → соль азотной кислоты + вода + газ (N2, N2O, NO, NO2 или NH4 + );
• С неметаллами:
Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот:
S 0 + 6HNO3(конц) → H2S +6O4 + 6NO2 + 2H2O;
B 0 + 3HNO3 → H3B +3O3 + 3NO2;
3P0 + 5HNO3 + 2H2O → 5NO + 3H3P +5O4
Фосфор (P) - открыт алхимиком Х. Брандом в 1669 году. В свободном состоянии в природе не встречается. Электронная конфигурация
1S22S22P63S23P3 .
Химические свойства.
Фосфор реагирует:
• С кислородом: 4P 0 + 5O2 – tºC→ 2P2 +5O5;
(при недостатке кислорода: 4P 0 + 3O2 – tºC→ 2P2 +3O3); С галогенами и серой: 2P + 3Cl2 → 2PCl3; 2P + 5Cl2 → 2PCl5; 2P + 5S – tºC→ P2S5;
• С азотной кислотой: 3P0 + 5HN+5O3 + 2H2O → 3H3P +5O4 + 5N+2O↑;
• С металлами образует фосфиды, в которых фосфор проявляет степень окисления - 3:
2P 0 + 3Mg → Mg3P2 -3 ;
(фосфид магния легко разлагается водой):
Mg3P2 + 6H2O → 3Mg(OH)2 + 2PH3↑(фосфин)); 3Li + P → Li3P -3
• Со щелочью: 4P + 3NaOH + 3H2O → PH3 + 3NaH2PO2 Реакция диспропорционирования.
P2+3O3 - фосфористый ангидрид (оксид фосфора (III)). Белые кристаллы, tпл.= 24 С; tкип.= 175C. Существует в виде нескольких модификаций. В парах состоит из молекул P4O6, P2O3 соответствует фосфористая кислота H3PO3. Получение:
Окисление фосфора при недостатке кислорода: 4P + 3O2 → 2P2O3 Химические свойства
Для P2O3 характерны все свойства кислотных оксидов. Оксид фосфора (III) растворяется в воде с образованием фосфористой кислоты, являющейся слабым электролитом: P2O3 + 3H2O → 2H3PO3.
Является сильным восстановителем и при взаимодействии с
кислородом образует оксид фосфора (V): O2+ P2 +3O3 → P2 +5O5
P2+5O5 - фосфорный ангидрид (оксид фосфора (V)). Белые кристаллы, tпл.= 570º С, tкип.= 600ºC, ρ = 2,7 г/см3 . Имеет несколько модификаций. В парах состоит из молекул P4H10, очень гигроскопичен (используется как осушитель газов и жидкостей).
Получение:
4P + 5O2 → 2P2O5
Химические свойства
Оксид фосфора (V), проявляя кислотные свойства: реагирует с водой, основными оксидами и щелочами:
• P2O5 + H2O → 2HPO3(метафосфорная кислота);
P2O5 + 2H2O → H4P2O7(пирофосфорная кислота);
P2O5 + 3H2O → 2H3PO4(ортофосфорная кислота);
• P2O5 + 3BaO → Ba3(PO4)2 ;
P2O5 + 6KOH → 2K3PO4+ 3H2O
• P2O5 - сильное водоотнимающее средство:
P2O5+ 2HNO3 → 2HPO3 + N2O5;
P2O5+ 2HClO4 → 2HPO3+ Cl2O7
HP+5O3 - Метафосфорная кислота
Получение
P2O5+ H2O → 2HPO3
Соли метафосфорной кислоты - метафосфаты (KPO3 – метафосфат
калия)
Химические свойства Характерны все свойства кислот.
H3P+5O3 Фосфористая кислота
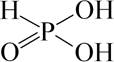
Бесцветное кристаллическое вещество; tпл.= 74ºС, хорошо растворимое в воде.
Получение
PCl3+ 3H2O → H3PO3+ 3HCl
Химические свойства
• Водный раствор H3PO3 - двухосновная кислота средней силы (соли – фосфиты):
H3PO3+ 2NaOH → Na2HPO3+ 2H2O;
• При нагревании превращается в ортофосфорную кислоту и фосфин: 4H3PO3 → 3H3PO4+ PH3;
• Проявляет восстановительные свойства: H3PO3+ HgCl2+ H2O →
H3PO4+ Hg + 2HCl
H3P +5O4 Ортофосфорная кислота
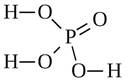
Белое твердое вещество, гигроскопичное, хорошо растворимое в воде; tпл.= 42ºС, ρ = 1,88 г/см3 . Диссоциация:
H3PO4 ↔ H+ + H2PO4 – H2PO4 - ↔ H+ + HPO4 2-
HPO4 2- ↔ H+ + PO4 3-
Ортофосфорная кислота – кислота трехосновная средней силы. Она образует средние соли - ортофосфаты (Na3PO4) и два типа кислых солей - дигидрофосфаты (NaH2PO4) и гидрофосфаты (Na2HPO4). Получение
Растворением фосфорного ангидрида в воде: P2O5+ 3H2O → 2H3PO4 ; Промышленный способ:
а) Взаимодействием ортофосфатат кальция с серной кислотой: Ca3(PO4)2(твердый) + 3H2SO4(конц.) → 2H3PO4 + 3CaSO4↓; б) Растворением фосфора в азотной кислоте: 3P + 5HNO3+ 2H2O → 3H3PO4+ 5NO↑
Химические свойства
Для ортофосфорной кислоты характерны все свойства кислот – неокислителей. При нагревании она превращается в пирофосфорную кислоту.
2H3PO4 – tº→ H4P2O7 + H2O
Качественная реакция на обнаружение в растворе анионов PO4 3- : 3Ag+ + PO4 3- → Ag3PO4↓(ярко-желтый осадок) Биологическая роль азота и фосфора.
Азот играет исключительно важную роль в жизни растений, поскольку входит в состав аминокислот, белков и хлорофилла, витаминов группы В, ферментов, активизирующих обмен веществ. Поэтому недостаток азота в почве отрицательно сказывается на растениях, и в первую очередь на содержание хлорофилла в листьях, из-за чего они бледнеют. Овощные растения потребляют от 50 до 250 кг азота на 1 гектар площади почвы. Больше всего азота находится в цветах, молодых листьях и плодах. Важнейшим источником азота для растений являются азотные удобрения ― это в основном нитрат аммония и сульфат аммония. Следует отметить также особую роль азота как составной части воздуха ― важнейшего компонента живой природы.
Ни один из химических элементов не принимает столь активного и многообразного участия в жизненных процессах растительных и животных организмов, как фосфор. Он является составной частью нуклеиновых кислот, входит в состав некоторых ферментов и витаминов.
У животных и человека в костях сосредоточено до 90 % фосфора, в мышцах ― до 10 %, в нервной ткани ― около 1 % (в виде неорганических и органических соединений). В мышцах, печени, мозге и других органах фосфор находится в виде фосфатидов и фосфорных эфиров. Фосфор принимает участие в мышечных сокращениях и в построении мышечной и костной ткани.
Людям, занимающимся умственным трудом, необходимо употреблять повышенное количество фосфора, чтобы не допустить истощения нервных клеток, которые функционируют с повышенной нагрузкой именно при умственном труде. При недостатке фосфора понижается работоспособность, развивается невроз, нарушается обмен веществ. Недостаток фосфора может быть пополнен употреблением таких овощей и фруктов, как салат, шпинат, щавель, фасоль, морковь, томаты, баклажаны, огурцы, сладкий перец, клубника, абрикосы. Из продуктов животного происхождения наиболее богаты фосфором мясо, мозг, говяжья печень, рыба, яйца, молокопродукты.
Тема 33. Химия и производство. Химическая промышленность и химические технологии. Сырье, вода, энергия в химической
окружающей среды и охрана труда при химическом производстве.
Химическая промышленность и химическая технология
Многие химические реакции, с которыми вы познакомились в лабораторных условиях, или аналогичные им осуществляют в промышленных условиях при производстве важнейшей для повседневной жизни химической продукции.
Пластмассы, синтетические волокна, фармацевтические препараты, удобрения, мыла и моющие средства, красители, пестициды, косметика и парфюмерные изделия и даже компоненты пищи — все это только некоторые виды продукции, выпуск которой полностью или частично зависит от химической промышленности.
Одиннадцать первых мест по объему производства принадлежит веществам, формулы которых: H2SO4, NH3, N2, СаО, O2, С2Н4, NaOH, Cl2, НСl, H3PO4, HNO3. Эти-то вещества и используют в больших количествах далее для получения столь необходимых видов продукции, как названные выше.
Даже если речь идет о «100%-м природном продукте», это означает лишь то, что в нем нет синтетических добавок, и совсем не означает, что при получении не использовались какие-либо химические технологии.
Химическая промышленность — это отрасль народного хозяйства, производящая продукцию на основе химической переработки сырья.
Основой ее является химическая технология — наука о наиболее экономичных методах и средствах массовой химической переработки природных материалов (сырья) в продукты потребления и промежуточные продукты, применяемые в различных отраслях народного хозяйства.
Главная задача химии и химической технологии — производство разнообразных веществ и материалов с определенным комплексом механических, физических, химических и биологических свойств.
Любое химическое производство создается на основе общих научных принципов (табл. 1).
Таблица 1. Научные принципы организации химических
производств
Общие Частные принципы
принципы
1.
![]() Создание
Противоток веществ, прямоток веществ, оптимальных условий увеличение площади
поверхности проведения соприкосновения реагирующих веществ, химических реакций использование
катализатора, повышение
Создание
Противоток веществ, прямоток веществ, оптимальных условий увеличение площади
поверхности проведения соприкосновения реагирующих веществ, химических реакций использование
катализатора, повышение
давления, повышение концентраций реагирующих веществ
2. Полное и Циркуляция, создание смежных производств комплексное (по переработке отходов)
использование сырья
3. Использование Теплообмен, утилизация теплоты реакций теплоты химических реакций
4. Принцип Механизация и автоматизация производства непрерывности
5. Защита окружающей Автоматизация вредных производств, среды и человека герметизация аппаратов, утилизация отходов, нейтрализация выбросов в атмосферу
Несмотря на огромное многообразие химических производств веществ и материалов, все они включают составляющие, указанные на схеме 1.
Сырьем называют природные материалы (природные ресурсы), используемые в промышленности для получения различных продуктов и еще не прошедшие промышленной переработки. Иногда используют вторичное сырье — это изделия, отслужившие свой срок, или отходы каких-либо производств, которые экономически выгодно снова переработать в химические продукты.
Сырье химической промышленности классифицируют по различным признакам.
По составу сырье делят на минеральное и органическое (растительное и животное).
По агрегатному состоянию различают твердое (руды, горные породы, твердое топливо), жидкое (нефть, рассолы) и газообразное (природный и попутный газы, воздух) сырье.
К минеральному сырью относят руды (из них получают металлы) и нерудные ископаемые: сера, фосфориты, калийные соли, поваренная соль, песок, глины, слюда (из них получают неметаллы, удобрения, соду, щелочи, кислоты, керамику, цемент, стекло и другие продукты).
К органическому сырью относится ископаемое горючее: торф, уголь, нефть, природный и попутный нефтяной газы — это ценное энергетическое сырье и сырье для химических синтезов. К органическому сырью также относится сырье растительного и животного происхождения, его дают сельское, лесное и рыбное хозяйство. В основном оно идет для производства продуктов питания, но частично, к сожалению, является и техническим сырьем. Кроме природных веществ, на химических заводах применяют полупродукты и отходы предприятий, а также вспомогательные материалы: воду, топливо, окислители, растворители, катализаторы (схема 2).
Схема 2. Классификация химического сырья
В связи с бурным развитием промышленности растет и объем потребления полезных ресурсов. Это приводит к тому, что многие сырьевые источники быстро истощаются, поэтому необходимо решать проблему бережного и рационального использования сырья. Вода
Особое место среди природных ресурсов занимает вода. Она играет важную роль в химической промышленности.
В ряде производств это сырье и реагент, непосредственно участвующий в основных химических реакциях, например при получении водорода, серной, азотной и фосфорной кислот, щелочей; в реакциях гидратации и гидролиза.
Будучи универсальным растворителем и одним из наиболее распространенных катализаторов, вода дает возможность осуществлять многие химические реакции с большой скоростью в растворах или в присутствии ее следов. В химической, металлургической, пищевой и легкой промышленности воду используют как растворитель твердых, жидких, газообразных веществ. Часто ее применяют для перекристаллизации, для очистки различных продуктов производства от примесей.
Вода используется как теплоноситель из-за ее большой теплоемкости, доступности и безопасности в применении. Ею охлаждают реагирующие массы, нагретые в результате экзотермических реакций. Водяным паром или горячей водой подогревают взаимодействующие вещества для ускорения реакций или проведения эндотермических процессов.
Современные химические комбинаты расходуют миллионы кубических метров воды в сутки. Например, для получения 1 т аммиака требуется 1500 м3 воды. Поэтому химические предприятия, нефтехимические заводы строят рядом с водными источниками.
Задачу сокращения расхода воды химическими предприятиями решают в трех основных направлениях: широкое применение оборотного водоснабжения (вода, используемая в теплообменных аппаратах, охлаждается и снова поступает в теплообменные аппараты, и так повторяется многократно), замена водяного охлаждения воздушным, очистка сточных вод и их повторное использование.
Энергия
Вы знаете, что большинство химических процессов требует затраты энергии. В химическом производстве энергию также расходуют на проведение вспомогательных операций: транспортировку сырья и готовой продукции, сжатие газов, дробление твердых веществ, контрольноизмерительное обслуживание и др. Химическая промышленность относится к одной из самых энергоемких. Средний расход только электрической энергии на производство 1 т аммиачной селитры NH4NO3 равен 11 000 кВт•ч; 1т синтетического аммиака — 3200; 1 т фосфора — 16 500; 1 т алюминия — 19 000.
В химической промышленности используют различные виды энергии:
электрическую, тепловую, ядерную, химическую и световую.
Электрическую энергию используют для проведения электролиза расплавов и растворов веществ, нагревания, в операциях, связанных с электростатическими явлениями, например, в электрофильтрах при производстве серной кислоты для очистки оксида серы (IV). Электроэнергию вырабатывают тепловые (ТЭС), атомные (АЭС) электростанции и гидроэлектростанции (ГЭС).
Тепловая энергия в химической промышленности необходима для нагревания реагирующих веществ при проведении химических реакций, а также для сушки, плавления, дистилляции, выпаривания и других операций. Ее источником в производстве цемента, стекла, керамики служат различные виды топлива (твердого, жидкого, газообразного). Большинство же химических предприятий используют тепловую энергию в виде пара, горячей воды, получаемых из котельных установок или ТЭЦ.
Ядерную энергию используют главным образом для получения электроэнергии. Но такие реакции, как полимеризация, синтезы фенола и анилина, отверждение полимеров, проводят с помощью радиоактивного излучения.
Химическая энергия выделяется в виде теплоты в результате экзотермических реакций. Ее используют для предварительного подогрева исходных веществ, получения горячей воды, водяного пара. Химическая энергия может превращаться в электрическую, например, в аккумуляторах. А есть такие производства, в которых за счет энергии химических реакций покрывают собственные потребности, а излишки отпускают другим потребителям.
При получении 1 т серной кислоты из серы выделяется 5 МДж теплоты, а общие затраты на ее производство составляют всего 0,36 МДж. Излишки поступают к другим потребителям в виде пара и электроэнергии.
Световую энергию (ультрафиолетовое, инфракрасное, лазерное излучение) используют при синтезе хлороводорода, галогенировании органических веществ, реакциях изомеризации.
Ученые разрабатывают способы использования солнечной энергии, например фотохимическое разложение воды.
С точки зрения защитников окружающей среды, у химической промышленности плохая репутация. С чем это связано? Попробуем разобраться.
Все отрасли химической промышленности выпускают полезную продукцию. Вы можете сомневаться в необходимости тех или иных продуктов, но экономически они полезны и нужны, иначе бы их не производили.
Например, кому-то может быть неясно, зачем существует производство хлора, зато все согласны с необходимостью строительства завода по выпуску труб из поливинилхлорида.
Некоторые виды химической продукции действительно не вызывают особой симпатии: взрывчатые вещества для мин и снарядов, отравляющие вещества-пестициды, т. е. препараты для борьбы с сорняками, вредителями, возбудителями болезней.
С одной стороны, производство пестицидов возрастает, так как необходимо производить все больше продуктов питания для непрерывно увеличивающегося населения Земли. Но с другой стороны, некоторые пестициды весьма устойчивы в окружающей среде и представляют реальную опасность для существующих экосистем: гибнут полезные насекомые, птицы, рыбы, звери, происходит отравление людей непосредственно пестицидами или продуктами, в которых они накопились.
Любое промышленное предприятие (и химическое, конечно) имеет отходы. Производство без отходов невозможно. Газы выбрасывают в атмосферу, жидкие отходы — в канализацию, а иногда и в реку, твердые и некоторые жидкие сжигают в специальных печах или захоранивают в специально оборудованных местах.
Эти вещества загрязняют окружающую среду, неблагоприятно влияют на здоровье людей.
Поэтому химические предприятия потенциально опасны, их не строят непосредственно в городах. На самих предприятиях существуют жесткие требования охраны труда, что делает работу на них иногда даже безопаснее, чем на строительстве.
Например, установлены безопасные для здоровья людей предельно допустимые концентрации (ПДК) вредных веществ в воздухе производственных помещений и на территории предприятий, а также в атмосфере населенных мест; предусмотрены строгие меры для предотвращения пожаров и быстрой ликвидации возможных возгораний; на некоторых производствах работники имеют индивидуальные средства защиты от вредных веществ. Выполнение правил охраны труда контролируют органы государственной инспекции, а также внутризаводская служба.
Наилучшим способом решения проблемы снижения вредности производства для людей и охраны окружающей среды служит применение безотходных или малоотходных технологий. Пример — синтез аммиака, в котором отходы (непрореагировавшие газы) многократно возвращают в производство.
В других случаях остро стоит вопрос об очистке отходов. К современным ее методам относят фильтрацию, пыле-, газоулавливание, обезвреживание (нейтрализация, поглощение газов жидкими и твердыми поглотителями), биологическую очистку (при помощи микроорганизмов), осаждение в специальных отстойниках, химические методы (перевод веществ в малорастворимые и нерастворимые соединения) и другие способы.
Очистные сооружения, конечно, требуют определенных материальных затрат, а некоторые руководители предприятий стараются избавиться от отходов самыми дешевыми способами. Такой подход, очевидно, объясняется невниманием к проблемам охраны окружающей среды от загрязнения, а может быть, связан с некомпетентностью в этом вопросе.
Характерная черта химической промышленности — сравнительно небольшое количество работающих. Это обусловлено высокой степенью механизации и автоматизации производств, что также способствует охране труда работников.
Производство аммиака и метанола
Любое химическое производство состоит из отдельных взаимосвязанных процессов-стадий (схема 3).
Схема 3. Основные стадии химического производства
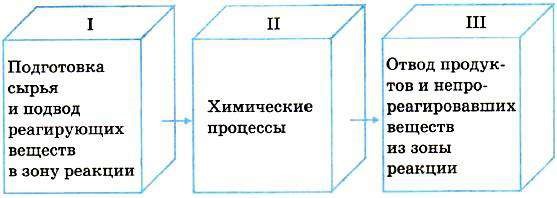
Сравним два химических производства: синтез аммиака и синтез метанола. Оба процесса очень похожи по условиям их проведения и источникам сырья. Их осуществляют на аналогичных установках (рис. 1), которые часто монтируют на одном предприятии.
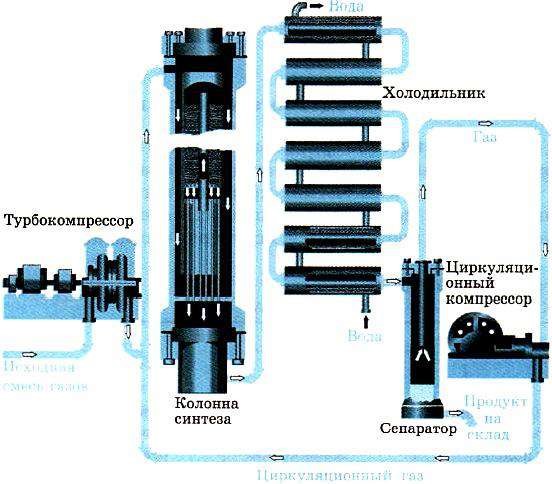
Рис. 1. Схема установки, которую можно использовать в производстве аммиака и метанола
Все аппараты этих производств максимально герметичны, используется только энергия экзотермических реакций. Благодаря циклической (замкнутой) схеме синтеза эти производства служат примерами малоотходных, почти не имеющих выбросов в окружающую среду. Затраты на производство существенно снижены за счет осуществления непрерывного процесса: исходные вещества постоянно поступают в реактор, а продукты постоянно из него выводятся. Непрерывность процесса позволяет его полностью автоматизировать.
Производства аммиака и метанола считаются наиболее передовыми с точки зрения химической технологии (табл. 2).
Таблица 2. Производство аммиака и метанола
|
Основные стадии производства I. Подготовка сырья. Подвод реагирующих веществ в зону реакции с помощью турбокомпрессора и циркуляционного компрессора 1) Оба производства используют в качестве сырья природный газ метан • аммиак Реагирующие вещества: азот N2 и водород Н2. Источник азота — воздух, источник водорода — природный газ (метан СН4). Исходную смесь газов берут в соотношении 1 объем N2 к 3 объемам Н2 • метанол Реагирующие вещества: оксид углерода (II) СО и водород Н2 (их смесь называется синтез-газом). Синтез-газ получают конверсией метана водяным паром при высокой температуре: •
смесь берут в соотношении 1 объем СО к 5 объемам Н2 2) реагирующие газы тщательно очищают, затем подают в турбокомпрессор, где сжимают до аммиак - 25—60 МПа, метанол - 25—30 МПа, а затем смешивают с циркуляционным газом (о нем смотрите далее) и направляют в колонну синтеза II. Химический процесс проходит в основном аппарате производства — колонне синтеза Колонны синтеза бывают разной конструкции, мы рассматриваем колонну, совмещающую в одном корпусе катализаторную коробку и теплообменник. Внутреннее устройство колонны синтеза можно увидеть на схеме установки. В таких колоннах можно осуществлять и синтез аммиака, и синтез метанола (рис. 50). Рассмотрим характеристику реакций, лежащих в основе получения целевых продуктов, — обратимые, экзотермические, гомогенные идут с уменьшением объема аммиак – |
|||||
|
|
|
|
|||
|
|
|
метанол – |
|
|
|
|
Подбор оптимальных условий проведения этих синтезов осуществляют исходя из характеристики химических реакций: 1) реакции обратимые, гомогенные (исходные вещества и продукты — газы) и идут с уменьшением объема, следовательно, смещению равновесия в сторону продуктов способствует повышенное давление; метанол - 2) смещению равновесия вправо способствует также увеличение концентрации водорода в исходной смеси по сравнению со стехиометрическим; 3) реакции экзотермические, повышение температуры смещает химическое равновесие в сторону исходных веществ, а понижение температуры — в сторону продуктов реакции, но при этом скорость синтеза будет очень мала. Поэтому реакции проводят при оптимальных для данных процессов температурах: • аммиак - 450—500 °С • метанол - 370—400 °С Уменьшение давления и увеличение температуры способствуют увеличению доли побочных продуктов Исходную смесь газов сначала нагревают в теплообменнике за счет выходящих газов, движущихся противотоком, а затем в зоне экзотермической реакции. Противоток — движение различных веществ навстречу друг другу с целью создания наилучших условий для обмена энергией (в данном случае); 4) для ускорения синтеза, быстрейшего установления равновесия используют катализатор: • аммиак - восстановленное железо Fe (с примесью оксидов калия и алюминия) • метанол - «цинк-хромовый» 8ZnO•Сr2O3•СrO3, имеющий селективное действие (от лат. selectio — выбор); он ускоряет целевую реакцию, уменьшая долю побочных продуктов В обоих процессах реагенты и продукты реакции находятся в газовой фазе и образуют гомогенную систему. Реакции протекают на поверхности твердых катализаторов. Такие реакции составляют особый класс — гетерогенно-каталитических реакций. Важное значение имеет площадь поверхности катализатора. Катализатор изготавливают в виде губчатых гранул или таблеток. |
|
Так как активность катализатора сильно снижается от присутствия примесей, то реагирующие газы подвергают тщательной очистке (от воды, соединений серы и др.); 5) при всех указанных условиях проведения реакций равновесный выход продукта составляет не более 20%. Поэтому синтез продукта осуществляют по способу многократной циркуляции, т. е. непрореагировавшую смесь газов многократно возвращают в производство после отделения от нее полученного продукта III. Отвод продуктов и непрореагировавших веществ из зоны реакции производят через холодильник с последующим разделением в сепараторе Газовая смесь, состоящая из непрореагировавших веществ и продукта аммиак - N2, Н2 и NH3, метанол - СО, Н2 и СН3ОН, после контакта с катализатором предварительно охлаждается в теплообменнике, отдавая теплоту входящим газам, а затем поступает в холодильник. Охлаждение производят водой, которая движется противотоком. Глубокое охлаждение приводит к конденсации продукта реакции, а в сепараторе он отделяется от непрореагировавших газов (циркуляционных), которые циркуляционный компрессор возвращает в колонну синтеза. Многократная циркуляция газов позволяет повысить выход продукта до 85—90% от теоретического. |
Аммиак в дальнейшем используют для получения азотной кислоты, которая идет на производство удобрений, лекарств, красителей, пластмасс, искусственных волокон, взрывчатых веществ. Большие количества аммиака расходуются на получение мочевины, являющейся прекрасным азотным удобрением, да и сам жидкий аммиак и его водный раствор — это жидкие удобрения. На легком сжижении и последующем испарении с поглощением теплоты основано его применение в холодильных установках.
Метанол используют для получения большого количества разных органических веществ, в частности формальдегида
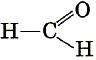
и метилметакрилата
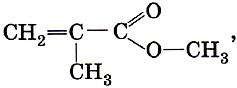
которые используют в производстве фенолформальдегидных смол и полиметилметакрилата (органического стекла) соответственно. Помимо этого, метанол используют как растворитель, экстрагент, а в ряде стран — в качестве моторного топлива, так как добавка его к бензину повышает октановое число топлива и снижает количество вредных веществ в выхлопных газах.
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.