
Раздел 3. Строение и свойства неорганических веществ( 15 часов)
Тема3.2. Физико-химические свойства неорганических веществ ( 8 часов)
Урок № 20
ТЕМА УРОКА : Металлы. Общие физические и химические свойства металлов. Способы получения. Значение металлов и неметаллов в природе и жизнедеятельности человека и организмов.
Цели и задачи урока:
1. Обеспечить восприятие и осмысление учащимися основных понятий темы «металл как элемент» и «металл как простое вещество»;
2. Подвести учащихся к осознанию практической значимости металлов в жизни человека;
3. Развивать умение владеть химической терминологией, чётко формулировать и высказывать свои мысли.
4. Воспитывать самостоятельность мышления в ходе учебной деятельности.
Задания студентам:
1 Изучите материал.
2 По плану составьте конспект.
3Выполните тестовые задания
План лекции:
1. Металлы. Классификация.
2. Нахождение в природе.
3. Производство металлов.
4. Физические свойства металлов.
5. Химические свойства металлов.
6. Электронное строение металлов.
7. Сплавы металлов.
8. Применение металлов.
1 Металлы (от лат. Metallum - шахта, рудник) - группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Классификация

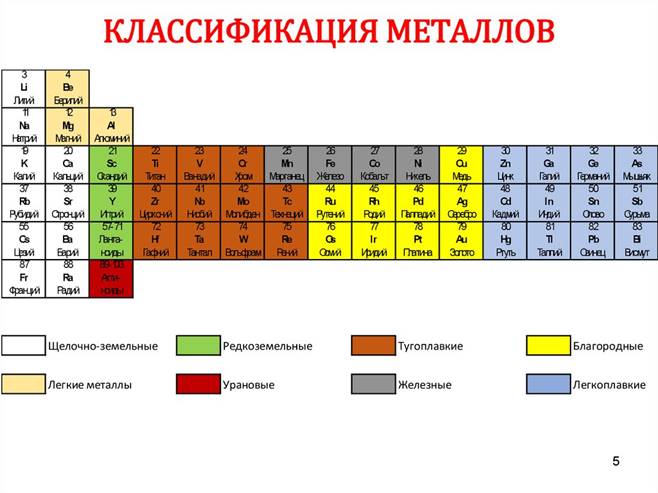
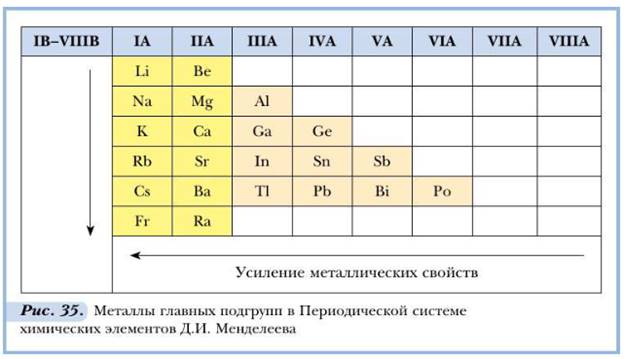
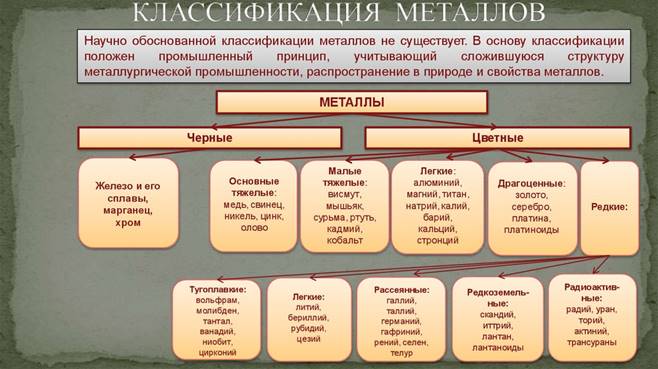
2 Нахождение в природе
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 химических элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь - в печени, железо - в крови.
3 Получение металлов
Рудами называют минералы и горные породы, содержащие металлы и их соединения, из которых технически возможно и экономически целесообразно получать чистые металлы.
Получение металлов из руд — задача металлургии.
Металлургия — это и наука о промышленных способах получения металлов из руд, а также соответствующая отрасль промышленности.
Любой металлургический процесс — это процесс
восстановления катионов металла с помощью различных
восстановителей.
Существует несколько способов получения металлов:
· пирометаллургический,
· электрометаллургический.
Пирометаллургия (таким способом, в основном получают металлы побочных подгрупп или металлов средней и низкой активности – все кроме IА, IIА групп) — восстановление металлов из руд при высоких температурах с помощью углерода C, оксида углерода(II) CO, водорода H2, металлов — алюминия Al, магния Mg.
 Цех пирометаллургического производства
Цех пирометаллургического производства
1. Восстановление металлов из их оксидов с помощью углерода (в виде кокса, раньше — в виде древесного угля) или оксида углерода(II) называется карботермией.
Например, олово восстанавливают из оловянного камня углеродом:
SnO2 +C→t° Sn + CO2
Медь восстанавливают из куприта оксидом углерода(II):
CuO + CO →t° Cu + CO2
2. Восстановление металлов из их оксидов с помощью металлов называется металлотермией.
Например, хром восстанавливают из оксида хрома(III) при помощи алюминия (алюминотермия или алюминотермия):
Cr2O3 + 2Al →t° 2Cr + Al2O3
Титан восстанавливают из оксида титана (IV) магнием:
TiO2 + 2Mg → t° Ti + 2MgO
3. Восстановление металлов из их оксидов с помощью водорода. Таким образом получают металлы с высокой степенью чистоты.
Например, так восстанавливают вольфрам из оксида вольфрама(VI):
WO3 +3H2 → t° W + 3H2O
4. Руды, образованные сульфидами металлов, предварительно подвергают обжигу (окисляют кислородом воздуха), а затем металл восстанавливают из образовавшегося оксида.
Например, цинковую обманку (сульфид цинка) подвергают обжигу (при этом образуется оксид цинка и диоксид серы), а затем полученный оксид цинка восстанавливают углеродом:
1) 2ZnS + 3O2 → t° 2ZnO + 2SO2 2) ZnO + C → t° Zn + CO
Электрометаллургия — восстановление металлов из
растворов или расплавов их соединений под действием электрического тока
(электролиз).
В процессе электролиза за счёт электрической энергии осуществляется химическая
реакция, которая самопроизвольно идти не может.
 Электролизный цех металлургического завода
Электролизный цех металлургического завода
1. Восстановление активных металлов (IА, IIА групп) электролизом из расплавов их солей (галогенидов).
Например, натрий можно получить из расплавленного хлорида натрия под действием электрического тока:
2NaCl → электролиз 2Na + Cl2
4 ФИЗИЧЕКИЕ СВОЙСТВА
|
Свойства |
Особенности |
Примеры |
Применение |
|
Металлический блеск |
Способность отражать солнечный свет |
Наиболее блестящими металлами являются Hg, Ag, Pd |
Изготовление зеркал |
|
Плотность |
Лёгкие – имеют плотность меньше 5 г/см3 |
Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см3 |
Изготовление облицовки, деталей самолётов |
|
Тяжёлые – имеют плотность больше 5 г/см3 |
Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см3 |
Использование в сплавах |
|
|
Пластичность |
Способность изменять форму без разрушений (можно раскатать в тонкую фольгу) |
Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn |
Формовка, сгибание труб, изготовление проволоки |
|
Твёрдость |
Мягкие – режутся ножом |
Na, K, In |
Изготовление мыла, стекла, удобрений |
|
Твёрдые – сравнимы по твёрдости с алмазом |
Самый твёрдый – хром, режет стекло |
Изготовление несущих конструкций |
|
|
Температура плавления |
Легкоплавкие – температура плавления ниже 1000°С |
Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C) |
Производство радиотехники, жести |
|
Тугоплавкие – температура плавления выше 1000°С |
Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С) |
Изготовление ламп накаливания |
|
|
Теплопроводность |
Способность передавать тепло другим телам |
Лучше всего проводят ток и тепло Ag, Cu, Au, Al |
Приготовление пищи в металлической посуде |
|
Электропроводность |
Способность проводить электрический ток за счёт свободных электронов |
Передача электричества по проводам |
5.Химические свойства металлов
Взаимодействие с простыми веществами
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны).
Реакции с простыми веществами
· С кислородом реагируют все металлы, кроме золота и платиновых металлов. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
4 Li + O2 = 2 L i2O оксид лития;
2 Na + O2 = Na 2O2 пероксид натрия; K + O2 = KO2 надпероксид калия.
Серебро, золото и платина с кислородом не реагируют
Au + O2 ≠
Видео «Горение магния на воздухе»
Видео "Самовоспламенение никеля на воздухе"
2 С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
6Li + N2 = 2 L i3N.
При нагревании:
3Ca + N2 =t, °C= Ca3N2
3Na + P =t, °C= Na3P
Взаимодействие со сложными веществами
I. Взаимодействие воды с металлами
1). Взаимодействие с самыми активными металлами, находящимися в периодической системе в I(А) и II(А) группах (щелочные и щелочноземельные металлы) и алюминий. В результате образуются основание и газ водород.
Me + H2O = Me(OH)n + H2 (р. замещения)
Видео «Взаимодействие натрия с водой»
Внимание! Алюминий и магний ведут себя также:
2Al + 6H2O = 2Al(OH)3+3H2
Магний (в горячей воде):
Mg + 2H2O =t°C= Mg(OH)2+H2
2) Взаимодействие воды с менее активными металлами, которые расположены в ряду активности от алюминия до водорода.
Металлы средней активности, стоящие в ряду активности до (Н2) – Be, Fe, Pb, Cr, Ni, Mn, Zn – реагируют с образованием оксида металла и водорода
Me + Н2О = МехОу + Н2 (р. замещения)
Бериллий с водой образует амфотерный оксид:
Be + H2O =t°C= BeO + H2
Раскалённое железо реагирует с водяным паром, образуя смешанный оксид — железную окалину Fe3O4 и водород:
3Fe + 4H2O =t°C= FeO‧Fe2O3 + 4H2
3) Металлы, стоящие в ряду активности после водорода, не реагируют с водой.
Cu + H2O ≠ нет реакции
II. Взаимодействие растворов кислот с металлами
Металлы, стоящие в ряду активности металлов левее водорода, взаимодействуют с растворами кислот (раствор азотной кислоты – исключение), образуя соль и водород.
Кислота (раствор) + Me до (Н2) = Соль + H2↑
Zn + H2SO4 = ZnSO4 + H2↑
Cu + H2SO4 ≠
Au + H2SO4 ≠
Видео «Электрохимический ряд напряжений - вытеснение водорода металлами»
III. Взаимодействие кислот-окислителей с металлами
Металлы особо реагируют с серной концентрированной и азотной кислотами:
H2SO4 (конц.) + Me = Сульфат + H2O + Х
2H2SO4 (конц.) + Cu =t°C= CuSO4 + 2H2O + SO2↑
8Na0 + 5H2+6SO4 = 4Na2+1SO4 + H2S-2↑ + 4H2O
Повторите «Окислительные свойства концентрированной серной кислоты»
HNO3 + Me = Нитрат + H2O + Х
4HNO3 (k) + Cu = Cu(NO3)2 + 4H2O + 2NO2↑
8HNO3 (p) + 3Cu = 3Cu(NO3)2 + 4H2O + 2NO↑
4Zn + 10HNO3 (раствор горячий) =t˚C= 4Zn(NO3)2 + N2O + 5H2O
4Zn + 10HNO3 (оч. разб. горячий) =t˚C= 4Zn(NO3)2 + NH4NO3 + 3H2O
Zn + 4HNO3 (конц. горячий) =t˚C= Zn(NO3)2 + 2NO2 + 2H2O
Повторите «Специфические свойства азотной кислоты»
IV. С растворами солей менее активных металлов
Ме + Соль = Новый металл + Новая соль
Fe + CuCl2 = FeCl2 + Cu
FeCl2 + Cu ≠
Видео «Электрохимический ряд напряжений металлов. Вытеснение металла из соли другими металлами»
Видео «Взаимодействие металлов с солями»
Активность металла в реакциях с кислотами, водными растворами солей и др. можно определить, используя электрохимический ряд, предложенный в 1865 г русским учёным Н. Н. Бекетовым: от калия к золоту восстановительная способность (способность отдавать электроны) уменьшается, все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород.
Видео «Взаимодействие хлорида олова (II) с цинком («Оловянный ежик»)»
6 Электронное строение металлов
Все металлы имеют слабую связь валентных электронов (электронов внешнего энергетического уровня) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов (называемых электронами проводимости) в кристаллической решётке.
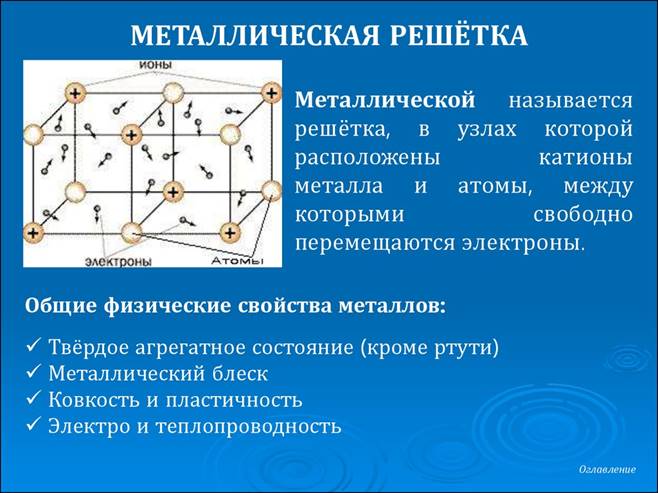
Из-за лёгкой отдачи электронов возможно окисление металлов, что может приводить к коррозии и дальнейшей деградации свойств. Способность к окислению можно узнать по ряду активности металлов. Этот факт подтверждает необходимость использования металлов в комбинации с другими элементами (сплав, важнейшим из которых является сталь), их легирование и применение различных покрытий.
Для более корректного описания электронных свойств металлов необходимо использовать квантовую механику. Во всех твёрдых телах с достаточной симметрией уровни энергии электронов отдельных атомов перекрываются и образуют разрешённые зоны, причём зона, образованная валентными электронами, называется валентной зоной. Слабая связь валентных электронов в металлах приводит к тому, что валентная зона в металлах получается очень широкой, и всех валентных электронов не хватает для её полного заполнения.
Принципиальная особенность такой частично заполненной зоны состоит в том, что даже при минимальном приложенном напряжении в образце начинается перестройка валентных электронов, то есть течёт электрический ток.
Та же высокая подвижность электронов приводит и к высокой теплопроводности, а также к способности зеркально отражать электромагнитное излучение (что и придаёт металлам характерный блеск).
7 Сплавы металлов
Сплав - макроскопически однородный металлический материал, состоящий из смеси двух или большего числа химических элементов с преобладанием металлических компонентов.
Сплавы состоят из основы (одного или нескольких металлов), малых добавок специально вводимых в сплав легирующих и модифицирующих элементов, а также из неудалённых примесей (природных, технологических и случайных).
По способу изготовления сплавов различают литые и порошковые сплавы. Литые сплавы получают кристаллизацией расплава смешанных компонентов. Порошковые - прессованием смеси порошков с последующим спеканием при высокой температуре. Компонентами порошкового сплава могут быть не только порошки простых веществ, но и порошки химических соединений.
По способу получения заготовки (изделия) различают литейные (например, чугуны, силумины), деформируемые (например, стали) и порошковые сплавы.
В твердом агрегатном состоянии сплав может быть гомогенным (однородным, однофазным - состоит из кристаллитов одного типа) и гетерогенным (неоднородным, многофазным).
8 Применение металлов
Конструкционные материалы Электротехнические материалы
Металлы используются в качестве хороших проводников электричества (медь, алюминий), так и в качестве материалов с повышенным сопротивлением для резисторов и электронагревательных элементов (нихром и т. п.).
Инструментальные материалы
Металлы и их сплавы широко применяются для изготовления инструментов (их рабочей части). В основном, это инструментальные стали и твёрдые сплавы. В качестве инструментальных материалов применяются также алмаз, нитрид бора, керамика.
Широкое применение среди всевозможных сплавов нашли различные стали, чугун, сплавы на основе меди, свинца, алюминия, магния, а также легкие сплавы.
Стали и чугуны – сплавы железа с углеродом, причем содержание углерода в стали до 2%, а в чугуне 2…4%. Стали и чугуны содержат легирующие добавки: стали – Cr, V, Ni, а чугун – Si.
Выделяют различные типы сталей.
По назначению: конструкционные, нержавеющие, инструментальные, жаропрочные и криогенные стали.
По химическому составу: углеродистые (низко-, средне- и высокоуглеродистые) и легированные (низко-, средне- и высоколегированные).
В зависимости от структуры: аустенитные, ферритные, мартенситные, перлитные и бейнитные стали.
Сплавы на основе меди называют латунями, в качестве добавок они содержат от 5 до 45% цинка. Латунь с содержанием от 5 до 20% цинка называется красной (томпаком), а с содержанием 20…36% Zn – желтой (альфа-латунью).
Среди сплавов на основе свинца выделяют двухкомпонентные (сплавы свинца с оловом или сурьмой) и четырехкомпонентные сплавы (сплавы свинца с кадмием, оловом и висмутом, сплавы свинца с оловом, сурьмой и мышьяком), причем (характерно для двухкомпонентных сплавов) при различном содержании одинаковых компонентов получают разные сплавы.
Сплавы на основе алюминия двухкомпонентные – Al-Si, Al-Mg, Al-Cu. Эти сплавы легко получать и обрабатывать. Они обладают электро- и теплопроводностью, немагнитны, безвредны в контакте с пищевыми, взрывобезопасны.
Тестовые задания
1. В какой группе находится металл полоний:
- в шестой
- в восьмой
- в седьмой
2. К четвертой группе относится элемент:
- германий
- сурьма
- висмут
3. Как проходит условная граница между между металлическими и неметаллическими элементами:
- по диагонали
- по горизонтали
- по вертикали
4. Металлургический процесс включает в себя:
-восстановление ионов металла
- окисление ионов неметалла
- восстановление ионов неметалла
5. Пирометаллургией является:
- процесс получения металлов из их соединений при высокой температуре
- процесс получения неметаллов из их соединений при низкой температуре
- процесс получения неметаллов из их соединений при высокой температуре
6. В пирометаллургии используются:
- восстановители
- окислители
- как восстановители, так и окислители
7. При алюмотермии используют металл:
- алюминий
- железо
- серебро
8. В гидрометаллургии получают:
- металлы из растворов их соединений
- неметаллы из растворов их соединений
- воду из растворов их соединений
9. В электрометаллургии используется процесс:
- электролиз расплавов
- обработка при предельно высокой температуре
- реакция замещения и соединения
тест 10. При электролизе восстановителем является:
- катод
- анод
- и катод, и анод
11. Чем определяются физические свойства металлов:
- типом кристаллической решетки
- количеством протонов, электронов, нейтронов
- расположением в определенной группе или подгруппе
12. Отличием атомов металлов от неметаллов можно назвать:
- содержат небольшое количество электронов на внешнем уровне, большой радиус и низкая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, маленький радиус и высокая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, большой радиус и высокая электроотрицательность
13. Металлической является связь:
- между ионами металлов
- между ионами неметаллов
- между ионами металла и неметалла
14. Для какого агрегатного состояния не характерна металлическая связь:
- для газа
- для жидкого состояния
- для твердого состояния
15. Чем обусловлена электропроводность металлов?
- наличием свободных электронов
- наличием свободных нейтронов
- наличием свободных протонов
16. С повышением температуры электропроводность:
- понижается
- повышается
- может как повышаться, так и понижаться
17. Электропроводность увеличивается от:
- ртути к серебру
- меди к железу
- алюминия к цинку
18. Максимальной теплопроводностью обладает:
- серебро
- магний
- алюминий
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.