
Дата:
Класс: 8
Предмет: Химия
Урок №
Тема: Типы химических реакций.
Цель: закрепить знания о химических реакциях, правилах их составления, законе сохранения массы веществ, изучить классификацию химических реакций, научиться определять их тип; продолжить формирование умений записывать уравнения. Продолжение работы по развитию интеллектуальных и мыслительных умений (умение анализировать, сравнивать и обобщать); развивать познавательный интерес при выполнении лабораторных опытов. Воспитывать такие личностные качества, как внимание, наблюдательность, инициатива; проводить рефлексию собственной деятельности.
Тип урока: комбинированный.
Ход урока
1. Организационный этап.
2. Актуализация опорных знаний.
Фронтальный опрос
А что мы знаем о химических реакциях?
Давайте с вами вспомним:
1. Что же такое химические превращения или химические реакции?
2. Назовите признаки химических реакций.
3.Какие же условия необходимы для того, чтобы произошла химическая реакция?
4. Можно ли условно записать химическую реакцию?
5. Что такое химическое уравнение?
6. На основании какого закона составляют уравнения химических реакций?
3.Изучение нового материала.
Никакой, даже самый современный компьютер, не смог бы подсчитать число возможных химических реакций. В природе, технике, в организмах растений и животных, в лабораториях и на заводах совершается множество медленных и быстрых химических взаимодействий. От образования минералов, которое протекают миллионы лет, до ядерных реакций, которые завершаются в доли секунды.
Ржавление железа, окисление резины – примеры медленно протекающих реакций. Взрыв пороха, вспышка паров бензина в двигателе автомобиля – примеры быстро протекающих реакций.
Какая же тема нашего сегодняшнего урока – «Типы химических реакций». Запишите тему урока в тетрадях.
Сегодня мы познакомимся с одной из классификаций химических реакций
На доске представлены несколько химических реакций
2H2 + O2 = 2H2O
CaO + H2O = Ca(OH)2
Cu(OH)2 = CuO + H2O
2HgO =2Hg + O2
Zn + 2HCl = ZnCl2 + H2
AgNO3 + HCl=AgCl + HNO3
- можно ли выделить признак, по которому эти реакции, возможно, разделить на группы?
- различаются ли между собой реакции одной группы?
В ходе обсуждения учащиеся приходят к выводу, что одним из признаков, по которому можно классифицировать химические реакции является число и состав вступающих и образующихся в результате реакции веществ.
По этой классификации реакции можно разделить на 4 типа:
реакции соединения, разложения, замещения, обмена.
Наша с вами задача разобраться, какие реакции относятся к реакциям соединениям, разложениям; что такое реакции замещения и реакции обмена.
Учащиеся
в тетрадях рисуют схему «Типы химических реакций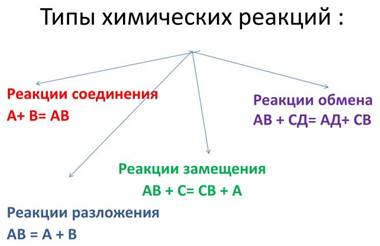
Реакция соединения (демонстрация опыта)
Посмотрим опыт горение магния.
Данная реакция сопровождается ослепительной вспышкой, раньше она применялась при фотографировании объектов в тёмных освещениях.
Запишите данную химическую реакцию, расставьте коэффициенты.
2Mg + O2 = 2MgО
А сейчас я приведу случай из жизни. Один мальчик взял без спросу кусок негашеной извести (СаО) и положил его в карман. Спасаясь от преследователей, он попал в воду. Известь нагрелась и причинила ему сильные ожоги.
Мораль: не следует брать ничего без спросу!
Запишем данную реакцию (демонстрация опыта)
СаО + Н2О = Са(ОН)2
1.Что объединяет эти две реакции?
2. В чём их отличие?
3.Как одним словом мы можем назвать процесс, который протекает?
Реакция разложения.
Одним из способов получения кислорода является разложение перекиси водорода.
Проделаем данный опыт. При этом из перекиси получается вода и кислород. Запишем реакцию
2Н2О2 = 2Н2O + О2 .
Проведение лабораторного опыта.
Разложение основного карбоната меди.
Записывают уравнение реакции и
делают вывод.
CuCO3*
Cu(OH)2 = 2CuO + CO2 + H2O
Реакция замещения.
Познакомимся с реакцией замещения
Реакция замещения меди железом.
Записывают уравнение реакции и делают
вывод.
Fe + CuSO4
= FeSO4
+ Cu
Реакция обмена (демонстрация опыта)
CuSO4+2NaOH=Cu(OH)2+Na2SO4
Многие химические реакции нельзя отнести ни к одному из перечисленных четырех типов. Примером может служить реакция горения метана:
CH4 + 2O2 = CO2 + 2H2O
3. Закрепление
Задание: Тест – шифровка. Проверим, как вы научились различать типы реакций.
|
Тест-шифровка На мои вопросы вы будете отвечать буквами, соответствующими типам химических реакций: соединения – С, замещения – З, разложения – Р, обмена – О. 1.В реакцию вступает одно простое и одно сложное вещество. 2.Образуется одно сложное вещество. 3.Образуются два сложных вещества. 4.Вступают два или несколько простых или сложных веществ. 5.Вступает только одно сложное вещество. 6.Одно из двух образовавшихся веществ - простое. 7.Образуется несколько простых или сложных веществ. 8.Вступают два сложных вещества. |
Ответы:
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
З |
С |
О |
С |
Р |
З |
Р |
О |
2.
Ba + O2 → BaO
Fe(OH)3 + HCl → FeCl3 + H2O
Na + S → Na2S
Fe + O2 → Fe3O4
C + O2 → CO2
CH4 → C2H2 + H2
Ca + HCl → CaCl2 + H2
K + S → K2S
HNO3 + CaO → Ca(NO3)2 + H2O
Fe + O2 → Fe2O3
BaO + H2SO4 → BaSO4 + H2O
Fe + Cl2→ FeCl3
5.Домашнее
задание: § ,упр.№
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.