
Министерство общего и профессионального образования
Ростовской области
государственное бюджетное профессиональное образовательное учреждение Ростовской области
«Новошахтинский технологический техникум
Комплект практических занятий
ОДП. 02 Химия
для ППССЗ по специальности
29.02.10 Конструирование. Моделирование и технология изготовления изделий лёгкой промышленности (по видам)
г. Новошахтинск
Практическое занятие №1 «Решение заданий на использование химической символики и названий соединений»
Цель: формировать умения называть бинарные соединения и навыки определения степени окисления элемента и определения массовой доли элемента в веществе.
Задачи:
1.Научиться пользоваться химической символикой и названиями соединений по номенклатуре международного союза теоретической и прикладной химии и тривиальных названий для составления химических формул двухатомных соединений (оксидов, сульфидов, гидридов и т.п.) и других неорганических соединений отдельных классов.
2.Уметь грамотно оформлять отчёты и формулировать выводы по проделанной работе.
Обеспеченность занятия (средства обучения):
1. Сборник методических указаний для студентов по выполнению практических занятий по учебной дисциплине «Химия».
2. Таблица «Периодическая система химических элементов Д.И. Менделеева».
3. Тетрадь для практических занятий в клетку.
4. Карточки – задания.
5. Калькулятор.
6. Ручка.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Бинарные соединения – это сложные вещества, состоящие из атомов двух химических элементов (как правило, на первом месте записывается элемент с положительной степенью окисления, на втором месте – с отрицательной степенью окисления).
Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (ионные и ковалентно-полярные) состоят только из ионов.
Степень окисления показывает, сколько электронов смещается к более электроотрицательному элементу. Электроотрицательность (ЭО) – свойство атомов данного химического элемента оттягивать к себе общие электронные пары.
Степень окисления может иметь положительное, отрицательное и нулевое значения.
Степени окисления расставляются: вверху над символом элемента, причем вначале пишется заряд (+ или -), а затем число (1,2,3).
Примеры веществ, в которых у элементов проставлены степени окисления:
Na2+1S-2, H2+1O-2, Cl20.
Для того, чтобы по формулам химических соединений рассчитать степени окисления с.о.), необходимо знать определенные правила:
1. В соединениях отрицательное значение с.о. имеют элементы с большим значением электроотрицательности, а положительное значение с.о. – элементы с меньшим значением электроотрицательности.
2. Есть элементы с постоянной с.о. и элементы с переменной с.о.
Элементы с постоянным значением с.о.:
а) металлы всегда имеют положительное значение с.о.
У металлов главных подгрупп: I группы во всех соединениях с.о. равна +1, II группы - +2, III группы - +3.
б) элемент фтор в соединениях всегда проявляет степень окисления -1
Элементы с переменным значением с.о.:
а) все остальные металлы (кроме перечисленных выше металлов);
б) почти все неметаллы;
в) кислород почти всегда имеет с.о. -2;
г) в большинстве соединений водород имеет с.о. +1.
3. У элементов, которые в бинарном соединении записываются на втором месте, с.о. отрицательна и рассчитывается по формуле: № группы элемента -8.
4. У простых веществ и свободных атомов с.о. всегда равна нулю (H2, N2, Fe, Al, Cl, N, Na).
5. В соединениях сумма всех степеней окисления элементов всегда равна нулю. То есть, сумма положительных и отрицательных зарядов в молекуле всегда равна нулю.
6. Для того, чтобы рассчитать с.о. одного элемента в соединении, надо знать с.о. другого элемента.
Нахождение с.о. по формуле вещества.
Составим алгебраическое уравнение с одним неизвестным для определения значения с.о. в каком-либо соединении.
Найдем с.о. хлора в соединении Cl2O. Выпишем с.о. кислорода и обозначим неизвестную степень окисления хлора через х: Cl2xO-2
Составим уравнение:
2х+(-2)▪1=0; 2х=2; х=+1
Записываем степень окисления хлора: Cl2+1O-2
Составление формулы соединения по известным с.о.элементов.
Например, составить формулу бинарного соединения алюминия с углеродом.
Запишем знаки алюминия и углерода: Al C, причем вначале записываем элемент с положительным значением с.о. (какой это элемент в нашем примере?), а затем – элемент с отрицательным значением с.о.
Теперь по порядку:
1. Алюминий находится в 3 группе, это металл, его с. о. всегда положительна и равна +3.
2. Углерод находится в 4 группе, его с.о. его будет равна -4 (4 – 8 = -4)
Запишем эти значения в формулу: Al+3C-4, найдем наименьшее общее кратное для них (оно равно 12). Затем рассчитаем индексы:
12
Al +3 C -4 → Al4C3
Названия бинарных соединений образуются из двух слов – названий входящих в их состав химических элементов. Вначале произносят корень латинского названия элемента с отрицательной с.о.(у нас углерод, его латинское название - карбонеум), добавляя суффикс – «ид» (в именительном падеже), после этого добавляют название элемента с положительной с.о. в родительном падеже.
Например: NaCl – хлорид натрия, MgS – сульфид магния, KH – гидрид калия.
Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив с. о. римской цифрой, которую ставят в конце названия в скобках.
Например: Fe+2O-2 оксид железа (II); Fe2+3O3-2 оксид железа (III).
Если же соединение состоит из двух элементов-неметаллов, то к корню латинского названия более ЭО (находится в формуле на втором месте) из них прибавляют суффикс «ид», второй компонент называют в родительном падеже.
Например: O+2F2-1 – фторид кислорода, S+4O2-2- оксид серы (IV), S+6O3-2- оксид серы (VI).
В некоторых случаях число атомов элементов обозначают при помощи названий греческих числительных – моно, ди, три, тетра.
CO- монооксид углерода, CO2- диоксид углерода, PbCl4- тетрахлорид фтора.
Относительная молекулярная
масса (Mr)- безразмерная величина, показывающая, во сколько раз масса
молекулы данного вещества больше 1/12 массы изотопа углерода C12.
Относительная молекулярная масса вещества равна сумме относительных атомных
масс всех элементов с учетом индексов.
Примеры:
Mr(B2O3) = 2 · Ar(B) + 3 · Ar(O) = 2 · 11 + 3 · 16 = 70
Mr(KAl(SO4)2) = 1 · Ar(K) + 1 · Ar(Al) + 1· 2 · Ar(S)
+ 2· 4 · Ar(O) =
= 1 · 39 + 1 · 27 + 1 · 2 · 32 + 2 · 4 ·16 = 258
Массовая доля химического элемента.
Зная химическую формулу, можно вычислить массовую долю химических элементов в веществе. Массовая доля элемента в вещества обозначается греческой буквой «омега» - ω и рассчитывается по формуле:
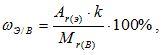 где k – число
атомов этого элемента в молекуле.
где k – число
атомов этого элемента в молекуле.
Пример: рассчитать массовые доли водорода и кислорода в молекуле воды Н2О.
Решение:
1) Вычисляем относительную молекулярную массу воды:
Mr(Н2О) = 2*Аr(Н) + 1*Аr(О) = 2*1 + 1* 16 = 18
2) Вычисляем массовую долю водорода в воде:
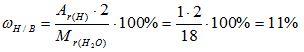
3) Вычисляем массовую долю кислорода в воде. Так как в состав воды входят атомы только двух химических элементов, массовая доля кислорода будет равна:
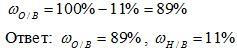
Вопросы для закрепления теоретического материала к практическому занятию
1. Какую информацию даёт формула СО2?
2. Что такое степень окисления?
3. Какие величины могут находиться рядом с химическим знаком?
4. Приведите примеры простых веществ и назовите их формулы.
5. Приведите примеры сложных веществ и назовите их формулы.
6. Сформулируйте правила определения степеней окисления.
7. Какова формула для определения массовой доли химического элемента?
Задания для практического занятия:
Ответьте на задания, выбрав вещества из вашего варианта под номерами… (по указанию учителя).
|
Варианты |
|||||
|
|
1 |
2 |
3 |
4 |
5 |
|
1 |
AgCl |
Na2S |
Ca3N2 |
H2Se |
AgBr |
|
2 |
LiBr |
NH3 |
NaCl |
P2O5 |
MgCl4 |
|
3 |
HF |
Ca3P2 |
Li2S |
SF6 |
LiH |
|
4 |
K2S |
HCl |
N2O5 |
Na3N |
NH3 |
|
5 |
AlI3 |
CrF3 |
LiI |
K2S |
PCl3 |
|
6 |
PH3 |
BaBr2 |
CaF2 |
LiBr |
H2S |
|
7 |
CaH2 |
PbI2 |
HBr |
PCl5 |
FeBr3 |
|
8 |
CH4 |
CuCl2 |
KH |
BaH2 |
CaC2 |
|
9 |
Na3P |
ZnS |
AgI |
SiH4 |
CCl4 |
|
10 |
FeCl2 |
SiH4 |
Mg3P2 |
H2S |
SO3 |
|
11 |
H2S |
NaH |
MnS |
MgS |
Ba3P2 |
|
12 |
HgBr2 |
HF |
PH3 |
CaCl2 |
HI |
|
13 |
NiI2 |
SO2 |
CuBr2 |
ClF5 |
SrS |
1. Дайте названия веществам из вашего варианта.
2. Определите качественный и количественный состав вещества из вашего варианта под номерами...
3. Рассчитайте относительную молекулярную массу веществ из вашего варианта под номерами...
4. Рассчитайте массовые доли химических элементов, входящих в состав основания из вашего варианта под номером…
5. Определите тип химической связи в веществах из вашего варианта под номерами...
6. Определите степени окисления каждого элемента в основаниях из вашего варианта под номерами...
Инструкция по выполнению практического занятия
Вариант 5 № 13
1. SrS – сульфид стронция
2. Качественный состав – атомы стронция и серы, количественный состав – всего два атома: один атом стронция и один атом серы.
3. Mr(SrS)= 88+32=120
4. W(Sr)=n*Ar(Sr)/Mr(SrS)*100%=1*88/120*100%=73,33%
W(S)= n*Ar(S)/Mr(SrS)*100%=1*32/120*100%=26,67%
5. Ионная
6. Sr+2S-1
Порядок выполнения отчёта по практическому занятию
1.В тетради для практических занятий напишите номер, название и учебную цель занятия.
2.Ответьте устно на вопросы для закрепления теоретического материала к практическому занятию.
3.Выполните задания № 1, 2, 3, 4, 5, 6 к веществам, указанным учителем.
4.Запишите вывод о проделанной работе.
Практическое занятие №2 Решение практических заданий на составление электронно-графических формул элементов 1–4 периодов.
Цели:
ü отработка навыков составления электронно-графических формул элементов 1–4 периодов.
ü Отработка навыков характеристики химические элементы малых периодов, а также калия и кальция по положению в периодической системе химических элементов Д. И. Менделеева и строению их атомов.
Задание 1
|
Указать элемент, в атоме которого: |
|
|
Вариант 1 |
Вариант 2 |
|
а) 25 протонов б) 13 электронов |
а) 41 протон б) 20 электронов |
Образец решения задания № 1
Указать элемент, в атоме которого 30 протонов.
Алгоритм решения
Дано: N(p+) = 30.
Найти: элемент.
Решение
Известно, что число протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов) N(p+) = Z.
Определяемый элемент имеет N(p+) = Z = 30.
В Периодической таблице Д.И. Менделеева это цинк (Zn).
Ответ: цинк (Zn)
Задание 2
|
Назвать два элемента, в атоме которых: |
|
|
Вариант 1 |
Вариант 2 |
|
3 энергетических уровня |
5 энергетических уровней |
Образец решения задания № 2
Назвать два элемента, в атоме которых 4 энергетических уровня.
Алгоритм решения
Дано: 4 энергетический уровень.
Найти: 2 элемента.
Решение
Номер периода в Периодической системе химических элементов им. Д.И. Менделеева указывает, сколько энергетических уровней имеет тот или иной элемент. Поэтому любой элемент из 4 периода относится к атомам, у которых 4 энергетических уровня.
Выберем два элемента из 4 периода Периодической системы химических элементов им. Д.И. Менделеева, например это могут быть калий (К), порядковый номер 19 и цинк (Zn), порядковый номер 30.
Ответ: калий (К), порядковый номер 19 и цинк (Zn), порядковый номер 30.
Задание 3
|
Определить два элемента, в атоме которых на последнем энергетическом уровне: |
|
|
Вариант 1 |
Вариант 2 |
|
4 валентных электрона |
7 валентных электронов |
Образец решения задания № 3
Определить два элемента, в атоме которых на последнем энергетическом уровне 5 валентных электрона.
Алгоритм решения
Дано: 5 валентных электронов.
Найти: 2 элемента.
Решение
Число валентных электронов определяют с помощью Периодической таблицы Д.И. Менделеева, а именно, по номеру группы, в которой находится элемент (подгруппу при этом не учитывают).
Таким образом, найдем два элемента из 5 группы, пусть это будут: азот (N, порядковый номер 7) и фосфор (Р, порядковый номер 15).
Ответ: азот и фосфор.
Задание 4
|
Указать местоположение элементов в Периодической системе химических элементов Д.И. Менделеева, напишите электронные формулы атомов данных элементов: |
|
|
Вариант 1 |
Вариант 2 |
|
а) № 37 б) № 30 |
а) № 24 б) № 50 |
Образец решения задания № 4
Указать местоположение элементов в периодической системе химических элементов, напишите электронные формулы атомов данных элементов:
а) № 41
б) № 68
Алгоритм решения
Дано: элементы с порядковыми номерами 41 и 68.
Найти: 1) месторасположение элементов в периодической системе химических элементов;
2) электронные формулы атомов элементов.
Решение
Элемент с порядковым номером 41 - это ниобий (Nb). Элемент расположен в 5 периоде, значит у атома 5 энергетических уровней, в 6 ряду, следовательно у него 6 подуровней, 5 группе, побочной подгруппе, следовательно у элемента 5 валентных электронов.
Электронная конфигурация Nb: 1s22s22p63s23р64s23d104p65s14d4.
Проверяем сумму электронов в атоме:
2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 1 + 4 = 41
Следовательно, электронная конфигурация атома написана верно.
Элемент с порядковым номером 68 - это эрбий (Er). Элемент расположен в 6 периоде, значит у атома 6 энергетических уровней, в 8 ряду, следовательно у него 8 подуровней, в 3 группе, подгруппе лантаноидов, у элемента 14 валентных электронов.
Электронная конфигурация Er:
1s22s22p63s23р64s23d104p65s24d105p66s26f12
Проверяем сумму электронов в атоме:
2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 2 + 10 + 6 + 2 + 12 = 68
Следовательно, электронная конфигурация атома написана верно.
Задание 5
|
Чем сходны и чем отличаются по составу изотопы: |
|
|
Вариант 1 |
Вариант 2 |
|
4019К 3919К |
3517Сl 3717Cl |
Образец решения задания № 5
Чем сходны и чем отличаются по составу изотопы:
126С и 146C
Алгоритм решения
Дано: изотопы: 126 С и 146 C
Найти: сходства и различия изотопов.
Решение
Изотопы 126С и 146C отличаются массовым числом (А), но имеют одинаковый заряд ядра (Z), т.е. число протонов (N(p+) = 6) и число электронов (N(е-) = 6). Также изотопы отличаются числом нейтронов (N(n0)).
Изотоп 126 С: Массовое число А = 12, число протонов N(p+) = 6, число электронов N(е-) =6, число нейтронов N(n0) = 12 – 6 = 6.
Изотоп 146 С: Массое число А = 14, число протонов N(p+) = 6, число электронов N(е-) =6, число нейтронов N(n0) = 14 – 6 = 8.
Практическое занятие №3 «Решение заданий на установление связи между строением атомов химических элементов и периодическим изменением свойств химических элементов и их соединений в соответствии с положением ПСХЭл Д.И. Менделеева
Цель: обобщить знания об электронном строении атомов химических элементов; закрепить умения и навыки составления электронных формул атомов химических элементов, а также их графических изображений. Отработать основные понятия: «электронное облако», «атомная орбиталь», «радиус».
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- Периодический закон Д.И. Менделеева, структуру периодической таблицы: периоды (малые и большие), группы (главная и побочная), строение атома и атомного ядра, строение электронных оболочек атомов элементов малых и больших периодов, электронные конфигурации атомов химических элементов.
Обучающийся должен уметь:
- характеризовать: элементы малых и больших периодов в Периодической системе, строить электронные конфигурации атомов, определять количество протонов и нейтронов в ядре.
Задачи практического занятия:
Обеспеченность занятия:
Краткие теоретические и учебно-методические материалы по теме практического занятия
Атом состоит из атомного ядра и электронной оболочки.
Ядро атома состоит из протонов (p+) и нейтронов (n0). У атома водорода ядро состоит из одного протона.
Число протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов). N(p+) = Z
Сумма числа нейтронов N(n0), обозначаемого просто буквой N, и числа протонов Z называется массовым числом и обозначается буквой А.
A = Z + N (6)
Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е-).
Число электронов N(e-) в электронной оболочке нейтрального атома равно числу протонов Z в его ядре.
Химический элемент - вид атомов (совокупность атомов) с одинаковым зарядом ядра (с одинаковым числом протонов в ядре).
Изотоп - совокупность атомов одного элемента с одинаковым числом нейтронов в ядре (или вид атомов с одинаковым числом протонов и одинаковым числом нейтронов в ядре).
Разные изотопы отличаются друг от друга числом нейтронов в ядрах их атомов.
Обозначение
отдельного атома или изотопа: ![]() (Э
- символ элемента), например:
(Э
- символ элемента), например: ![]() .
.
Атомная
орбиталь - состояние электрона в атоме. Условное обозначение орбитали - ![]() .
Каждой орбитали соответствует электронное облако.
.
Каждой орбитали соответствует электронное облако.
Орбитали реальных атомов в основном (невозбужденном) состоянии бывают четырех типов: s, p, d и f.
Орбитали одного слоя образуют электронный («энергетический») уровень, их энергии одинаковы у атома водорода, но различаются у других атомов.
Однотипные орбитали одного уровня группируются в электронные (энергетические) подуровни:
s-подуровень (состоит из одной s-орбитали),
условное обозначение - ![]() .
.
p-подуровень (состоит из трех p-орбиталей),
условное обозначение - ![]()
![]()
![]() .
.
d-подуровень (состоит из пяти d-орбиталей),
условное обозначение - ![]()
![]()
![]()
![]()
![]() .
.
f-подуровень (состоит из семи f-орбиталей),
условное обозначение - ![]()
![]()
![]()
![]()
![]()
![]()
![]() .
.
Энергии орбиталей одного подуровня одинаковы.
При обозначении подуровней к символу подуровня добавляется номер слоя (электронного уровня), например: 2s, 3p, 5d означает s-подуровень второго уровня, p-подуровень третьего уровня, d-подуровень пятого уровня.
Общее число подуровней на одном уровне равно номеру уровня n. Общее число орбиталей на одном уровне равно n2. Соответственно этому, общее число облаков в одном слое равно также n2.
Обозначения: ![]() - свободная орбиталь (без электронов),
- свободная орбиталь (без электронов),
![]() - орбиталь с электронной парой (с
двумя электронами).
- орбиталь с электронной парой (с
двумя электронами).
Порядок заполнения электронами орбиталей атома определяется тремя законами природы (формулировки даны в приложении 2):
Валентные электроны - электроны атома, которые могут принимать участие в образовании химических связей. У любого атома это все внешние электроны плюс те предвнешние электроны, энергия которых больше, чем у внешних. Например: у атома Ca внешние электроны - 4s2, они же и валентные; у атома Fe внешние электроны - 4s2, но у него есть 3d6, следовательно у атома железа 8 валентных электронов. Валентная электронная формула атома кальция - 4s2, а атома железа - 4s23d6.
Периодический закон химических элементов Д.И. Менделеева (современная формулировка): свойства химических элементов, а также простых и сложных веществ, ими образуемых, находятся в периодической зависимости от значения заряда из атомных ядер.
Периодическая система Д.И. Менделеева - графическое выражение периодического закона (приложение 1).
Естественный ряд химических элементов - ряд химических элементов, выстроенных по возрастанию числа протонов в ядрах их атомов, или, что то же самое, по возрастанию зарядов ядер этих атомов. Порядковый номер элемента в этом ряду равен числу протонов в ядре любого атома этого элемента.
Таблица химических элементов строится путем «разрезания» естественного ряда химических элементов на периоды (горизонтальные строки таблицы) и объединения в группы (вертикальные столбцы таблицы) элементов, со сходным электронным строением атомов.
В зависимости от способа объединения элементов в группы таблица может быть длиннопериодной (в группы собраны элементы с одинаковым числом и типом валентных электронов) и короткопериодной (в группы собраны элементы с одинаковым числом валентных электронов).
Группы короткопериодной таблицы делятся на подгруппы (главные и побочные), совпадающие с группами длиннопериодной таблицы.
У всех атомов элементов одного периода одинаковое число электронных слоев, равное номеру периода.
Число элементов в периодах: 2, 8, 8, 18, 18, 32, 32. Большинство элементов восьмого периода получены искусственно, последние элементы этого периода еще не синтезированы. Все периоды, кроме первого начинаются с элемента, образующего щелочной металл (Li, Na, K и т. д.), а заканчиваются элементом, образующим благородный газ (He, Ne, Ar, Kr и т. д.).
В короткопериодной таблице - восемь групп, каждая из которых делится на две подгруппы (главную и побочную), в длиннопериодной таблице - шестнадцать групп, которые нумеруются римскими цифрами с буквами А или В, например: IA, IIIB, VIA, VIIB. Группа IA длиннопериодной таблицы соответствует главной подгруппе первой группы короткопериодной таблицы; группа VIIB - побочной подгруппе седьмой группы: остальные - аналогично.
Характеристики химических элементов закономерно изменяются в группах и периодах.
Вопросы для закрепления теоретического материала к практическому занятию
Задания для практического занятия:
Задание 1
|
Указать элемент, в атоме которого: |
|
|
Вариант 1 |
Вариант 2 |
|
а) 25 протонов б) 13 электронов |
а) 41 протон б) 20 электронов |
Образец решения задания № 1
Указать элемент, в атоме которого 30 протонов.
Алгоритм решения
Дано: N(p+) = 30.
Найти: элемент.
Решение
Известно, что число протонов N(p+) равно заряду ядра (Z) и порядковому номеру элемента в естественном ряду элементов (и в периодической системе элементов) N(p+) = Z.
Определяемый элемент имеет N(p+) = Z = 30.
В Периодической таблице Д.И. Менделеева — это цинк (Zn).
Ответ: цинк (Zn)
Задание 2
|
Назвать два элемента, в атоме которых: |
|
|
Вариант 1 |
Вариант 2 |
|
3 энергетических уровня |
5 энергетических уровней |
Образец решения задания № 2
Назвать два элемента, в атоме которых 4 энергетических уровня.
Алгоритм решения
Дано: 4 энергетический уровень.
Найти: 2 элемента.
Решение
Номер периода в Периодической системе химических элементов им. Д.И. Менделеева указывает, сколько энергетических уровней имеет тот или иной элемент. Поэтому любой элемент из 4 периода относится к атомам, у которых 4 энергетических уровня.
Выберем два элемента из 4 периода Периодической системы химических элементов им. Д.И. Менделеева, например, это могут быть калий (К), порядковый номер 19 и цинк (Zn), порядковый номер 30.
Ответ: калий (К), порядковый номер 19 и цинк (Zn), порядковый номер 30.
Задание 3
|
Определить два элемента, в атоме которых на последнем энергетическом уровне: |
|
|
Вариант 1 |
Вариант 2 |
|
4 валентных электрона |
7 валентных электронов |
Образец решения задания № 3
Определить два элемента, в атоме которых на последнем энергетическом уровне 5 валентных электрона.
Алгоритм решения
Дано: 5 валентных электронов.
Найти: 2 элемента.
Решение
Число валентных электронов определяют с помощью Периодической таблицы Д.И. Менделеева, а именно, по номеру группы, в которой находится элемент (подгруппу при этом не учитывают).
Таким образом, найдем два элемента из 5 группы, пусть это будут: азот (N, порядковый номер 7) и фосфор (Р, порядковый номер 15).
Ответ: азот и фосфор.
Задание 4
|
Указать местоположение элементов в Периодической системе химических элементов Д.И. Менделеева, напишите электронные формулы атомов данных элементов: |
|
|
Вариант 1 |
Вариант 2 |
|
а) № 37 б) № 30 |
а) № 24 б) № 50 |
Образец решения задания № 4
Указать местоположение элементов в периодической системе химических элементов, напишите электронные формулы атомов данных элементов:
а) № 41
б) № 68
Алгоритм решения
Дано: элементы с порядковыми номерами 41 и 68.
Найти: 1) месторасположение элементов в периодической системе химических элементов;
2) электронные формулы атомов элементов.
Решение
Элемент с порядковым номером 41 - это ниобий (Nb). Элемент расположен в 5 периоде, значит у атома 5 энергетических уровней, в 6 ряду, следовательно у него 6 подуровней, 5 группе, побочной подгруппе, следовательно у элемента 5 валентных электронов.
Электронная конфигурация Nb: 1s22s22p63s23р64s23d104p65s14d4.
Проверяем сумму электронов в атоме:
2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 1 + 4 = 41
Следовательно, электронная конфигурация атома написана верно.
Элемент с порядковым номером 68 - это эрбий (Er). Элемент расположен в 6 периоде, значит у атома 6 энергетических уровней, в 8 ряду, следовательно у него 8 подуровней, в 3 группе, подгруппе лантаноидов, у элемента 14 валентных электронов.
Электронная конфигурация Er:
1s22s22p63s23р64s23d104p65s24d105p66s26f12
Проверяем сумму электронов в атоме:
2 + 2 + 6 + 2 + 6 + 2 + 10 + 6 + 2 + 10 + 6 + 2 + 12 = 68
Следовательно, электронная конфигурация атома написана верно.
Задание 5
|
Чем сходны и чем отличаются по составу изотопы: |
|
|
Вариант 1 |
Вариант 2 |
|
4019К 3919К |
3517Сl 3717Cl |
Образец решения задания № 5
Чем сходны и чем отличаются по составу изотопы:
126С и 146C
Алгоритм решения
Дано: изотопы: 126 С и 146 C
Найти: сходства и различия изотопов.
Решение
Изотопы 126С и 146C отличаются массовым числом (А), но имеют одинаковый заряд ядра (Z), т.е. число протонов (N(p+) = 6) и число электронов (N(е-) = 6). Также изотопы отличаются числом нейтронов (N(n0)).
Изотоп 126 С: Массовое число А = 12, число протонов N(p+) = 6, число электронов N(е-) =6, число нейтронов N(n0) = 12 – 6 = 6.
Изотоп 146 С: Массое число А = 14, число протонов N(p+) = 6, число электронов N(е-) =6, число нейтронов N(n0) = 14 – 6 = 8.
Вопросы для контроля
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №4 «Решение практико-ориентированных теоретических заданий на характеризацию химических элементов».
Цель: научиться делать описание химического элемента и вещества, используя периодическую систему химических элементов Д.И. Менделеева.
Методическое и материально-техническое обеспечение:
Ход работы:
Теоретическая часть
План – алгоритм характеристики элемента по его положению в ПСХЭ Д. И. Менделеева
1. Название.
2. Химический знак, относительная атомная масса (Ar)
3.Порядковый номер
4. Номер периода (большой 4-7 или малый 1-3)
5.Номер группы, подгруппа (главная «А» или побочная «Б»)
6. Состав атома: число электронов, число протонов, число нейтронов
Подсказка!
Число электронов = числу протонов = порядковому номеру;
Число нейтронов = атомная масса (Ar из таблицы Менделеева) – число протонов.
7. Вид элемента (s, p, d, f)
Подсказка!
s-элементы: это первые два элемента в 1-7 периодах;
p-элементы: последние шесть элементов1-6 периодов;
d-элементы: это элементы больших периодов (по 10 штук) между s- и p-элементами;
f-элементы: это элементы 6 и 7 периодов – лантаноиды и актиноиды, они вынесены вниз таблицы.
8. Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня.
Подсказка! Внешний уровень завершён у элементов VIII группы главной подгруппы "А" - Ne, Ar, Kr, Xe, Rn.
Подсказка! Для написания схемы нужно знать следующее:
Заряд ядра атома = порядковому номеру атома;
Число энергетических уровней определяют по номеру периода, в котором находится элемент;
У s- и p-элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент.
Например, Na+11)2)8)1=номеру группы;
У d- элементов на последнем уровне число электронов всегда равно двум (исключения – хром, медь, серебро, золото и некоторые другие на последнем уровне содержат один электрон).
Например, Ti+22)2)8)10)2 ; Cr++24)2)8)13)1 – исключение
Максимальное возможное число электронов на уровнях определяют по формуле Nэлектронов = 2n2, где n – номер энергоуровня.
Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV– 32 электрона и т.д.
9. Электронная и электронно-графическая формулы строения атома
Подсказка!
Для написания электронной формулы используйте шкалу энергий:
1s
Помните! На s – орбитали максимум может быть 2 электрона, на p – 6, на d – 10, на f – 14 электронов.
Например, +11Na 1s22s22p63s1; +22Ti 1s22s22p63s23p64s23d2
10.Металл или неметалл
Подсказка!
К неметаллам относятся: 2 s-элемента - водород и гелий и 20 p-элементов – бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат и радон.
К металлам относятся: все d- и f-элементы, все s-элементы (исключения водород и гелий), некоторые p-элементы.
11. Высший оксид (только для s, p)
Подсказка!
Общая формула высшего оксида дана под группой химических элементов (R2O, RO и т.д.)
12. Летучее водородное соединение (только для s, p)
Подсказка!
Общая формула летучего водородного соединения дана под группой химических элементов (RH4, RH3 и т.д.) – только для элементов 4 -8 групп.
Для составления характеристики элемента воспользуйтесь Периодической системой химических элементов Д.И. Менделеева.
Каждый элемент находится в ней в своей ячейке. Большая часть описания берется именно оттуда.
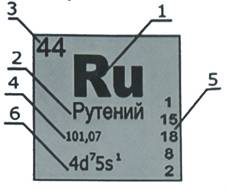 бозначение химического элемента.
бозначение химического элемента.
При расчете количества нейтронов можно воспользоваться следующей таблицей:
|
частица |
заряд |
характеристика |
|
Протон (р+) |
+ |
Сумма протонов (Z) = заряд ядра = количество электронов – порядковый номер элементов |
|
Нейтрон (n0) |
Нет заряда |
Масса протона = масса нейтрона; в сумме – атомная масса ( массовое число – А) |
|
Электрон (е-) |
- |
Масса ничтожна |
Практическая часть
Вариант 1
Дайте общую характеристику элементов с порядковыми номерами 15, 25, 38, 56 по плану приведенному выше.
Вариант 2
Дайте общую характеристику элементов с порядковыми номерами 14, 26, 37, 55 по плану приведенному выше.
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы;
- задание;
- вывод.
4. Вопросы по теме практического занятия:
4.1. Сколько электронов может максимально находиться на одной электронной орбитали?
4.2. Сколько электронов максимально может находиться на s-, р-, d-подуровне?
4.3. Почему в атоме Лития электрон, расположенный на втором электронном уровне, находится на s-орбитали, а не на р-орбитали?
4.4. Сколько электронов находится на внешнем энергетическом уровне атомов: а) Гелия; б) Лития; в) Бериллия; г) Бора; д) Углерода.
4.5. Сколько энергетических уровней заняты электронами в атомах: а) Лития, Натрия, Калия; б) Бериллия, Магния, Кальция; в) Фтора, Хлора, Брома?
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №5 «Составление уравнений реакций ОВР методом электронного баланса».
Цель: составление окислительно-восстановительных реакций методом электронного баланса, определение окислителя, восстановителя.
Методическое и материально-техническое обеспечение:
Ход работы:
Теоретическая часть
Степень окисления элемента - это условный заряд атома в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов.
Реакции, в ходе которых происходит изменение степени окисления элементов, называются окислительно-восстановительными.
Например:
Zn + H2SO4= ZnSO4 + H2
Zn0 – 2e = Zn+2 процесс окисления; Zn0 - восстановитель
2H+1 + 2e = H20 процесс восстановления; Н+ - окислитель
Металлический цинк Отдает электроны, Окисляется, а сам является Восстановителем (восстановитель – это тот, кто электроны отдает).
Катионы водорода Взяли электроны, Восстановились, а сами являются Окислителями.
Соединение, содержащее элемент в высшей степени окисления, может быть только окислителем (например: KMnO4).
Соединение, содержащее элемент в низшей степени окисления, может быть только восстановителем (например: H2S).
Соединение, содержащее элемент в промежуточной степени окисления, может быть и окислителем, и восстановителем, в зависимости от его роли в конкретной химической реакции (например: H2SO3).
Составление уравнений окислительно-восстановительных реакций методом электронного баланса
Алгоритм составления уравнений. Напишем уравнение реакции между алюминием и кислородом и определим степени окисления элементов
Al0 + O20 = Al2+3 O3-2
Чтобы получить степень окисления +3, атом алюминия должен отдать 3 электрона. Молекула кислорода, чтобы превратиться в кислородные атомы со степенью окисления -2, должна принять 4 электрона:
Al0 - 3e = Al+3 4 восст-ль, ок-ся
O20 + 4e = 2O-2 3 ок-ль, восст-ся
Чтобы количество отданных и принятых электронов выровнялось, первое уравнение надо умножить на 4, а второе – на 3. Для этого достаточно переместить числа отданных и принятых электронов против верхней и нижней строчки так, как показано на схеме вверху.
Если теперь в уравнении перед восстановителем (Al) мы поставим найденный нами коэффициент 4, а перед окислителем (O2) – найденный нами коэффициент 3, то количество отданных и принятых электронов выравнивается и становится равным 12.
Электронный баланс достигнут. Видно, что перед продуктом реакции Al2O3 необходим коэффициент 2.
Теперь уравнение окислительно-восстановительной реакции уравнено:
4Al + 3O2 = 2Al2O3
Все преимущества метода электронного баланса проявляются в более сложных случаях:
KMnO4 +
KCl + H2SO4 = Cl2 + MnSO4 +
K2SO4 +H2O![]()
Электронный баланс:
Mn+7 + 5e = Mn+2 2 ок-ль, восст-ся
2Cl-1 - 2e = Cl2 5 восст-ль, ок-ся
2KMnO4 + 10KCl + 8H2SO4 = 5Cl2 + 2MnSO4 + 6K2SO4+8H2O
Практическая часть
Задание 1: Какие соединения и простые вещества могут проявлять только окислительные свойства? Выпишите такие вещества из предложенного перечня, укажите степень окисления элемента-окислителя:
|
Вариант 1 |
Вариант 2 |
|
NH3, CO, SO2, KMnO4, Сl2, HNO2. |
H2S, SiO, P2O3, H2SO4, H2SO3, N2 |
Задание 2: Какие соединения и простые вещества могут проявлять только восстановительные свойства? Выпишите такие вещества из предложенного перечня, укажите степень окисления элемента-восстановителя:
|
Вариант 1 |
Вариант 2 |
|
H2S, HMnO4, Mg, Al2O3, KNO3 |
H2SO3, NH3 , SiO2, P2O5, Fe |
Задание 3: Подберите коэффициенты в следующих уравнениях окислительно-восстановительных реакций методом электронного баланса, укажите окислитель и восстановитель:
Вариант 1
Вариант 2
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы;
- задание;
- вывод.
4. Вопросы по теме практического занятия:
4.1. Высшая степень окисления элемента определяется:
а) по номеру периода б) по номеру группы
в) по порядковому номеру г) по подгруппе
4.2. Степень окисления восстановителя в окислительно-восстановительной реакции:
а) повышается б) понижается
в) остается без изменения г) сначала повышается, затем понижается
4.3. Схема, отражающая процесс окисления:
а) S0 → S-2 б) S+6 → S+4
в) S+4→ S+6 г) S+6 → S-2
4.4. Укажите вещество, в котором атом углерод имеет наибольшую степень окисления:
а) CО2 б) CH4
в) СО г) СаС2
4.5. Степень окисления атома азота в ионе аммония NH4+:
а) – 3 б) - 4
в) +3 г) + 4
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ № 6 «Расчёты по уравнениям химических реакций с использованием массы, объёма (н.у) газов, количества вещества»
Цель: закрепить умения решать количественные задачи по нахождению количества вещества, молярной массы, молярного объема, относительной плотности газов, массовой доли элементов в соединении.
Методическое и материально-техническое обеспечение:
Ход работы:
Теоретическая часть
ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА
Обозначение: Ar
Относительна атомная масса - это отношение массы данного атома к массе атома водорода:
Ar = 𝒎ат. /𝒎ат𝑯
Показывает во сколько раз масса данного атома больше массы атома водорода
Является безразмерной величиной.
Определяется по Периодической системе:
Ar(H) = 1
Ar(O) = 16
Ar(C) = 12
Ar(S) = 32
Ar(Na) = 23
ОТНОСИТЕЛЬНАЯ МОЛЕКУЛЯРНАЯ МАССА
Обозначение: Мr
Относительна молекулярная масса - это отношение массы данной молекулы к массе атома водорода:
Мr = 𝒎молек. /𝒎ат𝑯
Показывает во сколько раз масса молекулы больше массы атома водорода
Является безразмерной величиной.
Определяется по Периодической системе:
Мr(H2) = 2
Мr(O2) = 32
Мr(CО2) = 12 + 16*2 = 44
Mr(H2SO4) = 1*2 + 32 + 16*4 = 98
Mr(Na2CO3) = 23*2 + 12 + 16*3 = 106
КОЛИЧЕСТВО ВЕЩЕСТВА
В процессе химических реакций атомы (или молекулы) вещества друг с другом взаимодействуют, образуя новые молекулы. Но определить количество атомов, молекул и других частиц на практике невозможно – они слишком малы и не видны невооруженным глазом.
Для определения числа структурных частиц вещества в химии применяют особую величину – количество вещества (n – «эн»).
Единицей количества вещества является моль (от слова «молекула»).
1 моль любого вещества содержит 6,02·1023 частиц (молекул, атомов, ионов), т. е. число частиц в 1 моле – это и есть постоянная величина (NA постоянная Авогадро).
Например:
1 моль Са имеет массу 40 г и содержит 6,02·1023 атомов кальция
1 моль CaCl2 (ионное соединение) имеет массу 111 г и содержит 6,02·1023 ионов кальция и 12,04·1023 ионов хлора.
1 моль H2O имеет массу 18 г и содержит 6,02·1023 молекул воды или 6,02·1023 атомов кислорода и 12,04·1023 атомов водорода.
Используя постоянную Авогадро, можно находить количество вещества, если известно число молекул в нем, и наоборот.
Количество вещества равно отношению общего числа его молекул к постоянной Авогадро.
n =N / NA
Зная количество вещества, находят число структурных единиц N.
Зная число структурных единиц, находят количество вещества n.
Задача. Рассчитайте, сколько атомов содержится в 0,5 моль метана СН4?
Рассуждаем, если 1 моль СН4 содержит 6,02·1023 молекул, то 0,5 моль СН4 содержит 3,01·1023 молекул
1 молекула СН4 содержит 5 атомов, следовательно 3,01·1023·5=15,5·1023 молекул.
Если считать отдельно атомов углерода, то видно, что их будет 3,01·1023, а атомов водорода будет 3,01·1023·4=12,04·1023
Задача. Рассчитайте количество вещества, которое соответствует 0,6·1023 молекул аммиака NH3 ?
n (NH3)= N / NA = 0,6·1023 /6,02·1023 = 0,099 моль
МОЛЯРНАЯ МАССА
Установлено, что масса одного моля вещества численно равна его относительной молекулярной массе. Такая величина называется молярной массой вещества, М. Молярная масса измеряется в г/моль.
Например, молярная масса азота N2 равна 28 г/моль.
Количество вещества можно вычислить, разделив массу порции вещества на молярную массу этого вещества:
n =m / М.
Задача. Какое количество оксида кальция содержится в 112 г этого вещества?
|
Дано: m (СаО )=112г Найти: n (СаО) – ? |
Решение: Химическая формула оксида кальция – СаО. n(CaO) = m(CaO)/М(СаО) Mr(CaO) = 40 + 16 = 56 n(CaO) = 112 г/ (56г/моль) = 2 моль |
|
Ответ: 2 моль СаО. |
Задача. Вычислите массу порции воды, в которой содержится столько же молекул, сколько их в 22 г углекислого газа.
|
Дано: m(CO2) = 22 г n(CO2) = n(H2O) Найти: m(H2O) – ? |
Зная массу углекислого газа, рассчитывают его количество. Затем находят количество воды (оно будет равно количеству углекислого газа). А потом, зная количество воды, вычисляют ее массу: m(CO2) → n(CO2) → n(H2O) → m(H2O) Решение 1. n(CO2) = m(CO2)/М(СО2) Mr(CO2) = 12 + 16·2 = 44 n(CO2) = 22 г/ 44 г/моль = 0,5 моль 2. n(H2O) = n(CO2) = 0,5 моль 3. m(H2O) = n(H2O)·M(H2O) Mr(H2O) = 1·2+16 = 18 m(H2O) = 0,5 моль·18 г/моль = 9 г |
|
Ответ: 9 г Н2О. |
МОЛЯРНЫЙ ОБЪЕМ
В 1811 году итальянский ученый Амедео Авогадро сформулировал основной газовый закон, который назвали его именем.
Закон Авогадро звучит так: в равных объемах газов при одинаковых условиях содержится равное число молекул.
Следовательно, при одинаковых условиях равные количества различных газов занимают равные объемы.
При нормальных условиях (при температуре 0 °С и давлении 1 атм.) 1 моль любого газа занимает объем 22,4 л.
Эта физическая постоянная – молярный объем газа при н. у.:
Vm = 22,4 л/моль при нормальных условиях.
Количество газообразного вещества равно отношению объема порции газа к молярному объему газа при данных условиях.
n = V / Vm.
Задача. Вычислите массу метана СН4, объем которого при н. у. составляет 67,2 л.
|
Дано: V(CН4) = 67,2 л Найти: m(CН4) – ? |
Решение. Алгоритм решения V(CН4) → n(CН4) → m(CН4) 1) n(CН4) = V(CН4)/Vn = 67,2 л/ 22,4 (л/моль) = 3 моль 2) m(CН4) = n(CН4)·M(CН4) Mr(CН4) = 12 + 1·4 =16 m(CН4) = 3 моль·16 г/моль = 48 г |
|
Ответ: 48 г CН4. |
ОТНОСИТЕЛЬНАЯ ПЛОТНОСТЬ ГАЗА
Относительная плотность газа — это отношение молярной массы данного газа к молярной массе того газа, по которому она находится.
D = M1 / M2
Эта постоянная величина выводится из следствия из закона Авогадро:
2 следствие:
Отношение масс одинаковых объёмов различных газов при одинаковых условиях равно отношению их молярных масс (поскольку в равных объёмах газов при одинаковых условиях содержится одинаковое число молекул и, следовательно, одинаковое число молей):
m1/m2 = M1 / M2 = D
D – показывает во сколько раз один газ тяжелее или легче другого и является безразмерной величиной.
Очень часто определяют относительную плотность газа по воздуху.
М (воздуха) = 29 г/моль
Зная относительную плотность газа, можно определить его молярную массу:
М (газа1) = М(газа 2) • Dгаза 2 (газа 1)
Задача. Определить относительную плотность аммиака по водороду.
Решение:
DH2(NН3) = М(NН3) / М(Н2)
М(NH3) = 17г/моль, М(Н2) = 2г/моль
DH2(NН3) =17г/моль / 2г/моль = 8,5
Задача. Определите молярную массу газа, если его относительная плотность по воздуху равна 2,207.
Решение:
Из Dвозд.(газа) = Мгаза / М(воздуха) имеем:
Мгаза = М(воздуха) · Dвозд. = 29 г/моль · 2,207 = 64,0 г/моль.
МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА
Массовая доля элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
w(элемента) = n·Ar(элемента) / Mr(вещества) ·100 %
где w – массовая доля элемента в веществе,
Ar– относительная атомная масса,
n– индекс в химической формуле,
Mr– относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях:
w (элемента) = 20% или 0,2.
Задача. Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H3PO4, с точностью до сотых.
|
Дано: Фосфорная кислота H3PO4
Найти: w%(H) w%(P) w%(O) |
Решение: 1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав ортофосфорной кислоты Ar(H)=1, Ar(P)=31, Ar(O)=16 2.Записываем формулу расчета в общем виде Mr(H3PO4): Mr(H3PO4) = n1·Ar(H) +n2·Ar(P) + n3·Ar(O) 3.Подставляем значения относительных атомных масс элементов с учетом моль атомов в формулу расчета и вычисляем: Mr(H3PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98 4. Вычисляем массовые доли элементов по формуле: w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества) для водорода: w(H) = n(H)·Ar(H)·100% / Mr(H3PO4) = 3·1·100% / 98 = 3,06% для фосфора: w(P) = n(P)·Ar(P)·100% / Mr(H3PO4) = 1·31·100% / 98 = 31,63% для кислорода: w(O) = n(O)·Ar(O)·100% / Mr(H3PO4) = 4·16·100% / 98 = 65,31% Проверка: Сумма значений массовых долей всех элементов должна составить 100%. w(H) + w(P) + w(O) = 100% Подставляем значения: 3,06% + 31,63% + 65,31% = 100% Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно. |
|
Ответ: w(H) = 3,06%, w(P) = 31,63%, w(O) = 65,31% |
Практическая часть
Вариант 1
Вариант 2
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы;
- задание;
- вывод.
4. Вопросы по теме практического занятия:
4.1. Наибольшую относительную молекулярную массу имеет вещество с формулой: MgO, Al2O3, NaOH
4.2. Вычислить массу железа, взятого количеством 1,5 моль.
4.3. Записать формулу, связывающую объём, количество вещества и молярный объём.
4.4. Записать формулу, связывающую массу, количество вещества и молярную массу.
4.5. Определить относительную плотность аммиака (NH3) по водороду (Н2).
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №7 «Решение заданий на составление ионных уравнений».
Цель: закрепить и расширить знания об особенностях и условиях протекания реакций ионного обмена, закрепить умения составлять ионные уравнения.
Методическое и материально-техническое обеспечение:
Ход работы:
Теоретическая часть
Многие химические реакции происходят в растворах, которые содержат ионы. Поэтому реакции в растворах электролитов фактически сводятся к реакциям между ионами.
Реакции ионного обмена – это реакции между ионами, образовавшимися в результате диссоциации электролитов.
Реакции ионного обмена протекают до конца в следующих случаях:
р р н р
NaCl + AgNO3 = AgCl¯ + NaNO3
Na+ + Cl- + Ag+ + NO3- = AgCl¯ + Na+ + NO3-
Ag+ + NO3- = AgCl¯
Na2CO3 + 2НCl =2NaCl + Н2O + СО2
2Na+ + C O3 2-+ 2Н++ 2С l - = 2Na+ + 2Cl - + Н2O + СО2
C O3 2-+ 2Н+= Н2O + СО2
КОН + НNO3 = КNO3 + Н2O
К+ + ОН - + Н + + NO3- = Н2O + К+ + NO3-
ОН - + Н + = Н2O
Если в растворах нет таких ионов, которые могут связываться между собой с образованием осадка¯, газа, или воды Н2O, то реакция является обратимой.
Правила cоставления ионных уравнений
Алгоритм составления ионного уравнения реакции
|
Алгоритм составления ионного уравнения реакции |
Пример |
|
3NaОН + FeCl3 = Fe(ОН)3¯ + 3NaCl
р р н р 3NaОН + FeCl3 = Fe(ОН)3¯ + 3NaCl
3Na++3ОН- + Fe3++3Cl - = Fe(ОН)3¯ + 3Na+ +3Cl-
3Na++3ОН- + Fe3++3Cl - = Fe(ОН)3¯ + 3Na+ +3Cl- 3ОН- + Fe3+ = Fe(ОН)3¯ |
Практическая часть
Вариант 1
Задание 1. Закончите уравнения реакций. Составьте полное и сокращенное ионное уравнения этих реакций.
Задание 2. Напишите молекулярные и ионно-молекулярные уравнения взаимодействия пар веществ:
- гидроксид магния и азотная кислота;
- карбонат кальция и соляная кислота.
Задание 3. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания используйте следующий перечень веществ: иодид калия, гидроксид калия, серная кислота, азот, сульфат натрия.
Задание 4. Рассчитайте массу соли, полученной при взаимодействии 200 г 10% раствора нитрата серебра с 100 г 5% раствора хлорида магния.
Вариант 2
Задание 1. Закончите уравнения реакций. Составьте полное и сокращенное ионное уравнения этих реакций.
Задание 2. Напишите молекулярные и ионно-молекулярные уравнения взаимодействия пар веществ:
- гидроксид натрия и азотистая кислота;
- сульфид калия и серная кислота.
Задание 3. Из предложенного перечня веществ выберите вещества, между которыми возможна реакция ионного обмена. Запишите молекулярное, полное и сокращённое ионное уравнения этой реакции.
Для выполнения задания используйте следующий перечень веществ: сероводород, оксид железа(II), нитрат серебра, карбонат бария, хлорид железа (III).
Задание 4. Рассчитайте массу соли, полученной при взаимодействии 100г 2% раствора гидроксида натрия и 200г 5% раствора нитрата железа (II).
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы;
- задание;
- вывод.
4. Вопросы по теме практического занятия:
4.1. Объяснить, в каких случаях реакции ионного обмена идут до конца.
4.2. Привести пример уравнения реакции, идущей с выделением газообразного вещества.
4.3. Привести пример уравнения реакции, идущей с образованием осадка.
4.4. Привести пример уравнения реакции, идущей с образованием малодиссоциирующего вещества.
4.5. Написать уравнения реакций диссоциации хлорида меди, гидроксида бария, серной кислоты.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №8 «Решение практических заданий по классификации, номенклатуре и химическим формулам неорганических веществ различных классов».
Цель: закрепить и расширить знания о классификации и номенклатуре неорганических веществ различных классов.
Методическое и материально-техническое обеспечение:
Ход работы:
Теоретическая часть
Классификация неорганических веществ основана на их способности к разложению. Простые вещества, состоящие из атомов только одного химического элемента (O2, H2, Mg), не распадаются. Легко разлагаются сложные вещества, состоящие из атомов двух и более элементов (CO2, H2SO4, NaOH, KCl).
К важнейшим классам неорганических веществ по традиции относят:
Простые вещества обычно делят на металлы и неметаллы.
Металлы – простые вещества, в которых атомы связаны между собой металлической связью.
Неметаллы – простые вещества, в которых атомы связаны между собой ковалентными (или межмолекулярными) связями.
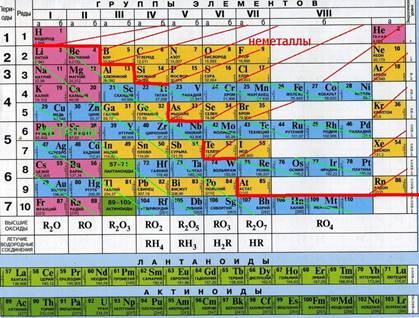
По химическим свойствам среди металлов выделяют группу так называемых амфотерных металлов.
Это название отражает способность этих металлов, их оксидов и гидроксидов реагировать как с кислотами, так и со щелочами.
ОКСИДЫ
Оксиды – бинарные соединения, одним из двух элементов в которых является кислород со степенью окисления -2.
|
Основные |
Амфотерные |
Кислотные |
Несолеобразующие |
Солеобразные (двойные) |
|
|
Оксиды металлов в степенях окисления +1, +2, кроме амфотерных. |
Оксиды металлов в степенях окисления +2: толькоBe, Zn, Sn, Pb; +3 (все, кроме La2O3), +4 |
1) Оксиды неметаллов, кроме несолеобразующих; 2) Оксиды металлов в степенях окисления от +5 и выше. |
Оксиды неметаллов, которым не соответствуют кислоты.
NO, N2O, CO, (SiO) |
Некоторые оксиды, в которых элемент имеет 2 степени окисления: Fe3O4
|
|
|
С о л е о б р а з у ю щ и е |
|||||
Каждому солеобразующему оксиду соответствует гидроксид:
Основным оксидам соответствуют основания;
Амфотерным оксидам – амфотерные гидроксиды,
Кислотным оксидам – кислородсодержащие кислоты.
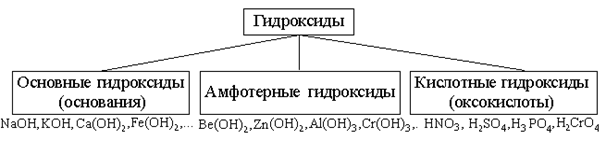
ГИДРОКСИДЫ
Гидроксиды – соединения, в состав которых входит группа Э–О-Н. И основания, и кислородсодержащие кислоты, и амфотерные гидроксиды – относятся к ГИДРОКСИДАМ!
Связь между оксидом и гидроксидами
|
Степень окисления |
Оксид |
Гидроксиды |
Примеры |
||
|
Основания |
Кислоты |
||||
|
+1 |
Э2О |
ЭОН |
НЭО |
КОН |
НClO |
|
+2 |
ЭО |
Э(ОН) 2 |
Н2ЭО2 |
Ba(OH) 2 |
? |
|
+3 |
Э2О3 |
Э(ОН) 3 |
НЭО2 (мета-форма) --(+H2O) Н3ЭО3 (орто-форма) |
Al(OH) 3 |
HNO2 H3PO3 |
|
+4 |
ЭО2 |
----- |
H2ЭО3 H 4ЭO 4 |
----- |
Н2СО3 H 4SiO 4 |
|
+5 |
Э2О5 |
----- |
НЭО3 Н3ЭО4 |
----- |
HNO3 H3PO4 |
|
+6 |
ЭО3 |
----- |
H2ЭO4 |
----- |
H2SO4 |
|
+7 |
Э2О7 |
----- |
НЭО4 --(+ 2H2O) H 5ЭО6 |
----- |
HClO4 H5IO6 |
Как составить формулу кислотного гидроксида:
А. Если чётная степень окисления элемента в оксиде: ПРИБАВЛЯЕМ ВОДУ к оксиду.
Пример: WO3 –(+H2O)
= H2WO4
Б. Если нечетная степень окисления:
|
Мета-форма кислоты - ОДИН атом водорода: НЭОх |
Орто-форма кислоты – отличается от МЕТА-формы на одну молекулу воды. Н3ЭОх+1 |
Пример: Оксид As2O5, степень окисления мышьяка +5.
Составим формулу кислоты: Н+As+5O-2x
Так как суммарный заряд =0, легко рассчитать, что х=3.
HAsO3 - это МЕТА-форма кислоты - мета-мышьяковая кислота.
Но для фосфора и мышьяка существует и более устойчива ОРТО-форма. Прибавив к мета-форме Н2О, получим H3AsO4. Это орто-мышьяковая кислота.
ОСНОВАНИЯ
Основания – сложные вещества, содержащие в своем составе гидроксид-ионы ОН- и при диссоциации образующие в качестве анионов только эти ионы.
Типы оснований
|
Растворимые (Щелочи) |
Нерастворимые |
|
1) гидроксиды металлов первой группы главной подгруппы: LiOH, NaOH, KOH, RbOH, CsOH 2) гидроксиды металлов второй группы главной подгруппы, начиная с кальция: Ca(OH)2, Sr(OH)2, Ba(OH)2 |
Все остальные гидроксиды металлов. |
КИСЛОТНОСТЬ основания – это число групп ОН в его формуле:
однокислотные – содержащие только 1 гидроксогруппу
двухкислотные – имеющие 2 гидроксогруппу;
трёхкислотные – с тремя группами ОН.
КИСЛОТЫ
Кислоты – сложные вещества, содержащие в своем составе ионы оксония Н+ или при взаимодействии с водой образующие в качестве катионов только эти ионы.
Классификация кислот по составу
|
Кислородсодержащие кислоты |
Бескислородные кислоты |
|
1) высшие кислоты H2SO4 серная кислота HNO3 азотная кислота H3PO4 фосфорная кислота H2CO3 угольная кислота H2SiO3 кремниевая кислота 2) кислоты с меньшей степенью окисления неметалла H2SO3 сернистая кислота HNO2 азотистая кислота |
HF фтороводородная кислота HCl хлороводородная кислота (соляная кислота) HBr бромоводородная кислота HI иодоводородная кислота H2S сероводородная кислота |
Классификация кислот по числу атомов водорода
|
Одноосновные |
Двухосновные |
Трехосновные |
|
HNO3 азотная HF фтороводородная HCl хлороводородная HBr бромоводородная HI иодоводородная |
H2SO4 серная H2SO3 сернистая H2S сероводородная H2CO3 угольная H2SiO3 кремниевая |
H3PO4 фосфорная |
Классификация по силе и устойчивости
|
Сильные кислоты |
Слабые кислоты |
|
HI иодоводородная HBr бромоводородная HCl хлороводородная H2SO4 серная HNO3 азотная HClO4 хлорная |
HF фтороводородная H3PO4 фосфорная HNO2 азотистая (неустойчивая) H2SO3 сернистая (неустойчивая) H2CO3 угольная (неустойчивая) H2S↑ сероводородная H2SiO3↓ кремниевая СН3СООН уксусная |
СОЛИ
Соли – это сложные вещества, состоящие из одного (нескольких) атомов металла (или более сложных катионных групп, например, аммонийных групп NН4+) и одного (или нескольких) кислотных остатков.
Классификация солей.
|
СОЛИ |
|||||
|
Средние |
Кислые |
Основные |
Двойные |
Сме-шанные |
Комплексные |
|
Продукт полного замещения атомов водорода в кислоте на металл |
Продукт неполного замещения атомов водоро-да в кислоте на металл |
Продукт непол-ного заме-щения ОН-групп на кислотный остаток |
Содержат два разных металла и один кислотный остаток |
Содер-жат один металл и два кислотных остатка |
Содержат комплексный катион или анион – атом металла, связанный с несколькими лигандами. |
|
AlCl3 |
КHSO4 |
FeOHCl |
KAl(SO4)2 |
CaClBr |
K2[Zn(OH)4] |
|
Хлорид алюминия |
Гидросульфат калия |
Хлорид гидроксожелеза (II) |
Сульфат алюминия-калия |
Хлорид-бромид кальция |
Тетрагидроксоцинкат калия |
Номенклатура солей. В названиях солей используются латинские названия образующих кислоты неметаллов.
|
Элемент |
Латинское название |
Корень |
|
Н |
гидрогениум |
ГИДР- |
|
С |
карбоникум |
КАРБ- |
|
N |
нитрогениум |
НИТР- |
|
S |
сульфур |
СУЛЬФ- |
Построение названий солей.
|
Соль какой кислоты |
Кислотный остаток |
Название солей |
Примеры |
|
|
Высшие кислоты |
Азотная HNO3 |
NO3- |
нитраты |
Ca(NO3)2 нитрат кальция |
|
Кремниевая H2SiO3 |
SiO32- |
силикаты |
Na2SiO3 силикат натрия |
|
|
Угольная H2CO3 |
CO32- |
карбонаты |
Na2CO3 карбонат натрия |
|
|
Фосфорная H3PO4 |
PO43- |
фосфаты |
AlPO4 фосфат алюминия |
|
|
Серная H2SO4 |
SO42- |
сульфаты |
PbSO4 сульфат свинца |
|
|
Бескислородные кислоты |
Бромоводородная HBr |
Br- |
бромиды |
NaBr бромид натрия |
|
Иодоводородная HI |
I- |
иодиды |
KI иодид калия |
|
|
Сероводородная H2S |
S2- |
сульфиды |
FeS сульфид железа (II) |
|
|
Соляная HCl (хлороводородная) |
Cl- |
хлориды |
NH4Cl хлорид аммония |
|
|
Фтороводородная HF |
F- |
фториды |
CaF2 фторид кальция |
|
|
Более низкая степень. ок. |
Cернистая кислота H2SO3 |
SO32- |
сульфиты |
К2SO3 сульфит калия |
|
Азотистая HNO2 |
NO2- |
нитриты |
КNO2 нитрит калия |
Кислые соли, помимо ионов металла и кислотного остатка, содержат ионы водорода. Названия кислых солей содержат приставку "гидро": NaHCO3 – гидрокарбонат натрия,
K2HPO4 – гидрофосфат калия,
KH2PO4 – дигидрофосфат калия.
Основные соли, помимо ионов металла и кислотного остатка, содержат гидроксильные группы. Основные соли образуются при неполной нейтрализации основания. Названия основных солей образуют с помощью приставки "гидроксо":
Mg(OH)Cl - гидроксохлорид магния (основная соль)
Двойные соли – имеют два разных катиона металла или аммония. В названии их перечисляют через дефис:
(NH4)Fe(SO4)2 – сульфат железа (III)-аммония.
Смешанные соли – имеют два разных аниона кислотных остатков. В названии их называют через дефис: СаOCl2 или CaCl(OCl) - хлорид-гипохлорит кальция (традиционное название хлорная известь).
Комплексные соли – содержат сложный комплексный анион (или реже катион), состоящий из металла-комплексообразователя и нескольких лигандов (отрицательно заряженные ионы или молекулы аммиака или воды).
Пример: K[Al(OH)4] – тетрагидроксоалюминат калия
K4[Fe(CN)6] – гексацианоферрат калия
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди (II)
Бытовые (тривиальные) названия некоторых солей.
|
Соль |
Международное название |
Традиционное название |
|
NaHCO3 |
Гидрокарбонат натрия |
Сода питьевая |
|
Na2CO3 |
Карбонат натрия |
Сода кальцинированная |
|
K2CO3 |
Карбонат калия |
Поташ |
|
Na2SO4 |
Сульфат натрия |
Глауберова соль |
|
KClO3 |
Хлорат калия |
Бертолетова соль |
|
Ca3(PO4)2 |
Фосфат кальция |
Фосфорит |
|
СаСО3 |
Карбонат кальция |
Известняк |
|
CuSO4∙5H2O |
Пентагидрат сульфата меди |
Медный купорос |
|
Na2CO3∙10Н2О |
Декагидрат карбоната натрия |
Сода кристаллическая |
Практическая часть
Вариант 1
Задание 1. Указать к какому классу принадлежат следующие неорганические соединения, дать им названия по систематической номенклатуре:
FeOHCl2, P2O5, CaCl2, NO, HCl, BaO, H3PO4, SrCO3.
Задание 2. Из задания № 1 выписать формулы кислот.
Задание 3. Составить формулы всех возможных оксидов для следующих элементов: Ca , S, O, Mg.
Задание 4. Составить формулы следующих соединений: оксид азота (I), гидроксид натрия, сульфат бария, оксид магния, хлорид алюминия, дигидрофосфат калия.
Задание 5. Установить соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
|
Формула вещества |
Класс/группа |
|
А) NH4HCO3 Б) KF В) NО |
1) соль средняя 2) оксид кислотный 3) оксид несолеобразующий 4) соль кислая |
Вариант 2
Задание 1. Указать к какому классу принадлежат следующие неорганические соединения, дать им названия по систематической номенклатуре:
CuSO4, NaHS, Mn2O7, B2O3, H2MnO4, Ni(OH)2, H2Se, Sn(OH)2.
Задание 2. Из задания № 1 выпишите формулы солей.
Задание 3. Составить формулы всех возможных оксидов для следующих элементов: C, Al, N, Fe.
Задание 4. Составить формулы следующих соединений: фтороводородная кислота, гидроксид бария, нитрат меди, оксид железа (III), оксид кремния, гидрофосфат натрия.
Задание 5. Установить соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию из второго столбца, обозначенную цифрой.
|
Формула вещества |
Класс/группа |
|
А) CrO3 Б) (CuOH)2CO3 В) (NH4)2HPO4 |
1) основная соль 2) оксид амфотерный 3) оксид кислотный 4) кислая соль |
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы;
- задание;
- вывод.
4. Вопросы по теме практического занятия:
4.1. Кислотным и основным оксидом являются соответственно:
1) SO2 и MgO 2) CO2 и Al2O3
3) Na2O и FeO 4) ZnO и SO3
4.2. К кислым солям не относится вещество, формула которого:
1) NH4Cl 2) NaHS
3) Ca(HCO3)2 4) NaH2PO4
4.3. К амфотерным оксидам относится:
1) SO3 2) K2O 3) ZnO 4) N2O
4.4. Число гидроксидов среди перечисленных веществ равно:
Н2SO4, Ni(OH)2 , Fe2(SO4)3 , Zn(OH)2 , SO2 , KOH , NaCl , H3PO4
1) 5 2) 2 3) 3 4) 4
4.5. Основные свойства проявляет высший оксид элемента
1) серы 2) азота 3) бария 4) углерода
Практическое занятие №9
Решение задач на вычисление массовой доли (массы) химического элемента (соединения) в молекуле (смеси).
Цель работы: На практике закрепить знания об относительной атомной и молекулярной массе, массовой доле элемента в сложном веществе в решении упражнений и задач по вычислению относительной молекулярной массы (задание №1), вычислению массовых отношений элементов (задание №2), массовых долей элементов (задание №3) в соединениях, нахождение формулы вещества по содержанию массовых долей элементов в соединении (задание № 4)
Вычисление относительной молекулярной массы
Теоретическое обоснование
1.Относительная молекулярная масса равна сумме всех относительных атомных масс элементов с учетом индекса элемента. Относительная молекулярная масса соединения величина безразмерная. Она показывает во сколько раз относительная молекулярная масса соединения больше 1/12 массы изотопа углерода-12.
2.Для вычисления относительной молекулярной массы необходимо суммировать относительные атомные массы элементов образующих соединение.
Мr = n1 *Аr1 + n2* Ar2 + n3* Ar3
|
Задание №1 Вычислите относительную молекулярную массу сульфата алюминия, химическая формула которого Al2(SO4)3. Алгоритм решения |
|
Дано: Al2(SO4) 3 |
1.Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав сульфата алюминия: Ar(Al)=27 2.Записываем формулу расчета Мr (Al2(SO4) 3) в общем виде: Мr (Al2(SO4) 3) = n1 *Аr (AI) + n2* Ar(S) + n3* Ar(O) n1- число атомов (моль атомов алюминия) n2- число атомов (моль атомов серы) n3- число атомов кислорода (моль атомов кислорода) 2.Подставляем значения относительных атомных масс элементов с учетом моль атомов в формулу расчета и вычисляем. Мr (Al2(SO4) 3 )= 27 * 2 + (32 + 16*4) * 3 = 342 |
|
Мr (Al2(SO4) 3)-? |
Ответ: Мr (Al2(SO4) 3) =342 Не забывайте, что Мr величина безразмерная |
Задание № 1 (для учащихся) Вычислите относительные молекулярные массы:
Вариант 1: оксида железа (III) Fe2O3, гидроксида кальция Ca(OH)2,
Вариант 2: нитрата меди (II) Cu(NO3)2, глицерина C3H8O3,
Вариант 3: оксида углерода (IV) CO2, азотной кислоты HNO3,
Вариант 4: гидроксида алюминия Al(OH) 3, карбоната калия K2CO3.
II.Вычисление отношения масс атомов элементов в сложном веществе по его формуле
Теоретическое обоснование
Зная относительные атомные массы элементов и число атомов, входящих в состав химического соединения, можно определить массовые соотношения этих элементов
|
Задание №2 Вычислите массовые отношения элементов в серной кислоте Алгоритм решения |
|
|
Дано: H2SO4 |
1.Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав серной кислоты: Ar(Н)=1, Ar(S)=32, Ar(O)=16 2.Вычисляем массовые отношения элементов в молекуле серной кислоте: В молекуле серной кислоте: 1*2 часть приходиться на атомы H (так как два атома) 32 части - на атомы S (так как один атом) 16 *4 =64 части – на атомы О (так как четыре атома) 2.Определим, как они относятся к друг другу в массовом соотношении: H : S : O = 2: 32 : 64 = 1 : 16 : 32 1+16+32=49 Это означает,что 49 мас.частей серной кислоты приходится: 1 мас.ч. Н, 16 мас. ч. S, 32 мас. ч. О |
|
Определить: Аr(Н):Аr(S):Аr(O) |
Ответ: 1:16:32 |
Задание № 2 (для учащихся) Вычислите массовые доли элементов в соединении
Вариант 1: в перманганате калия КМnО4.
Вариант 2: в карбонате магния MgCO3.
Вариант 3: в сульфиде железа FeS.
Вариант 4: в бромиде железа FeВr3.
III. Вычисление массовой доли элементов в соединение
Теоретическое обоснование занятия
Массовая доля элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества.
n·Ar(элемента)
w(элемента) = ------------------------------- *100 %
Mr(вещества), (5)
где
w – массовая доля элемента в веществе, Ar– относительная атомная масса,
n– индекс в химической формуле, Mr– относительная молекулярная масса вещества.
Массовые доли выражают в процентах или в долях: w (элемента) = 20% или 0,2.
|
Задание № 3 Вычислите массовые доли элементов в фосфорной кислоте, имеющей простейшую химическую формулу H3PO4, с точностью до сотых. АЛГОРИТМ РЕШЕНИЯ |
|
Дано: Фосфорная кислота H3PO4 |
Решение: 1. Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов, входящих в состав ортофосфорной кислоты Ar(H)=1, Ar(P)=31, Ar(O)=16 2.Записываем формулу расчета в общем виде Mr(H3PO4): Mr(H3PO4) = n1*Ar(H) +n2*Ar(P) + n3*Ar(O) 3.Подставляем значения относительных атомных масс элементов с учетом моль атомов в формулу расчета и вычисляем: Mr(H3PO4) = 3·Ar(H) + Ar(P) + 4·Ar(O) = 3·1 + 31 + 4·16 = 98 3. Вычисляем массовые доли элементов по формуле: w(элемента) = (n· Ar(элемента) · 100%) / Mr(вещества) для водорода: w(H) = n(H)·Ar(H)·100% / Mr(H3PO4) = 3·1·100% / 98 = 3,06% для фосфора: w(P) = n(P)·Ar(P)·100% / Mr(H3PO4) = 1·31·100% / 98 = 31,63% для кислорода: w(O) = n(O)·Ar(O)·100% / Mr(H3PO4) = 4·16·100% / 98 = 65,31% Проверка: Сумма значений массовых долей всех элементов должна составить 100% w(H) + w(P) + w(O) = 100% Подставляем значения: 3,06% + 31,63% + 65,31% = 100% Таким образом, массовые доли элементов в фосфорной кислоте вычислены правильно. |
|
Найти: w%(H) w%(P) w%(O) |
Ответ: w(H) = 3,06% w(P) = 31,63% w(O) = 65,31% |
Задание №3
Вариант 1: Вычислить массовую долю азота в нитрате кальция (Ca(NO3)2
Вариант 2: Вычислите содержание кислорода в перманганате калия (KMnO4)
Вариант 3: Вычислите содержание серы в минерале пирите (FeS2)
Вариант 4: Вычислите массовую долю серебра в оксиде серебра (Ag2O)
IV.Нахождение формулы вещества по содержанию массовых долей элементов
Теоретическое обоснование
1.Задачи на вывод формулы вещества по данным химического анализа относится к группе задач, которые решаются по формулам.
2. Для решения задач данного типа необходимо знать массовые доли элементов, которые входят в состав соединения.
3.Также необходимо знать, что общее содержание веществ в соединении равно 100%. Поэтому иногда в условии задачи указывается содержание не всех элементов, с учетом того, что неизвестное содержание второго или третьего элемента всегда можно определить.
|
Задача 4. Установите формулу вещества, которое состоит из углерода (w=25%) и алюминия (w=75%). АЛГОРИТМ РЕШЕНИЯ |
|
|
Дано: w(С)=25% (0.25 ) w(Аl)=75% (0.75) |
1.Из Периодической таблицы имени Д.И.Менделеева выписываем значения относительных масс атомов элементов Al, С: M(Al)=27 , М(С)=12 , значит. молярные массы веществ равны соответственно: M(Al)=27 г/моль, М(С)=12 г/моль 2.Из условия задачи нам известно, что w(С)=25% (0.25 ) и w(Аl)=75% (0.75), значит в 100 г вещества содержится: m(AI)=27 г и m(C)=25г 3.Определим, сколько количества вещества содержится в 27 г. алюминия:n(Al) : - для этого воспользуемся формулой нахождения количества вещества: n(Al)= m(AI)/ M(Al) -подставляем значения в формулу и рассчитываем: n(Al)= 75 г / 27 г/моль =2,78 моль 4.Определим, сколько количества вещества содержится в 25 г. углерода: - для этого воспользуемся формулой нахождения количества вещества: n(C)=m(C)/M(C) -подставляем значения в формулу и рассчитываем: n (C) = 25г / 12 г/моль = 2,08 моль n (C) n(AI): n(C)= 2.78 : 2,08 Получившийся результат выражается десятичными числами, поэтому необходимо привести результат к целым. а)принимаем меньшее число условно за 1 и производим операцию деления деления большего числа на меньшее и получаем: 2,78 : 2,08=1,34:1 б)в результате деления снова получили десятичное число, следовательно нужно искать получившийся результат последовательным делением меньшего числа на натуральные числа:: 2,3,4,5 и т.д до тех пор пока полученная при делении величина не будет укладываться в большем числе целое количество раз. 2,08 : 2. = 1,04 2,78: 1,04 = 2,67 : 1 2,08 :3 = 0,69 2,78 :0,69 = 4 : 3 Следовательно, индексы x и y в формуле вещества AlxCy равны 4 и 3, соответственно. |
|
Найти: AlхCу |
Ответ: Al4C3 (карбид алюминия). |
Задание № 4
Вариант 1:
В состав химического вещества входят кальций (массовая доля 29,4%),сера (23,5%) и кислород (47,1%). Установите формулу этого вещества.
Вариант 2:
Массовая доля серы в соединении с кислородом равна 40%. Выведите формулу этого вещества.
Вариант №3:
В соединении калия, хлора и кислорода массовые доли элементов равны соответственно 31,8, 29,0, 39,2%.Установите формулу этого вещества.
Вариант №4:
Массовая доля магния в его соединении с кислородом равна 60%. Определите формулу этого соединения.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №10 «Составление уравнений химических реакций с участием простых и сложных неорганических веществ».
Цель: закрепить и обобщить теоретические и практические знания о неорганических соединениях.
Методическое и материально-техническое обеспечение:
Ход работы:
Теоретическая часть
Химическое уравнение — это условная запись химической реакции с помощью формул и символов.
Их записывают в виде схемы, в которой отражён процесс превращения. В левой части располагаются формулы реагентов — веществ, вступающих в реакцию. Завершается уравнение продуктами реакции — веществом или веществами, которые получились в результате.
Новые вещества образуются потому, что изменяются связи между атомами, но сами атомы не возникают из ниоткуда и не исчезают в никуда. На рисунке видно, что атом углерода из состава метана перешёл в состав углекислого газа, атом водорода — в состав воды, а атомы кислорода распределились между молекулами углекислого газа и воды. Число атомов не изменилось.
Согласно закону сохранения массы, общая масса реагентов всегда равна общей массе продуктов реакции. Именно поэтому запись химической реакции называют уравнением.
Чтобы составить уравнение химической реакции, важно правильно подобрать коэффициенты перед формулами веществ.
Коэффициент в химических уравнениях означает число молекул (формульных единиц) вещества, необходимое для реакции. Он обозначается числом перед формулой (например, 2NaCl в последнем примере).
Коэффициент не следует путать с индексом (числом под
символом химического элемента, например, О₂). Индекс обозначает
количество атомов этого элемента в молекуле (формульной единице).
ХИМИЧЕСКИЕ СВОЙСТВА НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Кислотные оксиды
SO3 + H2O = H2SO4
Cl2O7 + H2O = 2HClO4
SO2 + 2NaOH = Na2SO3 + H2O
P2O5 + 6KOH = 2K3PO4 + 3H2O
CO2 + BaO = BaCO3
SiO2 + K2O = K2SiO3
Основные оксиды
CaO + H2O = Ca(OH)2
Na2O + H2O = 2NaOH
CuO + 2HCl = CuCl2 + H2O
3K2O + 2H3PO4 = 2K3PO4 + 3H2O
MgO + CO2 = MgCO3
Амфотерные оксиды
Al2O3 + 6HCl = 2AlCl3 + 3H2O
ZnO + H2SO4 = ZnSO4 + H2O
ZnO + 2KOH = K2ZnO2 + H2O
(Правильнее: ZnO + 2KOH + H2O = K2[Zn(OH)4])
Al2O3 + 2NaOH = 2NaAlO2 + H2O
(Правильнее: Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4])
ZnO + CO2 = ZnCO3
ZnO + Na2O = Na2ZnO2
Al2O3 + K2O = 2KAlO2
Cr2O3 + CaO = Ca(CrO2)2
Кислоты
2HNO3 + CuO = Cu(NO3)2 + H2O
3H2SO4 + Fe2O3 = Fe2(SO4)3 + 3H2O
3H2SO4 + Cr2O3 = Cr2(SO4)3 + 3H2O
2HBr + ZnO = ZnBr2 + H2O
H2SiO3 + 2KOH = K2SiO3 + 2H2O
2HBr + Ni(OH)2 = NiBr2 + 2H2O
3HCl + Cr(OH)3 = CrCl3 + 3H2O
2HNO3 + Zn(OH)2 = Zn(NO3)2 + 2H2O
2HBr + CaCO3 = CaBr2 + H2O + CO2
H2S + K2SiO3 = K2S + H2SiO3
2HCl + Zn = ZnCl2 + H2
H2SO4 (разб.) + Fe = FeSO4 + H2
Важно: кислоты-окислители (HNO3, конц. H2SO4) реагируют с металлами по-другому.
Амфотерные гидроксиды
2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O
Be(OH)2 + 2HCl = BeCl2 + 2H2O
Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O
Al(OH)3 + NaOH = NaAlO2 + 2H2O
Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]
Sn(OH)2 + 2NaOH = Na2[Sn(OH)4]
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Al(OH)3 + NaOH = Na[Al(OH)4]
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
Щелочи
Ba(OH)2 + N2O5 = Ba(NO3)2 + H2O
2NaOH + CO2 = Na2СO3 + H2O
3KOH + H3PO4 = K3PO4 + 3H2O
Bа(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O
2NaOH + ZnO = Na2ZnO2 + H2O (Правильнее: 2NaOH + ZnO + H2O = Na2[Zn(OH)4])
2NaOH + Zn(OH)2 = Na2[Zn(OH)4]
NaOH + Al(OH)3 = Na[Al(OH)4]
Ca(OH)2 + Cu(NO3)2 = Cu(OH)2 + Ca(NO3)2
3KOH + FeCl3 = Fe(OH)3 + 3KCl
2NaOH + Zn + 2H2O = Na2[Zn(OH)4] + H2
2KOH + 2Al + 6H2O = 2K[Al(OH)4] + 3H2
Соли
Na2SiO3 + 2HNO3 = 2NaNO3 + H2SiO3
BaCO3 + 2HCl = BaCl2 + H2O + CO2 (H2CO3)
Pb(NO3)2 + K2S = PbS + 2KNO3СaCl2 + Na2CO3 = CaCO3 + 2NaCl
Cu(NO3)2 + 2NaOH = 2NaNO3 + Cu(OH)2
2FeCl3 + 3Ba(OH)2 = 3BaCl2 + 2Fe(OH)3
Zn + CuSO4 = ZnSO4 + Cu
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
Важно: 1) металл (**) должен находиться в ряду напряжений левее металла (*), 2) металл (**) НЕ должен реагировать с водой.
Образец выполнения задания 1
1) Напишите уравнения реакций, характеризующие химические свойства BeO и HClO4.
BeO – амфотерный оксид, не растворяется в воде, взаимодействует с кислотами и щелочами, а также при сплавлении с основными и твердыми кислотными оксидами:
BeO + 2HCl → BeCl2 + H2O
BeO + 2 NaOH+ H2O → Na2[Be(OH)4]
BeO
+ CaO![]() CaBeO2
CaBeO2
BeO
+ SiO2![]() BeSiO3
BeSiO3
2) HClO4 – хлорная кислота проявляет общие химические свойства кислот, т.е. изменяет окраску индикаторов, взаимодействует с основаниями, основными оксидами, амфотерными оксидами и гидроксидами, солями, металлами:
2 HClO4 + Ca(OH)2 → Ca(ClO4)2 + 2 H2O
2 HClO4 + CaO→ Ca(ClO4)2 + H2O
2 HClO4 + ZnO → Zn(ClO4)2 + H2O
2 HClO4 + Zn(OH)2 → Zn(ClO4)2 + 2 H2O
2 HClO4 + CaCO3 → Ca(ClO4)2 + H2O + CO2↑
2 HClO4 + Zn → Zn(ClO4)2 + H2↑
Образец выполнения задания 2
Запишите молекулярные, полные ионные и сокращенные уравнения реакций.
В молекулярной форме: 2NaCl + Pb(NO3)2 = PbCl2↓ + 2NaNO3
в полной ионной форме — с указанием всех существующих в растворе ионов: 2Na+ + 2Cl− + Pb2+ + 2NO3− = PbCl2↓ + 2Na+ + 2NO3−
в сокращенной ионной форме, которая, собственно, и выражает взаимодействие ионов: Pb2+ + 2Cl− = PbCl2↓.
Образец выполнения задания 3
Определите,
какая масса меди вступит в реакцию с концентрированной серной кислотой для
получения оксида серы (IV) объёмом 3л (н.у.), если выход оксида серы (IV)
составляет 90%.
|
Дано: Vпр(SO2) = 3 л Wпр(SO2) = 90% |
Решение:
Ответ: m(Cu) = 9,52 г |
|
Найти: m(Cu) - ? |
Практическая часть
Вариант 1
Задание 1. Написать уравнения реакций, характеризующие химические свойства предложенных веществ. CaO, HNO3.
Задание 2. Привести молекулярные и ионные уравнения тех реакций, которые возможны в растворе.
NaOH + CaCO3 →
CaSO4 + SrCl2 →
(CuOH)2SO4 + HCl →
Cu(NO3)2 + H2S →
CuCl2 + AgNO3 →
Задание 3. Решить задачу.
При взаимодействии цинка с соляной кислотой образовался газ объемом 33,6 л. Определить массу цинка, вступившую в реакцию.
Вариант 2
Задание 1. Написать уравнения реакций, характеризующие химические свойства предложенных веществ. CO2, Ba(OH)2.
Задание 2. Привести молекулярные и ионные уравнения тех реакций, которые возможны в растворе.
Cu(OH)2 + Na2SO4 →
Na2SO4 + BaCl2 →
Fe(OH)3 + H2SO4 →
Al(OH)3 + NaOH →
Pb(NO3)2 + H2S →
Задание 3. Решить задачу.
Сколько грамм оксида магния образуется при сжигании магния массой 12 г.
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы;
- задание;
- вывод.
4. Вопросы по теме практического занятия:
4.1. Привести примеры получения оксидов.
4.2. Объяснить, какими химическими свойствами обладают основные оксиды.
4.3. Привести примеры получения оснований.
4.4. Перечислить основные химические свойства солей.
4.5. Записать способы получения солей
Практическое занятие №11 «Решение практико-ориентированных теоретических заданий на свойства, состав, получение и безопасное использование важнейших неорганических веществ в быту и практической деятельности человека».
Цель: Повторение свойств, состава, способов получения и безопасного использования важнейших неорганических веществ в быту и практической деятельности человека.
Методическое и материально-техническое обеспечение:
Работа по группам.
Каждой группе выдается карточка с названием вещества и карточка для ответов. В течении 7 минут каждая команда должна подготовить рассказ об этом веществе (без называния самого вещества, и однокоренных слов). Далее по очереди один из членов команды рассказывает о веществе, чтобы другие команды догадались что это и написали в свою карточку для ответов.
Какая команда наберет больше всего правильных ответов – победит.
План ответа про вещество:
1. Агрегатное состояние при н.у.
2. Цвет, запах, вкус?
3. Химические свойства
4. Применение в промышленности, в быту, в производстве.
Примеры веществ, которые могут быть в карточке:
1. Гашеная известь
2. Фосфорная кислота
3. Фосфор белый
4. Хлор
5. Сода питьевая
6. Медный купорос
7. Гидроксид натрия (щелочь)
8. Поваренная соль
Практическое занятие №12 «Решение практико-ориентированных заданий о роли неорганической химии»
Цели: отработать навыки поиска и анализа необходимой информации о роли неорганических веществ, используемых в будущей профессии (специальности) в различных источниках (печатные издания, сеть интернет)
Заполнить таблицу
|
п/№ |
Название вещества |
Формула |
Физические свойства |
Значение в профессии (специальности) |
|
|
|
|
|
|
|
|
|
|
|
|
Пример:
|
п/№ |
Название вещества |
Формула |
Физические свойства |
Значение (применение) в профессии (специальности) |
|
1 |
Сульфит натрия |
Na2SO3 |
Белое кристаллическое вещество, растворимое в воде. |
Применяется в производстве препаратов для химической завивки, в парикмахерских используется для термической перманентной завивки. |
|
2 |
Бикарбонат аммония (гидрокарбонат аммония) |
(NH4)HCO3 |
Белый кристаллический порошок, растворимый в воде. |
Применяется в косметике для производства красителей, в парикмахерских используется как активизирующее вещество перекиси водорода для осветления волос |
|
3 |
Бура (тетраборат натрия) |
Na2B4O7 |
Белый порошок, растворимый в воде и глицерине. |
Применяется для смягчения воды, в косметике используется в качестве эмульгатора |
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ№ 13 «Решение упражнений на составление названий отдельных классов органических соединений».
Цель: приобрести навыки написания структурных формул изомеров и гомологов.
Методическое и материально-техническое обеспечение:
Ход работы:
Теоретическая часть
Для названия органических соединений используется две номенклатуры: рациональная и современная – систематическая, которую называют также международной или научной (предложена Международным союзом теоретической и прикладной химии IUPAK в 1957, 1965 гг.). Она имеет много общего с женевской номенклатурой, часто встречающейся в химической литературе.
По систематической номенклатуре первые четыре представителя ряда насыщенных углеводородов называются: метан, этан, пропан, бутан. Названия последующих углеводородов образуются из основы греческих числительных и окончания –ан, например С6Н14 – гексан и т.п.
Углеводородными радикалами называются заряженные частицы, полученные при отнятии от молекул предельных углеводородов атомов водорода. Названия однозарядных радикалов производят от названий соответствующих углеводородов, в которых окончание –ан заменяют на –ил.
Гомологический ряд предельных углеводородов и их радикалы
|
углеводород |
радикал |
углеводород |
радикал |
|
Метан СН4 |
Метил СН3- |
Гексан С6Н14 |
Гексил С6Н13- |
|
Этан С2Н6 |
Этил С2Н5- |
Гептан С7Н16 |
Гептил С7Н15- |
|
Пропан С3Н8 |
Пропил С3Н7- |
Октан С8Н18 |
Октил С8Н17- |
|
Бутан С4Н10 |
Бутил С4Н9- |
Нонан С9Н20 |
Нонил С9Н19- |
|
Пентан С5Н12 |
Пентил С5Н11- |
Декан С10Н22 |
Декил С10Н21- |
Общее название предельных углеводородов – алканы, непредельные углеводороды – алкены, алкины, алкадиены.
Названия сложных углеводородов с разветвленной цепью производятся по следующей схеме:
|
Так, соединение 1 |
2 |
3 |
4 |
5 |
6 |
|
|
СН3 – СН – СН – СН2 – СН – СН3 |
||||||
|
| |
| |
| |
||||
|
СН3 |
СН3 |
С2Н5 |
||||
|
называется 2,3-диметил-5-этилгексан. |
||||||
Практическая часть
Вариант 1
Задание 1. Составить формулы:
2,2-дихлорпентан 2-метил-3,3-диэтилгептан
3-метил-4-этилоктан 3,3-диметилпентан
Задание 2. Привести названия алканов:
1) СН3-СН-СН-СН3 2) СН3-СН2-СН2-СН3
| |
СН3 СН3
Задание 3. Привести названия алкенов:
1) СН2=СН-СН3 2) СН3-СН=СН-СН2-СН3
Задание 4. Привести названия алкинов:
1) СН≡С-СН2-СН2-СН2 - СН3 2) СН3-СН2-С≡СН
Задание 5. Привести названия алкадиенов:
1) СН2=С=С- СН3 2) СН3-СН2-СН=С=СН2
|
СН3
Вариант 2
Задание 1. Составить формулы:
2,3-диметилпентан 1-хлор-2-метилбутан
2,2,4,4-тетраметилпентан 2,4-диметил-3-этилпентан
Задание 2. Привести названия алканов:
1) СН3-СН-СН-СН2- СН3 2) СН3- СН2-СН3
| |
СН3 СН3
Задание 3. Привести названия алкенов:
1) СН2=СН-СН2-СН3 2) СН3-СН2-СН=СН-СН2-СН3
Задание 4. Привести названия алкинов:
1) СН≡С-СН-СН2 -СН3 2) СН3-СН2-С≡С-СН3
|
СН3
Задание 5. Привести названия алкадиенов:
1)СН2=С=С -СН2-СН3 2)СН3-СН2-СН=С=СН-СН3
|
СН3
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы;
- задание;
- вывод.
4. Вопросы по теме практического занятия:
4.1. Дополнить фразу: «Молекула представляет собой группировку атомов элементов, располагающих в строго определенном порядке, согласно правилам валентности» - отражает суть (выберите ответ):
4.2. Дополнить фразу: «Вещества, имеющие одну и ту же эмпирическую формулу (обладающие одинаковым количественным и качественным составом), но разный порядок расположения атомов в молекуле, т.е. разное строение, а потому, и различные свойства, называются…» (выберите ответ):
4.3. Дополнить фразу: «Формулы СН3-(СН 2) 2 -СН 3 и СН3 -СН(СН3)-СН3 отражают строение» (выберите ответ):
Практическое занятие №13 «Решение упражнений на составление структурных формул отдельных классов органических соединений»
Цели: научиться составлять структурные формулы органических веществ по названию
Алгоритм составления формул органических соединений по названию:
Некоторые шаги, которые предшествуют составлению формулы:

При составлении формул по названию надо:
1. Определить число атомов углерода в цепочке.
2. Определить положение кратной связи. (Цифра после названия).
3. Определить положение радикалов. (Цифра перед названием).
4. Записать формулы радикалов.
5. В последнюю очередь определить количество и расставить атомы водорода.
Задание:
Построить структурные формулы органических соединений
1) бутадиен – 1,3; 2) 2,3 – диметилгексадиен-1,4;
3) 4 - метилпентин -2; 4) 3,4,5 – трихлоргексин-1;
5) 1,4-дихлор-2-метилгексан; 6) 2,4,4 – триметилгексадиен-1,5;
7) 3,3- диметилбутин -1; 8) 3,4,5 – трибромпентин-1;
9) 2,4-диметилпентен-2; 10) 3-метил-4-этилгептан;
11) 3,3-диметилбутен-1; 12) изопрен; 13) бензол; 14) дивинил; 15) толуол;
16) ацетилен; 17) пропилен; 18) 2-метил-3-этилгептан;
19) 2,3-диметилпентадиен-1,2; 20) метилциклопентан
Практическое занятие № 12 «Составление уравнений химических реакций с участием органических веществ».
Учебная цель: изучить свойства органических соединений отдельных классов.
Учебные задачи:
1.Научиться составлять уравнения химических реакций с участием органических веществ на основании их состава и строения.
Задачи практического занятия:
1. Повторить теоретический материал по теме практического занятия.
2. Ответить на вопросы для закрепления теоретического материала.
3. Выполнить задания по теме.
4. Оформить отчет.
Обеспеченность занятия (средства обучения):
1. Сборник методических указаний для студентов по выполнению практических занятий по учебной дисциплине «Химия».
2. Таблица «Периодическая система химических элементов Д.И. Менделеева».
3. Тетрадь для практических занятий в клетку.
4. Карточки – задания.
5. Калькулятор.
6. Ручка.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Свойства органических соединений отдельных классов.
Алканы – это предельные углеводороды, в молекулах которых все атомы углерода связаны одинарными связями и соответствуют общей формуле СnH2n+2.
Физические и химические свойства алканов.
Алканы состава С1−С4 при комнатной температуре – газы, следующие 12 соединений – жидкости, а начиная с гептадекана С17Н36 – твёрдые вещества. Алканы – неполярные соединения, поэтому они практически не растворимы в воде, но хорошо растворимы в неполярных растворителях. В молекулах алканов все четыре валентности атома углерода задействованы на образование одинарных σ-связей с четырьмя соседними атомами. Связи С–С и С–Н достаточно прочны, поэтому реакционная способность этих соединений низкая. Основным механизмом реакций с участием алканов является радикальное замещение. Эти процессы требуют достаточно большой затраты энергии и поэтому протекают только в присутствии катализаторов или при высоких температурах, либо при интенсивном освещении. Радикальное фотохимическое хлорирование и бромирование – характерные реакции алканов. Хлорирование. В процессе взаимодействия метана с хлором на свету происходит последовательное замещение атомов водорода с образованием смеси хлорпроизводных метана.
СН4 + Cl2 → CH3Cl + HCl;
CH3Cl + Cl2 → CH2Cl2 + HCl;
CH2Cl2+ Cl2 → CHCl3 + HCl;
CHCl3 + Cl2 → CCl4 + HCl.
Схема механизма цепного радикального хлорирования метана.
I стадия: гомолитический разрыв связи; инициирование цепи
![]()
II стадия: рост цепи
![]()
III стадия: рекомбинация радикалов − обрыв цепи
![]()
Нитрование. Нитрование алканов – реакция замещения атома водорода на нитрогруппу – осуществляется действием азотной кислоты в газовой фазе при 4000С. Реакция протекает по радикальному механизму. СН4 + HNO3 → CH3NO2 + H2O Дегидрирование. Алканы отщепляют водород при нагревании до 400- 6000С в присутствии катализаторов: Ni, Pt, Pd, Cr2O3 − при этом образуются алкены. СН3−СН2−СН3 → СН2=СН−СН3 + Н2
При дегидрировании алканов, содержащих больше пяти атомов углерода, образуются циклоалканы.
Окисление. В присутствии избытка кислорода алканы полностью сгорают до воды и углекислого газа. СН4 + 2 О2 → СО2 + 2Н2О При проведении окисления в присутствии катализаторов возможно получение из алканов карбоновых кислот, кетонов и спиртов.
Нагревание алканов при температуре 500-7000С приводит к разрыву связей С-С, в результате чего образуются предельные и непредельные углеводороды с меньшим числом атомов углерода. Этот процесс называется термическим крекингом.
СН3−СН2−СН2−СН3 → СН3− СН3 + СН2=СН2
Проведение крекинга в присутствии катализаторов – смеси оксидов алюминия и кремния – вызывает образование разветвлённых изомерных алканов. Это процесс каталитического крекинга. Нагревание неразветвлённых алканов при повышенном давлении (4-5 атм) в присутствии катализатора платины приводит к образованию ароматических углеводородов. Этот процесс называется риформингом.
Получение и применение алканов.
Алканы получают фракционной перегонкой сырой нефти. Поэтому лабораторные методы синтеза немногочисленны и мало используются на практике. Реакция Вюрца позволяет синтезировать алканы с чётным числом атомов углерода (удвоение углеродного скелета). По реакции Гриньяра получают углеводороды как с чётным, так и с нечётным числом атомов углерода. Декарбоксилированием солей карбоновых кислот при их сплавлении со щелочами синтезируют углеводороды с меньшим на один числом атомов углерода, чем было в составе кислоты. В процессе электролиза растворов солей карбоновых кислот (синтез Кольбе) на аноде образуются углеводороды. Алканы используются в быту и на производстве как горючее: природный газ – в газовых горелках, бензин, керосин и газойль – автомобильное и авиационное топливо, мазут – на тепловых электростанциях. Алканы – сырьё для синтеза разнообразных органических веществ: алкенов, алкинов, спиртов, альдегидов, кетонов, кислот. Они хорошие растворители для малополярных веществ.
Физические и химические свойства алкенов.
Алкены не растворимы в воде, но хорошо растворимы в неполярных растворителях: бензоле, эфирах, хлороформе. Плотность их меньше воды. Температуры кипения повышаются с увеличением длины цепи и очень близки к температурам кипения алканов.
Наличие двойной связи обеспечивает участие алкенов в реакциях электрофильного присоединения. К молекулам алкенов могут присоединяться молекулы водорода, галогенов, галогеноводородов, воды. В этих реакциях двойная связь С=C превращается в одинарную С – С, образуется насыщенное соединение. Механизм реакции электрофильного присоединения рассмотрен на примере реакции галогенирования этилена. Присоединение молекулы галогена происходит легко в обычных условиях, особенно в среде полярных растворителей. Обесцвечивание бромной воды – качественная реакция на наличие кратных связей в органических соединениях.
Присоединение галогеноводородов к несимметричным алкенам протекает через образование наиболее устойчивого карбокатиона: атом водорода присоединяется к более гидрогенизированному атому углерода (правило Марковникова).
Аналогично происходит гидратация алкенов – присоединение молекулы воды.
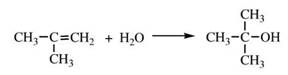
Гидрирование – присоединение водорода – протекает в присутствии катализаторов – никеля, платины, палладия. Реакция не требует высоких температур и давлений.
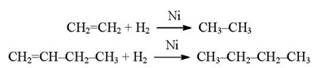
Окисление алкенов, в отличие от алканов, протекает легко. Реакция протекает под действием водного раствора перманганата калия. Состав продуктов зависит от характера среды, в которой проводится окисление. Мягкое окисление протекает в нейтральной среде (реакция Вагнера).
3H2C=CH2+ 2 KMnO4 + 4H2O → 3 HOCH2−CH2OH + 2 MnO2 + 2 KOH
Жёсткое окисление проводится кислыми растворами KMnO4или K2Cr2O7 при нагревании.
5H2C=CH2 + 8KMnO4 + 12H2SO4 → 10НСООН + 8MnSO4 + 2K2SO4 + 12H2O
При пропускании алкенов через раствор перманганата калия наблюдается исчезновение малиновой окраски KMnO4.
Алкены горят на воздухе светящимся пламенем.
С2Н4 + 3О2 → 2 СО2 + 2 Н2О
Реакции полимеризации с участием алкенов могут протекать по радикальному или ионному механизмам и лежат в основе промышленного синтеза полимеров. В общем виде схему полимеризации полиэтилена можно представить так:
![]()
Получение и применение алкенов.
В промышленности алкены получают путём каталитического дегидрирования алканов и термическим крекингом нефтепродуктов. В лаборатории алкены получают дегидратацией спиртов, проводя её нагреванием в присутствии серной кислоты.
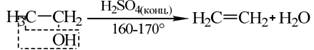
Действием спиртового раствора щёлочи, цинковой пыли на галогенопроизводные алканов также можно получить алкены.
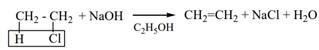
Дегидратация и дегидрогалогенирование спиртов осуществляется по правилу Зайцева: атом водорода отщепляется преимущественно от менее гидрогенизированного атома углерода.
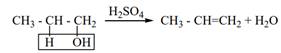
Наиболее широкое применение в промышленном органическом синтезе находят первые представители гомологического ряда алкенов – этилен, пропилен и бутилен, которые получают при крекинге нефти. Они служат исходным сырьём для получения спиртов, хлорзамещённых углеводородов, альдегидов, кетонов, карбоновых кислот. Полиэтилен, полипропилен, полистирол – полимеры – многотоннажные продукты, полученные полимеризацией алкенов.
Физические и химические свойства алкинов.
Наличие тройной связи в молекулах алкинов определяет их склонность к реакциям присоединения. Однако, в отличие от алкенов, могут протекать и реакции замещения «кислого» атома водорода. Присоединение по тройной связи. Водород, хлор и бром присоединяются к алкинам в две стадии. НС≡СН + Н2 → Н2С=СН2; Н2С=СН2 + Н2→ Н3С – СН3 Катализаторами для процесса гидрирования служа т никель, платина и палладий.
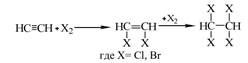
Галогенводороды присоединяются к алкинам с образованием галогеналкенов, а затем дигалогеналканов. Присоединение к несимметричным алкинам идет по правилу Марковникова.
![]()
Ацетилен взаимодействует с водой в присутствии солей ртути, образуя ацетальдегид (реакция Кучерова).
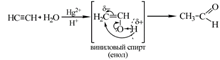
Молекулы алкинов могут реагировать друг с другом, образуя димеры и тримеры.
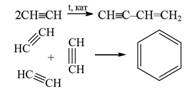
Реакции замещения. Атом водорода в молекуле ацетилена обладает «кислыми» свойствами, так как электронная плотность по связи С–Н сильно смещена к атому углерода. Это обусловлено высоким значением электроотрицательности sp-гибридного атома углерода. «Кислый» атом водорода способен замещаться на металл под действием солей ртути, меди, серебра, а также металлического натрия.
НС≡СН + 2 [Ag(NH3)2]OH → Ag – C≡C – Ag ↓ + 4 NH3 + 2 H2O
CH3 – C≡CH + [Cu(NH3)2]OH → CH3 – C≡C – Cu↓ + 2 NH3 + H2O
Образующиеся ацетилениды неустойчивые вещества, разлагающиеся со взрывом.
Реакции окисления с участием алкинов протекают труднее, чем с алкенами. Обесцвечивание раствора перманганата калия под действием алкинов можно рассматривать как качественную реакцию на тройную связь.
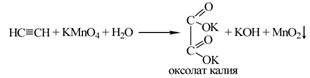
Алкины горят коптящим пламенем на воздухе, в присутствии кислорода происходит полное сгорание до углекислого газа и воды, яркость пламени исчезает. Температура пламени при этом достигает 28000С. 2 С2Н2 + 5 О2 = 4 СО2 + 2 Н2О.
Получение и применение алкинов.
В промышленности и в лаборатории ацетилен получают обработкой карбида кальция водой.
![]()
Другим промышленным способом является пиролиз метана, проводимый при температуре около 15000С. 2СН4 → СН≡СН + 3Н2
В лаборатории алкины получают действием спиртового раствора щелочи при нагревании на дигалогеналканы.
СН3–СНBr–СН2Br + 2 KOH → СН3−С≡СН + 2 KBr + 2 H2O СН3–СBr2 –СН3 + 2 KOH → СН3−С≡СН + 2 KBr + 2 H2O
Ацетилен применяется для сварки и резки металлов. А также служит исходным сырьем для синтеза различных органических соединений: уксусного альдегида, уксусной кислоты, винилацетата, изопрена, акрилонитрила.
Физические свойства бензола и его гомологов.
Бензол представляет собой бесцветную жидкость с характерным запахом, не растворимую в воде, Т кип.= 800С, Т пл.= 50С. Бензол ядовит. Гомологи бензола представляют собой также бесцветные, сильно преломляющие свет жидкости. Они нерастворимы в воде, но хорошо растворимы в органических растворителях. При этом сами являются растворителями для многих веществ. Легко воспламеняются и горят ярким, сильно коптящим пламенем. С воздухом образуют взрывоопасные смеси.
Химические свойства аренов.
Химические свойства ароматических соединений определяются наличием электронной π-системы, которая делает молекулу стабильной. Поэтому бензол и его гомологи, в отличие от ненасыщенных соединений, почти не участвуют в реакциях присоединения, а характерным для них типом реакций является электрофильное замещение атомов водорода в бензольном кольце. Реакции этого типа подчиняются общему уравнению:
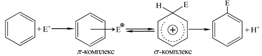
На первой стадии реакции в качестве промежуточного продукта образуется донорно-акцепторный π-комплекс, в котором ароматическая система бензольного кольца сохраняется. На второй стадии π-комплекс превращается в σ-комплекс, который стабилизируется, превращаясь в ароматическую систему, в результате отщепления протона. Чаще всего стадией, определяющей скорость реакции, является образование σ-комплекса. Наиболее важными реакциями электрофильного замещения являются галогенирование, нитрование, сульфирование, алкилирование и ацилирование. Галогенирование (хлорирование, бромирование) осуществляется в присутствии катализатора, вызывающего поляризацию молекулы галогена с образованием электрофильной частицы, атакующей бензольную π-систему. Наиболее распространённым является случай акцептирования аниона, когда поляризация осуществляется действием галогенидов координационно ненасыщенных (имеющих пустые квантовые ячейки) элементов – обычно FeCl3, FeBr3, AlCl3.
![]()
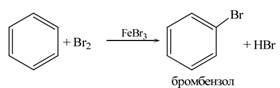
Нитрование бензола проводят смесью концентрированных серной и азотной кислот (нитрующей смесью). В смеси кислот устанавливается равновесие:
HNO3 + 2H2SO4 → NO2 + + H3O+ + HSO4 – . В качестве нитрующего агента выступает частица NO2 + .
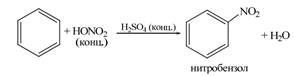
Образующийся нитробензол – тяжёлая желтоватая жидкость с запахом горького миндаля. Сульфирование бензола осуществляется нагреванием с концентрированной серной кислотой (лучше «дымящей», олеумом). Установлено, что сульфирующей частицей является SO3. Данная реакция обратима.
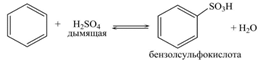
Замещение атома водорода на алкильную или ацильную группу протекает в присутствии тех же катализаторов, что и галогенирование (FeCl3, FeBr3, AlCl3). Эти процессы носят названия алкилирования и ацилирования по Фриделю-Крафтсу. В качестве алкилирующих агентов используются алкилгалогениды, а в качестве ацилирующих – галогенангидриды и ангидриды карбоновых кислот. В обоих случаях в присутствии кислот Льюиса образуются карбкатионы, играющие роль электрофила в реакциях замещения. С2Н5Cl + AlCl3 → C2H5 + + AlCl4
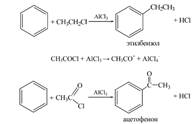
Действие галогенов на толуол в присутствии катализаторов FeCl3, FeBr3, AlCl3 приводит к более лёгкому, по сравнению с бензолом, замещению атомов водорода в кольце в орто- и пара-положения.
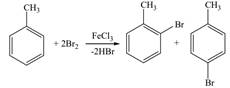
Электрофильное замещение в молекуле нитробензола, соединения, содержащего заместитель второго рода, протекает медленнее, чем для бензола, при этом замещается атом водорода в мета-положении относительно нитрогруппы.
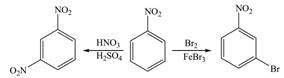
Свободнорадикальное замещение в боковой цепи. При действии на гомологи бензола галогенов на свету или при нагревании (без добавления катализаторов FeCl3, FeBr3, AlCl3) происходит реакция замещения водорода при α-атоме углерода боковой цепи.
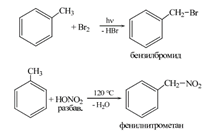
Реакции присоединения. Присоединение водорода к молекуле бензола (гидрирование) осуществляется в присутствии катализатора (Ni, Pd) при повышенной температуре и давлении. Причём присоединение первой молекулы водорода требует наибольших энергозатрат, так как связано с нарушением ароматичности. Последующее присоединение протекает легче.
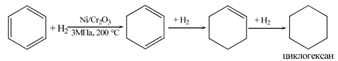
Присоединение хлора осуществляется под действием ультрафиолетового облучения или на ярком свету. Образуется гексахлорциклогексан.
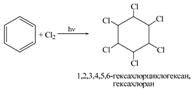
Реакции окисления. Бензол устойчив к действию водных растворов KMnO4 и K2Cr2O7. У гомологов бензола боковая цепь окисляется до карбоксильной группы, независимо от длины этой цепи образуется бензойная кислота.
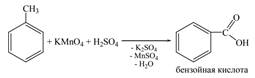
Получение и применение ароматических углеводородов.
Коксование каменного угля. Этот процесс исторически был первым и служил основным источником бензола до Второй мировой войны. В настоящее время доля бензола, получаемого этим способом, менее 1 %. Каталитический риформинг бензиновых фракций нефти. Этот процесс является основным источником бензола в США. В Западной Европе, России и Японии этим способом получают 40-60 % от общего количества. В процессе кроме бензола образуются толуол и ксилолы. Ввиду того, что толуол образуется в количествах, превышающих спрос на него, он также частично перерабатывается в бензол или смесь бензола и ксилолов. Пиролиз бензиновых и более тяжёлых нефтяных фракций. До 50 % бензола производится этим методом. Наряду с бензолом образуются толуол и ксилолы. В некоторых случаях всю эту фракцию направляют на стадию деалкилирования, где и толуол и ксилолы превращаются в бензол. Ещё один способ получения бензола открыл русский химик-органик Николай Дмитриевич Зелинский. При пропускании ацетилена над раскалённым до 600–650 °С активированным углём происходит его тримеризация и образуется бензол. Этот процесс получил название реакции Зелинского.
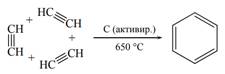
Бензол широко применяется в промышленном органическом синтезе стирола, кумола, фенола, анилина, фталевых кислот. Он служит исходным сырьём для производства красок, лекарств, взрывчатых веществ, пестицидов и т.д. Его применяют как растворитель и добавку к моторному топливу. Толуол используют в основном как растворитель и как исходное вещество в синтезе 2,4,6-тринитротолуола (тротила).
Физические свойства спиртов.
Низшие спирты представляют собой жидкости с характерным запахом и обжигающим вкусом, высшие спирты – твёрдые вещества без запаха. Наличие межмолекулярных водородных связей, образующихся между гидроксильными группами разных молекул, обусловливает высокие температуры кипения низших спиртов по сравнению с другими соединениями близкой молекулярной массы, а также превосходную растворимость низших спиртов в воде.
 Низшие спирты смешиваются с водой в
любых соотношениях. С увеличением углеводородного радикала, имеющего
гидрофобную природу, растворимость спиртов в воде уменьшается, приближаясь к
значениям соответствующих углеводородов, которые в воде практически не
растворимы. Многоатомные спирты прекрасно растворимы в воде.
Низшие спирты смешиваются с водой в
любых соотношениях. С увеличением углеводородного радикала, имеющего
гидрофобную природу, растворимость спиртов в воде уменьшается, приближаясь к
значениям соответствующих углеводородов, которые в воде практически не
растворимы. Многоатомные спирты прекрасно растворимы в воде.
Химические свойства спиртов.
Спирты имеют четыре реакционных центра: 1 - довольно полярную, протонизованную связь О-Н, на которой происходят многие реакции, аналогичные реакциям Н2О; 2 - слабополярную связь С-О, на которой проходят реакции замещения О-Н группы; 3 - связи С-Н в алкильной группе, которые могут подвергаться окислению или дегидрированию; 4 - неподелённые электронные пары атома кислорода, способные вступать в донорно-акцепторное взаимодействие с кислотами и солями металлов. Кислотно-основные свойства. Одноатомные спирты – нейтральные вещества. В их присутствии содержание ионов водорода в воде практически не изменяется. Путем взаимодействия спиртов со щелочами приготовить растворы алкоксидов щелочных металлов заметной концентрации не удаётся. Поэтому последние получают реакцией спиртов со щелочными металлами. Как слабые О-Н-кислоты, спирты также реагируют со щелочноземельными металлами, алюминием, галлием и таллием с образованием ионных и ковалентных алкоголятов.
2 C2H5OH + 2 Na→ 2 C2H5ONa + H2
6(СН3)2СНОН + 2 Al → 2 [(СН3)2СНО]3Al + 3 H2
В присутствии следов влаги алкоголяты легко гидролизуются как соли очень слабых кислот:
![]()
Многоатомные спирты обладают большей кислотностью по сравнению с одноатомными, а по свойствам в значительной степени напоминают одноатомные, причём в реакции могут вступать одна или несколько гидроксильных групп. Многоатомные спирты образуют с гидроксидами некоторых тяжёлых металлов в щелочной среде хелатные соединения, имеющие характерное окрашивание. Данные реакции могут быть использованы как качественные.
По аналогии с водой спирты, как основания (более сильные, чем вода из-за влияния алкильного заместителя), в присутствии сильных Н-кислот образуют ониевые соли.
Замещение гидроксильной группы. Важной реакцией спиртов является замещение ОН-группы на галоген. Существует большое число методов осуществления данной реакции, которые отличаются стереоселективностью и выходом основного продукта. В качестве примера можно привести реакцию получения алкилгалогенидов из спирта и галогеноводородов.
ROH + HHal → RHal + H2O
Реакционная способность галогенводородов уменьшается в ряду HI>HBr>HCl>>HF. Скорость реакции с HF слишком мала для прямого превращения спиртов в алкилфториды. Скорость реакции замещения резко снижается в ряду третичный>вторичный>первичный спирт. Как и в случае алканолов, гидроксогруппы многоатомных спиртов могут быть замещены.
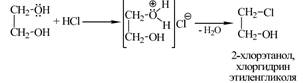
Взаимодействие с кислотами. Спирты, как одноатомные, так и многоатомные, образуют с кислотами сложные эфиры. Данная реакция получила название этерификации. С карбоновыми кислотами реакция этерификации протекает по уравнению:
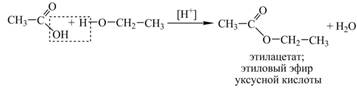
С неорганическими кислородсодержащими кислотами (азотной, серной, фосфорной и др.) взаимодействие протекает аналогично:
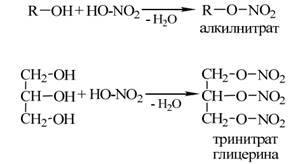
Эфиры азотной кислоты легко взрываются, особенно эфиры многоатомных спиртов, в частности, тринитроглицерин. Дегидратация спиртов. Дегидратация спиртов происходит при нагревании с концентрированной серной или фосфорной кислотой
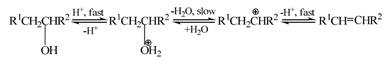
Первичные спирты при взаимодействии с серной кислотой легко образуют полуэфиры серной кислоты, поэтому элиминирование (отщепление) протекает в две стадии.
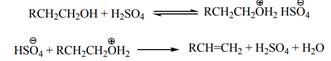
Реакции в данных условиях протекают при температурах 170–190 °С, в более мягких условиях при 130–140 °С преимущественно получаются простые эфиры.
![]()
Для внутри- и межмолекулярной дегидратации спиртов, особенно в промышленности, вместо серной кислоты используют безводную окись алюминия. Гетеролитическая каталитическая дегидратация первичных, вторичных и третичных спиртов над окисью алюминия при 350–450°С приводит к образованию алкенов.
![]()
При дегидратации этиленгликоля в зависимости от условий получают различные соединения, среди которых обычно отсутствует этиленоксид – предполагаемый продукт внутримолекулярного отщепления воды. Так нагревание с разбавленной серной кислотой приводит к межмолекулярному отщеплению двух молекул воды и образованию диоксана.
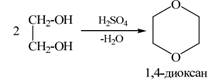
Глицерин при нагревании, отщепляя две молекулы воды, образует простейший α,β-ненасыщенный альдегид – акролеин.
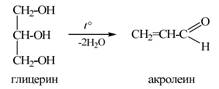
Окисление спиртов. Окисление первичных спиртов в альдегиды и вторичных в кетоны является одним из важнейших превращений функциональных групп и оценкой избирательного действия окислительного агента.
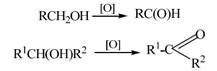
Третичные спирты в обычных условиях не окисляются, а в очень жёстких условиях их окисление сопровождается деструкцией углеродного скелета. Для окисления спиртов наиболее широкое применение нашли реагенты на основе переходных металлов – производные хрома VI, марганца VII и IV. Реакции комплексообразования. Спирты могут координироваться солями металлов, например:
CoSO4(т) + nC2H5OH ↔ [Co(C2H5OH)6] 2+ + SO4 2-(n-6)C2H5OH
В результате образуются этанольные сольватокомплексы.
Получение спиртов.
Метанол получают из природного газа. Смесь метана и водяного пара пропускают над никелевым катализатором при повышенном давлении. Получается синтез-газ (смесь СО и Н2). Синтез-газ пропускают над оксидами хрома, цинка или меди при температуре около 300оС и получают метанол. СН4 + Н2О = СО + 3Н2 СО + 2Н2 = СН3ОН Для получения этилового спирта применяется ферментативное брожение сахарсодержащих продуктов: зерна, картофеля, отходов сахароварения, соков плодовых культур. Для технических целей используют целлюлозу и древесину. Водные смеси сахаристых веществ смешивают с дрожжами, которые сбраживают глюкозу до этилового спирта и углекислого газа.
С6Н12О6 → 2СН3СН2ОН + 2СО2
Большую часть технического этанола получают гидратацией при 250– 300 ºС и давлении 7–8 МПа в присутствии кислоты. Н2С=СН2+ Н2О → СН3СН2ОН
Кислотно-каталитическая гидратация алкенов лежит в основе промышленного способа получения этанола из этилена и пропанола-2 из пропилена. Для получения других спиртов этот метод имеет весьма ограниченную область применения, поскольку гидратация алкенов часто сопровождается изомеризацией углеродного скелета за счёт перегруппировок.
Применение спиртов.
Метанол представляет собой бесцветную, горючую жидкость, смешивающуюся во всех соотношениях с водой и многими органическими растворителями. Метанол ядовит, летальная доза составляет 25 г. Его токсичность связана с происходящим в организме биологическим окислением до фомальдегида. В основном метанол перерабатывается дальше в формальдегид. Кроме того, он служит исходным сырьем в процессах синтеза многочисленных органических соединений, а также используется как растворитель.
Этанол – бесцветная жидкость со своеобразным запахом, неограниченно смешивается с водой и большинством органических растворителей. Этанол используется как растворитель, горючее вещество, дезинфицирующее средство, как исходное вещество для синтеза ацетальдегида, уксусной кислоты, диэтилового эфира, сложных эфиров, а также в пищевой и парфюмерной промышленности и производстве алкогольных напитков. Большие количества этанола обладают токсическим действием, летальная доза чистого спирта равна 300 г. Пропанол-2 или изопропиловый спирт используется как растворитель в производстве косметических и фармацевтических изделий, в производстве ацетона. Этандиол-1,2 или этиленгликоль используют как растворитель, в антифризах и для получения полиэфирных волокон. Пропантриол-1,2,3 или глицерин - бесцветная сиропообразная жидкость со сладковатым вкусом, смешивается с водой и этанолом в любых соотношениях. Глицерин входит в состав антифризов, основ мазей, тормозных жидкостей и пластификаторов. Используется как добавка к мылу, табаку и типографским краскам, в производстве взрывчатых веществ и полиэфиров.
Физические свойства фенола.
Фенол образует бесцветные игольчатые кристаллы, которые на воздухе и свету окрашиваются в красноватый цвет. Имеет своеобразный запах. Фенол плохо растворяется в холодной воде, при 70 ºС смешивается с водой в любых соотношениях. Очень хорошо растворим в этаноле и диэтиловом эфире. С ростом числа гидроксильных групп растворимость фенолов возрастает.
Химические свойства фенола.
Кислотные свойства фенолов выражены сильнее, чем у спиртов или воды, но слабее, чем у карбоновых и угольной кислот. По этой причине фенолы, в отличие от спиртов, могут вступать в реакции с щелочами, образуя соответствующие феноляты металлов, но не вытесняют СО2 из карбоната натрия.
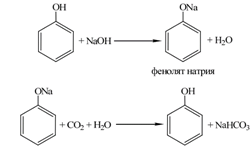
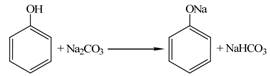
Характерной реакцией для всех фенолов является взаимодействие с хлоридом железа (III) FeCl3. Образующиеся при этом сложные продукты замещения водорода гидроксильной группы, зачастую неустановленной структуры, содержащие в составе комплекса в качестве лигандов исходные фенолы, имеют характерные интенсивные цвета. Так, с фенолом образуется фиолетовое окрашивание.
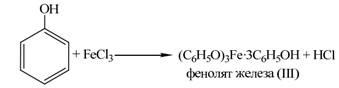
Каждый фенол даёт в подобной реакции свою окраску, например, пирокатехин – изумрудно-зелёную, пирогаллол – красную и т. д. Поэтому данная реакция является аналитической на фенолы. Реакции фенолят-аниона.
В отличие от спиртов фенолы труднее образуют простые и сложные эфиры. Простые эфиры нельзя получить простой межмолекулярной дегидратацией. Их получают из фенолятов, действуя на них алкилгалогенидами или арилгалогенидами.
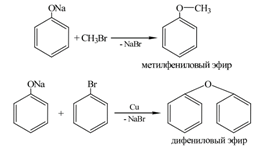
Реакции электрофильного замещения в бензольном кольце. Влияние гидроксогруппы на ароматическое кольцо проявляется в увеличении его реакционной способности по отношению к реакциям электрофильного замещения, которые протекают в более мягких условиях, чем в случае бензола. Например, фенол с бромной водой образует трибромфенол без всяких катализаторов, которые необходимы в подобных реакциях с бензолом.
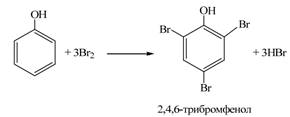
Специфические реакции фенолов. К данным реакциям можно отнести гидрирование фенолов до циклогексанолов. Кроме того, к специфическим относятся реакции замещения фенольного гидроксила на атом водорода при перегонке с цинковой пылью.
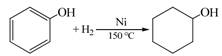
Применение фенолов.
Фенол обладает антисептическими свойствами, его 5% водный раствор под названием карболовой кислоты использовался как дезинфицирующее средство, ещё более сильным эффектом обладают 2- и 4-хлорфенолы. Фенол используют для производства фенолоформальдегидных смол, полиамидов, многочисленных красителей и лекарственных препаратов. Раствор смеси изомерных крезолов в мыльной воде называется лизолом, используется как дезинфицирующая жидкость. Крезолы используют для консервации дерева, в производстве фенопластов и антиоксидантов.
Физические и химические свойства альдегидов и кетонов.
Карбонильными называются соединения, в состав которых входит оксо-группа С=О (или карбонильная группа). Эти соединения разделяют на класс альдегидов и класс кетонов. В молекулах альдегидов карбонильная группа соединена хотя бы с одним атомом водорода, а в кетонах – с двумя алкильными или арильными группами.
R – C(O) – Н – альдегид; R – C(O) –R′ − кетон (R, R′ - алкильные
или арильные группы).
Альдегиды по сравнению со спиртами имеют более низкие температуры плавления и кипения, что свидетельствует о более слабых межмолекулярных водородных связях. За исключением газообразного формальдегида, низшие альдегиды и кетоны представляют собой подвижные жидкости хорошо растворимые в воде.
Реакции с водой и спиртами. При присоединении к альдегидам воды образуются гидраты (1,1-диолы). В большинстве случаев эти соединения неустойчивы и гидратация протекает обратимо. Но формальдегид в водном растворе практически полностью находится в гидратированной форме из-за значительного положительного заряда на атоме углерода.
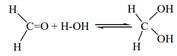 Присоединение к альдегидам спиртов
приводит к образованию полуацеталей и ацеталей, которые можно рассматривать как
простые эфиры геминальных диолов.
Присоединение к альдегидам спиртов
приводит к образованию полуацеталей и ацеталей, которые можно рассматривать как
простые эфиры геминальных диолов.
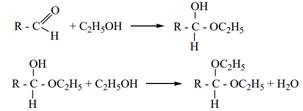
При восстановлении карбонильных соединений водородом или натрийборгидридом (NaBH4) можно получить первичные или вторичные спирты.
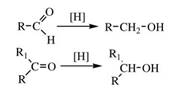
Альдегиды легко окисляются до соответствующих карбоновых кислот. В лаборатории для этого часто используют подкисленный раствор KMnO4. Качественными реакциями на альдегиды являются реакции серебряного и медного зеркала. Для проведения реакции серебряного зеркала используют реактив Толленса – аммиачный раствор оксида серебра, который выступает в роли окислителя. R−CHO + 2 [Ag(NH3)2]OH = 2Ag↓ + 3NH3 + RCOONH4+ H2O Образующееся серебро выделяется в виде чёрного осадка либо образует тонкую металлическую (зеркальную) плёнку на стеклянной поверхности колбы. Реакция медного зеркала заключается в окислении альдегидов гидроксидом меди (II), при этом образуется оранжево-красный оксид меди (I) или металлическая медь («медное зеркало»). R−CHO + 2Cu(OH)2 + NaOH = RCOONa + Cu2O↓ + 3H2O
Кетоны окисляются с трудом: при длительном кипячении с подкисленным раствором KMnO4 происходит разрыв связей С – С и С=О с образованием смеси продуктов.
СН3С(О)СН3→ СН3СООН + СО2 + Н2О
Применение альдегидов и кетонов.
Формальдегид используется в качестве дезинфицирующего средства, как консервант и дубильное вещество. Наибольшее применение он находит при производстве фенолоформальдегидных и мочевиноформальдегидных смол.
Ацетальдегид используется в производстве уксусной кислоты и этилацетата. Ацетон используется как растворитель и как исходное вещество в синтезе изопрена и некоторых фармацевтических препаратов.
Физические и химические свойства карбоксильных кислот.
Карбоновые кислоты представляют собой органические соединения, молекулы которых содержат одну или несколько карбоксильных групп - СООН, соединённых с углеводородным радикалом.
Образование солей. Карбоновые кислоты образуют соли, реагируя с металлами, карбонатами и щелочами.
2 RСО2Н + Mg → (RСО2)2Mg + H2
2 RСО2Н + Na2CO3 → 2 RСО2Na + CO2 + H2O
RСО2Н + NaOH→ RСО2Na + H2O
Соли карбоновых кислот – кристаллические вещества, растворимые в воде.
Этерификация. Карбоновые кислоты реагируют со спиртами в присутствии сильных кислот, образуя сложные эфиры. Этерификация карбоновых кислот протекает по механизму гетеролитического замещения.
RC OH O + H-O-R' RC O-R' O + H2O
В этой реакции в кислоте рвётся связь С−О, а не С−Н, как это было в случае нейтрализации. Процесс этерификации обратим. Сдвиг равновесия достигается удалением сложного эфира или воды из реакционной массы. Сложные эфиры широко распространены в природе. Запах цветов, ягод, фруктов обусловлен присутствием в них разных сложных эфиров.
Галогенирование. Атомы водорода, находящиеся в α-положении к карбоксильной группе, легко замещаются на атомы галогена. При пропускании хлора в кипящую уксусную кислоту в присутствии красного фосфора образуется хлоруксусная кислота. При последующем пропускании хлора при повышенной температуре возможно образование дихлор- и трихлоруксусной кислоты.
СН3СООН + Cl2 → ClСН2СООН + HCl
ClСН2СООН + Cl2 → Cl2СНСООН ;
Cl2СНСООН + Cl2 → Cl3CCOOH
Декарбоксилирование. При нагревании солей карбоновых кислот со щелочами происходит декарбоксилирование – удаление карбоксильной группы – и образуется углеводород, содержащий на один атом углерода меньше, чем исходная кислота. При электролизе солей карбоновых кислот на аноде образуются алканы с чётным числом атомов углерода (реакция Кольбе).
2RCOONa + 2H2O → R−R + 2CO2 + H2 + 2NaOH
Восстановление. Сильные восстановители, такие, как алюмогидрид лития, восстанавливают кислоты до спиртов.
RCOOН → RCН2ОН
Превращение в хлорангидриды. Хлорангидриды образуются при обработке кислот PCl5 или SOCl2.
RCOOH +SOCl2 → RCOCl + SO2 + HCl
Превращение в амиды. Амиды получают из карбоновых кислот и аммиака через стадию образования аммониевой соли. При нагревании до 2000С аммониевая соль дегидратируется с образованием амида.
RCOOH + NH3 → RCOONH4 → RCONH2 + H2O
Получение и применение карбоксильных кислот.
Окислительные методы. Кислоты образуются при окислении спиртов, альдегидов и кетонов. Первичные спирты окисляются через стадию образования альдегидов до карбоновых кислот. В качестве окислителя используют дихромат или перманганат калия в кислой среде. RCН2OH → RСHО → RCOOH Уксусную кислоту можно получать окислением ацетальдегида, который, в свою очередь, является продуктом гидратации ацетилена.
НС≡СН + Н2О → СН3С(О)Н + [О] → СН3СООН
Кроме того, уксусная кислота получается брожением на воздухе спиртосодержащих жидкостей (виноградное вино). Под действием фермента бактерий происходит окисление этилового спирта с образованием уксуснокислого раствора. Алкены окисляют перманганатом калия в кислой среде.
![]()
Бензойную кислоту получают окислением толуола. Однако и в том случае, если с ароматическим кольцом соединена большая группа, чем метильная, продуктом окисления всё равно будет бензойная кислота.
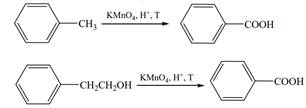
Уксусную и муравьиную кислоты в промышленности получают окислением смеси предельных углеводородов с 4-6 атомами углерода (бутан, пентан, гексан) кислородом воздуха при температурах 140-1800С в присутствии катализаторов (NaOH, MnO2). Реакцию проводят в закрытом резервуаре под давлением.
Перспективен способ
получения муравьиной и щавелевой кислоты из СО и NaOH: ![]()
Физические и химические свойства жиров и масел.
Жиры и масла относятся к липидам. Они представляют собой эфиры пропан-1,2,3-триола (глицерина) и карбоновых кислот с длинной углеродной цепью. Твёрдые жиры животного происхождения являются эфирами преимущественно насыщенных кислот, таких как стеариновая и пальмитиновая. Жидкие растительные масла – сложные эфиры глицерина и ненасыщенных жирных кислот, таких как олеиновая, линолевая и линоленовая.

Животные жиры ценятся выше, чем масла, поэтому значительные количества масел превращаются гидрированием в твёрдые жиры – саломасы (Т.пл. 31-330С). Реакцию гидрирования растительных жиров осуществляют в присутствии никелевых, никель-медных или металлокерамических катализаторов. Саломасы перерабатывают в маргарин, добавляя в очищенный от катализатора продукт витамины и небольшое количество β-каротина.
Особое место среди животных жиров занимает молочный жир, составляющий основную часть (около 90%) сливочного масла. В сливочном масле и молоке содержится значительное количество насыщенных жирных кислот с короткой цепью (например, масляной). Жиры являются исходным сырьём в производстве мыла. Щелочной гидролиз (омыление) жиров даёт глицерин и натриевые или калиевые соли жирных кислот, которые и являются мылом.
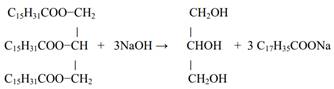
Этот процесс известен с древнейших времён, когда животные жиры кипятили с золой, содержащей карбонат калия. Натриевые мыла ограниченно растворимы в воде и могут быть получены в виде твёрдых брикетов. Калиевые мыла лучше растворимы и используются в шампунях.
Высокомолекулярные соединения.
Высокомолекулярные соединения имеют высокие молекулярные массы (обычно выше 10000 а.е.м.) . Большинство из них – полимеры, макромолекулы которых состоят из повторяющихся фрагментов (структурных звеньев). Число структурных звеньев, входящих в состав макромолекулы, называется степенью полимеризации. Низкомолекулярные соединения, из которых синтезируют полимеры, называются мономерами. Если в состав макромолекулы входят звенья одного мономера, высокомолекулярное соединение называют гомополимером, если – двух и более мономеров – сополимером. В зависимости от строения макромолекул различают линейные, имеющие линейную структуру, разветвлённые, в которых две или несколько цепей связаны между собой нерегулярно, и сетчатые (сшитые), где различные цепи связаны между собой поперечными связями. По используемым в технике свойствам полимеры разделяют на: - эластомеры, обладающие растяжимостью более 1000% и при постоянной температуре способные обратимо восстанавливать свою форму; - термопласты - при нагревании обратимо переходящие в пластичное или вязкотекучее состояние и в таком состоянии формуются в изделия; - реактопласты (термореактивные полимеры) - при нагреве подвергаются необратимым химическим превращениям, после чего теряют способность вновь подвергаться деформациям; - волокна, макромолекулы которых ориентированы преимущественно в одном направлении.
Способы получения полимеров.
Макромолекулы полимеров образуются в результате реакций полимеризации и поликонденсации.
Полимеризация – процесс получения макромолекул путём последовательного присоединения молекул мономера к реакционному центру, находящемуся в конце полимерной цепи. При этом состав мономера и структурного звена оказываются одинаковыми. Полимеризация является цепной реакцией. В ходе её выделяют несколько стадий: зарождение цепи (инициирование), рост цепи, обрыв цепи, а также реакции передачи цепи.
При зарождении цепи активная частица R* (радикал, катион, анион) присоединяется к мономеру А и активирует его.
R* + A → R−A*
Растущая активированная цепь реагирует с последующими молекулами мономера. R−A*+ A → R−A2* + A → ….→ R−An* Фрагмент инициатора R и зародышевый центр, отмеченный *, постоянно остаются в составе растущей цепи. После достаточно большого числа ступеней роста происходит дезактивация вследствие обрыва цепи и образуется макромолекула.
Реакции полимеризации разделяют на радикальные, катионные и анионные.
Радикальная полимеризация применяется наиболее часто. Инициирование производится свободными радикалами R·, которые образуются при термическом распаде инициаторов типа пероксида бензоила, азобисизобутилонитрила или персульфата калия. Радикальную полимеризацию также инициирует ультрафиолетовое излучение.
R· + СН2=СН2 → R− СН2−СН2·
R− СН2−СН2· + СН2=СН2 → R− СН2−СН2− СН2−СН2·
В процессе полимеризации образуются макромолекулы, содержащие от 1,5 до 60 тысяч звеньев СН2 в углеводородной цепи.
Ионная полимеризация начинается с образования реакционноспособных ионов (катионов или анионов). Катионную полимеризацию проводят при низких температурах в присутствии кислот или хлоридов алюминия, бора, титана. Анионная полимеризация требует присутствия щелочей или металлоорганических соединений. В результате реакций полимеризации получаются такие полимеры, как: полиэтилен, полипропилен, поливинилхлорид, полистирол, полиметилметакрилат и др. Поликонденсацией называют реакции получения полимеров, в которых макромолекулы строятся из би-, три-, или полифункциональных молекул с отщеплением низкомолекулярных соединений (воды, галогенводородов, спиртов и т.д.). Образующиеся макромолекулы имеют суммарный состав, отличный от состава реагирующих мономеров.
Рассмотрим образование капрона в процессе поликонденсации ε-аминокапроновой кислоты.
H2N−(CH2)5−COOH + HNH−(CH2)5−COO →
→ H2N−(CH2)5−CO−NH−(CH2)5−COOH + H2O
К образовавшемуся димеру присоединяются следующие молекулы ε-аминокапроновой кислоты, в результате чего образуется полимер полиамид, состава [−NH−(CH2)5−CO−]n. Из него изготавливают волокно – капрон. Полимерные сложные эфиры синтезируют из этиленгликоля и дикарбоновых кислот, например, терефталевой кислоты. Полученный при этом полимерный продукт называют полиэтилентерефталатом. Он нетоксичен, обладает высокой прочностью, низкой газопроницаемостью. В ёмкостях, выполненных из этого пластика, в продажу поступают газированные напитки, вода, растительное масло. Из расплава полиэтилентерефталата вытягивают нити волокна, называемого лавсаном. Он идёт на производство трикотажа, тканей, ковров, ремней безопасности. Из тонкой лавсановой нити изготавливают тюль. Лавсан выдерживает нагревание до 1700С. В технике используют полимерные сложные эфиры угольной кислоты – поликарбонаты (−R−O−C(O)O−)n. Пластики, созданные на основе поликарбонатов, по многим свойствам не уступают металлам, но устойчивы в агрессивных средах. Благодаря нетоксичности поликарбонаты применяют в качестве биоматериалов для костных протезов, из них делают фильтры для крови. Обладающие высокой ударопрочностью пластины из поликарбонатов используют в защитных экранах и щитах.
Полимерные материалы.
Пластмассы (пластики) – полимерные материалы, способные при переработке в изделия приобретать заданную форму и сохранять её при эксплуатации. Кроме полимера в состав пластмасс вводятся наполнители, улучшающие их механические свойства, стабилизаторы, препятствующие их медленному окислению, пластификаторы, уменьшающие их хрупкость, красители. Наиболее часто используются твёрдые наполнители в виде порошков мела или графита. Для увеличения жёсткости пластики армируют, вводя волокна, ткани или плёнки. Такие материалы, состоящие из нескольких компонентов, каждый из которых сохраняет собственную индивидуальность и свойства, называют композиционными или композитами. В качестве волокон, распределённых в полимере, часто используют стеклянные нити, которые получают из расплава оксида кремния с оксидами металлов. Стеклопластики не проводят электрический ток, не намагничиваются, имеют высокую прочность и коррозионную стойкость. Пропитывая углеродные волокна расплавленной смолой, получают углепластики. На их основе разработаны материалы, выдерживающие нагрев до 30000С. Из углепластиков делают детали гоночных автомобилей, самолётов, космических кораблей. Особой разновидностью полимерных материалов являются пенопласты. Рыхлая структура этих материалов создаётся благодаря вспениванию расплавленного полимера газами. В некоторых случаях газ получают разложением в расплаве веществ-газообразователей, таких как карбонат аммония или азодикарбонамид. Пенополистирол используется для изготовления упаковки для бытовой техники, из пенополиуретана изготавливают губки, сидения, матрасы. Пластификаторы повышают эластичность пластмасс. В качестве пластификаторов чаще всего используют сложные эфиры карбоновых кислот или фосфорной кислоты. Стабилизаторы препятствуют развитию процессов деструкции пластмасс в результате действия кислорода воздуха, солнечного света, высоких температур. Примерами наиболее распространённых пластмасс служат полиэтилен, полипропилен, полистирол, поливинилхлорид, полиметилметакрилат (органическое стекло), полиэтилентерефталат. Название полимера, из которого изготовлено изделие, указывают специальными знаками.
Наиболее распространённые полимерные материалы
Среди всех пластиков, выпускаемых мировой промышленностью, на первом месте по объёму производства находится полиэтилен. Он характеризуется высокой гибкостью и прочностью, инертен к действию кислот, щелочей, органических растворителей. Полиэтилен получают двумя способами – полимеризацией этилена при высоком и низком давлении.
Полиэтилен высокого
давления (ПВД) впервые был получен в 1933-36 гг. Этилен полимеризуется
радикально при давлениях 1300-2500 атм и температуре 150-3200С. Инициатором при
этом служит кислород или пероксиды. nCH2=CH2 →
[−CH2−CH2−]n  Получается сильно разветвлённый полимер с
молекулярной массой до 50 000. Это эластичный мягкий материал. Особенностью
структуры полиэтилена ПВД является большое количество длинных и коротких
ответвлений, не позволяющих молекулам с высокой молекулярной массой создавать
кристаллическую структуру. Связи поэтому между ними не сильные, а это говорит том, что
полиэтилен имеет невысокую устойчивость на разрыв и повышенную пластичность, а
также высокую текучесть в расплаве. ПВД называют также полиэтиленом низкой
плотности. Он нашел свое применение в изготовлении пленки для обертки,
контейнеров и пластиковых пакетов. Пакеты из полиэтилена высокого давления
нешуршащие, глянцевые. На изделиях из полиэтилена высокого давления указывается
латинская аббревиатура LDPE (Low Density PolyEthylene – полиэтилен низкой
плотности).
Получается сильно разветвлённый полимер с
молекулярной массой до 50 000. Это эластичный мягкий материал. Особенностью
структуры полиэтилена ПВД является большое количество длинных и коротких
ответвлений, не позволяющих молекулам с высокой молекулярной массой создавать
кристаллическую структуру. Связи поэтому между ними не сильные, а это говорит том, что
полиэтилен имеет невысокую устойчивость на разрыв и повышенную пластичность, а
также высокую текучесть в расплаве. ПВД называют также полиэтиленом низкой
плотности. Он нашел свое применение в изготовлении пленки для обертки,
контейнеров и пластиковых пакетов. Пакеты из полиэтилена высокого давления
нешуршащие, глянцевые. На изделиях из полиэтилена высокого давления указывается
латинская аббревиатура LDPE (Low Density PolyEthylene – полиэтилен низкой
плотности).
Полиэтилен низкого давления стали получать с 1953 года координационной полимеризацией в присутствии катализатора Циглера-Натта (хлорид титана – триэтилалюминий) при температуре 500С и давлении 1 атм. В этих условиях образуются линейные полимеры с молекулярной массой от 10 000 до 3 000 000. Полиэтилен низкого давления отличается большей жёсткостью и меньшей эластичностью. Его используют, как правило, в технических целях. Это производство труб, полиэтиленовых прокладок и высокопрочных мешков. Его преимуществами можно назвать устойчивость на сжатие-растяжение. Молекулы внутри такого полиэтилена расположены очень плотно, поэтому он ещё более устойчив к воздействию различных химических веществ. На изделиях из полиэтилена низкого давления указывается знак HDPE (High Density PolyEthylene – полиэтилен высокой плотности).

Полипропилен получают полимеризацией пропилена в присутствии металлокомплексных катализаторов Циглера—Натта.
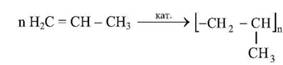
 Параметры, необходимые
для получения полипропилена близки к тем, при которых получают полиэтилен
низкого давления. По свойствам полипропилен напоминает полиэтилен, однако из
него можно изготавливать волокно, которое пригодно для изготовления технических
и бытовых тканей. Из полипропилена изготовляют следующие виды изделий для
строительной техники: трубы, плёнки, листы, вентиляционные решётки и
санитарно-техническое оборудование. Полипропиленовые трубы применяют для
горячего водоснабжения и для транспортировки агрессивных жидкостей. Плёнки из
полипропилена прозрачны и прочны, обладают хорошей свариваемостью, малой водо-,
паро- и газопроницаемостью. Применяют их для различных видов изоляции
сооружений. Аморфный поли- 80 пропилен используют для изготовления строительных
клеев, замазок, уплотняющих мастик и липких плёнок.
Параметры, необходимые
для получения полипропилена близки к тем, при которых получают полиэтилен
низкого давления. По свойствам полипропилен напоминает полиэтилен, однако из
него можно изготавливать волокно, которое пригодно для изготовления технических
и бытовых тканей. Из полипропилена изготовляют следующие виды изделий для
строительной техники: трубы, плёнки, листы, вентиляционные решётки и
санитарно-техническое оборудование. Полипропиленовые трубы применяют для
горячего водоснабжения и для транспортировки агрессивных жидкостей. Плёнки из
полипропилена прозрачны и прочны, обладают хорошей свариваемостью, малой водо-,
паро- и газопроницаемостью. Применяют их для различных видов изоляции
сооружений. Аморфный поли- 80 пропилен используют для изготовления строительных
клеев, замазок, уплотняющих мастик и липких плёнок.
Среди всех пластиков первым был получен полистирол (1839), промышленное производство его было налажено в 1920 г.
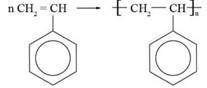
Полистирол – твёрдый
прозрачный материал, который легко окрашивается в любой цвет. В отличие от
полиэтилена и полипропилена он сохраняет прозрачность даже в толстом слое, что
позволяет изготавливать из него шкалы приборов, плафоны светильников. Этот
полимер нетоксичен, его применяют для изготовления галантерейных товаров,
посуды, тары и др., температура эксплуатации не выше 600С. 
На основе полистирола получают пенополистирол, называемый пенопластом. Его применяют как упаковочный материал, в строительстве − как звуко- и теплоизоляционный материал. Полистирол хрупок, но этого недостатка лишены сополимеры полистирола с каучуками (например, получаемый из акрилонитрила, бутадиена и стирола АБС-пластик), из которых делают защитные шлемы, корпуса приборов бытовой техники, спортивный инвентарь.
Примером негорючего пластика служит поливинилхлорид (ПВХ), более половины массы которого приходится на хлор. ПВХ получают радикальной полимеризацией винилхлорида.
nCH2=CHCl→ [−CH2−CHCl−]n
Преобладающей технологией является эмульсионная полимеризация. Средняя молекулярная масса поливинилхлорида от 25 000 до 100 000. Поливинилхлорид устойчив к действию щелочей, кислот и неполярных растворителей. При нагревании выше 1200С легко происходит отщепление хлороводорода, что вызывает необходимость добавки стабилизаторов. Температура эксплуатации не выше 1000С. На основе поливинилхлорида выпускают пластмассы двух видов: жёсткого продукта – винипласта и мягкого – пластиката. Винипласт представляет собой термопластичный материал с достаточно высокой прочностью. Он обладает хорошими изоляционными и антикоррозионными свойствами. Из него делают вентилляционные и канализационные трубы, оконные рамы, бытовые изделия. Пластикат - мягкий термопластичный материал, обладающий высокой эластичностью. Он используется для изготовления плёнок, шлангов, плинтусов, карнизов, линолеума, изоляции для электропроводов. Пенополивинилхлорид идёт на производство вспененых рулонных материалов (например, искусственной кожи).
Полиметилметакрилат (ПММА) получают радикальной полимеризацией метилового эфира метакриловой кислоты при температуре 40-600С.
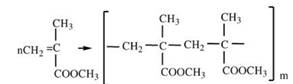
В результате получается прозрачный полимер, способный пропускать 74% ультрафиолетового излучения. Он легко окрашивается в различные цвета и используется в виде листов (органическое стекло) для декоративных ограждений, высокопрочных стёкол для салонов самолётов, автомобилей, оптических стёкол, линз и призм, а также для изготовления светильников, реклам и дорожных знаков. Поскольку оргстекло практически безвредно для человеческого организма, оно нашло применение в качестве материала для зубных протезов и контактных линз.
Полимеризацией тетрафторэтилена получают политетрафторэтилен – тефлон, открытый в 1938 г. в лаборатории американской компании «Дю Пон».
nCF2=CF2→ [−CF2−CF2−]n
Тефлон – тяжёлый полимер сероватого цвета, нерастворимый в органических растворителях, очень устойчивый к воздействию химических реагентов. Его используют в химической промышленности для изготовления трубопроводов и уплотнительных материалов. Благодаря высокой механической прочности тефлон применяется в производстве подшипников, поршневых колец и т.д. Полимер нашёл применение в хирургии для изготовления костных и суставных протезов.
Эластомеры
Традиционными эластомерами являются каучуки – продукты полимеризации диеновых углеводородов. Молекулы диеновых углеводородов с двумя двойными связями, разделёнными одинарной, при полимеризации образуют вещества, содержащие двойные связи. Природный каучук, содержащийся в млечном соке тропических растений (гевеи и фикуса), представляет собой полимер 2-метилбутадиена-1,3 – изопрена.
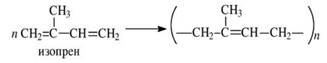
Каучук представляет собой эластичный материал жёлто-коричневого цвета, растворимый в углеводородах (бензин, бензол, толуол). В макромолекулах природного каучука все метильные группы расположены строго по одну сторону от двойных связей. В обычном состоянии все макромолекулы закручены в клубки, а при растяжении раскручиваются. При снятии нагрузки они возвращаются в прежнее состояние, что и обеспечивает материалу эластичность.
При температурах 15-400С каучук размягчается, поэтому в чистом виде он используется лишь в производстве резинового клея. При хранении на воздухе каучук стареет, постепенно теряет эластичность вследствие окисления по кратным связям.
Гуттаперча – другой природный полимер изопрена – имеет трансстроение. По сравнению с каучуком гуттаперча напоминает кожу, становится пластичной при нагревании, обладает большой клейкостью. Она используется в качестве изолятора в электротехнике, в производстве клеев.
В промышленности получают синтетические полимеры, по свойствам напоминающие натуральный каучук. Они представляют собой гибкие и эластичные материалы. Большую часть производимых каучуков вулканизируют – нагревают с серой без доступа воздуха. При этом отдельные макромолекулы сшиваются по местам двойных связей мостиками из атомов серы - образуется резина.
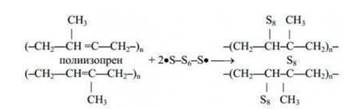
По сравнению с каучуком она более износостойка и устойчива к изменениям температуры. Чем больше добавлено серы, тем выше степень вулканизации и тем твёрже образующийся материал. Резина с большим содержанием серы идёт на изготовление шлангов, шин, обуви. Дальнейшая вулканизация резины приводит к образованию эбонита – твёрдого материала, используемого в качестве изолятора.
В настоящее время промышленность производит около ста видов синтетических каучуков. Наиболее распространённым является бутадиеновый каучук, получаемый полимеризацией бутадиена-1,3.
n CH2=CH−CH=CH2→ [−CH2−CH=CH−CH2−]n
Этот каучук относится к каучукам общего назначения. Его вулканизируют серой, в качестве наполнителя используют сажу. Резины из этого каучука обладают высокой износо- и морозостойкостью. Они устойчивы ко многим деформациям. Применяют этот каучук в производстве шин, резинотехнических изделий, для изоляции кабелей.
Бутадиен-стирольный каучук – каучук общего назначения, получаемый совместной полимеризацией бутадиена-1,3 и стирола. nCH2=CH−CH=CH2 +n С6Н5−СН=СН2→
→ [−CH2−CH=CH−CH2−]n− [CH2−CН(C6H5) −]n
Этот каучук также вулканизируют серой, в качестве наполнителя используется сажа. Применяют в производстве шин, резинотехнических изделий, обуви. Изопреновый каучук по техническим свойствам близок к натуральному каучуку. Он является его заменителем в производстве шин, рассчитанных на большие нагрузки (для самолётов, грузовых автомобилей, вездеходов). Хлоропреновый каучук (наирит, неопрен) получают полимеризацией хлоропрена.
nCH2=CCl−CH=CH2 → [−CH2−CCl=CH−CH2 −]n
Вулканизируют оксидами цинка и магния. Резины обладают масло-, бензо-, тепло- и износостойкостью. Не горючи и устойчивы к кислотам и щелочам. Применяют в производстве резинотехнических изделий, клеев и изоляции. Полиуретаны — гетероцепные полимеры, макромолекула которых содержит незамещённую и/или замещённую уретановую группу —N(R)— C(O)O—, где R = Н, алкилы, арил или ацил. В макромолекулах полиуретанов также могут содержаться простые и сложноэфирные функциональные группы, мочевинная, амидная группы и некоторые другие функциональные группы, определяющие комплекс свойств этих полимеров. Полиуретаны относятся к синтетическим эластомерам и нашли широкое применение в промышленности благодаря широкому диапазону прочностных характеристик. Используются в качестве заменителей резины при производстве изделий, работающих в агрессивных средах, в условиях больших знакопеременных нагрузок и температур. Диапазон рабочих температур — от −60 °С до +80 °С. Резины широко используются в различных сферах производственной и бытовой жизни человека, особенно в строительстве. Она входит в элементы строительных конструкций, начиная от фундамента и кончая деталями отделки зданий. Применение резины позволяет сделать возводимые здания устойчивыми к землетрясениям. В Малайзии на «рессоры» из натурального каучука ставят многие здания. В мировой практике имеется немало примеров строительства сооружений на резиновом фундаменте. Полимерные материалы используются в качестве герметиков, в том числе и эластомер – гернит, основу которого составляет хлоропреновый каучук. Гидроизоляция с применением жидкой резины (композиции, состоящей из битумной эмульсии и бутадиен-стирольных полимеров) по своим характеристикам приравнивается к многослойной гидроизоляции из рубероида. Большую часть олифы в масляных красках можно заменить на изопреновый каучук. Для защиты стальных конструкций от коррозии используются покрытия из резины или эбонита (гуммирование). Для заливки рельсовых швов и для заполнения швов во всех местах движения бетона и асфальта используют битумные композиции, содержащие резины.
Вопросы для закрепления теоретического материала к практическому занятию
1. Перечислите классы органических соединений.
2. Химические свойства алканов.
3. Химические свойства алкенов.
4. Химические свойства алкинов.
5. Химические свойства алкадиенов.
6. Химические свойства аренов.
7. Химические свойства спиртов.
8. Химические свойства альдегидов и кетонов.
9. Химические свойства карбоновых кислот.
10. Химические свойства жиров.
11. Химические свойства аминов.
12. Химические свойства аминокислот.
13. Химические свойства белков.
Задания для практического занятия:
Ответьте на задания, выбрав уравнения из вашего варианта под номерами (по указанию учителя).
УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
ОРГАНИЧЕСКИХ ВЕЩЕСТВ
|
варианты |
|||
|
|
1 |
2 |
3 |
|
1 |
С2H2+H2 → |
C2H4+H2→ |
|
|
2 |
СН4 + О2 → |
C2H6+O2→ |
C2H2+О2→ |
|
3 |
CH2Cl2+ Cl2 → |
C2H2+Cl2→ |
|
|
4 |
C2H6+Br2 → |
СH4+Br2→ |
|
|
5 |
H2C=CH-CH3 +HCl→ |
|
H2C=CH2 +HCl→ |
|
6 |
|
|
H2C=CH-CH3 +HBr→ |
|
7 |
|
СН4 + HNO3→ |
СН3-СН3+ HNO3→ |
|
8 |
Al4С3+H2O→ |
CaC2 +H2O → |
Na2C2+H2O→ |
|
9 |
Н2С=СН2+ Н2О → |
|
|
|
10 |
C2H5OH + Na → |
C6H5OH+Na→ |
CH3CH2Cl+Zn→ |
|
11 |
CH4→ |
C2H5OH+NH3→ |
С16Н34→ |
|
12 |
C2H5OH+ C2H5OH → |
С6Н12О6 → |
C2H5OH+CH3COOH→ |
|
13 |
|
СН3-СН2-СН3→ |
Н2С=СН2 → |
|
14 |
|
|
|
|
15 |
|
CH3CHO+H2→ |
C2H5OH+HNO3→ |
|
16 |
C6H5OH+NaOH→ |
R−CHO + [Ag(NH3)2]OH→ |
C6H5OH+Br2→ |
ЗАДАНИЯ:
1. Запишите уравнения химических реакций из вашего варианта под номерами….
2. Подпишите названия исходных веществ и продуктов реакции в записанных уравнениях реакций.
3. Расставьте коэффициенты в записанных уравнениях реакций.
4. Укажите типы записанных уравнений реакций.
Инструкция по выполнению практического занятия
Внимание! приведен пример только одного уравнения!!!
Вы должны выполнить все уравнения из вашего варианта
Вариант 3 № 16
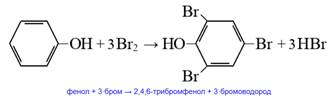
Реакция бромирования
Порядок выполнения отчёта по практическому занятию
1.В тетради для практических занятий напишите номер, название и
учебную цель занятия.
2.Ответьте устно на вопросы для закрепления теоретического материала к практическому занятию.
3.Выполните задания.
4.Запишите вывод о проделанной работе.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ № 15 «Решение упражнений на генетическую связь между классами органических соединений отдельных классов».
Цель: углубить знания о строении, химических свойствах углеводородов и кислородсодержащих веществ; научиться решать цепочки превращений, используя химические свойства веществ и способы их получения.
Методическое и материально-техническое обеспечение:
Ход работы:
Теоретическая часть
При изучении свойств органических соединений мы часто встречались с примерами взаимопревращений соединений различных классов. Так, с помощью реакции дегидрирования из алкана можно получить алкен, реакцией гидратации алкен превратить в спирт, спирт окислить до альдегида и далее до карбоновой кислоты и т. д. Получается целая цепь превращений веществ, которые объединяет одинаковое число атомов углерода в молекуле.
Генетической связью – называется связь между веществами разных классов, основанная на их взаимопревращениях и отражающая единство их происхождения, то есть генезис веществ.
Что же означает понятие «генетическая связь»
1.Превращение веществ одного класса соединений в вещества других классов.
2.Химические свойства веществ.
3.Возможность получения сложных веществ из простых.
4.Взаимосвязь простых и сложных веществ всех классов веществ.
Генетическим ряд веществ – ряд представителей разных классов веществ являющихся соединениями одного химического элемента, связанных взаимопревращениями и отражающими общность происхождения этих веществ.
Если основу генетического ряда в неорганической химии составляют вещества, образованные одним химическим элементом, то основу генетического ряда в органической химии (химии углеродных соединений) составляют вещества с одинаковым числом атомов углерода в молекуле.
Например:
C2H6 →C2H4→ C2H5OH→CH3CHO → CH3 – COOH →CH2Cl – COOH →NH2CH2COOH
Этан ®этен ®этаналь ® уксусная кислота ® хлорэтановая кислота ® аминоэтановая к-та
алкан ® алкен ®алканол ®алканаль®карбоновая кислота ®хлоркарбоновая кислота ®аминокислота
1. C2H6 → C2H4 + H2 ;
2. C2H4 + H2O → C2H5 OH
3. C2 H5OH + [O] → CH3CHO + H2O;
4. CH3CHO + [O] → CH3COOH
5. CH3COOH + Cl2 → CH2Cl - COOH;
6. CH2Cl - COOH + NH3 → NH2 CH2 – COOH + HCl
Между гомологическими рядами углеводородов существует генетическая связь, которая обнаруживается в процессе взаимного превращения этих веществ.
Для перехода от одной группы веществ к другой используют процессы: дегидрирование, гидрирование, циклообразование и другие.
Так можно осуществить большинство переходов, однако, этот способ получения углеводородов не является универсальным.
Стрелками в схеме указаны углеводороды, которые непосредственно можно превратить друг в друга одной реакцией.
Схематически это выглядит так:
Углеводороды, спирты, альдегиды и карбоновые кислоты генетически связаны между собой. При этом можно проследить постепенное усложнение строения веществ. Перечисленными классами далеко не исчерпывается круг органических соединений. Разнообразные преобразования кислот и других веществ обусловливают появление новых классов и, таким образом, дальнейшее развитие разнообразия органических соединений.
Прослеживая связь веществ в направлении их усложнения, можно заметить, что простейшими первичными «кирпичиками» являются углеводороды, от которых можно перейти к галогенопроизводным, спиртам и т.д.
Практическая часть
Вариант 1
Задание 1. Осуществить цепочки химических превращений:
1) CH4 → HCOH → CH3OH → CH3Cl → C2H6
2) Карбид кальция ® ацетилен ® уксусный альдегид ® уксусная кислота ® ацетат натрия ® метан ® ацетилен ® бензол ® хлорбензол ® фенол.
Задание 2. Установить соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
Реагирующие вещества |
Продукт взаимодействия |
|
А) 2-бромпропан и натрий Б) хлорэтан и КОН (спирт.) В) хлорэтан и КОН (водн.) Г) бутен-2 и водород |
1) гексан 2) 2,3-диметилбутан 3) этанол 4) бутан 5) этаналь 6) этен |
Задание 3. Из предложенных веществ состаить 2 генетических ряда: С2Н2, С3Н8, С2Н4, С2Н6, С4Н10, СН3-СН=СН2, С6Н6, С9Н12, СН4, С2Н5СООН, С3Н4, С2Н5О-ОССН3,C2H5-OH.
Задание 4. Решить задачу:
Какой объем хлора (н.у.) необходим для получения из пропана 31,4г. 2-хлорпропана?
Вариант 2
Задание 1. Осуществить цепочки химических превращений:
1) CH4 → C2H2 → CH3-COH → C2H5OH → CH3COOH
2) Этан ® бромэтан ® бутан ® уксусная кислота ® ацетат натрия ® метан ® ацетилен ® уксусный альдегид ® уксусная кислота ® этиловый эфир уксусной кислоты.
Задание 2. Установить соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
|
Реагирующие вещества |
Продукт взаимодействия |
|
А) бутен-1 и вода Б) пропин и водород (изб.) В) пропин и вода Г) циклопропан и бром |
1) пропанон 2) пропан 3) бутанол-1 4) бутанол-2 5) 1,2-дибромпропан 6) 1,3-дибромпропан |
Задание 3. Из предложенных веществ составить 2 генетических ряда: С2Н2, С3Н8, С2Н4, С2Н6, С4Н10, СН3-СН=СН2, С6Н6, С9Н12, СН4, С2Н5СООН, С3Н4, С2Н5О-ОССН3,C2H5-OH.
Задание 4. Решить задачу:
Найти массу воды, необходимой для получения метана из 1,8г. Карбида алюминия.
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы;
- задание;
- вывод.
4. Вопросы по теме практического занятия:
4.1. Дать определения понятиям: «генетическая связь», «генетический ряд веществ».
4.2. Объяснить, в чем выражается генетическая связь между углеводородами.
4.3. Перечислить названия реакций, которые встречались при выполнении заданий.
4.4. Объяснить, какая группа веществ лежит в основе большинства генетических цепочек
4.5. Объяснить, какой тип реакций характерен для предельных, а какой для непредельных углеводородов.
4.6. Объяснить, какой вид изомерии характерен для предельных, а какой для непредельных углеводородов.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №16 «Решение практико-ориентированных теоретических заданий на свойства органических соединений отдельных классов»
Цели: повторить, обобщить и систематизировать знания по химическим свойствам органических веществ различных классов.
Оснащение:
Задание 1.
Задана следующая схема превращений веществ:
![]()
Определите, какие из указанных веществ являются веществами X и Y.
1) H2
2) CuO
3) Cu(OH)2
4) NaOH (H2O)
5) NaOH (спирт)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
![]()
Задание 2
Задана следующая схема превращений веществ:
![]()
Определите, какие из указанных веществ являются веществами X и Y.
1) CH3CH2CH2OH
2) NaOH
3) CH3CH2COOCH3
4) H2
5) Cu(OH)2
6) CH3CH2CH2OCH3
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
![]()
Задание 3
Задана следующая схема превращений веществ:
![]()
Определите, какие из указанных веществ являются веществами X и Y.
1) CH3CH2OH
2) CH3COOH
3) NaOH
4) Cu(OH)2
5) CH3CHO
6) H2
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
![]()
Задание 4
Задана следующая схема превращений веществ:
![]()
Определите, какие из указанных веществ являются веществами X и Y.
1) этан
2) этилен
3) ацетилен
4) NaOH (водн.)
5) NaOH (спирт)
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
![]()
Задание 5
Задана следующая схема превращений веществ:
![]()
Определите, какие из указанных веществ являются веществами X и Y.
1) пропаналь
2) пропанол-1
3) пропанол-2
4) 1-бромпропан
5) 2-бромпропан
6) пропилен
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
![]()
Задание 6
Задана следующая схема превращений веществ:
![]()
Определите, какие из указанных веществ являются веществами X и Y.
1) пропаналь
2) пропанон
3) пропионовая кислота
4) пропан
5) пропилен
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
![]()
Задание 7
Задана следующая схема превращений веществ:
![]()
Определите, какие из указанных веществ являются веществами X и Y.
1) KOH (водн.)
2) KOH (спирт.)
3) CuO
4) K2Cr2O7 (H+)
5) H2
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
![]()
Задание 8
Задана следующая схема превращений веществ:
![]()
Определите, какие из указанных веществ являются веществами X и Y (вещество Y - углеводород).
1) HCl
2) CuO
3) H2O (кат.)
4) C2H6
5) C2H4
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
![]()
Задание 9
Задана следующая схема превращений веществ:
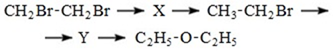
Определите, какие из указанных веществ являются веществами X и Y.
1) этан
2) этилен
3) ацетилен
4) этанол
5) ацетальдегид
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
![]()
Задание 10
Задана следующая схема превращений веществ:
![]()
Определите, какие из указанных веществ являются веществами X и Y.
1) пропанол-1
2) пропанол-2
3) пропионовая кислота
4) пропаналь
5) пропанон
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
![]()
Задание 11
Задана следующая схема превращений веществ:
![]()
Определите, какие из указанных веществ являются веществами X и Y.
1) азот
2) водород
3) вода
4) серная кислота (конц.)
5) гидроксид натрия
Запишите в таблицу номера выбранных веществ под соответствующими буквами.
![]()
Практическое занятие № 17 «Решение практико-ориентированных заданий на анализ факторов, влияющих на изменение скорости химической реакции» (в т.ч. с позиций экологически целесообразного поведения в быту и трудовой деятельности в целях сохранения своего здоровья и окружающей природной среды).
Учебная цель: изучить понятия скорости химической реакции.
Учебные задачи:
1.Научиться решать задачи на скорость химической реакции.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен:
иметь практический опыт: решения задач на скорость химической реакции и смещение химического равновесия.
знать: факторы, влияющие на изменение скорости химической реакции и факторы, влияющие на смещение химического равновесия;
уметь: решать задачи на скорость химической реакции и смещение химического равновесия.
Задачи практического занятия:
1. Повторить теоретический материал по теме практического занятия.
2. Ответить на вопросы для закрепления теоретического материала.
3. Выполнить задания по теме.
4. Оформить отчет.
Обеспеченность занятия (средства обучения):
1. Сборник методических указаний для студентов по выполнению практических занятий по учебной дисциплине «Химия».
2. Таблица «Периодическая система химических элементов Д.И. Менделеева».
3. Тетрадь для практических занятий в клетку.
4. Карточки – задания.
5. Калькулятор.
6. Ручка.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Скорость химической реакции.
Скорость химической реакции - основное понятие химической кинетики, выражающее отношения количества прореагировавшего вещества (в молях) к отрезку времени, за которое произошло взаимодействие.
Скорость реакции отражает изменение концентраций реагирующих веществ за единицу времени. Единицы измерения для гомогенной реакции: моль/л * сек. Физический смысл в том, что каждую секунду какое-то количество одного вещества превращается в другое.
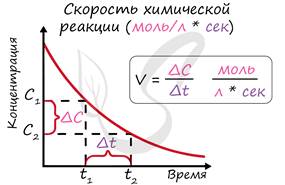
Основные факторы, влияющие на скорость химической реакции, это:
1. природа реагирующих веществ:
Самая высокая скорость реакции между растворами, в жидкостях. В газах она несколько ниже. Химическая активность также играет важную роль. Например, отвечая на вопрос "какой из металлов Fe или Ca быстрее прореагирует с серой?" мы отдадим предпочтение кальцию, так как в ряду активности металлов он стоит левее железа, а значит кальций активнее железа.
2. концентрация реагирующих веществ:
Влияние концентрации "прямо пропорционально" скорости реакции: при увлечении концентрации реагирующего вещества скорость реакции повышается, при уменьшении - понижается.
3. площадь поверхности соприкосновения реагентов:
Если реакция гетерогенная: жидкость + твердое вещество, газ + твердое вещество, жидкость + газ, то большую роль играет площадь соприкосновения реагирующих веществ. При измельчении твердого вещества скорость химической реакции увеличивается.
Если в реакции участвуют газы: при увеличении давления концентрация вещества на единицу объема возрастает (представьте, как газ сжимается). Поэтому увеличение давление, если среди исходных веществ есть газ, увеличивает скорость реакции.
4. температура, при которой проводится реакция:
Влияние температуры на скорость реакции "прямо пропорционально": чем выше температура, тем выше скорость реакции - чем ниже температура, тем меньше и скорость реакции.
Правило Вант-Гоффа, голландского химика, позволяет точно оценить влияние температуры на скорость химической реакции. Оно звучит так: "При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза".

5. присутствие в реакции катализатора (ингибитора).
Катализатор (греч. katalysis — разрушение) - вещество, ускоряющее химическую реакцию, но не участвующее в ней. Катализатор не расходуется в химической реакции.
Многие химические реакции в нашем организме протекают с участием катализаторов - белковых молекул, ферментов. Без катализаторов подобные реакции шли бы сотни лет, а с катализаторами идут одну долю секунды.
Катализом называют явление ускорения химической реакции под действием катализатора, а химические реакции, идущие с участием катализатора - каталитическими.
Ингибитор (лат. inhibere - задерживать) - вещество, замедляющее или предотвращающее протекание какой-либо химической реакции.
Ингибиторы применяют для замедления коррозии металла, окисления топлива, старения полимеров. Многие лекарственные вещества являются ингибиторами. Так при лечении гастрита - воспаления желудка (греч. gaster - желудок) или язв часто назначаются ингибиторы протонной помпы - химические вещества, которые блокирует выработку HCl слизистой желудке. В результате этого соляная кислота прекращает воздействие на поврежденную стенку желудка, воспаление стихает.
Закон действующих масс. Скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагентов, взятых в степенях, равных их стехиометрическим коэффициентам.
Для реакции аА + bB = cC + dD υ = k·[A]a·[B]b,
где [A] и [B] – концентрации веществ А и В в моль/л,
k – константа скорости реакции.
Концентрации твердых веществ, в случае гетерогенной реакции в кинетическое уравнение не включают.
Зависимость скорости реакции от концентрации реагирующих веществ определяется законом действующих масс:
υ = k·[A]a·[B]b
Очевидно, что с увеличением концентраций реагирующих веществ, скорость реакции увеличивается, т.к. увеличивается число соударений между участвующими в реакции веществами. Причем, важно учитывать порядок реакции: если реакция имеет первый порядок по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества. Если реакция имеет второй порядок по какому-либо реагенту, то удвоение его концентрации приведет к росту скорости реакции в 22 = 4 раза, а увеличение концентрации в 3 раза ускорит реакцию в 32 = 9 раз.
Химическая система находится в состоянии равновесия когда скорости прямой и обратной реакции равны. В равновесной системе за любой промежуток времени образуется столько же молекул, сколько их распадается, поэтому, концентрации исходных веществ и продуктов реакции не изменяются с течением времени.
Система будет находиться в состоянии равновесия до тех пор, пока не изменятся внешние условия. При изменении внешних условий произойдет изменение скоростей прямой и обратной реакции, что неизбежно приведет к "перекосу" в ту или иную сторону.
Согласно принципу Ле-Шателье, - если на систему, находящуюся в равновесии, оказать воздействие, то в результате протекающих процессов равновесие сместится в таком направлении, чтобы оказанное воздействие уменьшилось.
Нарушить равновесие системы можно изменением:
концентрации веществ, участвующих в реакции - равновесие системы смещается в сторону расхода вещества, концентрация которого увеличилась или в сторону образования вещества, концентрация которого уменьшилась;
давления - изменения объёма системы - при уменьшении давления (увеличении объема) равновесие смещается в сторону увеличения числа молекул газов и при увеличении давления (уменьшении объема) равновесие смещается в сторону уменьшения числа молекул газов;
температуры - при увеличении температуры равновесие смещается в сторону эндотермической реакции; при уменьшении температуры - в сторону экзотермической реакции.
Вопросы для закрепления теоретического материала к практическому занятию
1. Что такое скорость химической реакции.
2. Какие факторы влияют на скорость химической реакции.
3. Правило Вант-Гоффа.
4. Что такое химическое равновесие.
5. Какие факторы влияют на смещение химического равновесия.
Задания для практического занятия:
Ответьте на задания, выбрав карточку под номером (по указанию учителя).
Карточка № 1.
1.Реакция протекает по уравнению А+В = 2С. Начальная концентрация вещества А равна 0,22 моль/л, а через 10 с — 0,215 моль/л. Вычислите среднюю скорость реакции.
2.Как изменится скорость реакции: S (тв) + O2 (г) = SO2 (г) при увеличении давления в системе в 4 раза?
3.Вычислите, во сколько раз увеличится скорость реакции при повышении температуры от 30 до 70 ∘ С, если температурный коэффициент скорости равен 2.
4. В замкнутый сосуд поместили 6 моль H2 и 3 моль O2. Через некоторое время установилось равновесие 2H2(г) + O2(г) =2H2O (г) и образовалась вода химическим количеством 1,5 моль. Как изменилось давление в сосуде к моменту установления равновесия?
5.
Химическое равновесие в реакции ![]() смещается
в сторону образования продукта реакции при
смещается
в сторону образования продукта реакции при
1) понижении давления
2) повышении температуры
3) добавлении катализатора
4) добавлении водорода.
Карточка № 2.
1. Запишите кинетическое уравнение для следующих уравнений реакций: А) S(тв) + O2 (г) = SO2 (г) Б) 2SO2 (г) + O2 (г) = 2SO3 (ж)
2. Как изменится скорость реакции:2SО2 (г) + O2 (г) = 2SO3 (г) при увеличении давления в системе в 2 раза?
3. При температуре 10 ºС реакция протекает за 5 мин, при 20ºС – за 1 мин. Рассчитайте температурный коэффициент скорости реакции.
4. В гомогенной системе установилось равновесие: 2SO2+O2 ↔ 2SO3
Равновесные химические количества (моль) SO2, O2 и SO3 соответственно равны 0,1, 0,2 , 0,6. Определите исходные химические количества SO2 и O2.
5.
Равновесие ![]() смещается
в сторону исходных веществ при
смещается
в сторону исходных веществ при
1) уменьшении давления
2) нагревании
3) введении катализатора
4) добавлении водорода
Карточка № 3.
1. Константа скорости реакции омыления уксусноэтилового эфира: СН3СООС2Н5(р-р) + КОН(р-р)→СН3СООК (р-р) +С2Н5ОН(р-р) равна 0,1 л/моль∙мин. Начальная концентрация уксусноэтилового эфира была равна 0,01 моль/л, а щелочи – 0,05 моль/л. Вычислите начальную скорость реакции и в тот момент, когда концентрация эфира станет равной 0,008 моль/л.
2. Рассчитайте, во сколько раз изменится скорость реакции Н2+С12 = 2НС1 при увеличении давления в 2 раза.
3. Температурный коэффициент реакции равен 2,5. Как изменится ее скорость при охлаждении реакционной смеси от изменения температуры от 50 °С до 30 °С?
4. Равновесные молярные концентрации СO, O2 и CO2 после установления равновесия 2CO(г) + O2(г) = 2CO2(г) равны 0,3; 0,2 и 0,1 (моль/дм3) соответственно. Рассчитайте объемную долю кислорода в исходной газовой смеси (исходная молярная концентрация CO2 равна нулю).
5. Куда будет смещаться равновесие системы с увеличением температуры?
N2+O2 ↔ 2NO-108,5 кДж
N2+3H2 ↔ 2NH3+88 кДж
Инструкция по выполнению практического занятия
Задача 1. Молярная концентрация вещества до реакции составляла 1.5 моль/л по итогу реакции - 3 моль/л. Объем смеси 10 литров, реакция заняла 20 секунд. Рассчитайте скорость реакции.
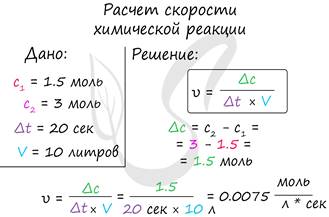
Задача 2. Окисление диоксида серы протекает по уравнению: 2SO2(г) + O2 = 2SO3(г). Как изменится скорость этой реакции, если объемы системы уменьшить в три раза?

Ответ: скорость реакции в таком случае возрастет в 27 раз.
Задача 3. Как изменится скорость гомогенной реакции при повышении температуры от 27°C до 57°C при температурном коэффициенте, равном трем?

Задача 4. Рассчитайте, чему равен температурный коэффициент скорости, если известно, что при понижении температуры от 250°C до 220°C скорость реакции уменьшилась в 8 раз.

Задача 5. Равновесные молярные концентрации СO, O2 и CO2 после установления равновесия 2CO(г) + O2(г) = 2CO2(г) равны 0,3; 0,2 и 0,1 (моль/дм3) соответственно. Рассчитайте объемную долю кислорода в исходной газовой смеси (исходная молярная концентрация CO2 равна нулю).
Решение
1)Записываем уравнение 2СО(г) + O2(г) =2СO2(Г)
2)Вносим в таблицу значение равновесных молярных концентраций веществ.
|
|
СО |
O2 |
СО2 |
|
Было |
0,4 |
0,25 |
--- |
|
Израсходовано |
0,1 |
0,05 |
--- |
|
Стало |
0,3 |
0,2 |
0,1 |
3)По уравнению находим молярные концентрации
прореагировавших угарного газа СО и кислорода: cпрор(CO)=c(CO2)=0,1моль/дм3,
спрор(О2)=![]() =
= ![]() =0,05 (моль/дм3).
=0,05 (моль/дм3).
4)Затем находим исходные молярные концентрации угарного газа и кислорода:
сисх(CO)= cпрор(CO) + cравн (СО) =0,3+0,1=0,4 (моль/дм3); сисх(О2)= спрор(О2)+ сравн(О2)=0,2+0,05=0,25 (моль/дм3).
5) Находим мольную долю кислорода в смеси, которая будет равна объёмной доле: если предположить, что объём смеси равен 1 дм3, то n(O2)=0,25 моль, n(CO)=0,4 моль, мольная доля равна
ᵡ(О2) = ᵠ = ![]() =
=![]() = 0,385.
= 0,385.
Ответ: ᵡ (О2)=0,385.
Задача 6. 
Порядок выполнения отчёта по практическому занятию
1.В тетради для практических занятий напишите номер, название и
учебную цель занятия.
2.Ответьте устно на вопросы для закрепления теоретического материала к практическому занятию.
3.Выполните задания.
4.Запишите вывод о проделанной работе, отразите, на сколько успешно Вы справились с учебными задачами практического занятия и реализованы ли образовательные результаты, заявленные во ФГОС третьего поколения.
Практическое занятие №18 «Расчеты теплового эффекта реакции»
Цели: отработать навыки вычисления теплового эффекта реакции.
Краткое теоретическое обоснование.
Тепловой эффект химической реакции. Термохимические уравнения. Расчеты
теплового эффекта реакции
Абсолютно любая химическая реакция идет либо с поглощением, либо с выделением энергии в виде тепла.
Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного моля реагента или (реже) для моля продукта реакции. Такая величина называется тепловым эффектом реакции.
Тепловой эффект реакции (ΔН) зависит от природы реагирующих веществ, от количества этих веществ и их агрегатного состояния, от температуры.

· экзотермические реакции (+Q) — протекают с выделением энергии (тепла);
· Эндотермические (-Q) — наоборот, поглощают энергию (теплоту).
Если приведен пример реакции горения, то тепловой эффект такой реакции называют теплотой сгорания.
Теплоту сгорания относят к 1 молю вещества
Задание 1. Для получения 56 л (н. у.) углекислого газа, согласно уравнению реакции, необходимо затратить теплоту в количестве
1) 90 кДж
2) 180 кДж
3) 450 кДж
4) 540 кДж
Задание 2. В соответствии с термохимическим уравнением при сгорании 44,8 л этена (н. у.) выделяется теплота в количестве
1) 700 кДж
2) 2800 кДж
3) 2100 кДж
4) 10 500 кДж
Задание 3. Для получения 22,4 г железа, согласно уравнению, потребуется затратить теплоты
1) 4,48 кДж
2) 5,4 кДж
3) 12 кДж
4) 13,5 кДж
Задание 4. При окислении 4,8 г угля до оксида углерода(II), согласно уравнению
![]() ,
,
выделится теплота в количестве
1) 22 кДж
2) 44 кДж
3) 88 кДж
4) 220 кДж
Задание 5. В реакцию, термохимическое уравнение которой
![]()
вступило 8 г оксида магния. Количество выделившейся при этом теплоты равно
1) 102 кДж
2) 204 кДж
3) 20,4 кДж
4) 1,02 кДж
Задание 6. В соответствии с термохимическим уравнением реакции
![]()
количество теплоты, необходимое для разложения 1,7 г нитрата серебра, составляет
1) 31,7 кДж
2) 1,585 кДж
3) 3,17 кДж
4) 15,85 кДж
Задание 7.
![]()
Задание 8.
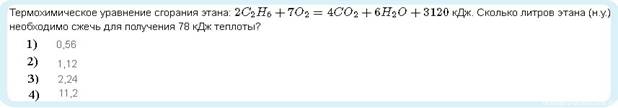
Задание 9.
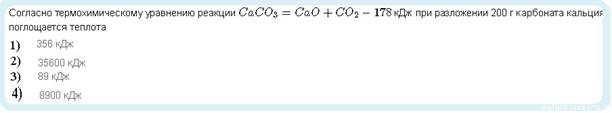
Практическое занятие № 19 «Решение практико-ориентированных заданий на применение принципа Ле-Шателье»
Учебная цель: изучить понятие химического равновесия.
Учебные задачи:
1.Научиться решать задачи на смещение химического равновесия.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен:
иметь практический опыт: решения задач на смещение химического равновесия.
знать: факторы, влияющие на смещение химического равновесия;
уметь: решать задачи на смещение химического равновесия.
Задачи практического занятия:
1. Повторить теоретический материал по теме практического занятия
2. Ответить на вопросы для закрепления теоретического материала.
3. Выполнить задания по теме.
4. Оформить отчет.
Обеспеченность занятия (средства обучения):
7. Сборник методических указаний для студентов по выполнению практических занятий по учебной дисциплине «Химия».
8. Таблица «Периодическая система химических элементов Д.И. Менделеева».
9. Тетрадь для практических занятий в клетку.
10. Карточки – задания.
11. Калькулятор.
12. Ручка.
Краткие теоретические и учебно-методические материалы
по теме практического занятия
Химическая система находится в состоянии равновесия когда скорости прямой и обратной реакции равны. В равновесной системе за любой промежуток времени образуется столько же молекул, сколько их распадается, поэтому, концентрации исходных веществ и продуктов реакции не изменяются с течением времени.
Система будет находиться в состоянии равновесия до тех пор, пока не изменятся внешние условия. При изменении внешних условий произойдет изменение скоростей прямой и обратной реакции, что неизбежно приведет к "перекосу" в ту или иную сторону.
Согласно принципу Ле-Шателье, - если на систему, находящуюся в равновесии, оказать воздействие, то в результате протекающих процессов равновесие сместится в таком направлении, чтобы оказанное воздействие уменьшилось.
Нарушить равновесие системы можно изменением:
концентрации веществ, участвующих в реакции - равновесие системы смещается в сторону расхода вещества, концентрация которого увеличилась или в сторону образования вещества, концентрация которого уменьшилась;
давления - изменения объёма системы - при уменьшении давления (увеличении объема) равновесие смещается в сторону увеличения числа молекул газов и при увеличении давления (уменьшении объема) равновесие смещается в сторону уменьшения числа молекул газов;
температуры - при увеличении температуры равновесие смещается в сторону эндотермической реакции; при уменьшении температуры - в сторону экзотермической реакции.
Вопросы для закрепления теоретического материала к практическому занятию
6. Что такое химическое равновесие.
7. Какие факторы влияют на смещение химического равновесия.
Задания для практического занятия:
Ответьте на задания, выбрав карточку под номером…(по указанию учителя).
Карточка № 1.
1. В замкнутый сосуд поместили 6 моль H2 и 3 моль O2. Через некоторое время установилось равновесие 2H2(г) + O2(г) =2H2O (г) и образовалась вода химическим количеством 1,5 моль. Как изменилось давление в сосуде к моменту установления равновесия?
2.
Химическое равновесие в реакции ![]() смещается
в сторону образования продукта реакции при
смещается
в сторону образования продукта реакции при
1) понижении давления
2) повышении температуры
3) добавлении катализатора
4) добавлении водорода.
Карточка № 2.
1. В гомогенной системе установилось равновесие: 2SO2+O2 ↔ 2SO3
Равновесные химические количества (моль) SO2, O2 и SO3 соответственно равны 0,1, 0,2 , 0,6. Определите исходные химические количества SO2 и O2.
2.
Равновесие ![]() смещается
в сторону исходных веществ при
смещается
в сторону исходных веществ при
1) уменьшении давления
2) нагревании
3) введении катализатора
4) добавлении водорода
Карточка № 3.
1. Равновесные молярные концентрации СO, O2 и CO2 после установления равновесия 2CO(г) + O2(г) = 2CO2(г) равны 0,3; 0,2 и 0,1 (моль/дм3) соответственно. Рассчитайте объемную долю кислорода в исходной газовой смеси (исходная молярная концентрация CO2 равна нулю).
2. Куда будет смещаться равновесие системы с увеличением температуры?
N2+O2 ↔ 2NO-108,5 кДж
N2+3H2 ↔ 2NH3+88 кДж
Инструкция по выполнению практического занятия
Задача 1. Равновесные молярные концентрации СO, O2 и CO2 после установления равновесия 2CO(г) + O2(г) = 2CO2(г) равны 0,3; 0,2 и 0,1 (моль/дм3) соответственно. Рассчитайте объемную долю кислорода в исходной газовой смеси (исходная молярная концентрация CO2 равна нулю).
Решение
1)Записываем уравнение 2СО(г) + O2(г) =2СO2(Г)
2)Вносим в таблицу значение равновесных молярных концентраций веществ.
|
|
СО |
O2 |
СО2 |
|
Было |
0,4 |
0,25 |
--- |
|
Израсходовано |
0,1 |
0,05 |
--- |
|
Стало |
0,3 |
0,2 |
0,1 |
3)По уравнению находим молярные концентрации
прореагировавших угарного газа СО и кислорода: cпрор(CO)=c(CO2)=0,1моль/дм3,
спрор(О2)=![]() =
=
![]() =0,05 (моль/дм3).
=0,05 (моль/дм3).
4)Затем находим исходные молярные концентрации угарного газа и кислорода:
сисх(CO)= cпрор(CO) + cравн (СО) =0,3+0,1=0,4 (моль/дм3); сисх(О2)= спрор(О2)+ сравн(О2)=0,2+0,05=0,25 (моль/дм3).
5) Находим мольную долю кислорода в смеси, которая будет равна объёмной доле: если предположить, что объём смеси равен 1 дм3, то n(O2)=0,25 моль, n(CO)=0,4 моль, мольная доля равна
ᵡ(О2) = ᵠ = ![]() =
=![]() = 0,385.
= 0,385.
Ответ: ᵡ (О2)=0,385.
Задача 2. ![]()
Порядок выполнения отчёта по практическому занятию
1.В тетради для практических занятий напишите номер, название и учебную цель занятия.
2.Ответьте устно на вопросы для закрепления теоретического материала к практическому занятию.
3.Выполните задания.
4.Запишите вывод о проделанной работе.
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №20 «Решение практико-ориентированных расчётных заданий на растворы»
Цель: обобщить знания о растворах, способах выражения их концентрации. Методическое и материально-техническое обеспечение:
Ход работы:
Теоретическая часть
Понятие о растворах
Концентрацией раствора называется весовое содержание растворённого вещества в
определённом весовом количестве или в определённом объёме раствора.
В химии применяют следующие способы выражения концентрации раствора:
процентная, молярная, моляльная и нормальная.
Процентная концентрация выражается числом граммов растворённого вещества,
содержащимся в 100 г. раствора. Например, 20%-ный раствор поваренной соли – это раствор, в 100 г. которого содержится 20 г. соли и 80 г. воды.
Молярная концентрация выражается количеством молей растворённого вещества,
содержащимся в 1 л. раствора. Раствор, содержащий 1 моль растворённого вещества в литре, называется одномолярным (1 М раствор), содержащий 0,1 моля, называется децимолярным (0,1 М раствор).
Моляльная концентрация – концентрация растворённого вещества в молях на 1000 г. растворителя.
Нормальная концентрация выражается числом грамм-эквивалентов растворённого вещества, содержащимся в 1 л. 1 г-экв. растворённого вещества, называется одномолярным (1 н. раствор), содержащий 0,1 г-экв. в 1 л. называется децинормальным (0,1 н. раствор).
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №21 «Решение практико-ориентированных заданий на дисперсные системы
Цель: получить дисперсные системы и исследовать их свойства, научиться готовить суспензию и эмульсию; решать задачи на определение массовой доли компонентов смеси и примесей.
Оборудование и реактивы: карбонат кальция, масло, вода, химический стакан, стеклянные палочки, мука, желатин, фонарик.
Теоретические сведения
Чистые вещества в природе встречаются очень редко, чаще всего встречаются смеси. Смеси разных веществ в различных агрегатных состояниях могут образовывать гомогенные (растворы) и гетерогенные (дисперсные) системы.
Дисперсными называют гетерогенные системы, в которых одно вещество - дисперсная фаза (их может быть несколько) в виде очень мелких частиц равномерно распределено в объеме другого - дисперсионной среде.
Среда и фазы находятся в разных агрегатных состояниях – твердом, жидком и газообразном. По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся 2 группы:
· грубодисперсные (взвеси) с размерами частиц более 100 нм. Это непрозрачные системы, в которых фаза и среда легко разделяются отстаиванием или фильтрованием. Это эмульсии, суспензии, аэрозоли.
· тонкодисперсные - с размерами частиц от 100 до 1 нм. Фаза и среда в таких системах отстаиванием разделяются с трудом. Это золи (коллоидные растворы "клееподобные") и гели (студни).
Коллоидные системы прозрачны и внешне похожи на истинные растворы, но отличаются от последних по образующейся “светящейся дорожке” – конусу при пропускании через них луча света. Это явление называют эффектом Тиндаля.
При определенных условиях в коллоидном растворе может начаться процесс коагуляции. Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок. При этом коллоидный раствор превращается в суспензию или гель.
Гели или студни представляют собой студенистые осадки,
образующиеся при коагуляции золей. Со временем структура гелей нарушается
(отслаивается) – из них выделяется вода. Это явление синерезиса. Посмотрите
учебный фильм «Дисперсные системы» используя ссылку https://youtu.be/LVFLbTowgsY или qr-код
Ход работы
Начертите таблицу для оформления опытов.
|
Название опыта |
Наблюдения |
Выводы |
Задание 1. Приготовление суспензии карбоната кальция в воде и изучение ее свойств.
В стеклянную пробирку влить 4-5 мл воды и всыпать 1-2 ложечки карбоната кальция. Пробирку закрыть резиновой пробкой и встряхнуть пробирку несколько раз. В наблюдениях отметьте внешний вид и видимость частиц, способность осаждаться и способность к коагуляции.
Ссылка и qr-код для просмотра видеоопыта https://youtu.be/8n7UFzWQ-wI

Задание 2. Приготовление эмульсии масла в воде и изучение ее свойств.
В стеклянную пробирку влить 4-5 мл воды и 1-2 мл масла, закрыть резиновой пробкой и встряхнуть пробирку несколько раз. В наблюдениях отметьте внешний вид и видимость частиц, способность осаждаться и способность к коагуляции.
Ссылка и qr-код для просмотра видеоопыта https://youtu.be/8n7UFzWQ-wI 
Задание 3. Приготовление коллоидного раствора и изучение его свойств.
В стеклянный стакан с горячей водой внести 1-2 ложечки муки (или желатина), тщательно перемешать. Пропустить через раствор луч света фонарика на фоне темной бумаги. В наблюдениях отметьте внешний вид и видимость частиц, способность осаждаться и способность к коагуляции. Наблюдается ли эффект Тиндаля?
Ссылка и qr-код для просмотра видеоопыта https://youtu.be/pCrD2Zs9Ipg

Общий вывод
Контрольные задания
Решите тест
1. Дисперсная система это:
а) гомогенная система б) гетерогенная система в) верно а и б
2. Туману соответствует дисперсная система: а) ж/г б) ж/ж в) г/ж
3. Нефти соответствует дисперсная система: а) ж/г б) ж/ж в) г/ж
4. Зубной пасте соответствует дисперсная система: а) т/г б) т/т в) т/ж
5. Сплавам соответствует дисперсная система: а) ж/г б) т/т в) г/ж
6. Из перечня выберите лишнее слово и подчеркните его: гель, суспензия, золь
7. Из перечня выберите лишнее слово и подчеркните его: золь, суспензия, аэрозоль
8. Что объединяет данные слова: мармелад, зефир, холодец
Ответ запишите в виде одного слова__________________________
9. Что объединяет данные слова: молоко, нефть, подсолнечное масло в воде.
Ответ запишите в виде одного слова__________________________
10. Что объединяет данные слова: лак для волос, дезодорант, пылевое облако.
Ответ запишите в виде одного слова__________________________
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №22. «Приготовление растворов с заданной концентрацией»
Цель работы: научиться взвешивать вещества; приготовить раствор соли заданной концентрации.
Оборудование и реактивы: стакан химический, стеклянная палочка, измерительный цилиндр, весы с разновесами, кристаллический хлорид натрия, вода.
Теоретические вопросы:
Ход работы
Задание 1. Рассчитайте, какую массу хлорида натрия и какой объем воды надо взять для приготовления 150 г 3 % раствора хлорида натрия.
Задание 2. Приготовьте раствор согласно задания 1.
1. Приведите в равновесие чашечки весов.
2. Отвесьте рассчитанную массу соли.
3. С помощью мензурки отмерьте рассчитанный объем воды.
4. В химическом стакане растворите соль в воде, перемешивая раствор стеклянной палочкой.
Задание 3. Добавьте к полученному раствору 150 г. воды.
1. Рассчитайте, как при этом изменится концентрация раствора (массовая доля растворенного вещества).
2. Запишите в тетрадь необходимые расчеты, сделайте по итогам работы вывод.
Контрольные вопросы
1. Вычислите массу гидроксида натрия и воды, которые требуются для приготовления 5кг 10%-ого раствора?
2. Определите массу азотной кислоты, которая содержится в 250мл её раствора с массовой долей растворенного вещества 20% (плотность азотной кислоты составляет 1, 115г/мл)
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ № 23 «Решение задач на приготовление растворов».
Цель: углубить и обобщить знания о растворах, способах выражения их концентрации, освоить расчеты и методику приготовления растворов.
Методическое и материально-техническое обеспечение:
Ход работы:
Теоретическая часть
Растворы играют важную роль в живой и неживой природе, а также в науке и технике. Большинство физиологических процессов в организмах человека, животных и растений, различных промышленных процессов, биохимических процессов в почвах и т.п. протекают в растворах.
Раствор – это гомогенная многокомпонентная система, в которой одно вещество распределено в среде другого или других веществ.
Растворы могут быть в газообразном, жидком и твердом агрегатных состояниях.
Масса раствора может быть вычислена по формуле:
mp-pa= mp.в. + mp-ля
Для выражения состава раствора используют количественные характеристики растворов или концентрации. Существуют разные способы выражения концентрации растворов:
w = mр.в./ mр-ра ·100%,
где mр.в - масса растворенного вещества,
mр-ра – масса раствора, г.
Массовая доля растворенного вещества, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора, (измеряется в %, поэтому ее называют процентная концентрация).
Массовая доля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %).
См = nв-ва/Vр-ра = m в-ва / М·Vр-ра
где m – масса растворенного вещества, г;
М – молярная масса, г/моль;
V - объем раствора, мл.
Молярная концентрация вещества показывает количество моль вещества в 1л раствора, (измеряется в моль/л).
Например, См =1моль/л = 1М (одномолярный раствор)
Решение задач с изменением концентрации растворов
При решении задач с изменением концентрации растворов необходимо помнить, что характеристики (m, V, w и пр.) даны для разных растворов: исходного и полученного.
Важно не перепутать эти характеристики между собой. Поэтому рекомендуется обозначать растворы цифрами 1,2,3 и ставить соответствующие индексы у величин.
Например, масса первого раствора будет записана так: m1р-ра, а массовая доля вещества во втором растворе: w2.
Если решение таких задач вызывает у вас трудности, то попытайтесь себе представить этот процесс (упаривание, разбавление, и пр.) с помощью схематичного рисунка.
Решение задач на упаривание растворов
При решении данного типа задач, следует помнить, что в большинстве случаев испаряется вода, и, следовательно, уменьшается масса полученного раствора. Масса вещества, как правило, остается неизменной.
Решение задач на концентрирование растворов (добавление вещества)
При решении таких задач важно понимать, что при добавлении вещества концентрация раствора увеличивается, то есть масса вещества в полученном растворе = масса вещества в исходном растворе + масса добавленного вещества.
Решение задач на разбавление растворов
При решении задач данного типа следует помнить, что масса растворенного вещества остается неизменной, изменяется лишь масса растворителя и, соответственно, масса всего раствора.
Практическая часть
Вариант 1
Задание 1. Сколько граммов хлорида натрия требуется для приготовления раствора массой 300г с массовой долей NaCl 10%?
Задание 2. Сколько граммов карбоната калия содержится в 0,2М растворе объемом 250мл?
Задание 3. Какой объем газа образуется при взаимодействии 250г 30% раствора серной кислоты с цинком?
Задание 4. Определите молярную концентрацию раствора, в 3-х литрах которого содержится 27г Na2CO3.
Задание 5. Сколько граммов воды надо испарить из 800 г 15%-го раствора вещества, чтобы увеличить его массовую долю на 5%?
Вариант 2
Задание 1. Сколько граммов хлорида бария требуется для приготовления раствора массой 500г с массовой долей ВаCl210%?
Задание 2. Сколько граммов карбоната натрия содержится в 0,5М растворе объемом 250мл?
Задание 3. Какой объем газа образуется при взаимодействии 500г 70% раствора серной кислоты с магнием?
Задание 4. Сколько граммов NaCl и воды нужно взять, чтобы приготовить 300г физиологического раствора, массовая доля соли в котором составляет 0,9%
Задание 5. К 200г 15-%-ного раствора хлорида натрия добавили 40 г воды. Определите массовую долю соли в полученном растворе.
3. Оформление отчета:
Отчет должен содержать:
- тему работы;
- цель работы;
- задание;
- вывод.
4. Вопросы по теме практического занятия:
4.1.Объяснить, какие существуют способы выражения концентрации раствора?
4.2. Объяснить, как определить массовую долю растворенного вещества, в каких единицах она выражается?
4.3. Объяснить, какой раствор называется молярным.
4.4.Объяснить, каким образом можно перевести ненасыщенный раствор в насыщенный раствор.
4.5. Вычислить массовую долю вещества в 200 г раствора, образованного при растворении 40 г соли в воде.
Практическое занятие №24 «Идентификация неорганических веществ».
Цель работы: с помощью характерных реакций распознать предложенные
неорганические вещества, определить качественный состав почвы.
Оборудование: штатив с пробирками, спиртовка, спички, держатель для пробирок.
Реактивы: растворы: хлорида аммония, сульфата натрия, гидроксида натрия, хлорида бария, соляной кислоты; синяя лакмусовая бумага, цинк, нитрат серебра.
Ход работы:
|
Что брл(а) и делал(а) |
Уравнения |
Наблюдения |
Вывод |
|
|
|
|
|
2. Выполнить опыты
3. Заполнить таблицу.
4. Сделать общий вывод.
Опыт Качественные реакции на неорганические вещества.
Задание: в трех пронумерованных пробирках (1, 2, 3) даны вещества:
ХЛОРИД АММОНИЯ
СОЛЯНАЯ КИСЛОТА
СУЛЬФАТ НАТРИЯ
С помощью характерных реакций распознать, в какой из пробирок находятся данные вещества
Для выполнения данного опыта содержимое каждой пронумерованной пробирки разделить на три пробы.
1. Для определения хлорида аммония – в пробирку с хлоридом аммония прилить раствор гидроксида натрия, нагреть в пламени спиртовки.
? Что наблюдаете?
Написать уравнение реакции в молекулярной, полной ионной, сокращенной ионной формах.
2. Для определения соляной кислоты - в пробирку с соляной кислотой прилить раствор нитрата серебра.
? Что наблюдаете?
Написать уравнение реакции в молекулярной, полной ионной, сокращенной ионной формах.
3. Для определения сульфата натрия - в пробирку с сульфатом натрия прилить раствор хлорида бария.
? Что наблюдаете?
4. Написать уравнение реакции в молекулярной, полной ионной, сокращенной ионной формах.
Практическое занятие № 25
«Проведение качественных реакций на белки. Денатурация белков»
Цели:
Ø Повторить и закрепить знания о белках;
Ø Закрепить умения и навыки пользоваться химическими реактивами, записывать уравнения проведённых химических реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приёмами сравнения, обобщения, делать выводы.
Оборудование: пробирки, штатив для пробирок, сухое горючее, спички, держатель для пробирок.
Реактивы: раствор куриного белка, раствор гидроксида натрия, раствор сульфата меди (II), концентрированная азотная кислота, ацетат свинца.
Ход работы:
1. Биуретовая реакция (на пептидные связи).
Влейте в пробирку 2-3 мл раствора белка и добавьте несколько миллилитров раствора гидроксида натрия, а затем немного раствора сульфата меди (II).
2. Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца).
В пробирку налейте 2-3 мл раствора белка и добавьте 0,5-1 мл концентрированной азотной кислоты. (Осторожно!). Нагрейте.
3. Цистеиновая реакция (на остатки аминокислот, содержащих серу).
В пробирку налей 2-3 мл раствора белка, добавьте несколько миллилитров раствора гидроксида натрия и немного ацетата свинца.
4. Денатурация белков.
К 3-4 мл раствора белка в воде добавьте несколько капель раствора медного купороса (сульфата меди (II)). Что наблюдаете?
Реклама
|
Денатурирующие агенты |
Особенности действия реагента |
|
Высокая температура (выше 60°С) Кислоты и щелочи Мочевина Спирт, фенол, хлорамин Соли тяжелых металлов |
Разрушение слабых связей в белке Изменение ионизации ионогенных групп, разрыв ионных и водородных связей Разрушение внутримолекулярных водородных связей в результате образования водородных связей с мочевиной Разрушение гидрофобных и водородных связей Образование нерастворимых солей белков и ионов тяжелых металлов |
Задания:
1. Как можно доказать наличие белков в пище?
2. Какова сущность цветных реакций белков?
3. Оформить работу в форме таблицы
|
Что брл(а) и делал(а) |
Уравнения |
Наблюдения |
Вывод |
|
|
|
|
|
Практическое занятие №26
«Качественные реакции на органические вещества»
Цели:
Ø систематизировать и обобщить знания о качественных реакциях на органические соединения.
Ø Закрепить умения и навыки пользоваться химическими реактивами, записывать уравнения проведённых химических реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приёмами сравнения, обобщения, делать выводы.
Ход работы:
Опыт 1. Качественная реакция на многоатомные спирты.
Взаимодействие глицерина СН2 – СН – СН2 с гидроксидом меди (II)
| | |
ОН ОН ОН
Оборудование и реактивы: штатив с пробирками, растворы глицерина, гидроксида натрия, сульфата меди.
В пробирку налейте 3-4 капли 2% раствора сульфата меди (II) и 2-3мл 10 % раствора гидроксида натрия до выпадения осадка. Осадок взболтайте и его половину перенесите в другую пробирку. К одной порции осадка добавьте несколько капель глицерина и встряхните до исчезновения осадка. Сравните окраску раствора с окраской осадка гидроксида меди (II) в другой пробирке.
Запишите свои наблюдения: _________________________________________________
Опыт 2. Качественная реакция на этиловый спирт. Йодоформная проба.
В пробирку налить 1мл этилового спирта и добавить 1мл раствора йода (раствора Люголя), а затем по каплям раствор гидроксида натрия. Раствор в пробирке сначала светлеет, а затем выпадает осадок йодоформа. Если нагреть полученный осадок в пламени спиртовки, то он растворяется, если охладить в стакане с холодной водой, то осадок снова выпадает. Данная реакция позволяет определять даже малые количества этилового спирта в растворах.
Опыт 3. Окисление этилового спирта и получение уксусного альдегида
Оборудование и реактивы: штатив с пробирками, этанол 95%, медная спираль.
В пробирку наливают 2мл этилового спирта. Накаливают медную спираль в пламени спиртовки, чтобы медь покрылась черным налетом оксида, затем быстро опускают ее в пробирку со спиртом. Данную операцию повторяют несколько раз. Обратите внимание на запах образующегося альдегида и на изменения, происходящие со спиралью.
Запишите наблюдения и напишите:
1. Уравнение окисления меди при нагревании: Сu + O2 =
2. Уравнение окисления спирта: С2Н5 – ОН + СuO =
Опыт 4. Качественные реакции на фенол С6Н5ОН
Оборудование и реактивы: пробирка, пипетка, раствор фенола, йодная вода- I2, раствор хлорида железа (III)- FeCl3.
а) Взаимодействие фенола с йодной водой
К 1млраствора фенола по каплям добавляют йодную воду. Сначала происходит обесцвечивание каждой капли реагента, а затем появляется белая муть – образуется аморфный осадок 2,4,6-трибромфенола
Напишите уравнение реакции: _______________________________________________
б) Взаимодействие фенола с хлоридом железа (III)
К 2-3мл раствора фенола по каплям добавляют раствор хлорида железа (III). Появляется интенсивное фиолетовое окрашивание. Реакция основана на образовании комплексного фенолята железа (III), сильно диссоциированного в воде
6С6 Н5 - ОН + FeCl3 → Fe (- О - С6 Н5 )6]3- + 3Сl- + 6H+
Опыт №5. Качественные реакции на восстанавливающие углеводы (глюкоза).
Оборудование и реактивы: пробирки, спиртовка, пробиркодержатель, растворы глюкозы - СбН12Об, сульфата меди (II), гидроксида натрия, нитрата серебра, сахарозы- С12Н22О11.
а) Взаимодействие глюкозы с с гидроксидом меди (II)
В пробирку налейте 3-4 капли 2% раствора сульфата меди (II) и 2-3мл 10 % раствора гидроксида натрия до выпадения осадка. К полученному осадку приливают равный объем раствора глюкозы. Содержимое пробирки встряхивают. Наблюдают растворение осадка и образование ярко-синего раствора сахарата меди (II). Это качественная реакция на многоатомные спирты.
Затем содержимое пробирки нагревают в пламени спиртовки и наблюдают выпадение сначала желтого, а затем кирпично-красного осадка. Это качественная реакция на альдегиды.
б) Реакция «серебряного зеркала глюкозы.
К 2мл аммиачного раствора оксида серебра, налитого в чистую пробирку, добавляют в два раза меньший объем раствора глюкозы - 1мл. Смесь осторожно нагревают на пламени спиртовки (равномерно и медленно) Наблюдают серебряное зеркало на стенках пробирки.
в) Взаимодействие сахарозы с гидроксидом меди (II)
В пробирке смешивают 2мл раствора сахарозы и 2мл раствора гидроксида натрия. Затем по каплям добавляют раствор сульфата меди (II), образующийся вначале голубой осадок гидроксида меди (II) при встряхивании растворяется, образуя синий раствор сахарата меди (II).
Если нагреть полученный раствор в пламени спиртовки до начала кипения, то видимых изменений (в отличие от раствора глюкозы) не наблюдается, поскольку сахароза относится к не восстанавливающим сахарам.
Опыт №6. Качественная реакция на крахмал
Оборудование и реактивы: пробирки; спиртовка; крахмальный клейстер, спиртовой раствор йода.
В пробирку наливают 2мл крахмального клейстера, разбавляют водой и добавляют каплю спиртового раствор йода.
Запишите свои наблюдения:
______________________________________________________________________________
Смесь нагрейте в пламени спиртовки. Запишите свои наблюдения: _________________
Опыт №7. Воспламенение целлюлозы
Оборудование и реактивы: фарфоровая чашка, пипетка, кристаллический перманганат калия KMnO4, концентрированная серная кислота – H2SO4, хлопковая вата.
В фарфоровую чашку помещают 2-3г кристаллического перманганата калия и пипеткой добавляют несколько капель концентрированной серной кислоты. Получается полужидкая кашица. В нее бросают кусочек ваты, который тотчас воспламеняется.
Практическое занятие № 27 «Поиск и анализ кейсов о применении химических веществ и технологий с учетом будущей профессиональной деятельности»
Темы: важнейшие строительные материалы, конструкционные материалы, краски, стекло, керамика, материалы для электроники, наноматериалы, текстильные волокна, источники энергии, органические и минеральные удобрения, лекарственные вещества, бытовая химия».
Учебная цель: изучить материалы о применении химических веществ и технологий с учетом будущей профессиональной деятельности по темам: важнейшие строительные материалы, конструкционные материалы, краски, стекло, керамика, материалы для электроники, наноматериалы, текстильные волокна, источники энергии, органические и минеральные удобрения, лекарственные вещества, бытовая химия.
Учебные задачи:
1.Научиться искать и анализировать кейсы о применении химических веществ и технологий с учетом будущей профессиональной деятельности.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Студент должен:
иметь практический опыт: поиска и анализа кейсов о применении химических веществ и технологий с учетом будущей профессиональной деятельности.
знать: материалы о применении химических веществ и технологий с учетом будущей профессиональной деятельности по темам: важнейшие строительные материалы, конструкционные материалы, краски, стекло, керамика, материалы для электроники, наноматериалы, текстильные волокна, источники энергии, органические и минеральные удобрения, лекарственные вещества, бытовая химия;
уметь: искать и анализировать кейсы.
Задачи практического занятия:
1. Выполнить задания по теме.
2. Оформить отчет в виде презентации.
Обеспеченность занятия (средства обучения):
1. Сборник методических указаний для студентов по выполнению практических занятий по учебной дисциплине «Химия».
2. Сайты Интернета.
3. Карточки – задания.
Задания для практического занятия:
Ответьте на задания, выбрав карточку под номером (по указанию учителя).
Карточка № 1.
Существуют различные виды материалов для строительства объектов и возведения разных сооружений. Их возводят с помощью силикатных блоков, дерева, по технологии монолитного бетонного строительства, применяют быстровозводимые методики ЛСТК. Но, несмотря на этот огромный выбор, кирпич не уступает своих позиций даже самым современным и инновационным материалам. Его применяют для создания частных домовладений, многоквартирных и загородных домов, офисных, производственных и складских объектов, административных и медицинских зданий, а также других. Кроме того, из кирпича нередко создают функциональные сооружения, например, стойки для заборов, различные беседки, мангальные зоны, обустраивают места для отдыха и прочее. В чем же его преимущества? Виды кирпичей, их особенности.
Карточка № 2.
Асфальт состоит главным образом из песка и битума. Битум (похож на черную смолу) – это один из продуктов, которые получают из нефти. Для строительства одного километра асфальтовой дороги требуется столько битума, сколько получается из 320 баррелей нефти. Нефть стоит дорого. А если нужно построить, например, 87 тысяч километров асфальтовых дорог, расходы на битум “влетят” в немаленькую копеечку.
У битума есть еще один нежелательный эффект: этот материал опасен для окружающей среды.
Как, по - другому скрепить между собой песчинки, чтобы получить дешевое и безопасное для природы асфальтоподобное дорожное покрытие?
Карточка № 3.
В 1825 году был получен металл, который ценился дороже золота. Погремушка сыны Наполеона III была изготовлена из этого металла, а самый богатый королевский двор Европы имел столовые приборы, изготовленные из этого металла. По распространённости в природе он занимает четвёртое место среди всех элементов и первое среди металлов (8,8% от массы земной коры). Он стал вторым по значению металлом XX века после железа. Кстати, по объёму производства он занимает второе место в мире после выплавки чугуна и стали. Он входит в состав различных пиротехнических смесей.
– О каком металле идёт речь?
– Каково положение этого металла в Периодической системе химических элементов Д. И. Менделеева.
– Каково строение атома этого металла?
– Какими физическими свойствами он обладает?
– В какие химические реакции вступает это вещество и какие вещества при этом образуются? Напишите уравнения возможных реакций и назовите продукты реакций.
– Почему при обычных условиях изделия из этого металла устойчивы к воздействию факторов окружающей среды?
– Почему до конца XIX века этот металл был на вес золота?
– На каких свойствах этого металла основано его применение в народном хозяйстве?
– Почему посуду из этого металла называют посудой бедняков?
Карточка № 4.
Серовато – белый порошок энергично взаимодействует с водой с выделением большого количества тепла и называется негашеной известью. Это вещество находит широкое применение в строительстве, химической промышленности, сельском хозяйстве, металлургии, водоочистке.
– Назовите это вещество.
– К какому классу соединений относится данное вещество?
– Каков качественный и количественный состав этого вещества?
– Какие вещества образуются при взаимодействии негашеной извести с кислотными оксидами, с кислотами? Запишите уравнения возможных реакций и назовите продукты реакций.
– Что образуется при взаимодействии негашеной извести с водой? Составьте уравнение реакции.
– Почему эту реакцию называют гашением?
Карточка № 5.
Составьте бизнес-проект по технической химии. В Вашем распоряжении имеется сырье – известняк. Ваша задача – создать новое производство на имеющемся сырье, показать возможности создания других производств. Отразить применение, общие принципы и методы производства, схему производства (реакционный аппарат), указать химические реакции. Слайды должны раскрыть содержание следующим образом: 1-ый слайд – Источник сырья, месторождение, доставка (карта, путь); 2-ой слайд – сырье, его подготовка, характеристика; 3-ий слайд - схема технологического процесса (упрощенная); принципы производства; 4-ый слайд – химические реакции (механизмы, если возможно); 5-ый слайд – аппараты, оборудование; 6-ой слайд – готовая продукция, характеристика; 7-ой слайд – применение готовой продукции, пути; 8-ой слайд – проблемы охраны среды; техника безопасности; 9-ый слайд – исторические факты, персоналии, портреты (при возможности); 10-ый слайд – литературные источники, в том числе, ссылки на сайты. 11 слайд – по усмотрению. Название – не входит в счет слайдов.
Карточка № 6.
В 1862 году в Лондоне состоялась международная выставка, на которой кроме технических новинок демонстрировались химические процессы и продукты. Среди последних демонстрировалось странное неприятное вещество, вдобавок обладающее неприятным запахом.
О каком веществе идет речь?
Почему оно удостоилось международной выставки?
Имена каких ученых связаны с этим веществом?
Карточка № 7.
Вам выданы образцы воды, взятой из разных источников (они указаны на этикетках). Предположительно в них содержатся ионы: Fe2+, Fe3+, Zn2+, Cu2+, Pb2+. Составьте план их определения. Предложите способы очистки воды от этих ионов. Каковы будут ваши действия, если концентрация указанных ионов в образцах будет слишком высокой (значительно превышать ПДК)?
Карточка № 8.
Космический корабль совершил аварийную посадку на неизвестную планету. Одному из космонавтов было предложено определить состав атмосферы, но в его распоряжении оказались лишь яблоко (не произошло изменения цвета на разрезе), немного известковой воды (не мутнела в атмосфере планеты) и малахитовая шкатулка, при нагревании кусочка малахита образовался красный порошок.
К какому выводу пришел космонавт?
Карточка № 9.
Жиры – смесь сложных эфиров, образованных глицерином и жирными кислотами. М.Э Шеврель посвятил изучению жиров 14 лет. В 1808 году к нему обратился владелец текстильной фабрики с просьбой изучить состав мягкого мыла, получаемого на фабрике. Шеврель установил, что мыло – натриевая соль высшей жирной кислоты. Шеврель изготовлял мыла из жиров различных животных, выделял из них жирные кислоты. Так были впервые получены стеариновая, олеиновая, капроновая кислоты. Шеврель показал, что жиры состоят из глицерина и жирных кислот, причем это не только их смесь, а соединение, которое, присоединяя воду, распадается на глицерин и жирные кислоты.
Карточка № 10.
В начале XX века из Нью-Йоркского порта вышли в открытый океан красавица-яхта. Её владелец, американский миллионер, не пожалел денег, чтобы удивить свет. Корпус был сделан из очень дорогого в то время алюминия, листы которого скреплялись медными заклепками. Это было красиво-сверкающий серебристым блеском корабль, усеянный золотистыми головками заклепок! Однако через несколько дней обшивка корпуса начала расходиться, и яхта пошла быстро ко дну.
1. Что же случилось с яхтой? Предложите свой способ спасения яхты.
2.Исследуйте свою квартиру, дом и установите, где использованы антикоррозионные покрытия. Постройте классификацию антикоррозионных покрытий на основании областей их применения.
3. Найдите дополнительную информацию о коррозии и способах борьбы с ней.
Инструкция по выполнению практического занятия
Требования к оформлению отчёта по практическому занятию
1.Продумайте план презентации заранее. Не забывайте об обязательных разделах:
- Титульная страница (первый слайд);
- Введение;
- Основная часть презентации (обычно содержит несколько подразделов);
- Заключение.
2.Оформление презентации
Соблюдайте единый стиль оформления. Избегайте стилей, которые будут отвлекать от самой презентации. Если выбрали для заголовков синий цвет и шрифт «Cambria», на всех слайдах заголовки должны быть синими и Камбрия. Выбрали для основного текста шрифт «Calibri», то всех слайдах придётся использовать его.
3. Цвет фона презентации
На одном слайде рекомендуется использовать не более трех цветов: один для фона, один для заголовка, один для текста. Обратите внимание на цвет гиперссылок (до и после использования). Следите за тем, чтобы текст не сливался с фоном, учитывайте, что на проекторе контрастность будет меньше, чем у вас на мониторе.
Лучший фон – белый (или близкий к нему), а лучший цвет текста – черный (или очень тёмный нужного оттенка). Имейте в виду что, черный цвет фона имеет негативный (мрачный) подтекст. Белый текст на черном фоне читается плохо (инверсия плохо читается).
4.Содержание и расположение текстовой информации, шрифт
Используйте короткие слова и предложения.
Размер шрифта: 24–54 пункта (заголовок), 18–36 пунктов (обычный текст);
Цвет шрифта и цвет фона должны контрастировать (текст должен хорошо читаться), но не резать глаза;
Тип шрифта: для основного текста гладкий шрифт без засечек (Arial, Tahoma, Verdana), для заголовка можно использовать декоративный шрифт, если он хорошо читаем. Всегда указывайте заголовок слайда (каждого слайда презентации). Отвлёкшийся слушатель в любой момент должен понимать, о чём сейчас речь в вашем докладе!
Курсив, подчеркивание, жирный шрифт, прописные буквы рекомендуется использовать только для смыслового выделения фрагмента текста.
Предпочтительно горизонтальное расположение информации. Наиболее важная информация должна располагаться в центре экрана.
Если на слайде имеется картинка, надпись должна располагаться под ней. Избегайте сплошной текст. Лучше использовать маркированный и нумерованный списки.
Помните, что экран, на котором вы будете показывать презентацию, скорее всего, будет достаточно далеко от зрителей. Презентация будет выглядеть меньше, чем на вашем экране во время создания.
Отойдите от экрана компьютера на 2-3 метра и попытайтесь прочесть текст в презентации. Если слайды читаются с трудом, увеличивайте шрифт. Если текст не вмещается на один слайд, разбейте его на 2, 3 и более слайдов (главное, чтобы презентация была удобной для просмотра).
5.Объем информации
Не стоит заполнять один слайд слишком большим объемом информации: люди могут единовременно запомнить не более трех фактов, выводов, определений. Не полностью заполненный слайд лучше, чем переполненный.
Наибольшая эффективность достигается тогда, когда ключевые пункты отображаются по одному на каждом отдельном слайде.
Делайте слайд проще. У аудитории всего около минуты на его восприятие.
Практическое занятие №28 «Анализ проб атмосферного воздуха и его гигиеническое значение»
Цель работы - ознакомление с методикой оценки загрязнения атмосферного воздуха, с методикой расчета предельно-допустимых выбросов, расчета максимально-допустимой концентрации вредных веществ в устье источников образования и минимальной высоты труб и методикой выбора размеров санитарно-защитных зон.
Задание для практической работы:
1. Ознакомиться с теоретической частью;
2. Решить по 1-й задаче из каждого заданий;
3. Ответить на контрольные вопросы и привести основные термины и их определения;
Оформить и сдать преподавателю отчёт по работе.
Требования к отчёту
1. Отчёт должен содержать основные термины, применяемые в данной работе и ответы на все контрольные вопросы.
2. Отчёт должен содержать решение 1-й задачи из каждого задания.
3. Общий вывод по заданию.
Теоретическая часть
При оценке результатов анализа проб атмосферного воздуха необходимо сравнить приведенные в задачах результаты анализов по содержанию каждого химического вещества с их ПДК в атмосферном воздухе. Известно, что для ПДК вредных химических веществ в атмосферном воздухе установлены два норматива: максимально-розовая концентрация (ПДК м.р.) и среднесуточная концентрация (ПДК с.с.).
Величины ПДК загрязняющих веществ в атмосферном воздухе населенных мест приведены в таблице
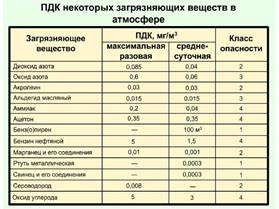
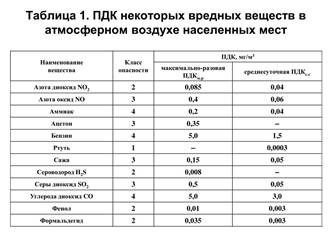
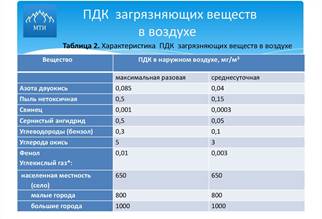

При совместном присутствии в атмосферном воздухе веществ, обладающих совокупным (односторонним) действием, сумма отношений их концентраций к ПДК не должна превышать единицу.
![]()
где, С1, …3, Сn – фактические концентрации веществ в атмосферном воздухе, мг/м3;
ПДК1, …, ПДКn – предельно – допустимые концентрации этих веществ в атмосфере, мг/м3.
Эффектом совокупного (однонаправленного) действия обладают: окись углерода и двуокись азот; сернистый ангидрит и сероводород; сернистый ангидрид и двуокись азота; сернистый ангидрид и окись углерода
Расчётная часть
Задание 1
Задача 1. В пределах жилой застройки города отобрана разовая проба атмосферного воздуха.
Результаты анализа следующие:
Сернистый ангидрид – 1,00 мг/м³
Сажа - 0,30 мг/м³
Пыль - 0,80 мг/м³
Окислы азота - 0,70 мг/м³
Окись углерода - 12,0 мг/м³
Сероводород - 0,008 мг/м³
Задача №2. В пределах жилой застройки города отобрана среднесуточная проба атмосферного воздуха.
Результаты анализов следующие:
Сернистый ангидрид – 0,10 мг/м³
Сажа - 0,04 мг/м³
Пыль - 0,12 мг/м³
Окислы азота - 0,20 мг/м³
Окись углерода - 2,00 мг/м³
Задача №3. В пределах промышленной площадки машиностроительного завода отобрана разовая проба атмосферного воздуха.
Результаты анализов следующие:
Сернистый ангидрид – 0,10 мг/м³
Сажа - 0,04 мг/м³
Пыль - 0,12 мг/м³
Окислы азота - 0,20 мг/м³
Окись углерода - 2,00 мг/м³
Задача №4. В пределах санитарно – защитной зоны машиностроительного завода отобрана среднесуточная проба атмосферного воздуха.
Результаты анализов пробы следующие:
Свинец - 0,001 мг/м³
Хром шестивалентный - 0,002 мг/м³
Мышьяк - 0,005 мг/м³
Задача №5. На границе санитарно – защитной зоны машиностроительного завода и жилой застройки отобрана разовая проба атмосферного воздуха.
Результаты анализов следующие:
Свинец - 0,0005 мг/м³
Хром шестивалентный - 0,001 мг/м³
Задача №6. Максимально – разовые концентрации загрязняющих веществ в приземном слое атмосферы, определяемых в стационарной точке, расположенной на границе санитарно – защитной зоны предприятия, составляют:
Сернистый ангидрид – 0,3 мг/м³
Окись углерода - 2,5 мг/м³
Двуокись азота - 0,07 мг/м³
Пыль - 0,4 мг/м³
![]()
Практическое занятие №29 «Способы выражения концентрации растворов: массовая доля растворенного вещества, молярная концентрации»
Цель: закрепить умения по использованию формул для нахождения молярной концентрации растворов и массовой доли растворенного вещества
Ход занятия.
Решение задач на вычисление концентрации растворов
Для получения оценки удовлетворительно достаточно выполнить первые три задания; для получения оценки хорошо необходимо выполнить четыре задания, для получения оценки отлично необходимо выполнить пять заданий.
С – молярная концентрация раствора.
Молярная концентрация – это отношение количества растворенного вещества к объему раствора
С = n (вещества)/ V(раствора) n (вещества)= m(в-ва)/М(в-ва)
Пример 1. Рассчитайте молярную концентрацию раствора (моль/л) раствора.
|
Дано: m (H2SO4)=14,5 г. V (раствора) = 0,5 л
|
Решение: С = n (вещества)/ V(раствора) n (вещества)= m(в-ва)/М(в-ва)
|
|
Найти: С (H2SO4)- ?
|
1. Находим молярную массу вещества: М (H2SO4)= 2Ar(H)+Ar(S)+4Ar(О)=2*1+32+4*16=98г/моль 2. n (H2SO4)= m(H2SO4 )/М(H2SO4) n (H2SO4)=14,5/98=0,15 моль 3. С (H2SO4)=0,15/0,5=0,3 моль/л Ответ: С (H2SO4)= 0,3 моль/л
|
Задание №1: Выполните по образцу задание своего варианта.
|
Вариант |
Формула вещества |
Масса вещества, г |
Объем раствора, л |
|
1. |
KBrO3 |
12,4 |
0,3 |
|
2. |
KNO3 |
8,5 |
0,4 |
|
3. |
KReO4 |
18,1 |
0,75 |
|
4. |
K2Cr2O7 |
14,7 |
0,75 |
|
5. |
K2GeO3 |
6,3 |
0,65 |
|
6. |
KNCS |
23,9 |
0,8 |
|
7. |
Tl(NO3)3 |
0,91 |
0,25 |
|
8. |
Tl2CO3 |
0,93 |
0,05 |
|
9. |
Tl2SO4 |
54,27 |
5,46 |
|
10. |
ZnSO4 |
25,35 |
1,27 |
|
11. |
CoCl2 |
17,72 |
0,65 |
|
12. |
Fe(NO3)3 |
35,23 |
2,54 |
|
13. |
Cu(NO3)2 |
22,27 |
0,74 |
|
14. |
Fe2(SO4)3 |
44,58 |
3,08 |
|
15. |
Al2(SO4)3 |
6,54 |
0,2 |
|
16. |
TlNO3 |
1,92 |
0,15 |
|
17. |
CH3COONa |
3,03 |
0,1 |
|
18. |
Ca(ClO4)2 |
4,13 |
0,5 |
|
19. |
KAl(SO4)2 |
5,9 |
1,65 |
|
20. |
Na4B4O7 |
12,04 |
3,98 |
|
21. |
CuSO4 |
13,6 |
2,4 |
|
22. |
Na3PO4 |
15,9 |
0,65 |
|
23. |
Fe(NO3)3 |
23,4 |
3,67 |
|
24. |
KMnO4 |
34,9 |
1,45 |
|
25. |
Na2SO4 |
24,7 |
1,55 |
Пример №2. Рассчитайте массовую долю (в %) гидроксида цезия в растворе массой 172 г, если масса растворенной щелочи равна 8,6г.
|
Дано: m (р-ра)=172 г. m (в-ва)=8,6 г |
Решение: W= m (вещества)/ m(раствора)
|
|
Найти: w ( CsOH)- ?
|
1. Находим массовую долю вещества: W=8,6/172=0,05; 5% Ответ: W (H2SO4)= 5% |
Задание №2: Найдите массовую долю вещества в данном растворе:
|
Вариант |
Формула вещества |
Масса раствора, г |
Масса вещества, г |
|
1. |
KOH |
125 |
5 |
|
2. |
H2SO4 |
250 |
15 |
|
3. |
HNO3 |
300 |
25 |
|
4. |
CH3COOH |
200 |
38 |
|
5. |
HCl |
160 |
24 |
|
6. |
NaOH |
235 |
9 |
|
7. |
H3PO4 |
345 |
23 |
|
8. |
H2SO4 |
500 |
134 |
|
9. |
CuSO4 |
127 |
35 |
|
10. |
CuCl2 |
435 |
56 |
|
11. |
Na2SO4 |
238 |
125 |
|
12. |
K2SO4 |
250 |
38 |
|
13. |
BaCl2 |
200 |
40 |
|
14. |
AlCl3 |
190 |
45 |
|
15. |
NaCl |
150 |
50 |
|
16. |
CH3COOH |
145 |
14 |
|
17. |
H2SO4 |
400 |
8,5 |
|
18. |
H3PO4 |
200 |
9,7 |
|
19. |
AlCl3 |
150 |
8 |
|
20. |
Na2SO4 |
125 |
5,8 |
|
21. |
CuSO4 |
110 |
67 |
|
22. |
KOH |
230 |
45 |
|
23. |
NaOH |
180 |
50 |
|
24. |
CuCl2 |
165 |
65 |
|
25. |
BaCl2 |
170 |
70 |
Пример №3. Какая масса серной кислоты, содержится в 400г 12%раствора?
|
Дано: m (р-ра)=400 г. W (H2SO4)=12%; 0,12 |
Решение: W= m (вещества)/ m(раствора) m (вещества)= W m(раствора) |
|
Найти: m (H2SO4)=? |
1. находим массу серной кислоты в растворе: m (H2SO4)= 400×0,12=48г Ответ: m (H2SO4)= 48г
|
Задание №3: Найдите массу вещества в данном растворе:
|
Вариант |
Задание |
|
1. |
Какую массу поваренной соли и воды надо взять, чтобы получить а)100г 10-процентного раствора; б) 200г 15- процентного раствора? |
|
2. |
Сколько граммов соли и воды надо взять, чтобы получить а) 50г 5% раствора соды; б) 20г 2% раствора соды? |
|
3. |
Какая масса серной кислоты содержится в 400г 12% раствора? |
|
4. |
Какая масса соли вводится в организм при вливании 353г физиологического раствора, содержащего 0,85 % по массе поваренной соли? |
|
5. |
Какую массу гидроксида кальция необходимо взять для приготовления 495г с массовой долей 1,5%? |
|
6. |
Какая масса соли растворена в 50 г 0,5 %-ного раствора. |
|
7. |
Какая масса соли растворена в 60 г 1 %-ного раствора |
|
8. |
Какая масса соли растворена в 70 г 2 %-ного раствора |
|
9. |
Какая масса соли растворена в 40 г 0,4 %-ного раствора |
|
10. |
Какая масса соли растворена в 80 г 0,2 %-ного раствора |
|
11. |
Какая масса соли растворена в 90г раствора с массовой долей соли 0,001 |
|
12. |
Какая масса соли растворена в 60 г раствора с массовой долей соли 0,002 |
|
13. |
Какая масса соли растворена в 50 г раствора с массовой долей соли 0,05 |
|
14. |
Какую массу соли и объем воды необходимо взять для приготовления: 70 г раствора с массовой долей соли 0,01 |
|
15. |
Какую массу соли и объем воды необходимо взять для приготовления: 120 г 10 %-ного раствора |
|
16. |
Какую массу соли и объем воды необходимо взять для приготовления: 90 г раствора с массовой долей соли 0,06 |
|
17. |
Какую массу соли и объем воды необходимо взять для приготовления: 150 г 2 %-ного раствора |
|
18. |
Какую массу соли и объем воды необходимо взять для приготовления: 150 г раствора с массовой долей соли 0,004 |
|
19. |
Какую массу соли и объем воды необходимо взять для приготовления: 200 г раствора с массовой долей соли 0,06 |
|
20. |
Какую массу соли и объем воды необходимо взять для приготовления: 140 г раствора с массовой долей соли 0,03 |
|
21. |
Какая масса соли растворена в 400г 13%-ного раствора |
|
22. |
Какая масса соли растворена в 350г 15% -ного раствора |
|
23. |
Какая масса соли растворена в 200г 12%-ного раствора |
|
24. |
Какая масса соли растворена в 80г 5%-ного раствора |
|
25. |
Какая масса соли растворена в 60г 4%-ного раствора |
Пример №4. Смешали 600г 20%-ного и 750г 40%-ного раствора нитрата аммония. Какова массовая доля соли в полученном растворе?
|
Дано: m1 (р-ра)=600г. W1 (NH4NO3 )=20%; m2 (р-ра)=750г. W2 (NH4NO3 )=40%; |
Решение: W= m (вещества)/ m(раствора) W3 (NH4NO3 )= m1( в-ва)+ m2( в-ва) / m1 (р-ра)+ m2 (р-ра) m (вещества)= W×m(раствора) |
|
Найти: W3 (NH4NO3 )= ?
|
1. находим массу нитрата аммония в растворах: m1 (NH4NO3)= 600×0,2=120г m2 (NH4NO3)= 750×0,4=300г 2. находим массовую долю вещества в новом растворе: W3 (NH4NO3 )=(120+300)/(600+750)=0,311; 31,1% Ответ: W3 (NH4NO3 )= 31,1% |
Задание № 4 Рассчитайте массовую долю в растворе при смешивании двух растворов с разной массовой долей вещества.
|
Вариант |
Масса раствора (m1 (р-ра)) |
Массовая доля вещества (W1)%
|
Масса раствора (m2 (р-ра)) |
Массовая доля вещества (W2)%
|
|
1. |
100 |
20 |
50 |
32 |
|
2. |
120 |
15 |
60 |
12 |
|
3. |
110 |
5 |
80 |
15 |
|
4. |
115 |
8 |
90 |
10 |
|
5. |
60 |
10 |
50 |
5 |
|
6. |
75 |
12 |
125 |
20 |
|
7. |
87 |
15 |
300 |
25 |
|
8. |
90 |
17 |
250 |
15 |
|
9. |
45 |
6 |
120 |
30 |
|
10. |
56 |
5 |
100 |
10 |
|
11. |
100 |
35 |
240 |
5 |
|
12. |
150 |
2 |
250 |
25 |
|
13. |
400 |
20 |
150 |
18 |
|
14. |
350 |
25 |
160 |
15 |
|
15. |
200 |
12 |
80 |
5 |
|
16. |
190 |
15 |
30 |
2 |
|
17. |
180 |
15 |
120 |
12 |
|
18. |
125 |
50 |
125 |
10 |
|
19. |
130 |
32 |
400 |
15 |
|
20. |
145 |
22 |
300 |
12 |
|
21. |
155 |
3 |
250 |
25 |
|
22. |
160 |
9 |
140 |
30 |
|
23. |
180 |
10 |
240 |
50 |
|
24. |
190 |
15 |
130 |
23 |
|
25. |
210 |
16 |
140 |
10 |
Задание повышенной сложности
Задание №5: Проведите необходимые вычисления.
Формулы необходимые для вычисления:
W= m (вещества)/ m(раствора)
m (вещества)= W×m(раствора)
m(раствора) = ᴠ×ρ
С=ν/ᴠ
m( Н2О) = m(раствора) - m (вещества)
|
вариант
|
Формула растворенного вещества |
Масса растворенного вещества m(в-ва), г
|
Масса раствора m(р-ра), г |
Масса воды m(H2O) |
Массовая доля вещества ω,% |
Молярная концентрация раствора, См |
Число молей растворенного вещества , моль |
Плотность раствора ρ,г/мл |
|
1. |
NaCl |
|
400 |
|
10 |
|
|
1,0 |
|
2. |
LiBr |
|
|
110 |
|
|
0,2 |
1,0 |
|
3. |
NH4F |
15 |
|
55 |
|
|
|
1,01 |
|
4. |
KF |
|
100 |
|
2 |
|
|
1,0 |
|
5. |
Na2SO4 |
|
|
200 |
|
|
0,4 |
1,0 |
|
6. |
BaCl2 |
10 |
|
120 |
|
|
|
1,0 |
|
7. |
KNO3 |
|
1050 |
|
50 |
|
|
1,0 |
|
8. |
MgCl2 |
|
300 |
|
|
1,2 |
|
1,01 |
|
9. |
NaNO3 |
25 |
|
105 |
|
|
|
1,01 |
|
10. |
LiCl |
|
60 |
|
|
0,5 |
|
1,01 |
|
11. |
NH4NO3 |
|
|
600 |
|
|
2,5 |
1,0 |
|
12. |
CrCl3 |
50 |
|
200 |
|
|
|
1,0 |
|
13. |
FeCl3 |
170 |
|
430 |
|
|
|
1,0 |
|
14. |
FeBr2 |
|
360 |
|
|
|
2,4 |
1,12 |
|
15. |
NaOH |
|
620 |
|
50 |
|
|
1,11 |
|
16. |
LiOH |
|
240 |
|
35 |
|
|
1,2 |
|
17. |
HNO3 |
|
|
150 |
|
|
2 |
1,3 |
|
18. |
HCl |
|
400 |
|
10 |
|
|
1,01 |
|
19. |
H2SO4 |
50 |
|
100 |
|
|
|
1,35 |
|
20. |
HBr |
|
250 |
|
5 |
|
|
1,01 |
|
21. |
KOH |
|
120 |
|
25 |
|
|
1,2 |
|
22. |
AlCl3 |
|
200 |
|
2 |
|
|
1,0 |
|
23. |
Ba(NO3)2 |
130 |
|
270 |
|
|
|
1,0 |
|
24. |
CH3COOH |
|
30 |
|
|
2 |
|
1,1 |
|
25. |
H2SO4 |
|
|
500 |
400 |
|
|
1,15 |
Практическое занятие №30 «Анализ воды на наличие катионов кальция и железа (III) и анионов хлора и сульфат-ионов»
Цели:
Ø Отработать навыки проведения анализа воды на наличие катионов кальция и железа (III) и анионов хлора и сульфат-ионов;
Ø Закрепить умения и навыки пользоваться химическими реактивами, записывать уравнения проведённых химических реакций, соблюдать правила техники безопасности;
Ø Закрепить умения и навыки пользоваться приёмами сравнения, обобщения, делать выводы.
Определение катионов кальция (Ca2+). К 5 мл исследуемой воды приливают каплю уксусной кислоты. После непродолжительного нагревания необходимо добавить три капли раствора щавелевокислого аммония и каплю водного раствора аммиака. При наличии катионов кальция выпадает белый кристаллический осадок – кальций оксалата, не растворимый в воде и уксусной кислоте:
(NH4)2С2О4 + СaСl2 → 2NH4Сl +СaС2О4↓;
С2О42- + Сa2+ → СaС2О4↓.
Определение катионов двухвалентного железа (Fe2+). К 5 мл исследуемой воды прибавляют 0,1 г калий сульфата и около 1 г красной кровяной соли ( K3[Fe(CN)6] ). В присутствии ионов двухвалентного железа появляется сине-зеленое окрашивание:
3Fe2++ 2K3[Fe(CN)6] → Fe3[Fe(CN)6]2↓ + 6K+.
Примерное содержание двухвалентного железа определяется по цвету раствора (табл. 1).
Таблица 1.Шкала оценки содержания Fe2+
|
Цвет раствора |
Содержание Fe2+, мг/л |
|
Сине-зеленый |
6,0 – 10,0 |
|
Синий |
10,1–15,0 |
|
Темно-синий |
15,1–30,0 |
Определение катионов трехвалентного железа (Fe3+). К 5 мл природной воды добавляют 1–2 капли концентрированной соляной кислоты и 5 капель 10%-ного раствора роданистого аммония NH4CNS. При наличии ионов Fe 3+ появляется красное окрашивание:
Fe3++ 3NH4CNS → Fe(CNS)3 + 3NH4+.
Примерное содержание трехвалентного железа определяется по цвету раствора (табл.2).
Таблица 2. Шкала оценки содержания Fe3+
|
Цвет раствора |
Содержание Fe3+, мг/л |
|
Желтовато-красный |
0,4 – 1,0 |
|
Красный |
1,1 – 3,0 |
|
Ярко-красный |
3,1 – 10,0 |
Определение сульфат-ионов (SO42-). К 5 мл исследуемой воды приливают 4 капли 10%-ного раствора HCl и столько же капель 5%-ного раствора BaCl2. Содержимое пробирки нагревают на пламени спиртовки. В присутствии сульфат-иона выпадает осадок белого цвета или появляется муть:Ba2+ + SO42- → BaSO4↓.
Примерное содержание сульфат-ионов определяется по шкале (табл.3).
Таблица 3. Шкала оценки содержания SO42-
|
Прозрачность раствора |
Содержание SO42-, мг/л |
|
Слабая муть, проявляющаяся через несколько минут |
1,0 – 10,0 |
|
Слабая муть, появляющаяся сразу |
10,1 – 100,0 |
|
Сильная муть |
100,1 – 500,0 |
|
Большой осадок, быстро оседающий на дно пробирки |
Более 500,0 |
Определение хлорид-ионов (Cl-).К 5 мл исследуемой воды приливают три капли 10%-ного раствора азотнокислого серебра, подкисленного азотной кислотой. Появление осадка или мути указывает на наличие анионов хлора (табл.4):
Ag+ + Cl– → AgCl↓.
Таблица 4. Шкала оценки содержания Cl–
Таблица 4. Шкала оценки содержания Cl–
|
Прозрачность раствора |
Содержание Cl-, мг/л |
|
Слабая муть |
1,0–10,0 |
|
Сильная муть |
10,1–50,0 |
|
Хлопья осаждаются не сразу |
50,1–100,0 |
|
Белый объемистый осадок |
Более 100,0 |
Скачано с www.znanio.ru
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.