
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ
БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧЕРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ
«БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
БИРСКИЙ ФИЛИАЛ
Факультет биологии и химии
Кафедра химии и методики обучения химии
МЕТОДИЧЕСКОЕ ПОСОБИЕ
Лыгин Сергей Александрович
Шакиров Айгиз Маликович
АНАЛИТИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
ЛЕКАРСТВЕННОГО РАСТИТЕЛЬНОГО СЫРЬЯ
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ
ГЛАВА I. ФИЗИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
1.1 Проверка физических свойств или измерение физических констант лекарственных веществ
1.2 Установление рН среды
ГЛАВА II. ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
2.1 Особенности химических методов анализа
2.2 Гравиметрический (весовой) метод
2.3 Титриметрические (объемные) методы
2.4 Газометрический анализ
2.5 Количественный элементный анализ
ГЛАВА III. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
3.1 Особенности физико-химических методов анализа
3.2 Оптические методы
3.3 Абсорбционные методы
3.4 Термические методы анализа
ГЛАВА IV. ФРАКЦИОНИРОВАНИЕ И ИЗУЧЕНИЕ ЭКСТРАКТИВНЫХ ВЕЩЕСТВ АЛОЭ ДРЕВОВИДНОГО
Фракционирование
Изучение веществ в гексановой (А-1) фракции алоэ
Изучение веществ в хлороформной (А-2) и этилацетатной (А-3) фракциях алоэ
Исследование вещества А-3/4-1
Исследование вещества А-3/5-2
Изучение веществ из водной (A-4) фракции алоэ
Обнаружение органических кислот
Изучение веществ из полисахаридной (A-5) фракции алоэ
ЗАКЛЮЧЕНИЕ
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
Химический анализ служит средством контроля производства и качества продукции в ряде отраслей народного хозяйства и фармакологии.
Для современной аналитической химии характерно чрезвычайное разнообразие методов анализа.
В зависимости от задач, аналитическая химия подразделяется на качественный анализ, нацеленный на определение того, что (или какие вещества), в какой форме находится в образце, и количественный анализ, нацеленный на определение сколько данного вещества (элементов, ионов, молекулярных форм и др.) находится в образце.
Растительное лекарственное сырье изучает фармакология. И изучаются они методами фармацевтического анализа. Один из методов - это аналитические методы анализа.
Аналитические методы подразделяются:
1. Физические методы анализа.
2. Химические методы анализа.
3. Физико-химические методы анализа.
Сейчас изучаются все новые лекарственные свойства уже известных лекарственных растений. И эти растения нужно исследовать. Всё это и обуславливает актуальность темы.
Объект исследования – аналитические методы исследования лекарственного сырья на примере алоэ древовидного.
Цель исследования – определить химический состав алоэ древовидного с помощью аналитических методов.
Задачи исследования:
1. Дать общую характеристику методов исследования.
2. Рассмотреть порядок фракционирования и изучить экстрактивные вещества алоэ древовидного.
Пособие состоит из четырех частей.
В первых трех частях дается описание и характеристики аналитических методов исследования. В первой части соответственно физические методы анализ, во второй – химические и в третей физико-химические методы анализа.
Четвертая
часть посвящена практическому применению рассмотренных выше главах
аналитических методов в стандартизации химических веществ в лекарственном сырье
на примере алоэ древовидного. Стандартизация подразумевает комплексное изучение
основных биологически активных и сопутствующих веществ находящихся в листьях
алоэ [24].
Подлинность лекарственного вещества свидетельствуют; окраска, запах; форма кристаллов или вид аморфного вещества; летучесть, подвижность, воспламеняемость (жидкостей); агрегатное состояние (твердое вещество, жидкость, газ); гигроскопичность или степень выветриваемости на воздухе; устойчивость к воздействию света, кислорода воздуха. Окраска лекарственного вещества — одно из характерных свойств, позволяющее осуществить его предварительную идентификацию.
Определение степени белизны порошкообразных лекарственных средств — физический метод, впервые включенный в ГФ XI[1]. Степень белизны (оттенка) твердых лекарственных веществ можно оценить различными инструментальными методами на основе спектральной характеристики света, отраженного от образца. Для этого измеряют коэффициенты отражения при освещении образца белым светом, полученным от специального источника со спектральным распределением или пропущенным через светофильтры с максимумом пропускания 614 нм (красный) или 459 нм (синий). Можно также измерять коэффициент отражения света, пропущенного через зеленый светофильтр (522 нм). Коэффициент отражения — это отношение величины отраженного светового потока к величине падающего светового потока. Он позволяет определить наличие или отсутствие у лекарственных веществ цветового оттенка по степени белизны и степени яркости. Для белых или белых с сероватым оттенком веществ степени белизны теоретически равна 1. Вещества, у которых она 0,95—1,00, а степени яркости < 0,85, имеют сероватый оттенок.
Более точно оценку белизны лекарственных веществ можно осуществить с помощью спектрофотометров отражения, например СФ-18, выпускаемых ЛОМО (Ленинградским оптико-механическим объединением). Интенсивность цветовых или сероватого оттенков устанавливают по абсолютным коэффициентам отражения. Значения степени белизны и степени яркости являются характеристиками качества белых и белых с оттенками лекарственных веществ. Их допустимые пределы регламентируются в частных статьях.
Будет более объективным если установить различные физические константы, например, температуры кипения или затвердевания, температуры плавления (разложения), вязкости, плотности. Важным показателем подлинности является растворимость лекарственных препаратов в воде, растворах щелочей, кислот, органических растворителях (этиловом и метиловом спирте, эфире, маслах, хлороформе, бензоле, ацетоне, и др.).
Температура плавления – это константа, характеризующая гомогенность твердых веществ. Ее применяют в фармацевтическом анализе для установления подлинности и чистоты большинства твердых лекарственных веществ. Известно, что это температура, при которой твердое тело находится в равновесии с жидкой фазой при насыщенной фазе пара. Температура плавления является постоянной величиной для индивидуального вещества. Присутствие даже небольшого содержания примесей изменяет (как правило, снижает) температуру плавления вещества, что позволяет судить о степени его чистоты. Подтвердить индивидуальность исследуемого соединения можно пробой смешанного плавления, так как смесь двух веществ, имеющих одинаковые температуры плавления, плавится при той же температуре.
В ГФ XI, вып. 1 (с. 149) включен метод фазовой растворимости, который дает возможность осуществлять количественную оценку степени чистоты лекарственного вещества путем точных измерений значений растворимости. Этот метод основан на правиле фаз Гиббса, которое устанавливает зависимость между числом фаз и числом компонентов в условиях равновесия. Суть установления фазовой растворимости заключается в последовательном прибавлении увеличивающейся массы препарата к постоянному объему растворителя. Для достижения состояния равновесия смесь подвергают длительному встряхиванию при постоянной температуре, а затем с помощью диаграмм определяют содержание растворенного лекарственного вещества, т.е. устанавливают, является ли испытуемый препарат индивидуальным веществом или смесью. Метод фазовой растворимости отличается объективностью, не требует для выполнения дорогостоящего оборудования, знания природы и структуры примесей. Это позволяет использовать его для качественного и количественного анализов, а также для изучения стабильности и получения очищенных образцов препаратов (до степени чистоты 99,5%), Важное достоинство метода — возможность отличать оптические изомеры и полиморфные формы лекарственных веществ. Метод применим ко всем видам соединений, которые образуют истинные растворы.
Значение рН раствора лекарственного препарата может дать важную информацию о степени чистоты. С ним можно выяснить наличие примесей щелочных или кислых продуктов.
Такие примеси свободных кислот и щелочей определяют титрованием. Эти вещества в растворе или в водном растворе препарата нейтрализуют в присутствии индикаторов (фенолфталеин, метиловый красный, тимолфталеин, бромфеноловый синий и др). По израсходованном на нейтрализацию говорят о кислотности или о щелочности.
Реакцию рН среды необходимо учитывать при испытании чистоты и количественного определения. От него еще зависит сроки хранения препаратов и особенности применения.
Из многочисленных способов установления значения рН среды ГФ XI рекомендует колориметрический и потенциометрический способы. [4]
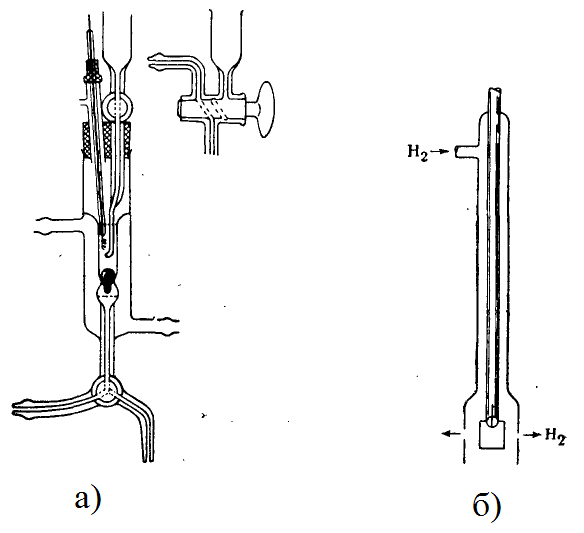
Рис. 1. а) Водородный электрод Хичкока и Тейлора;
б) Водородный электрод Гильдебранда
Основы химических методов базируются на закономерностях химических реакций, используемых для аналитических реакций. Это могут быть подготовка пробы на различных стадиях анализа.
При описании основ этого метода в гомогенных растворах должна быть равновесие.
Эти методы используются для установления подлинности лекарственных веществ, испытаний их на чистоту и количественного определения.
Для идентификаций применяю реакции, сопровождаемые внешним эффектом, например изменением окраски раствора, выделением газообразных продуктов, выпадением или растворением осадков. Установление подлинности неорганических лекарственных веществ заключается в обнаружении с помощью химических реакций катионов и анионов, входящих в состав молекул. Химические реакции, применяемые для идентификации органических лекарственных веществ, основаны на использовании функционального анализа.
Чистота лекарственных веществ устанавливается помощью чувствительных и специфичных реакций, пригодных для определения допустимых пределов содержания примесей.
Химические методы оказались самыми надежными и эффективными, они дают возможность выполнить анализ быстро и с высокой достоверностью. В случае сомнения в результатах анализа последнее слово остается за химическими методами.
Количественные методы химического анализа подразделяют на гравиметрический, титриметрический, газометрический анализ и количественный элементный анализ. [3]
Сущность гравиметрического анализа (гравиметрии) заключается в определении массы продукта химической реакции. Измеряют взвешиванием на аналитических весах массу вещества называемого гравиметрической формой. Гравиметрия является наиболее простым, точным, хотя и продолжительным методом анализа. Метод широко применяют для количественного определения неорганических и органических веществ. Гравиметрический анализ выполняют с использованием методов отгонки или осаждения.
Из неорганических лекарственных веществ, гравиметрическим методом можно определять сульфаты, переводя их в нерастворимые соли бария, и силикаты, предварительно прокаливая до диоксида кремния.
Наибольшее применение получил титриметрический метод. Титриметрический анализ (титриметрия) является одним из методов количественного анализа, в котором количество вещества определяют путем точного измерения объема раствора реагента (титранта), вступившего в химическую реакцию с определяемым веществом (титруемым веществом).
Титрованием называют процесс постепенного добавления из бюретки раствора реагента в титруемый раствор до того момента, пока его количество не станет равным количеству реагирующего с ним определяемого вещества (до достижения точки стехиометричности). Для определения этого момента в исследуемый раствор обычно добавляют индикатор, который изменяет окраску при состоянии системы, очень близком к точке стехиометричности.
Титриметрический метод анализа получил широкое распространение потому, что он позволяет использовать разнообразные химические реакции и определять вещества, учитывая их свойства и строение. Он выполняется быстро, с большой степенью точности, не нуждается в сложном оснащении и может использоваться как в лабораториях, так и в аптеках.
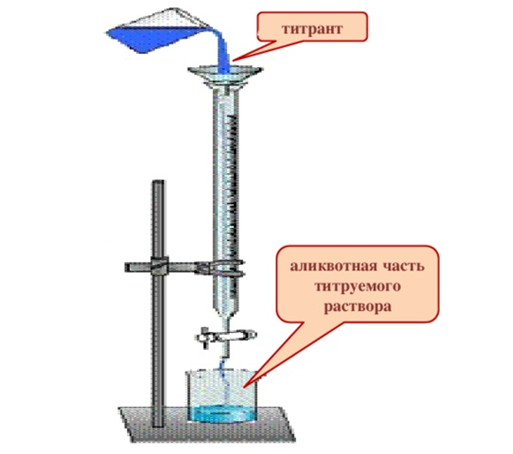
Рис. 2. Классический прибор для титрования
Для количественного определения лекарственного вещества титриметрическим методом необходимы титрованный (стандартный) раствор, набор простой лабораторной посуды (бюретки, пипетки, мерные колбы для титрования) и средств фиксации точки эквивалентности (конечной точки титрования).
В зависимости от типа реакции, положенной в основу титрования, различают:
· кислотно-основное титрование;
· осадительное титрование;
· комплексиметрическое титрование;
· комплексонометрическое титрование;
· окислительно-восстановительное титрование.
Кислотно-основное титрование осуществляется в воде и в неводных средах. Данный метод используется в 40 процентах методик, применяющихся для анализа лекарственных веществ. Им определяют концентрацию кислот, оснований, солей. В основе титрования лежит реакция взаимодействия протонов с гидроксид-ионами:
Н3О+ + ОН- = 2Н2О.
Титрованными (стандартными растворами являются растворы сильных кислот и сильных оснований. В процессе титрования изменяется рН системы. В зависимости от свойств определяемого вещества точка эквивалентности при титровании в воде может соответствовать различным величинам рН: Очевидно важно подобрать индикатор таким образом, чтобы величина рН в точке эквивалентности находилась в интервале перехода окраски выбранного индикатора.
В качестве индикаторов служат красители, изменяющие окраску в широком интервале рН от 1,2 до 10,5. Наиболее часто используются индикаторы: метиловый оранжевый (3,1—4,4); метиловый красный (4,8—6,0); фенолфталеин (8,2—10,0); тимол-фталеин (9,4—10,6). [2, 10]
Газометрический метод имеет ограниченное применение в фармацевтическом анализе. Объектами газометрического анализа являются два газообразных препарата: кислород и циклопропан. Сущность газометрического определения кислорода заключается во взаимодействии с поглотительным раствором, содержащим легко окисляющийся медноаммиачный комплекс. Определение выполняют в приборе Гемпеля (ГФ IX, с. 349), измеряя объем непрореагировавшего газа. Циклопропан определяют аналогично, используя в качестве поглотительного раствора концентрированную серную кислоту.
Элементный анализ используют для количественного определения органических и элементорганических соединений, содержащих азот, галогены, серу, а также мышьяк, висмут, ртуть, сурьму и другие элементы.
Фармакопейный метод определения азота в органических соединениях известен также под названием метода Кьельдаля. Он основан на сочетании минерализации органического вещества с последующим применением кислотно-основного титрования. Применяют метод Кьельдаля для количественного анализа азотсодержащих органических веществ, а также лекарственных препаратов, содержащих аминный, амидный и гетероциклический азот. [1]
Область применения метода Кьельдаля в фармацевтическом анализе довольно широка. ГФ рекомендует его для определения уретанов (мепротан), аминокислот (метионин, глутаминовая кислота) и других азотсодержащих лекарственных веществ (бензогексоний, оксафенамид, дипрофиллин). Самый существенный недостаток метода — его трудоемкость.
Кратко познакомимся с основными физическими и физико-химическими методами анализа и направлениями их развития.
Под физическими методами понимают методы, в которых в качестве "аналитического реагента" выступает энергия. Взаимодействие компонентов анализируемой пробы с энергией в виде излучения приводит к ее поглощению (абсорбционные методы) или возбуждению атомов или молекул вещества с последующей эмиссией кванта энергии (эмиссионные или люминесцентные методы анализа). При этом возможно взаимодействие атомов — атомные методы или молекул — молекулярные методы. В атомных методах анализируемую пробу необходимо перевести в плазменное состояние. В молекулярном анализе исследуется вещество в молекулярной форме и в этом случае анализируются растворы проб. В данной группе методов качественное и количественное определение вещества осуществляют по спектрам электромагнитного излучения. Отсюда общее название этих методов — "спектроскопия".[5]
Физико-химические методы приобретают все большее значение для целей объективной идентификации и количественного определения лекарственных веществ. Получивший распространение в различных отраслях недеструктивный анализ (без разрушения анализируемого объекта) играет важную роль и в фармацевтическом анализе. Для его выполнения пригодны многие физико-химические методы, в частности оптические, ЯМР-, ПМР-, УФ- и ИК- спектроскопия, ГЖХ, ВЭЖХ и др.
В фармацевтическом анализе наиболее широко используют физико-химические методы, которые могут быть классифицированы на следующие группы: оптические методы; методы, основанные на поглощении излучения; методы, основанные на испускании излучения; методы, основанные на использовании магнитного поля; электрохимические методы; методы разделения; термические методы.

Рис. 3. – Настольный ЯМР-спектрометр PicoSpin 80.
Большинство перечисленных методов (за исключением оптических, электрохимических и термических) широко применяют для установления химической структуры органических соединений.
Каждое новое издание ГФ является своеобразным отражением перспектив использования физико-химических методов в фармацевтическом анализе. Так ГФ XI по сравнению с ГФ X пополнилась общими статьями и разделами по таким методам, как ГЖХ, ВЭЖХ, ЯМР-спектроскопия, электрофорез, эмиссионная и атомно-абсорбционная пламенная спектрометрия. Остальные статьи, содержащие описание физико-химических методов, существенно переработаны и дополнены с учетом современных достижений в области теории и практики фармацевтического анализа.
Физико-химические методы анализа имеют ряд преимуществ перед классическими химическими методами. Они основаны на использовании как физических, так и химических свойств веществ и в большинстве случаев отличаются экспрессностью, избирательностью, высокой чувствительностью, возможностью унификации и автоматизации.
К этой группе относятся методы, основанные на определении показателя преломления луча света в растворе испытуемого вещества (рефрактометрия), измерении интерференции света (интерферометрия), способности раствора вещества вращать плоскость поляризованного луча (поляриметрия).
Оптические методы находят все более широкое применение в практике внутриаптечного контроля ввиду экспрессности, минимального расхода анализируемых лекарств.
Рефрактометрия использована для испытания подлинности лекарственных веществ, представляющих собой жидкости (диэтиламид никотиновой кислоты, метилсалицилат, токоферола ацетат), а во внутриаптечном контроле — для анализа лекарственных форм, в том числе двойных и тройных смесей. Применяют также объемно-рефрактометрический анализ и рефрактометрический анализ методом полной и неполной экстракции.
Разработаны различные варианты методик анализа интерферометрическим методом лекарственных препаратов, титрованных растворов, дистиллированной воды.
Поляриметрию применяют для испытания подлинности лекарственных веществ, в молекулах которых имеется асимметрический атом углерода. Среди них большинство препаратов из групп алкалоидов, гормонов, витаминов, антибиотиков, терпенов.
В аналитической химии и фармацевтическом анализе используются рентгенорефрактометрия порошков, спектрополяриметрический анализ, лазерная интерферометрия, дисперсия вращения и круговой дихроизм.
Эффективным недеструктивным методом является отражательная инфракрасная спектроскопия, которая используется для определения примесей различных продуктов разложения и воды, а также в анализе многокомпонентных смесей.
Абсорбционные методы основаны на свойствах веществ поглощать свет в различных областях спектра.
Атомно-абсорбционная спектрофотометрия основана на использовании ультрафиолетового или видимого излучения резонансной частоты. Поглощение излучения вызывается переходом электронов с внешних орбиталей атомов на орбитали с более высокой энергией. Объектами, поглощающими излучение, являются газообразные атомы, а также некоторые органические вещества. Метод отличается высокой избирательностью и чувствительностью.

Рис. 4. – Атомный абсорбционный спектрофотометр.
Ультрафиолетовая спектрофотометрия — наиболее простой и широко применяемый в фармации абсорбционный метод анализа. Его используют на всех этапах фармацевтического анализа лекарственных препаратов (испытания подлинности, чистоты, количественное определение). Разработано большое число способов качественного и количественного анализа лекарственных форм методом ультрафиолетовой спектрофотометрии. Для идентификации могут быть использованы атласы спектров лекарственных веществ, систематизирующие сведения о характере спектральных кривых и значениях удельных показателей поглощения. [6,23]
Нагревание лекарственных веществ до температуры, не вызывающей термического разложения, приводит к ряду изменений в их физических свойствах. Происходят полиморфные превращения, растворение в кристаллизационной воде, удаление сорбционной и кристаллизационной воды, сублимация, плавление, кипение. В зависимости от природы вещества, температуры и условий нагревания могут происходить химические превращения: структурирование, термическая, окислительная или гидролитическая деструкция. Термическая деструкция веществ сопровождается поглощением или выделением теплоты, а также образованием газообразных продуктов. Поэтому наиболее информативными и экспрессными методами оценки термической стабильности являются термография и термогравиметрия.
Термографический анализ лекарств весьма перспективен. Специфичность термограмм позволила использовать метод для идентификации целого ряда лекарственных веществ.
В последние годы проводятся исследования по комплексному применению физических и физико-химических методов. Это обеспечивает возможность получения новых характеристик и констант, позволяющих дать всестороннюю оценку лекарственного вещества или группы препаратов сходной химической структуры.
С целью комплексного изучения основных классов биологически активных и сопутствующих им соединений в составе листьев алоэ древовидного, мы подвергали их последовательной обработке различными экстрагентами, выделяя тем самым разные фракции (рис. 5, табл. 1).
Листья алоэ массой 3 кг измельчали в гомогенизаторе, затем прибавляли 10 л 96% этилового спирта и нагревали смесь на водяной бане с обратным холодильником при периодическом перемешивании в течение 90 мин. Спиртовое извлечение отделяли от шрота декантированием, упаривали на роторном испарителе до водного остатка, затем подвергали жидкофазной экстракции последовательно гексаном, хлороформом и этилацетатом; оставшийся водный остаток концентрировали и высушивали в вакуум-сушильном шкафу. Таким образом, нами были получены фракции: гексановая (А-1), хлороформная (А-2), этилацетатная (А-3) и водная (А-4). Шрот сырья после экстракции этиловым спиртом экстрагировали водой на кипящей водяной бане пятикратно в соотношении 1:15 до истощения, полученное извлечение упаривали до объема 100-120 мл, к упаренному остатку прибавляли пятикратный объем 96% этилового спирта, высаждая тем самым водорастворимые полисахариды. Полученный осадок отделяли центрифугированием и высушивали (А-5).
Качественный анализ Полученные из листьев алоэ фракции предварительно анализировали методом пробирочных качественных реакций с применением общепринятых методик на наличие основных классов соединений. Результаты предварительных анализов представлены в табл. 2.
В результате проведенного разделения экстрактивных веществ нами было получено 5 фракций (табл. 1).
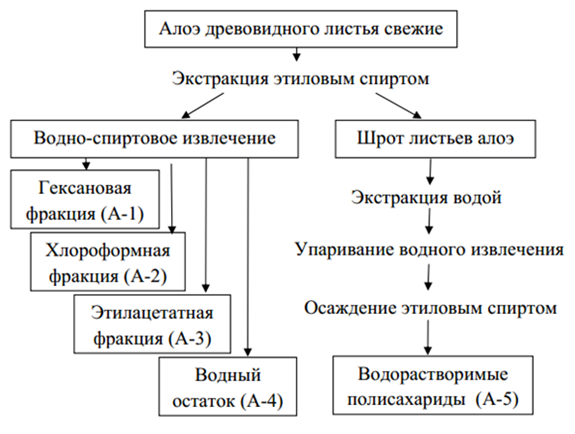 Рис.
5. – Фракционирование экстрактивных веществ из листьев алоэ древовидного свежих
Рис.
5. – Фракционирование экстрактивных веществ из листьев алоэ древовидного свежих
Таблица 1
Выход фракций экстрактивных веществ
от массы свежих листьев алоэ
* - номера фракций соответствуют представленным на рис. 5.
Таблица 2
Результаты предварительных испытаний фракций, полученных из листьев алоэ
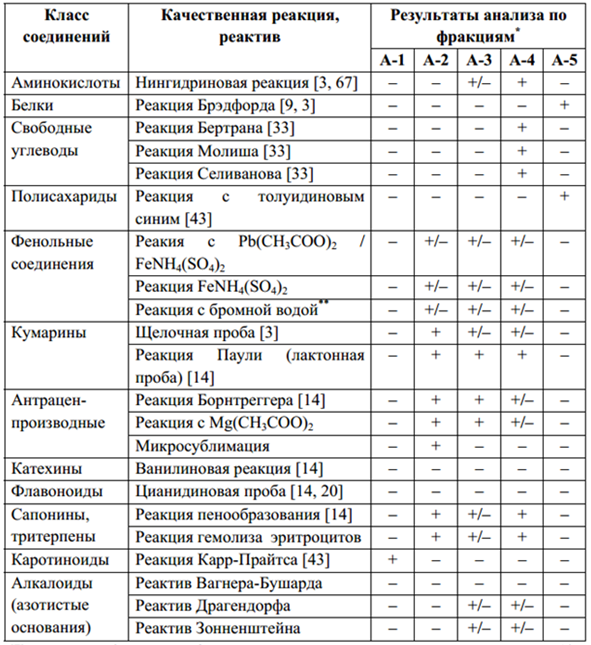
Примечания: *- номера фракций
соответствуют представленным на рис. 5; «+» - реакция положительная; «+/-» -
слабая выраженность аналитического сигнал; «-» - реакция отрицательная; **-
реакция положительная так же для алоэ-эмодина и алоинов
Предварительный анализ также включал хроматографическое разделение некоторых фракций методом высокоэффективной тонкослойной хроматографии (ВЭТСХ) в системе этилацетатметанол-вода (200:27:22) на пластинках силикагеля марки Сорбфил. Детекция осуществлялась в видимом и УФ-свете (365 нм) до и после обработки хроматограмм 5% спиртовым раствором калия гидроксида. Анализу подвергались фракции А-2, А-3 и А-4, а также алоэ сок нативный. В результате установлено наличие во фракции A-2 – не менее 14 соединений, A-3 – не менее 21, A-4 – не менее 9.
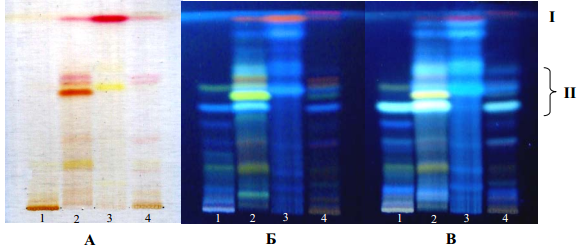
Рис. 6. – Хромотограммы предварительного ТСХ-анализа некоторых фракций и сока алоэ древивидного в видимом свете (А) и УФ-свете до (Б) и после (В) обработки раствором калия гидроксида
Условные обозначения: 1 – фракция А-2*; 2- фракция А-3; 3 – фракция А-4; 4 – сок алоэ нативный; I – алоэ-эмодин; II – зона алоинов
Согласно данным хроматографирования в присутствии достоверных образцов в исследованных фракциях установлено наличие алоэ-эмодина (рис. 6, зона I) и алоинов (рис. 6, зона II). Проведенное исследование показало, что в извлечениях A. arborescens присутствуют аминокислоты, свободные углеводы, полисахариды, фенольные соединения (в т.ч. кумарины, антраценпроизводные), тритерпеновые соединения, каротиноиды и, возможно, алкалоиды или азотисные основания. В гексановой фракции установлено наличие каротиноидов; в хлороформной – кумаринов, антраценпроизводных, тритерпенов; в этилацетатной – кумаринов, антраценпроизводных, тритерпенов, аминокислот и алкалоидов (или азотисных оснований); в водной (после спиртоводной экстракции) – аминокислот, свободных углеводов, кумаринов, антраценпроизводных, тритерпенов, и, вероятно, алкалоидов или азотистых оснований; фракция водорастворимых полисахаридов содержит углеводы и белковые вещества.
Предварительный анализ фракции А-1 с использованием характерных качественных реакций показал наличие в ней каротиноидов (табл. 6*2). Для того чтобы более точно характеризовать данную фракцию, мы провели ее анализ методом тонкослойной хроматографии (ТСХ). Анализ проводили на пластинках марки Сорбфил ПТСХ-АФ-А-УФ в системе петролейный эфир – ацетон (95:5) восходящим способом. В качестве достоверного образца в отдельных экспериментах использовали β-каротин (Sigma). Хроматограммы оценивали визуально в видимом свете с использованием светофильтров, УФ-свете до и после обработки проявляющим реактивом – 1% спиртовым раствором фосфорномолибденовой кислоты (ФМК).
В результате анализа в исследуемой фракции обнаружено более 10 соединений (рис. 7). На основании сопоставления экспериментальных данных с данными литературы [7, 8, 12], обнаруженные вещества относятся к двум основным классам липофильных веществ: каротиноидам (пятна в видимом свете имеют окраску от желтой до оранжевой, не флюоресцируют в УФ-свете, после проявления ФМК приобретают синий цвет) и хлорофиллам (окраска в видимом свете зеленая, со светофильтром - синяя, флуоресценция в УФ-свете красная, со временем усиливающаяся, окраска после проявления ФМК – зеленая).

Рис. 7. – Хроматограммы ТСХ-анализа липофильной гексановый фракции алоэ (А-1)
Условные обозначения: А – видимый свет (синий светофильтр); Б – видимый свет (красный светофильтр); В – УВ-свет; Г – видимый свет после обработки раствором фосфорномолибденовой кислоты.
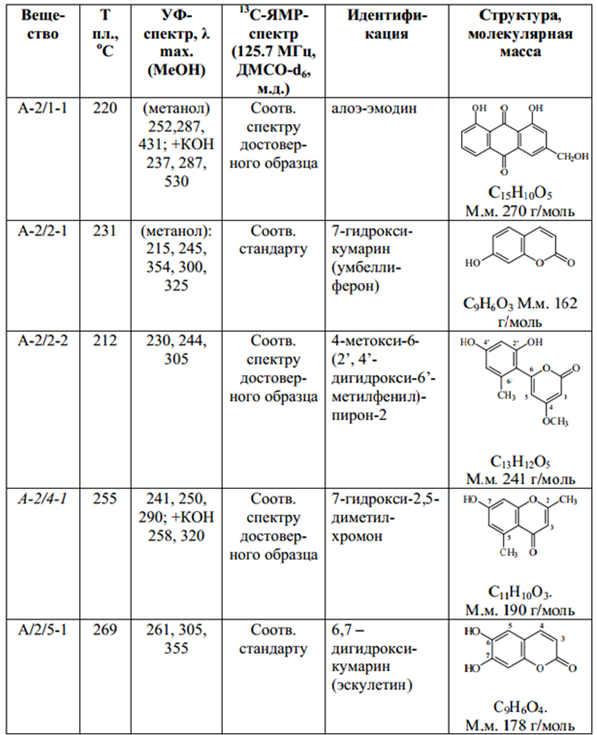
Хроматографическое разделение и анализ хлороформной фракции А-2 2,5 г фракции A-2 наносили на хроматографическую колонку с силикагелем (силикагель марки 100/250, колонка 5×20 см), затем элюировали в градиентной системе гексан : этилацетат (100:0)→(80:20). В результате было получено 5 фракций – A-2/1 (элюент 100:0), A-2/2 (элюент 95:5), A-2/3 (элюент 90:10), A-2/4 (элюент 85:15), A-2/5 (элюент 80:20), которые далее хроматографировали методами ТСХ в системе петролейный эфир : ацетон (7 : 3) (детектор – УФ-свет 365 нм) и ВЭТСХ в системе 67 толуол : метанол (85:15) (детекция в УФ-свете при 365 нм после обработки 5% раствором калия гидроксида). В результате хроматографического разделения были выделены зоны индивидуальных соединений, с которых элюировали вещества: из фракции А-2/1 – вещество A-2/1-1, из A-2/2 - A-2/2-1 и A-2/2-2, из A-2/4 - A-2/4-1, из A-2/5 – A-2/5-1. Выделенные индивидуальные вещества оценивали по температуре плавления, методами УФ- и 13СЯМР-спектроскопии, сравнивая полученные результаты с литературными данными и результатами, полученными для достоверных и стандартных образцов [18, 22] (табл. 2).
Идентификацию выделенных веществ мы подтверждали также методом хроматоденситометрии смеси достоверных образцов в сравнении с результатами ВЭТСХ-анализа фракции А-2 (рис. 8).
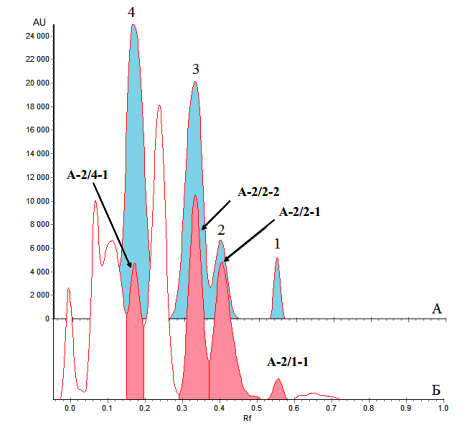
Рис. 8. – Денситограмма (ВЭТСХ) смеси достоверных образцов (А) и хлороформной фракции А-2 (Б)
Условные обозначения: 1 – алоэ-эмодин; 2 – умбеллиферон, 3 – 4-метокси-6-(2’, 4’-метилфенил)-пирон-2, 4 – 7-гидрокси-2,5-диметилхромон
Таблица 3
Результаты исследования и идентификации веществ, выделенных из хлороформной фракции листьев алоэ древовидного
Хроматографическое разделение и анализ этилацетатной фракции А-3
6,0 г фракции A-3 наносили на хроматографическую колонку с силикагелем (силикагель марки 100/250, колонка 6×30 см), которую элюировали в градиентной системе хлороформ : 96% спирт (100:0)→(0:100). В результате было получено 6 фракций – A-3/1 (100:0), A-3/2 (95:5), A-3/3 (90:10), A-3/4 (85:15), A-3/5 (80:20) и A-3/6 А-2/1-1 А-2/2-1 А-2/2-2 А-2/4-1 Рисунок 8*4 - Денситограмма (ВЭТСХ) смеси достоверных образцов (А) и хлороформной фракции А-2 (Б) Условные обозначения: 1 – алоэ-эмодин; 2 – умбеллиферон, 3 – 4- метокси-6-(2’, 4'-гидрокси-6'-метилфенил)-пирон-2, 4 – 7-гидрокси- 2,5-диметилхромон 70 (0:100), которые далее хроматографировали сначала методами ТСХ и ВЭТСХ в системе этилацетат : 95% этиловый спирт : вода (20:3:1) (детекция в УФ-свете при 365 нм после обработки 5% раствором калия гидроксида). В результате хроматографического разделения из фракции A-3/4 выделено вещество A-3/4-1, из фракции A-3/5 – вещества A-3/5-1 и A- 3/5-2, которые на основании литературных данных были идентифицированы как 2''-О-ферулоилалоэзин (вещество А-3/4-1), сумма алоинов А и В (вещество А-3/5-1) и алоэнин (вещество А-3/5- 2) [18, 22, 25].
Строение вещества А-3/4-1 изучали по данным физикохимического анализа и на основании химических превращений и хроматографического поведения продуктов кислотного гидролиза (рис. 5). Для этого 10 мг вещества растворяли в 10 мл 10% раствора HCl в 50% диоксане, после чего нагревали на кипящей водяной бане в течение 3 ч. Реакционную смесь разбавляли водой в 20 раз и экстрагировали сначала хлороформом, затем этилацетатом. Хлороформное извлечение упаривали досуха, остаток растворяли в минимальном объеме метанола, после чего подвергали разделению методом ТСХ в системе этилацетат: 96% этиловый спирт : вода (20:3:1) (детектция в УФ-свете при 365 нм после обработки 5% раствором калия гидроксида). В результате препаратаивного разделения нами получено соединение, идентифицированное по хроматографическому поведению, УФ-спектру и данным литературных источников с алоэзином.
Этилацетатное извлечение целиком наносили на хроматографическую пластинку и разделяли в системе хлороформ – этилацетат (2:1) (детектция в УФ-свете при 365 нм после обработки 5% раствором калия гидроксида), после чего элюировали и исследовали. Сравнение полученного вещества с достоверным образцом феруловой кислоты показало их соответствие друг другу по 71 ряду проверенных свойств (температура плавления, отсутствие дипрессии температуры плавления в присутствии достоверного образца, совпадение УФ-спектров и одинаковое хроматографическое поведение).
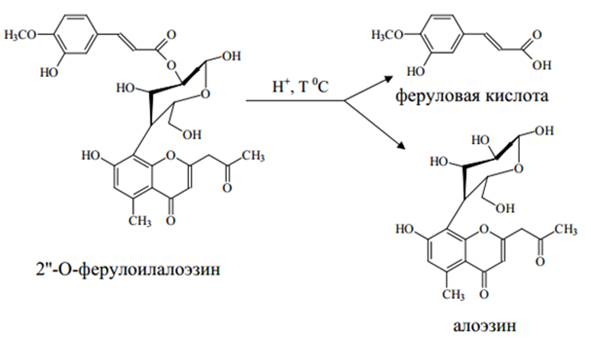
Рис. 9. – Схема кислотного гидролиза 2’’-O-ферулоилалоэзина, выделенного из этилацетатной фракции листьев алоэ древовидного
Исследование вещества A-3/5-1 выявило, что оно является смесью близкородственных веществ, обозначенных как алоин А и алоин В (С-глюкозиды алоэ-эмодина). Для того чтобы подтвердить это, мы провели сравнительное исследование вещества А-3/5-1 с достоверным веществом алоином (Aloin (Fluka)), которое проводили с применением ВЭЖХ. На рис. 6 представлены фрагмент хроматограммы ВЭЖХ и УФ-спектры алоина А (соединение 15) и алоина В (соединение 16), измеренные в остановленном потоке.

Рис. 10. – ВЭЖХ-анализ вещества А-3/5-1 и УФ-спектры алоинов А и В, измеренные в остановленном потоке
Строение вещества A-3/5-2 изучали с применением гидролиза с последующей идентификацией образовавшихся веществ, а также по физико-химическим свойствам в сравнении с данными литературы и библиотек спектров.
Кислотный гидролиз вещества A-3/5-2. Около 10 мг вещества растворяли в 10 мл 1% раствора кислоты хлористоводородной в 70% диоксане, после чего нагревали на кипящей водяной бане в течение 1 ч. Реакционную смесь разбавляли водой (1:20) и экстрагировали этилацетатом. Органическое извлечение концентрировали досуха, остаток растворяли в минимальном объеме метанола, после чего подвергали препаративному разделению методом ТСХ (система: петролейный эфир - ацетон (7 : 3); детекция в УФ-свете при 365 нм). В результате анализа было получено соединение, которое по хроматографическому поведению и характерным качественным реакциям мы идентифицировали как 4-етокси-6-(2’,4’-дигидрокси-6’-метилфенил)-пирон-2, ранее обнаруженный в хлороформной фракции (вещество А-2/2-2).
Водную фазу реакционной смеси после экстракции этилацетатом нейтрализовали на анионите АВ-17-8 ([НСО3]–-форма, производство фирмы «Биолар»), упаривали до минимального объема и анализировали методом высокоэффективной ТСХ с использованием смеси достоверных образцов моносахаридов (система растворителей: пропанол – 96% этиловый спирт – вода (7:1:2), двукратное элюирование на высоту 3 и 6 см; детектор – раствор кислоты п-оксидифенил-фталаниловой в кислоте ортофосфорной конц.). В результате анализа было установлено присутствие в реакционной смеси глюкозы (рис. 11).
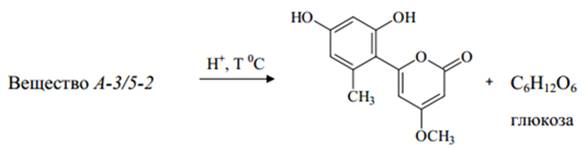
4-метокси-6-(2’,4’-дигидроксин-6’-метилфенил)-пирон-2
Рис. 11. – Схема кислотного гидролиза вещества А-3/5-2
Результаты анализа веществ, полученных нами при гидролизе вещества А-3/5-2, позволили предположительно отнести его к глюкозиду - алоэнину, описанному ранее в литературе [25, 26]. Подтверждением этому послужили данные, полученные нами при исследовании его физико-химических свойств (Таблица 4).
Таблица 4
Результаты анализа вещества А-3/5-2, выделенног из этилацетатной фракции (А-3) листьев алоэ древовидного
Фракция А-4 - водная фаза из листьев алоэ древовидного, оставшаяся после последовательной экстракции органическими растворителями и высушенная до сухого вещества с остаточной влажностью не более 5%. Основными компонентами, исследуемыми в данной фракции, являлись свободные углеводы и органические кислоты.
Обнаружение свободных углеводов 20 г фракции А-4 растворяли в 200 мл воды и пропускали через хроматографическую колонку с катионитом КУ-2-8 ([Н]+-форма, производство «Биолар»). Промывание колонки осуществляли водой до образования 200 мл элюата. Затем элюат наносили на другую хроматографическую колонку с анионитом АСД-4-5п ([Cl]–-форма, производство «Биолар»). Промывание колонки также осуществляли водой до образования 200 мл элюата. Элюат упаривали на водяной 75 бане под вакуумом до минимального объема и хроматографировали методом препаративной ВЭТСХ в системе пропанол – 95% этиловый спирт – вода (7:1:2) в присутствии достоверных образцов моно- и дисахаридов (проявитель - раствор кислоты п-оксидифенилфталаниловой в кислоте ортофосфорной конц.) [16, 17, 19]. В результате анализа в составе фракции А-4 были обнаружены глюкоза, фруктоза и сахароза.
Хроматографическую колонку с анионитом, после элюирования водой сахаров промывали 5% раствором кислоты уксусной до получения около 100 мл элюата. Элюат упаривали в вакууме досуха, остаток растворяли в минимальном объеме воды и хроматографировали методом ВЭТСХ в присутствии достоверных образцов органических кислот в системе ацетон – аммиак – 95% этиловый спирт – хлороформ – вода (60:22:10:6:2). Хроматографирование осуществляли трехкратно, после чего хроматограмму проявляли смесью равных объемов растворов метиленового красного и бромтимолового синего [21, 15]. Проявленную хроматограмму сканировали денситометрическим методом, результаты представлены на рис. 12. В результате анализа установлено, что доминирующим компонентом в составе органических кислот фракции А-4 является яблочная кислота. Кроме яблочной кислоты также обнаружены малоновая и щавелевая кислоты [22].
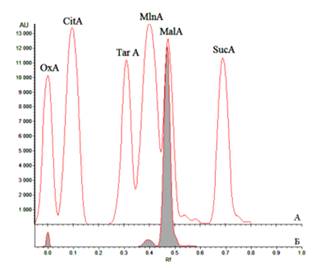
Рис. 12. – Денситограмма ВЭТСХ-анализа суммы органических кислот алоэ древовидного
Условные обозначения:
А – смесь достоверных образцов органических кислот: ОхА – щавелевой; CitA – лимонной; TarA – винной; VlnA – малиновой; MalA – яблочной; SucA – янтарной;
Б – фракция органических кислот алоэ древовидного
Фракция А-5 получена экстракцией горячей водой шрота листьев алоэ древовидного с последующим упариванием и высаждением суммы полисахаридов 96% этиловым спиртом. С целью изучения природы выделенных полисахаридов мы предварительно очищали фракцию А-5 от сопутствующих белковых веществ, затем осуществляли кислотный гидролиз фракции и изучали состав моносахаридов в гидролизате.
Очистка фракции
Около 35 г фракции А-5 растворяли в 200 мл воды, полученный раствор центрифугировали при 3000 об./мин., надосадочную Рисунок 12 – Денситограмма ВЭТСХ-анализа суммы органических кислот алоэ древовидного Условные обозначения: А – смесь достоверных образцов органических кислот: ОхА – щавелевой; CitA – лимонной; TarA – винной; MlnA – малоновой; MalA – яблочной; SucA – янтарной; Б – фракция органических кислот алоэ древовидного жидкость отделяли и пропускали через хроматографическую колонку с катионитом КУ-2-8 ([Н]+-форма, производство «Биолар»). Колонку промывали водой до получения 200 мл элюата, элюат диализировали на полупроницаемой динитроцеллюлозной мембране против воды в течение 48 ч. Недиализованный остаток депротеинизировали ферментативным методом (фермент проназа Streptomyces griseus (Sigma)) при 400С, после чего инактивировали фермент нагреванием смеси до 1000С в течение 15 мин. После охлаждения в реакционную среду прибавляли трихлоруксусную кислоту до концентрации 10%, выдерживали в течение 15 мин, затем центрифугировали при 3000 об./мин. Надосадочную жидкость диализовали на полупроницаемой динитроцеллюлозной мембране против воды в течение 48 ч. К остатку прибавляли ацетон в четырехкратном объеме, выпавший осадок собирали центрифугированием и высушивали [19, 20]. В результате было получено 12 г очищенной суммы водорастворимых полисахаридов с суммарным содержанием углеводов более 95%.
Кислотный гидролиз полисахаридов
Около
20 мг суммы полисахаридов растворяли в 5 мл 2 моль/л раствора трифторуксусной
кислоты, раствор герметично укупоривали и нагревали при 120°С в течение 3 ч. Из
реакционной среды удаляли трифторуксусную кислоту при 40°С под вакуумом при
порционном добавлении метанола, после чего гидролизат концентрировали до
минимального объема и анализировали методом ВЭТСХ. ВЭТСХ-анализ гидролизата
полисахаридов Анализ гидролизата методом ВЭТСХ проводили на пластинах Сорбфил
ПТСХ-АФ-В в системе растворителей пропанол – 95% этиловый спирт – вода (7:1:2).
Для этого на линию старта хроматографической пластинки наносили 2 мкл
гидролизата и по 1 мкл растворов моносахаридов через каждые 10 мм, затем
пластинку высушивали и хроматографировали восходящим способом 2 раза с пробегом
подвижной фазы 3 см и 6 см. После высушивания пластинку обрабатывали раствором
кислоты п-окси- дифенилфтаниловой в кислоте ортофосфорной и нагревали при 1100С
в течение 10 мин. Детекцию хроматограммы осуществляли денситометрическим
методом. Кроме оценки качественного состава моносахаридов оценивалось
соотношение площадей, принадлежащих обнаруженным на хроматограмме гидролизата
веществам. В результате проведенного анализа в гидролизате полисахаридов алоэ
древовидного обнаружены галактуроновая кислота, галактоза, арабиноза, рамноза,
глюкоза и ксилоза в соотношении 77,8 : 6,9 : 6,3 : 4,4 : 4,1 : 0,4, что
позволяет отнести водорастворимые полисахариды алоэ древовидного к пектинам [22].
Исследования аналитическими методами долгая и кропотливая работа. По этому, актуальной является необходимость совершенствования методов исследования для более быстрого и эффективного анализа. В ходе исследования были рассмотрены аналитические методы исследования лекарственного сырья.
Рассмотрены физические, химические и физико-химические методы исследования, описанные в первых 3-х главах. Выяснены, что существует огромное количество методик исследования и каждая применяется для определения подлинности вещества, количества содержания химических и биологически активных веществ, и свойства определенных групп веществ. И эти методы отличаются чувствительностью.
В 4-ой главе подробно рассмотрены практически все экстрактивные вещества алоэ древовидного. Для начала листья алоэ древовидное, предварительно измельчив, растворяли и высушивали последовательно этиловым спиртом, гексаном, хлороформом и этилацетатом. Оставшеюся от предыдущей обработки сухой шрот подвергали дальнейшей обработке: экстрагировали водой, упаривали и опять осаждали этиловым спиртом. Таким образом, получены 5 фракций, к которым применены различные аналитические методы анализа. Результаты анализов отображены в таблицах и рисунках.
1. Алексеев В. Н., Количественный анализ / Алексеев В. Н., Агасян П. К. // Москва издательство «Химия» 1972 – 9 с.
2. Кельнер Р., Аналитическая химия проблемы и подходы / Кельнер Р., Мерме Ж. М., Отто М., Видмер Г. М. // Москва 2004 – 359-374 с.
3. Крешков А.П. (ред.) Бессероводородные методы качественного полумикроанализа 2-е издание. — Москва: "Высшая школа", 1979. — 271 с
4. Никольский Б. П., Определение рН теория и практика / Никольский Б. П., Шульц М. М.
5. Петрухин О.М. Аналитическая химия. Физические и физико-химические методы анализа Учебник для вузов / А. Ф. Жуков, И. Ф. Колосова, В. В. Кузнецов и др.; Под ред. О. М. Петрухина. - М.: Химия, 2001. - 496 с: ил
6. Гринкевич, Н.И. Химический анализ лекарственных растений. / Н.И. Гринкевич, Л.Н. Сафронич – М.: Медицина, 1983. – 346 с.
7. Гусакова, С.Д. Липиды некоторых лекарственных растений. / С.Д. Гусакова, Г.А. Степаненко, Д.Т. Асилбекова, Ю.М. Мурдохаев // Растительные ресурсы. - №4. – 1983. – С. 444-446.
8. Долгова, А.А. Руководство к практическим занятиям по фармакогнозии. / А.А. Долгова, Е.Я. Ладыгина - М.: Медицина, 1977. – 275 с.
9.
Самородов,
В.Н. Фитохимический состав представителей
рода алоэ и его фармакологические свойства / В.Н. Самородов, С.В. Поспелов,
Г.Ф. Моисеева, А.В. Середа // Химико-фармацевтический журнал. - 1996. - Т.30,
№4. - С.32 – 37.
10. Клячко, Ю.А. Руководство по аналитической химии / Ю.А. Клячко М.: Мир, 1975. - 464 с
11. Кудрицкая, Г.М. Фишман, Л.М. Загородская, Д.М. Чиковани
12. Кудрицкая, С.Е. Каротиноиды Aloe arborescens / С.Е. 39.
13. Лавренов, В.К. Полная энциклопедия лекарственных растений. В 2-х т. / В.К. Лавренов, Г.В. Лавренов. – М.: ОлмаПресс, 1999. – Т. 2. – 267с.
14. Лениджер А., Биохимия. / А. Лениджер - М: Мир - 1974. – 957 с.
15. Оленников Д.Н., Ломбоева С.С., Танхаева Л.М. Органические кислоты лекарственных растений. 2. Orthilia secunda // Химия природ. соед., №5, Том 41. 2005. – С. 594- 595.
16. Оленников, Д.Н. Биологически активные вещества сухого экстракта какалии копьевидной. / Д.Н. Оленников, Л.М. Танхаева, Г.Г. Николаева, А.В. Рохин, Д.Ф. Кушнарев // Химия растительного сырья. – 2004. - №3. –С. 59-62.
17. Оленников, Д.Н. Исследование препарата «Сок подорожника». / Д.Н. Оленников, Л.М. Танхаева // Фармация. – 2008. - №1. – С. 10-14.
18. Оленников, Д.Н. Исследование химического состава алоэ древовидного (Aloe arborescens Mill.). / Д.Н. Оленников, И.Н. Зилфикаров, Т.А. Ибрагимов // Химия растительного сырья. – 2010. - №3. – С. 77-82.
19. Оленников, Д.Н. Методика количественного определения группового состава углеводного комплекса растительных объектов / Д.Н. Оленников, Л.М. Танхаева // Химия растительного сырья. - 2006. - №4. - С.29-33.
20. Оленников, Д.Н. Методика количественного определения полисахаридов в листьях Plantago major L. с использованием метода Дрейвуда / Д.Н. Оленников, Л.М. Танхаева, А.Б. Самюэльсен // Химия природных соединений. - 2006. - №3. - С. 221-223.
21. Оленников, Д.Н. Методика количественного определения суммарного содержания органических кислот в растительном сырье / Д.Н. Оленников, Л.М. Танхаева, Г.Г. Николаева, А.А. Маркарян // Растительные ресурсы. - 2004. - Вып. 3 - Т. 40 -С. 112–116.
22. Оленников, Д.Н. Химический состав сока алоэ древовидного (Aloe arborescens Mill.) и его антиоксидантная активность (in vitro). / Д.Н. Оленников, И.Н. Зилфикаров, Т.А. Ибрагимов, А.А. Торопова, Л.М. Танхаева // Химия растительного сырья. – 2010. - №3. – С. 83-90.
23. Пешкова, В. М., Методы абсорбционной спектроскопии в аналитической химии / Пешкова В.М., Громова М.И.
24. Самородов, В.Н. Фитохимический состав представителей рода алоэ
25. Hirata, T. Structure of aloenin, a new biologically-active bitter 103
26. Suga, T. Structure of aloenin, a bitter glucoside from Aloe species / T. Suga, T. Hirata, K. Tori // Chem. Lett. - 1974. - P. 715-718.
Скачано с www.znanio.ru
[1] Государственная фармакопея
Материалы на данной страницы взяты из открытых источников либо размещены пользователем в соответствии с договором-офертой сайта. Вы можете сообщить о нарушении.